Эндогенный гликопептид обладающий противовирусными свойствами
Обновлено: 18.04.2024
В течение многих лет в группу гликопетидных антибиотиков входили только два препарата - ванкомицин и тейкопланин. Однако рост резистентности к ним грамположительных бактерий обусловил необходимость создания новых полусинтетических соединений гликопептидного строения. Среди них для дальнейшей разработки и клинических исследований были отобраны три, в т. ч. оритаванцин и далбаванцин. В обзоре проводится сравнение характеристик ванкомицина и тейкопланина, приводятся результаты экспериментального изучения и клинических испытаний оритаванцина и далбаванцина. Рассматриваются перспективы применения новых гликопептидов в клинике. Подчеркивается, что далбаванцин и особенно оритаванцин обладают рядом фармакодинамических и фармакокинетических преимуществ перед ванкомицином и тейкопланином. Кроме того, они активны в отношении некоторых антибиотикорезистентных микроорганизмов.
Ванкомицин, введенный в медицинскую практику полвека назад, на протяжении почти 30 лет оставался единственным представителем антибиотиков группы гликопептидов [1]. В середине 1980-х гг. на фармацевтическом рынке появился тейкопланин. С тех пор и по настоящее время в клинике применяют только два гликопептида. Сходные с ними по химической структуре антибактериальные средства, прежде всего авопарцин, широко использовались в животноводстве и птицеводстве в качестве стимуляторов роста, что способствовало повышению уровня резистентности энтерококков к гликопептидам в Европе и других регионах, за исключением Северной Америки, где гликопептидные антибиотики никогда не были разрешены для добавления в корма животных [2]. В США причиной распространения устойчивости энтерококков к ванкомицину стало практически бесконтрольное 30-летнее использование данного антибиотика для лечения антибиотикоассоциированной диареи, вызванной C. difficile [3].
Помимо устойчивости к энерококкам, беспокойство вызывает и быстрое распространение в мире пенициллинорезистентного Streptococcus pneumoniae и метициллинорезистентного Staphylococcus aureus (MRSA), занимающих значительное место в этиологической структуре нозокомиальных и внебольничных инфекций различной локализации. Рост антибиотикоустойчивости грамположительных бактерий обусловливает поиск препаратов, активных в отношении резистентных микроорганизмов. Это послужило основанием для создания новых полусинтетических соединений гликопептидного строения. Среди них для дальнейшей разработки и клинических исследований были отобраны три, в т. ч. оритаванцин и далбаванцин [4].
Сравнительная характеристика ванкомицина и тейкопланина и их клиническое применение
Ванкомицин был внедрен в медицинскую практику как препарат для лечения инфекций, вызванных бета-лактамазопродуцирующим S. aureus. Парентеральное введение ванкомицина не получило широкого клинического применения в связи с разработкой в скором времени менее токсичных альтернатив, включая устойчивые к действию бета-лактамаз пенициллины и цефалоспорины, а также ингибиторы бета-лактамаз (клавулановая кислота и сульбактам) [1]. В США и значительно в меньшей степени в других регионах ванкомицин использовали для приема внутрь при диарее, вызванной Clostridium difficile, и колите. Рост использования ванкомицина сопровождался в США ростом резистентности к энтерококкам [5]. Это послужило основанием для введения ограничений на применение гликопептидов с целью поддержания их активности при инфекциях, возбудители которых не чувствительны к другим антибиотикам [6].
С целью профилактики распространения устойчивости к гликопептидам в большинстве стран разработаны рекомендации, вводящие ограничение на их применение [1, 4]. Гликопептиды рекомендуюся:
- для лечения бактериологически подтвержденных инфекций, вызванных MRSA;
- при тяжелых инфекциях у иммуннокомпрометированных больных (например, у пациентов с ожогами и сепсисом, находящихся в отделении интенсивной терапии) в лечебных учреждениях, где часто встречаются MRSA;
- при угрожающих жизни инфекциях, связанных с наличием инородных тел (например, у пациентов с постоянными чрескожными катетерами или искусственными клапанами сердца), в этиологической структуре которых значительное место занимают метициллинорезистентные коагулазонегативные стафилококки.
На метициллиночувствительные стафилококки ванкомицин действует слабее, чем пенициллины из группы производных изоксазола, что проявляется более длительными периодами лихорадки и персистенцией положительных культур крови. В связи с этим назначения ванкомицина и тейкопланина (для которого имеется меньше данных) при инфекциях, вызванных метициллиночувствительными штаммами стафилококков, следует избегать, особенно в опасных для жизни ситуациях, например при эндокардите. Исключение составляют пациенты с аллергией к
При тяжелых инфекциях, возбудителями которых являются мультирезистентные стафилококки, основными показаниями к применению ванкомицина являются:
- серьезные дифтероидные инфекции, вызванные пенициллинорезистентными штаммами, или у пациентов с аллергией к бета-лактамным антибиотикам);
- инфекции ЦНС, вызванные пенициллинорезистентным Streptococcus pneumoniae (в комбинации с цефотаксимом или цефтриаксоном);
- антибиотикоассоциированный колит, угрожающий жизни или не отвечающий на лечение метронидазолом. В последнем случае ванкомицин назначается исключительно внутрь.
С профилактической целью ванкомицин можно применять для предупреждения бактериального эндокардита при желудочно-кишечных и урогенитальных (в сочетании с гентамицином) или стоматологических (один ванкомицин) вмешательствах у пациентов с факторами риска развития эндокардита и аллергией к пенициллинам. Ванкомицин можно также использовать для хирургической профилактики при больших оперативных вмешательствах, связанных с имплантацией искусственных материалов или устройств, в медицинских учреждениях, где наблюдается высокий уровень инфекций, обусловленных MRSA или метициллинорезистентным S. epidermicus.
Тейкопланин назначается по тем же показаниям, что и ванкомицин, кроме инфекций ЦНС, что обусловлено его плохим проникновением через гематоэнцефалический барьер (ГЭБ) даже при воспалении менингиальных оболочек. При колите опыт применения тейкопланина значительно меньше, чем ванкомицина. Преимуществами тейкопланина перед ванкомицином являются более длительный период полувыведения (см. таблицу), возможность однократного внутримышечного введения в сутки и меньшая частота побочных эффектов.
Наиболее распространенными побочными эффектами гликопептидов является флебит на месте введения, а также нефро- и ототоксичность [1]. Последняя вызывает особое беспокойство, так как может носить необратимый характер. Мета-анализ 11 клинических исследований показал, что тейкопланин достоверно реже (21,9 против 13,9 %), чем ванкомицин, вызывает тяжелые побочные эффекты, прежде всего нефротоксические реакции и синдром “красной шеи” [13]. Частота развития этого синдрома определяется степенью очистки инъекционных лекарственных форм. Улучшение качества препаратов ванкомицина позволило существенно уменьшить вероятность этого побочного эффекта. Риск нефро- и ототоксичности гликопептидов значительно повышается при сочетанном применении с аминогликозидами и другими препаратами, вызывающими нарушения слуха и функции почек [14]. К числу редких токсических проявлений гликопептидов относятся нейтропения, тромбоцитопения, лихорадка, буллезный дерматоз, некротизирующий кожный васкулит и токсический эпидермальный некролиз [15].
Следует подчеркнуть, что большие хорошо спланированные исследования по сравнению двух гликопептидов не проводились [1]. Более того, рекомендуемые дозы тейкопланина со временем увеличивались, а в большинстве сравнительных исследований с ванкомицином тейкопланин применяли в дозе ≤ 6 мг/кг, которую в настоящее время считают недостаточной. Для оценки истинной токсичности тейкопланина необходимы дальнейшие исследования.
Свойства "идеального" гликопептида
При разработке новых препаратов были определены критерии “идеального” гликопептида, который может иметь клиническую ценность [1]. Спектр активности такого препарата должен включать грамположительные микроорганизмы, включая MRSA, ванкомициорезистентные энтерококки (VRE) и гликопептидорезистентные S. aureus. Препарат должен оказывать быстрый дозозависимый бактерицидный эффект. Фармакокинетические требования, предъявляемые к “идеальному” гликопептиду, включают: создание площади под кривой “концентрация/время” (AUC) и пиковых концентраций свободной фракции, адекватных для достижения МПК в отношении целевых патогенов; длительный период полувыведения (однократное введение в сутки); хорошее проникновение в ткани, включая ЦНС. И наконец, он должен реже вызывать побочные эффекты, чем ванкомицин и тейкопланин.
Среди синтезированных соединений гликопептидного строения этим требованиям в наибольшей степени отвечают оритаванцин и далбаванцин, поэтому именно они были отобраны для дальнейшего изучения в клинических исследованиях.
Оритаванцин (LY333328) был открыт компанией Eli Lilly, но в настоящее время разрабатывается компанией InterMune [1]. Активность препарата в отношении стафилококков аналогична таковой ванкомицина. МПК для этих микроорганизмов составляют от 0,03 до 8 мг/л и не отличаются для метициллиночувствительных и метициллинорезистентных штаммов. По активности в отношении энтерококков оритаванцин превосходит ванкомицин и тейкопланин (МПК ниже 1 мг/л), проявляя одинаковую активность в отношении гликопептидочувствительных и гликопептидорезистентных штаммов. Оритаванцин также оказывает мощное действие на пенициллиночувствительные и пенициллинорезистентные пневмококки. Он также высоко активен в отношении других грамположительных микроорганизмов, включая другие стрептококки, Listeria spp., Clostridium spp. и коринебактерии [16]. На грамотрицательные бактерии, включая Haemophilus influenzae, препарат не действует.
In vitro оритаванцин оказывает бактерицидный эффект, причем его минимальные бактерицидные концентрации (МБК) превышают МПК не более чем в 1–8 раз [16]. Опыты in vitro позволяют предположить, что механизм действия оритаванцина отличается от такового ванкомицина и тейкопланина. Наряду с угнетением синтеза клеточной стенки на этапе трансгликозирования в процессе биосинтеза пептидогликанов, препарат, подвергаясь димеризации, может также связываться с цитоплазматической мембраной, изменяя ее свойства [17].
Показано наличие у оритаванцина постантибиотического эффекта в отношении VRE и MRSA [17]. При одновременном применении оритаванцина с аминогликозидами проявляется синергидный эффект [18, 19]. Ампициллин усиливает бактерицидную активность оритаванцина, не вступая с ним в истинно синергическое взаимодействие, и удлиняет постантибиотический эффект гликопептида [20].
Фармакокинетические свойства оритаванцина в сравнении с другими гликопептидами представлены в таблице.
Экспериментальные и клинические исследования оритаванцина
Оритаванцин был изучен в моделях трудно поддающихся лечению инфекций. При экспериментальном эндокардите у кроликов при однократном введении в сутки он проявлял равную с ванкомицином активность [21]. В экспериментах на животных оритаванцин оказывал бактерицидный эффект при пневмококковом менингите, хотя его концентрации в ЦНС достигали лишь 5 % от концентраций в сыворотке крови [22].
Препарат был также изучен при инфекциях, вызванных гликопетидорезистентными энтерококками. Высокая эффективность оритаванцина наблюдалась при катетероассоциированной инфекции у крыс [23], однако его активность при эндокардите у кроликов была значительно ниже [24]. В последнем случае оритаванцин приводил к уменьшению количества бактерий в вегетациях, но не вызывал их стерилизации даже при создании высоких концентраций в сыворотке крови [24]. Комбинирование оритаванцина с гентамицином при бактериальном эндокардите позволяло достичь бактерицидного эффекта и предотвратить возникновение резистентных мутантов бактерий [25].
На модели полиморфоядерных лейкоцитов, инфицированных VRE [26] или MRSA [27], и макрофагов, инфицированных S. aureus [28], продемонстрировано наличие у оритаванцина внутриклеточной бактерицидной активности.
В настоящее время оритаванцин находится в III фазе клинических испытаний. Закончилось 2 исследования препарата у больных с осложненными инфекциями кожи и мягких тканей, вызванных грамположительными микроорганизмами, включая MRSA [29]. В одном из этих двойных слепых рандомизированных исследований показана равная клиническая эффективность оритаванцина в дозе 1,5 или 3 мг/кг в течение 3–7 дней и ванкомицина (15 мг/кг дважды в сутки в течение 3–7 дней с последующим переходом на пероральный цефалексин в течение 7–10 дней) [30].
Профиль безопасности оритаванцина
На сегодняшний день опубликованы только данные I фазы клинических исследований, в которых продемонстрирована хорошая переносимость препарата [31]. Вышеприведенное клиническое исследование опубликовано в форме реферата, в котором не содержатся подробные сведения о его безопасности [30]. Исследования на культуре клеток указывают на то, что оритаванцин может индуцировать отложение жиров, по всей вероятности, в связи с его способностью создавать высокие внутриклеточные концентрации [32]. Этот эффект требует дальнейшего изучения на животных.
Далбаванцин (В1397) – полусинтетическое производное естественного гликопептида А40926, обнаруженного компанией Biosearch Italia. В настоящее время препарат разрабатывает компания Vicuron Pharmaceuticals, образовавшаяся в результате слияния Biosearch Italia и Versicor. Поскольку почти все исследования далбаванцина опубликованы в форме рефератов, его детальное сравнение с оритаванцином затруднено.
По активности в отношении стафилококков далбаванцин превосходит ванкомицин, тейкопланин и до некоторой степени – оритаванцин. Его МПК колеблются от
Ингибиторы бета-лактамаз. Гликопептиды - ванкомицин
С целью клинического применения было получено несколько специфических ингибиторов бактериальных бета-лактамаз: клавуланат, сулбактам и тазобактам. Все эти препараты содержат бета-лактамное кольцо, однако ни один из них не применяют в клинике по отдельности, т.е. каждый из ингибиторов бета-лактамаз непригоден для монотерапии. Однако они ковалентно связываются с бактериальной бета-лактамазой, инактивируя ее и тем самым сохраняя бета-лактамное кольцо антибиотиков; в противном случае кольцо разрушается Р-лактамазой, и антибиотик утрачивает свой антибактериальный эффект. Их используют вместе с пенициллином при фиксированном соотношении доз лекарств.
Ингибиторы бета-лактамаз подавляют большинство важных бактериальных бета-лактамаз, включая лактамазы, продуцируемые стафилококками, гонококками, Н. influenzae, B. fragilis и некоторыми представителями семейства энтеробактерий. Однако они не ингибируют индуцибельную, хромосомоопосредованную бактериальную цефалоспориназу типа I, которая способна гидролизовать все цефалоспорины, в том числе цефалоспорины третьего поколения.
Комбинации пенициллин плюс ингибитор бета-лактамазы используют при полимикробных инфекциях, при которых применение одного препарата (содержащего два лекарства) исключает необходимость использования нескольких препаратов. На практике эти комбинации чаще всего применяют при лечении внутрибрюшных инфекций, раневых инфекций после укусов и инфицированных кожных язв.
Гликопептиды - ванкомицин
Гликопептиды представляют собой высокомолекулярные лекарственные препараты, построенные из сахаров и аминокислот.
В настоящее время единственным гликопептидом, применяемым в США, является ванкомицин, однако в некоторых регионах Европы используют тейкопланин. Ванкомицин — преимущественно бактерицидный антибиотик, ингибирующий синтез клеточной стенки бактерий путем ковалентного связывания с двумя концевыми остатками D-аланина на свободном карбоксильном конце пентапептида. В результате создается стерическое препятствие для элонгации пептидогликанового каркаса бактерий. В отличие от этого механизма действия бета-лактамы ингибируют позднюю стадию синтеза клеточной стенки, блокируя перекрестное связывание боковых цепей пентапептида. Вследствие высокой молекулярной массы ванкомицин не способен проникать через клеточную мембрану грамотрицательных бактерий, и его активность ограничена грамположительными бактериями.
Ванкомицин не содержит бета-лактамного кольца и связывается с боковыми цепями пептида, а не с пенициллин-связывающими белками, поэтому он не влияет на эти белки и бета-лактамазу. В связи с этим его применяют для лечения инфекций, вызванных грамположительными бактериями, резистентными к Р-лактамам. Приобретенная резистентность к ванкомицину возникает редко в результате изменения боковой цепи пентапептида и обычно ограничена E.fecium.
Ванкомицин используют для лечения инфекций, вызываемых стрептококками, стафилококками, энтерококками, Corynebacterium jeikeium и Clostridium difficile. Он представляет собой лекарство выбора при инфекциях, возбудителями которых служат резистентные к метициллину стафилококки и резистентные к пенициллину пневмококки. Ванкомицин часто применяют как альтернативное средство при лечении пациентов с тяжелой аллергией к бета-лактамам, т.к. между этими антибиотиками перекрестные реакции отсутствуют.
Ванкомицин чрезвычайно эффективен при пероральном применении (125-250 мг каждые 6 час) при лечении кишечной инфекции, вызванной С. difficile, поскольку препарат плохо абсорбируется и задерживается в кишечнике. Однако в этих случаях обычно предпочитают метронидазол из-за его меньшей стоимости.
Ванкомицин поступает в СМЖ, и его концентрация достигает уровня, близкого к МБК для стрептококков и стафилококков, однако клинический опыт применения этого антибиотика при бактериальном менингите ограничен, поэтому его не следует назначать при лечении менингита, если только патоген не является резистентным к цефалоспоринам третьего поколения и хлорамфениколу. Поскольку ванкомицин плохо всасывается из желудочно-кишечного тракта, поэтому в большинстве случаев его вводят в/в.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лекарства для лечения вирусных инфекций
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.
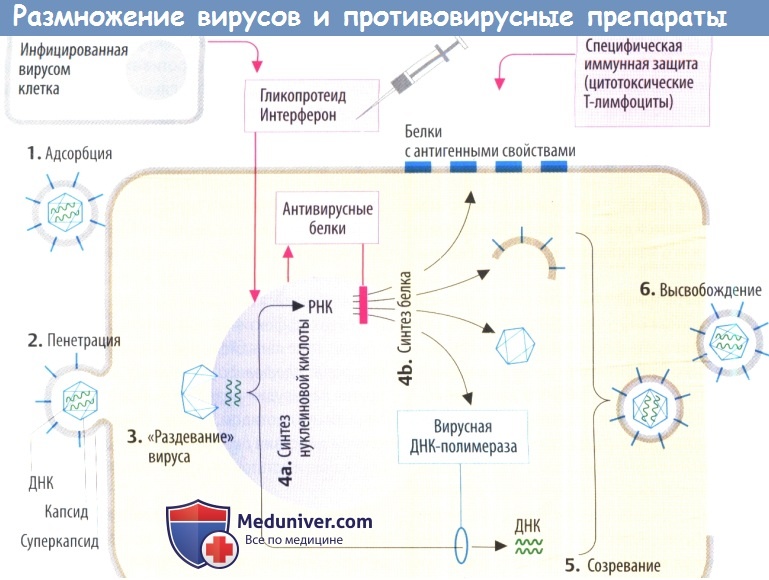
II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.
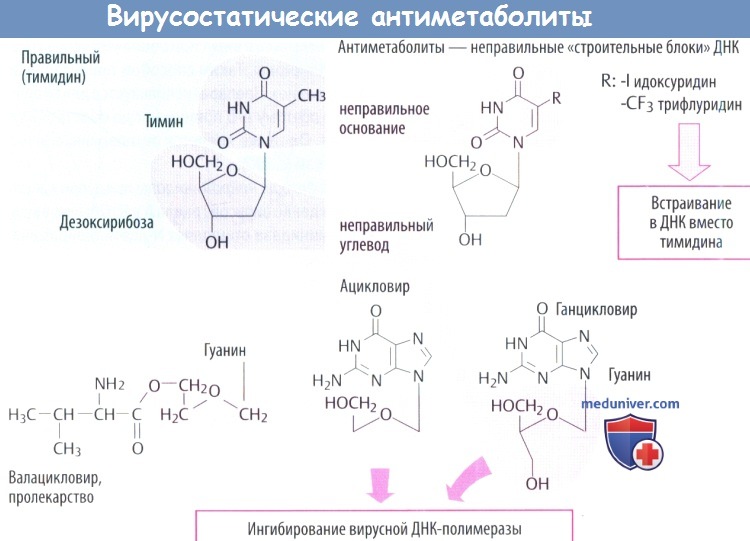
в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
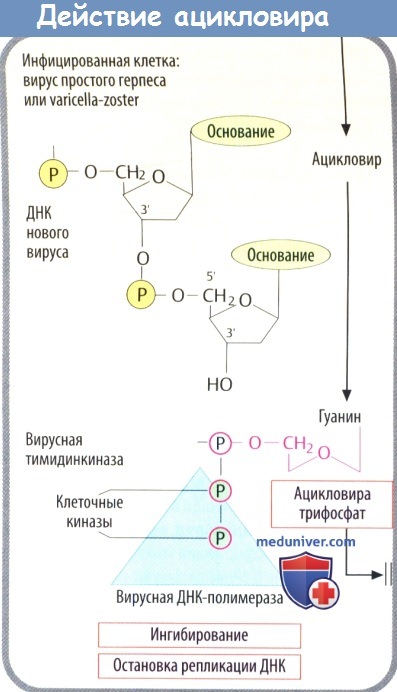
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З'-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.
г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).
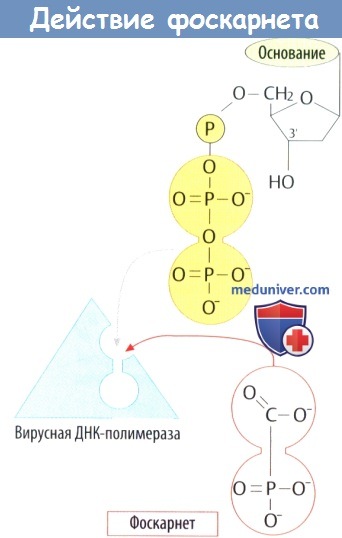
е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
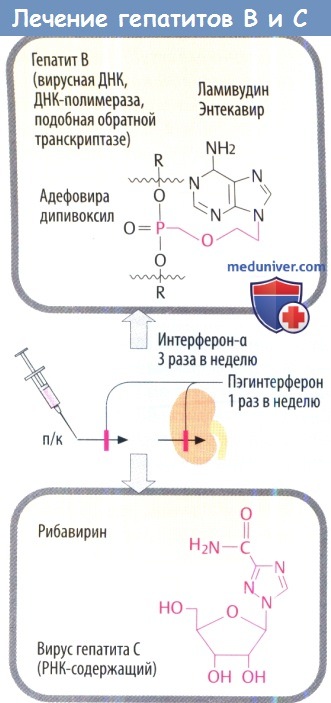
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.
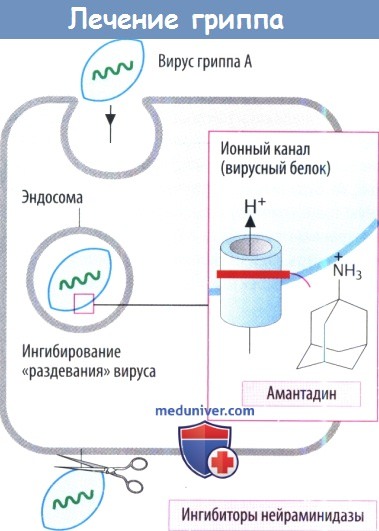
Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В 1 флаконе содержится:
активное вещество: тейкопланин (тейкопланин представляет собой смесь 50 % мононатриевой соли и 50 % цвиттер-ионов) - 200 мг
вспомогательные вещества: натрия хлорид -24 мг
Состав прилагаемого растворителя: вода для инъекций - 5 мл.
Тейкопланин, 400 мг
В 1 флаконе содержится:
активное вещество: тейкопланин (тейкопланин представляет собой смесь 50 % мононатриевой соли и 50 % цвиттер-ионов) - 400 мг
вспомогательные вещества: натрия хлорид -24 мг
Состав прилагаемого растворителя: вода для инъекций - 5 мл.
Описание: Порошок от белого до светло-желтого цвета.
Растворитель: вода для инъекций - 5,0 мл (РУ №ЛП-002377 от 18.02.2014).
Описание: Прозрачная бесцветная жидкость без запаха.
Фармакотерапевтическая группа:
Код АТХ:
Фармакологические свойства
Фармакодинамика
Тейкопланин является антибиотиком гликопептидной структуры, демонстрирующим in vitro бактерицидную активность в отношении анаэробных и аэробных грамположительных микроорганизмов. Тейкопланин подавляет рост чувствительных к нему микроорганизмов за счет ингибирования биосинтеза оболочки микробной клетки в местах, отличных от мест в оболочке микробной клетки, на которые воздействуют бета-лактамные антибиотики. Тейкопланин обладает активностью в отношении Staphylococcus spp. (включая штаммы, резистентные к метициллину и другим бета-лактамным антибиотикам), Streptococcus spp., Enterococcus spp., Listeria monocytogenes, Micrococcus spp., Corynebacterium spp. группы J/K и грамположительных анаэробов, включая Clostridium difficile, и Peptococcus spp. In vitro был продемонстрирован синергизм в отношении бактерицидного действия на Staphylococcus aureus при комбинировании тейкопланина с аминогликозидами или имипинемом.
In vitro аддитивный и синергидный эффекты в отношении Staphylococcus aureus показала комбинация тейкопланина с рифампицином. В отношении Staphylococcus epidermidis наблюдался синергизм тейкопланина с ципрофлоксацином. In vitro одноступенчатой резистентности к тейкопланину получено не было, и только после многократных пассажей in vitro вырабатывалась многоступенчатая резистентность.
Сообщалось о повышении минимальных подавляющих концентраций (МПК) тейкопланина для некоторых штаммов Staphylococcus haemolyticus.
Как правило, у тейкопланина не наблюдается перекрёстной резистентности с антибиотиками других групп, однако у Enterococcus spp. наблюдалась небольшая перекрёстная резистентность к тейкопланину и другому гликопептиду - ванкомицину.
При определении чувствительности микроорганизмов к тейкопланину используются диски (сенсидиски), содержащие по 30 микрограмм тейкопланина. Штаммы, у которых зона подавления роста имеет диаметр 14 мм или более, считаются чувствительными, те же штаммы, у которых зона подавления роста составляет в диаметре 10 мм и менее, считаются резистентными.
Фармакокинетика
Тейкопланин вводится парентерально или путем внутримышечных (в/м) инъекций, или путем внутривенных (в/в) инъекций, или инфузий. Биодоступность после однократного внутримышечного введения тейкопланина в дозе 3-6 мг/кг массы тела составляет около 90%.
После приема внутрь тейкопланин не абсорбируется и при отсутствии изменений пищеварительного тракта не поступает в системный кровоток; 40% от принятой внутрь дозы присутствует в каловых массах в микробиологически активной форме.
Изучение профиля плазменных концентраций у человека после внутривенного введения в дозе 3-6 мг/кг показало двухфазное распределение тейкопланина (с фазой быстрого распределения с периодом полувыведения из плазмы, составляющим около 0,3 часа, с последующей фазой более медленного распределения с периодом полувыведения из плазмы, составляющим около 3 часов), после чего наблюдается медленное выведение тейкопланина с конечным периодом полувыведения, составляющим приблизительно 150 часов. Такой длительный период полувыведения позволяет вводить препарат однократно в течение суток.
При внутривенном введении препарата в дозе 6 мг/кг массы тела в виде 30 минутной инфузии трижды через 12 часов и затем один раз в сутки (через каждые 24 часа) минимальная плазменная концентрация тейкопланина 10 мг/л по расчетам могла бы быть достигнута к 4 дню. Расчетные максимальная и минимальная плазменные концентрации в равновесном состоянии, составляющие 64 мг/л и 16 мг/ л, могли бы быть достигнуты к 28 дню лечения. Тейкопланин быстро распределяется в кожу (подкожно-жировую клетчатку) и волдырную жидкость, миокард, легочную ткань и плевральную жидкость, костную ткань и синовиальную жидкость, но плохо проникает в спинномозговую жидкость. Слабо аффинная связь с белками плазмы составляет 90-95%. Объем распределения в равновесном состоянии при внутривенном введении тейкопланина в дозе 3-6 мг составляет 0,94 - 1,41 л/кг. Объём распределения у детей существенно не отличается от такого у взрослых.
После парентерального введения метаболизм тейкопланина является минимальным (около 3%). 97% введённого тейкопланина выводится из организма в неизменённом виде. Приблизительно 80% введенной дозы выделяется через почки. Почечный клиренс после внутривенного введения 3-6 мг/кг находится в диапазоне 10,4 - 12,1 мг/ч/кг. Общий плазменный клиренс находится в диапазоне 11,9-14,7 мл/ч/кг.
Показания к применению
Для парентерального введения
- тяжелые инфекции, вызываемые чувствительными к препарату грамположительными бактериями, в том числе и резистентными к другим антибиотикам (пенициллины, в том числе метициллин и цефалоспорины), включая эти инфекции у пациентов с аллергией к пенициллинам и цефалоспоринам:
- эндокардит;
- септицемия;
- инфекции костей и суставов;
- инфекции нижних дыхательных путей;
- инфекции кожи и мягких тканей;
- инфекции мочевыводящих путей;
- перитонит, возникший при непрерывном амбулаторном перитонеальном диализе (НАПД).
- псевдомембранозный колит, вызванный Clostridium difficile (связанный с приемом антибактериальных препаратов).
Противопоказания
Применение при беременности и в период грудного вскармливания
Применение при беременности
Не следует применять Тейкопланин во время беременности или при подозрении на неё за исключением случаев, когда врач посчитает, что потенциальная польза для матери преобладает над возможным вредом для плода.
Исследования на животных не выявили тератогенных эффектов у тейкопланина.
Применение в период грудного вскармливания
Информация об экскреции тейкопланина в грудное молоко отсутствует. Поэтому не следует применять Тейкопланин во время периода от грудного вскармливания, а при необходимости его применения во время лактации необходимо временно прекратить грудное вскармливание ребенка.Способ применения и дозы
Тейкопланин вводится парентерально (внутривенно или внутримышечно). Внутривенное (в/в) введение может быть осуществлено путем либо в/в инъекции в течение 3-5 минут, либо - в/в инфузии в течение 30 минут. У новорожденных препарат должен вводится только в виде внутривенной инфузии.
Режим дозирования у взрослых и подростков 16-18 лет с нормальной функцией почекЛечение инфекций, вызываемых чувствительными к препарату грамположительными бактериями (эндокардит; септицемия; инфекции костей и суставов; инфекции нижних дыхательных путей; инфекции кожи и мягких тканей; инфекции мочевыводящих путей)
Для умеренно-тяжелых инфекций кожи и мягких тканей, мочевыводящих путей, инфекций нижних дыхательных путей начальная доза тейкопланина составляет 400 мг однократно в/в в первый день с последующей поддерживающей дозой 200 мг однократно в сутки в/в или внутримышечно (в/м).
Для лечения тяжелых инфекций костей и суставов, септицемии, эндокардита начальная доза составляет 400 мг в/в каждые 12 часов для первых трех доз с последующей поддерживающей дозой 400 мг в/в или в/м один раз в сутки. При тяжелых инфекциях минимальная концентрация в сыворотке крови не должна быть ниже 10 мг/л. Максимальные концентрации, определяемые через 1 час после в/в введения 400 мг, обычно находятся в интервале от 20 до 50 мг/л.
В отдельных случаях (у ожоговых пациентов или у пациентов с эндокардитом) поддерживающая доза может составлять до 12 мг/кг массы тела в сутки. Стандартные дозы 200 мг и 400 мг соответствуют дозам 3 мг/кг и 6 мг/кг массы тела. У пациентов с массой тела более 85 кг рекомендуется скорректировать дозу препарата с учетом массы тела, придерживаясь такой же терапевтической схемы: умеренно-тяжелые инфекции 3 мг/кг, тяжелые инфекции 6 мг/кг.
Пациенты с перитонитом, развившимся, как осложнение непрерывного амбулаторного перитонеального диализа.
После однократной нагрузочной дозы 400 мг внутривенно, в первую неделю вводят по 20 мг/л в каждый резервуар с раствором для перитонеального диализа, во вторую неделю вводят по 20 мг/л в каждый второй резервуар с раствором для перитонеального диализа, в третью неделю вводят по 20 мг/л в резервуар с раствором для перитонеального диализа для ночного диализа.
Антимикробная профилактика при хирургических операциях в ортопедии, при стоматологических операциях (например, профилактика эндокардита у пациентов с искусственными клапанами сердца): 400 мг тейкопланина (или 6 мг/кг при массе пациента более 85 кг) в виде в/в однократной инъекции во время вводного наркоза.
Псевдомембранозный колит, вызванный С.difficile: 200 мг тейкопланина перорально два раза в день.
Режим дозирования у детейДети старше 2 месяцев до 16 лет: для большинства грамположительных инфекций рекомендуемая начальная доза составляет 10 мг/кг массы тела в/в с интервалом 12 часов для первых трех доз с переходом на поддерживающую дозу 6 мг/кг массы тела, вводимую в/м или в/в один раз в сутки.
При тяжелых инфекциях и нейтропении рекомендуемая начальная доза составляет 10 мг/кг массы тела в/в с интервалом 12 часов для первых трех доз с переходом на поддерживающую дозу 10 мг/кг массы тела, вводимую в/в один раз в сутки.
Дети младше 2 месяцев, включая новорожденных: рекомендуемая начальная доза составляет 16 мг/кг массы тела в/в в первый день с переходом на поддерживающую дозу 8 мг/кг массы тела в/в один раз в сутки. В/в введение должно осуществляться методом в/в инфузии в течение 30 минут.
Режим дозирования у пациентов пожилого возраста
При нормальной функции почек коррекции режима дозирования не требуется.
Режим дозирования взрослых с почечной недостаточностью
До 4 дня лечения тейкопланином коррекции режима дозирования не требуется. Начиная с четвертого дня, вводимая доза должна поддерживать концентрацию тейкопланина в сыворотке на уровне 10 мг/л.
При умеренной почечной недостаточности (клиренс креатинина 40-60 мл/мин): поддерживающая доза должна быть уменьшена в два раза, либо путем введения прежней дозы один раз в два дня, либо введения половинной дозы один раз в сутки.
При тяжелой почечной недостаточности (клиренс креатинина менее 40 мл/мин) и у пациентов, находящихся на гемодиализе: поддерживающая доза должна быть уменьшена в три раза, либо путем введения прежней дозы каждый третий день, либо введения 1/3 прежней дозы один раз в сутки.
Тейкопланин не выводится при гемодиализе.
Продолжительность леченияПобочное действие
Эритема, боль в месте инъекции, тромбофлебит, абсцесс на месте в/м инъекции.
Реакции повышенной чувствительности
Тошнота, рвота, диарея.
Со стороны крови
Агранулоцитоз, лейкопения, нейтропения, тромбоцитопения, эозинофилия.
Со стороны печени
Повышение концентраций креатинина в сыворотке крови, почечная недостаточность.
Со стороны центральной нервной системы
Головокружение; головная боль, судороги при внутривенном введении.
Со стороны органа слуха и лабиринтные нарушения
Потеря слуха, звон в ушах и вестибулярные расстройства.
Прочие
Суперинфекция (чрезмерное размножение микроорганизмов, не чувствительных к препарату).Передозировка
Опыт передозировки у человека
Тейкопланин не выводится с помощью гемодиализа. Лечение передозировки должно быть симптоматическим.Взаимодействие с другими лекарственными средствами
С нефротоксическими и ототоксическими препаратами (стрептомицином, неомицином, канамицином, гентамицином, амикацином, тобрамицинол, цефалоридином, колистином,амфотерицином В, циклоспорином, цисплатином, фуросемидом, этакриновой кислотой)
Возможно увеличение риска развития побочных эффектов при одновременном или следующим друг за другом применении тейкопланина с этими препаратами. Тейкопланин фармацевтически несовместим с аминогликозидами.Особые указания
Тейкопланин нужно вводить с осторожностью в случае известной повышенной чувствительности к ванкомицину, так как возможно развитие перекрёстной повышенной чувствительности.
Сообщалось о токсическом воздействии на орган слуха, гематологической, печеночной и почечной токсичности тейкопланина. Поэтому следует контролировать состояние слуха, гематологические показатели, функциональное состояние печени и почек, особенно у пациентов с почечной недостаточностью, у пациентов, длительно получающих тейкопланин и у пациентов одновременно получающих другие ото- и нефротоксические препараты (аминогликозиды, колистин, амфотерицин В, циклоспорин, цисплатин, фуросемид и этакриновая кислота).
Суперинфекция: как и в случае с другими антибиотиками, применение тейкопланина, особенно, если оно длительное, может привести к чрезмерному размножению нечувствительных к препарату микроорганизмов. В случае развития суперинфекции во время лечения препаратом, необходимо принять соответствующие меры.Влияние на способность управлять транспортными средствами и механизмами
В период лечения необходимо соблюдать осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, т.к. препарат может вызывать головокружение и др. побочные эффекты, которые могут повлиять на указанные способности.
Форма выпуска
Лиофилизат для приготовления раствора для внутривенного и внутримышечного введения и приема внутрь 200 мг, 400 мг.
По 200 мг или 400 мг тейкопланина во флакон из бесцветного стекла (тип I) вместимостью 30 мл. Флакон укупоривают резиновой пробкой, обжимают алюминиевым колпачком и покрывают защитной пластиковой крышечкой.
Растворитель: вода для инъекций (РУ № ЛП-002377 от 18.02.2014) по 5 мл. в ампулу бесцветного нейтрального стекла или из полиэтилена низкой плотности с линией разлома.
По 1 флакону с препаратом и по 1 ампуле с растворителем (вода для инъекций) вместе с инструкцией по применению в пачку картонную.
По 5 флаконов или 10 флаконов с препаратом и соответственно по 5 или 10 ампул с растворителем (вода для инъекций) вместе с равным количеством инструкций по применению помещают в пачку картонную с разделительными перегородками или без них или 5 флаконов или 10 флаконов с препаратом и соответственно по 5 или 10 ампул с растворителем (вода для инъекций) на пластиковые поддоны вместе с равным количеством инструкций по применению помещают в картонную коробку (для стационаров).Условия хранения
Срок годности
Условия отпуска
Производитель
Джодас Экспоим Пвт. Лтд.
Район Солан (Химачал-Прадеш), Техсил Налагарх, Бадди, Налагарх
Бадди Роуд, 173205, ИндияТейкопланин - цена, наличие в аптеках
Указана цена, по которой можно купить Тейкопланин в Москве. Точную цену в Вашем городе Вы получите после перехода в службу онлайн заказа лекарств:
![]()
Обзор
Антимикробный пептид на поверхности модели бактериальной мембраны. Связывание пептида приводит к дестабилизации мембраны и проникновению воды внутрь бислоя.
Автор
Редакторы
После появления пенициллина более чем 80 лет человечество ведет ожесточенную борьбу с патогенными микроорганизмами. Широкое использование антибиотиков в терапии инфекционных заболеваний породило новые устойчивые к ним формы бактерий. На пороге XXI века медики и фармацевты столкнулись с проблемой поиска альтернативы традиционным антибиотикам. Для этой цели использование антимикробных пептидов может оказаться весьма эффективным.
![]()
Рисунок 1. Представители различных групп антимикробных пептидов.
1 — Линейные α-спиральные; 2 — не имеющие характерной структуры, напр. богатые определенной аминокислотой; 3 — дефензины; 4 — лантибиотики (низин).
Основная цепь пептидов изображена в виде ленты (1, 2). Фрагменты β-слоя представлены стрелками (3). Для низина (4) показаны также боковые цепи остатков.Антимикробные пептиды
Несмотря на огромное разнообразие, на основании структурной организации антимикробные пептиды можно разделить на несколько групп:
- линейные α-спиральные пептиды (напр., магаинин, меллитин, цекропин);
- пептиды, богатые определенной аминокислотой, напр., гистидином или пролином;
- пептиды, имеющие сложную пространственную организацию, содержащие дисульфидные мостики, тиоэфирные циклы и др. К ним относятся дефензины, протегрины и лантибиотики — высокоактивные бактериальные пептиды (напр., низин — см. выше).
Тем не менее, для большинства таких пептидов характерно несколько общих черт: высокий положительный заряд (+2 — +9), пространственное разделение гидрофобных и гидрофильных участков молекулы (амфифильность). Амфифильность является важной особенностью антимикробных пептидов, которая обеспечивает возможность одновременно выгодно взаимодействовать с гидрофобным ядром липидной мембраны и полярным окружением (например, с водой).
Механизмы действия
Выделяют два основных типа воздействия антимикробных пептидов на клетки: ингибирование метаболитических процессов или нарушение целостности клеточной мембраны [5]. Большинство антимикробных пептидов вызывают гибель клетки по второму механизму. Лишь для некоторых пептидов показано действие по первому типу, среди них лантибиотики, которые селективно связываются с предшественником бактериальной стенки [6]. Для того, чтобы достигнуть плазматической бактериальной мембраны, пептиды предварительно должны преодолеть несколько слоев клеточной стенки. В случае грам-отрицательных бактерии она состоит из внешней липополисахаридной мембраны и пептидогликанового слоя. У грам-положительных бактерий внешняя мембрана отсутствует, однако пептидогликановый слой развит гораздо сильнее. Пептиды обычно беспрепятственно достигают плазматической мембраны, и именно ее разрушение приводит гибели клетки.
Перспективы использования антимикробных пептидов в медицине
![]()
Рисунок 2. Антимикробный пептид рамопланин (Ramoplanin).
Продукт нерибосомального синтеза в микроорганизмах рода Actinomycetes spp. Механизм действия основан на связывании с предшественником бактериальной стенки липидом II. На данный момент находится на клинических испытаниях фазы III в качестве антибиотика против инфекций дыхательных путей (в первую очередь, стафилококков).Несмотря на то, что для антимикробных пептидов характерно довольно высокие действующие концентрации (~10 −7 —10 −6 моль, 10 −9 моль у лантибиотиков) и низкая селективность, они обладают некоторыми преимуществами: способность быстро убивать клетки-мишени, широкий спектр действия, активность в отношении штаммов, резистентных к другим антибиотикам, а также относительная трудность в развитии устойчивости. Поскольку некоторые антимикробные пептиды обладают цитотоксическим эффектом (действуют на эукариотические клетки), наиболее эффективно они могут быть использованы при лечении заболеваний наружных покровов, слизистых — без введения в кровь пациента. На сегодняшний день такие пептиды активно используются для создания новых лекарственных препаратов. Наиболее успешным примером, является циклический пептидный антибиотик рамопланин, который уже находится на стадии клинических испытаний для лечения инфекционных заболеваний дыхательных путей. Также показано, что ингаляции смеси, содержащей антимикробные пептиды, являются эффективными в терапии туберкулеза.
Все это позволяет рассматривать описанные выше молекулы в качестве основы для создания эффективных лекарств, особенно на фоне снижения потенциала обычных антибиотиков.
Читайте также:




