Эндометрит вызванный вирусом герпеса
Обновлено: 24.04.2024
The resume: We examined the character of blood flow in the spiral and uterine arteries in 140 women of reproductive age with chronic endometritis. The examination was made with impulse ultrasound dopplermetry. A typical condition for patients was dilatation arcuate veins, set at 80% of the women, accompanied by pain in the lower abdomen varying severity. Combined extension of arcuate veins and veins parametrium was observed in 15% of patients. In addition to chronic pelvic pain have been observed dyspareunia and dysmenorrhea. Every third patient along with the dilatation veins increased resistance index in the uterine and spiral arteries was found. For impaired blood flow correction complex treatment with venotonics Flebodia 600, having a pronounced angioprotective effect. After course of 3-6 months of treatment we observed normalization of venous and arterial blood flow of the uterus. The therapy with Flebodia 600 was much more effective than conventional treatment without this drug.
Key words: chronic endometritis, pelvic pain, a venous blood flow, Flebodia 600.
Хронический эндометрит как отдельная нозологическая форма был впервые выделен в Международной статистической классификации болезней, травм и причин смерти IX пересмотра в 1975 г. Этому событию предшествовала почти полувековая дискуссия о возможности существования, с точки зрения классической патологии, хронического воспаления в ткани, подвергающейся циклической трансформации с ежемесячной десквамацией функционального слоя. Работы Б.И. Железнова (1977) [1] положили конец научным спорам, так как было доказано, что в воспалительный процесс вовлекается не только функциональный, но и базальный слой эндометрия. При этом было показано, что морфологические изменения при хроническом воспалительном процессе в эндометрии аналогичны изменениям при хроническом воспалении других органов и тканей.
Частота этой патологии остается высокой, варьируя от 0,2 до 66%, и составляет в среднем 14%. По-видимому, столь значительный разброс данных вызван применением различных критериев диагностики хронического эндометрита [2,4]. Заболевание преимущественно развивается у женщин репродуктивного возраста. Максимальная частота хронического эндометрита (88,2%) приходится на возрастную группу 21-45 лет, т.е. на возрастной интервал, наиболее важный в реализации репродуктивной функции. Совершенно очевидна тенденция к росту частоты ХЭ, что может быть связано с расширенным применением внутриматочных контрацептивов, медицинскими абортами, различными внутриматочными манипуляциями, эволюцией микробного фактора - увеличение частоты внутриклеточной микрофлоры и вируснобактериальных ассоциаций в качестве возбудителей эндометрита. Кроме того, длительная антигенная стимуляция иммунокомпетентной системы приводит к ее функциональной перегрузке, истощению и развитию аутоиммунных реакций, вызывающих дополнительное повреждение ткани. Таким образом, патологический круг замыкается и хронический воспалительный процесс приобретает волнообразно-прогрессирующий характер [5].
Клиническая картина хронического эндометрита в значительной степени отражает глубину структурных и функциональных изменений в эндометрии и зависит от этиологического фактора, длительности заболевания и наличия сопутствующей патологии матки. Основной особенностью клинических проявлений хронического эндометрита в настоящее время является нарушение репродуктивной функции - бесплодия, невынашивания беременности. Нередко наблюдаются маточные кровотечения циклического характера, перименструальные кровяные выделения и хроническая тазовая боль. Причиной тазовых болей могут быть ухудшение микроциркуляции в матке на фоне венозного застоя, нарушение трофических процессов в органах малого таза, изменения функционального состояния центральной нервной системы и вегетативно-сегментарные расстройства.
Целью нашего исследования явилась оценка артериального и венозного кровотока матки у женщин с хроническим эндометритом вне обострения, как причины тазовой боли.
Материалы и методы исследования. Под наблюдением находились 140 пациенток репродуктивного возраста (24-34 года) и 20 здоровых женщин для ультразвукового контроля артерий и вен матки. Критериями включения в исследование являлись: подтвержденный диагноз хронического эндометрита, репродуктивный возраст, наличие нарушений репродуктивной функции. Критерии исключения - беременность, онкологические заболевания, эндометриоз, миома матки, опухоли яичников, аномалии развития матки.
Результаты исследования и их обсуждение
В ходе работы проанализированы особенности нарушений репродуктивной функции у обследованных больных, осложнения и исходы предыдущих беременностей. Полученные данные показали, что 80% (112) женщин страдали бесплодием, чаще вторичным. Невынашивание беременности в анамнезе имели 70% (98) женщин (в основном отмечена потеря беременности в I триместре), внематочную беременность - 3,5% (5), 30% (42) перенесли медицинский аборт, в т.ч. медикаментозный. Среди клинических проявлений заболевания на момент обследования преобладали перименструальные мажущие кровяные выделения, бели. Хроническую тазовую боль как основной симптом имели 20% (28) женщин, остальных беспокоили непостоянные, но повторяющиеся болевые ощущения в нижних отделах живота, не связанные с менструацией, или дисменорея.
В диагностике хронического эндометрита большое значение имело эхографическое исследование. Различные ультразвуковые признаки хронического эндометрита наблюдались у всех женщин: расширение полости матки - у 25% (35), неоднородная эхоструктура эндометрия - у 43% (60), асимметрия стенок эндометрия - у 18% (25), гиперэхогенные включения в базальном слое эндометрия - у 17% (24) пациенток. Культуральный анализ биоптатов эндометрия показал различную микробную и вирусную флору у 80% (112) женщин. Абсолютно преобладали представители ИППП: хламидии - у 20% (22), микоуреаплазмы - у 45% (50), вирус герпеса - у 24% (27), грибы рода кандида - у 11,2% (12) пациенток. Неспецифическая условно-патогенная микрофлора (анаэробные лактобациллы, бактероиды, анаэробные грамположительные кокки) были выделены у 17% (20), Campylobacter fetus - у 2,2% (2) женщин. Микробные ассоциации наблюдались в 68% случаев.
Морфологическое исследование подтверждало хронический эндометрит у большинства больных (70%). При окраске гематоксилином-эозином отмечались воспалительные инфильтраты из круглоклеточных лимфоидных элементов, местами формирующими фолликулоподобные структуры в сочетании с участками очагового фиброза стромы и склеротических изменений стенок спиральных артерий. Воспалительные элементы выявлялись как в функциональном, так и базальном слое эндометрия. У меньшей части женщин ярких морфологических картин не было, но иммуногистохимический анализ подтверждал воспалительные изменения в эндометрии.
Иммуногистохимическое исследование по методике Е.А. Михниной с соавт. [3], выполненное у 40 женщин, подтвердило наличие хронического эндометрита, у 8 (20%) из них был диагностирован аутоиммунный эндометрит (количество клеток CD 56 колебалось от 25 до 60 в поле зрения).
У каждой третьей больной выявлены допплерометрические признаки нарушения кровотока в маточных и спиральных артериях. Индекс резистентности в этих сосудах соответственно в 1,3 и 1,4 раза превышал показатели здоровых (см. табл. 1). Значения индексов резистентности и систоло-диастолического соотношения в маточной артерии справа и слева были равноценными.
Таблица 1.
Показатели кровотока в маточной и спиральных артериях у женщин с хроническим эндометритом.
| Артерии | IR y больных n=120 | IR у здоровых женщин | CDO у больных n=120 | CDO у здоровых женщин |
| Маточная артерия | 1,09 ± 0,02* | 0,7 ± 0,05 | 3,9 ± 0,03* | 3,0± 0,04 |
| Спиральные артерии | 0.69 ± 0,02* | 0.5 ± 0,05 | 2,9 ± 0,04* | 2,37 ± 0,04 |
Оценка венозного кровотока показала, что типичным состоянием для больных хроническим эндометритом является расширение аркуатных вен матки, которое было выявлено у 80% (112) женщин. Диаметр расширенных вен составлял 4-6 мм (у здоровых - 1-2 мм). Наряду с другими симптомами хронического эндометрита у большинства больных этот признак сопутствовал ощущению тяжести и непостоянным болям в нижних отделах живота, иногда болезненным половым контактам.
Сочетание расширения аркуатных вен и вен параметрия было установлено у 15% (21) больных, имевших хроническую тазовую боль основной жалобой. Степень расширения вен параметрия колебалась от 5 до10 мм (у здоровых - 3-4 мм). Помимо хронической тазовой боли эти женщины всегда отмечали болезненные менструации и диспареунию. Аналогичные симптомы имели 7 пациенток с расширением только вен параметрия (6-10 мм). Изолированного или сочетанного расширения яичниковых вен у больных хроническим эндометритом не было отмечено нами ни в одном случае. Типичные ультразвуковые картины этих нарушений представлены на рисунках 1-4.

Рисунок 1. Варикозное расширение вен миометрия до 4 мм.

Рисунок 2. Варикозное расширение вен миометрия до 6 мм и параметрия - до 8 мм.

Рисунок 3. Цветное допплеровское картирование расширенных маточных вен.

Рисунок 4. Варикозное расширение вен параметрия до 10 мм.
Всем больным была проведена комплексная терапия хронического эндометрита, 120 женщинам в комплекс лечения был включен венотоник - Флебодиа-600 (Франция), 20 пациенток (группа сравнения) его не получали. При выраженном болевом синдроме препарат применяли по 1 таблетке 2 раза в день до значительного уменьшения или исчезновения болевого синдрома, а затем продолжали лечение по 1 таблетке в день до 3-6 мес. Действующим веществом препарата является высокоочищенный диосмин, обладающий выраженным ангиопротективным эффектом за счет сильного венотонизирующего эффекта (снижает растяжимость вен, повышает их тонус, уменьшает венозный застой), улучшения лимфатического дренажа (повышает тонус и частоту сокращения лимфатических капилляров, увеличивает их функциональную плотность, снижает лимфатическое давление), улучшения микроциркуляции (повышает резистентность капилляров, уменьшает их проницаемость). Препарат обладает противовоспалительным действием, блокирует выработку свободных радикалов, синтез простагландинов и тромбоксана. Высокоочищенный диосмин имеет высокую тропность к сосудам, хорошую переносимость, а также дозозависимый эффект, что выгодно отличает его от других венотоников.
Результаты лечения показали, что через 1 мес. лечения уменьшились или исчезли болевые ощущения у всех женщин, предъявлявших жалобы на боли и получавших в комплексе лечения Флебодиа 600. Дисменорея прекратилась у 50% (60) больных, перименструальные кровянистые выделения - у 85% (102) пациенток. У женщин из группы сравнения изменений в болевых ощущениях не произошло. Динамика эхографической картины демонстрировала снижение частоты и степени выраженности присущих ХЭ признаков: расширение полости матки в основной группе после лечения не было установлено ни в одном случае, неоднородная эхоструктура эндометрия сохранилась у 16% (19), асимметрия стенок - у 11% (2) больных. Среди женщин из группы сравнения неоднородная структура эндометрия наблюдалась у 28% (5), гиперэхогенные включения - у 15% (3), ассиметрия стенок матки - у 14% (3).
В процессе лечения снизились, по сравнению с исходными данными, средние значения величин углонезависимых индексов кривых скоростей кровотока в маточных и спиральных артериях у подавляющего большинства женщин, что свидетельствовало о восстановлении кровотока в матке. Положительные изменения кровотока в маточных и спиральных артериях представлены в таблице 2 и на рисунке 5.
Таблица 2.
Показатели кровотока (М+м) в маточной и спиральных артериях у женщин с хроническим эндометритом до и после лечения с применением препарата Флебодиа 600.
| Артерии | IR до лечения, п=120 | IR после лечения c применением Флебодиа, n=120 | IR без применения венотоника, n=20 | CDO до лечения, n=120 | CDO после лечения c применением флебодиа, n=120 | CDO без применения венотоника, n=20 |
| Маточная артерия | 1,09±0,02 | 0,7±0,02* | 0,97±0,02 ^ | 3,9±0,03 | 3,0±0,02* | 3,7±0,02^ |
| Спиральные артерии | 0,69±0,02 | 0,5±0,02* | 0,63±0,02 ^ | 2,9±0,04 | 2,3±0,02* | 2,8±0,02^ |
*разница достоверна (р < 0,05) по сравнению с данными до лечения
^ разница достоверна (р<0,05) по сравнению с результатами после применения Флебодиа 600.

Рисунок 5. Допплерометрия маточной артерии у пациентки с хроническим эндометритом до и после комплексного лечения с включением препарата Флебодиа 600.
Позитивные результаты были получены и при оценке венозного кровотока. Через 1 месяц лечения диаметр аркуатных вен уменьшился на 1-2 мм у 50% (60) больных, вен параметрия - на 2-3 мм у 20 из 28 женщин (71,4%). Нормализация состояния аркуатных вен произошла у большинства женщин (92,40%) через 3 месяца лечения, вен параметрия - через 5-6 месяцев. У женщин, не получавших венотоник, состояние аркуатных вен улучшилось лишь в 21% случаев, диаметр вен параметрия в процессе лечения не изменился. На фоне лечения по мере восстановления кровотока матки произошла санация эндометрия: у 96,9% женщин эндометрий оказался стерильным, лишь у 3 (3,1%) сохранилась персистенция уреаплазм. В группе больных, не получавших венотоник, инфицирование эндометрия условно-патогенной и патогенной микрофлорой сохранилась у 13 из 16 женщин, несмотря на использование антибактериальных и противовирусных средств. Доказательством успешной терапии женщин основной группы явились результаты иммуногистохимического анализа: в строме эндометрия выявлялись единичные макрофаги, лежащие диффузно среди клеток стромы, реакция на лизоцим после лечения стала менее интенсивной. Лейкоциты, позитивные к лизоциму, выявлялись вокруг желез и только в функциональном слое эндометрия. После проведенного курса комплексной терапии с препаратом Флебодиа 600 признаков хронического аутоиммунного эндометрита также обнаружено не было, количество CD56 не превышало 5-7 клеток в поле зрения.
Иммуногистохимическое исследование эндометрия у 20 женщин группы сравнения показало, что в строме эндометрия сохранялись немногочисленные воспалительные инфильтраты из круглоклеточных лимфоидных элементов, формирующих фолликулоподобные структуры в виде скоплений практически у всех больных. Макрофаги CD68 по 20-30 клеток располагались на разных уровнях, большое их скопление отмечалось в воспалительных инфильтратах. У 10 женщин определялось повышение количества CD16, что свидетельствовало о хроническом эндометрите, у шести - сохранились признаки хронического воспаления с аутоиммунным компонентом и лишь у четырех - данных за эндометрит обнаружено не было.
Таким образом, проведенное исследование показало, что хронический эндометрит вне обострения сопровождается значительными нарушениями как артериального, так и венозного кровотока матки. Венозный застой приводит, вероятно, к развитию тканевой гипоксии, затрудняя репаративные процессы в эндометрии. Включение в комплекс лечения венотоника Флебодиа 600 нормализует состояние вен матки и способствует восстановлению артериального кровотока, что создает условия для успешного лечения больных хроническим эндометритом. Патогенетическая обоснованность, хорошая переносимость и эффективность препарата позволяют расширять его использование при лечении воспалительных заболеваний органов малого таза у женщин.
ЛИТЕРАТУРА:
1. Железнов Б.И. Структурные изменения слизистой оболочки матки и функция яичников при хроническом эндометрите. Акуш. и гин. 1977; 4: 3-7.
2. Краснопольский В.И., Серова О.Ф, Титченко Л.И. Лечение хронического эндометрита в прегравидарной подготовке женщин с невынашиванием беременности. М. 2007.
3. Михнина Е.А., Эллиниди В.Н., Давыдова Н.И. [и др.]. Russian Journal of Immunology. 2005; 9 (2): 205p.
4. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. 3-е изд. М.: МИА. 2005.
5. Сухих Г.Т., Шуршалина А.В. Хронический эндометрит. М.: ГЭОТАР-Медиа. 2010; 64 с.
Хронический эндометрит (ХЭ) – клинико-морфологический синдром, при котором в результате персистирующего повреждения эндометрия инфекционным агентом возникают множественные вторичные морфофункциональные изменения, нарушающие циклическую биотрансформацию и рецептивность слизистой оболочки тела матки.
Факторами риска развития хронического эндометрита являются:
- инвазивные манипуляции в полости матки (аборты, гистероскопия, диагностическое выскабливание, биопсия эндометрия, гистеросальпингография, введение внутриматочных контрацептивов, инсеминация, экстракорпоральное оплодотворение и др.),
- инфекционно-воспалительные осложнения после родов,
- инфекционные процессы во влагалище
- воспалительные и анатомические изменения шейки матки,
- бактериальный вагиноз,
- оперативные вмешательства на органах малого таза
Клинически бессимптомный воспалительный процесс в эндометрии представляет собой наличие ассоциаций облигатно-анаэробных микроорганизмов, а также персистенцию условно-патогенной флоры и персистенцию вирусов. По данным многих исследователей, наиболее характерным при хроническом эндометрите у женщин является наличие ассоциаций 2-3 видов облигатно-анаэробных микроорганизмов и вирусов [26, 31, 39, 44, 48, 62, 85, 105, 126 и др.].
Спектр генитальной инфекции, выявленной при ПЦР диагностики отделяемого из цервикального канала и полости матки у пациенток с ХЭ включет: хламидиоз – 14,9%, генитальный герпес – 33,6%, уреаплазмоз – 37,8%, микоплазмоз – 11,6%, цитомегаловирус – 18,9% СероваО.Ф., Овчинникова В.В., 2006).
В большинстве случаев инфицированность носит смешанный характер, причем у женщин с хроническим эндометритом в 1,5 раза чаще инфекция выявляется в полости матки, чем в цервикальном канале.
Среди персистирующих вирусов наибольшее значение имеют: герпес-вирусные инфекции (вирус простого герпеса, герпес-зостер), цитомегаловирус, энтеровирусные инфекции (Коксаки А, В), аденовирусы [13, 30, 31, 33, 42, 45, 47, 49, 58, 80, 87, 92, 107, 133, 157]. В литературе описан ряд клинических ситуаций, когда в ткани эндометрия в качестве моноинфекции выявляли вирусы простого герпеса (ВПГ), цитомегалии и др. Особое место занимает герпетическое поражение эндометрия. Герпетический эндометрит, как правило, возникает у женщин, страдающих атипичными или бессимптомными формами генитального герпеса и вызван длительной персистенцией ВПГ в эндометрии [31, 45, 49, 69, 101, 131].
Хроническое течение воспаления с персистированием в тканях инфекции, является источником постоянного антигенного раздражения, своего рода пусковым и поддерживающим воспалительную реакцию механизмом, а с другой стороны, иммунные нарушения в организме усугубляют течение инфекционного процесса [19, 24, 35,49,].
В условиях постоянного присутствия повреждающего агента в ткани не происходит завершения заключительной фазы воспаления – регенерации, нарушается тканевый гомеостаз и формируется целый каскад вторичных повреждений. Нарушение микроциркуляции в эндометрии приводит к ишемии и гипоксии ткани, активированные макрофаги в очаге воспаления являются источником активных форм кислорода и перекиси водорода и запускают процесс перекисного окисления липидов и повреждение клеточных мембран.
Длительная, часто бессимптомная персистенция инфекционных агентов в эндометрии приводит к выраженным изменениям в структуре ткани, ее рецепторном аппарате, вызывает дисбаланс цитокинов, что в свою очередь нарушает синтез стероидной сульфатазы и биологическую активность эстрогенов в эндометрии. В результате в нем нарушаются процессы пролиферации и циклической трансформации. Эти изменения усугубляются нарушением эндокринной системы вследствие патологической афферентации в отделы ЦНС, регулирующие гипоталамо-гипофизарно-яичниковые взаимоотношения, а также иммунной и в ряде случаев - системы гемостаза. Гормональные нарушения у пациенток с ХЭ характеризуются, чаще всего, гипопрогестеронемией.
Как известно, локальные факторы защиты в цервикальном канале способствуют поддержанию стерильности эндометрия. В матке аналогичную функцию выполняет эндометрий, препятствующий проникновению микроорганизмов, благодаря периодическому отторжению его функционального слоя. Однако при ХЭ воспалительные изменения наблюдаются и в базальном слое эндометрия [21, 35, 43, 52, 103].
Структурные изменения в эндометрии сопровождаются нарушением его функции, в частности, продукции эндометриальных белков, отражающих полноценность секреторных преобразований эндометрия в лютеиновую фазу цикла и необходимых для поддержания успешной беременности: •альфа-2-микроглобулина фертильности (АМГФ) - показателя функциональной активности маточных желез и плацентарного альфа-1 микроглобулина (ПАМГ) - показателя децидуализации эндометрия. Это еще раз свидетельствует о том, что у женщин на фоне хронического эндометрита отмечается неполноценность эндометрия, включающая недоразвитие железистого и стромального компонентов, являющаяся основой недостаточности лютеиновой фазы цикла (НЛФ).
На фоне хронического эндометрита наблюдается ослабление экспрессии эстрогеновых и, особенно, прогестероновых рецепторов в эпителиальных и стромальных клетках. Это снижает их чувствительность к стероидам, поэтому отмечается неполноценность циклических превращений даже при удовлетворительном синтезе эстрогенов и прогестерона [69, 86, 99, 175].
Кроме того, при склерозе кровеносных сосудов, происходящем при тяжелой форме хронического эндометрита, затрудняется обмен между кровью и тканями, в том числе и проникновение гормонов к клеткам эндометрия, реагирующим на их действие, что усугубляет НЛФ.
Все эти изменения в эндометрии при ХЭ препятствуют нормальной имплантации и плацентации и формируют патологический ответ на беременность, что обусловливает ранние репродуктивные поттери (В.М.Сидельникова, 2002, И.Б.Манухин, 2001, Серова О.Ф., 2003; А.П.Милованов, 2004S.Glasser, J.Aplin, 2002; A.Sharkey, 2003).

Основным местом локализации первичной генитальной инфекции ВПГ у женщин является шейка матки. Чаще всего, герпетические поражения у женщин локализуются на больших и малых половых губах (68,6%), в области вульвы (41,8%), клитора (35,7%), влагалища и шейки матки (84,4%).
ВПГ был изолирован из шейки матки во время первичного заражения у 88—90 % женщин с первичной инфекцией ВПГ-2, которые имели везикулезную сыпь на наружных гениталиях, у 65 % — с повторным эпизодом инфекции ВПГ-2, и у 80 % женщин с ВПГ-1. Большинство (89 %) женщин, выделяющих вирус при первичном эпизоде заболевания, имели изменения на шейке матки.
Особенностью генитального герпеса (Herpes genitalis) женских половых органов является многоочаговость. В патологический процесс нередко вовлекаются нижний отдел мочеиспускательного канала, слизистая оболочка ануса и прямой кишки. Вовлечение в инфекционный процесс этих органов может происходить вторично, вслед за возникновением герпеса наружных гениталий, но может протекать и как изолированное поражение.
Рецидивирующая герпетическая инфекция (РГИ) может проявляться клиникой вульвовагинита и цервицита, вызывать поражения слизистой матки, труб и придатков. В 83,6 % случаев при стойких, не поддающихся терапии кольпитах, лейкоплакиях шейки матки выделяют вирус простого герпеса (ВПГ) как один из ведущих этиологических факторов заболевания.
По некоторым данным, в 66 % случаев у женщин герпетическая инфекция (ГИ) протекает атипично. Об имеющейся длительно текущей хронической ГИ можно говорить на основании особенностей клинического течения, наличия герпетического антигена в эпителиальных клетках вульвы, влагалища и периферической крови.
д) хронических часто рецидивирующих сальпингоофоритах (воспаление маточных труб и яичников) и эндометритах, не поддающихся стандартной антибактериальной терапии;
У 1–2% женщин, поступающих в гинекологическую клинику, независимо от основного заболевания, обнаруживают цитологические доказательства ВПГ-инфекции.
Герпес наружных половых органов у женщин
При рецидивирующем герпесе (РГ) наружных половых органов у женщин, очаг поражения находится в области наружных гениталий и перианальной области. Герпетические высыпания у женщин возникают на больших и малых половых губах, области лобка и промежности.
Типичная форма РГ наружных гениталий характеризуется ярко выраженными симптомами болезни, классическим развитием очага поражения (эритема, образование везикул, развитие эрозивно-язвенных элементов, эпителизация) и субъективными ощущениями (зуд, чувство жжения, болезненность, недомогание). проявляется повторяющимися пузырьковыми высыпаниями. Выраженная симптоматика позволяет врачам визуально поставить диагноз РГГ, своевременно назначить лечение и информировать больного об инфекционном характере заболевания и опасности заражения полового партнера.
Герпес нижнего отдела урогенитального тракта, анальной области и ампулы прямой кишки
Поражение слизистых оболочек входа во влагалище, влагалища, влагалищной части шейки матки, цервикального канала, уретры, мочевого пузыря, анальной области и ампулы прямой кишки проявляется в двух клинических формах:
- очаговой, характеризующейся появлением типичных для простого герпеса слизистых оболочек везикулезно-эрозивных элементов,
- диффузной, при которой патологический процесс протекает по типу неспецифического воспаления.
Герпес верхнего отдела полового тракта (поражение матки, маточных труб).
Типичная клиническая картина герпетических поражений органов верхнего отдела мочеполового тракта проявляется симптомами неспецифического воспаления. Неспецифические герпетические поражения внутренних половых органов проявляются эндоцервицитом, эрозией шейки матки, вагинитом. Ряд авторов цервициты без наружных язв также относят к атипичным проявлениям ГГ.
Клинические проявления герпетических поражений внутренних половых органов не имеют специфических особенностей по сравнению с воспалительными процессами невирусной этиологии. Обычно больные предъявляют жалобы на выделения из влагалища, периодически появляющиеся боли в малом тазу, области проекции матки, яичников.
Герпетические поражения шейки матки
Герпетические поражения шейки матки могут носить типичный и нетипичный характер. В типичном варианте генитального герпеса – это всегда хорошо заметные множественные, довольно мелкие, с четкими границами округлые эрозии; высыпные элементы быстро минуют везикулярную стадию, в которой, кстати, эти элементы плохо различимы без применения кольпоскопии. Проблема причастности ВПГ к развитию нетипичных герпетических изменений слизистой шейки матки в настоящее время находится в стадии исследований.
При кольпоскопии в острый период герпетической инфекции шейки матки определяют изъязвление с неровными краями с сукровицей в области дна. Эволюция этого поражения идет от изъязвления с красным дном к простой эрозии до полного исчезновения в течение 3-х недель. К предшествующим изменениям относят маленькие буллезные образования, затем округлые микроэрозии с последующим формированием простых красных пятен, которые похожи на местный пятнистый кольпит.
Исследования показали, что выделение ДНК ВПГ с поверхности эрозии шейки матки в 60 % случаев сопровождается репликативной фазой ГИ (репликация и сборка вирусных частиц в инфицированных клетках). При эрозии и дисплазии шейки матки ВПГ-2 выявляется в 27,2% случаев непосредственно в соскобах со слизистой цервикального канала и сопровождается повышением титра специфических иммуноглобулинов в крови до диагностических уровней.
Особое значение влияние герпетической инфекции на состояние эпителия шейки матки имеет у женщин, длительно принимающих оральные гормональные контрацептивы. Известно, что длительный прием комбинированных стероидов в той или иной мере усиливает процессы плоскоклеточной метаплазии, а также может вызывать эффект эндоцервикальной гиперплазии, причем этот эффект в случае его развития наблюдается как в эпителии цервикального канала, так и в участках псевдоэрозии на фоне эктропиона, в полипах слизистой цервикального канала. В связи с этим прием оральных комбинированных контрацептивов может являться кофактором в развитии рака шейки матки, особенно в сочетании с герпетической инфекцией.
Герпетический цервицит
Герпетический цервицит – это воспалительный процесс, вызванный ВПГ. Для клинических проявлений герпетического цервицита характерно разнообразие проявлений — от легкой гиперемии с небольшим количеством эрозий до тяжелого некротического поражения (под эрозией шейки матки понимают дефект эпителия в результате воспаления). Цервицит диагностируется у 70-90% женщин с герпетическим поражением половых органов. Шейка матки при герпетическом эндоцервиците отечна, часто имеет эрозии, легко кровоточит при манипуляциях.
Герпетический эндометрит
Эндометрит — это воспаление внутренней (слизистой) оболочки матки (эндометрия) с поражением как функционального, так и базального слоя. Эндометрит, вызванный вирусом простого герпеса, является следствием длительной персистенции (существования) вируса в эндометрии. Герпетический эндометрит, как правило, возникает при атипичном или бессимптомном течении ГГ, типичная форма отмечается редко (~20% случаев). Клинические симптомы при вирусном поражении эндометрия чаще всего отсутствуют или проявляются нетипично, что приводит к ошибкам в диагностике и позднему началу лечения.
При герпетическомпоражении ткани нарушаются факторы местного и общего иммунитета, целостность поверхности эпителия, что приводит к созданию благоприятных условий для развития других инфекционных процессов .
Клинически герпетический эндометрит чаще проявляется во второй фазе менструального цикла или во время беременности, что, возможно, обусловлено повышением уровня простагландинов в этот период или супрессией Т-клеточного звена иммунитета, способствующих реактивации ВПГ, персистирующего в эндометрии. Субклиническая латентная внутриматочная герпетическая инфекция является важным фактором невынашивания беременности. Эндометриты ВПГ-этиологии встречаются нечасто, но эти заболевания очень опасны и могут вызвать гибель женщины и плода.
Герпес уретры и мочевого пузыря (герпетический уретрит)
Герпетический уретрит у женщин субъективно проявляется болями и резями в начале мочеиспускания, частыми позывами к мочеиспусканию. У 4,8% женщин имеет место очень болезненное мочеиспускание, или задержка мочеиспускания в результате инфекции уретры и слизистой оболочки мочевого пузыря. Нормализация функции мочевого пузыря у больных с задержкой мочеиспускания обычно происходит в течение 6–10 дней.
При осмотре наблюдаются гиперемия наружного отверстия уретры, наличие скудных слизистых выделений; при уретроскопии в передней части уретры иногда удается обнаружить мелкие поверхностные эрозии, катаральное воспаление.
Герпетический цистит
Ведущими симптомами герпетического цистита являются цисталгия, появление болей в конце мочеиспускания, дизурические явления. При герпетическом цистите появляются гематурия (кровь в моче), появление болей в конце мочеиспускания, боли в области мочевого пузыря. У женщины это может быть первым и единственным признаком ВПГ-инфицирования мочеполовой сферы. Он нередко возникает в первые 1-3 месяца после начала половой жизни или после смены полового партнера.
Герпес анальной области и прямой кишки
Очаг поражения в анальной области обычно представляет собой рецидивирующую трещину, что нередко является поводом для диагностических ошибок. Такие больные с ошибочным диагнозом "трещина заднего прохода" попадают к хирургам. Зудящая форма герпеса ануса и герпетическое поражение геморроидальных узлов, также трудны для диагностики.
Поражение анальной области может возникнуть первично как самостоятельное заболевание или вторично – в результате затекания отделяемого влагалища и мацерации слизистой оболочки ануса при наличии у пациентки герпетического кольпита, сопровождающегося обильной экссудацией.
При поражении сфинктера и слизистой оболочки ампулы прямой кишки (герпетический проктит) больных беспокоят зуд, чувство жжения и болезненность в очаге поражения, возникают мелкие эрозии в виде поверхностных трещин с фиксированной локализацией, кровоточащие при дефекации. При ректоскопии определяется катаральное воспаление, иногда эрозии.
Герпес внутренних гениталий - субклиническая и бессимптомная формы.
Для субклинической формы герпеса внутренних гениталий (влагалища, матки, яичников и т.д.) типично отсутствие у пациентки жалоб, иногда имеются указания на периодически появляющиеся необильные слизистые выделения из влагалища. При гинекологическом осмотре симптомы воспаления не выявляются. При динамическом лабораторном исследовании мазков отделяемого канала шейки матки, влагалища и уретры периодически выявляется повышенное количество лейкоцитов (до 200–250 и выше в поле зрения), свидетельствующее о наличии воспалительного процесса. При вирусологическом исследовании мазков методом иммунофлюоресценции в лейкоцитах определяется антиген ВПГ.
Бессимптомная форма герпеса внутренних гениталий характеризуется отсутствием у больных каких-либо жалоб на половую сферу, объективных клинических данных, подтверждающих воспаление. При лабораторном исследовании отделяемого урогенитального тракта выделяется ВПГ, в то время как в мазках признаков воспаления (лейкоцитоза) нет. Бессимптомная форма герпеса внутренних гениталий выявляется у 20–40% женщин, страдающих РГГ ягодицы и бедра. Это важное обстоятельство необходимо учитывать при планировании беременности у женщин с этой формой РГГ в связи с существующей вероятностью развития во время беременности осложнений ВПГ-инфекции.
Согласно данным литературы, у 83,6% женщин, страдающих не поддающимися терапии кольпитами и лейкоплакией шейки матки, ВПГ является одним из факторов заболевания. Доказано, что ВПГ может быть причиной развития эндометрита и сальпингоофорита.
Герпетический вульвовагинит
У женщин часто встречаются герпетический вульвовагинит, особенностью течения которого является нередкое присоединение отека пораженной области. Вирус герпеса могут изолированно поражать вульву и влагалище. Заражение происходит от больных. Герпетический вульвовагинит проявляется мелкими пузырьками на гиперемированной вульве. Пузырьки содержат прозрачную, а при присоединении вторичной инфекции — гнойную жидкость. Через 5—7 дней пузырьки вскрываются с образованием эрозий и язвочек, которые покрываются струпом. В начале заболевания выражены жжение, боли и зуд в области вульвы. Общие симптомы включают головную боль, озноб, повышение температуры тела.
Генитальный герпес во время беременности
Заболевание ВПГ женщин во время беременности может явиться причиной гибели плода, мертворождения, преждевременных родов. Герпесвирусы вызывают до 30% спонтанных абортов на ранних сроках беременности и свыше 50% поздних выкидышей, занимают второе место после вируса краснухи по тератогенности (развитие уродств плода).
Тяжелейшие формы неонатального герпеса развиваются при инфицировании новорожденного вирусом простого герпеса в родах. При первичном ГГ у матери инфицируется от 30% до 80% детей, при рецидивирующем герпесе – 3–5%. Инфицирование плода во время родоразрешения, если у матери в конце беременности имели место герпетические высыпания, происходит у 50% женщин, больных РГГ; при этом у 60–80% инфицированных детей развивается энцефалит.
Герпес менструальный
Менструальный герпес — это генитальный герпес (ГГ) с монотонным типом рецидивирования и тяжелым течением, характеризующийся ежемесячными обострениями инфекционного процесса до, во время или после менструации. Такое течение заболевания может стать для женщины сильнейшим психотравмирующим фактором, ограничивающим ее социальную активность и снижающим качество жизни.
Этот вариант ГИ является сложным для лечения. Поэтому разработка адекватных и эффективных способов лечения и профилактики рецидивов у больных с данными формами ГГ остается актуальной. Европейские стандарты лечения пациенток предусматривают длительную (годами) супрессивную терапию противовирусными препаратами , что не исключает повторного рецидирования ГГ и бессимптомного вирусовыделения, появления побочных эффектов и резистентности вирусов герпеса к лекарственной терапии.
Герпетические заболевания органов мочеполовой системы все чаще наблюдаются у пациентов с микст-инфекцией. Генитальный герпес в 80% случаев протекает в виде микробной ассоциации, в сочетании с хламидиями, уреа- и микоплазмой, стрепто-, стафилококками, грибковой флорой. Не исключено сочетанное поражение гениталий ВПГ, гонококком, бледной трепонемой, другими вирусами, передающимися при половом контакте. При выявлении бактериально-вирусных ассоциаций необходимо учитывать синергическое действие (взаимодействие) различных возбудителей в развитии воспалительного процесса гениталий
Вследствие сочетания инфекций и общего влияния возбудителей на организм развивается более тяжелое, иногда с атипической симптоматикой, заболевание. В этом случае необходимо тщательного обследовать пациентов для постановки точного диагноза и исключения ВИЧ-инфекции.
Рецидивирующий генитальный герпес также чаще протекает не как самостоятельное заболевание, а сопровождает другую патологию мочеполовой системы. Накапливаются данные о том, что гонококковая, хламидийная, трихомонадная инфекции могут активизировать герпетическую инфекцию, предопределяя возникновение рецидивов герпетического заболевания гениталий.
Иммунодефицитные состояния
ВПГ угнетает иммунную систему (иммуносупрессия). Клинически это выражается в частых простудах, сниженной работоспособности, быстрой утомляемости, низкой устойчивости к стрессам, апатии. Температура может повышаться до субфебрильной. По мере прогрессирования иммуносупрессии увеличивается частота возникновения рецидивов герпетической инфекции, увеличивается распространенность очагов поражения кожи и слизистой оболочки.
Психоэмоциональные осложнения

При длительно протекающей, часто рецидивирующей герпетической инфекции для больных характерно развитие психоэмоциональных нарушений, в большой степени связанных с астеническим синдромом. У некоторой части больных герпетическая инфекция вызывает диагностически значимую личностную дисгармонию, с риском развития тяжелых невротических и депрессивных состояний.
Генитальный герпес (ГГ) у женщин сопряжен с большей степенью психоэмоциональных осложнений, чем у мужчин. Так, у 48% женщин с генитальным герпесом специализированное обследование позволило установить отклонение личности, а у 11% – неврастенические, депрессивные синдромы.
Часто рецидивирующее и длительное течение генитального герпеса вызывает тяжелые физические страдания. Бичом для женщин и мужчин являются генитальный герпес с яркими высыпаниями, жжением, выделениями различного характера из половых органов.
Еще одним психологическим аспектом проблемы герпеса является социальная, т.к. инфекция нарушает нормальную половую жизнь пациентов, способствует возникновению фобий, порождает страх социальной оценки и приводит к семейным неурядицам.
ГГ как причина рака. Онкогенное влияние герпетической инфекции.
Важное значение вируса простого герпеса (ВПГ) в патологии человека – это его возможная ассоциация с некоторыми формами рака у людей.
Следует отметить возможную роль ВПГ-2 (в ассоциации с паповавирусами, ЦМВ, хламидиями и микоплазмами) в развитии опухолевых процессов у человека, в частности рака шейки матки и рака предстательной железы. Считают, что в этом случае ВПГ-2 может поддерживать канцерогенез, инициируя развитие дисплазии и поддерживая ее в состоянии стабилизации.
Накапливается число клинико-экспериментальных наблюдений, подтверждающих этиологическую роль биотипов ВПГ в развитии дисплазии, карциномы in situ, рака шейки матки у женщин. Так, при эрозии и дисплазии шейки матки, ВПГ-2 выявляется в 27,2% случаев непосредственно в соскобах со слизистой цервикального канала и сопровождается повышением титра специфических иммуноглобулинов в крови до диагностических уровней.
Герпетическая инфекция (ГИ) с большей вероятностью может приводить к онкологическому заболеванию при смешанных формах инфекции. Например при наличии ассоциации ВПГ-2 с вирусами папилломы человека регистрируется значительно более высокая степень риска развития онкопоражений, когда происходит направленная индукция процессов малигнизации эпителиальных клеток.
Хроническая ГИ повышает риск развития онкозаболеваний при воздействии химических канцерогенов и мутагенов. Это происходит потому, что геномы клеток, хронически инфицированных ВПГ-2, становятся уязвимыми к действию химических канцерогенов. Как пример — курение увеличивает риск развития рака шейки матки у женщин с хронической герпетической инфекцией эндоцервикса.
Еще одним фактором в инициации и поддержании механизмов канцерогенеза у человека, может стать иммуносупрессивный эффект хронической рецидивирующей ГИ. Из-за подавления ряда звеньев клеточного (противоопухолевого) иммунитета развивается ВПГ-индуцированный иммунодефицит. Он может послужить благоприятным фоном для развития неопластического процесса из единичных мутировавших (стареющих) потенциально раковых клеток.
ГГ и ВИЧ-инфекция
Генитальный герпес способствует распространению ВИЧ-инфекции, а также других инфекций, передающихся половым путем (эпидемиологический синергизм).
• в кожных герпетических изъязвлениях содержится большое количество CD4+ лимфоцитов, которые являются идеальной мишенью для ВИЧ, вследствие чего даже при очень низкой концентрации ВИЧ возрастает вероятность инфицирования полового партнера;
• герпесвирусы способствуют экспрессии генов ВИЧ, что создает дополнительные условия для эффективной репродукции вируса
Вирусы герпеса могут активировать ВИЧ, находящийся в стадии про-вируса, и являются кофактором прогрессирования ВИЧ-инфекции и СПИДа. В этой связи герпетическая инфекция является одним из важных СПИД-индикаторных заболеваний.
Атеросклероз
Ассоциация атеросклероза с вирусной инфекцией была экспериментально обоснована в 70-е годы прошлого века. За последние 30 лет накопилось достаточно много экспериментальных и клинических данных, свидетельствующих об участии в патогенезе атеросклероза некоторых вирусов, среди которых вирус простого герпеса.
Тенденцию к ускорению процесса атеросклероза в последние годы связывают именно с огромным инфицированием ВПГ. Находит все большее подтверждение вирусная гипотеза происхождения атеросклероза, в основе которой лежит предположение об индуцирующей роли вирусов герпеса в развитии заболевания.
ВПГ, возможно, в ассоциации с цитомегаловирусом, играет значительную роль в индукции атеросклероза. Наиболее вероятной причиной изменений в атеросклеротической бляшке больных атеросклерозом является вирусное инфицирование, так как вирусы (в большинстве случаев ВПГ, ЦМВ) выявляются и в сосудистом эндотелии, и в гладкомышечных клетках сосудистой стенки. Данный факт также предполагает вероятность трансформации гладкомышечных клеток под действием ВПГ.
При аутопсии людей, погибших от случайных причин, в различных слоях артериальной стенки, в том числе эндотелии и гладкомышечных клетках, выявлены иммунологические маркёры цитомегаловируса (ЦМВ) и вируса простого герпеса (ВПГ). У больных атеросклерозом вирус простого герпеса в 90% случаях явился инфекционным агентом, причем, частота и патогенность ВПГ-1 несколько выше, чем ВПГ-2.
В атеросклеротических бляшках возможно присутствие сразу нескольких патогенов: например, ЦМВ, ВПГ-1 и других патогенных штаммов. Более того, в ряде исследований была продемонстрирована взаимосвязь между числом различных патогенов, которыми инфицирован индивидуум, и 1) распространенностью атеросклеротического процесса, 2) риском смерти вследствие сосудистых катастроф (в т.ч. и инсультов),
Вирус герпеса и болезни сердца.

Герпесвирусная инфекция повышает риск развития осложнений при сердечно-сосудистых заболеваниях, например влияет на особенности клинического течения ишемической болезни сердца (ИБС). Более тяжелое течение ИБС ассоциировано с инфицированием двумя типами вируса простого герпеса (более выраженные и продолжительные ангинозные боли, плохо купирующиеся приемом нитроглицерина или ингаляций нитроминта, одышка и чувство нехватки воздуха). При инфицировании только I типом вируса простого герпеса, в исследованиях отмечено более легкое течение ИБС.
Герпесвирусная инфекция в худшую сторону влияет и на клиническое течение инфаркта миокарда, вызывая осложнения. При инфаркте миокарда, у пациентов, имеющих высокие титры IgM и IgG к ВПГ-1 и ВПГ-2, на фоне активации хронической герпесвирусной инфекции, значительно повышается риск развитии острой сердечно-сосудистой недостаточности (в том числе отеков легких) и нарушений сердечного ритма в виде жизнеугрожающих аритмий.
Что такое эндометрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Делеске И. А., гинеколога со стажем в 9 лет.
Над статьей доктора Делеске И. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
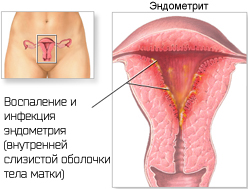
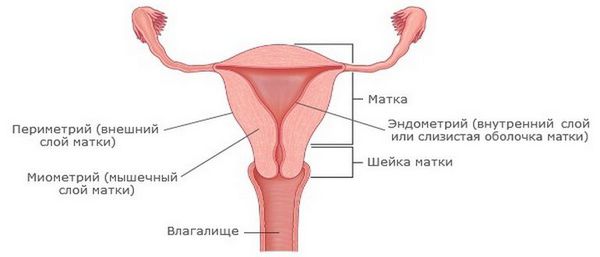
Эндометрит — это воспаление внутреннего слоя матки (эндометрия), которое приводит к изменению его функций. Возникает в результате заражения этой области микробами, вирусами и грибковыми инфекциями.
Эндометрит — одно из наиболее распространенных гинекологических заболеваний. По данным зарубежных источников, распространенность эндометрита составляет 20% в популяции, отечественные авторы указывают до 60-70%, чаще всего болеют женщины репродуктивного возраста [9] [11] . Стабильный рост заболеваемости отмечается последние 20-30 лет [1] [10] . Часто встречается в сочетании с ранним началом половой жизни, отсутствием контрацепции, абортами, наличием хронических воспалительных заболеваний нижнего отдела репродуктивного тракта. [7] [8] .
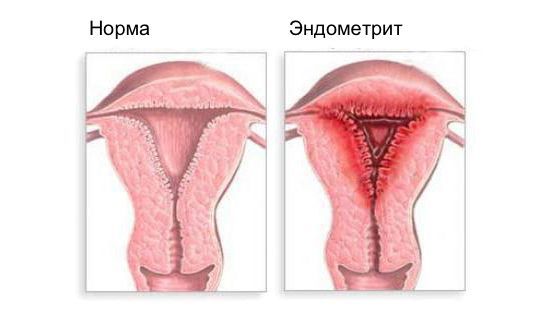
Эндометрит часто является причиной бесплодия, привычного невынашивания (два и более выкидыша в анамнезе), нарушения менструального цикла, осложнений беременности, родов и послеродового периода, неудачных попыток ЭКО, гиперпластических заболеваний эндометрия и сексуальных проблем [1] .
Чем эндометрит отличается от эндометриоза
Эндометриоз — это разрастание эндометриоидной ткани. Эндометриоз может поражать полость матки, её оболочки, маточные трубы, яичники, брюшину и области вне половых органов. Эндометритом же называют воспаление внутреннего слоя матки.
Причины эндометрита
В женском репродуктивном тракте присутствуют различные микроорганизмы, среди которых преобладают Lactobacillus spp. Эндометрит чаще ассоциирован с чрезмерным размножением бактерий Enterobacter, Enterococcus, Streptococcus, Staphylococcus, Ureaplasma, Mycoplasma.
Эндометрит вызывают также вирусные инфекционные агенты: вирус герпеса, цитомегаловирус, вирус папилломы человека, энтеровирусы и аденовирусы.
Возможен эндометрит специфической этиологии: гонорейный, туберкулезный, актиномикотический (грибковая инфекция) и неспецифический. [8] [7] [10] .
Риск развития эндометрита увеличивают:
- манипуляции в полости матки — аборты, выскабливания, метросальпингография (контрастное рентгенологическое исследование полости матки и проходимости фаллопиевых труб), введение внутриматочного контрацептива, инсеминация (введение спермы), ЭКО;
- заболевания мочевыделительной системы;
- операции на органах малого таза;
- послеродовые гнойно-воспалительные осложнения;
- другие гинекологические заболевания (хронический сальпингоофорит, цервицит, гиперплазия эндометрия, полип эндометрия);
- частая смена половых партнеров;
- незащищенные половые связи;
- предшествующие прерывания беременности;
- кесарево сечение до 28 недель гестации;
- длительный безводный период в родах;
- ручное отделение плаценты;
- инвазивные исследования для пренатальной диагностики;
- длительное ношение внутриматочного контрацептива.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы эндометрита
Воспаление может протекать в острой и хронической форме. Чаще всего симптомы эндометрита появляются на четвёртый день после инфицирования. При острой форме эндометрита отмечаются общие симптомы воспаления, такие как слабость, быстрая утомляемость, повышение температуры тела, изменения в общем анализе крови (сдвиг лейкоцитарной формулы влево и повышение СОЭ).
К локальным симптомам острого эндометрита можно отнести:
- периодические умеренные или острые тянущие боли внизу живота, иногда отдающие вниз спины и в пах;
- жидкие гноевидные выделения из половых путей с неприятным запахом (возможно с примесью крови);
- диспареуния (боль при половом акте).
При отсутствии правильного и своевременного лечения эндометрита в течении 10 дней возможен переход в хронический воспалительный процесс. При этом держится повышенная температура, появляются новые симптомы:
- нарушение менструального цикла, мажущие кровянистые выделения в середине цикла;
- привычное невынашивание беременности;
- серозно-гнойные выделения из половых путей;
- ноющие боли внизу живота;
- боль во время секса [3][5][8] .
Течение острого послеродового эндометрита более тяжёлое, проявляется в следующих симптомах:
Эндометрит при беременности
Эндометрит препятствует имплантации плодного яйца, из-за чего оно может отторгнуться полностью или возникнет нарушение процессов имплантации. В дальнейшем это может привести к выкидышу или замершей беременности.
Если воспалительный процесс усиливается, может развиться хориоамнионит — воспаление плаценты, которое приводит к разрыву плодных оболочек, излитию околоплодных вод и преждевременным родам.
Чтобы избежать возможных осложнений, женщинам с хроническим эндометритом при планировании беременности необходимо пройти комплексное лечение.
Патогенез эндометрита
На начальном этапе воспаления инфекционный агент (бактерии, вирусы или грибки) внедряется в слизистую оболочку матки. Начинается выработка медиаторов воспаления, которая приводит к нарушению микроциркуляции крови в его очаге. Миграция лейкоцитов в зону повреждения, активация нейтрафилов и макрофагов ведёт к активной выработке цитокинов и перекиси водорода, запуску перекисного окисления липидов с повреждением мембран клеток. В это время на фоне повышенной выработки цитокинов и факторов роста происходит деградация матрикса клеток. Нарушение микроциркуляции крови приводит к развитию локальной ишемии и гипоксии ткани, которые затем активируют процессы склерозирования. При длительной стимуляции иммунной системы происходит её истощение и появление аутоиммунных реакций.
В 95% случаев эндометрит является первичным — патогенные микроорганизмы попадают в полость матки восходящим путём, при половом контакте или гинекологических манипуляциях . В 5% случае эндометрит носит вторичный характер: инфекция попадает в эндометрий гематогенным путем, либо же лимфогенным или нисходящим путём (с верхних отделов репродуктивного тракта).
При длительности воспалительного процесса более 2 месяцев можно расценивать его как хронический процесс. Развиваются изменения в структуре и функции ткани, происходит нарушение пролиферации (деления клеток) и физиологической циклической трансформации эндометрия. В связи с этим возможно нарушение нормальной имплантации эмбриона при беременности.
Существует аутоиммунная теория патогенезе хронического эндометрита. Она говорит о том, что при длительном воздействии инфекционного агента на иммунную систему происходит вторичное повреждение эндометрия. При этом нарушается процесс апоптоза (запрограммированной гибели клетки) [11] .
Классификация и стадии развития эндометрита
Эндометрит можно разделить на острую и хроническую форму.
Острый эндометрит возникает при абортах, диагностических манипуляциях, выскабливании, развивается быстро, воспаление сопровождается острыми или ноющими болями и повышением температуры. Наиболее частый путь инфекции при нём — восходящий. Распространение инфекции из влагалища в верхние отделы репродуктивного тракта происходит при несостоятельности барьера шейки матки. Воспаление может локализоваться в эндометрии, а также переходить на миометрий. При несвоевременном и неполноценном лечении возможно развитие пельвиоперитонита (воспаление оболочки брюшины в области малого таза).
Отдельно выделяется острый послеродовый эндометрит — начинается на 2-4 сутки после родов, ему может предшествовать хориоамнионит (инфицирование оболочек плода и жидкости).
При хроническом эндометрите симптоматика сглажена. Характерны периодические обострения и рецидивы после переохлаждения и воспаления другой локализации урогенитального тракта.
По клиническим проявлениям эндометрит подразделяется на клиничеcки выраженную и субклиническую форму.
По характеру воспалительного процесса эндометрит можно разделить на:
- Катаральную форму (поражение поверхностных слоев слизистой оболочки матки и выделение слизистого экссудата).
- Катарально-гнойную форму.
- Гнойную форму.
- Некротическую форму.
- Гангренозную форму.
По морфологическим признакам:
- Атрофический эндометрит — наблюдается атрофия желез эндометрия, фиброз стромы, инфильтрация лимфоидными элементами;
- Кистозный эндометрит — сдавление протоков желез фиброзной тканью, образование кистозных элементов в эндометрии;
- Гипертрофический эндометрит — характеризуется гипертрофией желез эндометрия в результате хронического воспаления [5] .
Осложнения эндометрита
Осложнения у эндометрита могут быть достаточно серьёзными.
Метротромбофлебит (тромбоз тазовых вен) развивается через 2-3 недели от начала заболевания эндометритом. Пациентки отмечают общие симптомы воспаления, сохраняющуюся повышенную температуру тела, тянущие или острые боли внизу живота, выделения из половых путей [1] [2] .
Параметрит — воспаление околоматочной клетчатки. После внедрения инфекционного возбудителя в параметрий возможно образование диффузного воспалительного инфильтрата. При отсутствии лечения происходит нагноение и переход в хроническое течение. При переходе на всю клетчатку развивается пельвиоцеллюлит (воспаление клетчатчки малого таза) [2] [9] [10] .
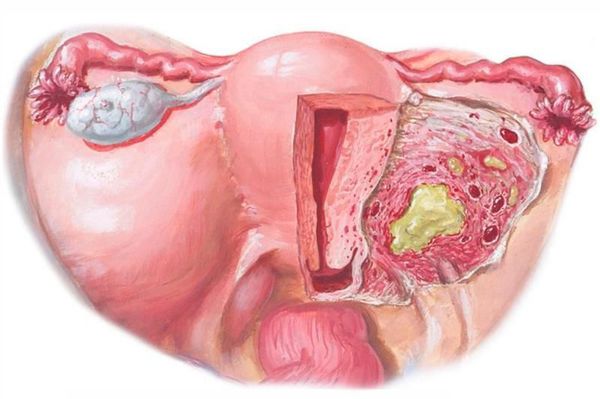
Пельвиоперитонит — воспаление выходит за пределы матки, в процесс вовлекаются листки брюшины. Пациентки отмечают резкое повышение температуры, симптомы интоксикации, тошноту, рвоту, интенсивные боли внизу живота (основная локализация ниже пупка), симптом раздражения брюшины ( резкое усиление боли в животе при быстром надавливании и снятии руки).
Сальпингоофорит — воспалительный процесс в маточных трубах и яичнике. Наиболее частые осложнения при несвоевременном лечении: пиовар (гнойное воспаление яичника) и туюоовар (формирование единого гнойного конгламерата из воспаленного яичника и маточной трубы). Все вышеперечисленные осложнения требуют оперативного лечения [2] [9] [10] .
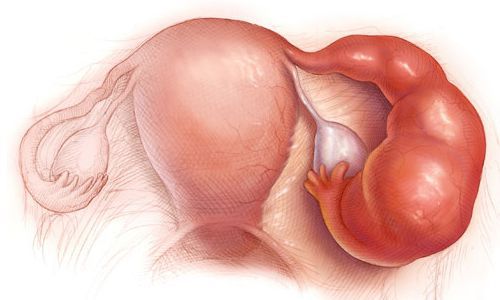
Другими осложнениями могут быть бесплодие, нарушение менструального цикла, выкидыши, внематочная беременность, спаечный процесс в малом тазу [1] [2] [3] .
В некоторых случаях возникает септический шок — угрожающее жизни осложнение, в условиях которого критически нарушается кровоснабжение тканей и клеточный метаболизм. Главные симптомы сепсиса — высокие показатели температуры тела, симптомы интоксикации, снижение давления и тахикардия, изменения в общих анализах крови, обильное потоотделение, спутанность сознания [8] [9] .
Диагностика эндометрита
Диагностика хронического эндометрита должна быть основана на комплексном подходе анализа жалоб пациентки, анамнеза, симптомов, результатов эхографических исследований, лабораторной диагностики, данных морфологического исследования эндометрия и иммунного статуса.
Пайпель-биопсия эндометрия
Хронический эндометрит диагностируют прежде всего с помощью морфологического исследования [8] .
Гистологический материал получают при выскабливании стенок полости матки под контролем гистероскопа или пайпель-биопсии. Пайпель-биопсия — это получение гистологического материала с помощью тонких канюль при аспирации (удалении) эндометрия. Данный метод имеет большую диагностическую ценность в амбулаторных условиях.
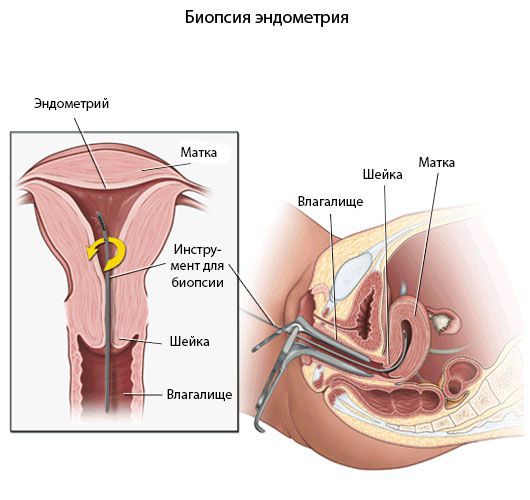
Критериями хронического эндометрита является наличие очаговых или диффузных лимфоидных инфильтратов, склероз стенок спиральных артерий, фиброз стромы и наличие плазматических клеток. При этом к абсолютным признакам хронического эндометрита относят плазматические клетки.
Микробиологическое исследование
Микробиологические посевы используются для выявления возбудителя воспалительного процесса.
Иммуногистохимическое исследование
Иммуногистохимическое исследование при эндометрите заключается в исследовании биоптата слизистой оболочки матки с целью определения мембранного белка, который является маркером плазматических клеток. Информативность гистологического исследования при этом возрастает до 85-90%, можно установить и иммунный характер повреждения эндометрия [5] [7] [8] .
УЗИ при эндометрите
При эхографии (УЗИ) хронический эндометрит определяют по:
- изменениям в структуре эндометрия;
- участкам повышенной эхогенности различной формы и величины в зоне М-Эхо;
- наличию сниженной эхогенности в эндометрии;
- наличию жидкости в полости матки;
- присутствию мелких кальцинатов 1-3 мм в эндометрии;
- участкам фиброза в эндометрии разной степени;
- наличию внутриматочных синехий.
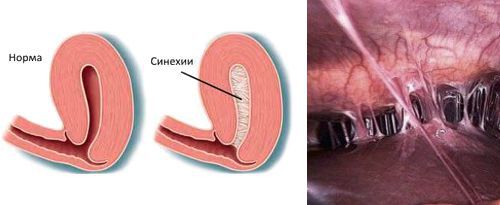
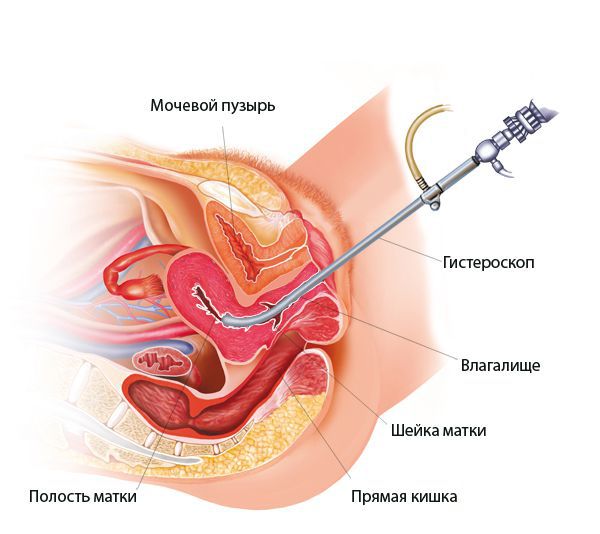
Гистероскопия при эндометрите
При гистероскопии определяются следующие признаки хронического эндометрита: гиперемия слизистой оболочки матки, неровномерная толщина эндометрия, полипообразные образования, кровоизлияния, очаговая гиперплазия эндометрия.
Лечение эндометрита
Лечение эндометрита на первом этапе заключается в устранении бактериального или грибкового возбудителя, а для эндометрита вирусной этиологии — снижении вирусной нагрузки [7] . Для этого проводят комплексное лечение, включающее в себя антибактериальную терапию, анаэробные средства, противовоспалительные и противовирусные лекарственные средства [5] [6] [8] .
Второй этап заключается в восстановлении рецептивности эндометрия и его функциональности. Успешное восстановление рецепторного аппарата эндометрия должно происходить без снижения пролиферации (размножения, разрастания) клеток. Устраняются последствия ишемии, склеротические процессы, восстановливается отток крови. Длительность и объёмы терапии зависят от тяжести воспалительного процесса и сопутствующей гинекологической патологии. После проведения основных этапов лечения необходим курс реабилитации (физио-терапевтическое лечение) [7] [8] [10] .
Иммуностимулирующую терапию применяют при комплексном лечении хронического эндометрита, если выявлена вирусная инфекция: вирус папилломы человека, герпеса, Эпштейна — Барр, цитомегаловирус.
Гормональную терапию используют для подготовки эндометрия, чаще всего перед ЭКО. Для применения гормональных препаратов необходимо гистологическое подтверждение патологии эндометрия.
Контрольные критерии эффективности терапии хронического эндометрита:
- допплерометрическое исследование сосудов матки с ЦДК во 2 фазу менструального цикла;
- определение ангиогенных факторов;
- клиническое улучшение.
Рекомендации по диагностике и лечении эффективны лишь у половины больных, а частота рецидивов остается на уровне 25 % [13] .
Прогноз. Профилактика
При своевременном и полноценном лечении прогноз благоприятный. Пациентки отмечают улучшение состояния в течении двух суток. При запоздалом лечении эндометрита возможно развитие септического шока.
Читайте также:

