Еще миллиарды бактерий вирусов
Обновлено: 19.04.2024

В последнее время бактериофаги привлекают все больше внимания как альтернативный антибиотикам способ лечения. РБК Тренды попросили эксперта рассказать о них все, что известно науке на сегодняшний день
В этой статье о бактериофагах:
Об эксперте: Константин Мирошников, доктор химических наук, главный научный сотрудник лаборатории молекулярной биоинженерии ИБХ РАН.
Что такое бактериофаги
Бактериофаги — это вирусы бактерий. У всех организмов на Земле есть крошечные, невидимые в оптический микроскоп паразиты — вирусы. Есть они и у одноклеточных.
Цикл размножения бактериальных вирусов обычно заканчивается гибелью микроба. Однако существуют разновидности бактериофагов, которые не уничтожают клетку хозяина напрямую, а, как вирусы более совершенных организмов, оставляют ее истощенной, но жизнеспособной.
Бактерии доминируют в биосфере Земли, составляя более 90% ее биомассы. У каждого вида бактерий имеется множество специализированных типов вирусов. Бактериофаги — это самые многочисленные существа в биосфере. Их изучают уже более ста лет.
Кто открыл бактериофаги
В последней четверти XIX века благодаря микробной теории инфекционных заболеваний Пастера и Коха ускорился прогресс в области экспериментальной микробиологии. В частности, ученые научились культивировать микроорганизмы. Исследователи регулярно наблюдали необычный эффект: растущая культура бактерий внезапно самоуничтожалась по не известным тогда причинам. Существование мельчайшего инфекционного агента, способного проходить через самые тонкие фильтры и вызывать гибель бактерий, выявили в конце 1890-х.
Однако природа этого агента оставалась непонятной. В то же время исследователи активно изучали вирусы. Сопоставить эти две линии экспериментальных находок и обосновать это в дискуссии с научными оппонентами удалось в 1917 году франко-канадскому естествоиспытателю Феликсу Д’ Эрелю.
Главной проблемой ранних работ в области биологии бактериофагов была ограниченность доступных в то время экспериментальных методов. Исследователям приходилось работать с невидимым организмом, многие свойства которого было невозможно интерпретировать. Как выглядит бактериофаг, удалось узнать только в 1940-х годах с появлением электронной микроскопии.

Как работают бактериофаги
Инфекционный цикл бактериофагов проходит по тем же основным этапам, что и у других вирусов. Бактериофаг должен присоединиться к бактериальной клетке и доставить свой генетический материал внутрь нее. Дальнейшие этапы развития инфекции переключают механизмы жизнедеятельности бактерии на обслуживание бактериофага, размножение его генома, построение копий вирусных оболочек, упаковку в них нуклеиновой кислоты вируса и, наконец, разрушение зараженной клетки. У каждого из этих этапов существуют множество нюансов, имеющих глубокий эволюционный и экологический смысл.
Роль бактериофагов в биосфере — регуляция численности и разнообразия одноклеточных микроорганизмов. Бактерии и их вирусные паразиты сосуществуют миллиарды лет. И эта борьба за выживание не закончилась ни тотальным уничтожением одноклеточных, ни приобретением тотальной устойчивости к фагам и бесконтрольным размножением бактерий.
Самые распространенные бактериофаги
На что способны бактериофаги
Во время раннего периода изучения бактериофагов, в 1920–1930-х годах, единственным достоверно понятным их свойством была способность уничтожать бактерии, в том числе и болезнетворные. Этим свойством незамедлительно заинтересовались исследователи в области медицины. Первые попытки лечения фагами дизентерии, раневых инфекций, холеры и тифа были проведены пусть не по современным стандартам, но достаточно аккуратно. Успех выглядел вполне убедительно. Перспективными были попытки бороться с их помощью с бактериальными болезнями животных и растений.
Однако после начала массового выпуска и использования фаговых препаратов эйфория сменилась разочарованием. На тот момент было известно очень мало о том, что такое бактериофаги, как их производить, очищать и применять их лекарственные формы.
В 1940-х годах более перспективным оказался подход применения в медицине низкомолекулярных веществ, убивающих микроорганизмы, — антибиотиков. Эти вещества были проще в производстве, хранении, а главное — быстро и качественно уничтожали всех микробов в человеческом организме.
Расшифровка геномов организмов тоже началась с небольших геномов фагов. С развитием экспериментальной геномики ученые все больше узнавали о колоссальной роли бактериофагов в экологии и эволюции биосферы. Выполненные в начале 2000-х исследования метагеномов — полного генетического материала биологических сообществ — пролили свет на колоссальное разнообразие бактериофагов в природе. Так, например, была открыта система CRISPR-Cas.
Какой потенциал у изучения бактериофагов
Потенциал детальных исследований бактериофагов еще очень велик как в фундаментальном, так и в прикладном контексте.
Возобновляется интерес к бактериофагам как к терапевтическим средствам. В последние десятилетия использование антибиотиков вызывает все больше вопросов. Возникает проблема поиска дополнительных и альтернативных средств борьбы с болезнетворными бактериями. В отличие от ситуации столетней давности, о бактериофагах известно достаточно, чтобы обоснованно выбирать те, которые подходят для терапевтических целей. Изучены многие аспекты поведения фагов в организме человека и их взаимодействия с иммунной системой.
Для разработки и производства эффективного препарата необходимо точно подобрать бактериофаги с полностью расшифрованными геномами, культивировать их по современным биотехнологическим стандартам на определенных штаммах бактерий в химически чистых средах и провести очистку высокой степени. Однако это все равно дешевле, чем создание современных сложных антибиотиков. Кроме того, использование бактериофагов и антибиотиков в медицинских целях не противоречит друг другу. При совместном их применении наблюдается синергизм — взаимное усиление антибактериального эффекта. Это позволяет, например, снизить дозы антибиотиков до значений, не вызывающих выраженных побочных эффектов. Опубликован ряд работ, которые детально описывают успешные случаи излечения с помощью бактериофагов инфекций, устойчивых к антибиотикам.
За что критикуют исследование бактериофагов в научном сообществе
Разумеется, бактериофаги не всесильны. Есть ряд фундаментальных ограничений их использования. Прежде всего — очень высокая специфичность действия. С одной стороны, это достоинство, так как антибактериальный эффект препаратов не затрагивает нормальную микрофлору человеческого организма. Но, с другой, применение бактериофагов требует высокоточной диагностики целевого патогена — возбудителя заболевания. В идеале подбор фагов-компонентов лекарственного препарата можно было бы делать индивидуально для каждого конкретного пациента. Но несмотря на то, что о персонифицированной медицине много говорится, эта концепция слишком сложна и дорога на практике.
Но по существующим правилам при каждом изменении компонентов необходимо заново проводить сертификационные действия. Требуется разработка принципиально новых стандартов тестирования и регистрации лекарственных препаратов на основе бактериофагов. Это признается специалистами здравоохранения, но нигде в мире пока не реализовано.

Юлия Ткаченко, руководитель блока медицинских инноваций BestDoctor
Мнение ученых по поводу распространения нового штамма разделились: одни считают его предвестником окончания пандемии, другие допускают появление еще более заразных мутаций.
Так, глава Европейского регионального бюро ВОЗ Ханс Клюге заявил, что после омикрон-штамма, возможно, наступит конец пандемии. Ранее такую же версию выдвинули ученые из ЮАР: их исследования показали вероятность окончания эпидемической фазы COVID-19 и переход ее в эндемическую, характерную для определенной местности.
Российские эксперты с этой версией не согласны. Александр Гинцбург, директор Национального исследовательского центра эпидемиологии и микробиологии им. Н. Ф. Гамалеи, считает, что новый штамм не поможет окончанию пандемии в России. Распространение омикрона может спровоцировать появление новых, более опасных мутаций вируса. Чтобы предотвратить такой сценарий, в стране должны быть привиты 75–80% населения.
Главный внештатный инфекционист Минздрава Владимир Чуланов также заявляет, что на омикроне эволюция вируса COVID-19 не остановится. Благодаря высокой контагиозности вирус очень быстро распространяется, и большое число одновременно заболевших может вызвать перегрузку медицинской системы. Поэтому важно вакцинироваться и через полгода делать бустерную прививку, а также соблюдать меры предосторожности: носить маски, соблюдать дистанцию, избегать мест большого скопления людей. В таком случае риск заразиться есть, но за счет вакцины вирус может быть блокирован на самом раннем этапе, после прикрепления к эпителию верхних дыхательных путей.
Даже в этом случае можно заразиться, считает Чуланов. Но это может произойти без дальнейшего развития заболевания: оно, скорее всего, пройдет в более легкой форме, так как иммунная система быстро заблокирует вирус.
22 января правительство РФ утвердило перечень дополнительных мер по борьбе с омикроном. Рассказываем, на что нужно обратить внимание при первых признаках болезни.
Симптомы омикрона

Юлия Ткаченко, руководитель блока медицинских инноваций BestDoctor
Пока не существует научных данных об особенностях симптоматики штамма омикрон, отличить омикрон по его проявлениям от другого штамма нового коронавируса невозможно. Стоит отметить, что и отличить COVID-19 от другой ОРВИ (острой респираторной вирусной инфекции) по одним лишь симптомам довольно затруднительно, в связи с чем при симптомах ОРВИ врачи рекомендуют выполнить ПЦР-тест на COVID-19.
Основные признаки

Согласно данным Роспотребнадзора, главные симптомы штамма омикрон похожи на те, что бывают при сезонных ОРВИ [4]:
- слабость;
- головная боль;
- повышение температуры до 38 °С, иногда и выше;
- ломота в мышцах и суставах;
- заложенность носа, насморк;
- першение в горле;
- чихание, кашель;
- снижение аппетита;
- потеря обоняния и вкусовых ощущений (редко).
Омикрон может проявляться как в виде одного симптома, так и сразу в комплексе нескольких из них, считает врач-инфекционист Евгений Тимаков. А в случае более выраженной болезни у пациентов также наблюдаются реакции со стороны ЖКТ.
До недавнего времени одним из основных признаков омикрона ученые считали боль в горле [5]. Но симптомы каждой новой мутации коронавируса сильно различаются, поэтому не стоит пытаться по ним диагностировать заболевание штаммом омикрон, заявил вирусолог, профессор МГУ, доктор биологических наук Алексей Аграновский. У нового штамма довольно размытые признаки. Известно лишь, что он меньше поражает легкие и в большей степени — верхние дыхательные пути. Поэтому боль в горле может быть симптомом коронавируса далеко не во всех случаях.
Юлия Ткаченко: Признаки болезни остаются теми же, что и у других штаммов коронавируса: в первую очередь характерны повышение температуры, кашель, общая слабость, притупление или искажение обоняния. Также возможны затруднение дыхания, одышка, чувство неполного вдоха. Кроме того, омикрон, как и другие штаммы, способен спровоцировать повышенное тромбообразование, которое может проявиться болью в ногах (тромбоз вен нижних конечностей), одышкой и удушьем (тромбоэмболия легочной артерии), болью в сердце (острый коронарный синдром) и неврологической симптоматикой (острое нарушение мозгового кровообращения).
Отличительные особенности

У нового штамма коронавируса есть несколько отличий:
- Инкубационный период. У омикрона он значительно короче, чем у других штаммов. По предварительным данным, он составляет от двух до пяти дней (против 6–8 дней у предыдущих мутаций коронавируса) [6].
- Высокая контагиозность. По сравнению с предыдущим штаммом дельта, омикрон передается в семь раз быстрее. А носитель вируса может быть заразным уже в первые сутки после инфицирования.
Юлия Ткаченко: Главной отличительной особенностью штамма омикрон является особое строение спайк-белка вируса. Спайк-белок — это структура, благодаря которой вирус проникает в клетки организма. Именно к этому белку у нас образуется иммунитет после перенесенной болезни или вакцинации, поэтому изменение строение белка несет за собой повышение устойчивости вируса к нашему иммунитету. Другими словами, штамм омикрон более устойчив к иммунитету по сравнению со своими предшественниками, и люди могут заразиться им, даже если уже переболели более ранними штаммами.
Еще одной отличительной особенностью нового штамма является более высокая заболеваемость среди детей и подростков, что также связывают с новым строением спайк-белка и облегченным проникновением вируса в клетки.
Есть и хорошая новость: первые результаты оценки тяжести течения болезни показывают, что среди заболевших штаммом омикрон меньше пациентов с тяжелым течением заболевания, они реже попадают в реанимацию и оказываются на ИВЛ, однако эти данные требуют подтверждения более масштабными исследованиями.
Как выявляют омикрон
Центр эпидемиологии и микробиологии имени Гамалеи разработал тест для определения омикрона, сообщил Александр Гинцбург. Система выявляет наличие вируснейтрализующих антител к омикрон-штамму. Но пока она доступна только НИЦ.
Юлия Ткаченко: Стандартная диагностика остается такой же, как и ранее, — ПЦР-тестирование. Для врачей вопрос о том, болен пациент омикроном или, к примеру, дельтой, не является принципиально важным, так как лечение будет одинаковым. Информация о том, каким именно штаммом болен человек, нужна в первую очередь ученым для проведения исследований. Для этих целей используется исследование генома вируса — секвенирование.
Вакцина против омикрона


Волна заражений новым штаммом коронавируса — омикроном— только набирает обороты в РФ, поэтому убедительных данных об эффективности вакцин против заражения пока нет. Однако резкий подъем кривой заболеваемости не сопровождается параллельным ростом госпитализаций и смертей. В то же время необходимо помнить, что в больницу пациенты с коронавирусом попадают в среднем спустя 10–15 дней после заражения, поэтому расслабляться пока явно преждевременно, особенно тем, кто до сих пор не привился.
Помимо исключительно высокой заразности, у штамма омикрон есть ряд особенностей, о которых уже известно. Это короткий инкубационный период (1–3 дня) и склонность в большей степени поражать верхние дыхательные пути, чем ткань легких, что, конечно, гораздо безопаснее для здоровья и жизни человека.
Эффективность почти всех существующих в настоящее время вакцин против новых штаммов снижается со временем и уступает степени защиты от предыдущего штамма — дельты.
Для того чтобы помешать новому штамму уйти от защиты, на помощь приходит бустерная доза, или ревакцинация.
Опыт стран, уже прошедших взрывной рост заболеваемости новым штаммом, указывает на то, что все вакцины защищают от тяжелого течения заболевания и предотвращают необходимость госпитализации. Так, по некоторым данным, риск попасть в больницу для вакцинированных в пять раз меньше, чем у непривитых. Речь идет о тех, кто получил третью дозу вакцины (ревакцинацию/бустер). Причем эффективность против штамма омикрон возрастает на 37% уже через неделю после третьей дозы.
Напомню, что Минздрав рекомендует пройти ревакцинацию через шесть месяцев без анализа титров антител.
Лечение омикрона
Методы терапии нового штамма коронавирусной инфекции не отличаются от лечения других мутаций. Новых протоколов диагностики и лечения пациентов с COVID-19, утвержденных Минздравом РФ, на дату публикации материала не выпускалось.
Существующие схемы лечения коронавируса, которые включают в себя глюкокортикостероиды и блокаторы рецепторов к интерлейкину-6, эффективны и против омикрона, считает ВОЗ [12]. Глюкокортикостероиды — это гормоны для лечения COVID-19, их использование Организация одобрила в сентябре 2020 года. Блокаторы рецепторов к интерлейкину-6 — вторая рекомендованная группа лекарственных препаратов: они улучшают состояние пациентов в тяжелом и критическом состоянии.
Юлия Ткаченко: Специфического лечения против нового штамма на данный момент не существует. Все терапевтические стратегии, применимые к предшественникам нового штамма, используются и при омикроне. Актуальной остается и вакцинация, вопреки расхожему мнению о том, что вакцина против омикрона неэффективна. Уже существуют исследования, которые показывают, что эффективность вакцин достаточно высока для того, чтобы защитить человека от тяжелого течения заболевания.
Важно понимать, что вирус не лечится антибиотиками, так как они являются антибактериальными, а не противовирусными препаратами и назначаются только при осложнениях COVID-пневмонии. Использование гормональных препаратов оправдано только при среднетяжелом течении болезни в условиях стационара, а кроверазжижающие препараты без контроля врача могут вызвать неконтролируемое кровотечение.
В случае лечения пациента на дому необходимо тщательно придерживаться назначений врача, не используя самостоятельно назначенных себе препаратов, с симптоматическими целями самостоятельно можно использовать стандартное лечение ОРВИ: обильное питье, постельный режим, жаропонижающие при температуре выше 38,5 °С.

Весь мир говорит о новом омикрон-штамме и его необычайно высокой заразности. Специалист по молекулярной биологии Константин Северинов рассказывает, что ученые знают об этом варианте коронавируса на данный момент
Откуда взялся омикрон-штамм?
Вторая гипотеза связана с большим биоразнообразием Африки: за счет последовательного заражения человека, потом какого-то животного, опять человека и так далее вирус набрал необходимые мутации и стал очень заразным.

Возможно, это означает, что вирус способен к более быстрому заражению людей, но приводит к менее тяжелому течению заболевания.
Согласно некоторым данным, полученным в лабораториях, есть вероятность того, что этот штамм не способен глубоко проникать в легкие. Но именно по этой причине, раз возбудители находятся на поверхности, в носоглотке, мы чаще его выдыхаем и заражаем большее количество людей.
Работает ли иммунитет у вакцинированных и переболевших?
Также важно учитывать условия заражения. Вирус — это крохотная частица, она переходит по воздуху, который мы выдыхаем при общении, и само заражение происходит после того, как мы эту крохотную частицу вдыхаем от человека рядом. Конечно, вирусу труднее будет заразить человека, у которого уже есть иммунитет. Но даже человек с иммунитетом, находясь рядом с переносчиком вируса в непроветриваемом помещении в течение долгого времени, получает слишком большую дозу вируса и может заболеть.
Почему это происходит? Всякий раз, когда мы задаемся этим вопросом, полезно представлять себе, что вы и есть вирус, которому очень хочется жить. Понятно, что вирус не обладает желаниями, это физико-химический объект, но чтобы существовать, ему необходимо оставить потомство, а значит — заразить кого-то из нас. Таким образом, если уже существует значительная иммунная прослойка, вирус будет заражать детей просто потому, что заражать больше некого.
Остались ли другие штаммы?
Многих волнует, что штаммов стало слишком много: греческий алфавит скоро закончится, но победили ли мы предыдущие варианты коронавируса?
Поэтому длительное сосуществование разных штаммов коронавируса просто невозможно.
Как часто нужно будет ревакцинироваться?
Возможна ли вакцина от всех штаммов?
Второй вариант — это продолжать работать с S-белком. Белок — это огромная молекулярная структура, состоящая из более чем тысячи аминокислотных остатков. И у всех вариантов коронавируса меняется буквально 10–15 этих остатков. Возможно, нужно создать вакцину, которая будет выборочно работать по постоянным участкам, в частности, S-белка и, может быть, других поверхностных структур.



В геноме человека 21 тысяча генов — примерно столько же, как у круглого червя Caernorhabditis elegans (20,5 тысячи генов), и значительно меньше, чем у " водяной блохи " дафнии Daphnia (31 тысяча генов). Но, в отличие от homo sapiens , ни один из представителей животного мира не умеет разговаривать и сложно мыслить.
Уникальные способности человека определяются в том числе его микробиотой — совокупностью микроорганизмов, населяющих все ткани тела, отмечает в книге " 10% Human. Как микробы управляют людьми " биолог Аланна Коллен. Полтора килограмма бактерий, вирусов, грибов и архей добавляют homo sapiens около четырех с половиной миллионов генов, и они, вместе с собственными генами человека, управляют его сложным организмом.
Вдесятером н а о дного

Ученые пока не пришли к единому мнению, сколько микробов обитает в человеке. Когда в 2012 году были представлены первые результаты международного проекта "Микробиом человека" (Human Microbiome Project), говорили о ста триллионах микроорганизмов и более десяти тысячах видов. Но уточняли, что "микробное население" может отличаться от человека к человеку. И ногда микроорганизмов столько же, сколько собственных клеток, а бывает, и до десяти микробов на одну клетку .
Сегодня склоняются к более осторожным оценкам: в человеке живет от 30 до 40 триллионов микроорганизмов, причем преобладают бактерии (около 90 процентов). Плюс дрожжевые грибы, вирусы и археи.
Единого набора микробов не существует. Лишь очень немногочисленные штаммы бактерий встречаются у всех людей. Микробиота каждого человека так же уникальна, как отпечатки пальцев, и меняется в течение жизни.
Микробный мегаполис
Одно из самых густонаселенных мест тела — кишечник. В нем обитает около тысячи видов микроорганизмов. Они расщепляют молекулы пищевых волокон, инактивируют ферменты и токсины, помогают синтезу витаминов в организме. Установлено также, что кишечные бактерии могут влиять на центральную нервную систему, способствовать развитию тревожных расстройств, депрессии, аутизма, укреплять иммунитет.
Среди обитателей кишечника преобладают бактерии двух видов: Firmicutes и Bacteroidetes. Именно от их баланса зависит вес человека. При ожирении первый вид стремительно размножается (например, Clostridium coccoides), а второй (Bacteroides, Prevotella) сокращается. Ученые утверждают, что, зная только состав микробиоты, можно определить, страдает ли человек ожирением.
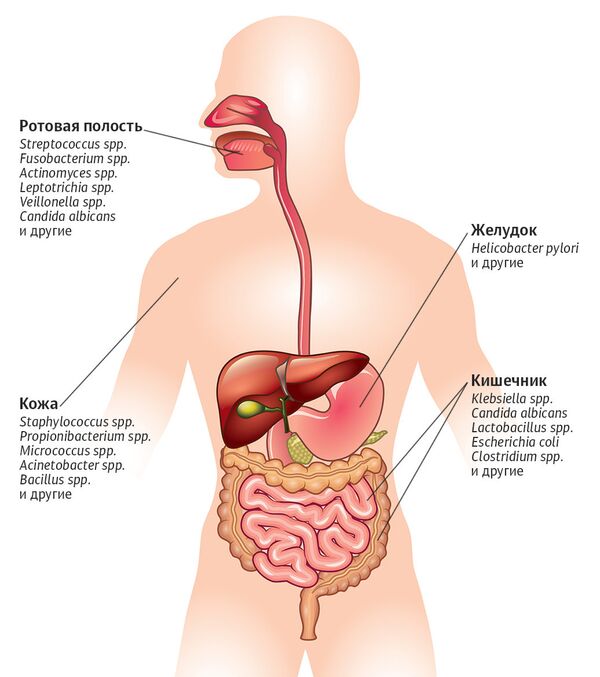
А вот к желудку микроорганизмы относятся с опаской. Его чрезвычайно кислая среда по зубам немногим. Одна из них — бактерия Helicobacter pylori. Именно она виновата в язве желудка и двенадцатиперстной кишки, гастрите и даже раке желудка.
Впрочем, у 80 процентов носителей Helicobacter pylori нет никаких желудочных заболеваний. Те же, у кого этой бактерии в организме нет, попадают в группу риска. Ученые выявили связь между исчезновением из желудочно-кишечного тракта Helicobacter pylori и развитием астмы.
Одна микробиота на двоих
Примерно 800 видов микроорганизмов прижилось во рту человека. Самые многочисленные там — стрептококки. Хотя у этих микробов дурная слава (вызывают кариес, серьезные воспаления горла — от острого фарингита до некротического фасциита), некоторые из них приносят пользу, прогоняя враждебные патогенные бактерии и вирусы.
Другие микробы, выделяя оксид азота и тем самым расслабляя артерии, помогают регулировать кровяное давление. Но они же, как выяснилось, вызывают мигрень. А вот если бактерии Klebsiella pneumoniae попадут изо рта в кишечник, гарантирован язвенный колит или болезнь Крона.
Сообщество микроорганизмов во рту самое непостоянное. Его состав способен меняться несколько раз в сутки. Но все же микробиота полости рта пересекается у разных индивидуумов на 40–50 процентов. И чем дольше люди живут вместе (например, в браке), тем более похожи микробные сообщества у них во рту.
Дополнительная микробная кожа
Микроорганизмы, обитающие на человеческой коже, — это дополнительный санитарный кордон для внутренних органов. Большинство — комменсалы, защищающие от патогенов. Однако они могут вызывать кожные заболевания — от угревой сыпи до перхоти — и ответственны за неприятный запах пота.
Расселение микроорганизмов на коже зависит от условий проживания. Так, пропионовокислые бактерии (Propionibacterium), питающиеся жиром сальных желез, выбирают кожу лица и спины. Коринебактерии (Corynebacterium) и стафилококки (Staphylococcus), любящие повышенную влажность и питающиеся азотистыми соединениями из потовой жидкости, предпочитают пупок, подмышки и подколенную ямку.
Кожные квартиранты — самые пестрые и разнообразные. Даже у одного человека микробы на правой руке значительно отличаются от обитателей левой. Состав же кожных микроорганизмов у разных людей отличается в среднем на 85 процентов и уникален для каждого из нас.
Кстати, именно на эту особенность обратили внимание биологи из Чикагского университета (США), предложившие искать преступников по отпечатку микробиоты. В рамках исследования инсценировали взломы десяти домов. Ученые по составу микроорганизмов, оставленных "преступниками", вычисляли их с точностью 70 процентов.

ТАСС, 28 апреля. Биологи выяснили, с чьей помощью некоторые вирусы-бактериофаги блокируют систему BREX, которая защищает микробов от их атак. Об этом пишет пресс-служба Сколковского института науки и технологий со ссылкой на статью в научном журнале Nucleic Acid Research.
Возбудителя туберкулеза обучили душить себя по команде. Ученые нашли уязвимость в биохимии палочки Коха, которую можно использовать против самого патогена. Следующий шаг — придумать лекарство на этом механизме

"Пять лет назад мы знали, что бактерии могут защищаться от вирусов с помощью RM-систем, CRISPR-системы и токсин-антитоксиновых систем. В последние годы с помощью методов биоинформатики было предсказано, что они – лишь малая часть огромного многообразия защитных механизмов. BREX стала первой среди новых предсказанных систем, защитное действие которой было показано в экспериментах", – прокомментировал один из авторов работы, аспирант Сколковского института науки и технологий Артем Исаев.
От болезней и инфекций страдают не только люди и другие многоклеточные, но и одноклеточные микробы. Вирусы, как предполагают ученые, появились почти одновременно с бактериями, и между ними уже несколько сотен миллионов лет идет беспрерывная война на выживание.
Ее последствия можно увидеть фактически везде. К примеру, в каждом миллилитре речной или морской воды живут несколько сот миллионов бактериофагов – вирусов, которые специализируются на заражении микробов. Их носителями могут быть до 70% ныне живущих бактерий.
За миллионы лет эволюции вирусы постепенно научились обходить защитные системы микробов. К примеру, бактерии разработали своеобразный генетический "антивирус", систему CRISPR-Cas9, которая находит следы вирусной ДНК в геноме микроба, вырезает ее или заставляет бактерию самоуничтожиться для того, чтобы защитить своих соседей от инфекции. Бактериофаги, в свою очередь, научились подавлять работу CRISPR-Cas9, что открыло новый виток этой биологической "гонки вооружений".
Борьба вирусов и антивирусов
Исаев и его коллеги изучали работу еще одной системы подобного рода – BREX, которая, по текущим оценкам ученых, есть в геноме примерно каждого десятого микроба на Земле. Ученые пока не знают, как именно она работает, однако они предполагают, что та похожа на другой "антивирус" – систему RM, которая распознает чужеродную ДНК по отсутствию определенных меток на одной или двух ее спиралях.

Руководствуясь этой идеей, Исаев и его коллеги предположили, что некоторые вирусные белки, которые задействованы в нейтрализации RM-системы, могут играть важную роль в подавлении BREX внутри вирусов, на которые этот бактериальный "антивирус" не действует. Ученые проверили, так ли это на самом деле, удалив из генома хорошо изученного бактериофага T7 один из генов, которые отвечает за синтез белка Ocr. Этот белок – один из главных компонентов системы защиты вируса от бактериального "антивируса".
Эти опыты подтвердили, что подобное изменение "обезоружило" вирус, не дав ему подавлять работу как RM-системы, так и BREX. Как предполагают ученые, это связано с тем, что обе эти формы бактериального "антивируса" для того, чтобы наносить специальные метки на ДНК самого микроба, которые позволяют отличить ее от чужеродных фрагментов генетического кода, используют фермент BrxX. Работу этого фермента блокирует Ocr.
Почему нейтрализация BrxX не приводит к самоуничтожению бактерий, ученым еще предстоит выяснить.
"История борьбы бактерий с фагами насчитывает миллиарды лет. Эта непрекращающаяся "гонка вооружений" является одной из основных движущих сил эволюции в мире микроорганизмов. Обе стороны накопили богатый арсенал стратегий борьбы друг с другом. Лично мне интересно узнать, какие еще тайны хранит в себе геном и какие новые механизмы мы сможем открыть, изучить и применить в будущем", – подытожил Исаев.
Читайте также:

