Этиология опухолей онкогенные вирусы
Обновлено: 17.04.2024
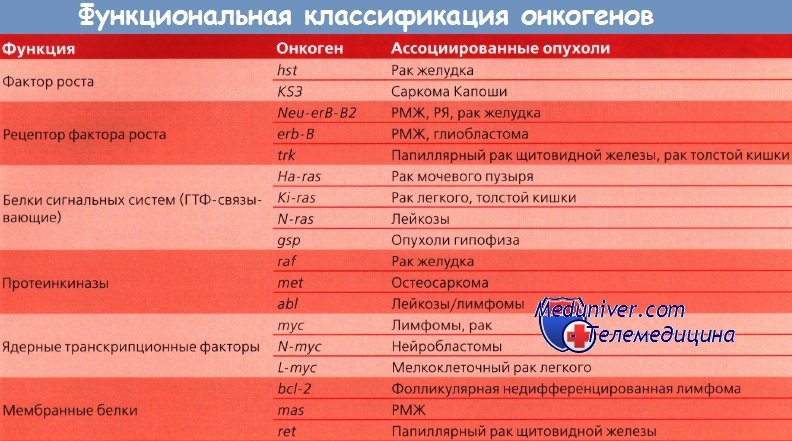
Онкогены и их функциональная классификация
За последние 25 лет произошел существенный прогресс в нашем понимании молекулярных механизмов развития злокачественных опухолей. Идентифицировано три типа генов, нарушения в которых приводят к раку: доминантные трансформирующие, или онкогены; рецессивные трансформирующие, или опухолевые супрессоры; гены, ответственные за репарацию ДНК. Многие онкогены были впервые выделены как формы протоонкогенов онкогенных РНК-содержащих вирусов.
На протяжении многих лет известно, что вирусы способны вызывать злокачественные опухоли у животных. Это наблюдение послужило стимулом к обширным исследованиям, направленным на выявление генов, которые вызывают рак и переносятся вирусами, и генов человека, повреждающихся при развитии злокачественных опухолей. В итоге обнаружили удивительный факт, что гены, вовлеченные в канцерогенез, часто представляют собой измененные формы вирусных генов.
Другие протоонкогены кодируют внутриклеточные белки, ответственные за усиление митогенного сигнала; третьи — кодируют белки, вовлеченные в контроль клеточного деления и находящиеся под контролем ядра. Такие онкогены могут быть активированы посредством нескольких механизмов: возможна амплификация гена и активация его копий; в редких случаях наблюдается траислокация гена на другую хромосому, где он попадает под контроль чужого промотора и стимулирует неконтролируемый рост. Три группы онкогенов находятся под разным контролем.
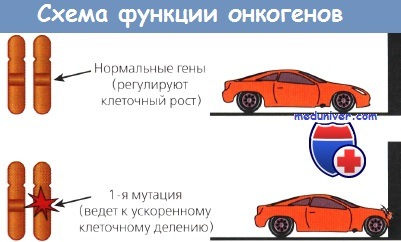
Первая группа включает пептидные факторы роста и их рецепторы, как, например, эпидермальный или тромбоцитарный.
Эти пептиды служат скорее костимуляторами опухолевого роста, чем факторами, непосредственно инициирующими опухолевую трансформацию. По мере расшифровки механизмов, стимулирующих опухолевую прогрессию, все более реальной становится молекулярно-нацеленная (таргетная) терапия, направленная непосредственно против продуктов этих генов или против белков, активируемых ростовыми факторами. Так разработаны препараты:
1) трастузумаб (Герцептин) — моноклональные антитела, блокирующие Her-2/neu;
2) иматиниба мезилат (Гливек) — препарат, частично блокирующий активность c-kit, BCR-ABL и некоторых других тирозинкиназ;
3) цетуксимаб (Эрбитукс) — моноклональные антитела, связывающиеся с рецептором эпидермального фактора роста;
4) гефитиниб (Пресса) — низкомолекулярный ингибитор некоторых изоформ рецептора эпидермалыюго фактора роста.

Другой класс онкогенов происходит из немембранных внеядерных факторов роста, передающих каскадные сигналы внутри клетки. К ним относятся G-белки и белки семейства ras. Наконец, некоторые онкогены кодируют ядерные регуляторные белки, например myc. Схематическое изображение функций онкогенов представлено на рисунке.
Открытие человеческих аналогов вирусных генов привело к формулировке многообещающей гипотезы, согласно которой злокачественные опухоли человека, включая большинство невирусной этиологии, могут возникать вследствие мутаций, превращающих полезные протоонкогены в опасные онкогены. В подтверждение этой гипотезы показано, что повреждение даже одного аллеля таких протоонкогенов достаточно для злокачественной трансформации некоторых клеток in vitro. Подобные доминантные мутации ведут к гиперэкспрессии нормального гена и, следовательно, гиперпродукции нормального белка или же к синтезу его аберрантной формы, обладающей повышенной активностью.
В любом случае результатом оказывается усиление стимулирующих сигналов внутри клетки, даже в отсутствие стимулирующих воздействий извне.
Парадоксально, но первым ключом к выявлению некоторых онкогенов стало исследование РНК-содержащих онкогенных вирусов животных, не вызывающих опухолей у человека. Эти ретровирусы, инфицирующие кур, грызунов, кошек и обезьян, оказались крайне высокоонкогенными: развитие опухоли часто наблюдали уже при первом контакте. У одного из вирусов этой группы, вируса саркомы кур Рауса, выявлен ген, ответственный за злокачественное перерождение инфицированных клеток. Этот тип трансформирующих онкогенов был назван вирусным онкогеном.
Единственный онкоген вируса саркомы Рауса, проникая в клетки кур, способен нарушать и перестраивать их метаболизм, направляя его по пути злокачественной трансформации.
В 1976 г. Varmus и Bishop показали, что онкоген вируса саркомы Рауса в действительности вовсе не есть вирусный ген, а происходит от предсуществовавшего клеточного гена, захваченного предком вируса саркомы Рауса. Однажды встроив его в свой геном, вирус далее использовал этот ген для трансформации клеток млекопитающих.
Более ранние предки вируса саркомы Рауса были способны реплицироваться в инфицированных клетках, но не могли трансформировать ее; туморогенный потенциал был приобретен после захвата нормального клеточного гена — протоонкогена. В связи с этим значение работы Varmus и Bishop гораздо больше, чем просто исследование вируса саркомы Рауса: показано существование гена в нормальном геноме клеток млекопитающих, обладающем трансформирующим потенциалом при соответствующей активации, в данном случае ретровирусом.
Информация, полученная при исследовании ретровирусов и онкогенов, существенно помогла в изучении причин злокачественных новообразований. Ретровирусы, так же как вирус саркомы Рауса, неинфекционны для человека и, соответственно, не могут активировать протоонкогены человека. Однако возможны альтернативные механизмы их активации. Эффекты, сходные с производимыми вирусом в последовательности ДНК, могут быть вызваны химическими или физическими воздействиями.
Это было подтверждено в начале 80-х годов прошлого столетия: в геноме опухолевых клеток были выявлены мутированные гены (протоонкогены). Во всех случаях причиной превращения протоонкогена в активный онкоген оказались изменения последовательности гена. Например, онкоген ras образуется из протоонкогена-предшественника в клетках рака мочевого пузыря человека вследствие замены одной пары нуклеотидных оснований; онкоген myc появляется во многих злокачественных новообразованиях в результате амплификации.
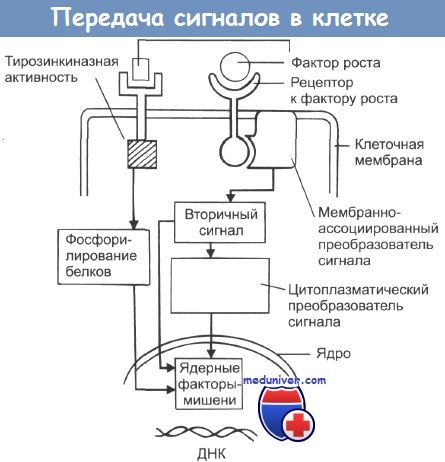
В последующем были изучены механизмы, посредством которых большинство, если не все онкогены вызывают трансформацию клеток. Это стало возможным благодаря определению путей, посредством которых клетки регулируют свой собственный рост. Рост иделение нормальной клетки вткани контролируется преимущественно ее окружением. В норме клетка редко или даже никогда не определяет скорости своего деления, а только реагирует на сигналы от окружающих клеток.
Эти сигналы, стимулирующие или подавляющие рост, передаются посредством ростовых факторов, выделяемых окружающими клетками. Ростовые факторы попадают в межклеточное пространство и связываются с рецепторами на поверхности клеток-мишеней. Клетки реагируют на сигналы ростовых факторов активацией механизмов синтеза клеточных структур, удвоением ДНК и делением. Нормальная клетка никогда не запускает программу роста, если она не получила внешнего сигнала. Каждая клетка обладает сложной системой, позволяющей ей получать ростовые сигналы, обрабатывать их и запускать программу деления. Эта система состоит из большого количества белков, ответственных за получение ростовых сигналов и передачу их в клетку. К этим белкам относятся:
1) рецепторы на клеточной поверхности, распознающие наличие во внеклеточном пространстве ростовых факторов и передающие сигнал во внутриклеточное пространство;
2) белки внутриклеточной сигнальной системы, которые активируются поверхностными рецепторами и затем передают сигнал дальше в клетку;
3) ядерные транскрипционные факторы, активирующиеся в ответ на сигнал, переданный белками внутриклеточной сигнальной системы, и, в свою очередь, активирующие широкий спектр клеточных генов.
Активирующиеся гены руководят программой роста клетки; именно эти гены определяют те события, которые вместе взятые приведут к делению клетки. Протоонкогены кодируют многие белки в этой сложной сигнальной системе, позволяющей нормальной клетке отвечать на экзогенные ростовые факторы. Белки онкогенов участвуют в сигнальной системе, отбирая ее неправильно функционирующие версии нормальных компонентов, и вызывают ее постоянную стимуляцию в отсутствие внешних ростовых сигналов. В результате клетка постоянно растет, даже если окружающая среда не содержит каких-либо факторов, в норме необходимых для клеточного роста.
Некоторые исследователи указывают, что в злокачественной клетке должны присутствовать как минимум две мутации в протоонкогенах, причем только строго определенные мутации могут вызывать злокачественную трансформацию. Это связано с тем, что отдельные онкогены, даже если они служат важными регуляторами клеточного метаболизма, сами по себе не способны индуцировать злокачественное новообразование. Данная точка зрения подтверждается выявлением в опухолевых клетках более 10 различных онкогенов. Однако при тщательном исследовании ожидаемые нарушения обнаруживают лишь примерно в 20 % опухолей.
Ни одна опухоль не несет ни одной пары сочетанных нарушений из выявляемых в культивируемых линиях злокачественных клеток. Предполагается также, что врожденные мутации, ответственные за предрасположенность людей к раку, не есть онкогены. Это объясняется существованием рецессивных антионкогенов, получивших название генов-супрессоров, тоже играющих крайне важную роль в развитии опухолей.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
Промотор репликации плазмидного вектора показан оранжевым. Короткие толстые зеленые стрелки представляют экзоны, кодирующие латентные белки: (EBNAs 1, 2, 3A, 3B and 3C, and EBNA‑LP, LMPs 1, 2A and 2B, BHRF1,BARF1). Короткие голубые стрелки сверху представляют наиболее транскрибириуемые полиаденилированные ВЭБ-кодируемые РНК (EBER1, EBER2). Средняя длинная зеленая линия представляет транскрипцию ВЭБ при 3-ем типе латентности, в которой белки EBNA транскрибированы с промотора Ср или Wp. Различные EBNA кодированы индивидуальными мРНК, которые сгенерированы различным сплайсингом одного и того же длинного первичного транскрипта. Внутренняя красная линия представляет транскрипт EBNA1, который берет начало от промотора Qp при 1 и 2 типе латентности.
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.

Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.

Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV

Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.

Иммунитет играет важную роль в исходе острых инфекций. Быстрый, сильный и мультиспецифичный ответ против многих белков вирусов гепатита В (HBV) и гепатита C (HCV) приводит к острой инфекции, устраняемой клеткой-хозяином.
Источники
Oncogenes and RNA splicing of human tumor viruses. Masahiko Ajiro & Zhi-Ming Zheng.(September 2014)
Carcinogenic human papillomavirus infection. Mark Schiffman, John Doorbar, Nicolas Wentzensen, Silvia de Sanjosé, Carole Fakhry, Bradley J. Monk, Margaret A. Stanley & Silvia Franceschi.( December 2016)
Human T-cell lymphotropic virus type 1 and its oncogenesis Lan-lan ZHANG, Jing-yun WEI, Long WANG, Shi-le HUANG, Ji-Long CHEN.(2017)
Immunoblastic Lymphoma in Persons with AIDS-Associated Kaposi's Sarcoma: a Role for Kaposi's Sarcoma–Associated Herpesvirus. Eric A Engels M.D., Stefania Pittaluga M.D., Denise Whitby Ph.D., Charles Rabkin M.D., Yoshiyasu Aoki M.D., Elaine S Jaffe M.D. & James J Goedert M.D.(may 2003)
Kaposi’s sarcoma-associated herpesvirus ORF34 is essential for late gene expression and virus production. Mayu Nishimura, Tadashi Watanabe, Syota Yagi, Takahiro Yamanaka & Masahiro Fujimuro( march 2017)
Саркома Капоши: патогенез и основы терапии Н.С. Потекаев, Г.А. Паньшин, Н.П. Теплюк, Н.С. Арсентьев, Е.Ю.,Вертиева,Г.И. Махов, Е.С. Сизова, В.С. Пауков, М.Г. Карташова. (март 2013)
Human T-Cell Lymphotropic Virus: A Model of NF-κB-Associated Tumorigenesis. Zhaoxia Qu and Gutian Xiao(June 2011)
Immune responses and immunopathology in acute and chronic viral hepatitis. Eui-Cheol Shin, Pil Soo Sung & Su-Hyung Park(July 2016)
Pathogenic mechanisms in HBV and HCV-associated hepatocellular carcinoma. Alla Arzumanyan, Helena M. G. P. V. Reis and Mark A. Feitelson(February 2013) Epstein–Barr virus: more than 50 years old and still providing surprises. Lawrence S. Young, Lee Fah Yap & Paul G. Murray( September 2016)
Медицинская микробиология, вирусология и иммунология. В.В. Зверев, А. С. Быков.
РНК-вирусы как причина развития рака - вирусный канцерогенез
Открытие вирусов, вызывающих злокачественные опухоли у животных, произошло еще на рубеже XIX и XX веков. В 1910 г. Пейтон Рауш обнаружил, что бесклеточный фильтрат из тканей птичьей саркомы может вызывать развитие аналогичной саркомы у цыплят. Примерно в это же время была доказана вирусная природа птичьего миелобластоза. Позднее было обнаружено, что часто проходит весьма значительный латентный период между инфицированием вирусом и развитием рака.
Тем не менее вплоть до 1960-х годов не существовало четких доказательств того, что инкорпорация вирусной ДНК в геном клетки является необходимым условием развития злокачественной трансформации, как не было и случаев выделения вирусной ДНК из раковых клеток.
РНК-содержащие вирусы вызывают развитие целого ряда различных опухолей у животных, при этом наиболее распространена индукция этими вирусами лимфом, лейкемий и сарком. Типичная структура таких вирусов - это две идентичные цепочки молекул РНК в сочетании с ферментом обратная транскриптаза, одетых в гликопротеиновую оболочку. При инфицировании вирусом его обратная транскриптаза заставляет клетки синтезировать ДНК, комплементарную вирусной РНК.
Эта ДНК затем встраивается в клеточные хромосомы, и на ее основе клетка уже сама начинает синтез новых вирусных белков, вирусных обратных транскриптаз и элементов гликопротеиновой оболочки. Из-за механизма их действия этот тип вирусов получил название ретровирусы. Все они имеют весьма схожий внешний вид на электронных микрофотографиях и являются самыми маленькими из известных вирусов.
Некоторые из ретровирусов (например, вирусы птичьего лейкоза, кошачьей и мышиной лейкемии) содержат в себе только три гена и обладают очень длительным инкубационным периодом с момента заражения до возникновения опухоли. Другие вирусы (например, вирус саркомы Рауса (ВСР)) вызывают очень быструю злокачественную трансформацию и могут быть выделены из культуры опухолевых клеток.
Показано, что вирус ВСР содержит особый ген (v-src), способный вызывать трансформацию фибробластов in vitro. Этот ген кодирует наработку протеинкиназы, которая фосфорилирует тирозин. К сожалению, действие этой протеинкиназы запускает целый каскад различных метаболических процессов, и очень сложно оценить, какой именно из них ведет к злокачественной трансформации.
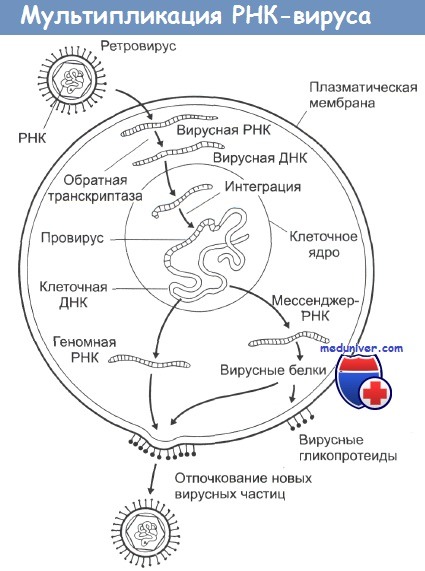
В настоящее время известно, что и нормальные, и злокачественные клетки содержат в своем генотипе участки ДНК, сходные или идентичные ряду последовательностей онкогенных РНК-содержащих вирусов. Такие участки получили название клеточных прото-онкогенов (чтобы отличать их от вирусных онкогенов). Постулируется, что активация этих участков, возникающая в результате канцерогенного воздействия, запускает целую цепочку событий, ведущую в итоге к злокачественной трансформации клетки. Считается также, что ретровирусы инкорпорировали эти клеточные участки в свой геном в процессе эволюции.
В настоящее время мы лучше понимаем механизмы действия продуктов вирусной активации. Примером такого продукта является протеинкиназа, активируемая геном sre, а также целый ряд других вирус-индуцированных канцерогенов. Это и рецепторы к эпидермальному фактору роста, продуцируемые геном v-erb, и тромбоцитарный фактор роста (ТФР), кодируемый фрагментами гена v-sis, и целый ряд связывающихся с ядром клетки белков, продукцию которых вызывает вирус птичьей лейкемии.
Как нормальные, так и раковые клетки содержат в себе участки последовательностей ДНК, гомологичные РНК онкогенных вирусов. Если происходит экспрессия или активация под действием канцерогенов этих клеточных онкогенов, это ведет к злокачественной трансформации клеток.
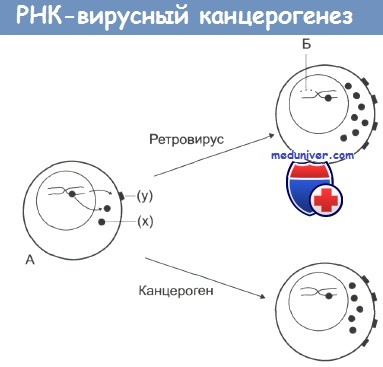
Онкогенная и злокачественная трансформация.
На стадии А нормальная клетка, которая характеризуется низкой протоонкогенной активностью, продуцирует фактор роста (х) или белки дифференцировки или рецепторы (у).
Канцерогены повышают активность протоонкогенов, что дает начало неопластической трансформации.
По другому механизму: при заражении ретровирусом происходит внедрение в ДНК клетки вирусных промоторов или онкогенов (Б), что также ведет к увеличению онкогенной активности и последующей злокачественной трансформации.
Первым ретровирусом, для которого была однозначно доказана связь со злокачественными новообразованиями, был вирус Т-клеточной лейкемии человека (ВТКЛ-1), выделенный из клеток хронической кожной Т-лимфомы. Этот вирус довольно широко распространен, может передаваться половым путем, через кровь, особенно в среде наркоманов, и от беременной женщины к плоду. Первоначально эндемический ареал циркуляции данного вируса был в основном представлен тропическими странами, однако в настоящее время в США серопозитивная реакция на вирус обнаруживается у каждого из 4000 человек населения. Кроме Т-клеточной лейкемии вирус вызывает тропический спастический паралич.
После 20 лет наблюдения за серопозитивными пациентами оценено, что риск развития последнего заболевания составляет около 5%. Один из вирусных генов, а именно tax-ген, вызывает увеличение продукции клеточного интерлейкина-2 (ИЛ-2) и его рецепторов, что является основным фактором, стимулирующим деление Т-клеток.
Ретровирусы могут вызывать опухолевые заболевания не напрямую, а опосредованно, как это было показано для вируса иммунодефицита человека (ВИЧ-1), вызывающего развитие СПИДа. Случаи развития рака у ВИЧ-инфицированных рассмотрены в одном из обзоров. Отмечается, что у ВИЧ-инфицированных наиболее часто развиваются три типа опухолей: мгновенная или высокозлокачественная В-клеточная лимфома; саркома Капоши (СК, которую вызывает другой вирус — герпесвирус ГСК, или герпесвирус 8); карцинома шейки матки.
До разработки эффективных методов терапии ВИЧ-инфицированных более 40% из них заболевали тем или иным видом рака. Тем не менее связь этого вируса с развитием онкологических заболеваний скорее всего косвенная и опосредована развитием общей хронической иммунодепрессии организма, которая и позволяет другим канцерогенным вирусам вызывать рак. В-клеточные лимфомы также характеризуются довольно сложным патогенезом. Хотя В-клетки не поражаются вирусом ВИЧ-1, они могут быть мишенью для других типов вирусов, например для вируса Эпштейна-Барра (ВЭБ). Рак шейки матки у женщин также развивается на основе вторичной вирусной инфекции — вируса папилломы человека (ВПЧ), на фоне общей иммунодепрессии, вызванной ВИЧ-1. По причине общего снижения иммунных реакций организма все эти опухоли развиваются особенно быстро и агрессивно.
Показано, что РНК-содержащий вирус гепатита С значительно увеличивает риск заболевания гепатоклеточной карциномой. У больных, инфицированных этим вирусом, риск развития раковой опухоли возрастает в 100 раз, но механизмы его канцерогенного действия в настоящее время почти не изучены. Если больной заражен еще и вирусом гепатита В, риск развития рака печени возрастает многократно. На земном шаре одним или обоими из этих вирусов заражено около миллиарда человек.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ДНК-вирусы как причина развития рака - вирусный канцерогенез
В канцерогенезе также могут участвовать ДНК-содержащие вирусы. Наиболее крупные ДНК-содержащие вирусы принадлежат к группе герпесвирусов. Первым вирусом, выделенным из культуры опухолевых клеток, был вирус Эпштейна-Баррра (ЭБВ).
Вирус был получен из культуры опухолевых клеток больных лимфомой Беркита. В культуре in vitro ЭБВ вызывает бесконечную пролиферацию человеческих В-лимфоцитов. Вирусные гены, встраиваясь в геном этих клеток, инициируют пролиферацию путем активации клеточных генов-регуляторов роста (онкогенов).
В крови больных лимфомой Беркита обнаруживается более высокий, чем у здоровых людей, титр антител к антигенам вирусной оболочки и к мембранным антигенам. В то же время в африканских странах среди множества детей, инфицированных этим вирусом, лимфома развивается только в единичных случаях.
Механизм онкогенеза этого заболевания не может быть объяснен только вирусным заражением. К тому же, за пределами африканского континента регистрируются случаи заболевания лимфомой Беркита, абсолютно не связанные с инфицированием вирусом ЭБВ. По-видимому, ЭБВ также может принимать участие в патогенезе карциномы носоглотки, так как клетки этой опухоли экспрессируют вирусные антигены EBNA-1.
При исследованиях саркомы Капоши, развивающейся у больных СПИДом, в 1994 г. из ее клеток был выделен новый герпесвирус. Первоначально вирус получил название герпес-вируса саркомы Капоши (ГСК), впоследствии он был переименован в герпесвирус человека серотип 8 (ГВЧ 8). Вирус обнаруживается в веретеновидных клетках саркомы Капоши практически при всех случаях заболевания.
ГВЧ 8 был также найден в опухолевых клетках первичной эффузионной лимфомы и в клетках многоочаговой болезни Кастлемана. Данный вирус кодирует синтез циклина, который является промотором клеточного деления, чем и объясняется высокая пролиферативная активность инфицированных клеток.
Человеческие папилломавирусы (ПВЧ) вызывают кожные бородавки и ряд доброкачественных папиллом. Это весьма обширный класс вирусов, и некоторые его представители могут в той или иной степени участвовать в развитии злокачественных опухолей. Большинство вирусов вызывает лишь ограниченную пролиферацию клеток, но ряд серотипов может вызвать и развитие злокачественных новообразований.
Наибольшую опасность с точки зрения онкологии представляют серотипы 16, 18, 31 и 33. Более 90% опухолей карциномы шейки матки in situ обнаруживают в своих клетках генные последовательности вирусов ПВЧ. Эти вирусы также играют значительную роль в возникновении инвазивных и многоочаговых плоскоклеточных раков кожи, которые часто развиваются у больных после долгосрочных курсов иммуносупрессивной терапии.
Механизмы вирусного канцерогенеза в этом случае изучены недостаточно. В исследованиях доказано, что существует вероятность включения вирусной ДНК в клетки базального эпителия. Обычно в клеточную ДНК внедряются восемь ранних и два поздних гена. Ранние гены Е6 и Е7 вызывают пролиферацию клеток.
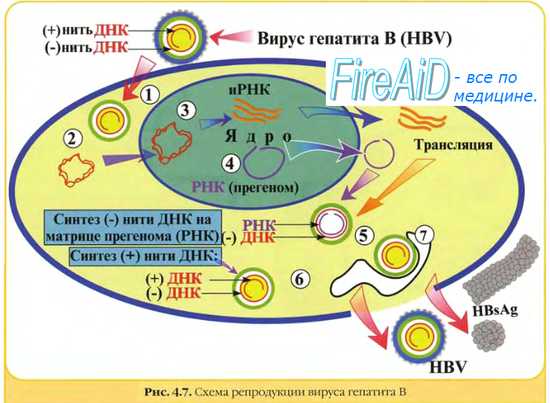
Вирус гепатита В четко связывают с развитием печеночно-клеточного рака. Риск развития этого заболевания у инфицированных вирусом в 200 раз превышает таковой у неинфицированных людей. Механизмы зарождения рака не до конца понятны: считается, что вирус вызывает бесконечную пролиферацию клеток, хотя зараженные вирусом клетки уничтожаются иммунной системой организма. Возможно, что пролиферирующие клетки становятся чувствительными к другим канцерогенам, например к афлатоксину.
Подытоживая вышесказанное, можно заключить, что основным механизмом канцерогенного воздействия является повреждение молекул ДНК и нарушения процессов ее репарации. Если не происходит исправления первичных повреждений ДНК, ошибки со временем начинают накапливаться, что ведет к дестабилизации структуры хромосом и к соматическим мутациям. Большинство таких мутаций летальны для клетки.
Однако, если часть клеток выживает, происходит постепенное накопление клеточной массы с опухолевым фенотипом, что в итоге приводит к клиническим проявлениям. Большой вклад в понимание этого процесса внесли современные исследования механизмов регулировки клеточного цикла и недавнее открытие регуляторных белков, которые запрещают клетке делиться, если ее геном сильно поврежден.
Для развития опухоли может быть недостаточно единичных мутаций в генах-регуляторах деления, но накопление массы ошибок в регуляторных генах может привести к фатальным последствиям. Особенно критичны мутации в генах, регулирующих клеточное деление, так называемых онкогенах. Очень опасны также мутационная инактивация генов, подавляющих клеточное деление — генов-подавителей опухоли, и мутации в генах, кодирующих белки, запрещающие деление при повреждении клеточного генотипа.
Накопление числа жизнеспособных мутаций по одному или нескольким из этих генов приводит к общей клеточной дезорганизации и к потере контроля над клеточным делением. В следующем разделе мы рассмотрим механизмы действия онкогенов и наиболее важные моменты контроля над клеточным циклом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Изучение этиологии онкологических заболеваний длится уже много десятилетий. В результате этих исследований были обнаружены онкогенные вирусы. Их роль в возникновении онкологических заболеваний была продемонстрирована на многих моделях: саркоме Рауса у кур, папилломе и раке кожи у кроликов, лимфоме у цыплят. Однако еще в прежние времена у всех исследователей возникал вопрос: куда исчезает вирус после злокачественного перерождения клетки?. Ни один метод не мог его обнаружить в раковой клетке.
Противоречие удалось объяснить русскому ученому Л.А. Зильберу - создателю вирусно-генетической теории происхождения злокачественных опухолей.
Для трансформации нормальной клетки в опухолевую необходимо взаимодействие генома вируса и клетки, в результате которого образуется новый комплексный геном и вирус "исчезает" из клетки, оставаясь в ее ядре в виде провируса. Было выявлено, что процесс злокачественного перерождения зависит как от вируса, так и от клетки-хозяина.
Благодаря развитию молекулярной биологии установлено, что в нормальных клетках существует семейство генов- протоонкогенов. Эти гены необходимы для регуляции и размножения клеток. Их продуктами являются различные протеокиназы и факторы транскрипции. Различные внешние факторы могут воздействовать на протоонкоген клетки и вызывать его превращение в онкоген. Под их влиянием включается генетический механизм перерождения нормальной клетки в злокачественную.
Одним из факторов генетического воздействия на геном клетки могут быть вирусы, которые могут содержать (onc+) или не содержать онкоген (onc-). Вирус onc+, интегрируясь в хромосому клетки, одновременно вносит в нее онкоген со всеми вытекающими последствиями для клетки. Онкоген вируса, соединившись с хромосомой клетки, наделяет ее способностью к безграничному размножению.
Вирус onc-, проникнув в клетку на первом этапе взаимодействия генома с геном клетки-хозяина, не вызывает ее трансформации. Однако развитие событий зависит от локализации этого контакта. Если вирус onc- интегрируется в хромосому рядом с одним из протоонкогенов, он подчиняет его работу своему промотору. Выходя из хромосомы, вирусный геном захватывает с собой протоонкоген, который становится его составной частью и превращает вирус onc- в вирус onc+. Клеточный онкоген выходит из-под контроля материнской клетки. Интегрируясь в хромосому другой клетки, вновь образованный вирус onc+ одновременно вносит в нее онкоген и активирует трансформацию клетки в злокачественную.
В дальнейшем оказалось, что онкогенез вирусов зависит от реакции клетки. Гены p53 и Rb кодируют опухоль-супрессирующие белки. Ген р53 является супрессором опухолевого роста. В результате его деятельности происходить ограничение размножения клеток. Rb- ген кодирует белок, контролирующий клеточную пролиферацию. В результате его деятельности замедляется клеточная пролиферация.
Против вирусно-генетической теории может свидетельствовать наличие онкогенных свойств не только у ДНК-содержащих, но и у РНК-содержащих вирусов, что исключает включение РНК-генома вируса в ДНК-геном клетки хозяина. Однако это противоречие было устранено после открытия РНК-зависимой ДНК-полимеразы, которая на базе вирионных РНК синтезирует ДНК-копию, способную к интеграции с ДНК-геномом клетки. Механизм онкогенеза реализуется в результате активации протоонкогена включением в геном клетки ДНК- провируса. Роль вируса в злокачественном перерождении клеток сводится к пусковому механизму онкогенеза.
Читайте также:

