Фаги применяют для лечения и профилактики вирусных заболеваний
Обновлено: 22.04.2024
Первые клинические эксперименты с бактериофагами начались сто лет назад, и казалось, что этот новый метод терапии обречен на успех: с научной точки зрения он выглядел безупречным, и результаты применения выглядели многообещающими.
Почему же в последующие десятилетия интерес к терапевтическому применению бактериофагов в мире упал? Почему он возник вновь, и почему эта замечательная идея до сих пор не реализована в полной мере? И практические врачи, и их пациенты сегодня должны четко представлять не только суть, но и все сильные и слабые стороны этого перспективного вида терапии
Бактериофаги – это не обычные лекарства. Они не являются простыми химическими веществами, как антибиотики и большинство других препаратов, но их вряд ли можно считать и полноценными живыми организмами, так как они, как и все остальные вирусы, могут размножаться только в клетке-хозяине. По сути, это нанороботы с генетической программой, способные проникнуть внутрь бактериальной клетки и там размножиться, разрушив ее.
Поэтому к бактериофагам не всегда применимы стандартные для фармакологии нормы и подходы. И хотя фаговые препараты сегодня производятся и используются в медицине, наши знания о многообразии этих вирусов, механизмах их взаимодействия с бактериями и конкуренции с себе подобными пока недостаточны, чтобы в полной мере использовать их мощный терапевтический потенциал.
Безопасно и эффективно
Фаготерапия родилась едва ли не сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
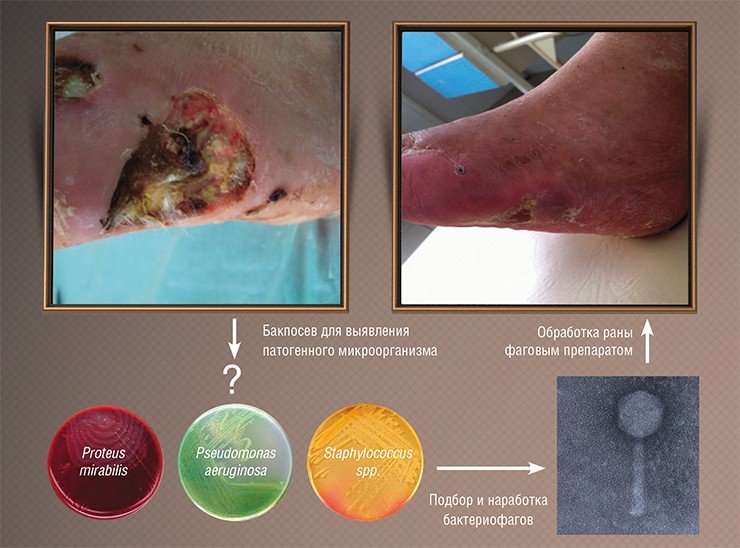
К сожалению, результаты подобных исследований, проводившихся в СССР, не были должным образом документированы и описаны в научной литературе, к тому же они проводились по схемам, не соответствующим принятым на сегодня протоколам клинических испытаний. Тем не менее главные результаты этой работы были бесспорны: фаги доказали свою безопасность и высокую эффективность в реальных условиях и с тех пор используются в нашей стране в клинической практике наряду с обычными лекарственными средствами.

Знакомьтесь – фекотрансплантация
С появлением антибиотиков интерес к фагам на Западе был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и проводить испытания, которые, по сути, повторяли исследования, уже проведенные в СССР. Результаты этих работ вновь подтвердили безопасность препаратов бактериофагов, что, в частности, отметило и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA).
В Великобритании успешно проведены эксперименты по лечению бактериофагами хронического отита, вызванного нечувствительной к антибиотикам синегнойной палочкой Pseudomonas aeruginosa, а в рамках проекта Phagoburn семь медицинских центров Франции, Бельгии и Швейцарии проводят клинические испытания коктейля фагов для предотвращения инфекций при ожогах. Об испытаниях собственных оригинальных коктейлей фагов для лечения широкого спектра заболеваний сообщает и ряд американских фирм (Intralytix, Enbiotix, AmpliPhi). Правда ни одно из этих масштабных клинических испытаний пока не доведено до конца.
В России препараты бактериофагов можно приобрести в обычной аптеке. Но при этом нужно понимать, что в отличие от других лекарств с точной химической формулой и концентрацией действующих компонентов препарат бактериофага представляет собой нестандартный раствор, содержащий живые вирусные частицы. Даже препарат с одним и тем же названием, но произведенный на разных предприятиях или в разное время, может содержать отличающиеся комбинации и (или) пропорции фагов.
Поэтому покупать препарат бактериофага, чтобы лечиться самостоятельно, не стоит. Назначить лечение и выбрать лекарство должен специалист. Спектр заболеваний, которые можно лечить бактериофагами широк: трофические язвы, ожоговые и раневые инфекции, инфекции органов дыхания, мочеполовой системы и желудочно-кишечного тракта, остеомиелит и т. п. Возбудителями болезней во всех этих случаях служат такие печально известные бактерии, как золотистый стафилококк, включая лекарственно устойчивые штаммы, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, протеи, стрептококки и др. В принципе в природе можно найти бактериофаг против любой бактерии, включая возбудителей чумы и сибирской язвы. Можно применять бактериофаги и для профилактики бактериальных инфекционных болезней, например, они были успешно использованы в детских садах и школах для предотвращения эпидемии дизентерии.

Основная же и главная причина неудач – неумелый подбор фагов для лечения конкретных пациентов. Каждый конкретный фаг эффективен против одного или максимум нескольких штаммов бактерий, а у разных пациентов схожая по внешнему проявлению инфекция, например, ангина может быть вызвана разными штаммами стрептококка. Чтобы вылечить больного, необходимо выделить культуру патогена и протестировать ее на чувствительность к конкретным фагам. То есть терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная медицина практически не готова.

На пути к персонализированной Фаготерапии
Опыт СССР, Грузии и Польши показал, что для успешного применения бактериофагов нужны не только клиника, но и производственно-лабораторный участок, располагающий коллекцией фагов и специалистами, способными идентифицировать бактерии, подбирать и выделять бактериофаги для конкретного пациента.
Но в таком случае имеет ли смысл масштабное производство фаговых препаратов? Ответ – да, потому что проблема узкой специфичности фагов частично решается производством фаговых коктейлей из нескольких (иногда десятков) разных фагов, поражающих разные штаммы целевого возбудителя. Ведь подобрать для больного нужный фаговый коктейль быстрее и проще, чем тестировать отдельные фаги из большой коллекции.
И все же не надо думать, что бактериофаги полностью заменят антибиотики – эти препараты дополняют друг друга, и применяться они должны в разных ситуациях. Когда больной находится в тяжелом состоянии, и есть уверенность, что причиной служит бактериальная инфекция, времени на эксперименты и подбор препаратов нет. Единственно правильное решение в этой ситуации – антибиотик широкого спектра действия.
Но в ситуации хронической инфекции или инфекции, вызванной бактериями со множественной устойчивостью к антибиотикам, предпочтение следует отдавать бактериофагу. В случае таких затяжных болезней, как отит, у врача есть время, чтобы использовать фаговый коктейль или специально подобрать фаг. Или же, когда после операции больной поражается антибиотикоустойчивым бактериальным штаммом, и его состояние быстро ухудшается, фаготерапия может стать единственным спасением.
Богатый опыт применения бактериофагов в клинической практике, накопленный за последние сто лет, свидетельствует о перспективности фаговых медицинских технологий. Дальнейшая работа специалистов из множества компаний, работающих сегодня в этой области, и применение методов синтетической биологии обязательно приведут к созданию препаратов с несравненно большей эффективностью по сравнению с современными фаговыми коктейлями.
Тем не менее, биотехнологи, также как ученые и медики, надеются, что безвредные и эффективные препараты все же займут свое законное место в арсенале терапии инфекционных заболеваний.
Алешкин А. В. Бактериофаги в инфекционной патологии: прошлое, настоящее и будущее // Лекции по исследованию и применению бактериофагов. 2016. Ульяновск. С. 11—51.
Козлова Ю. Н., Репин В.Е., Анищенко В.В., Власов В.В. и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки. // Патент РФ №2455355. 2012.
Козлова Ю. Н., Морозова В. В., Тикунова Н. В. и др. Штамм бактериофага Staphylococcus aureus SA20, обеспечивающий разрушение биопленок, образуемых бактериями рода Staphylococcus // Патент РФ № 2565824. 2015.
Морозова В. В., Козлова Ю. Н., Тикунова Н. В. и др. Штамм бактериофага Citrobacter freundii CF17, способный лизировать патогенные штаммы Citrobacter freundii // Патент РФ № 2565559. 2015.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Аcta Naturae. 2009. № 3. С. 6—15.
Тикунова Н. В. и Власов В. В. Бактериофаги – враги наших врагов // Наука из первых рук. 2013. № 2(50). С. 58—69.
Покровская М. П. Каганова Л. С., Морозенко М. А. и др. Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с
Górski A. et al. Phages targeting infected tissues: novel approach to phage therapy. // Future Microbiol. 2015. V. 10. P. 199—204.
Międzybrodzki R. et al. Clinical aspects of phage therapy // Adv. Virus. Res. 2012. V. 83. P. 73—121.
В публикации использованы иллюстрации из книги Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с.
Бактериофаги — современные антимикробные препараты природного происхождения. Это микроорганизмы, способные точечно уничтожать только болезнетворные бактерии. Бактериофаги используются в профилактике и антибактериальной терапии заболеваний, возбудителями которых являются патогенные бактерии.

- Присутствуют повсюду в нашем мире — в океане, почве, глубоководных источниках, питьевой воде и пище.
- Самая распространённая форма жизни на Земле; в биосфере содержится от 10 30 до 10 32 фаговых частиц.
- Старейшие из известных микроорганизмов — их возраст оценивают примерно в 3 миллиарда лет.
- Играют ключевую роль в поддержании баланса всех исследованных человеком экосистем.
- Контролируют количество микробной флоры и сдерживают её патологический рост.

- История применения бактериофагов насчитывает более 100 лет. Мировое врачебное и научное сообщество активно исследует фаги в качестве антимикробных агентов.
- Биотехнологи научились создавать медицинские антибактериальные препараты на основе бактериофагов и применять их для лечения пациентов.
- Современная медицина позволяет использовать бактериофаговую терапию против большинства бактериальных инфекций.
12345678
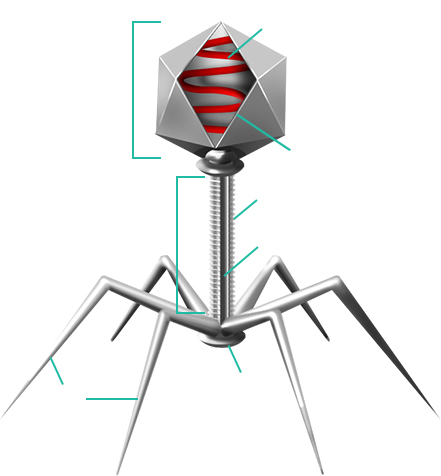
Бактериофаги имеют кубическую, нитевидную или форму головастика. Головка бактериофага содержит нуклеиновую кислоту (ДНК или РНК) , заключённую в белковую оболочку .
Ниже расположен хвостовой отросток , состоящий из внутреннего стержня и сократительного чехла .
Передвигается бактериофаг с помощью ножек-фибрилл , скреплённых в центре базальной пластиной . Размер бактериофага в сотни и тысячи раз меньше микробных клеток.
Факты о бактериофагах
Безопасны и нетоксичны, побочные эффекты редки, применяются у новорождённых детей, беременных и кормящих женщин
Бактериофаги совместимы со всеми лекарственными препаратами. Применение бактериофагов не ограничивает использование других лекарств и не влияет на их эффективность
Воздействует лишь на чувствительные к ним болезнетворные бактерии, вызывающие инфекционное заболевание, разрушая их изнутри
Как работают бактериофаги
Бактериофаги (от лат. phagos - пожирающий бактерии) — особые вирусы, которые способны размножаться только в присутствии определенного вида болезнетворных бактерий. Бактериофаги воспроизводят себе подобных только за счёт бактерий. Но человеку эта особенность только на руку: бактериофаг питается клетками вредных бактерий и полностью разрушает их.










Что лечат бактериофагами
Препараты бактериофагами применяются для лечения и профилактики инфекционных заболеваний в следующих областях: гастроэнтерология, урология, гинекология, хирургия, оториноларингология, пульмонология, инфекционные заболевания желудочно-кишечного тракта (ЖКТ), гнойно-воспалительные заболевания кожи и слизистых.
Абсцесс, панариций, парапроктит, остеомиелит, мастит, перитонит, фурункулы, ожоги, гнойные раны, профилактика внутрибольничных инфекций
ПРОИЗВОДСТВО БАКТЕРИОФАГОВ

На предприятии разрабатываются первый в мире мире универсальный бактериофаг против бактерий рода энтеробактер. Ведутся работы по созданию новых фаговых коктейлей, включая препарат, который действует на синегнойную палочку и бактерии рода ацинетобактер баумани.
Регистрационные удостоверения
Лекарственные препараты бактериофаги сертифицированы в соответствии с государственными стандартами Российской Федерации.
Мубаракшина О.А.
Воронежская государственная медицинская академия им. Н.Н. Бурденко, Воронеж
В статье рассмотрены основные аспекты применения лечебно-профилактических препаратов бактериофагов, особенности их использования в отоларингологической практике. Обоснована актуальность применения препаратов бактериофагов на современном этапе, в условиях роста антибиотикорезистентности бактерий. Произведено сравнение бактериофагов с препаратами антибиотиков. Представлены примерные схемы использования фаготерапии при хронических гнойных риносинуситах и других заболеваниях ЛОР-органов. Отмечена важность идентификации возбудителя и правильного выбора бактериофага для обеспечения эффективности терапии.
Острые гнойно-воспалительные заболевания ЛОР-органов – одна из самых частых причин обращаемости пациентов к врачам общей практики и отоларингологам. Уровень заболеваемости риносинуситами, тонзиллитами, отитами особенно возрастает в осенне-зимний период и тесно связан с повышением частоты острых респираторных вирусных инфекций у детей и взрослых.
Заболевания ЛОР-органов вирусной этиологии нередко сопровождаются активизацией условно-патогенной микрофлоры или колонизацией респираторного тракта патогенными бактериями. Это приводит к развитию гнойных заболеваний верхних дыхательных путей.
Причем воспалительные явления бактериальной природы могут быть осложнением вирусной инфекции, но иногда сопровождают ее с самого начала. Так, у детей этиологическая значимость вирусно-бактериальных ассоциаций отмечается при 25–30 % острых заболеваний респираторного тракта [1].
Особенно значительно в последние годы растет частота встречаемости хронических гнойных риносинуситов. Предполагаемой причиной этого являются изменения в характере иммунного ответа на местном и системном уровнях [2].
Для адекватного лечения и предупреждения перехода гнойно-воспалительных заболеваний ЛОР-органов в хроническую форму необходимы идентификация возбудителя и своевременное использование эффективных этиотропных препаратов с антибактериальной активностью.
Многие десятилетия для этой цели с успехом использовались антибиотики и синтетические химиотерапевтические препараты с антимикробным действием. Однако на сегодняшний день все актуальнее становится проблема антибиотикорезистентности [3].
Новые штаммы бактерий образуются намного быстрее, чем создаются новые антибактериальные препараты. Этому способствует тотальное использование антибиотиков в сельском хозяйстве и не всегда оправданное назначение антимикробных средств врачами разных специальностей.
Экономический ущерб из-за появления аитибиотикорезистентных форм бактерий исчисляется десятками и сотнями миллионов долларов. Например, в странах ЕС он составляет минимум 1,5 млрд евро в год [4]. В России ситуация усугубляется свободной продажей антибиотиков в аптеках и широким распространением самолечения.
Наиболее существенную роль в развитии бактериальных инфекций верхних дыхательных путей играют Staphylococcus spp., Streptococcusspp., Haemophilusinfluenzaе, Moraxellacatarrhalisи ряд других патогенных и условно-патогенных штаммов бактерий [5]. При этом наиболее серьезную угрозу здоровью с клинических и эпидемиологических позиций составляют метициллинрезистентный Staphylococcusaureusи Pseudomonasaeruginosa.
За последнее десятилетие значительно выросла резистентность этих бактерий к макролидам и пенициллинам, традиционно широко использующимся в отоларингологии. Кроме того, в последние годы отмечается резкий рост числа бактерий, продуцирующих β-лактамазы расширенного спектра действия, что связано с широким использованием в стационарной и амбулаторной практике цефалоспоринов первого, второго и третьего поколений [6].
Помимо распространения антибиотикорезистентности у возбудителей заболеваний ЛОР-органов определенную проблему составляет все повышающаяся частота аллергических реакций на введение антибактериальных препаратов.
Поэтому на сегодняшний день особую важность приобретает применение дополнительных и эффективных средств с низким аллергенным потенциалом, позволяющих уничтожать полирезистентные бактерии. Одним из перспективных путей решения этой проблемы является расширение использования бактериофагов [7].
Бактериофаги представляют собой вирусы бактерий. При наличии чувствительности к ним у бактериального штамма они проникают в бактерии, размножаются в них и в конечном итоге разрушают. После лизиса бактерии фаговые частицы вновь готовы к действию. Фаги специфичны: в отличие от антибиотиков они вызывают гибель только определенного вида бактерий, не подавляя нормальную микрофлору пациента.
Исследования фармакокинетики фагов, проведенные на лабораторных животных, свидетельствуют, что бактериофаги при любом способе введения поступают в общий кровоток, откуда быстро адсорбируются различными тканями. Наиболее часто их обнаруживают в лимфатических узлах, селезенке, печени и почках.
Так как при наличии в организме соответствующего микроба фаги активно размножаются, длительность их пребывания в организме увеличивается и напрямую зависит от присутствия фагочувствительного возбудителя инфекции. Может иметь место даже повышение титра бактериофага. Средняя длительность пребывания бактериофагов в организме человека составляет около 5–6 суток. Иногда этот срок увеличивается [8].
Диапазон методов применения лечебных бактериофагов весьма широк. Он включает не только аппликации на месте поражения, но и пероральный, подкожный, внутримышечный, ректальный, а также внутрибрюшинный способы введения. Эффективно и применение препаратов в виде клизм и аэрозолей [9].
Циклы репродукции бактериофагов и их накопление в очаге воспаления являются важной особенностью фаготерапии. Это принципиально отличает ее от применения химиотерапевтических средств с широким антимикробным спектром, часто уничтожающих не только патогенные бактерии, но и нормальную микрофлору организма хозяина [10]. Различия между антибиотиками и бактериофагами представлены в таблице.
Таблица.Различия между антибиотиками и бактериофагами.
Фаги, как и все другие микроорганизмы, способны менять свои свойства: форму и размеры колоний, способность к адсорбции на микробной клетке, спектр литического действия, устойчивость к внешним воздействиям.
В свою очередь бактерии могут приобретать устойчивость к отдельным фагам. Однако на сегодняшний день из-за незначительной распространенности терапии бактериофагами эта проблема не столь актуальна, как в случае с традиционными антибактериальными препаратами.
По современным представлениям, антибиотики не должны использоваться для профилактики гнойно-воспалительных заболеваний ЛОР- органов. Это связано с их низкой эффективностью при решении данной задачи, повышенным риском развития антибиотикорезистентных штаммов и потенциальной токсичностью для организма.
Применение бактериофагов с профилактической целью, напротив, используется уже давно, доказало свою эффективность и безвредность. К примеру, бактериофаги могут применяться для эрадикации носительства стрептококков группы А без воздействия на нормальную микрофлору слизистых оболочек [11]. Особенно актуальным профилактическое применение бактериофагов становится в холодное время года у часто болеющих детей, а также у пациентов с иммунодефицитами различной этиологии.
С лечебной целью при бактериальных заболеваниях ЛОР-органов бактериофаги могут использоваться как альтернатива антибиотикам, особенно в случаях выделения антибиотикорезистентных штаммов бактерий или при наличии у пациента поливалентной аллергии.
Хороший терапевтический эффект бактериофаги дают и при совместном назначении с традиционной антибактериальной терапией. Такой подход оправдан и доказал свою клиническую эффективность [12].
При правильном выборе и использовании бактериофаги сопоставимы по эффективности с антибиотиками широкого спектра действия. К тому же фаги не токсичны, практически не вызывают аллергических реакций и не имеют противопоказаний к применению.
Еще одним из значимых свойств бактериофагов является их опосредованное иммуностимулирующее действие. Считается, что разрушенные фагом клеточные стенки бактерий могут действовать как своеобразная вакцина, повышая в первую очередь местный иммунитет. Это особенно важно при лечении часто рецидивирующих хронических гнойно-воспалительных заболеваний ЛОР-органов.
Самым важным условием, обеспечивающим положительный эффект фаго- терапии, является определение чувствительности выделенного штамма к препарату назначаемого бактериофага.
В отоларингологии различные препараты бактериофагов, применяемые в соответствии с видом возбудителя, высокоэффективны при лечении риносинуситов, но могут также использоваться в комплексном лечении отитов, тонзиллитов, паратонзиллярных абсцессов [13].
На сегодня наиболее универсальным препаратом, предназначенным для лечения гнойно-воспалительных заболеваний ЛОР-органов, является пиобактериофаг поливалентный очищенный (Секстафаг). Это раствор для местного и наружного применения, а также для приема внутрь, который представляет собой стерильный фильтрат фаголизатов Streptococcus spp., Staphylococcusspp., Pseudomonasaeruginosa, Escherichiacoli, Klebsiellapneumoniae, Proteusvulgaris, Proteusmirabilis.
Комплекс бактериофагов, входящих в его состав, охватывает практически весь основной спектр возбудителей госпитальных инфекций. Каждый компонент Секстафага обладает достаточно широким диапазоном действия в отношении различных бактериальных штаммов. При изготовлении его производственных серий используются микроорганизмы, выделенные от больных, в т. ч. стационарных. Кроме того, обязательной является адаптация препарата к фагоустойчивым или слабочувствительным к пиобактериофагу бактериальным штаммам.
Соответственно, Секстафаг может поражать как чувствительные к анти- бактериальным средствам, так и полиантибиотикорезистентные клетки возбудителя. При этом он способен к повторному избирательному лизису клеток возбудителя вплоть до полной их элиминации из очага воспаления без нарушения нормального микро- биоценоза.
Использование Секстафага не вызывает развития аллергических реакций и органотропного токсического воздействия. Отсутствие неблагоприятных побочных явлений при применении препарата позволяет эффективно использовать его для детей всех возрастов и беременных женщин.
Использование в лечении хронических гнойных риносинуситов пиобактериофага поливалентного очищенного позволяет эффективно элиминировать патогенные бактерии из очага воспаления и стимулирует местный клеточный иммунитет. Это способствует сокращению частоты рецидивов риносинусита в сравнении с антибиотикотерапией [14].
У детей с острым гнойным риносинуситом было также показано положительное влияние бактериофагов на мукоцилиарный клиренс – важный универсальный механизм защиты слизистой оболочки дыхательных путей. Это позволяет отнести пиобактериофаг не только к этиологическим, но и к патогенетическим средствам при терапии гнойно-воспалительных заболеваний ЛОР-органов [15].
При риносинуситах для достижения эрадикации возбудителя из очага воспаления и получения наилучшего клинического эффекта рекомендуется следующая схема лечения:
1. После катетеризации верхнечелюстной пазухи промыть ее стерильным 0,9 %-ным раствором NaCl, после чего ввести в полость пазухи через катетер 5 мл поливалентно- го очищенного пиобактериофага. Процедуру повторять 2 раза в день в течение 5–6 суток, затем катетер удалить.
2. В последующие 10–15 суток 2–3 раза в день инсталлировать пиобактериофаг поливалентный очищенный по 5 капель в каждый носовой ход, а также вводить на 1 час 3 раза в день турунды, смоченные пиобактериофагом [14].
При комплексном лечении наружного и острого среднего отита рекомендуется закапывание в ухо 2–10 мл Секстафага 1–3 раза в день. При тонзиллите используется полоскание раствором бактериофага 3 раза в стуки на фоне традиционной антибактериальной терапии.
Таким образом, терапия гнойно-воспалительных заболеваний ЛОР- органов препаратами бактериофагов является перспективным направлением, должна рассматриваться и как альтернатива антибиотикотерапии, и как вспомогательное лечение при традиционной терапии антибактериальными средствами.
Литература
1. Нестерова И.В. Проблемы лечения вирусно-бактериальных респираторных инфекций у "часто и длительно болеющих" иммунокомпрометированных детей // Лечащий врач 2009. № 6. С. 26–29.
2. Азнабаева Л.Ф., Арефьева Н.А., Ворошилова Н.Н. и др. Взаимосвязь факторов защиты и микробного сообщества слизистых оболочек носа у больных хроническим гнойным риносинуситом // Успехи современного естествознания 2007. № 3. С. 69–71.
3. Решедько Г.К., Козлов Р.С. Состояние резистентности к антиинфекционным химиопрепаратам в России. Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. Смоленск, 2007. С. 32–46.
5. Зубков М.Н. Алгоритм терапии острых и хронических инфекций верхних и нижних дыхательных путей // РМЖ 2009. Т. 17. № 2. С. 123–31.
6. Paterson DL, Bonomo RA. Extended-spectrum beta-lactamases: a clinical update. Clin Microbiol Reviews 2005;18:7–86.
7. Loc-Carrillo С, Abedon ST. Pros and cons of phage therapy. Bacteriophage 2011;1(2):111–14.
8. Парфенюк Р.Л. Микробиологические основы пероральной фаготерапии гнойно- воспалительных заболеваний. Дисс. канд. биол. наук. 2004. C. 101.
9. Алсынбаев М.М.. Медведев К.А. Туйгунов М.М. Биопрепараты и ведущие направления их лечебно-профилактического применения. Уфа: РИО филиала “Иммунопрепарат” ФГУП НПО Микроген МЗРФ, 2008. C. 100.
10. Matsuzaki S, Rashel M, Ushiyama J, et al. Bacteriophage therapy: a revitalized therapy against bacterial infectious diseases. J Infect Chemother 2005;11(5):211–19.
11. Nelson D, Loomis L, Fischetti VA. Prevention and elimination of upper respiratory colonization of mice by group A streptococci by using a bacteriophage lytic enzyme. ProcNatlAcadSciUSA2001;98;4107–12.
12. Захарова Ю.А., Николаева А.М., Падруль М.М. Использование препаратов бактериофагов у беременных при инфекциях мочевыводящих путей // Биопрепараты, 2010;2(38):14–17.
14. Султанов Н.М. Антибактериальная активность и клиническая эффективность препарата пиобактериофага поливалентного очищенного при лечении хронического гнойного риносинусита. Дисс. канд. биол. наук. 2007. C. 94.
15. Янборисова Э.Р., Янборисов Т.М. Влияние пиобактериофага на мукоцилиарный клиренс при местном применении у детей с острым синуситом // Российская ринология, 1997. № 2. С. 55.
Быков А.С., Быков С.А.
ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ, Москва
Рассматриваются биологические свойства бактериофагов, данные об их структуре, разновидностях, механизмах действия. Представлена информация о препаратах бактериофагов против возбудителей кишечных инфекций, таких как интести-бактериофаг жидкий, бактериофаг дизентерийный поливалентный, бактериофаг сальмонеллезный, бактериофаг брюшнотифозный, бактериофаг колипротейный жидкий. Подчеркиваются безопасность, стабильность, специфичность бактериофагов и препаратов на их основе.
Бактериофаги (от слов “бактерия” и греч. phagos – пожирающий; БФ), или фаги, – специфические вирусы бактерий, вызывающие их лизис (разрушение клеток) или изменяющие их свойства. Они впервые были обнаружены микробиологами Ф. Туортом (1915) в Великобритании и Ф. д’Эрелем (1917) во Франции. Однако изучить их морфологию удалось только после изобретения электронного микроскопа.
Биология бактериофагов
Широкое распространение БФ в природе связано с повсеместным распространением их основных хозяев – бактерий. БФ могут поражать не только бактерии, но и грибы, и простейшие, поэтому их также называют фагами. По степени специфичности различают: поливалентные БФ, взаимодействующие с родственными видами бактерий; моновалентные БФ, взаимодействующие с бактериями определенного вида; типовые БФ, взаимодействующие с отдельными типами (вариантами) данного вида бактерий.
БФ состоят из белка – капсида, защищающего один тип нуклеиновой кислоты (ДНК или РНК, одно или двунитевые). Различают БФ с длинным отростком, имеющие сокращающийся или несокращающийся чехол, а также БФ с короткими отростками, аналогами отростков, без отростков и нитевидные (рис. 1, 2). Размер БФ колеблется от 20 до 800 нм (у нитевидных форм). БФ, имеющие форму сперматозоида, достигают до 200 нм длиной, состоят из хвостового отростка и головки икосаэдрического типа, содержащей нуклеиновую кислоту. Капсид головки и чехол хвостового отростка БФ состоят из полипептидных субъединиц, уложенных по икосаэдрическому (головка) или спиральному (отросток) типу симметрии. Хвостовой отросток имеет внутри полую трубку (стержень), через которую при инфицировании нуклеиновая кислота фага проходит из головки в бактерию. Чехол отростка заканчивается шестиугольной базальной пластинкой с шипами, от которых отходят фибриллы (нити). Базальная пластинка и хвостовые фибриллы участвуют в прикреплении БФ к бактериальной ячейке. Не все БФ имеют базальные пластинки и хвостовые фибриллы. В зависимости от жизненного цикла БФ могут быть вирулентными (литическими) или умеренными.
Вирулентные (литические) БФ для внедрения в бактерию адсорбируются на специфических рецепторах клетки, в т. ч. на липополисахариде, липопротеине, тейхоевых кислотах, протеинах, или даже на пилях. Специфичность рецепторов означает, что БФ может инфицировать только определенные бактерии. Попав в бактерию, БФ репродуцируется, формируя 200–500 фаговых частиц, и вызывает гибель бактерии. Это продуктивный (литический) тип взаимодействия. БФ с сокращающимся чехлом адсорбируются на клеточной стенке с помощью фибрилл хвостового отростка. Чехол хвостового отростка сокращается, и стержень с помощью ферментов (лизоцима) как бы просверливает оболочку клетки. Через канал трубки БФ нуклеиновая кислота инъецируется из головки в бактериальную клетку, а капсид БФ остается снаружи бактерии (рис. 2). Нуклеиновая кислота БФ направляет синтез его ферментов. При этом инактивируются ДНК и РНК хозяина. Нуклеиновая кислота БФ реплицируется и направляет синтез новых белков капсида. Происходят самосборка капсида вокруг фаговой нуклеиновой кислоты и формирование БФ, которые выходят из бактерии в результате ее лизиса, выталкивания или в некоторых случаях почкованием. Из бактерии высвобождается 200–1000 новых БФ, которые инфицируют другие бактериальные клетки.
Умеренные БФ взаимодействуют с бактериями по продуктивному или интегративному типу. Продуктивный тип умеренного фага, как и у вирулентных фагов, заканчивается лизисом бактерий. При интегративном типе ДНК умеренного фага встраивается в хромосому бактерии, реплицируется синхронно с бактериальным геномом, не вызывая ее лизиса (передается при делении бактерии). ДНК фага, встроенная в хромосому бактерии, называется профагом, а культура бактерий – лизогенной, сам процесс – лизогенией (от греч. lysis – разложение, genea – происхождение).
Хромосома умеренного фага лямбда, введенная в бактерию, вызывает либо лизис, либо лизогенизацию (проникшая в бактерию ДНК умеренного фага приобретает форму кольца и интегрирует в строго определенную область хромосомы). Ультрафиолетовое облучение индуцирует литический процесс с выходом фага. При лизогении фаги не образуются в результате “выключения” фаговых генов репрессором, кодируемым одним геном фага.
Профаги могут спонтанно или под действием индуцирующих агентов (ультрафиолетовые лучи, митомицин С и др.) дерепрессироваться, исключаться из хромосомы. Этот процесс заканчивается продукцией фагов (индукцией профага) и лизисом бактерий. Профаг придает бактерии новые свойства, что получило название фаговой конверсии (лат. conversio – превращение). Конвертироваться могут морфологические, культуральные, биохимические, антигенные и другие свойства бактерий. Например, наличие профага в холерном вибрионе обусловливает его способность продуцировать холерный экзотоксин.
БФ применяют для профилактики, лечения инфекций, а также для диагностики (например, для фаготипирования с целью выявления источника инфекции). Кроме того, БФ используют в генной инженерии в качестве векторов, переносящих участки ДНК; возможна также естественная передача генов между бактериями посредством трансдукции.
Фаготипирование – один из методов эпидемиологического маркирования. Применяется для выявления источника инфекции. Выделение бактерий одного фаговара от разных больных указывает на общий источник их заражения. При внутривидовой идентификации бактерий, т. е. при определении фаговара (фаготипа) бактерий с помощью фаготипирования, на чашку Петри с плотной питательной средой, засеянную чистой культурой возбудителя в виде “газона”, наносят капли различных диагностических типоспецифических фагов. Бактерии, чувствительные к фагу, лизируются (образуется стерильное пятно, “бляшка”, или т. н. негативная колония фага).
БФ – уникальное явление; они участвуют в разнообразных процессах:
- в передаче лекарственной резистентности при трансдукции, особенно у стафилококков;
- лизогенная конверсия приводит к приобретению новых характеристик бактерий;
- случайная инсерция (вставка) в бактериальную хромосому может вызывать инсерционную мутацию;
- в эпидемиологическом типировании бактерий (фаготипировании);
- в лямбде БФ – модельной системе для изучения латентной инфекции;
- БФ используются в генной инженерии как векторы и библиотеки генов;
- БФ ответственны за естественное удаление бактерий; используются для профилактики и лечения некоторых инфекций.
Получение эффективных лечебно-профилактических БФ связано с тщательным и постоянным поиском штаммов с широким спектром (валентностью) действия на бактерии и высокой степенью их литической активности. Литическая активность и, следовательно, лечебная, а также профилактическая эффективность препаратов БФ зависят от видовой, инфравидовой принадлежности возбудителя, его рецепторных особенностей и факторов его микроокружения. Например, антитела и другие гуморальные белки могут заблокировать участки связывания бактерий с БФ, что исключает возможность парентерального введения последних. Кроме того, возможно быстрое формирование резистентности бактерий к применяемым БФ. Для получения лечебного эффекта при неблагоприятных бактериальных ассоциациях препараты БФ выпускают либо поливалентными, направленными против различных видов и сероваров одного возбудителя, либо комбинированными, содержащими БФ против различных видов возбудителя.
БФ не вызывают побочных реакций, не нарушают нормальную микрофлору. При дисбактериозе, нарушениях функций кишечника, обусловленных развитием местных воспалительных процессов, подавлении резидентной микрофлоры, происходит активация ряда условно-патогенных микроорганизмов и транзиторной микрофлоры. Эти обстоятельства поднимают значимость селективной деконтаминации, проводимой с помощью антибиотиков направленного действия и литических БФ.
БФ, обладая специфичностью действия против определенных возбудителей острых кишечных инфекций, могут также вносить вклад в развитие оральной толерантности. Известно, что организм человека проявляет пероральную (региональную) толерантность к собственной нормальной микрофлоре. Эта толерантность обусловлена блокадой активации сигнальных рецепторов (например, толл-подобных рецепторов – TLR и др.) к компонентам микрофлоры человека и активностью регуляторных T-лимфоцитов (Treg), которых в свою очередь активируют NKT-клетки (natural killer T cells). Компоненты (паттерны) БФ и разрушенных ими бактерий могут активировать определенные сигнальные рецепторы клеток организма, стимулирующие синтез антимикробных пептидов, подавляющих развитие наиболее агрессивных микробов (рис. 3). Срыв оральной толерантности влечет развитие различных нарушений, в т. ч. хронического гастрита, болезни Крона, неспецифического язвенного колита, некротизирующего энтероколита у детей, язвенной болезни желудка и двенадцатиперстной кишки.
Препараты БФ хранят при температуре 2–10 °С в сухом темном месте. БФ чувствительны к ультрафиолетовым лучам; даже их непродолжительное пребывание на свету приводит к утрате литической активности. Для защиты БФ от действия желудочного сока их выпускают в капсулах или таблетках, покрытых кислотоустойчивой оболочкой. Материалом защитного покрытия является нетоксичная целлюлоза, эстерифицированная уксусной и фталевой кислотами, образующая гладкую прозрачную пленку. Для детей из-за проблем проглатывания таблеток используют пектиновое покрытие. Пектин, обволакивая БФ, защищает их от разрушающего действия желудочного сока.
Нормализация микрофлоры, возможное участие БФ в поддержании колонизационной резистентности и оральной толерантности обеспечивают стабилизацию гуморального и клеточного звеньев иммунитета. Изредка применение БФ совпадает с ухудшением качества стула из-за массовой гибели чувствительных к нему бактерий. В этом случае для уменьшения интоксикации целесообразно назначать на ночь энтеросорбент – не ранее 3–4 часов после последнего приема БФ.
Препараты бактериофагов против возбудителей кишечных инфекций
Интести-бактериофаг жидкий содержит стерильные фильтраты фаголизатов шигелл (S. flexneri сероваров 1, 2, 3, 4, 6 и S. sonnei), сальмонелл (S. paratyphiA, S. paratyphiB, S. typhimurium, S. choleraesuis, S. infantis, S. oranienburg, S. enteritidis), энтеропатогенных кишечных палочек наиболее этиологически значимых сероваров (Escherichia coli О111, О55, О26, О125, О119, О128, О18, О44, О25, О20), протея (вульгарис и мирабилис), стафилококков, энтерококков и синегнойной палочки (Pseudomonas aeraginosa). Интести-бактериофаг (Bacteriophagum intestinalis fluidum) представляет собой прозрачную жидкость желтого цвета различной интенсивности.
Препарат предназначен для лечения и профилактики заболеваний желудочно-кишечного тракта, вызванных вышеуказанными бактериями, их сочетанием (в т. ч. бактериальной дизентерии, сальмонеллеза, брюшного тифа, паратифа, дисбактериоза, энтероколита, колита, диспепсии). Его назначают в остром периоде болезни: монотерапия при легких и стертых формах, при бактериовыделении; комбинированная терапия с другими антибактериальными средствами (при среднетяжелом течении) или иммуномодуляторами (при затянувшемся бактериовыделении). Залогом эффективности использования интести-бактериофага является определение фагочувствительности возбудителя и раннее применение препарата, который назначают перорально или ректально при помощи клизмы. Перорально интести-бактериофаг назначают 3–4 раза в сутки натощак за 1,0–1,5 часа до еды в течение 7–10 дней и в разовой дозе: детям до 6 месяцев – 5–10 мл, 6–12 месяцев – 10–15 мл, 1–3 года – 15–20 мл, старше 3 лет – 20 – 40 мл (см. таблицу). Для детей первых месяцев жизни назначенный препарат в первые двое суток разводят кипяченой водой в 2 раза. Если побочные осложнения отсутствуют (срыгивания, высыпания на коже), препарат назначают неразведенным. Перед приемом интести-бактериофага детям старше 3 лет и взрослым назначают раствор питьевой соды (0,5 чайной ложки на 0,5 стакана воды) или щелочную минеральную воду. В отсутствие колитического синдрома препарат назначают ректально 1 раз в день после опорожнения кишечника.
Бактериофаг дизентерийный поливалентный (в таблетках с кислотоустойчивым покрытием и в свечах) содержит стерильные фильтраты фаголизатов шигелл (S. flexneri и S. sonnei). Применяют с 6-месячного возраста для лечения и профилактики бактериальной дизентерии. Для лечения его применяют перорально 3 раза в сутки за час до еды в течение 5–7 дней и в разовой дозе: для детей от 6 месяцев до 3 лет – по 1 таблетке, 3–8 лет – по 1–2 таблетки, старше 8 лет – 2–3 таблетки. При слабовыраженном колитическом синдроме и в период реконвалесценции третий прием БФ внутрь можно заменить его ректальным применением: с 6 месяцев до 3 лет – 20–40 мл, с 3 до 8 лет – 40–60 мл, старше 8 лет – 60–80 мл.
С профилактической целью рекомендуют ежедневный прием препарата в зависимости от возраста: по 10–40 мл или 1–2 таблетки.
Бактериофаг сальмонеллезный групп A, B, C, D, E в таблетках с кислотоустойчивым покрытием, в свечах, жидкий содержит стерильные фильтраты фаголизатов сальмонелл (S. paratyphi A, S. paratyphi B, S. typhimurium, S. heidelberg, S. newport, S. choleraesuis, S. oranienburg, S. infantis, S. dublin, S. enteritidis, S. anatum, S. newlands). Для лечения его применяют перорально 3 раза в день за час до еды в течение 7–10 дней и в разовой дозе: для детей 6–12 месяцев – по 0,5 таблетки; 1–3 лет – по 0,5–1,0; 3–8 лет – по 1,0; старше 8 лет – по 2 таблетке. Третий пероральный прием можно заменить ректальным введением препарата. С профилактической целью БФ назначают детям по 1 таблетке и взрослым по 2 таблетке 2 раза в неделю.
Бактериофаг брюшнотифозный в таблетках с кислотоустойчивым покрытием содержит стерильный фильтрат фаголизата сальмонелл брюшного тифа (S. typhi). Препарат назначают для профилактики брюшного тифа внутрь за час до еды детям от 6 месяцев до 3 лет по 1 таблетке, а старше 3 лет и взрослым – по 2 таблетке 1 раз в 3 дня или каждый день до выздоровления.
Бактериофаг колипротейный жидкий содержит стерильные фильтраты фаголизатов энтеропатогенных (диареегенных) кишечных палочек (Escherichia coli наиболее распространенных серологических групп O20, O26, O33, O44, O55, O111, O119, O26, O124, O125, O127, O151), Proteusvulgarisи Proteusmirabilis. Препарат предназначен для лечения и профилактики заболеваний, вызванных вышеуказанными бактериями, а также дисбактериоза.
Сфера применения других препаратов бактериофагов многообразна; они используются как для местного применения (“раневые” бактериофаги), так и для приема перорально или ректально, в т. ч. в зависимости от формы выпуска:
- бактериофаг клебсиелл пневмонии очищенный жидкий;
- бактериофаг клебсиеллезный поливалентный очищенный жидкий;
- бактериофаг коли жидкий;
- бактериофаг протейный жидкий;
- бактериофаг псевдомонас аэругиноза (синегнойный) жидкий;
- бактериофаг сальмонеллезный групп ABCDE в свечах;
- бактериофаг сальмонеллезный групп ABCDE жидкий;
- бактериофаг сальмонеллезный групп ABCDE жидкий и сухой с кислотоустойчивым покрытием;
- бактериофаг стафилококковый в аэрозольной упаковке;
- бактериофаг стафилококковый в свечах;
- бактериофаг стафилококковый для инъекций жидкий;
- бактериофаг стафилококковый жидкий;
- бактериофаг стрептококковый жидкий.
В заключение следует отметить, что БФ и препараты БФ характеризуются многими положительными сторонами, они:
- безопасны, в т. ч. не токсичны, для человека;
- высокостабильны при длительном хранении;
- обладают строгой специфичностью действия на определенные виды бактерий и эффективностью как в качестве монотерапии, так и в сочетании с антибиотиками;
- не нарушают нормальную микрофлору;
- способны к самовоспроизведению и саморегуляции численности.
Литература
1. Атлас по медицинской микробиологии, вирусологии и иммунологии / 2-е изд. Под ред. А.С. Быкова, А.А. Воробьева, В.В. Зверева. М., 2008. C. 272.
2. Дарбеева О.С., Жиленков Е.Л. Бактериофаги. Общая и санитарная микробиология с техникой микробиологических исследований: учебное пособие / Под ред. А.С. Лабинской, Л.П. Блинковой, А.С. Ещиной. М., 2004. C. 576.
3. Урсова Н.И., Минухина А.М. Бактериофаги. Клинико-иммунологическая эффективность иммунобиологических препаратов / Под. ред. М.П. Костинова, Н.В. Медуницина. М., 2008. C. 256.
Читайте также:

