Фетальный гепатит у новорожденного из за чего
Обновлено: 24.04.2024
Клиника внутриутробной инфекции. Перинатальные поражения нервной системы у новорожденных
Клинические проявления внутриутробных инфекций полиморфны и зависят не столько от этиологии/сколько от локализации и тяжести процесса. Наиболее типичны задержка внутриутробного развития, гепатомегалия, спленомегалия, желтуха, сыпь, синдром дыхательных расстройств, сердечнососудистая недостаточность и неврологические нарушения. Тяжесть клинических проявлений в большей мере зависит от того, на каких сроках гестации произошло инфицирование.
При развитии инфекции во второй половине беременности заболевание у новорожденного клинически манифестирует как генерализованная инфекция или как поражение отдельных органов. У всех наблюдавшихся больных, госпитализированных в Центр детской гепатогии с перинатальной патологией гепато-билиарной системы, были выражены и поражения центральной нервной системы, по поводу которых они получали специальное обследование и лечение невропатолога.
Последствия перинатальных инфекционных заболеваний ЦНС в плане этиологии и патогенетической основы рассматриваются как:
1) поражения вследствие перенесенного (врожденного) энцефалита, менингита, менингоэнцефалита (TORCH-синдром — цитомегаловирусная инфекция, герпетическая инфекция, токсоплазмоз, врожденная краснуха, ECHO — вирусы и другие, сифилис);
2) поражения ЦНС вследствие перенесенного неонатального сепсиса (менингит, менингоэнцефалит, вентрикулит, энцефалит).
Варианты клинических форм в первой группе — перинатальное постинфекционное (врожденное) органическое поражение мозга с различными клиническими синдромами, исходы которых могут варьировать от легких до тяжелых форм умственной отсталости, ДЦП, симптоматических резистентных эпилепсии. Варианты клинических форм во второй группе — постинфекционная
3) энцефалопатия или постинфекционное поражение ЦНС, проявляющиеся клиническими синдромами гидроцефалии, гиперактивного поведения, нарушений (задержки) моторного развития, очаговых нарушений (парезы и параличи), тяжелых нарушений моторного развития (формирующиеся и сформированные ДЦП) и другими. Исходы поражений ЦНС зависят от ранней диагностики и определяются своевременностью адекватной терапии, могут варьировать от легких функциональных до тяжелых психоневрологигеских нарушений.
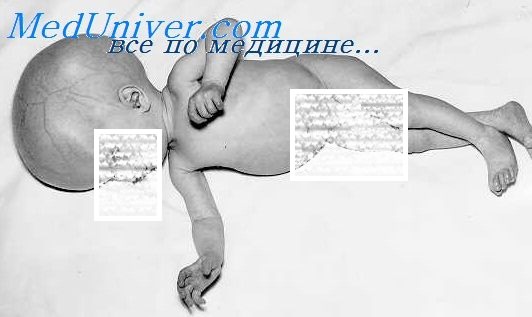
Новорожденный с врожденным токсоплазмозом
Целью исследований К. Е. Скляр с соавторами было выявление клинико-патогенетических закономерностей формирования врожденных пороков развития при внутриутробной инфекции у новорожденных. Проведено обследование 86 новорожденных с врожденными пороками развития различной локализации (у 50 % — врожденные пороки сердца) и клиническими признаками внутриутробной инфекции. Положительные результаты ПЦР получены у 43 (53 %) детей, в том числе РНК краснухи — у 36, ДНК токсоплазмоза — у 2, ДНК хламидий и вируса простого герпеса — в двух случаях, смешанная инфекция — у трех.
Анализ анамнестических данных и клинического течения заболевания не позволил авторам выделить каких-либо симптомов, соответствующих этиологии инфекции. У 30 (34,9%) оперативное лечение проведено в периоде новорожденности, из них — у 8 (9,3 %) в первые сутки после рождения. При морфологическом исследовании интраоперационно полученных биоптатов выявлены нарушения гистоархитектоники, склеротические и дистрофические явления, признаки нарушения локального кровообращения. Развитие указанных процессов в органах, по всей видимости, отражает исход инфекционного процесса.
По мнению авторов, именно склеротические процессы в аномальных тканях могут оказывать влияние на дальнейшее развитие детей и проявляться в различных формах хронических состояний, в том числе хронического гепатита и атрезии желчевыводящих путей при поражении пегени.
Желтуха и поражение печени наряду с поражением центральной нервной системы — ведущие клинические признаки большинства перинатальных инфекций.
В подтверждении диагноза и выяснении этиологии поражения пегени у новорожденных велика ответственность спектра, кагества проведения и клинического толкования результатов лабораторных исследований. Характеристика диагностических методов внутриутробной инфекции, применяемых в повседневной практике, предполагает определение титра специфических антител IgG в динамике (если он не снижается в возрасте от 6 до 12 недель, диагностируется врожденная инфекция). В 6 месяцев титр пассивно приобретенных от матери антител должен быть не выше 1:8.
Однако диагностика иммунохимическими методами у беременных и новорожденных может быть затруднена из-за недостаточной выработки специфических маркеров острой инфекции — антител класса IgM, трансплацентарной передачи антител класса IgG, низкого уровня продукции антигенов. В связи с этим клиническую значимость приобретает метод полимеразной цепной реакции.
Диагностика предполагает использование методов этиологической расшифровки с помощью генодиагностики. В то же время выявление ДНК вируса и тем более микоплазм и хламидий не может служить основанием для верификации этиологии инфекции и назначения лечения. Е. М. Малковой с соавторами из 117 новорожденных с признаками ВУИ у 112 обнаружены ДНК 26 возбудителей. Отмечено значительное количество вирусно-вирусных, микоплазменно-вирусных, вирусно-вирусно-микоплазменных, вирусно-хламидийных и прочих ассоциаций, составивших 22,1% среди положительных результатов исследований.
Клиническая картина не имела специфических признаков, была выраженной дыхательная недостаточность с развитием пневмонии, раннее и затяжное тегение желтухи, неврологические нарушения. Развитие фетального гепатита преобладало при сочетанных инфекциях. Наиболее тяжелое состояние отмечалось у детей при положительных результатах ПЦР сразу в нескольких биоматериалах. Необходимость терапии латентных форм заболеваний у новорожденных при детекции ДНК возбудителей определяется способностью многих из них длительно сохраняться в условиях иммунокомпетентного организма (персистировать с сохранением патогенных свойств).
При изменении иммунного статуса происходит быстрое восстановление вирулентности, которое становится основой рецидивирующего характера хронических инфекций и возможной инвалидизации ребенка. Однако, по данным авторов, результаты ПЦР-иследований у беременных женщин и их детей совпали только в 33,3 % слугаев, поэтому их трактовка, с нашей тогки зрения, должна быть осторожной.
Врожденные гепатиты у детей – это группа гетерогенных заболеваний, возникающих в результате внутриутробного воздействия патогенных факторов на печень плода. Клинически такие патологии могут проявляться холестатическим синдромом, гепатоспленомегалией, отставанием в психофизическом развитии, неврологической симптоматикой. Лабораторная диагностика основывается на определении уровня АлАТ, АсАТ, билирубина, щелочной фосфатазы, HBs- HBe- HBc-антигенов, РСК, ПЦР, ИФА. Основное лечение – этиотропная терапия, коррекция рациона и водно-электролитного баланса. При необходимости проводится патогенетическая фармакотерапия, хирургическая коррекция или трансплантация печени.
Общие сведения
Врожденные гепатиты у детей – это полиэтиологическая группа острых или хронических воспалительных, дистрофических и пролиферативных заболеваний печени, возникающих во внутриутробном периоде либо во время родов. Суммарная распространенность всех форм составляет 1:5 000-10 000. Среди всех новорожденных порядка 15% инфицируются трансплацентарно и 10% – непосредственно во время родов. Вероятность развития врожденного гепатита у детей зависит от этиологического фактора. При остром вирусном гепатите В она составляет до 90%, при HCV-инфекции – около 5%. Прогностически благоприятными формами врожденных гепатитов у детей считаются холестатические, неблагоприятными – с выраженной гепатоцеллюлярной недостаточностью. Во втором случае летальность на первом году жизни достигает 40%.

Причины врожденных гепатитов у детей
Ведущую роль в этиологии врожденных гепатитов у детей играют вирусные инфекции из группы TORCH: цитомегаловирус, вирусы гепатита В и простого герпеса человека, вирусы Эпштейна-Барр, ECHO, краснухи. Также развитие этой группы патологий могут вызывать перенесенные во время беременности бактериальные и паразитарные заболевания: сифилис, листериоз, туберкулез, токсоплазмоз. К факторам риска со стороны матери относятся бесконтрольный прием медикаментов с гепатотоксическими свойствами, употребление алкоголя, табачных изделий, наркотических веществ. Со стороны ребенка спровоцировать развитие врожденного гепатита у детей могут наследственные ферментопатии: муковисцидоз, галактоземия, дефицит α1-антитрипсина и тирозина. Довольно часто точную этиологию определить не удается. В таком случае устанавливается диагноз идиопатический врожденный гепатит.
Механизм заражения при врожденных гепатитах у детей основывается на трансплацентарной (вертикальной) передаче вирусных или инфекционных агентов от матери к ребенку или их интранатальной аспирации вместе с околоплодными водами. Реже заражение происходит при контакте кожи и слизистых оболочек ребенка с инфицированными родовыми путями. Развитие врожденного гепатита во внутриутробном периоде обычно происходит в III триместре. Риск заражения ребенка в первой половине беременности при остром гепатите В или С составляет до 10%. Воздействие TORCH-инфекций на плод в I-II триместре может привести к спонтанному аборту.
В основе патогенеза врожденных гепатитов у детей помимо структурных изменений гепатоцитов (баллонной или вакуольной дистрофии и др.) лежит холестатический синдром. Его главное морфологическое проявление – имбибиция цитоплазмы желчными пигментами и образование желчных тромбов в начальных отделах внутрипеченочных ходов. Также при врожденных гепатитах у детей возможна гипо- или аплазия внепеченочных отделов желчевыводящих путей, что еще больше усугубляет холестаз.
Симптомы врожденных гепатитов у детей
Первые симптомы бактериальных врожденных гепатитов у детей возникают на 2-3 сутки после рождения. Как правило, отмечается субфебрильная или фебрильная температура тела, диарея, увеличение печени. Часто развиваются пневмонии и инфекционно-токсический шок, появляются признаки энцефалита. В зависимости от возбудителя наблюдаются характерные клинические особенности. Для ЦМВ характерны геморрагии, микроцефалия или гидроцефалия, поражения сетчатки, легких и почек. При краснухе отмечается незаращение артериальной протоки, поражение хрусталика и внутреннего уха. Токсоплазмозный врожденный гепатит у детей сопровождается кожными высыпаниями, гидро- и микроцефалией, хориоретинитом. При герпес-вирусном гепатите, помимо других симптомов, возникают высыпания на коже, слизистых оболочках рта и конъюнктивы, а также геморрагический синдром и ДВС-синдром. При заболевании сифилитической этиологии формируется специфическая сыпь на коже и слизистых, обнаруживается периостит.
Диагностика и лечение врожденных гепатитов у детей
Диагностика врожденных гепатитов у детей включает в себя сбор анамнеза, объективное обследование ребенка, лабораторные анализы и инструментальные методы исследования. Анамнестические данные дают возможность определить, в каком возрасте возникли первые признаки заболевания и какими они были. Также они могут указывать на потенциальные этиологические факторы. При физикальном обследовании педиатром внимательно осматриваются все кожные покровы и видимые слизистые оболочки на предмет желтухи и высыпаний. Оцениваются размеры печени и селезенки, размеры живота, определяются возможные неврологические расстройства.
При врожденных гепатитах у детей наблюдаются неспецифические изменения лабораторных анализов. Наиболее информативными являются печеночные трансаминазы – АлАТ и АсАТ, уровень которых значительно повышается. Также отмечается повышение уровня билирубина (как прямой, так и непрямой фракций), щелочной фосфатазы. При исследовании кала удается выявить отсутствие в нем желчи (ахолия), в моче определяется наличие уробилина. В диагностике врожденных гепатитов у детей крайне важными являются вирусологические и иммунологические исследования, которые позволяют установить этиологию заболевания. Среди них используются определение HBs- HBe- HBc-антигенов в крови, Ig M и G при ИФА, бактериальные посевы крови и ликвора, ПЦР и РСК.
Среди инструментальных методов исследования при врожденных гепатитах у детей информативными могут быть УЗИ и биопсия. При ультразвуковом исследовании определяются структурные изменения паренхимы печени, желчного пузыря и желчевыводящих путей. Пункционная биопсия печени используется с целью подтверждения диагноза на фоне нечеткости клинической картины и лабораторных результатов. По данным цитологического исследования тканей печени при врожденных гепатитах у детей может выявляться фиброз, склероз или некроз печеночных ацинусов, наличие гигантских клеток, лимфо- и плазмоцитарная инфильтрация, имбибиция цитоплазмы желчными пигментами.
Специфическое этиотропное лечение врожденных гепатитов у детей осуществляется в соответствии с их этиологией. При идиопатических формах применяется только патогенетическая и симптоматическая терапия. Проводится коррекция рациона ребенка, при подтверждении острой патологии у матери показан перевод на искусственные смеси, в других случаях – грудное вскармливание, нормализация водно-электролитного баланса. Смеси, применяемые у таких детей, должны быть богатыми на триглицериды, кальций, фосфор, цинк и водорастворимые витамины. При наличии холестатического синдрома в рацион ребенка также включают витамины A и E. Помимо коррекции питания могут назначаться гепатопротекторы, желчегонные, глюкокортикостероиды, интерфероны в зависимости от клинической ситуации. При наличии структурных аномалий или атрезии желчевыводящих путей выполняется их хирургическая коррекция. В тяжелых случаях врожденного гепатита у детей показана трансплантация печени.
Прогноз и профилактика врожденных гепатитов у детей
Прогноз при врожденном гепатите у детей зависит от этиологии, тяжести состояния ребенка и эффективности лечения. Показатель смертности на первом году жизни составляет 25-40%. Сюда преимущественно относятся формы, которые сопровождаются выраженной гепатоцеллюлярной недостаточностью. Еще у 35-40% детей формируются хронические заболевания печени и различные осложнения. Наиболее распространенными среди них являются холестатический синдром, синдромы недостаточности витаминов D, E и K, цирроз печени и фиброзирующий хронический гепатит, портальная гипертензия и острая печеночная недостаточность, энцефалопатия, задержка физического развития.
Специфическая профилактика врожденных гепатитов у детей проводится при выявлении у матери в крови HBs-антигенов или подтверждении диагноза острого гепатита. Таким детям уже в первый день жизни осуществляется вакцинация донорскими иммуноглобулинами и рекомбинантной вакциной. В 1 и 6 месяцев показана повторная вакцинация без иммуноглобулинов. Неспецифические профилактические меры включают в себя контроль над используемой донорской кровью и медицинским инструментарием, антенатальную охрану плода, регулярное посещение женской консультации и прохождение соответствующих обследований во время беременности.
Желтуха новорожденных – физиологическое или патологическое состояние, обусловленное гипербилирубинемией и проявляющееся желтушным окрашиванием кожи и видимых слизистых у детей в первые дни их жизни. Желтуха новорожденных характеризуется повышением концентрации билирубина в крови, анемией, иктеричностью кожных покровов, слизистых оболочек и склер глаз, гепато- и спленомегалией, в тяжелых случаях – билирубиновой энцефалопатией. Диагностика желтухи новорожденных основывается на визуальной оценке степени желтухи по шкале Крамера; определении уровня эритроцитов, билирубина, печеночных ферментов, группы крови матери и ребенка и др. Лечение желтухи новорожденных включает грудное вскармливание, инфузионную терапию, фототерапию, заменное переливание крови.
Общие сведения
Желтуха новорожденных – неонатальный синдром, характеризующийся видимой желтушной окраской кожи, склер и слизистых оболочек вследствие повышения уровня билирубина в крови ребенка. По наблюдениям, на первой неделе жизни желтуха новорожденных развивается у 60 % доношенных и 80% недоношенных детей. В педиатрии наиболее часто встречается физиологическая желтуха новорожденных, составляющая 60–70 % всех случаев синдрома. Желтуха новорожденных развивается при повышении уровня билирубина свыше 80-90 мкмоль/л у доношенных и более 120 мкмоль/л у недоношенных младенцев. Длительная или выраженная гипербилирубинемия оказывает нейротоксическое действие, т. е вызывает повреждение головного мозга. Степень токсического воздействия билирубина зависит, главным образом, от его концентрации в крови и длительности гипербилирубинемии.

Классификация и причины желтухи новорожденных
Прежде всего, неонатальная желтуха может быть физиологической и патологической. По происхождению желтухи новорожденных делятся на наследственные и приобретенные. На основании лабораторных критериев, т. е. повышения той или иной фракции билирубина различают гипербилирубинемии с преобладанием прямого (связанного) билирубина и гипербилирубинемии с преобладанием непрямого (несвязанного) билирубина.
К конъюгационным желтухам новорожденных относятся случаи гипербилирубинемии, возникающие вследствие пониженного клиренса билирубина гепатоцитами:
- Физиологическую (транзиторную) желтуху доношенных новорожденных
- Желтуху недоношенных новорожденных
- Наследственные желтухи, связанные с синдромами Жильбера, Криглера-Найяра I и II типов и др.
- Желтуху при эндокринной патологии (гипотиреозе у детей, сахарном диабете у матери)
- Желтуху у новорожденных с асфиксией и родовой травмой
- Прегнановую желтуху детей, находящихся на естественном вскармливании
- Медикаментозную желтуху новорожденных, обусловленную назначением левомицетина, салицилатов, сульфаниламидов, хинина, больших доз витамина К и др.
Гемолитическая желтуха новорожденных характеризуется повышением уровня билирубина вследствие усиленного разрушения (гемолиза) эритроцитов ребенка. К такого вида гипербилирубинемиям относят:
- Гемолитическую болезнь плода и новорожденных
- Эритроцитарные ферменто- и мембранопатии
- Гемоглобинопатию (серповидно-клеточную анемию, талассемию)
- Полицитемию
Механические желтухи новорожденных обусловлены нарушением отведения билирубина с желчью по желчным путям и кишечнику. Они могут возникать при пороках (атрезии, гипоплазии) внутрипеченочных и внепеченочных протоков, внутриутробной желчнокаменной болезни, сдавлении желчных ходов извне инфильтратом или опухолью, закупорке желчных протоков изнутри, синдроме сгущения желчи, пилоростенозе, кишечной непроходимости и пр.
Желтухи смешанного генеза (паренхиматозные) возникают у новорожденных с фетальным гепатитом, обусловленным внутриутробными инфекциями (токсоплазмозом, цитомегалией, листериозом, герпесом, вирусными гепатитами А, В, D), токсико-септическим поражением печени при сепсисе, наследственных заболеваниях обмена веществ (муковисцидозе, галактоземии).
Симптомы желтухи новорожденных
Физиологическая желтуха новорожденных
Транзиторная желтуха является пограничным состоянием периода новорожденности. Сразу после рождения ребенка избыток эритроцитов, в которых присутствует фетальный гемоглобин, разрушается с образованием свободного билирубина. Вследствие временной незрелости фермента печени глюкуронилтрансферазы и стерильности кишечника связывание свободного билирубина и его выведение из организма новорожденного с калом и мочой снижено. Это приводит к накоплению лишнего объема билирубина в подкожно-жировой клетчатке и окрашиванию кожи и слизистых в желтый цвет.
Физиологическая желтуха новорожденных развивается на 2-3 сутки после рождения, достигает своего максимума на 4-5 сутки. Пиковая концентрация непрямого билирубина составляет в среднем 77-120 мкмоль/л; моча и кал имеют нормальную окраску; печень и селезенка не увеличены.
При транзиторной желтухе новорожденных легкая степень желтушности кожных покровов не распространяется ниже пупочной линии и обнаруживается только при достаточном естественном освещении. При физиологической желтухе самочувствие новорожденного обычно не нарушается, однако при значительной гипербилирубинемии может отмечаться вялое сосание, заторможенность, сонливость, рвота.
У здоровых новорожденных возникновение физиологической желтухи связывается с временной незрелостью ферментных систем печени, поэтому не считается патологическим состоянием. При наблюдении за ребенком, организации правильного вскармливания и ухода проявления желтухи стихают самостоятельно к 2-хнедельному возрасту новорожденных.
Желтуха недоношенных новорожденных характеризуется более ранним началом (1–2 сутки), достижением пика проявлений к 7 суткам и стиханием к трем неделям жизни ребенка. Концентрация непрямого билирубина в крови недоношенных выше (137-171 мкмоль/л), его прирост и снижение происходит медленнее. Вследствие более длительного созревания ферментных систем печени у недоношенных детей создается угроза развития ядерной желтухи и билирубиновой интоксикации.
Наследственные желтухи
Наиболее распространенной формой наследственной конъюгационной желтухи новорожденных является конституциональная гипербилирубинемия (синдром Жильбера). Данный синдром встречается в популяции с частотой 2-6%; наследуется по аутосомно-доминантному типу. В основе синдрома Жильбера лежит дефект активности ферментных систем печени (глюкуронилтрансферазы) и, как следствие, - нарушение захвата билирубина гепатоцитами. Желтуха новорожденных при конституциональной гипербилирубинемии протекает без анемии и спленомегалии, с незначительным подъемом непрямого билирубина.
Наследственная желтуха новорожденных при синдроме Криглера-Найяра связана с очень низкой активностью глюкуронилтрансферазы (II тип) или ее отсутствием (I тип). При I типе синдрома желтуха новорожденных развивается уже в первые дни жизни и неуклонно нарастает; гипербилирубинемия достигает 428 мкмоль/л и выше. Типично развитие ядерной желтухи, возможен летальный исход. II тип синдрома, как правило, имеет доброкачественное течение: неонатальная гипербилирубинемия составляет 257-376 мкмоль/л; ядерная желтуха развивается редко.
Желтуха при эндокринной патологии
Обычно возникает у детей с врожденным гипотиреозом в связи с дефицитом гормонов щитовидной железы, нарушающим созревание фермента глюкуронозилтрансферазы, процессы конъюгации и экскреции билирубина. Желтуха при гипотиреозе выявляется у 50-70% новорожденных; проявляется на 2-3-й сутки жизни и сохраняется до 3-5 месяцев. Кроме желтухи, у новорожденных отмечается вялость, пастозность, артериальная гипотония, брадикардия, грубый голос, запоры.
Ранняя желтуха может возникать у новорожденных, матери которых страдают сахарным диабетом, вследствие гипогликемии и ацидоза. Проявляется затяжным желтушным синдромом и непрямой гипербилирубинемией.
Желтуха у новорожденных с асфиксией и родовой травмой
Гипоксия плода и асфиксия новорожденных задерживают становление ферментных систем, следствием чего является гипербилирубинемия и ядерная желтуха. Различные родовые травмы (кефалогематомы, внутрижелудочковые кровоизлияния) могут являться источниками образования непрямого билирубина и его усиленного проникновения в кровь с развитием желтушного окрашивания кожи и слизистых. Выраженность желтухи новорожденных зависит от тяжести гипоксически-асфиксического синдрома и уровня гипербилирубинемии.
Прегнановая желтуха
Синдром Ариеса, или желтуха детей, находящихся на естественном вскармливании, развивается у 1-2% новорожденных. Может возникать на первой неделе жизни ребенка (ранняя желтуха) либо на 7-14 день (поздняя желтуха новорожденных) и сохраняться 4-6 недель. Среди возможных причин прегнановой желтухи новорожденных называют присутствие в молоке материнских эстрогенов, препятствующих связыванию билирубина; неустановившуюся лактацию у матери и относительное недоедание ребенка, вызывающие обратное всасывание билирубина в кишечнике и его поступление в кровяное русло и др. Считается, что факторами риска желтухи у новорожденных, находящихся на грудном вскармливании, служат позднее (позже 12ч жизни) отхождение мекония, задержка пережатия пуповины, стимуляция родов. Течение такого вида желтухи новорожденных всегда доброкачественно.
Ядерная желтуха и билирубиновая энцефалопатия
При прогрессирующем повышении концентрации непрямого билирубина в крови может происходить его проникновение через гематоэнцефалический барьер и отложение в базальных ядрах головного мозга (ядерная желтуха новорожденных), обусловливающее развитие опасного состояния - билирубиновой энцефалопатии.
На первом этапе в клинике преобладают признаки билирубиновой интоксикации: вялость, апатия, сонливость ребенка, монотонный крик, блуждающий взгляд, срыгивания, рвота. Вскоре у новорожденных появляются классические признаки ядерной желтухи, сопровождающиеся ригидностью затылочных мышц, спастичностью мышц тела, периодическим возбуждением, выбуханием большого родничка, угасанием сосательного и других рефлексов, нистагмом, брадикардией, судорогами. В этот период, который длится от нескольких дней до нескольких недель, происходит необратимое поражение ЦНС. В течение последующих 2-3 месяцев жизни в состоянии детей наблюдается обманчивое улучшение, однако уже на 3-5 месяце жизни диагностируются неврологические осложнения: ДЦП, ЗПР, глухота и т. д.
Диагностика желтухи новорожденных
Желтуха выявляется еще на этапе пребывания ребенка в родильном доме врачом-неонатологом или педиатром при посещении новорожденного вскоре после выписки.
Для визуальной оценки степени желтухи новорожденных используется шкала Крамера.
- I степень – желтушность лица и шеи (билирубин 80 мкмоль/л)
- II степень – желтушность распространяется до уровня пупка (билирубин 150 мкмоль/л)
- III степень - желтушность распространяется до уровня коленей (билирубин 200 мкмоль/л)
- IV степень - желтушность распространяется на лицо, туловище, конечности, за исключением ладоней и подошв (билирубин 300 мкмоль/л)
- V - тотальная желтушность (билирубин 400 мкмоль/л)
Необходимыми лабораторными исследованиями для первичной диагностики желтухи новорожденных являются: билирубин и его фракции, общий анализ крови, группа крови ребенка и матери, тест Кумбса, ПТИ, общий анализ мочи, печеночные пробы. При подозрении на гипотиреоз необходимо определение тиреоидных гормонов Т3, Т4, ТТГ в крови. Выявление внутриутробных инфекций осуществляется методом ИФА и ПЦР.
В рамках диагностики механических желтух новорожденным проводится УЗИ печени и желчных протоков, МР-холангиография, ФГДС, обзорная рентгенография брюшной полости, консультация детского хирурга и детского гастроэнтеролога.
Лечение желтухи новорожденных
Для предотвращения желтухи и уменьшения степени гипербилирубинемии все новорожденные нуждаются в раннем начале (с первого часа жизни) и регулярном грудном вскармливании. У новорожденных с неонатальными желтухами частота рекомендуемых кормлений грудью составляет 8–12 раз в сутки без ночного перерыва. Необходимо увеличение суточного объема жидкости на 10-20% по сравнению с физиологической потребностью ребенка, прием энтеросорбентов. При невозможности оральной гидратации проводится инфузионная терапия: капельное введение глюкозы, физ. раствора, аскорбиновой кислоты, кокарбоксилазы, витаминов группы В. С целью повышения конъюгации билирубина новорожденному с желтухой может назначаться фенобарбитал.
Самым эффективным методом лечения непрямой гипербилирубинемии является фототерапия в непрерывном или прерывистом режиме, способствующая переводу непрямого билирубина в водорастворимую форму. Осложнениями фототерапии могут являться гипертермия, дегидратация, ожоги, аллергические реакции.
При гемолитической желтухе новорожденных показано заменное переливание крови, гемосорбция, плазмаферез. Все патологические желтухи новорожденных требуют незамедлительной терапии основного заболевания.
Прогноз желтухи новорожденных
Транзиторная желтуха новорожденных в подавляющем большинстве случаев проходит без осложнений. Однако нарушение механизмов адаптации может привести к переходу физиологической желтухи новорожденных в патологическое состояние. Наблюдения и доказательная база свидетельствуют об отсутствии взаимосвязи вакцинации от вирусного гепатита В с желтухой новорожденных. Критическая гипербилирубинемия может привести к развития ядерной желтухи и ее осложнений.
Дети с патологическими формами неонатальной желтухи подлежат диспансерному наблюдению участкового педиатра и детского невролога.
Гепатит В у детей – инфекционное поражение печеночной паренхимы, вызываемое гепатотропным вирусом типа В. Специфические проявления гепатита В у детей развиваются в желтушном периоде, когда появляется потемнение мочи, обесцвечивание кала, желтая окраска глазных склер, слизистых и кожных покровов, тяжесть и боль в правом подреберье. Диагностика гепатита В у детей проводится на основании клинико-лабораторных данных (симптоматики, биохимического анализа крови, определения маркеров). Базовая терапия гепатита В у детей включает диету, интерферонотерапию, дезинтоксикационную терапию, назначение гепатопротекторов, сорбентов, витаминов; в тяжелых случаях – плазмаферез и гемосорбцию.
Общие сведения
Гепатит В у детей (парентеральный или сывороточный гепатит) – специфическое вирусное воспаление печени, протекающее в острой или хронической форме. Возбудителем гепатита В у детей является ДНК-содержащий вирус, высоко патогенный и чрезвычайно устойчивый к воздействиям окружающей среды. При инфицировании ребенка вирусом гепатита В в перинатальном периоде или грудном возрасте вероятность хронического поражения печени возрастает до 70-90%. У 20-35% людей, инфицированных гепатитом В в детстве, в дальнейшем развивается цирроз печени или первичная гепатоцеллюлярная карцинома. Профилактика и повышение эффективности лечения гепатита В у детей служит одной из приоритетных задач педиатрии.

Причины гепатита В у детей
Гепатит В у детей является типичной антропонозной инфекцией; источником заражения выступают как больные люди, так и вирусоносители. Основными путями инфицирования детей гепатитом В служат трансплацентарный (внутриутробное заражение), интранатальный (в процессе родов), постнатальный (послеродовый).
Трансплацентарный путь передачи реализуется в 6-8 % всех зафиксированных случаев. Особенно часто инфицирование плода происходит на фоне фетоплацентарной недостаточности и отслойки плаценты. Внутриутробное инфицирование плода вирусом гепатита В грозит преждевременными родами. Интранатальная передача вируса гепатита В у детей (около 90%) обусловлена контактом ребенка с биологическими жидкостями и кровью инфицированной матери при прохождении по родовым путям. Постнатальное заражение ребенка происходит в процессе кормления грудью или ухода за младенцем: при нарушении целостности кожи и слизистых оболочек у ребенка, тесном контакте с инфицированной матерью, выделении вируса с кровью из трещин сосков.
В более старшем возрасте заражение детей гепатитом В может происходить при использовании общих полотенец, мочалок, зубных щеток и др. предметов гигиены, а также половым путем (у подростков). Не исключается возможность инфицирования детей гепатитом В при проведении гемотрансфузии, инвазивных лечебно-диагностических процедур. Риск развития гепатита В повышен у детей, находящихся на почечном диализе. Высока вероятность инфицирования среди подростков-наркоманов, использующих общие иглы и шприцы.
Незрелость иммунной системы детей обусловливает быстрое распространение вируса гепатита В через жидкие среды организма и поражение паренхимы печени. Обычно острая форма гепатита В у детей протекает быстро и заканчивается выздоровлением с выработкой стойкого пожизненного иммунитета к вирусу. При латентном, бессимптомном течении гепатита В у детей во взрослом возрасте может быть случайно выявлено рубцовое изменение ткани печени. Дети с хроническим гепатитом В являются пожизненными вирусоносителями.
Симптомы гепатита В у детей
Циклическое течение гепатита В у детей включает инкубационный (латентный), преджелтушный, желтушный периоды и период реконвалесценции.
Продолжительность инкубационного периода составляет 2-4 месяца и определяется инфицирующей дозой, путем заражения и возрастом ребенка. В случае переливания инфицированных компонентов крови длительность латентного течения гепатита В у ребенка уменьшается до 1,5-2 месяцев, при других путях заражения может увеличиваться до 4-6 месяцев. Чем меньше возраст ребенка, тем непродолжительнее инкубационный период. На данном этапе клинические проявления гепатита отсутствуют, однако в конце периода в крови обнаруживаются маркеры гепатита В (НВsAg, НВeAg, анти-НВсAg IgM) и высокая активность печеночных ферментов.
В преджелтушном периоде, который длится от нескольких часов до 2-3 недель, преобладает общая инфекционная астения (слабость, вялость), миалгии и артралгии, кожные высыпания, абдоминальный синдром, срыгивания, рвота, снижение аппетита, метеоризм, понос. Иногда первыми клиническими признаками гепатита В у детей служат потемнение мочи и обесцвечивание кала. В крови отмечается повышенный уровень трансаминаз и прямого билирубина, обнаруживается ДНК вируса.
Период желтухи при гепатите В у детей может длиться от 7-10 дней до 1,5-2 месяцев. Появлению желтухи во всех случаях предшествует изменение цвета мочи и кала. Интенсивность желтушного окрашивания кожи и видимых слизистых оболочек нарастает в течение 7 дней и сохраняется еще 1-2 недели. В отличие от гепатита А, при гепатите В с появлением желтухи обще состояние не улучшается, а интоксикационный синдром, напротив, усиливается: температура тела повышается до 38°С, нарастает вялость, заторможенность, адинамия. У детей с гепатитом В может отмечаться появление пятнисто-папулезной сыпи на коже, артериальная гипотония, увеличение размеров печени, иногда – селезенки. На высоте желтушного периода в крови регистрируется максимальная активность трансаминаз, снижение ПТИ, гипоальбуминемия.
При благоприятном течении гепатита В у детей заболевание оканчивается периодом реконвалесценции, который продолжается 3-4 месяца. Постепенно исчезает желтуха, нормализуется аппетит, сон, активность, показатели крови. Гепатит В у детей может иметь острое (до 3 мес.), затяжное (до 6 мес.) и хроническое (более 6 мес.) течение.
У грудных детей преобладают среднетяжелые и тяжелые формы гепатита В, возможны летальные исходы вследствие злокачественного течения заболевания. В последнем случае у детей быстро нарастает картина печеночной энцефалопатии, печеночной недостаточности, развивается печеночная кома.
Диагностика гепатита В у детей
Постановке обоснованного диагноза способствует осмотр ребенка педиатром и детским инфекционистом, анализ сведений о развитии и течении заболевания (цикличность, характерная симптоматика), эпидемиологический анамнез (предшествующие гемотрансфузии, инъекции, инвазивные манипуляции, операции) и т. п.
Основная роль в диагностике гепатита В у детей принадлежит лабораторным методам: обнаружению маркеров (HBsAg, HBeAg, анти-HBs, анти-НВе, анти-НВс), изменению биохимических показателей крови (повышению уровня билирубина и увеличению активности трансфераз).
При подозрении на гепатит В у детей в преджелтушном периоде следует исключить грипп, ОРВИ, пищевые токсикоинфекции, артрит; в желтушном периоде - вирусные гепатиты А, С, Е, желтую лихорадку, инфекционный мононуклеоз, цитомегаловирусную инфекцию, синдром Жильбера, ЖКБ, холангит, панкреатит, цирроз печени и пр. С целью дифференциальной диагностики дополнительно проводятся МР холангиография, УЗИ печени и желчного пузыря, сцинтиграфия печени, пункционная биопсия печени.
Лечение гепатита В у детей
Дети с диагностированным гепатитом В подлежат госпитализации в инфекционное отделение. В течение всего желтушного периода показан постельный режим, затем – щадящий режим. Назначается диета (стол №5 по Певзнеру) с преобладанием молочно-растительной, механически и химически щадящей пищей, обильное питье.
Базисная лекарственная терапия гепатита В у детей включает витамины групп В, С, А, Е; спазмолитики (папаверин, дротаверин), гепатопротекторы, желчегонные средства. При тяжелых формах гепатита В у детей показаны интерфероны, дезинтоксикационная терапия, трансфузии плазмы и альбумина, при необходимости - глюкокортикоиды, гепарин, мочегонные препараты, плазмаферез, гемосорбция.
Диспансерное наблюдение реконвалесцентов проводится в течение 1 года (каждые 3 месяца) с осмотром кожи и видимых слизистых, определением размеров печени и селезенки, оценкой цвета мочи и кала, определением лабораторных показателей. Детям, перенесшим гепатит В, рекомендуется санаторное лечение в учреждениях гастроэнтерологического профиля.
Прогноз и профилактика гепатита В у детей
Типичные формы гепатита В у детей, как правило, заканчиваются выздоровлением. Переход в хроническую форму отмечается в 2-18% случаев. Перенесенный в детстве гепатит В сопровождается формированием стойкого пожизненного иммунитета.
Осложнениями гепатита В у детей могут являться хронический гепатит или цирроз печени, резко повышающие риски развития гепатоцеллюлярной карциномы во взрослом возрасте. При злокачественном течении гепатита В у детей летальность крайне высока (75%).
Самым надежным способом профилактики гепатита В у детей является вакцинация, которая осуществляется трехкратно: в первые сутки после рождения ребенка, 1 и 6 месяцев жизни рекомбинантными вакцинами Регевак, Энджерикс В, Эувакс В, Комбиотех и др. Вакцинация против гепатита В обеспечивает 95% защиту от инфекции на 15 лет.
Неспецифическая профилактика гепатита В у детей предполагает использование одноразового медицинского инструментария, тщательную обработку и стерилизацию многоразовых инструментов, обследование доноров, проведение трансфузионной терапии по строгим показаниям.
Неонатальный гепатит у детей: причины, диагностика
Заболевание характеризуется развитием воспаления в печени. Во многих случаях какой-либо причины выявить не удаётся. В отличие от билиарной атрезии у детей с неонатальным гепатитом часто наблюдают ЗВУР и гепатоспленомегалию при рождении. При биопсии печени в ряде случаев выявляют только неспецифические изменения.
Недостаточность а1-антитрипсина как причина неонатального гепатита. Недостаточность a1-антитрипсина может проявляться поражением печени у детей (в том числе грудного возраста) и эмфиземой лёгких у взрослых. Это аутосомно-рецессивное заболевание, частота которого в Великобритании составляет 1 случай на 1000-2000. Существует несколько фенотипов ингибитора протеаз (Pi), кодирующий их ген локализуется на хромосоме 14. Болезнь печени ассоциирована с фенотипом PiZZ.
У детей заболевание чаще всего проявляется затяжной неонатальной желтухой, в некоторых случаях также развивается геморрагический синдром (в том числе внутричерепные кровоизлияния), обусловленный дефицитом витамина К (особенно у детей, находящихся на грудном вскармливании). Выявляют гепатомегалию, по мере развития цирроза печени и портальной гипертензии развивается спленомегалия. Для подтверждения диагноза определяют концентрацию а1-антитрипсина в плазме крови и его фенотип.
Приблизительно у 30% детей симптоматика разрешается, у остальных развивается хроническое поражение печени, которое в части случаев приводит к циррозу печени и портальной гипертензии, что обусловливает необходимость трансплантации печени. Значимые поражения лёгких у детей не наблюдают. Недостаточность а1-антитрипсина можно диагностировать в антенатальном периоде.

Галактоземия как причина неонатального гепатита. Заболевание наблюдают редко (1 случай на 40 000). Характерны недостаточная прибавка массы тела, рвота, желтуха и гепатомегалия при грудном вскармливании. При отсутствии лечения неизбежно развиваются хроническая печёночная недостаточность, катаракта и задержка развития. В некоторых случаях наблюдают быстро прогрессирующее течение заболевания с летальным исходом, характеризующееся развитием шока, геморрагического и ДВС-синдрома, часто вследствие сепсиса, вызванного грамотрицательными бактериями.
В качестве скрининга на галактоземию у новорождённых с затяжной желтухой используют тест-восстанавливающие субстанции в моче. Диагноз подтверждают с помощью определения активности галактозо-1-фосфатуридилтрансферазы в эритроцитах. Диета с исключением галактозы позволяет предупредить прогрессирование поражения печени, но в дальнейшем могут развиться яичниковая недостаточность и нарушения обучения.
Другие причины кнеонатального гепатита. Неонатальный гепатит может развиваться при тирозинемии 1-го типа, муковисцидозе, болезнях накопления липидов и гликогена, пероксисомных болезнях, а также иногда ассоциируется с парентеральным питанием.
Синдром Аладжила — аутосомно-доминантное заболевание. Характерные признаки включают треугольное лицо, аномалии скелета, периферический стеноз лёгочной артерии, почечные тубулярные нарушения, аномалии глаз, гипоплазию внутрипечёночных жёлчных протоков, проявляющуюся выраженным зудом и нарушением физического развития. Прогноз вариабельный, 50% детей доживают до зрелого возраста без трансплантации печени.
Прогрессирующий семейный внутрипечёночный холестаз (PFIC) — гетерогенная группа холестатических расстройств, связанных с дефектами переносчика жёлчных кислот. Клинические проявления включают желтуху, зуд, нарушение физического развития, диарею и поражение печени. Прогноз вариабельный, в части случаев может потребоваться трансплантация печени.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

