Фетальный гепатит у новорожденных клинические рекомендации
Обновлено: 24.04.2024
Для цитирования: Московская И.А., Карпова З.С., Наумова В.А. и др. Перинатальный гепатит В и С - проблемы диагностики, лечения и профилактики. РМЖ. 2003;16:909.
Центр детской гепатологии, Тула
П еринатальная передача вирусов гепатитов В (HBV) и С (HCV) от матери ребенку может реализоваться пренатально (трансплацентарно), интранатально (во время родов) или постнатально – во время ухода за новорожденным [11].
Большинство проведенных в этой области исследований посвящено изучению риска инфицирования детей, родившихся у больных острой и хронической формами гепатитов, а также носителей различных маркеров вирусов [6, 12].
Клинические проблемы диагностики, лечения и исходов перинатального инфицирования, а также их связь с выраженностью проявлений гепатита у матери однозначного решения пока не получили. Р.Ю. Кольнер отмечала трудность дифференциальной диагностики гепатита у детей грудного возраста, что наряду с отсутствием настороженности врачей, нечеткостью клинических проявлений приводит к поздней госпитализации [5].
Наблюдение в динамике за пациентами, поступавшими в Детскую инфекционную больницу г. Тулы в первые месяцы после рождения, позволило нам накопить определенный опыт и оценить необычайную сложность для повседневной клинической практики проблем диагностики, лечения и профилактики перинатального инфицирования вирусами гепатитов [8].
Задачи настоящего исследования включают вопросы:
– Клинические проявления и исходы перинатальной HBV–инфекции.
– Частота перинатальной передачи младенцам HCV–инфекции и длительность циркуляции у них материнских специфических антител.
– Клинические проявления и исходы перинатальной HCV–инфекции.
– Клиническая эффективность интерферонотерапии при перинатальном инфицировании вирусами гепатитов В и С.
– Иммунологическая эффективность вакцины Engerix–B у рожденных женщинами с HBs –антигенемией.
По данным В.Ф. Учайкина с соавт. перинатальная инфекция HBV протекает в двух вариантах: преимущественно как персистентная малосимптомная инфекция с формированием так называемого первично–хронического гепатита и очень редко как манифестная острая циклическая инфекция. При манифестном врожденном гепатите В с рождения появляется выраженная желтуха, интенсивность которой быстро нарастает и продолжается от 2–3 недель до 2–3 месяцев [9]. У всех 42 детей, родившихся в Москве у женщин с персистирующей HBs–антигенемией и обследованных в динамике в клинике НИИ вирусологии, желтуха отсутствовала, клиническая симптоматика была скудной, гиперферментемия незначительной и не во вех случаях, HBs–антигене мия была транзиторной (максимальный период обнаружения HBsAg в крови – 144 дня) [11].
Среди наших пациентов перинатальный гепатит В диагностирован у 13 детей, в том числе у 2 завершивших курс вакцинопрофилактики против гепатита В. Матери 9 из них перенесли во время беременности острый вирусный гепатит В с исходом в выздоровление, у 4 диагностирован ХГВ.
Один ребенок, мама которого болела в 3 триместре беременности, в возрасте 3 месяцев был госпитализирован в отделение реанимации с клиникой фульминантного гепатита В, с летальным исходом. У 12 больных сформировался первично–хронический гепатит В. При оценке степени активности и стадии процесса мы использовали классификацию хронического гепатита у детей, предложенную В.Ф. Учайкиным с соавт [10]. Впервые госпитализированы в возрасте от 24 дней до 11 месяцев 7 больных, остальные в более старшем возрасте. Длительность наблюдения с момента госпитализации за 4 детьми полтора года, за двумя – 3,5 года, за шестью – 5–6 лет. Поводом для направления в стационар семи из них были гепато–лиенальный синдром, явления интоксикации, отставание в физическом развитии, изменения функции почек, пяти – обнаружение HBsAg при обследовании в связи с HBs–антигенемией у мамы во время беременности. При поступлении общее состояние этих 12 больных расценивалось как средней тяжести, отмечались плотная консистенция и увеличение размеров печени (на 2–6 см), у 7 – увеличение селезенки. Желтухи ни у одного ребенка не было. Нарушения функции почек (у 9) при динамическом наблюдении расценены нефрологами, как проявления пиелонефрита или интерстициального нефрита, ассоциированного с HBV–инфекцией. Функциональные пробы печени были изменены у всех больных: повышение активности АЛТ до 2,2–20 норм, АСТ до 2–12, ЩФ до 1,5–2,3 норм, у четырех – холестерина и b -липопротеидов. Диспротеинемия проявлялась повышением в сравнении с возрастной нормой g - и/или b -фракций глобулинов, снижением сулемовой пробы до 1,5–1,6 мл. Маркеры HBV–HBsAg, anti–HB cor Ig M – или Ig M + Ig G выявлены у всех больных, DNA HBV – у 11. При этом HBsAg определялся у всех больных в течение всего периода наблюдения, длительная (более 6 месяцев) репликативная активность HBV выявлена у 9.
При ультразвуковом исследовании печени у всех больных отмечено увеличение размеров, чаще за счет правой доли, повышение эхогенности паренхимы до 21 – 24 (в среднем 23±1,12 при возрастной норме 19,0±0,86), у 8 – закругление контуров, у 5 – уплотнение стенок воротной вены. Повышение гистоплотности паренхимы печени документировалось даже у самых маленьких (в возрасте 1 месяца) пациентов. При динамическом исследовании УЗ – картина соответствовала слабовыраженному фиброзу у 4, умеренному у 5, выраженному у 3 больных. Результаты морфологических исследований биоптатов печени у 3 больных соответствовали ультразвуковым признакам фиброза.
У 5 детей гепатит характеризовался низкой, у 2 умеренной, у 5 – выраженной активностью. У 3 из 5 детей с выраженной активностью ХГВ документировано антенатальное инфицирование, поскольку HBsAg у них был обнаружен на первом месяце жизни как перинатальный исход острого гепатита В у матерей.
Диагноз перинатального гепатита С чрезвычайно ответственен, поскольку определяет тактику ведения пациента, индивидуальный календарь прививок.
Под нашим наблюдением находилось 98 пар – матери, у которых во время беременности обнаружены антитела к вирусу гепатита С (anti–HCV), и их новорожденные дети. Сроки наблюдения – от 1,5 до 7 лет. В анамнезе 22 матерей были инфузии препаратов крови и/или оперативные вмешательства, у 29 парентеральное введение наркотиков, у 42 источник выяснить не удалось, у 5 детей инфицированы оба родителя. У 84 женщин обнаружена RNA HCV, генотипирование проведено у 15, в 11 случаях определен генотип 1b, в 4 – 3a.
На грудном вскармливании находилось 9 детей, материнское молоко в родильном доме получали 11, искусственное вскармливание с рождения – 87. У всех 9 детей, родившихся у женщин, у которых RNA HCV не обнаруживалась, anti–HCV в течение 6 месяцев элиминировали. Из 84 детей, рожденных женщинами, у которых RNA HCV обнаруживалась, у 66 (78,6%) anti–HCV элиминировали в возрасте от 5 до 12 месяцев. У 18 (21,4%) антитела определялись более 1,5 лет. У этих 18 детей была обнаружена RNA HCV – впервые в возрасте до 1 месяца у 6, в 3 месяца у 8 (из них у 2 в 1месяц RNA HCV не обнаружена), в 6–7 месяцев у 4 (из них у 2 в 1 месяц не обнаружена). У 5 детей RNA HCV обнаруживается и в возрасте старше 1 года: у трех в возрасте от 1 до 2 лет, у одного 6 лет, у одного 7,5 лет (срок наблюдения). Кроме того, из 8 родившихся у матерей со смешанной HCV и ВИЧ–инфекцией у 4 anti–HCV элиминировали в возрасте 12–15 месяцев, у 4 (50%) обнаружена HCV RNA, констатирована перинатальная передача HCV. Рожденные женщинами с HCV и ВИЧ–инфекцией наблюдаются с мамами в центре профилактики.
У 4 детей перинатальная HCV–инфекция протекала как острый гепатит, с повышением активности АЛТ и АСТ до 4–10 норм, с гипербилирубинемией, у 2 – за счет конъюгированной фракции, обнаружением anti–HCV и RNA HCV, с затяжным течением и исходом в выздоровление.
У 14 детей перинатальная HCV–инфекция проявлялась умеренной гепатомегалиeй, повышением до 2–6 норм активности АЛТ и АСТ, изменениями количественнных критериев эхографии печени. В этой группе у 5 наступило выздоровление, у 3 стабильная или длительная ремиссия (все 8 пролечены Вифероном), у 6 (в том числе у 3 пролеченных Вифероном) сформировался первично–хронический гепатит С с умеренной активностью.
При диагностировании хронического гепатита В, С проводится лечение Вифероном в суппозиториях, или Рофероном–А, или Интроном А внутримышечно из расчета 3 млн МЕ/м 2 тела [9]. Достоверной разницы частоты достижения ремиссии при монотерапии различными препаратами интерферона получено не было. Необходимость постоянных инъекций, побочные явления и возможные осложения ограничивают применение парентеральных препаратов в педиатрии. К применению у детей раннего возраста разрешен только интерферон a2b в суппозиториях (Виферон) [7].
Доза препарата – 3 млн МЕ/м 2 поверхности тела ребенка. Схема применения: 2 недели ежедневно 2 раза в сутки, затем трижды в неделю курсами от 6 до 9 месяцев. Катамнестическое наблюдение проведено за 10 пролеченными Вифероном по поводу перинатальной HВV и 15 –HСV – инфекцией.
Из 15 перинатально инфицированных HCV, завершивших лечение и обследованных в динамике, у 8 констатировано выздоровление с элиминацией RNA HCV и anti–HCV (в том числе у 3 детей с острым гепатитом). Из 7 больных хроническим гепатитом С (в том числе у одного ребенка как исход острого гепатита) у 4 наступила стабильная или длительная ремиссия, у 3 (20%) остается умеренная активность, постоянно обнаруживается anti–HCV и RNA HCV, прогрессируют признаки фиброза. У всех 3 детей, не получавших Виферон, сформировался хронический гепатит, с умеренной активностью, гепато–лиенальный синдром.
Все мамы при поступлении и в динамике обследованы, консультированы гепатологом, 6 из них – в Клинике им. В.В. Василенко ММА.
Приводим сведения о больной и двух ее детях с перинатальным гепатитом.
Через 5 дней после рождения первого ребенка мама была госпитализирована в инфекционное отделение, где диагностирован острый вирусный гепатит С, тяжелая клиническая форма. В дальнейшем сформировался и до настоящего времени диагностируется ХГС. Постоянно повышена до 2–3 норм активность АЛТ и АСТ. Определяются anti–HCV и RNA HCV, генотип 1b.
Ребенок П.С. родился 6.02.1996 г, в возрасте 8 дней поступил в отделение патологии новорожденных по поводу желтухи. При обследовании – билирубин 196 ммоль/л, реакция прямая. В отделение гепатитов ДИБ госпитализирован в возрасте 3 месяцев по поводу гепато–лиенального синдрома. При обследовании – anti–HCV и RNA HCV обнаружены, активность АЛТ и АСТ повышена до 8 норм. УЗИ – повышена гистоплотность паренхимы до 24 ед, нарушено соотношение долей, признаки фиброза. Получал комлексную терапию, в том числе Виферон курсами (рис. 1). В настоящее время – длительная ремиссия.
Рис. 1. Аминотрансферазы и маркеры HCV у больного перинатальным гепатитом СП.С. родился 6.02.1996 года
Ребенок П.М. родился 5.08.1999 г, с рождения наблюдался, получал Виферон (рис. 2). В возрасте 2 лет 11 месяцев констатировано выздоровление с элиминацией anti–HCV.
Рис. 2. Аминотрансферазы и маркеры HCV у больного перинатальным гепатитом СП.М. родился 5.08.1999 года
Нет оснований для оптимизма в плане безусловного профилактического эффекта от вакцинопрофилактики ГВ у рожденных женщинами с HBs–антигенемией. По данным М.В. Базаровой с соавторами [1], у 15 из 235 (6,4%) обследованных детей, рожденных женщинами с HBs–антигенемией, в возрасте 12 месяцев (перед четвертой прививкой) был обнаружен HBsAg. Harrison T.J. и Zuckerman A.J. пришли к заключению, что в организме матери присутствуют варианты HBV с генетическими отклонениями. Составляя незначительную часть всей вирусной популяции, они ускользают от нейтрализации при элиминации вирусов дикого типа и затем становятся доминирующим вариантом у новорожденных. Ускользающие от поствакцинального иммунитета мутанты были выявлены у вакцинированных и инфицированных детей [13].
Мы проводили вакцинопрофилактику и клинико– лабораторное наблюдение за 57 детьми, рожденным женщинами с HBs –антигенемией. При проведении поствакцинального скрининга HBsAg при отсутствии протективных антител обнаружен у 2. У остальных 55 титр anti–HBs превысил 100 МЕ/л, у 47 (82,4%) – был более 1000 МЕ/л. Представляют интерес результаты динамического определения поствакцинального иммунитета у детей, родившихся у женщин с персистирующей НВs–антигенемией . У 11 обследованных после 1 и 2 введения введения вакцины антитела не обнаруживались. У 20 детей выполнено два исследования по количественному определению anti–НВs – через месяц после третьего введения вакцины (в возрасте 3 месяца) и через месяц после четвертой вакцинации (в возрасте 13 месяцев). После трех иммунизаций отмечена выработка антител. Исследование после четырех введений продемонстрировало значительный бустерный эффект. Концентрацию anti–НВs выше 1000 МЕ/л выявили у 84,6%. Длительность латентной фазы первичного иммунного ответа, во время которой происходит представление антигена иммунокомпетентным клеткам и запуск пролифервации антигенспецифичных клонов клеток–антителпродуцентов, должна учитываться при оценке риска для новорожденного реализации HBV–инфекции.
Таким образом, при перинатальной HBV– инфекции отмечено формирование хронического гепатита у 12, острый фульминантный гепатит у 1 больного.
Перинатальная передача вируса гепатита С документирована у 18 детей, рожденных женщинами с anti–HCV и RNA HCV. Из 18 у 4 перинатальное инфицирование клинически проявилось в форме острого гепатита (у 1 с исходом в ХГ), у 8 протекало с минимальными клиническими проявлениями, у 6 сформировался хронический гепатит с умеренной активностью.
Эффективность Виферона зависела от этиологии гепатита. Применение Виферона оказалось эффективным у 12 (80%) детей с перинатальным инфицированием HCV: у 8 (в том числе 3 с острым гепатитом) наступило выздоровление, у 4 – ремиссия. Из 10 получавших виферон по поводу перинатального первично–хронического гепатита В ремиссия наступила у 4. Отмечена хорошая переносимость и безвредность препарата.
Учитывая угрозу реализации перинатальной HBV– инфекции у рожденных женщинами с HBs –антигенемией, необходимо в процессе вакцинации определять HBsAg, проводить функциональные пробы печени.
Дети, рожденные женщинами с anti–HCV, должны находиться под наблюдением до исключения или верификации перинатальной инфекции с определением активности цитолитических ферментов, anti–HCV и RNA HCV не реже 1 раза в 3 месяца для своевременного назначения лечения.
1. Базарова М.Ф., Шахгильдян И.В., Кузина Л.Е., Чешик С.Г. Вакцинопрофилактика гепатита В среди новорожденных, родившихся у женщин с персистирующей HBs – антитинемией. // Проблемы внутриутробной инфекции плода и новорожденного. : Материалы 111 съезда Российской ассоциации специалистов перинатальной медицины 11–13 сентября 2000 года, г.Москва.– М., 2000,с.241–243.
2. Воробьев А.А. /под редакцией/ Микробиология и иммунология. М,1999,420с
3. Горячева Л.Г., Шилова И.В, Мукомолова А.Л. Диагностика различных форм HCV–инфекции у детей. // Гепатит В,С и D – проблемы диагностики, лечения и профилактики. : Тезисы докладов V научно–практической конференции . М., 2003. с 65–66.
4. Ершова О.Н, Шахгильдян И.В., Кузин С.Н., Самохвалов Е.И, Кириллова И.Л., Розова А.В. Распространенность НС–вирусной инфекции у беременных женщин и частота перинатальной передачи вируса гепатита С. // Гепатит С (Российский консенсус):Тез. Докл. научно–практической конференции 26–27 сентября 2000 г.– М., 2000.– с.38–39
5. Кольнер Р.Ю. Болезнь Боткина у детей. Киев,1965. 255 с
6. Кузин С.Н. Сравнительная эпидемиологическая характеристика гепатитов с парентеральным механизмом передачи возбудителей в России и других странах СНГ: Автореф.дисс. . д–ра мед.наук.– М., 1998. –52с.
7. Малиновская В.В. Новый отечественный комплексный препарат Виферон и его применение в перинатологии и педиатрии при инфекционной патологии. Росс. вестник перинатологии и педиатрии, 1999, т.44, 3, 36–43
8. Московская И.А. HBV – инфекция у детей раннего возраста. //Педиатрия, 2003, № 3, с. 19–23.
9. Учайкин В.Ф., Нисевич Н.И., Чередниченко Т.В. Вирусные гепатиты от А до TTV у детей. М., 2003: 234–242, 418.
10. Учайкин В.Ф., Чередниченко Т.В., Писарев А.Г. Оценка течения хронического гепатита у детей.//Росс. Журнал гастроэнтерологии, гепатологии, колопроктологии, 2000 т Х, №2, с 48–53.
11. Шахгильдян И.В, Михайлов М.И.. Онищенко Г.Г. Парентеральные вирусные гепатиты. М.,2003: 196–203.
12. Шехтман М.М. Острые вирусные гепатиты: перинатальные исходы. // Акушерство и гинекология, 2000, № 4,с 3–6.
13. Harrison TJ, Zuckerman AJ. Hepatitis B virus antibodi escape mutants. // Drug News Perspect 1993; 6; 271–3.
14. Hitoshi Tajiri, Yoko Miyoshi, Shunpel Funato et al. Prospectiv studi of mother – to–infant transmisson of hepatitis C virus. // Pediatr Infect Dis J, 2001; 20:10–14.
Неонатальный гепатит у детей: причины, диагностика
Заболевание характеризуется развитием воспаления в печени. Во многих случаях какой-либо причины выявить не удаётся. В отличие от билиарной атрезии у детей с неонатальным гепатитом часто наблюдают ЗВУР и гепатоспленомегалию при рождении. При биопсии печени в ряде случаев выявляют только неспецифические изменения.
Недостаточность а1-антитрипсина как причина неонатального гепатита. Недостаточность a1-антитрипсина может проявляться поражением печени у детей (в том числе грудного возраста) и эмфиземой лёгких у взрослых. Это аутосомно-рецессивное заболевание, частота которого в Великобритании составляет 1 случай на 1000-2000. Существует несколько фенотипов ингибитора протеаз (Pi), кодирующий их ген локализуется на хромосоме 14. Болезнь печени ассоциирована с фенотипом PiZZ.
У детей заболевание чаще всего проявляется затяжной неонатальной желтухой, в некоторых случаях также развивается геморрагический синдром (в том числе внутричерепные кровоизлияния), обусловленный дефицитом витамина К (особенно у детей, находящихся на грудном вскармливании). Выявляют гепатомегалию, по мере развития цирроза печени и портальной гипертензии развивается спленомегалия. Для подтверждения диагноза определяют концентрацию а1-антитрипсина в плазме крови и его фенотип.
Приблизительно у 30% детей симптоматика разрешается, у остальных развивается хроническое поражение печени, которое в части случаев приводит к циррозу печени и портальной гипертензии, что обусловливает необходимость трансплантации печени. Значимые поражения лёгких у детей не наблюдают. Недостаточность а1-антитрипсина можно диагностировать в антенатальном периоде.

Галактоземия как причина неонатального гепатита. Заболевание наблюдают редко (1 случай на 40 000). Характерны недостаточная прибавка массы тела, рвота, желтуха и гепатомегалия при грудном вскармливании. При отсутствии лечения неизбежно развиваются хроническая печёночная недостаточность, катаракта и задержка развития. В некоторых случаях наблюдают быстро прогрессирующее течение заболевания с летальным исходом, характеризующееся развитием шока, геморрагического и ДВС-синдрома, часто вследствие сепсиса, вызванного грамотрицательными бактериями.
В качестве скрининга на галактоземию у новорождённых с затяжной желтухой используют тест-восстанавливающие субстанции в моче. Диагноз подтверждают с помощью определения активности галактозо-1-фосфатуридилтрансферазы в эритроцитах. Диета с исключением галактозы позволяет предупредить прогрессирование поражения печени, но в дальнейшем могут развиться яичниковая недостаточность и нарушения обучения.
Другие причины кнеонатального гепатита. Неонатальный гепатит может развиваться при тирозинемии 1-го типа, муковисцидозе, болезнях накопления липидов и гликогена, пероксисомных болезнях, а также иногда ассоциируется с парентеральным питанием.
Синдром Аладжила — аутосомно-доминантное заболевание. Характерные признаки включают треугольное лицо, аномалии скелета, периферический стеноз лёгочной артерии, почечные тубулярные нарушения, аномалии глаз, гипоплазию внутрипечёночных жёлчных протоков, проявляющуюся выраженным зудом и нарушением физического развития. Прогноз вариабельный, 50% детей доживают до зрелого возраста без трансплантации печени.
Прогрессирующий семейный внутрипечёночный холестаз (PFIC) — гетерогенная группа холестатических расстройств, связанных с дефектами переносчика жёлчных кислот. Клинические проявления включают желтуху, зуд, нарушение физического развития, диарею и поражение печени. Прогноз вариабельный, в части случаев может потребоваться трансплантация печени.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Врожденные гепатиты у детей – это группа гетерогенных заболеваний, возникающих в результате внутриутробного воздействия патогенных факторов на печень плода. Клинически такие патологии могут проявляться холестатическим синдромом, гепатоспленомегалией, отставанием в психофизическом развитии, неврологической симптоматикой. Лабораторная диагностика основывается на определении уровня АлАТ, АсАТ, билирубина, щелочной фосфатазы, HBs- HBe- HBc-антигенов, РСК, ПЦР, ИФА. Основное лечение – этиотропная терапия, коррекция рациона и водно-электролитного баланса. При необходимости проводится патогенетическая фармакотерапия, хирургическая коррекция или трансплантация печени.
Общие сведения
Врожденные гепатиты у детей – это полиэтиологическая группа острых или хронических воспалительных, дистрофических и пролиферативных заболеваний печени, возникающих во внутриутробном периоде либо во время родов. Суммарная распространенность всех форм составляет 1:5 000-10 000. Среди всех новорожденных порядка 15% инфицируются трансплацентарно и 10% – непосредственно во время родов. Вероятность развития врожденного гепатита у детей зависит от этиологического фактора. При остром вирусном гепатите В она составляет до 90%, при HCV-инфекции – около 5%. Прогностически благоприятными формами врожденных гепатитов у детей считаются холестатические, неблагоприятными – с выраженной гепатоцеллюлярной недостаточностью. Во втором случае летальность на первом году жизни достигает 40%.

Причины врожденных гепатитов у детей
Ведущую роль в этиологии врожденных гепатитов у детей играют вирусные инфекции из группы TORCH: цитомегаловирус, вирусы гепатита В и простого герпеса человека, вирусы Эпштейна-Барр, ECHO, краснухи. Также развитие этой группы патологий могут вызывать перенесенные во время беременности бактериальные и паразитарные заболевания: сифилис, листериоз, туберкулез, токсоплазмоз. К факторам риска со стороны матери относятся бесконтрольный прием медикаментов с гепатотоксическими свойствами, употребление алкоголя, табачных изделий, наркотических веществ. Со стороны ребенка спровоцировать развитие врожденного гепатита у детей могут наследственные ферментопатии: муковисцидоз, галактоземия, дефицит α1-антитрипсина и тирозина. Довольно часто точную этиологию определить не удается. В таком случае устанавливается диагноз идиопатический врожденный гепатит.
Механизм заражения при врожденных гепатитах у детей основывается на трансплацентарной (вертикальной) передаче вирусных или инфекционных агентов от матери к ребенку или их интранатальной аспирации вместе с околоплодными водами. Реже заражение происходит при контакте кожи и слизистых оболочек ребенка с инфицированными родовыми путями. Развитие врожденного гепатита во внутриутробном периоде обычно происходит в III триместре. Риск заражения ребенка в первой половине беременности при остром гепатите В или С составляет до 10%. Воздействие TORCH-инфекций на плод в I-II триместре может привести к спонтанному аборту.
В основе патогенеза врожденных гепатитов у детей помимо структурных изменений гепатоцитов (баллонной или вакуольной дистрофии и др.) лежит холестатический синдром. Его главное морфологическое проявление – имбибиция цитоплазмы желчными пигментами и образование желчных тромбов в начальных отделах внутрипеченочных ходов. Также при врожденных гепатитах у детей возможна гипо- или аплазия внепеченочных отделов желчевыводящих путей, что еще больше усугубляет холестаз.
Симптомы врожденных гепатитов у детей
Первые симптомы бактериальных врожденных гепатитов у детей возникают на 2-3 сутки после рождения. Как правило, отмечается субфебрильная или фебрильная температура тела, диарея, увеличение печени. Часто развиваются пневмонии и инфекционно-токсический шок, появляются признаки энцефалита. В зависимости от возбудителя наблюдаются характерные клинические особенности. Для ЦМВ характерны геморрагии, микроцефалия или гидроцефалия, поражения сетчатки, легких и почек. При краснухе отмечается незаращение артериальной протоки, поражение хрусталика и внутреннего уха. Токсоплазмозный врожденный гепатит у детей сопровождается кожными высыпаниями, гидро- и микроцефалией, хориоретинитом. При герпес-вирусном гепатите, помимо других симптомов, возникают высыпания на коже, слизистых оболочках рта и конъюнктивы, а также геморрагический синдром и ДВС-синдром. При заболевании сифилитической этиологии формируется специфическая сыпь на коже и слизистых, обнаруживается периостит.
Диагностика и лечение врожденных гепатитов у детей
Диагностика врожденных гепатитов у детей включает в себя сбор анамнеза, объективное обследование ребенка, лабораторные анализы и инструментальные методы исследования. Анамнестические данные дают возможность определить, в каком возрасте возникли первые признаки заболевания и какими они были. Также они могут указывать на потенциальные этиологические факторы. При физикальном обследовании педиатром внимательно осматриваются все кожные покровы и видимые слизистые оболочки на предмет желтухи и высыпаний. Оцениваются размеры печени и селезенки, размеры живота, определяются возможные неврологические расстройства.
При врожденных гепатитах у детей наблюдаются неспецифические изменения лабораторных анализов. Наиболее информативными являются печеночные трансаминазы – АлАТ и АсАТ, уровень которых значительно повышается. Также отмечается повышение уровня билирубина (как прямой, так и непрямой фракций), щелочной фосфатазы. При исследовании кала удается выявить отсутствие в нем желчи (ахолия), в моче определяется наличие уробилина. В диагностике врожденных гепатитов у детей крайне важными являются вирусологические и иммунологические исследования, которые позволяют установить этиологию заболевания. Среди них используются определение HBs- HBe- HBc-антигенов в крови, Ig M и G при ИФА, бактериальные посевы крови и ликвора, ПЦР и РСК.
Среди инструментальных методов исследования при врожденных гепатитах у детей информативными могут быть УЗИ и биопсия. При ультразвуковом исследовании определяются структурные изменения паренхимы печени, желчного пузыря и желчевыводящих путей. Пункционная биопсия печени используется с целью подтверждения диагноза на фоне нечеткости клинической картины и лабораторных результатов. По данным цитологического исследования тканей печени при врожденных гепатитах у детей может выявляться фиброз, склероз или некроз печеночных ацинусов, наличие гигантских клеток, лимфо- и плазмоцитарная инфильтрация, имбибиция цитоплазмы желчными пигментами.
Специфическое этиотропное лечение врожденных гепатитов у детей осуществляется в соответствии с их этиологией. При идиопатических формах применяется только патогенетическая и симптоматическая терапия. Проводится коррекция рациона ребенка, при подтверждении острой патологии у матери показан перевод на искусственные смеси, в других случаях – грудное вскармливание, нормализация водно-электролитного баланса. Смеси, применяемые у таких детей, должны быть богатыми на триглицериды, кальций, фосфор, цинк и водорастворимые витамины. При наличии холестатического синдрома в рацион ребенка также включают витамины A и E. Помимо коррекции питания могут назначаться гепатопротекторы, желчегонные, глюкокортикостероиды, интерфероны в зависимости от клинической ситуации. При наличии структурных аномалий или атрезии желчевыводящих путей выполняется их хирургическая коррекция. В тяжелых случаях врожденного гепатита у детей показана трансплантация печени.
Прогноз и профилактика врожденных гепатитов у детей
Прогноз при врожденном гепатите у детей зависит от этиологии, тяжести состояния ребенка и эффективности лечения. Показатель смертности на первом году жизни составляет 25-40%. Сюда преимущественно относятся формы, которые сопровождаются выраженной гепатоцеллюлярной недостаточностью. Еще у 35-40% детей формируются хронические заболевания печени и различные осложнения. Наиболее распространенными среди них являются холестатический синдром, синдромы недостаточности витаминов D, E и K, цирроз печени и фиброзирующий хронический гепатит, портальная гипертензия и острая печеночная недостаточность, энцефалопатия, задержка физического развития.
Специфическая профилактика врожденных гепатитов у детей проводится при выявлении у матери в крови HBs-антигенов или подтверждении диагноза острого гепатита. Таким детям уже в первый день жизни осуществляется вакцинация донорскими иммуноглобулинами и рекомбинантной вакциной. В 1 и 6 месяцев показана повторная вакцинация без иммуноглобулинов. Неспецифические профилактические меры включают в себя контроль над используемой донорской кровью и медицинским инструментарием, антенатальную охрану плода, регулярное посещение женской консультации и прохождение соответствующих обследований во время беременности.
Клиника внутриутробной инфекции. Перинатальные поражения нервной системы у новорожденных
Клинические проявления внутриутробных инфекций полиморфны и зависят не столько от этиологии/сколько от локализации и тяжести процесса. Наиболее типичны задержка внутриутробного развития, гепатомегалия, спленомегалия, желтуха, сыпь, синдром дыхательных расстройств, сердечнососудистая недостаточность и неврологические нарушения. Тяжесть клинических проявлений в большей мере зависит от того, на каких сроках гестации произошло инфицирование.
При развитии инфекции во второй половине беременности заболевание у новорожденного клинически манифестирует как генерализованная инфекция или как поражение отдельных органов. У всех наблюдавшихся больных, госпитализированных в Центр детской гепатогии с перинатальной патологией гепато-билиарной системы, были выражены и поражения центральной нервной системы, по поводу которых они получали специальное обследование и лечение невропатолога.
Последствия перинатальных инфекционных заболеваний ЦНС в плане этиологии и патогенетической основы рассматриваются как:
1) поражения вследствие перенесенного (врожденного) энцефалита, менингита, менингоэнцефалита (TORCH-синдром — цитомегаловирусная инфекция, герпетическая инфекция, токсоплазмоз, врожденная краснуха, ECHO — вирусы и другие, сифилис);
2) поражения ЦНС вследствие перенесенного неонатального сепсиса (менингит, менингоэнцефалит, вентрикулит, энцефалит).
Варианты клинических форм в первой группе — перинатальное постинфекционное (врожденное) органическое поражение мозга с различными клиническими синдромами, исходы которых могут варьировать от легких до тяжелых форм умственной отсталости, ДЦП, симптоматических резистентных эпилепсии. Варианты клинических форм во второй группе — постинфекционная
3) энцефалопатия или постинфекционное поражение ЦНС, проявляющиеся клиническими синдромами гидроцефалии, гиперактивного поведения, нарушений (задержки) моторного развития, очаговых нарушений (парезы и параличи), тяжелых нарушений моторного развития (формирующиеся и сформированные ДЦП) и другими. Исходы поражений ЦНС зависят от ранней диагностики и определяются своевременностью адекватной терапии, могут варьировать от легких функциональных до тяжелых психоневрологигеских нарушений.
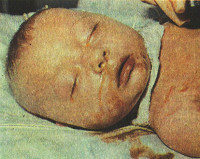
Новорожденный с врожденным токсоплазмозом
Целью исследований К. Е. Скляр с соавторами было выявление клинико-патогенетических закономерностей формирования врожденных пороков развития при внутриутробной инфекции у новорожденных. Проведено обследование 86 новорожденных с врожденными пороками развития различной локализации (у 50 % — врожденные пороки сердца) и клиническими признаками внутриутробной инфекции. Положительные результаты ПЦР получены у 43 (53 %) детей, в том числе РНК краснухи — у 36, ДНК токсоплазмоза — у 2, ДНК хламидий и вируса простого герпеса — в двух случаях, смешанная инфекция — у трех.
Анализ анамнестических данных и клинического течения заболевания не позволил авторам выделить каких-либо симптомов, соответствующих этиологии инфекции. У 30 (34,9%) оперативное лечение проведено в периоде новорожденности, из них — у 8 (9,3 %) в первые сутки после рождения. При морфологическом исследовании интраоперационно полученных биоптатов выявлены нарушения гистоархитектоники, склеротические и дистрофические явления, признаки нарушения локального кровообращения. Развитие указанных процессов в органах, по всей видимости, отражает исход инфекционного процесса.
По мнению авторов, именно склеротические процессы в аномальных тканях могут оказывать влияние на дальнейшее развитие детей и проявляться в различных формах хронических состояний, в том числе хронического гепатита и атрезии желчевыводящих путей при поражении пегени.
Желтуха и поражение печени наряду с поражением центральной нервной системы — ведущие клинические признаки большинства перинатальных инфекций.
В подтверждении диагноза и выяснении этиологии поражения пегени у новорожденных велика ответственность спектра, кагества проведения и клинического толкования результатов лабораторных исследований. Характеристика диагностических методов внутриутробной инфекции, применяемых в повседневной практике, предполагает определение титра специфических антител IgG в динамике (если он не снижается в возрасте от 6 до 12 недель, диагностируется врожденная инфекция). В 6 месяцев титр пассивно приобретенных от матери антител должен быть не выше 1:8.
Однако диагностика иммунохимическими методами у беременных и новорожденных может быть затруднена из-за недостаточной выработки специфических маркеров острой инфекции — антител класса IgM, трансплацентарной передачи антител класса IgG, низкого уровня продукции антигенов. В связи с этим клиническую значимость приобретает метод полимеразной цепной реакции.
Диагностика предполагает использование методов этиологической расшифровки с помощью генодиагностики. В то же время выявление ДНК вируса и тем более микоплазм и хламидий не может служить основанием для верификации этиологии инфекции и назначения лечения. Е. М. Малковой с соавторами из 117 новорожденных с признаками ВУИ у 112 обнаружены ДНК 26 возбудителей. Отмечено значительное количество вирусно-вирусных, микоплазменно-вирусных, вирусно-вирусно-микоплазменных, вирусно-хламидийных и прочих ассоциаций, составивших 22,1% среди положительных результатов исследований.
Клиническая картина не имела специфических признаков, была выраженной дыхательная недостаточность с развитием пневмонии, раннее и затяжное тегение желтухи, неврологические нарушения. Развитие фетального гепатита преобладало при сочетанных инфекциях. Наиболее тяжелое состояние отмечалось у детей при положительных результатах ПЦР сразу в нескольких биоматериалах. Необходимость терапии латентных форм заболеваний у новорожденных при детекции ДНК возбудителей определяется способностью многих из них длительно сохраняться в условиях иммунокомпетентного организма (персистировать с сохранением патогенных свойств).
При изменении иммунного статуса происходит быстрое восстановление вирулентности, которое становится основой рецидивирующего характера хронических инфекций и возможной инвалидизации ребенка. Однако, по данным авторов, результаты ПЦР-иследований у беременных женщин и их детей совпали только в 33,3 % слугаев, поэтому их трактовка, с нашей тогки зрения, должна быть осторожной.
Желтухи новорожденных и их дифференциация
Желтухи — различные состояния новорожденных детей, сопровождающиеся гипербилирубинемией. Визуально желтушная окраска кожи у доношенных новорожденных определяется при уровне билирубина более 85 мкмоль/л, у недоношенных — более 120 мкмоль/л (Н. П. Шабалов.). Выделяют так называемую физиологическую желтуху новорожденных — т. е. транзйторное состояние, пограничное между нормой и патологией и связанное с временной незрелостью ферментных систем печени, и патологическую желтуху (проявление различных заболеваний).
Физиологическая желтуха появляется на 3-5 день жизни, длится не более 7-10 дней у доношенных и не более 10-14 дней у недоношенных новорожденных, не сопровождается нарушением общего состояния ребенка. Уровень неконъюгированного (непрямого) билирубина при этой форме желтухи не превышает 200-222 мкмоль/л. Патологчческие желтухи могут отмечаться при различных заболеваниях новорожденных и иметь различные механизмы происхождения.
Классификация неонатальных желтух может основываться на их патогенезе, но более удобной для практики является классификация по клинико-лабораторным признакам, прежде всего по виду билирубина.
Н.И. Михайловская приводит следующую патогенетическую классификацию:
1. Желтуха новорожденных вследствие повышенной продукции билирубина
а) приобретенные причины:
- ГБН
- Кровоизлияния
- Синдром заглоченной крови
- Полицитемии
- Лекарственный гемолиз
- Повышенная энтеропатогенная циркуляция
- билирубина
- Витамин Е-дефицитная анемия
б) наследственные причины:
- Эритроцитарные мембранонатии
- Эритроцитарные энзимодефициты
- Гемоглобинпатии
2. Желтуха новорожденных вследствие пониженного клиренса билирубина
а) приобретенные причины:
- Дефициты гормонов
- Инфекционные гепатиты
- Токсические гепатиты
- Недоношенность
- ППП
б) наследственные причины:
- Дефект захвата билирубина
- Дефект конъюгации билирубина
- Дефект экскреции билирубина
- Симптоматические
3. Обструктивные (младенческая холангиопатия) причины желтухи новорожденных
а) приобретенные причины:
- Атрезия или гипоплазия внепеченочных желчных путей из-за перинатального гепатита
- Внутрипеченочные атрезии или гипоплазии желчевыводящих путей при перинатальном гепатите разной этиологии
- Стеноз общего желчного протока или его киста
- Холелитиаз
- Сдавление опухолями и др. обр.
- Синдром сгущения желчи
б) наследственные причины:
- Атрезия или гипоплазия внепеченочных желчевыводящих путей фетального типа — синдромальные аномалии желчных путей в сочетании с др. пороками развития
- Семейные несиндромные холестазы
- Симптоматические холестазы при наследственных болезнях
- Холестазы с расширением внутрипеченочных желчных путей
4. Желтухи новорожденных смешанного генеза (с доминированием одного из компонентов)
а) приобретенные причины:
- Сепсис
- Внутриутробные инфекции
б) наследственные причины:
- Транзисторная желтуха новорожденных
- Неонатальная желтуха новорожденных
Н.И. Михайловская приводит следующую клинико-лабароторную классификацию желтух новорожденных:
1. Непрямая гипербилирубинемия
- Гемолитические анемии
- Полицитемия
- Гематомы
- Дети от матерей с СЭУ'.рным диабетом
- Наследственные
- Пониженное удаление билирубина из кишечника и повышенная кишечно-печеночная циркуляция билирубина
2. Прямая гипербилирубинемия
а) Стул обычного цвета:
- Гепатиты
- Наследственные аномалии обмена веществ
б) Обесцвеченный стул
- Полная внутрипеченочная атрезия желчных путей
- Полная атрезия внепеченочных желчных путей
- Гипоплазия внепеченочных желчных путей
- Гепатит без аномалий желчевыводящих путей.
- Синдром сгущения мочи
- Киста желчного протока
- Муковисцидоз и дефицит альфа-1-антитрипсина
Для дифференциальной диагностики многочисленных нозологических форм болезней, сопровождающихся желтухами, необходим тщательный анализ клинико-анамнестических и лабораторных данных, из которых важнейшими являются:
— в семейном анамнезе указания на перенесенную желтуху или анемию у родственников, старших детей;
— в материнском анамнезе указания на острые заболевания во время беременности, на контакты с инфекционными больными, на сахарный диабет, на прием некоторых медикаментов во время беременности (в частности, сульфаниламидов, нитрофурантов, противомалярийных препаратов, в родах — окситоцина), отсроченная перевязка пуповины;
— при осмотре ребенка наличие признаков задержки внутриутробного развития, различных внешних аномалий (стигмы дисэмбриогенеза), кефалогематом, бледности и петехий, изменений области пупка, гепатоспленомегалии;
— из лабораторных показателей — групповая и резус-принадлежность крови матери и ребенка, сведения об обследовании матери на внутриутробные инфекции (сифилис, СПИД, цитомегалию, герпес, хламидии, носительство антигенов гепатита В и С), сведения об обследовании матери на Rh-и групповые антитела (р. Кумбса), у ребенка — уровень фракций билирубина в динамике, показатели гемоглобина, ретикулоцитоза, морфологические особенности эритроцитов, СОЭ, другие особенности клинического анализа крови (к-во лейкоцитов и лейкоцитарная формула, количество тромбоцитов), прямая реакция Кумбса, уровень иммуноглобулинов М (общий и специфические); изменения в анализах мочи, уровень трансаминаз, протеинограмма, уровень глюкозы в крови, наличие внутричерепных кровоизлияний по данным УЗИ, наличие рвоты или задержки стула, окраска стула.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

