Фиксированный вирус бешенства штамм cvs 11
Обновлено: 01.05.2024
Бешенство. Вирус бешенства. Возбудитель бешенства.
Бешенство — остропротекающая болезнь теплокровных животных, характеризующаяся поражением центральной нервной системы. Оно относится к числу наиболее опасных заболеваний человека и животных, которое регистрируется на пяти континентах. Вирус передается главным образом со слюной при укусах.
После размножения в экстраневральных тканях он вскоре достигает спинальных ганглиев и головного мозга, где реплицируется только в определенных группах нейронов. Заболевание, как правило, завершается летальным исходом.
Основную роль в иммунитете у вакцинированных против бешенства играют ВНА, направленные против G белка, который вызывает выраженный В клеточный ответ. Нейтрализующие IgG появляются на 6-8 дни после вакцинации. ВНА достигают титра 1:16— 1:32 на 9-12 дни, а максимального уровня через 3 недели и сохраняются более 6 месяцев. После переболевания у лошадей, КРС и свиней антитела могут сохраняться более 7 лет. Т-клеточный иммунный ответ сохраняется в течение длительного периода.

Несмотря на высокую антигенность белков вируса бешенства, его размножение в инкубационный период заболевания, т.е. в период продвижения вируса от места внедрения до центральной нервной системы, практически остается безответным со стороны иммунной системы организма. Вероятно, в этот период очень мало вирусного антигена достигает иммунной системы, так как основная масса его задерживается в мышечных клетках или в нервных аксонах. Однако ранние стадии инфекции чувствительны к антителам, поэтому эффективна классическая пастеровская вакцинация, особенно в сочетании с применением гипериммунного глобулина. Иммунологическое вмешательство является эффективным в течение первого этапа длительного инкубационного периода между началом репликации вируса в мышечных клетках и проникновением вируса в защищаемое окружение нервной системы.
Блестящим примером применения живой антирабической вакцины для человека явилась вакцина Ферми. Эту вакцину готовили из суспензии мозга овец или коз, инфицированных фиксированным штаммом вируса бешенства. Вирус частично инактивировали добавлением небольшого количества фенола. В дальнейшем для размножения фиксированного штамма вируса использовали мозг зараженных кроликов, новорожденных мышей, а также утиные эмбрионы и культуры клеток (первичные культуры клеток почек новорожденных хомяков, собак, поросят, телят, фибробласты эмбрионов кур; диплоидные клетки обезьян; линию клеток Vero). С использованием различных систем для пассирования и размножения получены разные варианты фиксированного штамма вируса бешенства (CVS, ERA, SAD, PM, HEP, LEP, Kelev, Kissling, Внуково 32). По данным ВОЗ (1992 г.), культуральные вакцины для иммунизации людей являются безопасными и более иммуногенными, чем вакцины из нервной ткани. С целью исключения возможных осложнений по причине использования живого вируса в вакцине для человека, вакцинный вирус стали полностью инактивировать фенолом, формалином или (3- пропиолактоном. В дальнейшем аналогичная рекомендация сделана в отношении вакцин против бешенства животных.
Вакцины, применяемые для профилактики бешенства животных (преимущественно собак и кошек), принципиально не отличаются от вакцин, применяемых людям. Отличие заключается в том, что в ряде стран по экономическим соображениям для иммунизации животных используют живые вакцины из безопасных аттенуированных штаммов вируса бешенства. Для иммунизации собак и кошек в основном применяют инактивированные комбинированные вакцины против нескольких заболеваний.
Современные инактивированные культуральные вакцины и иммуноглобулин против бешенства являются основой борьбы с бешенством людей. Специфическая профилактика бешенства у животных основана на применении безопасных и эффективных живых и инактивированных вакцин. Хотя антирабические вакцины начали применять еще в 1885 г., однако до сих пор остается нерешенным ряд проблем, касающихся профилактики бешенства и борьбы с ним среди животных. Вакцинация векторных домашних и диких животных направлена в первую очередь на охрану здоровья человека. Антирабические вакцины особенно нужны в районах, где бешенство является эндемическим заболеванием диких и домашних плотоядных. Основным резервуаром вируса бешенства в природе являются собаки, лисицы, еноты, скунсы и летучие мыши.
В мире ежегодно более 4 млн людей подвергаются вакцинопрофилактике и около 50000 погибают преимущественно от покусов инфицированными собаками. Специфическая профилактика бешенства людей в основном приходится на Африку, Азию и Южную Америку.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Бешенство. Вирус бешенства. Возбудитель бешенства.
Бешенство — остропротекающая болезнь теплокровных животных, характеризующаяся поражением центральной нервной системы. Оно относится к числу наиболее опасных заболеваний человека и животных, которое регистрируется на пяти континентах. Вирус передается главным образом со слюной при укусах.
После размножения в экстраневральных тканях он вскоре достигает спинальных ганглиев и головного мозга, где реплицируется только в определенных группах нейронов. Заболевание, как правило, завершается летальным исходом.
Основную роль в иммунитете у вакцинированных против бешенства играют ВНА, направленные против G белка, который вызывает выраженный В клеточный ответ. Нейтрализующие IgG появляются на 6-8 дни после вакцинации. ВНА достигают титра 1:16— 1:32 на 9-12 дни, а максимального уровня через 3 недели и сохраняются более 6 месяцев. После переболевания у лошадей, КРС и свиней антитела могут сохраняться более 7 лет. Т-клеточный иммунный ответ сохраняется в течение длительного периода.

Несмотря на высокую антигенность белков вируса бешенства, его размножение в инкубационный период заболевания, т.е. в период продвижения вируса от места внедрения до центральной нервной системы, практически остается безответным со стороны иммунной системы организма. Вероятно, в этот период очень мало вирусного антигена достигает иммунной системы, так как основная масса его задерживается в мышечных клетках или в нервных аксонах. Однако ранние стадии инфекции чувствительны к антителам, поэтому эффективна классическая пастеровская вакцинация, особенно в сочетании с применением гипериммунного глобулина. Иммунологическое вмешательство является эффективным в течение первого этапа длительного инкубационного периода между началом репликации вируса в мышечных клетках и проникновением вируса в защищаемое окружение нервной системы.
Блестящим примером применения живой антирабической вакцины для человека явилась вакцина Ферми. Эту вакцину готовили из суспензии мозга овец или коз, инфицированных фиксированным штаммом вируса бешенства. Вирус частично инактивировали добавлением небольшого количества фенола. В дальнейшем для размножения фиксированного штамма вируса использовали мозг зараженных кроликов, новорожденных мышей, а также утиные эмбрионы и культуры клеток (первичные культуры клеток почек новорожденных хомяков, собак, поросят, телят, фибробласты эмбрионов кур; диплоидные клетки обезьян; линию клеток Vero). С использованием различных систем для пассирования и размножения получены разные варианты фиксированного штамма вируса бешенства (CVS, ERA, SAD, PM, HEP, LEP, Kelev, Kissling, Внуково 32). По данным ВОЗ (1992 г.), культуральные вакцины для иммунизации людей являются безопасными и более иммуногенными, чем вакцины из нервной ткани. С целью исключения возможных осложнений по причине использования живого вируса в вакцине для человека, вакцинный вирус стали полностью инактивировать фенолом, формалином или (3- пропиолактоном. В дальнейшем аналогичная рекомендация сделана в отношении вакцин против бешенства животных.
Вакцины, применяемые для профилактики бешенства животных (преимущественно собак и кошек), принципиально не отличаются от вакцин, применяемых людям. Отличие заключается в том, что в ряде стран по экономическим соображениям для иммунизации животных используют живые вакцины из безопасных аттенуированных штаммов вируса бешенства. Для иммунизации собак и кошек в основном применяют инактивированные комбинированные вакцины против нескольких заболеваний.
Современные инактивированные культуральные вакцины и иммуноглобулин против бешенства являются основой борьбы с бешенством людей. Специфическая профилактика бешенства у животных основана на применении безопасных и эффективных живых и инактивированных вакцин. Хотя антирабические вакцины начали применять еще в 1885 г., однако до сих пор остается нерешенным ряд проблем, касающихся профилактики бешенства и борьбы с ним среди животных. Вакцинация векторных домашних и диких животных направлена в первую очередь на охрану здоровья человека. Антирабические вакцины особенно нужны в районах, где бешенство является эндемическим заболеванием диких и домашних плотоядных. Основным резервуаром вируса бешенства в природе являются собаки, лисицы, еноты, скунсы и летучие мыши.
В мире ежегодно более 4 млн людей подвергаются вакцинопрофилактике и около 50000 погибают преимущественно от покусов инфицированными собаками. Специфическая профилактика бешенства людей в основном приходится на Африку, Азию и Южную Америку.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Бешенство. Вирус бешенства. Свойства возбудителя бешенства. Эпидемиология бешенства.
Бешенство — острая инфекция ЦНС, сопровождающаяся дегенерацией нейронов головного и спинного мозга; летальность при этом заболевании достигает 100%.
Победа над бешенством в результате его профилактики связана с именами Пастёра, Ру и Шамберлана.
Возбудитель бешенства включён в род Lyssavirus семейства Rhabdoviridae. Зрелые вирионы вируса бешенства имеют пулевидную форму и размер 75x180 им; один конец закруглён, другой плоский.
Геном вируса бешенства образует однонитевая несегментированная молекула -РНК. Сердцевина вириона вируса бешенства симметрично закручена внутри оболочки по продольной оси частицы.
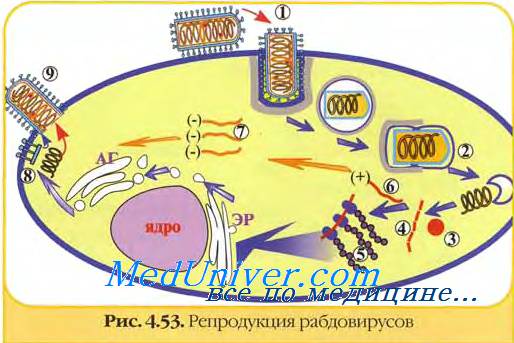
Репродукция вируса бешенства реализуется в цитоплазме клетки. Вирус бешенства малоустойчив во внешней среде и быстро инактивируется под действием солнечного света и высокой температуры.
В трупах животных вирус бешенства может сохраняться до 3~4 мес; чувствителен к действию различных дезинфектантов.
Эпидемиология бешенства
Бешенство распространено повсеместно, исключая островные государства (Англию, страны Карибского бассейна и др.). Бешенство— типичный зооноз; резервуаром возбудителя могут быть практически все млекопитающие (собаки, кошки, крупный рогатый скот, летучие мыши, лисы, волки, грызуны и др.).
Основной путь передачи бешенства — через укус больного животного; также возможно проникновение возбудителя через повреждённые кожные покровы (например, царапины) при ослюнении их больным животным.
В слюне животных вирус бешенства появляется за несколько дней до начала клинических проявлений, что увеличивает риск развития бешенства после укуса до 30-40%.
После проникновения вируса бешенства в ЦНС больного животного риск заражения через укус снижается до 10%.
Выделяют два типа бешенства — бешенство лесное и городское.
• Дикое (лесное) бешенство. Основной резервуар — дикие животные, специфичные для отдельных регионов, например скунсы (США), лисицы (Россия, Северная Америка), летучие мыши-вампиры (страны Карибского бассейна и Южная Америка).
• Городское бешенство. Наибольшую эпидемическую опасность представляют больные собаки (до 90% всех случаев) и кошки. В Нигерии последние передают человеку близкий к бешенству вирус Мокола, вызывающий неврологические заболевания (параличи) с летальным исходом.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Исследовали на модели культур клеток зависимость специфической инфекционной активности вируса бешенства промышленных (фиксированных) штаммов L. Pasteur и CVS от длительности и температуры хранения. Вирусную суспензию накапливали в клеточной культуре / С13 и замораживали при -20 и -80°С. Анализ специфической активности проводили через 1 неделю, 1, 2, 3, 6 и 12 месяцев хранения. Экспериментально установили, что для исследованных штаммов более эффективной для длительного хранения является температура -80°С.
Ключевые слова: вирус бешенства, вируссодержащая суспензия, антирабический иммуноглобулин, антирабическая вакцина, долгосрочное хранение, низкие температуры
The dependence of specific infectious activity on the cell culture model of rabies virus industrial (fixed) strains L. Pasteur and CVS from the duration and storage temperature was investigated. Viral suspension was produced by cell culture / C13 and frozen at -20 and -80°C. Analysis of the specific activity was performed after 1 week, 1, 2, 3, 6 and 12 months of storage. It was experimentally discovered that the temperature -80°C is more effective for storage for the studied strains.
Keywords: rabies virus, virus-containing suspension, rabies immunoglobulin, rabies vaccine, long-term storage, low temperature
Введение
Бешенство является опасным нейроинфекционным заболеванием теплокровных животных (в том числе и человека), которое встречается более чем в 150 странах мира [7, 10]. Возбудителем данного заболевания является РНК-содержащий вирус рода Lyssavirus, семейства Rhabdoviridae, порядка Mononegavirales. Заражение бешенством главным образом происходит через укус, в ходе которого инфекция передаётся со слюной. Основной мишенью вируса бешенства является центральная нервная система (ЦНС). Вирус бешенства является единственным из царства Virae, который поражает всех теплокровных животных с летальностью 100 %. От укусов животных, больных бешенством, ежегодно в мире погибает более 55 000 человек. В связи с этим согласно оценке Всемирной Организации Здравоохранения (ВОЗ) бешенство входит в пятёрку болезней, которые наносят наибольший ущерб человечеству и мировой экономике. Единственным методом борьбы с данным заболеванием являются пред- и постэкспозиционная профилактика, в рамках которой используются антирабические иммуноглобулин (АИГ) и вакцина (в дальнейшем — антирабические препараты) [1, 7, 10, 11].
Для получения антирабических препаратов и контроля их качества используются аттенуированные (или фиксированные) штаммы вируса бешенства, которые получают в ходе воздействия на полевые изоляты мутагенов или других факторов, позволяющих менять свойства вирионов. В отличие от полевых изолятов штаммы фиксированного вируса бешенства могут быть полностью или частично лишены способности к заражению целого организма животного или человека, но сохраняют возможность заражать ткани и клетки при непосредственном контакте. Наиболее распространёнными в производстве антирабических препаратов являются фиксированные штаммы вируса бешенства L. Pasteur и CVS, выделенные более 100 лет назад из полевых изолятов, ослабленные путём пассирования через мозг кроликов и адаптированные к мозгу мышей и клеточным линиям. С 1996 года ВОЗ рекомендует при производстве антирабических препаратов полностью отказаться от использования вируса бешенства, полученного пассированием через мозговую ткань животных, и использовать для накопления вирусной суспензии клеточные культуры [8, 11].
Цель исследования
Цель исследования — экспериментально определить эффективный температурный режим для долгосрочного хранения суспензии вируса бешенства штаммов L. Pasteur и CVS в условиях производства.
Материалы и методы
В качестве субстрата для накопления суспензии вируса бешенства использовали перевиваемую клеточную линию ВНК-21 / C13 (ATCC CCL-10), которая широко применяется для производства культуральной вакцины против бешенства [5, 6, 8, 12]. Клеточную линию накапливали в пристеночном монослое 1 сутки в стерильных пластиковых флаконах (SPL, Германия). В ходе исследования использовали фиксированные штаммы вируса бешенства L. Pasteur (адаптированный к клеточной линии Vero, № 2061 / Vero, 15 пассаж) и CVS (challenge virus standard), рекомендованные ВОЗ для производства АИГ и антирабических вакцин для животных и человека [8, 12]. Штамм L. Pasteur был адаптирован к клеточной линии ВНК-21 / C13 [6] и предоставлен Институтом Пастера (Нови-Сад, Сербия) вместе с технологическим регламентом производства антирабического антигена.
Вирусную суспензию культивировали в течении 4-х суток с момента заражения в поддерживающей среде DMEM (Dulbecco's Modified Eagle's Medium) c 0, 2 % бычьего альбумина (PAA, Австрия) в СО2-инкубаторе (Binder, Германия) при 33ºС и 5 % СО2. Сбор вирусной суспензии проводили на 4 сутки после заражения. Полученную вирусную суспензию центрифугировали при 3000 об/мин 15 минут в рефрижераторной центрифуге (MPW, Польша) при 4ºС для удаления клеточного детрита. Супернатант собирали, добавляли к нему сахарозу с конечной концентрацией 5 %, расфасовывали в пластиковые криопробирки (PAA, Австрия) и замораживали при -20 и -80ºС в морозильных камерах (National Lab, Германия). Контроль температуры, при которой хранили криопробирки, производили с помощью спиртовых термометров [5, 6, 8, 12].

Для определения специфической инфекционной активности вирусной суспензии использовали метод титрации вируса в культуре клеток линии ВНК-21 / C13. Суспензию вируса бешенства размораживали через 1 неделю, 1 , 2, 3, 6 и 12 месяцев хрнения при низких температурах (срок наблюдения) и титровали с коэффициентом разведения 5 на культуре клеток ВНК-21 / C13 в 96-луночных планшетах (SPL, Германия) в 5-ти повторах (n = 5). Культивировали клетки 48 часов в СО2-инкубаторе при 37ºС и 5 % СО2, затем фиксировали монослой клеточной лини охлаждённым при -20ºС ацетоном. Так как промышленные штаммы вируса бешенства не оказывают на клеточные линии цитопатогенного действия, то для определения инфекционной активности вирусной суспензии использовали метод непрямой флуоресценции. Для этого применяли специфические моноклональные антитела к вирусу бешенства, меченные изотиоцинатом флуоресцина (FITC) (Fujirebio, U.S.A.), которыми производили окрашивание клеточного монослоя. Учёт результатов производили с помощью медицинского микроскопа (МИКМЕД-6, ЛОМО, Россия) (увеличение 100×) с люминисцентной насадкой. При микроскопировании учитывали яркое специфическое свечение зелёного цвета, которое свидетельствует о наличии вируса бешенства в клетках, и лунки с таким свечением отмечали как положительные (рисунок 1) [4, 5, 9, 12].
Рисунок 1 — Клетки лини ВНК-21 / С13, инфицированные вирусом бешенства штамма L. Pasteur. Окраска FITC-меченными моноклональными антителами, увеличение 100×
Расчёт титра вируса проводили с помощью формулы Спирмена-Карбера и выражали в десятичном логарифме 50 %-ой фокусформирующей инфицирующей дозы (lg FFD50):

, где
x0 — lg наибольшего разведения, в котором во всех лунках отмечается положительное свечение;
d — lg фактора разведения;
ni — общее количество лунок, приходящихся на каждое разведение титрации вирусной суспензии;
ri — количество положительных лунок в каждом разведении титрации вирусной суспензии [3, 9, 12].
Статистический анализ данных осуществляли с помощью стандартных пакетов компьютерных программ Microsoft Excel-2010 и Past. Вид распределения определяли с помощью W-критерия Шапиро-Уилка, достоверность различий между группами данных рассчитывали с использованием параметрического t-критерия Стьюдента (для групп с нормальным распределением данных). Расхождение считали статистически значимым при p ≤ 0, 05.
Результаты и обсуждение
В ходе проведенных исследований была проанализирована сохранность специфической инфекционной активности суспензии вируса бешенства штаммов L. Pasteur и CVS после хранения при температурах -20 и -80°С через 1 неделю, 1, 2, 3, 6 и 12 месяцев (срок наблюдения). В качестве контроля использовали данные по хранению вируса на протяжении 1-ой недели.

При анализе данных по хранению вирусной суспензии промышленного штамма L. Pasteur при -20ºС были получены следующие результаты. Активность вирусной суспензии через 1 неделю после замораживания при температуре -20°С составила 8,11±0,29 lg FFD50 (n = 5) (рисунок 2). При сравнении данных по специфической активности вируса после 1-ого месяца хранения различия не были статистически значимыми (р ≥ 0, 05). После 2-х месяцев хранения при этой температуре активность вируса данного штамма начала снижаться (р ≤ 0, 05 ). Аналогичные данные были получены при сравнении активности вирусной суспензии после хранения на протяжении 3-х, 6-ти и 12-ти месяцев при температуре -20°С. Различия между данными по специфической активности после указанных сроков хранения были статистически значимы (р ≤ 0, 05). Через 12 месяцев хранения при температуре -20°С активность вируса штамма L. Pasteur составила 4, 75 ± 0, 19 lg FFD50, что на 3, 36 lg FFD50 меньше, чем данные контроля.
Специфическая инфекционная активность вирусной суспензии штамма L. Pasteur через 1 неделю после замораживания при температуре -80°С составила 8, 18 ± 0, 19 lg FFD50 (n = 5) и не изменялась в течение 2-х месяцев (р ≥ 0, 05). Между 2-м и 3-м месяцами хранения при температуре -80°С инфекционная активность вируса начала достоверно снижаться (р ≤ 0, 05 ), как и на протяжении последующего хранения. Через 12 месяцев хранения при температуре -80°С активность вируса штамма L. Pasteur составила 5, 66 ± 0, 29 lg FFD50, что на 2, 52 lg FFD50 меньше, чем данные контроля. Со 2-ого по 12-й месяцы хранения при -80°С показатели инфекционной активности были достоверно выше (р ≤ 0, 05 ), по сравнению с образцами, хранившимися при -20°С.
Активность вирусной суспензии промышленного штамма CVS через 1 неделю после хранения при температуре -20°С составила 6, 78 ± 0, 19 lg FFD50 (n = 5) (рисунок 3) и не изменялась до 2-х месяцев хранения (р ≥ 0, 05). Между 2-м и 3-м месяцами хранения при данной температуре произошло достоверное снижение (р ≤ 0, 05 ), активности, как и на протяжении последующего хранения. Через 12 месяцев хранения при температуре -20°С активность штамма CVS составила 4, 96 ± 0, 29 lg FFD50, что на 1, 82 lg FFD50 меньше, чем специфическая активность вируса при хранении в данном температурном режиме в течение недели.

Активность вирусной суспензии штамма CVS через 1 неделю после замораживания при температуре -80°С составила 6, 78 ± 0, 47 lg FFD50 (n = 5) и не изменялась в течение 6-ти месяцев (р ≥ 0, 05). Достоверное снижение (р ≤ 0, 05) показателя активности вируса произошло между 6-м и 12-м месяцами хранения при данной температуре. После 12 месяцев хранения при температуре -80°С активность вирусной суспензии снизилась на 0,28 lg FFD50 и составила 6, 5 ± 0, 19 lg FFD50 по сравнению с данными контроля. С 3-ого по 12-й месяцы хранения при -80°С показатели инфекционной активности данного штамма были достоверно выше (р ≤ 0, 05 ), по сравнению с образцами, хранившимися при -20°С.
В результате проведенных исследований более низкие результаты сохранности обоих штаммов вируса были получены при хранении вирусной суспензии при температуре -20°С. Это может быть связано с тем, что эвтектическая температура солевых растворов, входящих в состав среды консервирования и ультраструктурных компонентов вирионов находится ниже -20°С, и вирионы подвергаются действию повреждающих факторов, связанных с кристаллизацией жидкой фазы, изменением рН и гиперконцентрацией электролитов [2].
Результаты исследования показали, что фиксированный штамм CVS более устойчив к хранению при низких температурах, чем штамм L. Pasteur. Предположительно, различия криоустойчивости изучавшихся промышленных штаммов вируса бешенства обусловлены особенностями строения их капсидов. Этот вопрос требует отдельного изучения.
Полученные результаты по сохранности вируса бешенства промышленных штаммов в суспензии не соответствуют требованиям производства, так как необходимо сохранение спицефической ативности вируса на протяжении более длительных сроков. Поэтому следует провести исследования по применению различных режимов замораживания вирусной суспензии и использованию различных криозащитных сред. Полученные данные, вероятно, смогут позволить хранить промышленные штаммы вируса бешенства при низких температурах более длительное время без потери их специфической активности.
Читайте также:

