Где осуществляется синтез вирусного белка
Обновлено: 18.04.2024
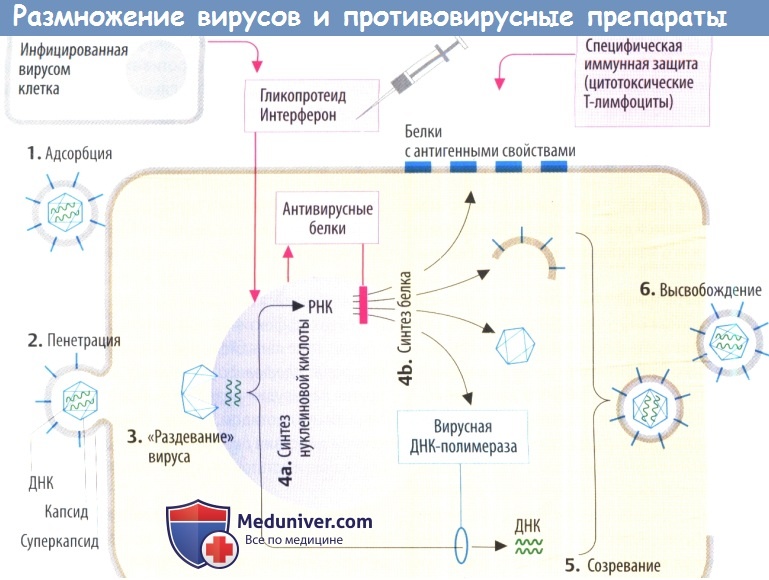
Этап синтеза вирусных компонентов. Синтез вирусных компонентов - эклипс-период.
Вскоре после обнажения вирусного генома происходит уменьшение или исчезновение инфекционности, поскольку вирионов как таковых уже не существует, а инфекционность нуклеиновой кислоты намного меньше инфекционности полных вирионов. Данное явление было названо эклипсом (затмением), а фаза вирусной инфекции с момента адсорбции и до появления в клетке новых инфекционных вирионов — эклипс-фазой, или латентным периодом. При высокой множественности заражения клеток некоторая часть вирионов сохраняет инфекционные свойства в течение всей эклипс-фазы, что зачастую затрудняет определение ее продолжительности.
В течение этого периода происходят все существенные процессы вирусной репродукции, приводящие к образованию вирусных компонентов и формированию нового потомства вирионов. С появлением в клетке первых вновь синтезированных вирионов завершается эклипс-период размножения вируса.
Процессы, происходящие в эклипс-фазе, схематично показаны на рисунке, где в качестве примера представлены основные этапы репликации аденовирусов.
Из представленной схемы видно, что после прикрепления вирион входит в клетку и частично или полностью лишается оболочки, обнажая вирусный геном. Некоторые ранние вирусные гены транскрибируются с образованием мРНК, которые могут затем изменяться различными путями, включая сплайсинг. Ранние мРНК транслируются с образованием трех главных продуктов: белков, которые подавляют или останавливают синтез белков и нуклеиновых кислот; белков, которые регулируют экспрессию вирусного генома; ферментов, необходимых для репликации вирусных нуклеиновых кислот. Вслед за репликацией вирусной нуклеиновой кислоты транскрибируются поздние вирусные гены, продуктами трансляции которых являются в основном структурные вирусные белки, используемые при сборке новых вирионов. Некоторые из них претерпевают посттрансляционные изменения перед включением в структуру вирионов. В каждой инфицированной клетке образуются сотни и тысячи вирионов, которые, освобождаясь, заражают другие клетки.
У большинства ДНК-вирусов транскрипция и репликация ДНК происходит в ядре клетки, с использованием клеточной РНК-полимеразы II и других клеточных ферментов. Большинство РНК-вирусов размножается в цитоплазме, где отсутствуют ферменты, копирующие РНК на РНК-матрице, поэтому вирусный геном должен сам по себе функционировать как мРНК или вирус должен нести свою РНК-полимеразу, чтобы транскрибировать РНК на РНК-геноме.
Синтез вирусных белков происходит только в цитоплазме клетки. В инфицированных клетках вирусные нуклеиновые кислоты и вирусспецифические белки синтезируются в значительно большем количестве, чем включаются в вирионы. Избыточный синтез структурных компонентов при репродукции вирусов является своеобразной платой за паразитизм на генетическом уровне.
Потомство вирионов проявляется спустя определенный период после того, как начал осуществляться синтез составляющих их компонентов. Продолжительность периода от момента инфицирования до появления дочерних вирионов довольно вариабельна и отражает глубокое различие между разными вирусами.
Латентный период мелких вирусов, не имеющих оболочки и содержащих односпиральную РНК, длится примерно 2 часа и является наиболее коротким среди всех известных вирусов животных. ДНК-содержащие вирусы имеют более продолжительный латентный период. Длительный латентный период отмечен также у реовирусов и вируса саркомы Рауса. У простых мелких РНК-содержащих вирусов быстрее протекает не только латентный период, но и весь цикл размножения вируса. Вирусы, геном которых выполняет функции мРНК, имеют более короткий репликативный цикл, чем вирусы, у которых функции мРНК выполняет не вирионная РНК, а комплементарная ей минус-нить.
Размножение ДНК-содержащих вирусов может продолжаться даже через 24 часа после заражения. Причины, определяющие длительность цикла размножения разных вирусов, не выяснены. Возможно, что это связано с более сложной последовательностью событий при репродукции крупных, сложно устроенных вирусов.
Укорочение латентного периода при высокой множественности заражения было обнаружено у различных РНК и ДНК вирусов и, возможно, связано с ускорением процесса образования ферментов, участвующих в синтезе нуклеиновой кислоты. При высокой множественности заражения не исключается также роль капсидных белков в ускорении начала цикла репродукции.
Число инфекционных вирусных частиц, образуемых в одной клетке, зависит от типа вируса, и количество их варьирует очень широко. Интересно, что на долю вирусспецифических продуктов приходится от 0,1 до 5% массы клетки животного.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лекарства для лечения вирусных инфекций
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.
II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.
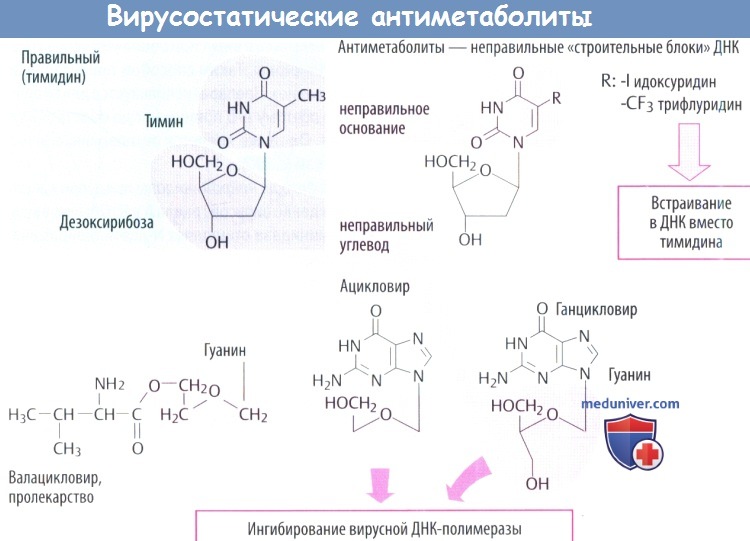
в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
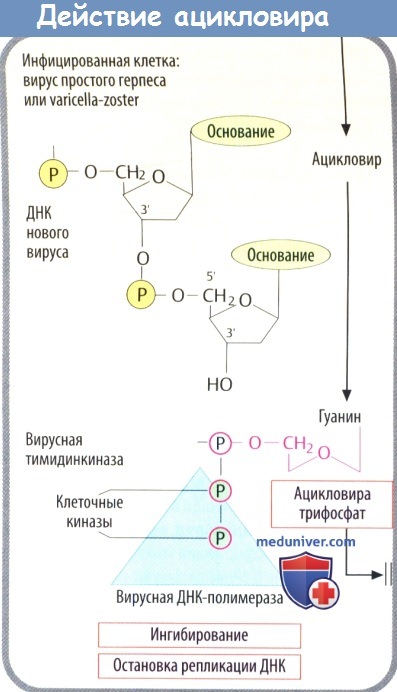
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З'-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.
г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).
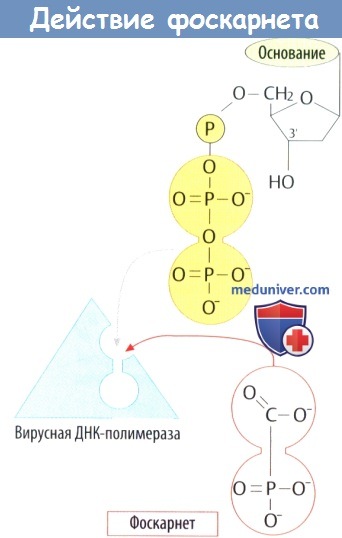
е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
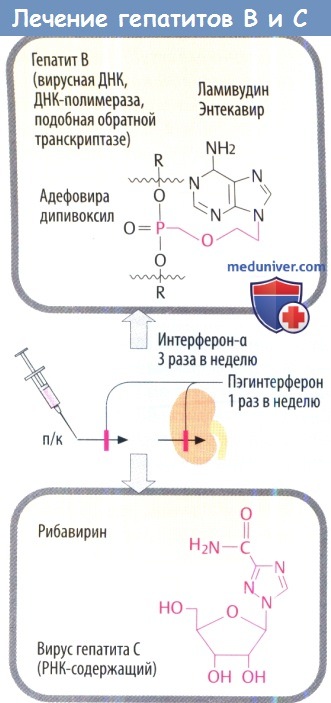
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.
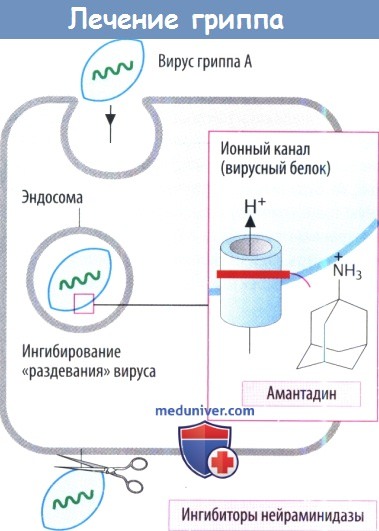
Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Одни вирусы способны интегрироваться в геном клетки-мишени и таким образом оставаться во всех дочерних клетках, которые будут в будущем получены после ее деления. К таким вирусам относятся гаммаретровирусы и лентивирусы. Другие делать этого не умеют (например, адено- и аденоассоциированные вирусы). Но для производства белков и репликации (размножения) все они используют клетку и ее синтетический аппарат.
Как это работает?
Для того чтобы вирус мог проникнуть в клетку, белки его оболочки должны связаться с мембранными белками клетки-мишени. Важно отметить, что проникает вирус только в те клетки, которые могут в дальнейшем помочь его репликации. Вирус ВИЧ живет в клетках иммунной системы, вирус гепатита С — в клетках печени. Есть особые вирусы, которые поражают только растения или даже только бактерии.
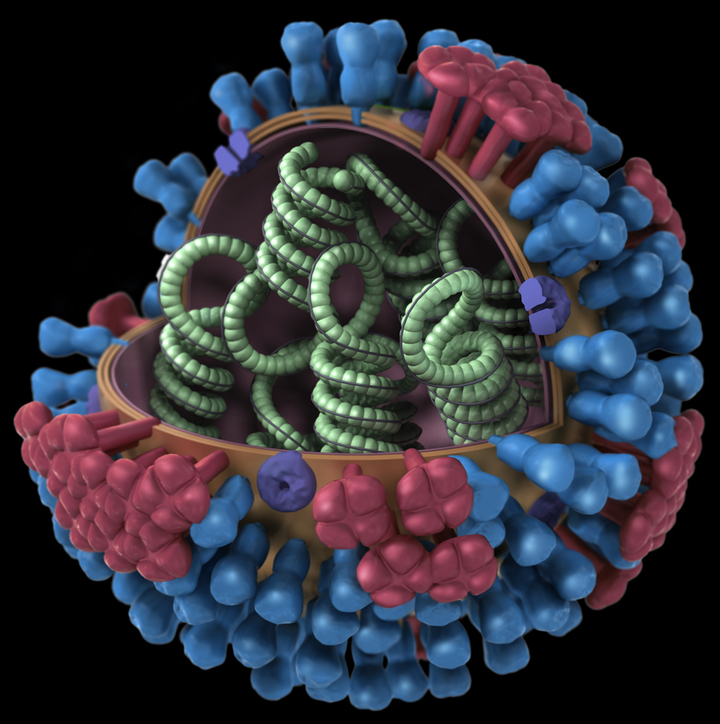
Строение вируса гриппа. Под оболочкой вириома - генетический материал вируса, необходимый для его воспроизводства в клетке.
Содержащие неактивный вирус и оставшиеся в живых клетки иногда сохраняют возможность нормального функционирования. В этом случае клетки могут быть заражены, но вирус проявит себя спустя длительный период времени. Так устроен герпес.
В зависимости от того, каким типом нуклеиновой кислоты представлен генетический материал, выделяют ДНК-содержащие вирусы и РНК-содержащие вирусы. И тут стоит остановиться на классификации.
Типы вирусов. Коротко о главном
Современная типология вирусов содержит 7 классов и была предложена Дэвидом Балтимором еще в 1971 году. С тех пор, впрочем, она была уточнена и расширена, в том числе советскими учеными. И выглядит в настоящее время таким образом:
Вирусы, содержащие двухцепочечную ДНК
Описание
Для репликации вирусу необходимо попасть в ядро клетки-мишени и воспользоваться ее ДНК-полимеразой. Иногда вирус вызывает незапланированное деление самое клетки, то есть становится онкогенным. Эти вирусы хорошо изучены.
Пример: Вирус герпеса, адено- и папилломавирусы
Вирусы, содержащие одноцепочечную ДНК
Описание
Попадая в ядро клетки, вирусы образуют двухцепочечную ДНК, после чего реплицируются так же, как вирусы класса I.
Пример: Парво- и цирковирусы
Вирусы, в которых РНК способна к репликации (редупликации)
Описание
Вирусы этого класса могут размножаться в цитоплазме клетки, им не нужна молекула ДНК. Каждый ген, находящийся в РНК вируса, кодирует только один вирусный белок.
Пример: Бирна- и реовирусы
Вирусы, содержащие одноцепочечную (+) РНК
Описание
Из геномной (+) РНК на рибосомах хозяина создаются вирусные белки. В одном фрагменте РНК могут быть закодированы разные белки, что увеличивает сложность вируса без удлинения генов.
Пример: Пикорнавирусы (полиомиелит, гепатит А) и коронавирусы
Вирусы, содержащие одноцепочечную (–) РНК
Описание
(–) РНК этих вирусов предварительно должна быть транскрибирована в (+) РНК вирусными РНК-полимеразами, после чего может начаться синтез вирусных белков. Вирусы этого класса делятся еще на две группы, в зависимости от их генома и места его репликации (цитоплазма или ядро).
Пример: Филовирусы, аренавирусы (геморрагическая лихорадка Ласса), ортомиксовирусы (вирусы гриппа) и так далее.
Вирусы, содержащие одноцепочечную (+) РНК, реплицирующиеся через стадию ДНК
Описание
Такие вирусы используют фермент обратную транскриптазу для превращения (+) РНК в ДНК, которая встраивается в геном хозяина ферментом интегразой. Дальнейшая репликация происходит при помощи полимераз клетки хозяина.
Пример: Ретровирусы (в том числе ВИЧ)
Вирусы, содержащие двухцепочечную ДНК, реплицирующиеся через стадию одноцепочечной РНК
Описание
Молекула ДНК замкнута в кольцо и является матрицей для синтеза мРНК и дополнительных молекул РНК, которые используются при репликации вирусного генома обратными транскриптазами.
Пример: Колимовирусы (вызывают инфекции растений) и гепаднавирусы (например, гепатит В)
Вакцинация и лечение
Как правило, организмы умеют бороться с паразитирующими на них вирусами. На примере млекопитающих и человека мы обычно говорим о главном инструменте — врожденном иммунитете.
Впрочем, наиболее эффективен этот вид защиты в отношении бактериальных инфекций и не может обеспечить продолжительную и надежную защиту, особенно от инфекций вирусных.
Именно поэтому огромное значение имеет приобретенный иммунитет, в результате которого клетки иммунной системы обучаются вырабатывать специфические к вирусу антитела, способные уничтожать как саму вирусную частицу, так и зараженные ею клетки.
Еще одна врожденная система борьбы с вирусными инфекциями — внутриклеточная. Как правило, клетка способна распознать чужеродную РНК в своей цитоплазме, куда ее сперва и доставляют многие вирусы, и имеет специальные комплексы для ее деградации. Но часть вирусов научились обходить и эту ловушку. К примеру, ротавирусы, которые даже внутри клетки сохраняют капсид с геномной РНК.
Миссия: уничтожить
Основная сложность в лечении вирусных заболеваний заключается в том, что они используют естественные функции клеток-мишеней для своего размножения, поэтому ученым зачастую оказывается не так-то просто придумать препарат, который будет токсичен для вируса и безопасен для самой клетки. Если такой безопасности достичь не удастся, лекарство будет иметь слишком много побочных эффектов, повреждающих сам организм, что окажется нецелесообразно для использования.

Сравнение жизненных циклов ВИЧ и вируса гриппа. Если первый использует обратную транскрипцию и живет в клетках иммунной стистемы, вирион второго, проникая в эпительные клетки дыхательных путей целиком - а именно там он и обитает - распадается уже внутри клетки, а репликация вирусной РНК происходит в ядре с помощью вирусных полимераз PA, PB1 и PB2 путем комплементарного копирования.
По принципу действия противовирусные препараты подразделяются на две группы: стимулирующие иммунную систему атаковать вирусы (например, за счет индукции синтеза белков-интерферонов) и атакующие вирусы напрямую. Препараты второй группы различаются по этапу жизненного цикла вируса, на котором они активны: это препараты, препятствующие проникновению вируса в клетку, препятствующие размножению вируса внутри клетки и препятствующие выходу копий вируса из клетки.
Еще один класс противовирусных препаратов блокирует ферменты, необходимые для создания и модификаций белков вируса. Такие лекарства называют протеазными ингибиторами.
Вместо заключения: а могут ли вирусы приносить пользу?
Безусловно, да. Несмотря на то, что вирусы ассоциируются у большинства людей с однозначным вредом, они могут приносить и пользу — если речь идет о так называемых вирусных векторах и терапевтических подходах на их основе.
Исследователи давно научились помещать в белковую оболочку вируса интересующие их нуклеиновые кислоты, чтобы доставлять нужный ген в клетки, а также убирать те гены, которые делают вирус опасным для организма.
Это позволило сделать возможной генную терапию, помогающую бороться с заболеваниями, вызванными известными генетическими мутациями. Создание вирусных векторов — достаточно непростая задача, к тому же ограниченная свойствами самих вирусных частиц: количеством помещающейся генетической информации, местом ее вставки, стабильностью. Кроме того, вирусный вектор, используемый в медицине, не должен вызывать иммунного ответа или критично влиять на жизнедеятельность клетки. Тем не менее эти сложности решаются, поэтому уже одобрен ряд вполне успешных и безопасных генных терапий. А в качестве основы для вирусных векторов чаще всего используются ретро-, ленти-, адено- и аденоассоциированные вирусы.

Обзор
здесь и далее рисунки Андрея Занкевича
Автор
Редактор

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Напомним, что РНК (рибонуклеиновая кислота) — это такая молекула, представляющая собой одну цепочку нуклеотидов. В составе каждого нуклеотида присутствует остаток моносахарида рибозы. На сегодняшний день известно множество разных типов РНК, которые выполняют совершенно разные функции: от кодирования клеточных белков (мРНК) до противовирусной защиты (некоторые микроРНК) [1–5]. РНК, входящие в состав многих вирусов, могут иметь ряд оригинальных функций, таких как регуляция времени экспрессии различных вирусных генов путем изменения пространственной организации цепи РНК или привлечение клеточных белковых комплексов.
Но бывает ли такое, что в пределах одной молекулы РНК одна ее часть, кодирующая некоторый белковый продукт, имеет положительную полярность, в то время как другая часть цепи представлена участком отрицательной полярности, кодирующим другой белок? Могла ли такая молекула возникнуть в процессе эволюции живых форм?
Ответ — да! И для того, чтобы разобраться, как функционируют такие молекулы, нам предстоит погрузиться в таинственный мир вирусов.
Давным-давно, в далекой-далекой галактике.
Как известно, все формы жизни обладают определенной наследственностью, которая определяет степень генетической идентичности живых объектов. В качестве молекул, ответственных за поддержание такой наследственной идентичности, выступают нуклеиновые кислоты (ДНК и РНК). Клеточные формы жизни для хранения и передачи информации используют только один тип нуклеиновых кислот — дезоксирибонуклеиновую кислоту (ДНК), в то время как вирусы в качестве основной молекулы наследственности могут использовать либо ДНК, либо РНК.
В случае ДНК-содержащих вирусов реализуется, как правило, Центральная догма молекулярной биологии в классическом виде: попав в клетку, ДНК удваивается в процессе репликации вирусного генома, на матрице ДНК в ходе транскрипции синтезируются мРНК, которые затем прочитываются рибосомой, синтезирующей по ним вирусные белки, то есть осуществляется трансляция. Далее вирусные белки ассоциируются с ДНК-геномом вируса в вирусную частицу (вирион), которая способна заражать новые клетки.
Очевидно, что РНК-содержащие вирусы используют иные стратегии размножения и, следовательно, реализации своего генома. Непривычные для большинства биологов молекулярные механизмы, которые используются такими вирусами, вероятно, унаследованы от далеких предков из того самого РНК-мира.
Размножение РНК-вирусов подразумевает использование разных типов РНК:
- геномная РНК находится внутри вириона, в зависимости от конкретного вируса, она может быть представлена (+)РНК, (–)РНК, (±)РНК, либо двухцепочечной РНК;
- комплементарная геномной РНК антигеномная РНК образуется в процессе репликации вирусов с одноцепочечным РНК-геномом и обладает полярностью, противоположной геномной РНК;
- субгеномная РНК (вирусная мРНК) имеет (+)полярность и является продуктом транскрипции геномной или антигеномной РНК. Как и подобает мРНК, субгеномная РНК участвует в процессе трансляционного синтеза белка.
Немного истории
Первым найденным РНК-вирусом стал бактериофаг f2, инфицирующий бактерию кишечную палочку (Escherichia coli) [7]. Выделенная геномная РНК фага f2 имела свойства мРНК, то есть она распознавалась рибосомой и могла транслироваться. На родственном РНК-бактериофаге Qβ была изучена РНК-зависимая РНК-полимераза (RdRp), которая, как оказалось, может синтезировать цепь РНК на матрице другой цепи РНК, то есть осуществлять репликацию вирусного РНК-генома! В ходе работы с РНК-бактериофагами f2 и его родственником Qβ были получены общие представления о биологии таких РНК-вирусов [8].
После РНК-бактериофагов были найдены (+)РНК-вирусы животных, такие, как вирус полиомиелита [9], [10], представитель группы пикорнавирусов. Подобные вирусы не содержат репликативных белков в составе вирусной частицы (вириона).
Встречаются вирусы, геном которых представлен двухцепочечной РНК. Как и в случае (–)РНК-вирусов, у дцРНК-вирусов во время репликации в клетке первым делом происходит синтез (+)цепи. Вирусные частицы этой группы также включают в свой состав RdRp.
Вирусы с двусмысленным РНК-геномом из семейства Bunyaviridae

Рисунок 1. Схематичное изображение структуры вириона флебовирусов
В семействе Bunyaviridae роды Phlebovirus, Tospovirus и Tenuivirus являются вирусами с двусмысленным РНК-геномом и, в отличие от остальных представителей семейства, имеют чуть более длинный S-сегмент генома (РНК S) (±)полярности. Род Tospovirus имеет вдобавок (+)участок на РНК M, который делает и эту РНК амбисенсной.
Флебовирусы
Вирусы рода Phlebovirus выделяют практически по всему миру и относят к нетаксономической группе арбовирусов, распространяющихся в членистоногих переносчиках и в позвоночных, на которых питаются переносчики. Члены этого рода переносятся кровососущими членистоногими. Инфекции не обходят стороной человека: вирусы сицилийской и неаполитанской москитных лихорадок широко распространены по территории Средиземноморья [15]. Среди симптомов таких инфекций — продолжительная сильная лихорадка, тошнота, рвота, диарея и головные боли. Вирус Тосканы, также переносимый москитами, обладает способностью проникать в нервную ткань и, вдобавок к вышеперечисленным симптомам, вызывает асептический менингит и менингоэнцефалит. Флебовирусы, переносимые клещами, например, вирус Бханджа, вирус тяжелой лихорадки с синдромом тромбоцитопении, или вирус Хартленд, вызывают серьезные вспышки инфекций среди людей [16].
Эти вирусы получили свое имя от латинского названия москитов (Phlebotominae), которые являются их основными переносчиками. Вирионы флебовирусов имеют диаметр 100-125 нанометров. Внутри вириона находятся три вирусных рибонуклеопротеина (вРНП), содержащих геномные сегменты, однако для вируса лихорадки долины Рифт (RVFV) было показано [17], что вирионы также могут содержать ещё три дополнительных вРНП, образованных цепочками антигеномных РНК, комплементарных геномным вирусным РНК. Рецептор-распознающий аппарат вирусов представлен гетеродимерами гликопротеинов Gn и Gc, которые организованным способом распределены по мембране вириона.
Структура генома флебовирусов
Геном флебовирусов как и других представителей семейства Bunyaviridae, включает три молекулы РНК: PHК L, РНК M, РНК S, имеющие на 5′- и 3′- концах уникальные для каждого геномного сегмента комплементарные последовательности. РНК L (–)полярности кодирует белок репликазы L. (–)РНК M кодирует предшественник гликопротеинов G1 и G2. (±)РНК S кодирует белок нуклеокапсида N на (–)полярном участке (ближе к 3′) и неструктурный белок NSs на (+)полярном участке (ближе к 5′) (рис. 2).

Рисунок 2. Схема структуры генома флебовирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
NSs выполняет ряд функций, среди которых подавление индукции интерферона, усиление репликации и транскрипции вирусной РНК и определение круга хозяев [18]. NSs через цепочку белковых факторов способен приводить к инактивации противовирусной протеинкиназы R организма-хозяина [19].
Механизмы транскрипции и репликации РНК флебовирусов
Остановка транскрипции (–)участка РНК S определяется межгенным сигналом терминации. Похожие сигналы терминации находятся в 5′-концевой области РНК M и РНК L. В результате синтезируются кэпированные, но неполиаденилированные (и, следовательно, не такие стабильные, как клеточные мРНК) субгеномные РНК [18]. Также было показано [17], что в инфицированных клетках наблюдается ранняя экспрессия белка NSs, к тому же при детальном анализе состава вирионов обнаружили, что в вирусную частицу может упаковываться как три геномных цепи, так и еще три антигеномных цепи. Считается, что антигеномная РНК S присутствует в вирионе для осуществления ранней транскрипции мРНК, кодирующей NSs, поскольку этот неструктурный белок способен регулировать клеточные процессы, и чем раньше он начнёт работать в зараженной клетке, тем интенсивнее будет протекать вирусная инфекция.
Жизненный цикл флебовирусов
Жизненный цикл состоит из следующих стадий (рис. 3):

Рисунок 3. Схема, демонстрирующая основные этапы цикла флебовируса
Тосповирусы и тенуивирусы
Название рода Tospovirus происходит от сокращения названия вируса пятнистого увядания томатов (tomato spotted wilt virus, ТоSWV), впервые выделенного в 1930 году из зараженных растений томата. Этот вирус имеет очень широкий спектр хозяев и важное хозяйственное значение, борьба с ним ведется, в основном, за счет контроля численности трипсов.
Структура генома тосповирусов и тенуивирусов
Представители родов Тospovirus и Tenuivirus (тенуивирусы близки к тосповирусам, но не имеют липидной оболочки) являются единственными известными РНКвирусами растений с двусмысленным геномом [23]. Геном тосповирусов представлен тремя РНК-сегментами: большим, средним и малым (L, M, S). РНК L кодирует репликазу L. РНК S, подобно таковой у флебовирусов, кодирует белок нуклеокапсида N в (–)области и неструктурный белок NSs в (+)области. Эти области не пересекаются, они разделены межгенным некодирующим участком, содержащим сигналы терминации транскрипции. М-сегмент генома имеет принципиально отличную от РНК М флебовирусов структуру, являясь амбисенсной РНК. РНК М тосповирусов имеет область (–)полярности, в которой находится последовательность, кодирующая мРНК GnGc — предшественника поверхностных гликопротеинов, а также участок (+)полярности в 5′-области, кодирующий белок межклеточного транспорта NSm. Эти последовательности также разделены межгенным участком (рис. 4). Механизмы транскрипции и репликации РНК этих вирусов сходны с таковыми у флебовирусов [18].

Рисунок 4. Схема структуры генома тосповирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
Отдельного внимания заслуживает неструктурный белок, закодированный в S-сегменте генома тосповирусов — NSs. Основной его функцией является супрессия противовирусного сайленсинга РНК, системы малых интерферирующих РНК [5], [24], распознающих вирусные РНК, что приводит к деградации последних [25]. Логично предположить, что синтез такого белка должен происходить как можно раньше, поэтому, возможно, по аналогии с белком NSs флебовирусов, ранняя транскрипция такой последовательности происходит в результате наличия в вирионе, помимо геномной цепи РНК S, еще и соответствующей ей антигеномной.
Вирусы с двусмысленным РНК-геномом из семейства Arenaviridae
Помимо семейства Bunyaviridae, амбисенсные РНК имеют представители семейства Arenaviridae. Аренавирусы являются таксономической группой вирусов позвоночных с сегментированным двусмысленным РНК-геномом. Вирусы, инфицирующие млекопитающих, определены в род Mammarenavirus, а заражающие рептилий — в роды Reptarenavirus и Hartmanivirus [26].
Вирионы аренавирусов, как и рассмотренных выше буньявирусов, плеоморфны, а их диаметр может варьировать от 40 до 200 нанометров в зависимости от вида, однако и частицы одного вида могут заметно различаться по размерам [27]. Границы вириона представлены липопротеидной оболочкой — производной клеточной мембраны, модифицированной равномерно распределёнными гликопротеиновыми комплексами (гетеродимерный гликопротеин GP1/GP2). Гликопротеины синтезируются в виде предшественника, который разрезается примерно пополам клеточной протеиназой на рецептор-распознающую субъединицу GP1 и трансмембранную субъединицу GP2. Последняя ответственна за слияние мембран при проникновении в цитоплазму [28]. В вирионе гликопротеины ассоциированны с лежащими на внутренней стороне мембраны молекулами матриксного белка Z, выстилающего внутреннюю поверхность мембраны, и белка нуклеокапсида N. Белок N способен связываться с РНК, распознавать кэп и ингибировать интерфероновый ответ. Структурный белок Z в клетке выполняет ряд функций (в том числе ингибирование трансляции клеточных мРНК и подавление апоптоза), являясь фактором созревания вирусных частиц (отвечает за инициацию сборки вирионов и за их отпочковывание).
Во время сборки вирусных частиц при формировании внешней оболочки иногда происходит захват субъединиц клеточных рибосом, по всей видимости, не играющих роли в вирусной инфекции (рис. 5).

Рисунок 5. Схематичное изображение структуры вириона аренавирусов
Значительная часть представителей семейства вызывает хронические и, как правило, бессимптомные инфекции у грызунов. При контакте человека с такими вирусами может развиваться острая и тяжелая инфекция, часто — геморрагическая лихорадка (например, в случае инфекции вирусом лихорадки Ласса, LasV). Вирус лимфоцитарного хориоменингита (LCMV), первый выделенный аренавирус, является нейроинвазивным. Попав в организм человека (например, через выделения грызунов), вирионы с током крови преодолевают гематоэнцефалический барьер центральной нервной системы и вызывают воспаления мозговых оболочек [29].
Структура генома аренавирусов

Рисунок 6. Схема структуры генома аренавирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирными линиями обозначены сайты протеолиза белковых продуктов.
РНК L на (–)участке несет последовательность, комплементарную гену репликазы L, и рамку матриксного и регуляторного белка Z на (+)участке в 5′-концевой части геномной РНК.
РНК S кодирует белок нуклеокапсида N в области (–)полярности и содержит рамку считывания GP1GP2 — предшественника поверхностных гликопротеинов GP1/GP2 (также в 5′-концевой части геномного сегмента).
Транскрипция и репликация генома аренавирусов
Переключение на репликацию связано с наличием белка N: когда его накапливается такое количество, что он начинает покрывать строящиеся цепи РНК, это, вероятно, влияет на конформацию репликазы и приводит к проскоку сигналов терминации транскрипции в виде межгенных шпилек. РНК S при репликации накапливается в больших количествах, так как нужно много копий белка нуклеокапсида, а также гликопротеинов (для экспрессии последних необходим предварительный синтез антигеномной РНК).
Заключение
Такая необычная организация двусмысленных геномных сегментов является интересным способом представления двух кодирующих последовательностей в одном геномном сегменте. На примере вирусов с двусмысленными РНК-геномами заметно, насколько изобретательной может быть эволюция вирусных РНК. Поскольку вирусы с двусмысленными РНК-геномами до сих пор удерживают определенную нишу, можно утверждать, что такой способ кодирования обладает некоторыми преимуществами по сравнению с более привычным для родственных вирусов способом, использующим только (–)РНК-сегменты.
Как возникли амбисенсные РНК и почему поддержались отбором, до сих пор остается одной из загадок современной вирусологии.
Благодарности от автора
Я благодарю доктора биологических наук, профессора кафедры вирусологии биологического факультета МГУ им. М.В. Ломоносова Аграновского Алексея Анатольевича за интересные и содержательные лекции по молекулярным процессам РНК-вирусов и вдохновение на написание данной статьи. Также выражаю благодарность художнику Андрею Занкевичу, чьи наглядные и яркие иллюстрации украшают данную статью.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

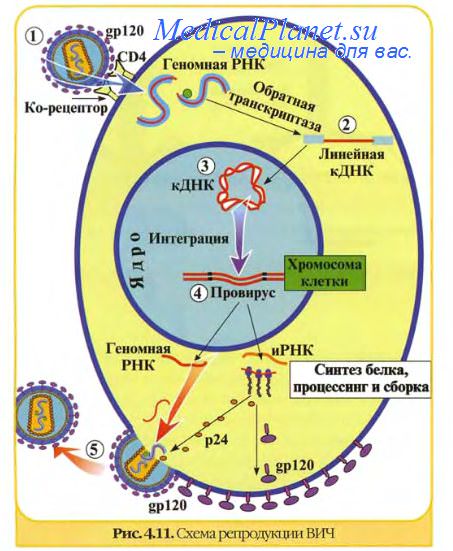
Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:

