Генетический паразитизм вирусов вироидов прионов
Обновлено: 24.04.2024
Вадим Израилевич Агол — член-корреспондент РАН и РАМН, доктор биологических наук, главный научный сотрудник Института полиомиелита и вирусных энцефалитов им. М. П. Чумакова, заведующий отделом Научно-исследовательского института физико-химической биологии им. А. Н. Белозерского МГУ. Область научных интересов — молекулярная биология и генетика вирусов.
Считается, что вирусы (от лат. virus — яд) — нечто противное, приносящее одни неприятности. Но это грубая ошибка. Вирусы — ключевые созидатели живой природы и двигатели ее эволюции.
Механизмы защиты и противозащиты
Каковы главные защитные механизмы зараженной клетки? Это компоненты врожденного иммунитета: деградация РНК (вирусных, а также клеточных), угнетение синтеза белков (как вирусных, так и клеточных), самоликвидация (апоптоз и другие виды программируемой гибели) и, наконец, воспаление. Собственно, многие вирусы так и обнаружили свое существование — из-за вызываемого ими воспаления (энцефалита, воспаления легких и т. д.). Клетка борется с вирусом, нарушая собственные обмен веществ и / или структуру, и ее защитные механизмы, как правило, самоповреждающие. Можно сказать, что человек, умерший от полиомиелита (а умирает менее 1%), сам убил себя, борясь с инфекцией.
У растений в качестве противовирусного механизма очень важную роль играет РНК-интерференция. Из вирусной РНК образуется двуцепочечная (важный фактор, по которому клетка узнает о наличии вируса). При участии компонентов системы РНК-интерференции — фермента Dicer, который разрезает эту двуцепочечную РНК на фрагменты длиной 21–25 пар нуклеотидов, а затем РНК-белкового комплекса RISC — в конце концов образуются одноцепочечные короткие фрагменты РНК. Гибридизуясь с вирусной РНК, они вызывают либо ее деградацию, либо угнетение ее трансляции. Такой защитный механизм эффективен, но может повреждать саму клетку, что хорошо видно на примере вироидов. Это патогены растений, короткие (несколько сотен нуклеотидов) молекулы кольцевой одноцепочечной РНК, не покрытые белковой оболочкой. Вироиды не кодируют белки, но могут вызывать тяжелые симптомы в зараженном растении. Это происходит потому, что клетка защищается. Образующаяся вироидная двуцепочечная РНК подвергается действию всех компонентов системы РНК-интерференции, в результате образуются фрагменты одноцепочечной РНК, которые гибридизуются уже не с вирусной РНК, а с клеточной. Это приводит к ее деградации и развитию симптомов заболевания. Однако многие вирусы растений кодируют разнообразные белки, препятствующие РНК-интерференции (viral suppressors of RNA silencing — VSR). Они либо угнетают распознавание и расщепление вирусных РНК, либо подавляют формирование и функционирование комплекса RISC. Поэтому эти VSR-белки могут нарушать механизмы физиологически важной (не связанной с вирусами) РНК-интерференции, вызывая патологические симптомы.
Схема полипротеина (белка-предшественника) пикорнавирусов

Модель вируса полиомиелита. Фото: virology.wisc.edu
Обоюдное разоружение

Модель менговируса (штамма вируса энцефаломиокардита). Фото: virology.wisc.edu
Эффект одновременного выключения клеточных защитных и вирусных противозащитных механизмов. Зараженные менговирусом дикого типа, клетки HeLa (а, незараженные) быстро гибнут от некроза (б, 4 ч после заражения). Клетки, зараженные частично разоруженным вирусом, у которого инактивирован лидерный белок, живут чуть дольше и гибнут уже от апоптоза (в, 8 ч после заражения). Когда же частично разоружены и вирус (инактивирован его лидерный белок), и клетки (у них выключен апоптоз добавлением химического соединения, которое угнетает каспазы), даже через вдвое больший промежуток времени клетки чувствуют себя значительно лучше, чем те, которые не были разоружены (г, д, 8 и 16 ч после заражения). Большинство клеток на панелях г и д морфологически больше похожи на клетки на панели а, чем на б и в. Сканирующая электронная микроскопия. Фото С. И. Галкиной
Программируемая гибель
Гонка вооружений
Однако длительная коэволюция хозяина и вируса должна приводить к снижению патогенности последнего (взаимовыгодному обоюдному разоружению). Классический пример — вирус миксомы / фибромы. В середине XIX в. в Австралию завезли европейских кроликов, которые быстро размножились и стали серьезной угрозой для сельского хозяйства. Через 100 лет для контроля их популяции стали использовать патогенный вирус фибромы / миксомы (из семейства поксвирусов, к которому относится и вирус оспы). Разные кролики по-разному реагируют на этот вирус. У бразильских кроликов через три недели после заражения он вызывает доброкачественную опухоль — фиброму (локализованный узелок на коже). Но у европейских кроликов, чувствительных к этому вирусу, уже через 10 дней после заражения развивается генерализованное смертельное заболевание.
Мой рассказ далеко не исчерпывает тему: о природе патогенности вирусов известно значительно больше. Многое из того, что мы сейчас знаем, удалось изучить в самые последние годы, и есть все основания ожидать новых сюрпризов. Можно и нужно винить вирусы за тяжелые болезни и необходимо бороться с ними, но мы должны быть благодарны вирусам за существование и разнообразие живой природы, и в том числе — за существование человека.
Автор благодарен коллегам по научной кооперации — сотрудникам Института полиомиелита и вирусных энцефалитов им. М. П. Чумакова РАМН, Московского государственного университета им. М. В. Ломоносова, Института белка РАН (Пущино Московской области), Университета Базеля (Швейцария), Университета штата Висконсин (США), Университета Неймегена им. Радбода (Нидерланды).
В природе помимо вирусов обнаружены другие очень мелкие загадочные инфекционные агенты с необычными свойствами. К ним относятся вироиды и прионы.
1. Вироиды, в отличие от вирусов, не имеют белковой оболочки и состоят только из инфекционной молекулы РНК. Они не обладают антигенными свойствами и поэтому не могут быть обнаружены серологическими методами.
2. Вироиды имеют очень малые размеры: длина молекулы РНК вироидов равна 1 ? 10 – 6 мм, она состоит из 300 – 400 нуклеотидов. Вироиды – самые маленькие способные к размножению единицы, известные в природе.
3. Молекулы вироидов представляют собой одноцепочечные кольцевые РНК. Такую кольцевую структуру имеет еще только один вирус – вирус дельта-гепатита.
4. Молекулы РНК вироидов не кодируют собственных белков, поэтому их размножение может происходить либо аутокаталитически, либо с участием клетки-хозяина.
С 1971 г. обнаружено более 10 различных вироидов, отличающихся по первичной структуре, кругу поражаемых хозяев, по симптомам вызываемых ими заболеваний. Все известные вироиды построены по одному плану: 300 – 400 нуклеотидов образуют кольцо, которое удерживается парами оснований и образует двухцепочечную палочковидную структуру с перемежающимися короткими одно– и двухцепочечными участками.
Поскольку вироиды не имеют собственных генов и белков, их нельзя считать живыми существами. Поэтому вопрос о природе, происхождении вироидов и о том, каким способом они распространяются, остается открытым. Существует предположение, что вироиды образуются из нормальных клеточных РНК, однако убедительных подтверждений этому не было представлено.
Синтез прионов контролирует ген prnP, который несет у человека 20-я хромосома. Установлено 18 различный мутаций этого гена, которые связаны с различными прионовыми болезнями.
Прионы состоят из особого белка, который существует в виде двух изомеров. Один из них – нормальный клеточный прионовый протеин – изоформа PrP C . Он состоит из 254 аминокислотных остатков и имеет м. м. 33 – 35 кД. PrP C растворим в детергентах, чувствителен к действию протеинкиназы К. Он, как полагают, участвует в регуляции суточных циклов многих гормонов. У здоровых животных содержание его составляет 1 мкг/г ткани мозга (больше всего его в нейронах).
Другой изомер прионового протеина PrP Sc – аномальный, имеет такую же м. м. Он отличается от PrP C вторичной структурой, устойчив к протеолизу, не растворяется детергентами, способен к самоагрегации / олигомеризации. Конверсия PrP C в PrP Sc присходит очень медленно, но ускоряется в присутствии экзогенного приона. Прионы PrP Sc – возбудители прионных медленных инфекций.
Содержание PrP Sc в ткани мозга больных животных в 10 раз больше, чем у здоровых.
Известны 12 нозологических единиц прионных болезней, из них 6 наблюдаются у животных (скрепи у овец, губкообразные энцефалопатии крупного рогатого скота, экзотических копытных и кошачьих, хроническое истощение у лосей и трансмиссивная энцефалопатия норок). Шесть болезней прионной этиологии описаны у человека.
Ку?ру (папуасское curu – дрожать, трястись) впервые описано в 1957 г. К. Гайдушеком у папуасов-каннибалов в Новой Гвинее. Характеризуется прогрессирующей мозжечковой атаксией, общим дрожанием, адинамией, а также психическими изменениями (эйфория, беспричинный смех и т. п.).
Летальная семейная бессонница – потеря сна, гиперреактивность симпатической системы, прогрессирующее ослабление автономных и эндокринных циклических временн?ых ритмов; наблюдается у лиц среднего возраста (около 45 лет).
Патогенез не изучен. Заболевание тянется длительно и заканчивается смертью.
Амиотрофический лейкоспонгиоз – медленная инфекция человека, характеризующаяся прогрессирующим развитием атрофических парезов мышц конечностей и туловища, нарушением дыхания и заканчивается смертью.
Синдром Альперса – медленная прионная инфекция. Наблюдается главным образом в детстве, характеризуется симптомами, свидетельствующими о поражении ЦНС.
Для прионовых болезней человека характеры 4 классических нейропатологических признака: спонгиозные изменения (множество овальных вакуолей диаметром 1 – 50 мк в сером веществе мозга), потеря нейронов, астроцитоз и формирование амилоидных бляшек.
Предполагается, что прионы играют роль в этиологии шизофрении, миопатии и некоторых других заболеваний человека. Природа прионов остается неясной. С вирусами их объединяют малые размеры (они способны проходить через бактериальные фильтры) и неспособность размножаться на искусственных питательных средах; специфический круг поражаемых хозяев; длительная персистенция в культуре клеток, полученной из тканей зараженного хозяина, а также в организме больного человека и животного. Вместе с тем они существенным образом отличаются от вирусов: во-первых, у них отсутствует собственный геном, следовательно, они не могут рассматриваться, в отличие от вирусов, как живые существа; во-вторых, они не индуцируют никакого иммунного ответа. В-третьих, прионы обладают значительно более высокой резистентностью, чем обычные вирусы, к действию высокой температуры (выдерживают кипячение в течение 1 ч), УФ-излучению, ионизирующей радиации и к различным дезинфектантам; нечувствительны к интерферонам и не индуцируют их синтеза.
По мнению С. Прузинера, есть два пути передачи аномального приона PrP Sc : наследственный (мутации в гене prnP) и трансмиссивный, или инфекционный (алиментарный и нозокомиальный). Прионовые болезни в том и другом случае наблюдаются в виде спорадических или групповых заболеваний.
К. Гайдушек в 1976 г. за открытие инфекционной природы прионных болезней и С. Б. Прузинер в 1997 г. за открытие прионов и разработку прионной теории были удостоены Нобелевских премий.
Основой таксономии вирусов является вирион, который представляет собой конечную фазу развития вируса. Вирион состоит из геномной нуклеиновой кислоты, окруженной одной или двумя оболочками. По строению вирусы можно разделить на четыре типа, которые различаются по характеру упаковки морфологических субъединиц:
1) вирусы со спиральной симметрией;
2) изометрические вирусы с кубической симметрией;
3) вирусы с бинарной симметрией, например фаги: у них головка имеет кубический тип симметрии, а хвостик – спиральный;
4) более сложно организованные вирусы, имеющие вторую оболочку.
Оболочка, в которую упакована геномная нуклеиновая кислота, называется капсидом (греч. capsa – ящик). Наиболее просто организованные вирусы представляют собой нуклеокапсиды: они состоят только из нуклеиновой кислоты и белковой оболочки, построенной из идентичных пептидных молекул. Поскольку число аминокислотных остатков в белковой молекуле всегда меньше числа нуклеотидов в гене (код триплетный), то для того, чтобы упаковать геномную нуклеиновую кислоту, требуется большое число одинаковых белковых молекул. А многократное повторение белок-белковых взаимодействий возможно лишь при условии симметричного расположения субъединиц. Существует всего два способа упаковки одинаковых белковых молекул в капсид, при которых он обладал бы стабильностью. Полимер будет стабильным, если он соответствует наименьшему уровню свободной энергии. Процесс образования такого полимера родствен процессу кристаллизации, он протекает по типу самосборки. Один из вариантов такой самосборки происходит с использованием спиральной симметрии, другой – кубической симметрии.
При спиральной симметрии (ее имеют нитевидные вирусы) белковые субъединицы располагаются по спирали, а между ними, также по спирали, уложена геномная нуклеиновая кислота. Лучше всего этот тип молекулярной организации вириона изучен у вируса мозаичной болезни табака. Он представляет собой нуклеопротеид, имеющий длину 300 нм и диаметр 18 нм. Молекулярная масса вириона 40 МД. Капсид вириона состоит из 2130 белковых молекул, винтообразно уложенных вокруг РНК, содержащей около 6000 нуклеотидов (рис. 76, а). Каждая белковая молекула имеет м. м. 18 240 Д и состоит из 158 аминокислотных остатков. С каждой белковой субъединицей связано три нуклеотида. Белковая спираль состоит из 130 витков, на каждый из которых приходится 16 1 /3 субъединиц. Период идентичности (3 оборота спирали) равен 6,9 нм.
При спиральной симметрии белковый чехол лучше защищает геномную нуклеиновую кислоту, но при этом требуется большее количество белка, чем при кубической симметрии. Большинство вирусов с замкнутым чехлом обладает кубической симметрией. В ее основе лежат различные комбинации равносторонних треугольников, образующихся из сочетания шаровидных белковых субъединиц. Сочетаясь определенным образом друг с другом, они могут формировать замкнутую сферическую поверхность. Из различных сочетаний равносторонних треугольников, которые образуют общую вершину и общую ось симметрии, могут возникать различные варианты многогранников: тетраэдры, октаэдры и икосаэдры. Икосаэдры имеют 20 граней (каждая представляет равносторонний треугольник), 12 вершин и пятикратную тройную и двойную оси вращательной симметрии (рис. 76, б). Икосаэдры – самая эффективная и экономичная симметрия для формирования замкнутого чехла, так как в этом случае при его сборке используются строительные белки минимального размера и обеспечивается наибольший внутренний объем вириона. Видимо, поэтому сферические вирусы животных чаще всего имеют форму икосаэдра.
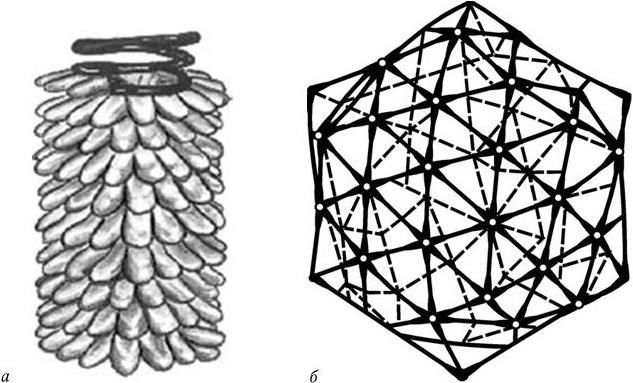
Рис. 76
а – спиральная симметрия (вирус мозаичной болезни табака); б – один из возможных вариантов кубической симметрии
Основные различия между спиральными и сферическими вирусами, по мнению Д. Каспара, таковы.

Упаковка по типу икосаэдра позволяет осуществлять переход от структурных единиц (белковых субъединиц) к морфологическим – капсомерам (греч. meros – часть). Например, 60 молекул субъединиц могут быть представлены в виде 30 молекул димеров или 20 молекул тримеров, морфологически такие олигомеры будут отличаться друг от друга. Число капсомеров для вирусов данного вида является постоянным, оно имеет диагностическое значение. Например, вирион аденовирусов имеет 252 капсомера, причем группы из 9 капсомеров располагаются на поверхности 20 граней (180 капсомеров), а группы из 6 капсомеров образуют 12 вершин (72 капсомера). Число капсомеров у парвовирусов – 32, у паповавирусов – 72. Молекулярная организация всех простых вирусов сводится к использованию спиральной и кубической симметрии.
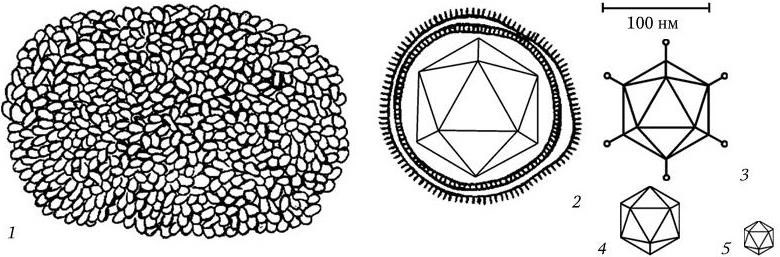
Рис. 77
. Форма и относительные размеры вирионов некоторых семейств ДНК-содержащих вирусов животных:
1 – Poxviridae; 2 – Herpesviridae; 3 – Adenoviridae; 4 – Papovaviridae; 5 – Parvoviridae
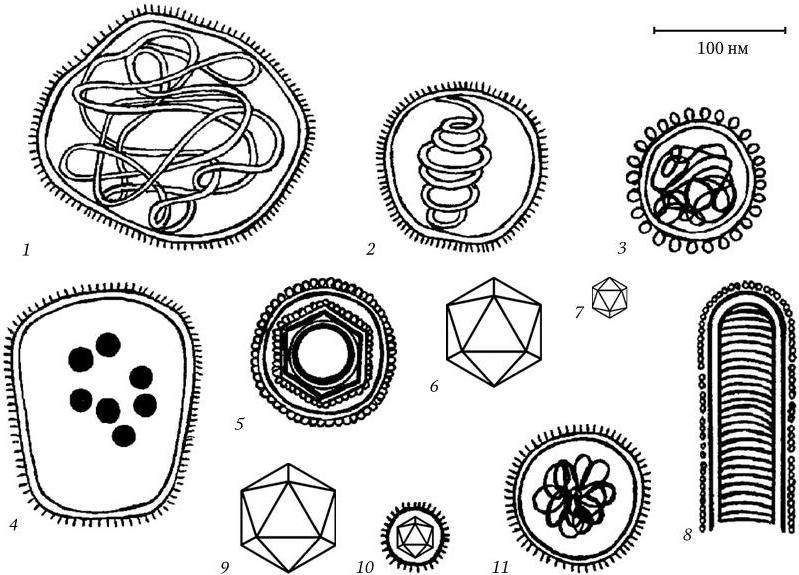
Рис. 78
. Форма и относительные размеры вирионов некоторых семейств РНК-содержащих вирусов животных:
1 – Paramyxoviridae; 2 – Orthomyxoviridae; 3 – Coronaviridae; 4 – Arenaviridae; 5 – Retroviridae; 6 — Reoviridae; 7 — Picornaviridae; 8 — Rhabdoviridae; 9 — Orbiviridae; 10 — Togaviridae; 11 — Bunyaviridae
Наиболее сложное строение имеют самые крупные вирусы, относящиеся к семейству поксвирусов. Их вирионы имеют форму параллелепипеда (или овоидную), размером 300 – 450 ? 170 – 260 нм. Вирионы покрыты внешней оболочкой, под которой располагаются сложное образование из тубулярных структур и внутреннее ядро, состоящее из ДНК-содержащей сердцевины и одного или двух боковых телец. Вирион содержит более 30 структурных белков и несколько ферментов. Таким образом, структура вириона у каждого семейства вирусов имеет отличительные особенности. Форма и относительные размеры ДНК– и РНК-содержащих вирусов представлены на рис. 77 и 78.

Прионные болезни – трансмиссивные спонгиоформные энцефалопатии (ТСЭ) – это относительно новая группа дегенеративных заболеваний ЦНС. Расстройства характеризуются хроническим необычным взаимодействием иммунной системы и предполагаемого этиологического фактора – белка приона.
Он на периферическом пути болезни размножается в эндоретулярной системе, откуда переходит в ЦНС (головной и спинной мозг), где он вызывают васкуляризацию нейроцитов, глиальных клеток, спонгиоматозную реконструкцию нейропилуса, вымирание и уменьшение количества нейрональных клеток, глиоз без значительного вовлечения воспаления.
Прион — убийца нейрона
Прион, также известный в микробиологии как инфекционный PrP Sc , – это профессиональный термин, описывающий дефектную форму протеина, часто встречающегося в тканях мозга млекопитающих, способствующего долгосрочному функционированию памяти.
Прионы убивают нейроны очень быстро, что провоцирует стремительное развитие дегенеративных заболеваний.
Согласно теории, речь идет об источнике многих нарушений ЦНС животных (включая человека). Эти белки играют роль в наследственных изменениях и эволюции.
Один из регуляторных факторов прионопреобразования – шапероны, функция которых заключается в чистке клеток от патогенных белков. Как шапероны, так и прионы относятся к группе клеточных протеинов.

Теории и гипотезы

Теорию прионов, как патогенных белков, Прусинер сформулировал в связи с поиском возбудителя расстройства Крейтцфельда-Якоба. Обнаруженный ним агент являлся чем-то новым. До 1982 г. считалось, что инфекционные заболевания могут вызывать только инфекционные организмы, содержащие нуклеиновую кислоту, несущую генетическую информацию. Но строение белка не содержит нуклеиновой кислоты. Это белок, размножающийся, изменяя аналогичные белки в организме. В 1997 г. С. Б. Прусинер получил Нобелевскую премию в этой области.
Патогенные белки прионы имеют одинаковую первичную структуру (аминокислотную последовательность), но различаются по своей конформационной конфигурации. В то время как дикий PrP с имеет выраженное преобладание α-геликса и около 5% β-листа, патогенный PrP Sc (Sc – scrapie) имеет долю β-листа до 40%. Причины аберрантных свойств прионов PrP Sc все еще рассматриваются. Сегодня есть несколько гипотез.
- Вирусная гипотеза объясняет воздействие прионов вирусологией. Предполагается участие РНК-вирусов в трансмиссивных губчатых энцефалопатиях. Как вироиды, так и прионы – мелкие инфекционные патогены; следовательно, результат воздействия вируса – прион инфекционной природы.
- Мультикомпонентная гипотеза. Предполагается, что для образования инфекционных белков, как новых возбудителей болезней необходима связь с полианионами и липидами.
- Отравление тяжелыми металлами. Интоксикация вызывает развитие инфекции при недостатке или избытке в организме меди (для здорового протеина необходимо оптимальное количество меди).

В чем заключается токсичность белка для нейрона?
Патогенные белки чрезвычайно устойчивы к физическим и химическим воздействиям, что приводит к трудностям при стерилизации (были предприняты попытки сжигания головного мозга у пораженных животных при 600°C, пеплом впоследствии были заражены примерно 1/3 животных). В соответствии с тем, какие метаболические процессы нарушают прионы в нейроне, наиболее инфекционные – ткани глаза, головного и спинного мозга.
Факторы риска развития инфекций
Фактор риска заболеваний с генетической точки зрения – наличие определенной последовательности оснований в определенном месте гена, кодирующего белок.
Высокий риск формирования инфекционных прионов и прионных болезней представляют операции с загрязнением тканей и трансплантацией от пациента с присутствующей инфекцией.
Недоказанный риск – потребление тканей больного животного. Здесь важен фактор токсичности приона, его свойства выживать при воздействии температуры, в несколько раз превышающей температуру кипения воды. Животноводство без потребления продуктов не является рисковым.
Наиболее опасные (заразные) из пораженного организма – мозг (ЦНС), мозговые оболочки, роговица (глаз), кровь, лимфатические органы. Мышцы и другие органы представляет намного меньший риск, но не исключают его.
Характеристика инфекций
Заболевания вызываются возбудителями, не содержащими нуклеиновой кислоты. Они могут быть спорадическими, генетически обусловленными, инфекционными (даже ятрогенными). Присутствие дефектных белков вызывает расстройства, обычно называемые спонгиоформными энцефалопатиями. Это дегенеративные нарушения нервной системы, при которых мозг постепенно приобретает губчатый вид из-за миниатюрных отверстий, ввиду того, что прионы убивают нейроны.
Все инфекции неизлечимы и смертельны. Сегодня проводятся исследования и тестирования, направленные на изучение методов замедления течения прионной болезни.

Отдельные нозологические единицы
Прионные болезни человека видоспецифичные. В основном они распространяются только среди особей одного вида. Но учеными была продемонстрирована межвидовая передача (преодоление межвидового барьера): это произошло у скрепи овец с ее передачей коровам (коровье бешенство). Передача заболевания от животного к человеку, несмотря на многие подозрения, не была продемонстрирована.
Ряд заболеваний имеет наследственное происхождение, часть является инфекционной. Иногда болезнь возникает неожиданно, без возможности профилактики.
Болезнь Крейцфельдта-Якоба (Creutzfeldt-Jakob disease)
Это редкое расстройство, поражающее пожилых людей (чаще всего 50-70-летних). Его течение относительно быстрое, смерть наступает через несколько месяцев (до года) от проявления первых симптомов. Нейроны быстро гибнут, развивается прогрессивная деменция, не имеющая известного лечения. Существует некоторая наследственная предрасположенность к этому заболеванию:
- Спорадическая форма. Заболеваемость составляет 1-2/1000000. Проблемы начинаются примерно в возрасте 65 лет. Расстройство возникает в виде острого прогрессирования деменции (в течение 2-3 месяцев), атаксии, миоклонуса. Возможностей, как продлить жизнь нейронам при этом прионом заболевании, нет, пациент умирает через 5-12 месяцев после появления первых симптомов.
- Ятрогенная форма. Возникала у пациентов, получавших гормон роста человека из трупных гипофизов (сегодня он готовится рекомбинантно), пересадкой твердых оболочек, перикарда, роговицы. Существует риск нейрохирургической передачи. Заражение возможно также при переливании.
- Семейная форма. Это генетическая форма с мутацией в гене PRNP и психоневрологической симптоматикой.
- Новый вариант. Характеризуется психиатрическими симптомами (тревога, депрессия, изменения в поведении), прогрессирующим мозжечковым синдромом, миоклонусом, другими неврологическими симптомами. В отличие от спорадической формы, новый вариант типичен медленным развитием вирусной инфекции; прионная болезнь затрагивает более молодые возрастные группы. Передача происходит алиментарным путем (при потреблении мяса пораженных животных). Инкубационный период – более 10 лет. В мире на сегодняшний день погибло около 200 человек.
- Детский вариант болезни Крейцфельдта-Якоба – болезнь Альпера. Имеет те же проявления, что и заболевание у взрослых; в дополнение сопровождается стеатозом печени.

Болезнь Герстманна-Штрюсслера-Шейнкера (Gerstmann-Sträussler-Scheinker disease)
Болезнь Герстманна-Штрюсслера-Шейнкера – это очень редкое аутосомно-доминантное наследственное заболевание, начинающееся в 3-4-ой декаде жизни. Проявляется медленным замедлением работы нейронов прионами, прогрессирующей дисфункцией мозжечка и спинного мозга. Признаки:
- атаксия;
- пирамидные симптомы;
- дизартрия;
- дисфагия;
- постепенно развивающаяся деменция.
В начале расстройства могут возникнуть апатия, депрессия. Средняя продолжительность заболевания – около 4-5 лет. Было описано несколько мутаций PRNP, связанных с этим расстройством.
Фатальная фамильярная инсомния (Fatal familiar insomnia)
Это очень редкое заболевание, приводящее к дегенерации ядра таламуса. Основные симптомы:
Дистрофия мозга по воздействием вируса приона
Развиваются когнитивные нарушения, появляются спутанность сознания и галлюцинации. В терминальной стадии развивается полная инсомния. Пациенты умирают в течение 3 лет от проявления первых признаков. Заболевание связано с мутацией PRNP D178N-129M. Существует также спорадическая форма расстройства.
Заболевания животных
Риск заболеваний животных для людей очень спекулятивен (лучше всего проблематику характеризует связь BSE и нового варианта расстройства Крейцфельдта-Якобса). У животных расстройства проявляются агрессивностью, нарушением двигательных способностей:
- cпонгиоформная энцефалопатия крупного рогатого скота (Bovine spongiform encephalopathy – BSE);
- скрепи;
- хроническая болезнь истощения (Chronic wasting disease – CWD);
- войлочная спонгиоформная энцефалопатия;
- трансмиссивная энцефалопатия.
Диагностика
Диагностика прионных болезней основана на обнаружении когнитивных расстройств, их прогрессирующем развитии, и уже на промежуточной стадии развития – не специфических нарушений ЭЭГ, постепенно переходящих на специфические паттерны (burst suppression pattern) с миоклониями в клинической и ЭМГ картине, эпилептическими приступами.
В спинномозговой жидкости присутствует только белок 14-3-3.
При спорадической форме болезни Крейцфельдта-Якобса МРТ на взвешенном изображении Т2 демонстрирует гиперинтенсивность в базальном и хвостовом ядре. При новом варианте заболевания она присутствует в пульвинарном таламусе, имеет форму клюшки.
Тестирование ДНК поможет выявить генетические и семейные формы расстройств, что означает выявление мутации E200K.
Подтверждением клинико-диагностического заключения являются иммуногистохимическое и нейрогистологическое исследование ткани головного мозга.
- типичная нейроцитарная вакуолизация;
- спонгиоматозная дегенерация нейропилы;
- потеря нервных клеток;
- астроглиоз;
- наличия скрепи-ассоциированных фибрилл в пораженном мозге.

Как замедлить течение прионной болезни
До недавнего времени было сложно замедлить прионную болезнь, не говоря о ее излечении.
Современная нейрохирургия может облегчить дегенеративные осложнения путем пересадки нейронов при прионом заболевании.
Врачи намерены использовать эту возможность очистить нейроны от патогенных протеинов для лечения нового варианта болезни Крейтцфельда-Якобса у людей. Дальнейшие исследования должны помочь улучшить лекарства, которые смогут очистить мозг и его микроглии от прионов.
Недавно М. Пфайфер и несколько других немецких ученых обнаружили и подтвердили способ, позволяющий очистить мозг от прионов. Они доказали, что РНК-интерференция может успешно лечить заболевания путем удаления из РНК-клетки части, ответственной за выработку патогенных белков. Это предотвратило их мутацию в опасные протеины.
Подобный метод – воздействие искусственно синтезируемых праймеров (олигонуклеотидов) против прионов. Как и РНК-интерференция, конструирование праймеров находится на стадии исследования.
Теоретически перспективным в лечении болезней может быть пептид PrP13, аналогичный структурному продукту, встречающемуся при этих заболеваниях. Вещество нацелено на ген PRNP, что должно повлиять на превращение PrPC в PrPres. Последняя названная патогенная молекула изменяется в структуру, подобную PrPC. Вещество используется под аббревиатурой PrP13, а его исследования на животных смогли продлить выживаемость на 50-300%.
Профилактика
В вопросе профилактики важно учитывать причины, по которой нейроны погибают при прионном заболевании. Предотвращение спорадических и наследственных форм инфекций не существует. Экспериментально ученые пытаются найти вещество, стабилизирующее белок в физиологической конформации, чтобы предотвратить его переход к конформационной патологии.
Для профилактики переносимых форм заболевания важно избегать всех влияющих факторов риска.

Американские биологи провели обширное метагеномное исследование с целью выявить функциональный состав геномов гигантских вирусов — как уже открытых, так и неизвестных науке (последние, естественно, изучаются пока только по нуклеотидным последовательностям). Гигантскими вирусами называется открытая в 2003 году группа очень крупных вирусов эукариот: они бывают крупнее некоторых клеток и имеют огромные геномы, в рекордных случаях тоже превосходящие размерами многие клеточные. Самые крупные известные представители гигантских вирусов паразитируют в пресноводных амебах. Анализ геномов показал, что у гигантских вирусов (особенно у семейства мимивирусов) есть аналоги множества клеточных генов, и в том числе генов, кодирующих ферменты метаболизма углерода. Многие гигантские вирусы имеют собственные ферменты гликолиза, глюконеогенеза и даже цикла Кребса. Соответствующие гены, конечно, были заимствованы вирусами от клеточных организмов. Но эти заимствования произошли давно (даже в эволюционном масштабе времени). Исследователей поразил сам факт, что у вирусов могут не только случайно появляться, но и устойчиво сохраняться в разных эволюционных ветвях гены, связанные с такими глубинными механизмами обмена веществ, которые раньше считались исключительной принадлежностью клеток.
Принято считать, что вирусы — это самые мелкие и самые простые живые организмы. Понимание того, что вирусы — отнюдь не бактерии, когда-то возникло под влиянием двух фактов: оказалось, что они, во-первых, невидимы под световым микроскопом, и во-вторых, свободно проходят сквозь фильтры, предназначенные для задержки бактерий. И то, и другое объясняется тем, что вирусы — а точнее, их компактные расселительные формы (вирионы) — как правило, чрезвычайно малы по меркам обычной биологии, изучающей животных, растения или даже микробов.
Для всех выделенных последовательностей авторы построили общее филогенетическое древо, добавив туда и некоторое количество референтных геномов, принадлежащих вирусам, которые уже заведомо известны (рис. 2). На этом древе вновь открытые вирусы распределились по шести семействам: оказалось, что большинство из них относится к мимивирусам и фикоднавирусам, а некоторые — к иридовирусам, асфарвирусам, марсельвирусам или питовирусам. Здесь, между прочим, хорошо видно, какое место занимает в современной биологии эволюционный подход. Раньше биологи сначала изучали живые организмы по отдельности, описывая в деталях их устройство, и только потом отваживались строить гипотезы о филогенетических отношениях между ними. Построенное филогенетическое древо было высшим уровнем исследовательской работы, ее венцом. Теперь же построение такого древа стало рутинной технической процедурой, и исследование (во всяком случае, биоинформатическое) с нее начинается. Авторы сначала выясняют хотя бы в общих чертах, какие места на филогенетическим древе занимают открытые ими существа, а уж потом переходят к подробностям.


Все это, однако, в целом было более или менее известно и раньше. Удивило исследователей другое. Оказалось, что у гигантских вирусов достаточно широко распространены гены, кодирующие ферменты, которые принимают участие в обмене углерода, в частности в таких процессах, как гликолиз (распад молекул глюкозы надвое, протекающий в несколько ступеней с выделением энергии) и глюконеогенез (синтез той же глюкозы из других соединений, например из аминокислот). Обмен углерода — это самая что ни на есть основа метаболизма живых клеток. Это центр, к которому сходятся все цепочки идущих в клетке химических реакций. Теперь выяснилось, что гигантские вирусы вторгаются даже сюда, причем очень основательно. Например, почти для каждого фермента гликолиза можно найти альтернативный ген, входящий в состав генома того или иного гигантского вируса. Особенно богато такими генами семейство мимивирусов, хотя и в других семействах они тоже встречаются. В нескольких вирусных геномах обнаружены блоки как минимум из двух генов, кодирующих ферменты смежных реакций гликолиза: иными словами, там фактически закодирован целый сплошной отрезок этого биохимического пути. У одного гигантского вируса есть гены, кодирующие аж 7 из 10 основных гликолитических ферментов, — то есть две трети реакций гликолиза этот вирус может провести сам, без поддержки клеточного генома. Причем вирусные ферменты гликолиза заметно отличаются от клеточных (в чем функциональный смысл отличий — еще предстоит разобраться, это интересная проблема). Можно ли после этого сомневаться в том, что у вирусов бывает свой метаболизм?
Еще интереснее, что у некоторых гигантских вирусов есть гены, кодирующие ферменты цикла Кребса, он же цикл трикарбоновых кислот (рис. 3). Цикл Кребса — это замкнутая цепочка химических реакций, служащая центром пересечения великого множества метаболических путей и являющаяся у организмов, дышащих кислородом, ключевым этапом клеточного дыхания (впрочем, цикл Кребса важен и в других отношениях). Казалось бы, ну зачем все это вирусам? Однако выяснилось, что не менее восьми ферментов цикла Кребса имеют у гигантских вирусов свои аналоги, причем более или менее широко распространенные. Соответствующих вирусных генов на самом деле еще больше: например, такой фермент, как сукцинатдегидрогеназа, состоит из трех субъединиц, каждая из которых кодируется отдельным геном — и все эти гены у вирусов есть. Пока, правда, не совсем понятно, как именно они их используют, но как-то используют точно: ген, на протяжении эволюционно значимого срока сохраняющийся в геноме в работоспособном состоянии, не может не иметь функции.


Рис. 3. Цикл Кребса, он же цикл трикарбоновых кислот. Ферменты цикла Кребса, гомологи которых есть у гигантских вирусов: цитратсинтаза (CS), аконитаза (ACON), изоцитратдегидрогеназа (ICD), изоцитратлиаза (ICL), сукцинатдегидрогеназа (SDA, SDB, SDC — три ее субъединицы), фумаратгидратаза (FH), малатсинтаза (MS), малатдегидрогеназа (MDH). Числа в цветных квадратиках — это число вирусных геномов, в которых обнаружен ген данного фермента. Они указаны отдельно для каждого семейства вирусов (см. легенду сбоку). Как видим, для некоторых ферментов эти числа измеряются десятками. Фрагмент иллюстрации из обсуждаемой статьи в Nature Communications
Источник: Mohammad Moniruzzaman, Carolina A. Martinez-Gutierrez, Alaina R. Weinheimer, Frank O. Aylward. Dynamic genome evolution and complex virocell metabolism of globally-distributed giant viruses // Nature Communications. 2020. V. 11. № 1. P. 1–11. DOI: 10.1038/s41467-020-15507-2.
Читайте также:

