Генетический вирус от спида
Обновлено: 15.04.2024
ВИЧ обладает огромной вариабельностью генома – способностью очень быстро мутировать – намного быстрее, чем, например, вирус гриппа. Именно поэтому с ВИЧ так сложно бороться: разработка вакцин и эффективной терапии упирается в то, что вирус опережает ученых.
Для решения этих задач необходимо, прежде всего, знать, с кем мы имеем дело – то есть знать обо всем разнообразии вируса, и о том, как он меняется.
Это важно понимать и для целей практической медицины: если, например, появилась новая группа, подтип или вариант ВИЧ, необходимы диагностические системы, которые могут их определять.
О том, как происходит изучение мутаций ВИЧ, его эволюции и о новых диагностических системах, которые позволяют улавливать малейшие изменения в геноме вируса, рассказал вице-президент отдела прикладных исследований и технологий компании Abbott доктор Джон Хэкет (John Hacket). Кстати, Abbott была первой компаний, создавшей в 1985 году тест на определение антител к ВИЧ, то есть тест, позволявший диагностировать вирус в крови.
Быстрее гриппа
В настоящее время известно о существовании двух типов - ВИЧ 1 и ВИЧ 2. ВИЧ 1 является наиболее распространенным типом и делится на группы – М (эта группа самая распространенная), N,O и P. Группа Р была обнаружена совсем недавно – в 2009 году у женщины из Камеруна, которая приехала во Францию. В группе М существует еще и множество подтипов. При этом постоянно происходит образование новых вариантов. Не исключено, что скоро возникнут новые группы и подтипы вируса.
Во-вторых, ВИЧ реплицируется (размножается) необыкновенно быстро: в больном, который не получает лечение, образуется до десяти миллиардов вирусных частиц в день.
В-третьих, вирус обладает способностью к рекомбинации: например, если человек инфицирован разными суб-типами ВИЧ, они рекомбинируют между собой в организме человека, что и приводит к образованию нового варианта вируса.
Когда медикам и ученым стало понятно, что разнообразие ВИЧ столь велико, появилась необходимость в создании диагностических систем, которые могли бы не только определять все типы, группы и подтипы, известные на данный момент, но и выявлять новые. Ведь иначе можно получить ложноотрицательный результат, пропустив в образце варианты вируса, которых диагностическая система просто не знает.
На данный момент в рамках программы уже собрано более 25 тысяч образцов ВИЧ и гепатита В из 16-ти стран. Особое внимание удаляется очагам в Африке – поскольку именно там наблюдается максимальное разнообразие вариантов ВИЧ. В программе участвовали также 10 медицинских центров из России.
Для обнаружения новых вариантов ВИЧ используются самые современные научные методы, такие как секвенирование генома, включая глубокое секвенирование.
На этой неделе китайский учёный сообщил о рождении генетически отредактированных близнецов. В их геном были внесены изменения, позволяющие почти полностью исключить риск развития хронической ВИЧ инфекции. 1% европейцев обладают такой устойчивостью с рождения. Рассказываем о появлении и механизме резистентности к ВИЧ.
Более 40 миллионов человек по всему миру заражены вирусом иммунодефицита человека (ВИЧ). Если сразу после заражения иммунная система не успевает уничтожить все вирусные частицы, они могут проникнуть внутрь клеток и встроиться в их геном. В результате этого человек становится носителем инфекции. Хроническая ВИЧ инфекция на сегодняшний день неизлечима, однако поддается контролю и в случае своевременной терапии не оказывает сильного влияния на самочувствие человека.
Для проникновения в клетку ВИЧ должен связаться с двумя рецепторами на ее поверхности. Один из рецепторов – CD4, присутствует на поверхности T-лимфоцитов и отвечает за распознавание чужеродных агентов. Второй рецептор, необходимый для слияния оболочки вируса и клетки, - CCR5. Его роль в иммунной реакции до конца не изучена, предполагается, что он участвует в развитии воспалительной реакции.

У некоторых людей с рождения есть защита от ВИЧ, обусловленная наличием в их геноме мутаций. Это снижает риск развития хронической инфекции даже в случае заражения. Одной из них является мутация в гене рецептора CCR5, представляющая собой потерю части гена (32 нуклеотида) - ССR5Δ32. В результате вирус не может связаться с рецептором и проникнуть в клетку.
При этом риск развития хронической инфекции низкий только у гомозиготных носителей мутации - у тех, кому мутантный ген достался от обоих родителей. Существуют противоречивые данные о влиянии мутации только в одной копии гена CCR5 на риск развития ВИЧ: от наличия защиты до отсутствия какого-либо влияния на течение заболевания.

Предполагается, что мутация ССR5Δ32 возникла около 1000 лет назад в Северной Европе среди викингов. Распространение мутации в Европе обычно связывают с набегами викингов на соседние народы. Длительное время было непонятно, что способствовало распространению и закреплению мутации среди народов Европы, ведь ВИЧ — сравнительно молодая инфекция, и носители этой мутации не получали какого-либо преимущества. Однако впоследствие было обнаружено, что кроме ВИЧ эта мутация также снижает вероятность заразиться черной оспой, многочисленные эпидемии которой в свое время привели к массовой гибели людей по всему миру.
В настоящее время частота встречаемости этой мутации в странах Европы составляет около 10%. Частота мутации среди клиентов Genotek оказалась равной 9,7%. При этом только 1,1% людей оказались носителями мутации в двух копиях гена CCR5, они имеет низкий риск развития хронической инфекции даже в случае заражения.
Гомозиготное носительство делеции в гене CCR5 не является абсолютной защитой от заражения ВИЧ и поводом не использовать до- и пост-контактную профилактику при угрозе заражения. Известны единичные случаи, когда у людей с таким генотипом развивалось хроническое носительство ВИЧ после заражения. Возможно, это связано с тем, что кроме CCR5, вирус может использовать другие рецепторы для проникновения в клетки (например, рецептор СXCR4).

Один известный случай излечения человека от хронической ВИЧ инфекции связан с этой мутацией. Тимоти Браун, или Берлинский пациент, был заражен ВИЧ и болен лейкемией. Ему требовалась пересадка костного мозга. Врач смог подобрать донора, гомозиготного по мутации в CCR5. Через 20 месяцев после операции, несмотря на отсутствие терапии, ВИЧ перестал обнаруживаться в крови, костном мозге и слизистой оболочке кишечника пациента.
А совсем недавно российским ученым удалось получить человеческие эмбрионы с измененным геном CCR5, используя 16 оплодотворенных яйцеклеток не пригодных для программ ЭКО. Из 16 модифицированных яйцеклеток, только 8 продолжили развитие, причем в 5 из них модификация прошла успешно и обе копии гена были изменены.
А в ноябре 2018 года было распространено заявление ученого из Китая, которому якобы удалось провести аналогичный эксперимент, в результате которого родились девочки-близнецы, у одной из которых мутация в CCR5 присутствует в двух генах, а другой - только в одном. Родители близнецов приняли решение не раскрывать своих имен и места жительства, никаких других доказательств, кроме заявления врача, также нет.
Проведя тщательный анализ этого образца, группа ученых во главе с Майклом Уороби (Michael Worobey) из университета Аризоны показала, что этот мужчина был инфицирован ВИЧ — вирусом, вызывающим синдром приобретенного иммунодефицита.
При жизни ни сам мужчина, ни его лечащие врачи об этом не знали. Формально вирус будет открыт лишь 17 лет спустя.
Извлекая крошечные генетические фрагменты из образца ткани, команда Уороби практически полностью реконструировала геном ВИЧ в том виде, в котором он существовал в те годы. А сама работа ученого помогла пролить свет на возникновение того, что станет причиной одной из самых важных пандемий в истории человечества.
В погоне за образцами
Вирус иммунодефицита человека был выявлен в 1980-х, после того как таинственный новый синдром затронул жителей США, и, как казалось, тогда он появился из ниоткуда. На самом деле эпидемия зародилась за несколько десятилетий до этого, просто на совсем другом континенте. В Африке.
Теперь мы можем с уверенностью утверждать, что по мере распространения геном вируса претерпевал постоянные изменения: сравнивая накопившиеся мутации и оценивая время, за которое они произошли, ученые могут проследить историю эволюции вируса вплоть до самого момента возникновения.
по теме

Общество
Наиболее вероятное место его появления — южный Камерун. А приблизительное время — 1920-е годы. Именно там и тогда вирус от шимпанзе перешел к человеку, перед тем как вскоре перебраться в город, известный в наше время как Киншаса.
В густонаселенном и быстрорастущем регионе с множеством потенциальных реципиентов вирус и обосновался, чтобы затем распространиться по всему миру.
Очевидно, что огромное количество людей тогда было инфицировано ВИЧ еще прежде, чем кто-то узнал о его существовании. Образцы тканей некоторых из погибших сохранились до наших дней: они рутинно собирались для исследований патологоанатомами, обрабатывались химическим фиксатором, располагались на восковых подложках, изучались под микроскопом (скорее всего, безрезультатно), а затем отправлялись в хранилище.
Но поскольку вирус до своего появления на Западе не был идентифицирован, определить заранее, какой именно образец ткани, взятый в то время, может содержать его следы, невозможно. Искать следы вируса в таких условиях — все равно что искать иголку в тысяче стогов сена.
Более того, процесс обработки химическим фиксатором и условия хранения образцов, дошедших до нашего времени, были таковы, что негативно влияли на содержащиеся в них РНК — молекулы, составляющие геном ВИЧ.
Вирус ВИЧ под микроскопом. Компьютерная Модель.
Однако нет ничего странного в том, что за два десятилетия поисков ученым удалось найти лишь два образца со следами вируса, собранных в Киншасе в период до его открытия.
Дэвид Хо (David Ho) из университета Рокфеллера (Rockefeller University) нашел следы вируса в образце крови, взятой в 1959 году; Уороби обнаружил их в кусочке лимфатического узла из 1960 года.
В обоих случаях от молекул РНК в целом сохранилось около одного процента. Но даже этих крошечных кусочков оказалось достаточно, чтобы доказать: именно ВИЧ блуждал по Киншасе за десятилетия до его открытия, а также чтобы наметить основные вехи истории его эволюции.
В то же время, ввиду ненадежности фрагментарных свидетельств, Уороби хотел собрать геном полностью. Целиком.
Его коллеги Софи Грисилс и Том Уоттс (Sophie Gryseels and Tom Watts) для этого разработали более точную технологию извлечения РНК и применили ее к более чем 1600 образцам тканей из Университета Киншасы (University of Kinshasa). И один из них, как оказалось, действительно содержал следы вируса.
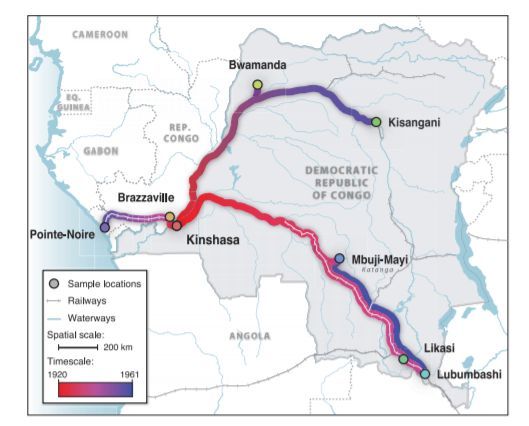
Скрытая эпидемия. Пути распространения ВИЧ в Африке до того, как вирус попал в США.
Место и время
Извлеченные образцы оказались больше всего похожи на подтип С, наиболее распространенный тип ВИЧ в Африке. Тот, что и сейчас доминирует в южной части континента.
На поверку генетический материал, попавший в руки ученых, является лишь малой частью того разнообразия, которое существовало в Киншасе в 1960-е.
А стало быть, из всех подтипов вируса лишь некоторые из тех, что в то время можно было обнаружить в городе, вырвались наружу, дабы стать общемировой проблемой.
История ВИЧ в датах
1930-е
Исследователи полагают, что приблизительно в 1930-х некая форма вируса иммунодефицита обезьян (SIV) перебралась к людям во время разделки или поедания мяса шимпанзе в Демократической Республике Конго. Этот вирус стали называть ВИЧ-1, и это самый распространенный тип вируса на сегодняшний день.
1959
Первый известный случай заболевания СПИДом выявлен при исследовании образцов плазмы крови мужчины, умершего в Демократической Республике Конго в 1959 году.
1960-е
ВИЧ-2, ареал распространения которого ограничен западной частью Африки, перешел к людям от обезьян вида дымчатый мангобей в Гвинее-Бисау в 1960-х.
Генетический анализ вируса, проведенный в 2003 году, говорит, что именно этот тип, вероятно, впервые перебрался в Соединенные Штаты примерно в 1968 году.
1970-е
На протяжении 1970-х вирус, оставаясь незамеченным, продолжает распространяться по США и остальному миру, начинается эпидемия.
1981
Высокая распространенность двух редких заболеваний — саркомы Капоши и пневмонии — отмечена среди молодых гомосексуальных мужчин в Нью-Йорке и Калифорнии в США. Это первый задокументированный случаи СПИДа. К концу года уже 121 человек умер от таинственного заболевания.
1982
Ученые центра по контролю и профилактике заболеваний (Centers for Disease Control and Prevention, CDC) в Атланте, США, предположили, что нарушение работы иммунной системы среди гей-сообщества вызвано инфекционным заболеванием. Они ввели термин Синдром приобретенного иммунодефицита (СПИД) и установили, что помимо геев в группу риска входят потребители инъекционных наркотиков, люди гаитянского происхождения и больные гемофилией. К концу 1982 года СПИД был обнаружен на пяти континентах.
1983
Эпидемия СПИДа бурно развивается в Европе: в первую очередь среди гей-сообщества, а также среди людей, имеющих тесные связи с центральной Африкой.
Начинается расследование случаев СПИДа в Руанде, Заире и других африканских странах.
1984
Используя недавно разработанные техники, в ходе нескольких исследований независимо друг от друга Люк Монтанье (Luc Montagnier) из Института Пастера в Париже (the Pasteur Institute in Paris), Франция, и Роберт Галло (Robert Gallo) из Национального института раковых заболеваний (the National Cancer Institute) в Вашингтоне, округ Колумбия, США, обнаруживают ретровирус, ответственный за развитие заболевания, известного как СПИД. Позднее он будет назван вирусом иммунодефицита человека (ВИЧ).
Случаи заболевания СПИДом все чаще начинают появляться в среде гетеросексуалов.
1985
В Атланте, США, проведена первая конференция, посвященная проблемам СПИДа.
Вслед за прошлогодним открытием вируса на рынке появляется первый метод тестирования на ВИЧ, одобренный Управлением по контролю за продуктами и лекарствами США (US Food and Drug Administration, FDA).
В США начинается тестирование крови в донорских пунктах.
1987
Азидотимидин (AZT), также известный как Зидовудин, первый противовирусный препарат, становится доступным для лечения ВИЧ после клинических испытаний. Препарат работает, блокируя действие обратной транскриптазы фермента ВИЧ, не давая вирусу размножаться в клетках. AZT замедляет развитие СПИДа, отдаляя смерть.
К 1987 году 16908 человек умерли от СПИДа в США. Всего Всемирная организация здравоохранения (ВОЗ) сообщила о 71571 случае заболевания СПИДом, из которых 47022 — в США.
По оценкам Всемирной организации здравоохранения, по всему миру носителями ВИЧ являются от 5 до 10 миллионов человек, ВОЗ запускает глобальную программу по борьбе со СПИДом.
1988
ВОЗ объявила 1 декабря всемирным днем борьбы с ВИЧ/СПИДом.
1991
Красная лента стала международным символом борьбы с ВИЧ/СПИДом.
1992
В США СПИД вышел на первое место среди причин смертности мужчин в возрасте от 24 до 44 лет.
Первые комбинированные лекарственные препараты для лечения ВИЧ появляются на рынке, после того как FDA наряду с AZT одобрило использование Zalcitabine (ddC), который также блокирует обратную транскриптазу.
Комбинированные препараты против ВИЧ оказываются более эффективными, а комплексное лечение замедляет развитие лекарственной резистентности.
1994
Использование AZT для предотвращения передачи ВИЧ от матери ребенку во время беременности рекомендовано в США. Исследование показало, что подобная терапия снижает шанс передачи вируса во время беременности до 8 %, в контрольной группе вероятность передачи составляла 25 %.
Через 12 лет после открытия вируса правительство США впервые запускает кампанию в медиа по пропаганде использования барьерных контрацептивов.
1995
ВОЗ объявила о достижении количеством зараженных миллионной отметки, всего же с начала эпидемии ВИЧ вирусом заразились более 19,5 миллиона человек.
1996
Международная инициатива по вакцинации против СПИДа (IAVI) — некоммерческая организация, базирующаяся в Нью-Йорке, — создана для ускорения поиска вакцины против ВИЧ.
90 % всех заболевших теперь проживают в развивающихся и развитых странах.
1997
Впервые благодаря появлению ВААРТ отмечено резкое падение смертности от СПИДа.
ООН объявляет, что к 2010 году 40 миллионов детей могут потерять одного или обоих родителей из-за СПИДа.
1998
Первые полномасштабные испытания вакцины против ВИЧ начинаются в США.
Две команды исследователей начинают разработку вакцин против штаммов ВИЧ, распространенных в странах Африки к югу от Сахары
В Сан-Франциско обнаружен штамм ВИЧ, устойчивый ко всем лекарственным средствам, подавляющим протеазу, которые в то время существовали на рынке. У некоторых пациентов, использующих для лечения ингибиторы протеазы, встречаются необычные побочные эффекты, такие как рост жировых отложений и проблемы с сердцем.
1999
33 миллиона человек инфицированы ВИЧ, а 14 миллионов умерли от СПИДа по всему миру.
СПИД становится одним из четырех самых массовых убийц современности.
2001
Индийская компания начинает продавать копии дорогих запатентованных лекарств против СПИДа через медицинскую благотворительную организацию в Африке. Этот шаг заставляет некоторые фармацевтические компании снижать цены.
2003
5 миллионов новых случаев СПИДа выявлены на протяжении 2003 года — самое большое количество с начала эпидемии. 3 миллиона человек умерли от СПИДа в этом же году.
2005
Около 40 миллионов человек инфицированы ВИЧ по всему миру.
Высокорезистивный штамм вируса, вызывающий быстрое развитие СПИДа, обнаружен в Нью-Йорке, США.
По оценкам ученых, сам ВИЧ возник где-то между 1896 и 1905 годом. Далеко не все вирусы так молоды. Когда ученые впервые обнаружили следы гепатита B времен Бронзового века, они подсчитали, что вирус менялся в 100 раз медленнее, чем предполагалось до этого. Открытие кардинально изменило предполагаемый период его возникновения. Даже ВИО (вирусы иммунодефицита обезьян), ближайшие родственники ВИЧ, поражающие шимпанзе, эволюционировали с разной скоростью в далеком прошлом и в новейшей истории, что делает оценку времени возникновения очень сложной.
В целом именно благодаря этому факту статистическими методами ученым удалось достаточно точно локализовать время и место начала пандемии. Установить, что с 1920-х годов именно Киншаса, ныне столица Демократической Республики Конго, стала центром первого очага эпидемии ВИЧ, а также положила начало эпидемии 1960-х годов в других частях континента.
Отсюда, из Киншасы, вирус прибыл на Гаити примерно в 1964 году. Причиной тому стало возвращение на родину жителей этого островного государства. До середины 60-х многие жители Гаити работали в только что получившем свою независимость Конго в качестве специалистов. И значительная часть гаитянских работников проживала именно в Киншасе.

Миграция из Гаити в США. Вторая половина 60-х тут наблюдается резкий рост. ВИЧ попадет в США именно в этот период.
Уже с Гаити вирус вместе с мигрантами перебрался на материк — в Соединенные Штаты Америки. Где очень быстро распространился среди гомосексуалов, воспользовавшись относительной уязвимостью перед ВИЧ именно этой группы.
Первые смерти от симптомов, крайне похожих на СПИД, будут зафиксированы здесь (преимущественно среди афроамериканских геев) уже в конце 60-х. Накануне знаменитых Стоунвольских бунтов, органично связанных с борьбой за права черного населения Америки и ставших отправной точкой эмансипации ЛГБТ-движения, завершившегося нынешней либерализаций законодательства относительной однополых браков и партнерств практически во всех западных странах.
Работа Уороби подтвердила эти и некоторые другие тезисы. Не на моделях, а на реальном генетическом материале.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.

по теме

Лечение
Лучшие научпоп-статьи 2018 года
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Научно-диагностический центр лабораторных технологий

Телефоны для справок:

Личный кабинет клиента

В корзине пусто!
Вирус иммунодефицита человека (HIV) провирусная ДНК
Подготовка к исследованию
Специальной подготовки не требуется.
Показания к исследованию
Обследование детей, рожденных от ВИЧ-инфицированных матерей (в возрасте до 18 месяцев);
В случаях сомнительных результатов определения антител методом иммуноблота и положительных результатов определения антител методом ИФА.
Интерпретация
Определение ДНК провируса у детей, рожденных от ВИЧ-инфицированных матерей, желательно проводить в возрасте до 48 часов жизни, 1-2 месяца, 3-6 месяцев.
Получение положительных результатов определения ДНК ВИЧ в двух отдельно взятых образцах крови у ребенка старше 1 месяца является лабораторным подтверждением диагноза ВИЧ-инфекции. Получение двух отрицательных результатов определения ДНК ВИЧ у ребенка в возрасте 1-2 месяцев и 4-6 месяцев (при отсутствии грудного вскармливания) исключает наличие ВИЧ-инфекции. Но снятие с диспансерного учета может осуществляться только в возрасте старше 1 года.
Определение ДНК провируса ВИЧ возможно использовать в ранней диагностике возможного инфицирования после эпизода повышенного риска (на 10-й день после потенциального инфицирования). Однако для полного исключения ВИЧ-инфекции необходимо в последующем проведение повторного исследования и серологической диагностики в сроки 4 и 12 недель.
На результаты могут влиять
загрязнение биоматериала;
наличие в образце ингибиторов – химических и белковых субстанций, влияющих на различные компоненты ПЦР;
присутствие в крови гепарина.
Пуповинная кровь для исследования не пригодна из-за возможного содержания в ней материнской крови.
Назначается в комплексе с
HIV (ПЦР количественный)

+(998 71) 256-09-19

c 08:00 до 18:00, Пн-Пт

c 08:00 до 16:00, Сб
Читайте также:

