Генитальный герпес и мононуклеоз
Обновлено: 24.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Генитальный герпес: причины появления, классификация, симптомы, диагностика и способы лечения.
Определение
Генитальный герпес – хроническое рецидивирующее заболевание вирусной этиологии, передающееся преимущественно половым путем. Герпес считается крайне распространенным эрозивно-язвенным заболеванием половых органов - ежегодно в мире регистрируется 500 000 новых случаев обращений по этому поводу. В Российской Федерации у лиц старше 18 лет инфицированность вирусом, вызывающим генитальный герпес, составляет 17,2 случая на 10 000 населения.
В 70% случаев заболевание протекает бессимптомно, что и обусловило широкое распространение этой патологии.
Причины появления генитального герпеса
Генитальный герпес вызывает вирус простого герпеса (ВПГ) I и/или II типов. Вирус герпеса I типа чаще всего поражает слизистую оболочку рта и носит название орального (лабиального) герпеса. При заражении этим вирусом очаги поражения локализуются на лице в области губ.
Вирус герпеса II типа чаще вызывает генитальный герпес, однако оба типа могут провоцировать развитие патологии оральной и генитальной локализации. Для ВПГ II типа более характерно рецидивирующее течение, чем для ВПГ I.
- Половой путь – самый часто встречающийся путь передачи генитальной герпетической инфекции.
- Передача вируса бытовым путем является самой редкой.
- Аутоинокуляция – перенос вируса с зараженных участков слизистой на здоровые самим больным.
- Трансплацентарный – через плаценту от инфицированной матери плоду.
- Перинатальный – в процессе родов.
- Контактно-бытовой (при несоблюдении правил ухода и гигиены).
- Аутоинокуляция (см. выше).
- Беспорядочная половая жизнь без использования барьерной контрацепции (презервативов).
- Нарушение правил личной и бытовой гигиены.
- Снижение иммунитета (в силу наличия длительно текущих хронических заболеваний, несбалансированного питания, подверженности частым стрессам, нарушения режима сна).
- Первый эпизод развития клинической симптоматики генитального герпеса.
- Рецидивирующая герпетическая инфекция.
- Инфекция мочеполовых органов.
- у мужчин,
- у женщин.
- Инфекция прямой кишки и перианальной кожи.
- Герпес с типичной клинической картиной.
- Атипичное течение.
Если иммунная система справляется с вирусом на этом этапе, то формируется иммунитет и носительство вируса, не исключающее рецидива заболевания при ослаблении защитных функций организма.
Если у организма нет ресурсов противостоять ВПГ, то вирус проникает во внутренние органы и фиксируется на них. При снижении иммунитета, прочих вирусных инфекциях или при обострениях хронических заболеваний ВПГ из органов вновь выходит в кровь и с ее током разносится по организму.
Симптомы генитального герпеса
При первичном инфицировании инкубационный период составляет от 1 до 10 дней, а клинические проявления длятся от 18 до 24 дней с нарастанием симптоматики в течение недели. До возникновения очагов повреждения у 50% больных появляются продромальные симптомы - парестезии, чувство жжения в генитальной области, невралгии в ягодичной, паховой бедренной областях, дизурия - и продолжаются до 24 часов. В последующем вирусное повреждение эпителия проявляется в виде везикул на эритематозном фоне с дальнейшим характерным разрешением (образованием корочек). Симптомы общей интоксикации, свойственные любой вирусной инфекции, – недомогание, слабость, субфебрилитет, головная боль - развиваются, как правило, при первичном инфицировании, при рецидиве они минимальны.
Непервичная генитальная герпетическая инфекция протекает менее выраженно: длительность клинических проявлений составляет до 15 дней, реже наблюдается бессимптомное выделение вируса, длительность слущивания поврежденного эпителия составляет всего 4-5 дней.
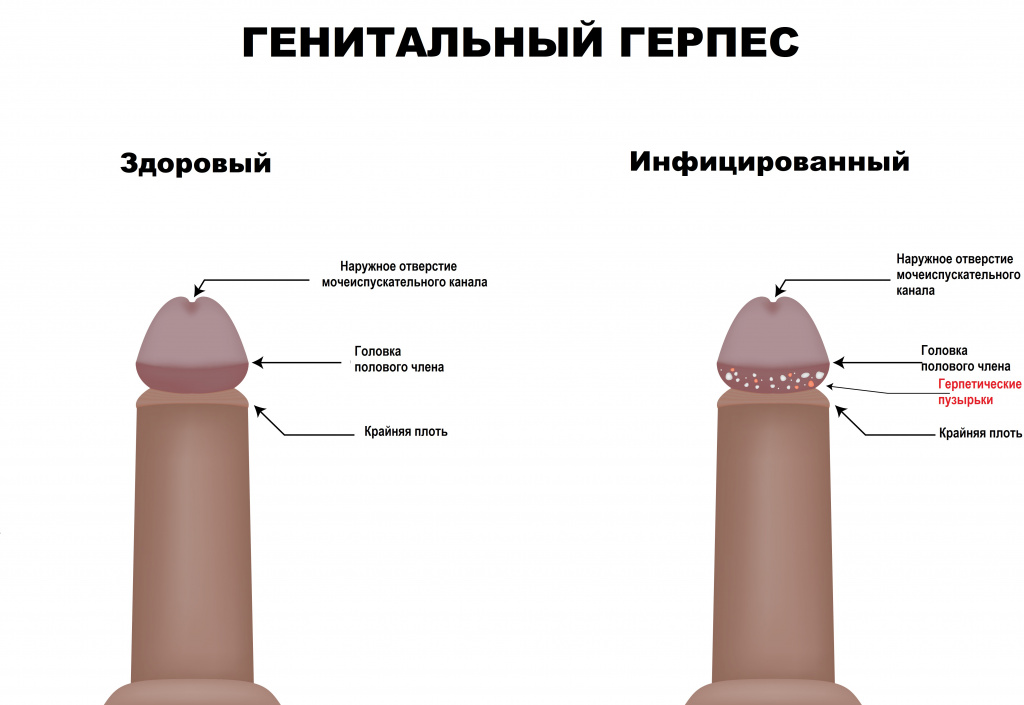
Высыпания на половых органах и/или в перианальной области всегда носят пузырьковый характер, содержимое прозрачное, основание пузырьков гиперемировано (красного цвета); могут быть множественными и единичными.
Пораженная область слизистой оболочки отечная. У мужчин самая частая локализация высыпаний – мошонка, половой член, лобок, промежность, перианальная область.
У женщин – клитор, влагалище, вульва, лобок, шейка матки, перианальная область. В случае присоединения вторичной (чаще бактериальной) инфекции появляются гнойные и слизисто-гнойные выделения.
В случае обострения генитального герпеса присутствует боль при половом контакте.
Диагностика генитального герпеса
Диагностика этого заболевания строится на характерной клинической картине высыпаний и на выявлении ДНК вируса в крови или в отделяемом с пораженных тканей.
Необходимо сдать анализы крови для подтверждения инфицированности вирусом герпеса и определения активности процесса, для выявления ДНК вируса в эякуляте, секрете простаты, в соскобе клеток урогенитального тракта, а также в соскобах с конъюнктивы, кожи, слизистой оболочки носа, ротоглотки.
Раздельное определение ДНК-вируса простого герпеса 1 типа (губного или лабиального) и 2 типа (генитального) в сыворотке крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме реального времени. Термин "герпес" (от древнегреч. – ползти, ползучи.
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано с их значительной эпидемиологической ролью и социальной значимостью в современном мире. Неуклонный рост числа герпетических заболеваний у взрослых и детей обусловливает необходимость всестороннего изучения герпетической инфекции и разработки эффективных методов профилактики и лечения разнообразных форм этой инфекции. Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия клинических проявлений, как правило, хронического течения, а также различных путей передачи вирусов.
Он входит в число наиболее распространенных и плохо контролируемых инфекций человека. Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом. По данным ВОЗ, смертность от герпетической инфекции среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%).
Герпес-вирусы объединены в обширное семейство Herpesviridae и в настоящее время наиболее четко классифицированы. Семейство Herpesviridae включает в себя более 80 представителей, 8 из которых для человека наиболее патогенны (human herpes virus-HHV). Герпес-вирусы — филогенетически древнее семейство крупных ДНК-вирусов — подразделяются на 3 подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ (табл. 1, по данным Н. Г. Перминова, И. В. Тимофеева и др., Государственный научный центр вирусологии и биотехнологий).
α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV, характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпес-вирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в ганглиях.
β-герпес-вирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму, в культуре клеток легко возникает персистентная инфекция. К этой группе относятся CMV, HHV-6, HHV-7.
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере, EBV и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
В эпидемиологическом плане наиболее интересны следующие сведения о герпес-вирусах: вирионы чрезвычайно термолабильны — инактивируются при температуре 50–52°С в течение 30 мин, при температуре 37,5°С — в течение 20 ч, устойчивы при температуре 70°С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50-процентном растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, во влажных медицинских вате и марле — до их высыхания при комнатной температуре (до 6 ч).
Уникальными биологическими свойствами всех герпес-вирусов человека является тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпес-вирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создает постоянную угрозу развития инфекционного процесса. Латенция герпес-вирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпес-вируса) ганглиев чувствительных нервов. Штаммы герпес-вирусов обладают неодинаковой способностью к персистенции и латенции и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпес-вируса свой темп персистенции и латенции. Среди изучаемых наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна-Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпштейна-Барр, герпеса человека 6 и 8 типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Герпес-вирусные инфекции широко распространены в мире и имеют тенденцию к неуклонному росту. Особенностью герпес-вирусной инфекции является возможность вовлечения в инфекционный процесс многих органов и систем, чем и обусловлено многообразие вызываемых герпес-вирусами заболеваний, варьирующих от простых кожно-слизистых до угрожающих жизни генерализованных инфекций. Важное свойство герпес-вирусов — это способность после первичного инфицирования в детском возрасте пожизненно персистировать в организме и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов.
Инфицирование человека указанными герпес-вирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: внезапная эритема (вирус герпеса человека 6 типа), афтозный стоматит (вирусы простого герпеса 1 или 2 типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейна-Барр), мононуклеозоподобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпес-вируса, влияние на течение острых и рецидивирующих герпес-вирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онкогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
Часто, особенно при снижении иммунореактивности организма, герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями, течению основного заболевания. Вирусы простого герпеса 1 и 2 типов, а также ЦМВ входят в число возбудителей TORCH-инфекций. Они играют важную роль в нарушении репродуктивной функции человека, развитии серьезных заболеваний матери, плода, новорожденного и детей младшего возраста.
Вызываемые вирусами ВПГ, CMV, ВЭБ заболевания рассматриваются как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. В 1988 г. они включены в расширенное определение случаев, подлежащих эпидемиологическому надзору по поводу СПИДа. Результаты исследований последних лет свидетельствуют о роли некоторых герпес-вирусов (ВГЧ-8, ЦМВ, ВЭБ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, рака груди, аденокарциномы кишечника и простаты, карциномы цервикального канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации — 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
Диагностика герпетической инфекции
Все методы индикации и идентификации вирусов основаны на следующих принципах:
- выявление вируса per se (электронная микроскопия);
- выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках);
- выявление и идентификация вирусов с помощью антител (МФА, ИФА, РАЛ, ИБ, РН, РСК);
- выявление и идентификация нуклеиновых кислот (ПЦР, МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить ГВ или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит
в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпес-вирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке.
Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ.
Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из различных клеточных культур.
Для обнаружения вируса герпеса используют молекулярно-биологические методы: полимеразную цепную реакцию и реакцию молекулярной гибридизации, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение герпетической инфекции
Лечение герпетической инфекции до настоящего времени остается сложной задачей. Хроническое течение процесса приводит к иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакции клеточного иммунитета, снижению неспецифической защиты организма. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения герпетической инфекции, лекарственных средств, обеспечивающих полное излечение от герпеса, не существует. Герпес-вирусная инфекция относится к трудно контролируемым заболеваниям. Это связано, в первую очередь, с разнообразием клинических поражений, развитием резистентности вируса к лекарственным средствам, наличием у герпес-вирусов молекулярной мимикрии. Поэтому для успешного лечения герпетической инфекции необходимо правильно подобрать противовирусный препарат, его дозу и длительность лечения, использовать комбинацию различных лекарств. В схемы терапии для повышения эффективности лечения необходимо также включать иммунобиологические препараты, способствующие коррекции иммунного статуса, а также патогенетические средства, облегчающие состояние пациента.
В настоящее время все антигерпетические средства подразделяются на 3 основные группы антивирусных препаратов (табл. 3).
Механизм действия химиопрепаратов (аномальных нуклеозидов: валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
В препаратах-иммуномодуляторах (алпизарин, имунофан, ликопид, полиоксидоний) активно действующие вещества обладают иммуностимулирующими свойствами в отношении клеточного и гуморального иммунитетов, окислительно-восстановительных процессов, синтеза цитокинов.
Препараты-индукторы ИФН (амиксин, неовир, циклоферон) сочетают этиотропный и иммуномодулирующий эффекты действия. Препараты индуцируют образование эндогенных ИФН (α, β, γ) Т- и В-лимфоцитами, энтероцитами, гепатоцитами.
Особое место среди средств антигерпес-вирусной терапии занимает герпетическая вакцина для активации клеточного иммунитета, его иммунокоррекции в фазе ремиссии. Вакцинация преследует 2 цели: предупреждение первичной инфекции и возникновения состояния латентности, а также предупреждение или облегчение течения заболевания.
Однако, несмотря на наличие обширного списка антигерпетических препаратов, герпес остается до сих пор плохо контролируемой инфекцией. Это обусловлено и генотипическими особенностями возбудителя, и длительной персистенцией вируса в организме, и формированием штаммов, устойчивых к антивирусным препаратам. Максимальный клинический эффект может быть получен только при рациональной комплексной терапии лекарственных средств с различным механизмом действия.
Санкт-Петербургской группой ученых вирусологов и инфекционистов во главе с В. А. Исаковым предложена программа лечения и профилактики герпетической инфекции (табл. 4).
Преимущества комплексной терапии ГИ.
- Сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект.
- Благодаря снижению дозы противовирусного ХПП уменьшается вероятность развития побочных эффектов, сокращается токсическое воздействие на организм больного.
- Снижается вероятность возникновения устойчивых штаммов герпес-вирусов к данному препарату.
- Достигается иммунокорригирующий эффект.
- Сокращается продолжительность острого периода болезни и сроков лечения.
Таким образом, терапия ГИ является сложной и многокомпонентной задачей.
По вопросам литературы обращайтесь в редакцию.
Т. К. Кускова, кандидат медицинских наук
Е. Г. Белова, кандидат медицинских наук
МГМСУ, Москва
Коварный инфекционный мононуклеоз: разберемся, чем он опасен и как его обнаружить
Сейчас все чаще можно услышать сложное и несколько пугающее название болезни — инфекционный мононуклеоз (ИМ). Но даже если это название для вас ново, вероятность, что вы или ваш ребенок уже столкнулись с его возбудителем, достаточно велика. При том, что распространенность этой болезни весьма широка, она не всегда диагностируется правильно. Это связано с тем, что проявляться мононуклеоз может по-разному — как у детей, так и у взрослых. Он способен умело маскироваться и имеет тенденцию к хронитизации. Неудивительно, что мононуклеоз считается крайне коварным явлением.
Давайте разберемся с его причинами, симптомами и, что особенно важно, с его диагностикой!

Что вызывает мононуклеоз?
Мононуклеоз у детей: симптомы и течение
Чаще всего первые проявления инфекционного мононуклеоза возникают у детей раннего возраста и впоследствии у подростков в пубертатном периоде. В любом случае для детского возраста характерно острое начало инфекции.
Какие симптомы в этом случае можно заметить?
В целом острая фаза инфекционного мононуклеоза длится около двух-трех недель. Как и другие разновидности герпес-вирусов, вирус Эпштейна — Барр склонен к сохранению в организме в латентном состоянии на всю жизнь.

Проявления инфекционного мононуклеоза у взрослых
Каковы проявления инфекционного мононуклеоза у взрослых?
Чем хуже обстоят дела с иммунитетом, тем чаще и мощнее будут рецидивы инфекции.
Скрытые опасности вируса Эпштейна — Барр
Ученые выявили тесную связь вируса Эпштейна — Барр с развитием некоторых видов новообразований (назофарингеальной карциономы) и болезней крови (лимфомы Бёркитта). Своевременное лечение обострений инфекционного мононуклеоза может снизить риск подобных осложнений.
Зачем нужна проверка на вирус Эпштейна — Барр?
Частые ангины, признаки ухудшения работы печени и другие перечисленные выше проявления встречаются при многих заболеваниях, что вызывает трудности в постановке диагноза на основе клинических проявлений. Возможности современных лабораторных исследований позволяют быстро прояснить ситуацию и сделать дифференциальную диагностику намного проще и точней.
Заболевания, под которые может маскироваться инфекция, вызванная вирусом Эпштейна — Барр:
Лабораторные тесты — это единственный и надежный способ обеспечить такую реализацию диагностики инфекционного мононуклеоза, результат который будет точным и информативным.

Лабораторная диагностика инфекционного мононуклеоза
Существует три главных критерия для лабораторного подтверждения диагноза:
Первые два пункта оцениваются с помощью развернутого общего анализа крови с лейкоцитарной формулой. Такой анализ позволяет установить процентное соотношение разных видов белых кровяных телец, выявить мононуклеары — измененные на фоне активности вируса Эпштейна — Барр белые кровяные клетки.
Серологический тест включает определение иммуноглобулинов класса М и G к нескольким видам вирусных антигенов (в том числе к капсидному, раннему и ядерному антигену) и позволяет сделать вывод о давности заражения, переходе инфекции в хроническую форму и ее реактивации (новом обострении).
Существует еще один метод диагностики инфекционного мононуклеоза, вызванного вирусом Эпштейна — Барр, — метод полимеразной циклической реакции (ПЦР). Данный метод молекулярной биологии, основанный на выявлении ДНК возбудителей инфекции, является сегодня одним из самых точных и чувствительных методов диагностики инфекционных заболеваний. ПЦР позволяет определять не только наличие инфекции, признаки ее реактивации, но вирусную нагрузку, то есть количественное присутствие вирусной ДНК в крови. Применение метода ПЦР в настоящее время можно считать лучшим вариантом для выявления первичной инфекции ВЭБ у детей раннего возраста, а также у лиц с иммунодефицитными состояниями, когда серодиагностика малоэффективна.
Диагностика инфекционного мононуклеоза в LAB4U

В сухом остатке:
Для первичной диагностики вируса Эпштейна — Барр у детей раннего возраста (до 3-х лет) применяется метод ПЦР-диагностики. Это исследование и ряд других, которые могут потребоваться при комплексном обследовании при наличии инфекционного мононуклеоза, можно всегда найти в каталоге онлайн-лаборатории LAB4U.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна–Барр: причины появления, симптомы, диагностика и способы лечения.
Вирус Эпштейна–Барр может инфицировать различные типы клеток, включая B-клетки иммунной системы (разновидность лейкоцитов – белых кровяных телец) и эпителиальные клетки слизистых оболочек.
ВЭБ является представителем ДНК-содержащих вирусов из семейства Herpesviridae (герпесвирусы), подсемейства гамма-герпесвирусов и рода лимфокриптовирусов. В процессе репликации (самокопирования) вируса экспрессируется свыше 70 различных вирусспецифических белков. В настоящее время выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции (ЕА – ранний антиген, ЕВNА-1 — ядерный антиген, VCA — капсидный антиген, LMP — латентный мембранный белок).
Другой способ заражения – контактно-бытовой (вирус передается через зубные щетки, столовые приборы, полотенца и т.д.). ВЭБ также может распространяться через кровь и сперму.
ВЭБ размножается в В-лимфоцитах и эпителиальных клетках, в связи с чем характерно многообразие клинических проявлений данной патологии. Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение В-лимфоцитов, а, наоборот, стимулирует его. В этом заключается особенность возбудителя - он размножается в клетках иммунной системы, заставляя их клонировать свою, вирусную, ДНК.
Хронический воспалительный процесс, вызванный ВЭБ, приводит к структурным и метаболическим нарушениям пораженных тканей, что является причиной возникновения разнообразной соматической патологии.
Классификация вируса Эпштейна-Барр
Единой классификации вирусной инфекции Эпштейна-Барр (ВИЭБ) не существует, к использованию в практической медицине предлагается следующая:
- по времени инфицирования – врожденная и приобретенная;
- по форме заболевания – типичная (инфекционный мононуклеоз) и атипичная: стертая, асимптомная, с поражением внутренних органов;
- по тяжести течения – легкая, средней степени и тяжелая;
- по продолжительности течения – острая, затяжная, хроническая;
- по фазе активности – активная и неактивная;
- смешанная инфекция – чаще всего наблюдается в сочетании с цитомегаловирусом.
- Инфекционный мононуклеоз (железистая лихорадка, болезнь Филатова) – распространенное инфекционное заболевание, основными проявлениями которого является подъем температуры до высоких значений, увеличение лимфатических узлов, воспаление слизистой оболочки глотки, увеличение печени и селезенки. ВЭБ в данном случае проникает через эпителий слизистых оболочек верхних дыхательных путей.
- Лимфогранулематоз (болезнь Ходжкина) и некоторые виды неходжкинских лимфом – группа заболеваний, объединенных злокачественной моноклональной пролиферацией лимфоидных клеток в лимфоузлах, костном мозге, селезенке, печени и желудочно-кишечном тракте.
- Синдром хронической усталости – состояние, характеризующееся длительным чувством усталости, которое не проходит после продолжительного отдыха.
- Синдром Алисы в стране чудес – состояние, клиническим проявлением которого является нарушение ощущения своего тела и отдельных его частей. Человек ощущает себя или части своего тела очень большими или очень маленькими по сравнению с действительностью.
- Гепатит, спровоцированный ВЭБ, часто является осложнением инфекционного мононуклеоза. Появляется слабость, тошнота, желтушность кожи и слизистых, увеличивается печень.
- Герпетическая инфекция в виде генитального или лабиального (на губах) поражения. Также возможен стоматит, вызванный ВЭБ. При активации инфекции появляется чувство жжения и боль, а затем множество маленьких пузырьков.
- Посттрансплантационная лимфопролиферативная болезнь – вторичное злокачественное заболевание, развивающееся после трансплантации гемопоэтических стволовых клеток (метод лечения, применяемый при онкологии, заболеваниях крови и др.), ассоциированное с ВЭБ-инфекцией.
- Рассеянный склероз – хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Характеризуется большим количеством симптомов и зависит от уровня поражения: часто снижается мышечная сила, угасают рефлексы, появляются параличи (обездвиженность) различных локализаций.
- Волосатая лейкоплакия – на слизистой оболочке языка по бокам, на спинке либо на его нижней части появляются белые участки с шероховатой поверхностью. Они безболезненны и не причиняют существенного дискомфорта. Основная опасность заключается в возможности озлокачествления измененных клеток слизистой.
- Назофарингеальная карцинома – злокачественное образование глотки. Среди его симптомов часто встречаются заложенность носа, потеря слуха, частые отиты, появление крови в слюне, кровянистые выделения из носа, увеличение лимфоузлов, головные боли.
- Аутоиммунный тиреоидит – хроническое заболевание щитовидной железы, при котором в организме образуются антитела к тканям щитовидной железы. При данном заболевании возможно появление зоба (увеличение щитовидной железы), развитие симптомов гипотиреоза: отеки, повышенная утомляемость, сонливость, запоры, сухость кожи, выпадение волос.
Лабораторное обследование включает:
-
вирус Эпштейна–Барр, определение ДНК в крови (Epstein Barr virus, DNA);
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Инфекционный мононуклеоз: причины появления, симптомы, диагностика и способы лечения.
Определение
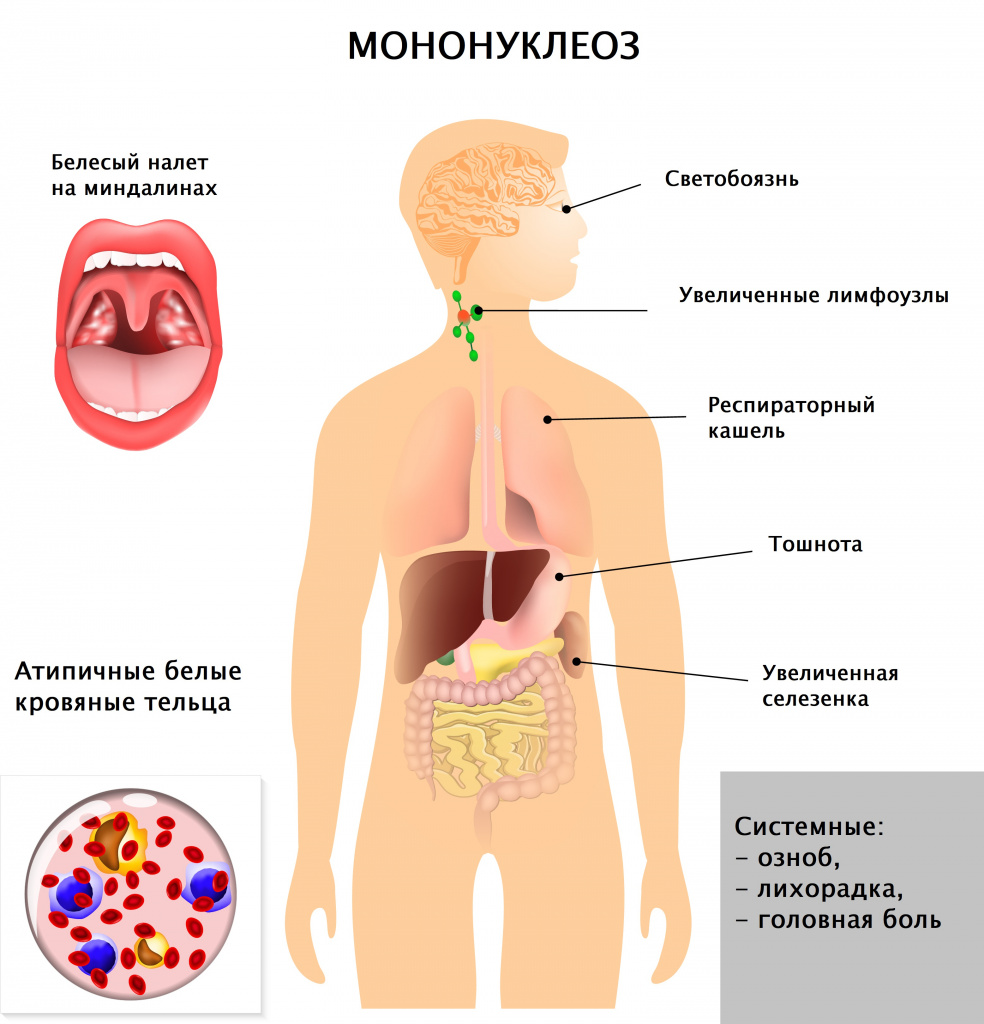
Инфекционный мононуклеоз – заболевание вирусной природы, при котором развивается лихорадка, увеличиваются печень и селезенка, лимфатические узлы, поражаются гортань, глотка. В крови регистрируются свойственные только этой патологии изменения (появление атипичных мононуклеаров, лимфоцитоз). В ряде случаев инфекционный мононуклеоз имеет хроническое течение, при некоторых состояниях клиническая картина стерта, что существенно затрудняет диагностику и постановку верного диагноза.
Причины появления инфекционного мононуклеоза
Заболевание вызывают вирусы семейства герпесвирусов, самым частым возбудителем считается вирус Эпштейна–Барр (ВЭБ, или вирус герпеса человека 4-го типа). Большинство людей переносят его в стертой клинической форме в детстве и юношестве, что подтверждается анализами крови на содержание иммуноглобулинов, которые вырабатываются в ответ на попадание вирусов в организм человека: по статистике у 9 из 10 взрослых положительные анализы крови на ДНК этого вируса.
Пути передачи вируса, вызывающего инфекционный мононуклеоз:
- Воздушно-капельный.
- Контактно-бытовой (в том числе половой).
- Парентеральный – во время переливания крови, пересадки органов и тканей в течение 6 предшествующих заболеванию месяцев.
К предрасполагающим факторам развития болезни относятся такие состояния, как снижение иммунитета, длительно текущие заболевания или обострение хронических патологий, неблагоприятная психоэмоциональная и экологическая обстановка.
Классификация заболевания
Единой общепринятой классификации инфекционного мононуклеоза нет. Для удобства формулировки диагноза используются следующие разделения патологии на группы:
По возбудителю:
- Вирус Эпштейна–Барр (ВЭБ).
- Цитомегаловирус.
- Вирус герпеса 6-го и 7-го типов (HV6, HV7).
- Аденовирус.
- Вирус иммунодефицита.
- Toxoplasma gondii (токсоплазма).
- Типичный – свойственная мононуклеозу клиническая картина и патогномоничные (характерные только для этого заболевания) изменения в анализах крови.
- Атипичный – стертая клиника, бессимптомное течение.
- Острый инфекционный мононуклеоз – проявления заболевания регистрируются в течение не более 3 месяцев.
- Затяжное течение (3–6 месяцев).
- Рецидивирующее течение – симптомы патологии возникают вновь через 1 месяц и менее после перенесенного заболевания.
- Хроническое – симптомы беспокоят более 6 месяцев.
Симптомы инфекционного мононуклеоза
Диагностика инфекционного мононуклеоза
Врач в первую очередь собирает анамнез и проводит визуальный осмотр пациента. При осмотре обращают на себя внимание увеличенные группы лимфатических узлов (в тяжелых случаях не только шейной группы, но даже внутренние лимфатические узлы), гиперемия (краснота) зева, увеличение селезенки и печени, которое врач выявляет при пальпации и перкуссии живота.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также:

