Геном вирусного гепатита в
Обновлено: 23.04.2024
М.И. МИХАЙЛОВ, член-корреспондент РАЕН, профессор, руководитель лаборатории.
В соавторстве с Т.А. СЕМЕНЕНКО. Гепатит В - широко распространенная вирусная инфекция, в клинически выраженных случаях характеризуется симптомами острого поражения печени и интоксикации, отличается многообразием клинических проявлений и исходов заболевания (выздоровление, развитие хронического гепатита, цирроза и рака печени).
Для исследователя, занимающегося вирусными инфекциями человека, гепатит В представляет особый интерес. Отвечая на вопрос, почему это так, можно привести следующие основные доводы:
- вирус гепатита В (HBV) - самый изменчивый ДНК-содержащий вирус;
- разнообразие антигенов вируса и антител к ним позволяет проводить диагностику, предсказание характера течения и исходов заболевания и профилактику постгрансфузионного гепатита, при этом требуя новых, наиболее информативных тестов индикации;
- множественность путей передачи возбудителя, определяющих его глобальное, но неравномерное распространение, что вызывает повышенный интерес эпидемиологов;
- существующие параллели между гепатитом В и ВИЧ-инфекцией делают правомерным определение, сформулированное как "гепатит В - кузина ВИЧ", заставляя организаторов здравоохранения разрабатывать новые подходы в работе;
- HBV - этиологический агент первичного рака печени.
Кроме того, наличие эффективной вакцины против гепатита В и ее применение позволяют получить удовлетворение от работы, реально ощущая воможность защиты людей от этой страшной инфекции.
Вирус, его размножение и мутантные формы
HBV - основной представитель семейства гепаднавирусов, от "hepar" - печень; "dna" - ДНК. Помимо вируса гепатита В человека в это семейство входят вирусы гепатита сурков, земляных белок, сусликов, пекинских уток и других животных. Объединяющие характеристики этих вирусов: сходное строение; циркулярная дезоксирибонуклеиновая кислота (ДНК); общая стратегия размножения вируса; преимущественное размножение в клетках печени; возможность длительной (иногда пожизненной) циркуляции вируса в организме; взаимосвязь с развитием первичного рака печени.
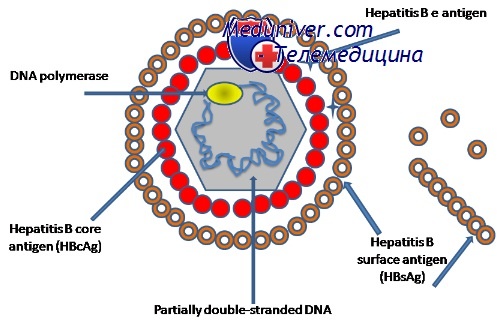
Частицы вируса гепатита В представляют собой сферические частицы размером 42 нм, имеющие ядро и оболочку, состоящую из поверхностного антигена вируса гепатита В (HBsAg). Информация о вирусных антигенах и белках, необходимых для его существования, заключена в небольшой (всего 3200 нуклеотидов) двуцепочечной кольцевой молекуле ДНК. В ней выделяют 4 гена - несущих информацию о HBsAg (S-ген); ядерном антигене - НВсАд (С-ген), ферменте ДНК - полимеразе (Р-ген) и Х-белке (Х-ген).
Заражение гепатитом В происходит при непосредственном попадании вируса в кровь, через слизистые оболочки или поврежденные кожные покровы. Считается, что любой человек, не имеющий антител к HBsAg, может заболеть гепатитом В. Чрезвычайно высокая инфекционность вируса (некоторые образцы сывороток крови с наличием HBV могут вызвать заболевания в разведениях 10 -7 - 10 -8 и устойчивость к различным физико-химическим воздействиям определяют широкое распространение гепатита В. Достигая по кровеносным сосудам клеток печени, вирус адсорбируется на их поверхности. Изучение механизма адсорбции и проникновения в клетку позволило выявить несколько специфических рецепторов на HBsAg и гепатоците. Помимо рецепторов, информация о которых заложена непосредственно в ДНК вируса (Pre-S1 и Pre-S2), в процессе адсорбции принимает участие печеночный белок аннексии V. В последние два года определено, что процесс адсорбции и проникновения вируса гепатита В представляет собой сложный механизм, вовлекающий несколько клеточных белков. Кроме того, установлено, что размножение вируса гепатита В может происходить не только в гепатоцитах, но и в других клетках организма человека: клетках крови, селезенки, поджелудочной железы и др.
Из всех известных ДНК-содержащих вирусов человека вирус гепатита В имеет самый сложный цикл размножения. Для того, чтобы получить новые вирусные частицы, репликация ДНК включает в себя дополнительный этап, когда с ДНК синтезируется РНК и лишь только с нее считывается информация о ДНК-HBV. Этот дополнительный этап репликации, не свойственный для других ДНК-содержащих вирусов, приводит к возможному появлению мутантных форм вируса гепатита В.
Изучение изолятов вируса гепатита В, выявленных в различных регионах мира, позволило установить наличие 6 основных генотипов, обозначенных А, В, С, D, Е и F. Определено, что HBV генотип F чаще выявляется у больных с тяжелым течением заболевания. В последние годы интерес исследователей вируса гепатита В был сконцентрирован на мутантной форме, обозначенный как Pre Core мутант вируса гепатита В. Установлено, что эта мутация возникает из-за замены одной аминокислоты (гуанин) на другую (аденин) в участке С-гена. У носителей вируса это приводит к прекращению синтеза НВеАg, атаке иммунных клеток на пораженные клетки и ухудшению самочувствия пациента. В подавляющем большинстве случаев эти больные плохо поддаются лечению препаратами интерферона. Всесте с тем продемонстрировано, что применяемые вакцины против гепатита В защищают человека от заражения различными генотипами и Pre Core мутантом вируса гепатита В.
Более тяжелому течению острого гепатита В способствуют следующие факторы: сопутствующие заболевания, такие, как сахарный диабет, язвенная болезнь, системные заболевания крови, прием наркотиков, тяжелые физические нагрузки и др.
Заражение вирусом гепатита В приводит к развитию инфекции с острым или хроническим течением заболевания. Причем инфекция может протекать как в желтушной, так и безжелтушной форме, их соотношение 1:6 - 1:8. Считается, что поражение гепатоцитов в основном связано не с непосредственным действием вируса, а с иммунопатологическими процессами. Так, механизм разрушения гепатоцитов в самых общих чертах может быть описан следующим образом: попав в кровь, вирус вызывает активацию В- и Т-клеточного звена иммунитета человека. Т-киллеры взаимодействуют с антигенами вируса гепатита В и антигенами главного комплекса гистосовместимости, представленными на поверхности печеночной клетки, вызывая разрушение гепатоцитов.
Кроме этого, значительную роль в развитии патологического процесса гепатита В играют аутоиммунные реакции, т.е. реакции на собственные компоненты гепатоцитов (полиальбумин, липополипротеид, фрагменты мембран митохондрий и др.). При этом происходит разрушение не только зараженных, но и незараженных гепатоцитов. В данном случае HBV играет пусковую роль в развитии аутоиммунного компонента гепатита В. Определенную роль имеют и циркулирующие иммунные комплексы HBsAg с антителами к нему. Считается, что эти комплексы определяют внепеченочные поражения при гепатите В, такие, как гломерулонефрит, узелковый периартериит и др.
Гепатит В может иметь легкое, средне-тяжелое и тежелое течение заболевания, включая фульминантный гепатит, который в большинстве случаев заканчивается смертью больного. Летальность при гепатите В составляет 0,4-1%. Более тяжелому течению острого гепатита В способствуют следующие факторы: сопутствующие заболевания, такие, как сахарный диабет, язвенная болезнь, системные заболевания крови, прием наркотиков, тяжелые физические нагрузки и др. К утяжелению инфекции приводит одновременное заражение вирусами гепатитов А, С и D. Так, например, известно, что острый гепатит С в подавляющем большинстве случаев имеет легкое течение, однако при сочетании с гепатитом В он протекает тяжело, иногда с летальным исходом.
Особенностью гепатита В является возможное развитие хронического гепатита В, который регистрируется в 5-10% случаев, при этом, очевидно, большая часть из них ассоциирована с присоединением дельта вирусной инфекции. Причины развития хронического процесса окончательно не установлены. Считается, что прежде всего это может быть связано с наличием у больного нарушений в клеточном звене иммунитета и с низкой продукцией эндогенно синтезированного интерферона. При гепатите В существует общая закономерность - чем в более раннем возрасте человек инфицируется вирусом, тем больше вероятность развития хронического гепатита. Так, при перинатальном инфицировании новорожденных, чьи матери помимо HBsAg имели НВеАg, хронический гепатит формируется в 80-90% случаев. У 15-20% больных хроническим гепатитом В происходит постепенное (5-20 лет) прогрессирование в цирроз, а у части из них - в первичный рак печени.
Гепатит В - "кузина СПИД"
Пaраллели между этими заболеваниями очень велики. Наличие вируса специфического фермента - ДНК-полимеразы, обладающей функцией обратной транскриптазы, позволяет называть вирус гепатита В как скрытый ретровирус. Обращает на себя внимание общность многих эпидемиологических характеристик СПИДа и гепатита В. Они касаются, в первую очередь, способов передачи заразного начала при обеих инфекциях: половой контакт, контаминированные вирусами инструменты при парентеральных манипуляциях, контаминированная кровь и ее продукты; передача от матери плоду или новорожденному. Соответственно, СПИД и гепатит В имеют общие группы риска. В случаях заражения гепатитом В лиц, инфицированных ВИЧ, инфекция быстро переходит в активную форму.
Первичный рак печени
Исследования, проведенные в различных странах мира, выявили, что около 80% всех случаев первичного рака печени связано с вирусом гепатита В. Наиболее часто он возникает у лиц старше 40-50 лет, страдающих циррозом печени. Вместе с тем необходимо отметить тенденцию к более частой регистрации первичного рака печени среди лиц молодого возраста.
Теоретически предполагают несколько путей реализации онкогенного действия HBV. Это возможное наличие в ДНК HBV нуклеиновых последовательностей с онкогенной функцией, так называемых онкогенов. Обнаружение белков, кодированных Х-геном HBV, в крови больных с первичным раком печени косвенно свидетельствует о роли этого антигена в развитии рака. Кроме того, предполагают, что HBV имеет свойство биологического мутaгена, приводящего к развитию этой опухоли печени. Взаимосвязь вируса гепатита В и первичного рака печени позволила предположить, что вакцинация против гепатита В снизит заболеваемость и первичным раком печени.
Бессимптомное носительство вируса
О носительстве HBV судят по обнаружению HBsAg в течение более шести месяцев при отсутствии клинических, морфологических и биохимических признаков гепатита. В настоящее время носительство HBV однозначно рассматривается как патологическое состояние организма. Длительный синтез HBsAg, в ряде случаев в течение всей жизни, связан с интеграцией ДНК HBV в геном гепатоцитов. Впервые гипотеза об интегративной природе носительства HBV высказана В.М. Ждановым и С. Хиршманом в конце 70-х годов, в дальнейшем она была экспериментально подтверждена. Носители HBsAg составляют основной резервуар вируса гепатита В. В настоящее время на земном шаре проживает более 300 млн бессимптомных носителей вируса, из них около 5 млн - в нашей стране. Многочисленные исследования продемонстрировали повсеместное, но неравномерное распространение носительства HBsAg. В России частота выявления колеблется от 1,5% в европейской части страны до 4-5% в Якутии и на Дальнем Востоке.
Состояние носительства может длиться до 10 лет и более. Ежегодно 1-2% носителей HBsAg спонтанно эллиминирует антиген. Причины и механизмы этого явления до сих пор не выяснены. В настоящее время отсутствуют эффективные методы и средства, способные исключить из гепатоцита интегрированный геном ДНК HBV.
Вакцины против гепатита В
Вирус гепатита В и его антигены
Среди вирусов, вызывающих гепатит у людей, HBV — единственный ДНК-содержащий вирус. Размер его генома всего 3,2 Кб, т. е. это мельчайший из ДНК-содержащих вирусов, вызывающих инфекционные заболевания у человека. Кольцевая ДНК вируса имеет двухцепочечную структуру лишь на протяжении части своей длины, тогда как значительный участок ДНК варьирующего размера остается одноцепочечным. Эндогенная ДНК-полимераза позволяет вирусу достраивать недостающий участок второй цепи из присутствующих в клетке нуклеотидов на основе вирусной матрицы.
Перед репликацией генома вирус синтезирует прегеном, представляющий собой полномерную одноцепочечную РНК-копию DNA HBV. Далее, используя эту РНК-копию в качестве матрицы, вирусная ДНК-полимераза (обратная транскриптаза) синтезирует ДНК-геном. Таким образом, HBV обладает главным свойством ретровирусов — способностью к обратной транскрипции. Полномерная прегеномная РНК выполняет также и вторую функцию: она служит матрицей для трансляции вирусных белков. Вирион состоит из белково-нуклеинового комплекса — нуклеокапсида, окруженного оболочкой — липопротеиновой мембраной.
Липиды оболочки представлены триглицеридами, фосфолипидами и холестерином, причем все они являются продуктами клетки хозяина. Нуклеокапсид имеет форму икосаэдра, присущую белку core (HBcAg) и содержит вирусную ДНК и полимеразу. Оболочка тесно связана с поверхностным (S-) антигеном (HBsAg) — трансмембранным белком, существующим в трех сходных формах. Все три формы белка являются продуктами одного гена, транслируемыми в S-OPC (открытую рамку считывания), но имеют три разных сайта начала трансляции (ATG). Общий стоп-кодон (ТАА) объясняет идентичность карбокситерминальной части всех трех форм белка.
Эти все формы, охарактеризованные пока неполностью и все вместе, называют поверхностным антигеном вируса гепатита В (HBsAg). HBsAg первоначально называли антигеном гепатита, или антигеном, связанным с гепатитом или австралийским антигеном.
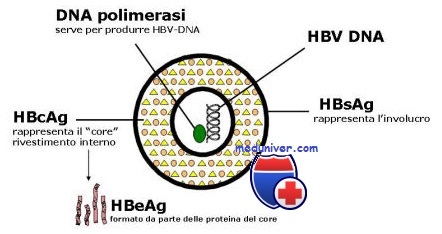
Геном HBV содержит 4 взаимно перекрывающихся открытых рамки считывания. По конечным продуктам экспрессии 4 ОРС названы: S (поверхностные белки), Р (полимераза), С (core) и X. В участке генома S выделяют области S, преSl и преS2. Область S кодирует основную, наименьшую по размеру форму HBsAg, состоящую из 226 аминокислот. Это наиболее обильно экспрессируемый белок вириона, составляющий также основную часть сферических и тубулярных частиц. Аббревиатуру HBsAg иногда применяют в узком смысле именно для обозначения этого белка.
Важным элементом стабилизации его трехмерной структуры служат дисульфидные связи. HBsAg — важнейший антиген HBV, так как именно он содержит эпитопы, к которым вырабатывается защищающий от HBV иммунитет и служит основным компонентом коммерческих вакцин. Установлено, что присутствие в сыворотке одних только антител к HBsAg достаточно для защиты от HBV-инфекции [5, 10]. Средняя по размеру форма HBsAg кодируется областями S и preS2 и содержит дополнительные 55 аминокислот, а максимальная по размеру форма кодируется областями S, preS2 и preSl и содержит еще 119 или 108 аминокислот в зависимости от субтипа (генотипа) вируса. Мембрана ьириона содержит смесь всех трех форм HBsAg как в гликозилированной, так и негликозилированной форме. Известно 6 генотипов HBV, обозначаемых латинскими буквами A-F. В основе разделения HBV на различные генотипы лежат отличия в последовательности нуклеотидов S-гена в сегменте между позициями 256 и 796.
Белок core (HBcAg) и секретируемый е-белок (HBeAg) являются продуктами гена pre-core и core и имеют примерно 160 общих аминокислот. HBeAg представляет собой полипептидный фрагмент HBcAg, подвергшийся посттрансляционному процессингу. HBeAg экспрессирован также на поверхности гепатоцитов и, по-видимому, служит важной мишенью для механизмов иммунитета, разрушающих гепатоциты. HBeAg индуцирует иммунологигескую толерантность и, таким образом, связан с хронической инфекцией.
Он также способен модулировать репликацию HBV, супрессируя инкапсулирование прегеномной РНК в нуклеокапсиды. Корпускулярный нуклеокапсидный антиген (HBeAg) в свободной форме может быть обнаружен в ядрах инфицированных гепатоцитов. В сыворотке крови его выявляют только в частицах Дейна.
Помимо структурных и секретируемых белков вирус способен синтезировать различные неструктурные белки. Ген Р кодирует вирусную ДНК-полимеразу (обратную транскриптазу). Р-ОРС перекрывает все другие ОРС вируса ГВ. Ген X кодирует Х-антиген (HBxAg), белок, биологические функции которого пока еще охарактеризованы неполностью. Известно, однако, что он играет регуляторную роль в процессе размножения вируса и способен активировать транскрипцию ДНК вируса при помощи ряда клеточных промоторов.
Мутации вируса гепатита В. Генетическая изменчивость ВГВ
Мутантом (от лат. mutare — меняться) называют ген, хромосому, организм или популяцию, отличающуюся от соответствующего дикого типа одним или более генетическим изменением — мутацией. Мутация — это относительно устойчивое и передающееся по наследству изменение генетического материала, представляющее собой биохимическое изменение в кодоне или физическое изменение в межхромосомных взаимоотношениях. Мутации HBV в современной научной литературе описывают довольно часто.
Установлено, что HBV подвержен более частым мутациям, чем предполагалось ранее, поскольку для его репликации необходима обратная транскрипция РНК-прегенома — процесс, при котором вероятность ошибок считывания весьма высока. Эта вероятность, как установлено, составляет 2x10-4 замен оснований на сайт в год, то есть на 4 порядка превышает частоту мутаций других ДНК-вирусов, хотя и не достигает частоты мутаций РНК вирусов.
Наличие длинных участков делеций свидетельствует о присутствии и других механизмов мутагенеза. Это могут быть ошибки считывания на других этапах репликации, действие клеточной топоизомеразы и сплайсинг генов с альтернативными донорными и акцепторными сайтами. Мутации могут возникнуть также в результате рекомбинации между коинфицирующими штаммами. Мутации HBV не ограничиваются отдельными ОРС и происходят во всех генах вируса и регуляторных элементах.
Среду мутантов HBV, выделяемых от пациентов как с острой (фульминантной), так и хронической инфекцией, различают 4 группы: мутанты генов pre-сorе и core, мутанты генов preS и S (поверхностных) белков, мутанты генов полимеразы/обратной транскриптазы и мутанты гена X. Нередко у одного пациента мутанты сосуществуют с вирусами дикого типа. Фактически слугаи инфекции с угастием мутантных штаммов вируса следует рассматривать как микст-инфекцию с разными исходными ДНК, взаимодействующими друг с другом путем trans-активации и рекомбинации.
Впервые мутанты HBV обнаружены у пациентов с хроническим гепатитом В, в крови которых выявляли вирусную ДНК на фоне отсутствия серологических признаков текущей или перенесенной инфекции (т. е. HBsAg и анти-HBs). Поскольку HBV может персистировать в организме в течение нескольких лет и даже десятилетий, мутации способны накапливаться и становиться клинически значимыми.
Точечные мутации в S-гене представляют наибольший интерес для практического здравоохранения, поскольку они способны влиять на иммуногенность HBsAg и, особенно, его детерминанты а, к которой вырабатываются протективные антитела. Для того чтобы объяснить, как мутация в одном участке гена может влиять на структуру двух или более удаленных друг от друга эпитопов, была предложена новая модель большого гидрофильного региона (БГР) S-белка.
Исходная модель детерминанты а белка S предполагала наличие двухпетлевой структуры в районе аминокислотных остатков 124-147 с дисульфидными мостиками между аминокислотными остатками 124 и 137. В соответствии с вновь предложенной моделью (36), которая не отрицает возможного наличия дисульфидных мостиков, большой гидрофильный регион белка S (аминокислотные остатки 100-160 или 169) рассматривают как паутиноподобную структуру, образованную цистеиновыми остатками в позициях 107, 137, 138, 139 и 149 и локализованную на наружной оболочке вириона. Пептидные петли, образованные аминокислотными остатками 107-137 и 139-147, формируют выступы на оболочке вириона, а еще одна плотная петля образована аминокислотными остатками 121-124.
Доказана роль вируса гепатита B в возникновении рака печени. Ежегодно в России от гепатокарциномы погибают 6 тыс. человек. В 2012-2017 гг. количество больных достигнет 20 тыс. человек.
Для достижения положительного эффекта в предупреждении заболеваемости гепатитом B ВОЗ рекомендует вакцинировать в России ежегодно не менее 3 млн человек.
Несколько ДНК-содержащих вирусов, вызывающих гепатиты человека и животных, объединены в современной классификации в семейство Hepadnaviridae. Вирус гепатита В человека (HBV) является представителем рода Orthohepadnavirus, который включает еще несколько вирусов; из них наиболее изучены вирус лесного сурка (WHV) и земляной белки (YSHV).
В семействе Hepadnaviridae несколько птичьих вирусов объединены в род Avihepadnavirus, включающий хорошо изученный вирус пекинских уток (DHBY), и менее изученные - возбудители гепатита цапель (HHBV) и домашних гусей. Принципиальное различие представителей двух родов заключается в том, что геном птичьих вирусов меньше - состоит только из 3 генов и не имеет Х-гена, а вместо 3 гликопротеидов у представителей рода Avihepadnavirus имеется только L-и S-белки.
Прошло почти 30 лет с момента опубликования пионерской работы Д.Дэйна и соавт. [3], в которой с помощью негативного контрастирования с сушкой на воздухе показано наличие в сыворотках больных гепатитом B вирусных частиц диаметром 40-48 нм, имеющих липидную мембрану и сердцевину, а также структур с липидной мембраной диаметром от 16 до 36 нм. В дальнейшем были уточнены параметры структур, обнаруженных Д.Дэйном, не давшие ринципиально новой информации. В настоящее время канонизирован диаметр вириона вируса гепатита В (частица Дэйна) и сердцевины (нуклеокапсид): 42 нм и 27-28 нм соответственно.
Геном гепатита вируса В включает 4 гена: Р, S, С и X. Р-ген кодирует многофункциональную полимеразу, С-ген кодирует С-белок (НВсАg ) и E-белок (HBeAg). S-ген имеет 3 кодона инициации и контролирует синтез 3 белков: L - 400 аминокислот, M -281 аминокислот и S - 226 аминокислот. L-белок кодируется областью pre-S1/pre-S2/S; M-белок - pre-S2/S и S - собственно областью S. Функционально роль этих белков весьма различна. Так, L -белок определяет рецепцию вириона с гепатоцитом и, как показано в последнее время, непосредственно с белком плазматической мембраны - аннексином V [5]. Кроме того, L-белок играет определяющую роль наряду с S-белком в формировании вириона вируса гепатита В.
Роль M-белка сегодня менее ясна, но, вместе с тем, показано, что отсутствие M-белка не препятствует формированию вириона. Нет единства мнений о представительстве всех 3 белков в липидной мембране вириона, т.к. диапазон расхождений весьма велик. Д.Ганем [4] разделяет мнение К.Хeерман [6], что L-, M- и S-белки представлены в соотношении 1:1:4. Вместе с тем, совершенно очевидно, что S-белок превалирует в структуре вириона, а в сферических структурах диаметром 20-22 нм L- и M-белки определяются в следовых количествах; S-белок детерминирует формирование протективных анти-НВs-антител.
Сегодня известны, по крайней мере, 6 HBs-генотипов (а-f), каждый из которых содержит консервативную последовательность из 24 аминокислот в положении 124-147 (а-детерминанта) и поэтому анти-HBs образуются к любому генотипу. Известны НВс-генотипы, но они характеризованы недостаточно. С-белок (HBcAg) формирует белковую оболочку (капсид) сердцевины. Корректные данные об активной секреции HBcAg в кровь отсутствуют, однако на определенных этапах инфекции формируются анти-НВс. Ряд авторов, в частности Зоринсон С.М., считают, что в образовании капсида принимает участие и Е-белок (HBеAg) [2]. Это представление базируется на основании данных, свидетельствующих, что при иммунизации животных фракцией сердцевин, полученной при обработке вирионов детергентом, формируются как анти-НВс, так и анти-НВе. Это лишний раз свидетельствует, что при самой тщательной очистке сложных белковых или макробелковых комплексов всегда остаются следовые количества какого-либо компонента и они выявляются высокочувствительными иммунологическими методами. Наличие тимидинкиназной активности во фракции сердцевин (cor-структур) подтверждает такую ситуацию. В то же время С- и Е-белки, полученные генноинженерным способом, тимидинкиназной активностью не обладают [4].
Следовательно, имеются веские доказательства считать Е-белок не структурным и не входящим в состав капсида вириона вируса гепатита В. Сегодня функция этого белка не вполне ясна, хотя известно, что после трансляции всего гена С формируется предшественник Е-белка (212 аминокислот), но его последующие модификации приводят к отщеплению сначала 19, а затем еще 4 аминокислот и Е-белок (полипептид 188 аминокислот) активно секретируется в кровоток.
Высказывается предположение, что поскольку Е-белок имеет идентичные последовательности с С-белком, то он связывается с цитотоксическими лимфоцитами (CTL) и последние не могут акцептироваться на плазматической мембране инфицированного гепатоцита [8]. Такая ситуация может носить некий позитивный эффект и предотвращать фульминантный тип развития инфекции, но с другой стороны, при существенной ингибиции CTL и подавлении цитолиза инфицированных гепатоцитов затрудняется элиминация вируса и развивается хроническая инфекция. Мутация в pre-С регионе в 1896 нуклеотиде с заменой U на А приводит к возникновению стопкодона (28), и Е-белок (HBeAg) не синтезируется. Такое событие чаще происходит у хронических больных, и в организме хроников выявляются как дикий вирус (+HBeAg), так и мутантный (-HBeAg).
У лиц с хроническими формами это может сопровождаться утяжелением клиники гепатита и ускорением развития цирроза печени. Высказывается мнение, что инфицирование мутантным вирусом (-HBeAg) чаще приводит к возникновению фульминантной формы течения инфекции, что не противоречит представлению, высказаному выше, а с другой стороны, наблюдаются лица с длительной бессимптомной инфекцией [7].
Таким образом, остается еще ряд нерешенных вопросов относительно роли мутантных вирусов по pre-C региону гена С.
По-видимому, большая часть С-белка (полипептид из 183 аминокислот) транспортируется в ядро, в котором происходит формирование капсида из 180 молекул и в целом формируется сердцевина, содержащая геном и полимеразу. Определенное количество С-белка экспонируется на плазматической мембране гепатоцита, и его N-концевая часть служит рецептором СТL. Только в результате цитолиза инфицированного гепатоцита происходит попадание в кровоток как сердцевин, так и молекул С-белка с формированием анти-НВс.
Продукт гена Х-неструктурный белок (154 аминокислоты), роль которого долгое время оставалась неясной, на сегодня изучена достаточно полно.
В значительной степени роль Х-белка стала очевидной при изучении WHL-вирусной инфекции у лесных сурков, так как у этих животных происходит, как правило, хронизация заболевания и быстрое формирование гепатокарциномы. Фактором, подтверждающим роль Х-белка в онкогенезе у лесных сурков, служит и то обстоятельство, что у представителей Avihepadnavirus гепатокарцинома не формируется.
Не вызывает сомнений этиологическая роль HBV в образовании гепатокарциномы человека. По своим биологическим свойствам Х-белок обладает трансактиваторной функцией и вызывает нарушение клеточной регуляции подобно Е6 белку папилломавирусов человека, большого
Т-антигена вируса SV-40 и EIB белку аденовирусов, т.е. тех ДНК-вирусов, которые вызывают развитие опухолей. Имеется ряд публикаций, в которых показано ингибирующее действие Х-белка на функцию р53, репрессирующего клеточные протоонкогены [4, 7].
В России с 1989 г. начата регистрация первичного рака печени, и ежегодно регистрируется от 8 до 8,5 тысяч случаев. Пока не осуществляется раздельная регистрация гепатокарциномы и холангиокарциномы (рак эпителия желчных протоков), ассоциированной с описторхозом, вызванным, в частности, Opisthorchius felineus (кошачий сосальщик).
В России, по-видимому, из общего числа первичного рака печени 75-80% следует относить к гепатокарциномам, и, таким образом, от 6 до 6,5 тыс. человек ежегодно погибают в период до 1 года, т.к. диагностика, как правило, осуществляется на поздних этапах. Хирургическое лечение по ряду обстоятельств проводится в очень незначительном масштабе, а химиотерапия пока не дает ощутимых результатов. Пик выявления гепатокарциномы приходится на старшие возрастные группы от 55 до 70 лет (до 80%). В возрасте 40-54 лет вероятность формирования гепатокарциномы существенно ниже - 15% от общего числа и существенно меньше в возрасте 15-39 лет (меньше 3%). Кроме гепатокарциномы у детей в возрасте до 3 лет диагностируется гепатобластома - агрессивная опухоль, при которой этиологическая роль вируса гепатита В не вызывает сомнений [1].
В России ежегодно регистрируется 200-300 случаев. Из гепатобластомы получены перевиваемые клеточные линии - Нер 92 и Hu H 7, 2215, в которых синтезируются все белки вируса гепатита B и даже формируются вирионы.
После краткой характеристики представителей семейства Hepadnaviridae, структуры вириона и генома, а также функциональной роли всех белков НВV необходимо обсудить состояние заболеваемости гепатитом В в России.
Эти цифры представлены для того, чтобы определить взаимосвязь числа случаев первичного рака печени и уровня заболеваемости гепатитом В (случаи безжелтушных форм гепатитов В и С не входят в официальную статистику). Если принять во внимание некую усредненную величину соотношения острого гепатита с манифестированной клиникой и c бессимптомной или не выраженной клиникой как 1:4, то число острых больных соответственно увеличивается в 1997 г. до 250 тысяч человек.
Величина 1:4 возможно и преуменьшена, т.к. у детей отмечают бессимптомные инфекции при перинатальном инфицировании в 100% случаев, а хронизацию инфекционного процесса - в 90% желтушных форм.
У детей старше 7 лет желтушные формы регистрируются в тех же пропорциях, что и у взрослых.
Цирроз печени и гепатокарцинома являются результатом хронического гепатита, число случаев которого в РФ подлежит только экспертным оценкам, так как официальная регистрация Минздравом России не введена.
В США, по оценке Ф.Холлинджера, количество больных хроническим гепатитом В составляет 1 млн человек [7]. Принимая во внимание более высокий уровень носителей маркера вируса гепатита В и не менее высокую заболеваемость, в России число больных хроническим гепатитом В также составляет около 1 млн человек.
Эти больные являются основным источником инфекции, так как не менее 90% острого гепатита возникает при инфицировании от хронических, в том числе бессимптомных носителей.
Экономические потери совершенно очевидны, а лечение манифестированного хронического гепатита интерфероном и модифицированными нуклеозидами на сегодня недоступно подавляющему большинству больных из-за очень высокой цены препаратов.
В социальном плане предпочтительна вакцинация всех новорожденных, подростков и лиц из других групп риска, но она, к сожалению, осуществляется в России в очень небольших масштабах. В 1998 г. вакцинировано около 70 тыс. человек, в то время как по рекомендации ВОЗ необходимо вакцинировать ежегодно не менее 3 млн человек. Только при таком объеме вакцинации можно предотвратить тенденцию к увеличению числа хронических больных гепатитом В в России и связанные с этим человеческие потери, которые в первом и втором десятилетии XXI века могут достигнуть уровня 45-50 тысяч человек в год.
Читайте также:

