Гепатит основная группа препаратов для лечения
Обновлено: 24.04.2024
По оценкам врачей, в России в настоящее время гепатитом С больны около 8 миллионов человек, причем по словам руководителя центра по вирусным гепатитам «они не все выявлены, многие люди живут с этой инфекцией и об этом не знают".
Как происходит заражение вирусом гепатита С?
Вирус гепатита С передается через контакт с человеческой кровью. Заразиться можно в следующих случаях:
Вам переливали кровь, компоненты крови от доноров с вирусом гепатита С
Вы когда-либо работали в лечебных учреждениях и имели частые контакты с кровью на работе
У Вашей матери был диагностирован вирусный гепатит С
У вас был половой контакт с инфицированным вирусом гепатита С
Вы жили с человеком инфицированным гепатитом С и пользовались его предметами личной гигиены, такими как бритвенные принадлежности, зубная щетка, на которых могли оставаться частицы крови
Вы перенесли какие-либо операции, в т. ч. стоматологические
Вы когда-либо употребляли наркотики, и при этом, пользовались общими шприцами или иглами
ВАЖНО: Гепатит С не передается через грудное молоко, пищевые продукты, воду или при бытовых контактах, например, объятиях, поцелуях или совместном приеме пищи и напитков с инфицированным лицом.
Как выявляют гепатит С?
Коварность заболевания в том, что оно не имеет специфических симптомов. У человека может быть повышенная утомляемость, но это не специфический симптом, поэтому он не обращается за медицинской помощью. Вирус выявляется случайно, когда человек сдает анализы на антитела к нему, например, при подготовке к госпитализации или по другой причине. Поэтому многие люди, которые, которые не проходили обследование, могут быть инфицированы, но об этом не подозревают.
У человека, заболевшего гепатитом С, могут отмечаться следующие неспецифичные симптомы:
Увеличенная потливость (особенно ночью)
Повышение температуры тела, озноб
Артралгия (ломота, боли в суставах)
Потеря аппетита, тошнота
Нарушение концентрации внимания, рассеянность
Сосудистые звездочки, кожный зуд
Расстройства пищеварения (запор, понос)
Стул светлого оттенка, обесцвеченный
Моча темного цвета
Увеличение размеров печени
Общая слабость, головокружение
При обращении к врачу назначают следующие виды исследований:
Анализ крови на наличие антител к вирусу гепатита С
Дает возможность узнать, был ли вирус в организме ранее. Некоторые люди избавляются от вируса самостоятельно, благодаря врожденному иммунитету, без медицинской помощи.
Тест ПЦР – полимеразной цепной реакции
Увеличить потребление продуктов с высоким содержанием пищевых волокон, например, фруктов (с учетом их калорийности) и овощей
Для выяснения уровня содержания билирубина, ферментов печени. Эти исследования помогают оценить насколько нарушены функции печени.
Определение генотипа вируса и вирусной нагрузки
Необходимы перед началом противовирусной терапии для определения длительности курса лечения.
УЗИ органов брюшной полости
Оценивают состояние печени, ее размеры, наличие или отсутствие кист и прочих образований.
Какие препараты используют для лечения гепатита С?
Инфицирование вирусом гепатита С не всегда требует лечения, поскольку многих пациентов иммунная система сама успешно справляется с вирусом. Лечение показано тем пациентам, у которых организм не справился с вирусом самостоятельно и вирус вызвал развитие заболевания. Целью терапии является полное излечение гепатита С.
Процесс лечения довольно длительный, от 8 до 72 недель. Длительность зависит от многих факторов, таких как форма патологии, стадия гепатита, наличие сопутствующих заболеваний.
Лечение проходит под обязательным контролем врача-инфекциониста, который разрабатывает индивидуальный подход с учетом всех особенностей конкретного пациента.
Существует две основные группы препаратов для лечения вирусного гепатита С
Эта группа препаратов действует не напрямую на вирус, а стимулируют собственный иммунитет человека. Усиливая иммунный ответ организма, интерфероны создают защиту для клеток печени, помогая им самостоятельно бороться с вирусом.
Противовирусные препараты прямого действия
Эти препараты направлены непосредственно на уничтожение вируса. Они делятся на несколько поколений. Препараты последних поколений считаются более эффективными и безопасными.
Препараты, защищающие клетки печени
Вне зависимости от выбранных противовирусных препараторов врачи назначают лекарственные средства, которые повышают устойчивость печени к патогенным факторам, восстанавливают гепатоциты и их нормальное функционирование.
С этой целью все чаще используют биорегуляторные пептиды – они восстанавливают нормальную структуру поврежденных печеночных клеток за счет их насыщения комплексом белков и нуклеотидов.
Как действуют биорегуляторные пептиды на клетки печени?
Печеночная клетка (гепатоцит) первая встречается с повреждающими агентами. И одним из факторов повреждения любой клетки, в том числе и печеночной, является снижение насыщения клетки белком, который входит во все клеточные структуры. При дефиците белка клетка теряет свою форму, нарушаются ее функции. Это ведет к дальнейшим патологическим изменениям всего органа.
Чтобы гепатоциты восстанавливались и были защищены от повреждения, в первую очередь нужны протеины. Белки (протеины) контролируют процессы межклеточного взаимодействия и определяют способность к самовосстановлению клетки. Но каждые ткани содержат определенные типы протеинов. Это удалось установить, благодаря открытию, сделанному в 1999 году Гюнтером Блобелом, который получил за свою научную работу Нобелевскую премию. Ученый выяснил, что белковая молекула является саморегулирующейся. Недостаток пептидов (с возрастом или при патологии) ускоряет износ тканей, процессы старения и приводит к развитию заболеваний.
Гепатамин –
биорегулятор печени
Гепатамин содержит компоненты, получаемые из печени крупного рогатого скота, которые представляют собой комплекс белков и нуклеопротеидов с избирательным действием на клетки печени, поскольку данные белки являются идентичными для всех млекопитающих. Комплекс обладает способностью усиливать восстановительные процессы в гепатоцитах, а также помогает нормализовать функцию клеток печени.
Гепатамин рекомендуется принимать по 1-3 таблетки, за 10–15 минут до еды, 2-3 раза в день, в течение 10-15 дней. Повторный курс через 3-6 месяцев. Гепатамин не имеет противопоказаний и может использоваться как самостоятельно, так и в рамках комплексной терапии.
Гепатамин –
биорегулятор печени
Гепатамин содержит компоненты, получаемые из печени крупного рогатого скота, которые представляют собой комплекс белков и нуклеопротеидов с избирательным действием на клетки печени, поскольку данные белки являются идентичными для всех млекопитающих. Комплекс обладает способностью усиливать восстановительные процессы в гепатоцитах, а также помогает нормализовать функцию клеток печени.
Гепатамин рекомендуется принимать по 1-3 таблетки, за 10–15 минут до еды, 2-3 раза в день, в течение 10-15 дней. Повторный курс через 3-6 месяцев. Гепатамин не имеет противопоказаний и может использоваться как самостоятельно, так и в рамках комплексной терапии.
Комплекс полипептидов и нуклеиновых кислот таблетки Цитамина
Клинические исследования воздействия Гепатамина на функции печени и желчевыводящих путей проводились у 115 больных, имевших заболевания печени, а также у 45 онкологических больных после проведенного курса химиотерапии.
После курсового приема Гепатамина более 70% пациентов отмечали исчезновение слабости, повышение аппетита и работоспособности, исчезновение диспептических проявлений. У половины обследованных больных установлено выраженное снижение интенсивности болевого синдрома. При оценке эффективности применения по данным биохимических исследований установлено, что в ходе использования Гепатамина наступила стабилизация уровней билирубина, аланинаминотрансферазы, уменьшился уровень иммуноглобулинов в периферической крови. Полученные данные свидетельствовали о существенном снижении активности воспалительного процесса в печеночной ткани. Таким образом, была подтверждена гепатопротекторная способность Гепатамина.
Подробнее о препаратах из статьи
Гепатамин
Читайте
в нашем блоге

Орган, который не болит. 5 признаков неполадок в работе печени
Печень – один из самых крупных внутренних органов, она весит от полутора до двух килограмм. Это жизненно важный орган, то есть орган, без которого невозможна жизнь человека.

Защита печени: как лечить жировой гепатоз
Не хотите отказываться от фаст-фуда, но беспокоитесь за свое здоровье? Желания кажутся взаимоисключающими. Однако, давайте посмотрим, можно ли каким либо образом снизить негативное влияние жирной пищи на печень.
Повсеместное внедрение диагностики вирусов гепатитов В (HBV) и С (HCV) открыло грандиозную картину: HBV инфицировано 300–350 млн человек в мире, носителями HCV являются, по разным данным, от 170 до 500 млн.

Повсеместное внедрение диагностики вирусов гепатитов В (HBV) и С (HCV) открыло грандиозную картину: HBV инфицировано 300–350 млн человек в мире, носителями HCV являются, по разным данным, от 170 до 500 млн. Следовательно, по меньшей мере каждый десятый житель Земли инфицирован одним из этих вирусов.
В мире и в нашей стране ведущее место среди всех ХВГ занимают гепатиты В и С. Именно они характеризуются непрерывным ростом заболеваемости и наиболее частым развитием ЦП и рака печени.
Лечение вирусных гепатитов — проблема трудная и неоднозначная. Имеющийся арсенал лекарственных средств базируется на гепатопротекторах, действие которых не является этиотропным. Ряд из них имеют побочные эффекты и достаточно высокую стоимость. Этиотропная противовирусная терапия остается дорогой и малодоступной для большинства пациентов. Это делает актуальным поиск новых эффективных и недорогих средств для лечения ХВГ.
Начиная с 1970–80-х гг. происходил поиск средств этиотропной терапии вирусных гепатитов [1, 7, 30, 31].
Основные группы лекарственных препаратов, применяющиеся для лечения ХВГ
Интерфероны. Интерфероны (ИФН) — группа гликопротеинов, действие которых связано с противовирусным эффектом — активацией (депрессией) клеточных генов, в результате чего синтезируются белки, ингибирующие синтез вирусной ДНК (РНК), а также иммуномодулирующим эффектом — усилением экспрессии антигенов HLA на клеточных мембранах и увеличением активности цитотоксических Т-клеток и естественных киллеров.
К 1 типу ИФН, действующему как ингибиторы репликации вируса, относятся 22 различных подтипа ИФН-α и 1 подтип ИФН-β. К 2 типу, проявляющему иммуномодуляторную активность, относятся ИФН-γ.
Существует 3 класса ИФН: ИФН-α, ИФН-β, ИФН-γ. К ИФН естественного происхождения относятся лимфобластоидный и лейкоцитарный ИФН (ИФН-α), синтезируемые соответственно стимулированными моноцитами и В-лимфоцитами человека, фибробластный ИФН (ИФН-β) и Т-лимфоцитарный ИФН (ИФН-γ). К искусственно синтезируемым ИФН относится рекомбинантный ИФН-a, получаемый по молекулярной технологии [27].
Среди рекомбинантных ИФН: ИФН-α-2а (Роферон-А), ИФН-α-2b (Интрон А, Реаферон), ИФН-α-2с, а также лимфобластоидный ИФН-α (Вэллферон). В последние годы в клинике стали использоваться препараты рекомбинантных ИФН-α пролонгированного действия — PEG (конъюгированные ИФН-α), производимые в виде препаратов Пегасис и ПегИнтрон. Пегасис — это препарат ИФН-α-2а, соединенный с молекулой полиэтиленгликоля (ПЕГ) с молекулярной массой 40 кДа, а ПегИнтрон — препарат ИФН-α-2-b, объединенный с молекулой ПЕГ с массой 12 кДа. Эти препараты обладают наибольшей противовирусной активностью [7].
Рекомбинантные ИФН-α являются в настоящее время основой лечения ХВГ В и С. Основным показанием для их назначения стало наличие репликации вируса, маркерами которой в крови являются: при HBV-инфекции — HBeAg, DNA HBV, при HCV-инфекции — RNA HCV.
Благоприятными прогностическими факторами у больных ХВГ B и C при проведении ИФН-терапии являются: длительность заболевания менее 5 лет, возраст менее 45 лет, отсутствие гистологических признаков ЦП, низкий уровень аланинаминотрасферазы (АЛТ), аспартаминотрансферазы (АСТ) (не более 3-х норм), низкое содержание железа в ткани печени (менее 650 мкг/г нативной массы) и нормальные цифры сывороточного железа (17–22 мкмоль/л) [1, 7, 8, 9, 10].
Схемы применения короткодействующих препаратов ИФН-α можно разделить на три основных режима.
Режим высоких доз — по 10 млн МЕ в/м ежедневно до получения нормальных трансаминаз, затем по 3 млн МЕ 3 раза в нед в течение еще 6 мес.
Режим средних доз — по 5 млн МЕ в/м 3 раза в нед в течение 2–3 мес, затем по 3 млн МЕ 3 раза в неделю в течение 4–12 мес.
Режим малых доз — по 3 млн МЕ в/м 3 раза в нед в течение 3–6 мес.
Режим высоких доз чаще применяется при острых вирусных гепатитах. При ХВГ лечение начинают с режима средних доз; при плохой переносимости ИФН переходят на режим малых доз [8, 9].
Оценка эффективности ИФН-терапии проводится по нормализации уровня трансаминаз (АЛТ, АСТ), устранению маркеров репликации вирусов гепатитов В и С из крови и выраженности положительной динамики морфологических изменений ткани печени после курса лечения [6, 7, 11, 12].
На фоне терапии ИФН-α могут наблюдаться побочные эффекты, такие как гриппоподобный синдром, развивающийся на 1–2 нед лечения. Он может быть уменьшен переносом инъекций ИФН-α на вечерние часы. Кроме того, могут отмечаться диспепсические явления, инсомния, похудание, слабость, лейко-, тромбоцитопения и гипертиреоз [13]. Большинство побочных эффектов являются дозозависимыми и могут быть устранены при подборе дозы [1, 8, 9].
Эффективность монотерапии короткодействующими ИФН-α невысока. Только у трети больных с ХВГ В и С достигается устойчивый вирусологический ответ на лечение ИФН-α (отсутствие репликации вируса, нормальный уровень АЛТ и АСТ через 6 мес после окончания терапии). В связи с этим большинство специалистов считает, что лечение ХВГ В и С не должно осуществляться одними только ИФН [7, 9, 12, 14, 15, 29, 33]. Очевидна необходимость одновременного использования разнонаправленных препаратов, хотя интерфероны продолжают оставаться базисным компонентом лечения.
С началом применения в клинической практике ПЕГ-ИФН-α открылись возможности для повышения эффективности лечения. Принципиальное преимущество ПЕГ-ИФН-α перед короткодействующими интерферонами — возможность их использования при ЦП, поскольку данные препараты не требуют для выведения высокосохранной печеночной перфузии [16]. Пролонгированные ИФН-α обладают меньшей антигенностью и могут применяться у больных с заболеваниями сердца, почек и гемоглобинопатиями [17]. Использование ПЕГ-ИФН-α удобно и тем, что инъекции вводятся гораздо реже. Введение осуществляется подкожно в дозе 1,5 мкг/кг массы тела всего 1 раз в нед в течение 6–12 мес.
В последние годы в лечении ХВГ привлекает внимание также отечественный препарат интерферона Виферон. Это комплексный препарат противовирусного и иммуномодулирующего действия. В его состав входят генно-инженерный интерферон-альфа-2, витамины Е и С, усиливающие противовирусный эффект и активизирующие систему ИФН.
Виферон стимулирует Т-клеточный иммунитет, восстанавливает иммунорегуляторный индекс, повышает активность естественных киллерных клеток, приводит к возрастанию фракции цитотоксических Т-лимфоцитов, активирует фагоцитоз.
В комплексной терапии ХВГ В и С у взрослых назначают Виферон по 1 млн МЕ или по 3 млн МЕ (по 1 суппозиторию утром и 1 суппозиторию вечером) через 12 ч трижды в неделю через день в течение 6–12 мес.
Если после достижения первичной ремиссии возникает обострение заболевания, назначают повторный курс лечения Вифероном продолжительностью 6 мес. При отсутствии ремиссии по окончании курса лечения дальнейшее применение препарата нецелесообразно.
Перспективным следует считать применение комбинированных схем терапии — одновременное назначение ИФН + индуктора ИФН (например, Виферон + Амиксин) с целью предупреждения ускользания ремиссии.
Аналоги нуклеозидов. Аналоги нуклеозидов — это группа средств, проявляющих активность в отношении генома вирусов гепатита.
Ламивудин (Зеффикс, Эпивир ТриТиСи) является препаратом, ингибирующим РНК-зависимую обратную транскриптазу, необходимую для транскрипции прегенома HBV-РНК в HBV-ДНК. Ламивудин обладает выраженной противовирусной активностью в отношении HBV [1, 18]. Лечение ламивудином показано больным с репликацией вируса гепатита В (наличие в крови НВеАg и ДНК HBV), при повышении активности АЛТ в 3 и более раз и изменении гистологической картины печени, а также у пациентов в стадии декомпенсации хронического гепатита и ЦП с сохраняющейся репликацией HBV [9, 18]. Взрослым ламивудин назначается в дозе 100–300 мг в день в течение как минимум 12 нед.
Критериями эффективности терапии ламивудином служат снижение концентрации HBV ДНК, исчезновение HBe-Ag и появление anti-HВe, нормализация АЛТ, уменьшение прогрессирования фиброза в печени и замедление перехода в цирроз по данным биопсии [18, 28].
Монотерапия ламивудином переносится хорошо. Побочные эффекты (недомогание, головная боль, тошнота, повышение температуры, лейкопения, депрессивный синдром) наблюдаются у 1–5% больных [18].
Терапия ламивудином позволяет через 1–3 мес лечения добиться подавления репликации и снижения уровня HBV ДНК до минимальных значений [19]. Длительное (в течение года и более) применение ламивудина приводит к исчезновению из крови ДНК HBV с нормализацией АЛТ и улучшению гистологической картины печени у 65% больных [20]. У остальных 35% больных после завершения годичного и даже трехгодичного курса терапии уровень HBV ДНК в крови вновь повышается.
Монотерапия ламивудином наиболее эффективна у больных с HBeAg-негативным вариантом ХВГ В. Тактика же лечения HBeAg-позитивного варианта HBV-инфекции требует комбинации ламивудина с ИФН [22].
Рибавирин (Копегус, Рeбетол, Веро-рибавирин) — аналог гуанозина, который вызывает торможение РНК-полимеразы вируса и непрямое торможение синтеза протеина. Доза препарата составляет 800–1200 мг/сут. Препарат принимается дважды в сутки внутрь в течение 12–48 нед. Среди его побочных эффектов отмечаются головокружение, тошнота, депрессия, гемолиз эритроцитов. Даже длительная монотерапия рибавирином не приводит к элиминации вируса. Поэтому рибавирин применяется только в комбинациии с ИФН-α, что значительно усиливает противовирусный эффект, особенно у больных, не ответивших на монотерапию ИФН, а также у больных, у которых не удалось добиться стойкого эффекта при лечении ИФН [14, 15, 23]. Схема комбинированного применения Интрона А в сочетании с Ребетолом в течение ряда лет являлась официально лицензированной схемой лечения ХВГ С [7]. Интрон А назначается в дозе 3 млн МЕ 3 раза в нед п/к или в/м в течение 24 нед, Ребетол — в дозе 800–1200 мг/сут per os в два приема также в течение 24 нед. После курса лечения у 40% больных стойко исчезала HCV РNA, снижалась активность АЛТ и уменьшался воспалительно-некротический процесс по данным биопсии печени [1].
Адефовира дипивоксил относится к группе аналогов нуклеозидов, является аналогом аденозина монофосфата (АМФ). Лечение препаратом в дозе 10 мг/сут приводит к достоверному улучшению гистологической картины печени у HBeAg-позитивных больных в сравнении с плацебо. Снижение уровня HBV DNA, скорость HВeAg-сероконверсии, нормализация АЛТ оказываются значительно выше в основной группе, чем в группе плацебо. Препарат эффективен и в лечении HВeAg-негативных больных. Важным качеством адефовира является его способность подавлять репликацию HBV DNA у ламивудин-резистентных мутантов.
Препарат в последние годы проходит клиническую апробацию как в виде монотерапии, так и в сочетании с ламивудином. Наибольший интерес вызывает последняя комбинация, хотя безопасность длительного курса адефовира дипивоксила еще предстоит уточнить.
Для пациентов с сочетанной HBV + HCV-инфекцией разработаны схемы лечения, включающие применение ПЕГ-ИФН-a в течение года и комбинацию с ламивудином в течение 6 мес, а затем рибавирина на тот же срок. При отсутствии стойкого эффекта возможно продление данной комбинированной терапии еще на 24–48 нед.
Индукторы ИФН (интерфероногены). Индукторы ИФН являются препаратами с комбинированным эффектом: этиотропным противовирусным и иммуномодулирующим, т. е. корригирующим нарушения иммунной системы. Они представляют собой семейство высоко- и низкомолекулярных природных и синтетических соединений, объединенных способностью вызывать в организме образование эндогенного ИФН. Большинство препаратов индуцируют синтез смеси α- и β-интерферонов в разных пропорциях; некоторые (Амиксин) индуцируют синтез интерферонов α, β и γ. Комбинированное применение с другими препаратами приводит к потенцированию их эффектов [24].
Индукторы интерферонов имеют определенные преимущества перед рекомбинантными интерферонами:
- индукторы ИФН не обладают антигенностью;
- рекомбинантные ИФН стимулируют цитотоксичность иммуноцитов и вызывают экспрессию молекул HLA в тех популяциях клеток, которые не экспрессируют эти антигены. Это может быть причиной усугубления аутоиммунного ответа организма;
- некоторые индукторы ИФН (Амиксин) обладают способностью запускать синтез интерферона в определенных популяциях клеток, что имеет преимущество перед поликлональной стимуляцией иммуноцитов рекомбинантными ИФН;
- рекомбинантные ИФН являются препаратами a-ИФН, что ограничивает их противовирусные свойства, т. к. для эффективной противовирусной защиты необходимо наличие всех трех классов ИФН, синтез которых вызывается индукторами интерфероногенеза;
- индукторы ИФН обладают собственными иммуномодулирующими свойствами.
Индукторы ИФН, применяющиеся для лечения ХВГ:
А — синтетические соединения:
- низкомолекулярные (ароматические) углеводы: флуореноны, акриданоны;
- полимеры (двуспиральные РНК) — поли(А) поли(У), поли(Г) поли(Ц);
В — природные соединения:
- низкомолекулярные полифенолы (производные госсипола).
Амиксин — наиболее известный препарат, является первым пероральным индуктором эндогенных ИФН α, β, γ. Он наиболее полно сочетает в себе преимущества индукторов ИФН. Являясь поликлональным стимулятором, Амиксин вызывает синтез ИФН 1 и 2 типов в Т-лимфоцитах, энтероцитах кишечника, гепатоцитах, клетках мозга. Важной особенностью Амиксина является вызываемая им длительная циркуляция в организме терапевтической концентрации ИФН (50–100 ЕД/мл в сыворотке крови) [25]. Препарат выпускается в таблетках по 125 мг, по 6 или 10 таблеток в упаковке.
Для лечения ХВГ В, С, В + С Амиксин назначается по схеме: в 1-й день — 2 таблетки по 125 мг, потом через каждые 48 ч по 125 мг — начальная фаза лечения (20 таблеток), затем следует фаза продолжения — по 125 мг 1 раз в нед на 10–20 нед (при HBV общее количество составляет 30 таблеток, при HСV и при HBV + HСV — 40 таблеток) [25].
Иммуномодуляторы. Интерлейкин-2 (ИЛ-2) представляет собой гликопротеин, индуцирующий пролиферацию и дифференцировку Т-лимфоцитов и NK-клеток. ИЛ-2 активизирует функциональную активность Т-хелперов, продуцирующих ИФН-γ. Усиление с помощью ИЛ-2 продукции ИФН-α ведет к активации макрофагов.
Интерлейкин-12 (ИЛ-12) активирует ТНJ-лимфоциты и NK-клетки, а также индуцирует выработку ИФН-α и ИЛ-2.
Для лечения ХВГ B ИЛ-2 и ИЛ-12 назначаются в дозе 500 мкг п/к 2–5 раз в нед на 4–6 мес, что ингибирует репликацию ДНК НВV без уничтожения инфицированных гепатоцитов. Биохимическая ремиссия достигается в 20% случаев. Однако после окончания лечения уровень АЛТ вновь повышается и нормальные показатели сохраняются лишь у 8% больных [1].
Рекомбинантный дрожжевой ИЛ-2 человека — Ронколейкин, является полным аналогом ИЛ-2 и обладает тем же спектром активности. Для лечения ХВГ С Ронколейкин вводят по 500000 МЕ в/в капельно 2–3 раза в нед в течение 8 нед. После курса монотерапии Ронколейкином нормальные биохимические показатели и негативная ПЦР наблюдаются у 40% пациентов [26].
Глицирризин — оказывает выраженный иммуномодулирующий эффект, характеризующийся усилением Т-клеточной активности, стимуляцией и продукцией эндогенного γ-интерферона, повышением фагоцитоза и антителообразования. Применяется в лечении хронического репликативного гепатита В. В первый месяц лечения препарат назначают по 40 мл 3 раза в нед, затем 2 раза в нед. Терапию глицирризином продолжают не менее 1 года, после чего назначается ИФН. Такая адъювантная терапия потенцирует последующий эффект интерферонотерапии у 60% больных с сероконверсией HBeAg, а у части больных наблюдается исчезновение ДНК HBV [1].
При ХВГ С представляется обоснованным назначение отечественного комплексного препарата Фосфоглив, содержащего фосфатидилхолин и тринатриевую соль глицирризиновой кислоты, обладающего не только гепатопротекторными свойствами, но и противовирусной активностью.
Применение лечебных вакцин. Принципиально новым подходом в лечении ХВГ В явилась разработка лечебных вакцин. Среди них выделяют три типа: рекомбинантные, Т-клеточные и ДНК-вакцины.
Эффективность первых двух типов вакцин оценена в пилотных исследованиях, результаты которых пока не позволяют рекомендовать их внедрение в клиническую практику. Усиление иммунного ответа в этих случаях связывают со снижением исходной вирусной нагрузки (комбинация с противовирусными препаратами) и с дополнительной иммуностимуляцией (комбинация с гамма-интерфероном, интерлейкином-2).
Особый интерес представляют плазмидные ДНК-вакцины, которые вводятся внутримышечно и индуцируют иммунный ответ против антигенов, синтезированных in vivo. В экспериментальных исследованиях на мышах показана не только длительная персистенция антител к HВsAg, но и мощный Т-клеточный ответ со стороны как цитотоксических Т-лимфоцитов, так и Т-хелперов 1-го типа. После получения доказательств безопасности ДНК-вакцин планируется исследование их эффективности у больных HBV-инфекцией.
Мы располагаем личным опытом патогенетической терапии у 44 пациентов с ХВГ В и ХВГ С. Применявшиеся нами препараты ламивудин, Циклоферон и Неовир оказывали неплохой ближайший эффект (снижение маркеров цитолиза и холестаза после курса лечения в 72–73% случаев, элиминация вирусных маркеров из крови в 28–30% случаев). Вместе с тем спустя 6 мес после окончания лечения вирусологические маркеры не определялись лишь у 12–15% больных, отмечалось рецидивирование активности патологического процесса.
У пациентов, инфицированных HCV с 1-м генотипом, комбинация Пегасиса и Копегуса (рибавирина) обеспечивает самый высокий показатель сероконверсии — 52%. В случае инфицирования ХВГ С с 4-м генотипом терапия, проводимая в течение 48 нед Пегасисом (180 мкг/нед) и Копегусом (1000 или 1200 мг/сут), дает возможность получить уровень сероконверсии, сопоставимый с таковым при 2-м и 3-м генотипах — около 80%. Статистически достоверно большее количество больных с высокой исходной вирусологической нагрузкой (> 2 в 106 копий/мл), принимающих Пегасис + Копегус, продемонстрировало достижение сероконверсии по сравнению с пациентами, получающими простой ИФН альфа-2b + рибавирин (53% против 41%, р = 0,003).
APRICOT (AIDS PEGASYS Ribavirin International Coinfection Trial) — международное многоцентровое рандомизированное исследование, изучающее комбинированное применение Пегасиса и Копегуса у больных с ВИЧ + ВГС, — продемонстрировало уровень эффективности, равный 40%, при длительности терапии 48 нед. Это самый высокий показатель по данной коинфекции, полученный в международном исследовании. Пегасис и Копегус — единственные препараты в мире, одобренные Управлением по контролю за пищевыми продуктами и лекарственными средствами (FDA) для лечения пациентов с ВИЧ + ВГС.
Клинические испытания проходит новый препарат ISIS-14803, нарушающий связывание РНК HCV с рибосомами.
В целом терапия вирусных гепатитов остается сложной и актуальной задачей на сегодняшний день. Можно утверждать, что будущее химиотерапии вирусных гепатитов принадлежит использованию комбинации лекарственных средств с разными механизмами действия.
В. В. Скворцов, доктор медицинских наук
А. В. Тумаренко, кандидат медицинских наук
ВГМУ, Волгоград
Хронические гепатиты - полиэтиологическое диффузное заболевание печени, обусловленное первичным поражением ее клеток, продолжающееся без улучшения не менее 6 месяцев и характеризующееся воспалительно-дистрофическими, а также дегенеративными изменениями как паренхимы, так и интерстиция органа без нарушения дольковой архитектоники печени, имеющее стационарное или прогрессирующее в циррозе печени течение.
Протокол "Хронический гепатит"
Коды МКБ-10: К 73
Классификация
Классификация хронических гепатитов и цирроза печени (принята конгрессом гепатологов, Лос-Анджелес 1994).
- хронический вирусный гепатит (с указанием вызвавшего его вируса В, С, Д);
- хронический вирусный гепатит (не идентифицируемый);
- хронический гепатит (не идентифицируемый ни как аутоиммунный, ни как вирусный);
- хронический медикаментозный, лекарственно-индуцированный гепатит;
- первичный билиарный цирроз;
- первичный склерозирующий холангит;
- болезнь недостаточности ά1 антитрипсина.
- смешанный (макро- и микронодулярный);
- причина не установлена.
- активный (минимальная степень активности, умеренная степень активности, резко выраженная степень активности).
Диагностика
Диагностические критерии
Жалобы и анамнез: боли в правом подреберье, увеличение печени и уплотнение ее края, тошнота при приеме пищи, слабость, носовые и другие кровотечения, преходящая желтуха, асцит, печеночные знаки, внепеченочные проявления.
Лабораторные исследования: умеренное повышение активности трансаминаз, увеличение тимоловой пробы, гипергаммаглобулинемия, гипоальбуминемия, снижение протромбинового индекса, анемия, лейкопения, тромбоцитопения, повышение преимущественно непрямого билирубина, холестерина, глутаматдегидрогеназы, признаки репликации вирусов (положительные серологические маркеры гепатитов В, С, Д), повышение активности щелочной фосфотазы.
Инструментальные исследования: увеличение печени, повышение ее плотности (диффузные изменения).
Компьютерная томография - изменение структуры печени, увеличение печени.
Показания для консультации специалистов:
- гематолог (по показаниям);
- невропатолог (по показаниям);
- окулист (по показаниям);
Минимум обследования при направлении в стационар:
- УЗИ органов брюшной полости;
- АЛТ, АСТ, билирубин;
- кал на яйца гельминтов;
- соскоб на энтеробиоз.
Перечень основных диагностических мероприятий:
1. Общий анализ крови (6 параметров).
2. Определение свертываемости капиллярной крови.
3. Определение гаммаглютамил транпептидазы.
4. Определение щелочной фосфотазы.
5. Определение билирубина.
6. Определение холестерина.
7. Гистологическое исследование ткани печени.
8. Тимоловая проба.
9. ПЦР HCV-РНК (генотип).
10. ПЦР HCV-РНК (колич.).
11. УЗИ органов брюшной полости.
12. Общий анализ мочи.
14. Протромбиновый индекс.
15. Определение общего белка.
16. Определение белковых фракций.
17. Определение железа.
20. ИФА HDV IG M.
21. Определение АЛТ.
22. Определение АСТ.
23. Определение креатинина.
24. Определение ост. азота.
25. Определение В-липопротеидов.
27. Определение церулоплазмина.
28. Определение меди в сыворотке.
29. Определение меди в моче.
32. Гематолог (по показаниям).
33. Невропатолог (по показаниям).
34. Окулист (по показаниям).
35. Инфекционист-гепатолог (по показаниям).
Перечень дополнительных диагностических мероприятий:
1. Определение глюкозы.
2. Биопсия (по согласию родителей).
3. ИФА на суммарные аутоантитела.
4. Определение на ВИЧ.
5. Определение диастазы.
6. Исследование кала на скрытую кровь.
7. Компьютерная томография.
Дифференциальный диагноз
Дифференциальная диагностика хронических гепатитов требует исключения ряда заболеваний, сопровождающихся гепатомегалией и желтухой.
Заболевания, проявляющиеся преимущественным увеличением печени можно разделить на 3 группы (Подымова, 1998):
1. Болезни печени и ее сосудов: острый вирусный гепатит, хронический вирусный гепатит В, С, Д и др., аутоиммунный гепатит, цирроз (латентная форма), эхинококкоз, рак, доброкачественные опухоли, непаразитарные кисты, туберкулезный гранулематоз, болезнь Бадда-Киари, туберкулома.
2. Болезни накопления: жировой гепатоз, гемохроматоз, гепатолентикулярная дегенерация, амилоидоз.
3. Болезни сердечно-сосудистой системы: констриктивный перикардит, недостаточность кровообращения 2 и 3 степени различной этиологии (застойная печень).
Острый вирусный гепатит. Имеет острое начало, неблагоприятный эпидемиологический анамнез, указание на гемотрансфузии, инъекции и операции. В крови - повышение активности аминотрансфераз, обнаруживаются маркеры гепатитов А, В или D антигенов.
Цирроз печени. В анамнезе - острый вирусный гепатит, токсические отравления. При осмотре - отмечаются внепеченочные сосудистые знаки, гинекомастия. В крови - повышение содержания глобулинов, аминотрансфераз, понижение уровня альбуминов, протромбина. Наблюдаются признаки портальной гипертензии: расширение вен пищевода, желудка, геморроидальных вен, увеличение диаметра портальной и селезеночной вен. Прицельная биопсия печени позволяет выявить мультилобулярные узлы до 5 мм в диаметре при макронодулярной форме, узлы одинаковых размеров до 3 мм и фибринозные септы при микронодулярной форме цирроза.
Жировая дистрофия печени. В анамнезе - сахарный диабет, заболевания желудочно-кишечного тракта. Печень увеличена с закругленным краем, гладкой поверхностью. Жировая дистрофия хорошо диагностируется при УЗИ и КТ. Характерных функциональных критериев диагностики нет. Наблюдается диффузное ожирение гепатоцитов в биоптате печени.
Гемохроматоз. В начальной стадии характерные клинические симптомы могут отсутствовать. Отмечается значительное увеличение содержания железа в сыворотке крови, повышенное насыщение железом трансферрина, резкий рост уровня ферритина с сыворотке. В биоптатах печени наблюдается обильное отложение железа, дающего положительную реакцию Периса. В последующем отмечается гаптомегалия, сахарный диабет, гиперпигментация кожи и кардиомиопатия.
Гепатолентикулярная дегенерация (болезнь Вильсона - Коновалова). При абдоминальной форме характерных клинических симптомов нет. Выявляется неврологическая симптоматика, дрожательно-ригидный симптом или гиперкинезы, снижение интеллекта. При осмотре роговицы с помощью щелевой лампы наблюдается кольцо Кайзера-Флейшера (темно-зеленый ободок, содержащий медь). В сыворотке крови - снижение содержания сывороточного церулоплазмина (
Амилоидоз печени. Характерно повышение α-2- и γ-глобулинов в сыворотке крови. В биоптате печени обнаруживается амилоид в виде гомогенных масс, окрашивающихся Конго красным в розовый цвет.
Наследственные пигментные гепатозы. Для семейной гипербилирубинемии Жильбера (аутосомно-доминантный тип наследования) характерно повышение непрямого билирубина крови, после эмоционального или физического стресса, острых инфекций, операций. Возможны жалобы астенического и диспепсического характера. Основные проявления - иктеричность и субиктеричность склер. Желтуха часто носит перемежающий характер. Диагностическая проба с введением индукторов транспортных белков и глюкуронилтрансферазы, фенобарбитала или зиксорина позволяет установить истинную причину желтухи. Решающим в диагностике является пункционная биопсия печени - выявляются отложения желтовато-коричневого пигмента по ходу желчных капилляров в центре долек.
Клиническая симптоматика при синдромах Дабина-Джонсона и Ротора сходна и включает астенический, диспепсический, болевой, абдоминальный синдром. Желтуха, постоянная или интермиттирующая, сопровождается нерезким кожным зудом, чаще наблюдается в подростковом и молодом возрасте. При синдроме Дабина-Джонсона в крови повышается содержание прямого билирубина вследствие нарушения его выделения из гепатоцитов в желчь. Отмечается увеличение печени и селезенки, отсутствие контрастирования желчного пузыря при пероральной холецистографии, накопление в печени крупнозернистого меланинподобного темно-коричневого пигмента.
Что такое гепатит Б? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит В (Б) — острое и хроническое инфекционное заболевание, вызываемое вирусом гепатита В, с гемоконтактным механизмом передачи (через кровь), протекающее в различных клинико-морфологических вариантах, и возможным развитием цирроза печени и гепатоцеллюлярной карциномы. Всего в мире, по самым скромных оценкам, инфицировано более 250 млн человек.
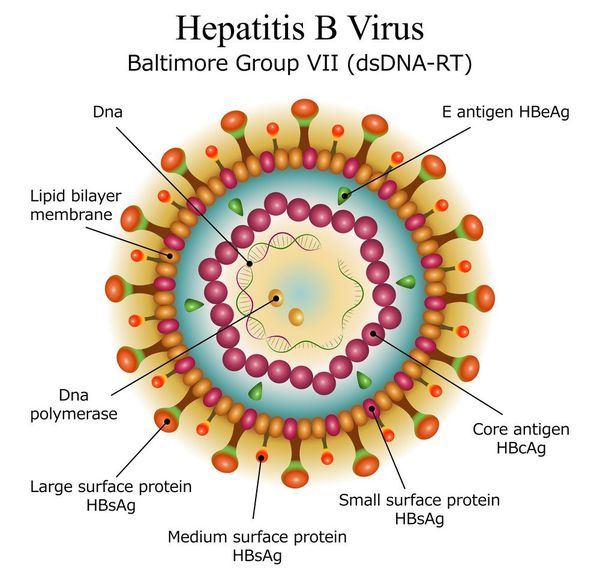
Этиология
вид — вирус гепатита В (частица Дейна)
Развитие вируса гепатита Б происходит в гепатоцитах (железистых клетках печени). Он способен к интеграции в ДНК человека. Имеются 9 генотипов вируса с различными подтипами — генетическая изменчивость позволяет вирусу образовывать мутантные формы и ускользать от действия лекарств.
Имеет ряд собственных антигенов:
- поверхностный HbsAg (австралийский). Появляется за 15-30 дней до развития болезни, свидетельствует об инфицировании (не всегда). Антитела к HbsAg выявляются через 2-5 месяцев от начала заболевания, а сам HbsAg исчезает из крови (при благоприятном течении процесса);
- сердцевинный HbcorAg (ядерный, коровский). Появляется в инкубационном периоде и совместно с ним появляются антитела (HbcorAb). Длительное присутствие HbcorAg в крови свидетельствует о вероятной хронизации процесса (неадекватный иммунный ответ);
- антиген инфекциозности и активного размножения вируса (HbeAg). Появляется совместно с HbsAg и отражает степень инфицированности. Его продолжительная циркуляция в крови является свидетельством развития хронизации процесса, а антитела к нему являются благоприятным прогностическим признаком (не всегда, но по меньшей мере указывают на возможность более благоприятного процесса, срок их циркуляции после выздоровления окончательно не определён, но не более пяти лет после благоприятного разрешения процесса);
- HbxAg — регулятор транскрипции, способствует развитию гепатокарциномы.
Вирус гепатита В чрезвычайно устойчив к действию всевозможных естественных факторов окружающей среды, инактивируется при 60 °C за 10 часов, при 100 °C за 10 минут, при оптимальной температуре сохраняется до 6 месяцев, при автоклавировании погибает за 5 минут, в сухожаровом шкафу — через 2 часа, 2% раствор хлорамина убивает вирус за 2 часа. [1] [3]
Эпидемиология
Источник инфекции — только человек, больной острой или хронической формой инфекции.
Механизм передачи: гемоконтактный и вертикальный (от матери к ребёнку), не исключается трансмиссивный механизм передачи (например, при укусах комаров в результате раздавливания и втирания инфицированного тела комара в поврежденную ткань человека).
Пути передачи: половой, контактно-бытовой, гемотрансфузионный (например, при переливании крови или медицинских манипуляциях). Восприимчивость всеобщая. Заболеваемость — 30-100 человек на 100 тысяч населения (зависит от страны). Летальность от острых форм — до 2%. После перенесённого острого заболевания при условии выздоровления иммунитет стойкий, пожизненный.
Для заражения характерна малая заражающая доза (невидимые следы крови). [1] [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита Б
Инкубационный период гепатита В длится от 42 до 180 дней (следует иметь в виду, что наличие клинической симптоматики характеризует лишь незначительную долю всех случаев заболевания).
Начало постепенное. Характерные синдромы:
- общей инфекционной интоксикации (проявляется как астеноневротический синдром);
- холестатический (нарушение секреции желчи);
- артрита;
- нарушения пигментного обмена (появление желтухи при уровне общего билирубина свыше 40 ммоль/л);
- геморрагический (кровоточивость кровеносных сосудов);
- экзантемы;
- отёчно-асцитический (скопление жидкости в брюшной полости);
- гепатолиенальный (увеличение печени и селезёнки).
При первых признаках гепатита B нужно обратиться к доктору.
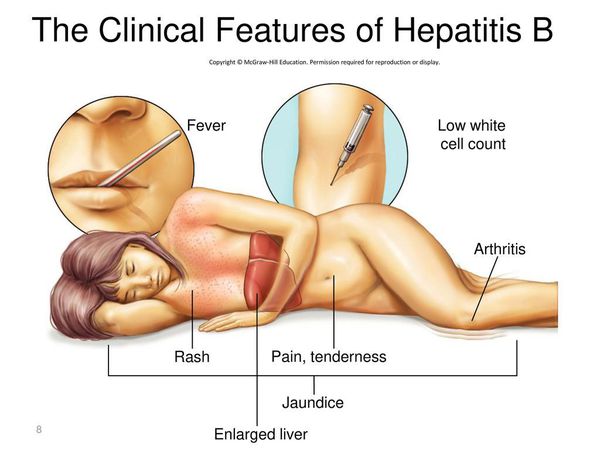
Первые признаки гепатита B
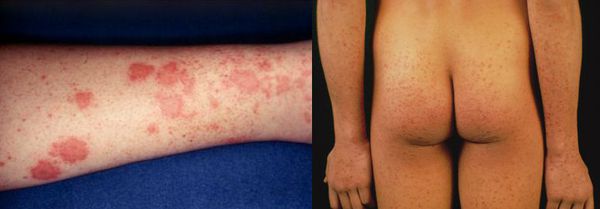
Начальный (преджелтушный) период продолжается 7-14 дней. Чаще протекает по многообразному типу с болевыми ощущениями в различных суставах по ночам и утром, уртикарными высыпаниями, астеновегетативными проявлениями (снижение аппетита, апатия, нервозность, слабость, разбитость, повышенная утомляемость). Изредка развивается синдром Джанотти-Крости — симметричная, яркая пятнисто-папулёзная сыпь. Не исключены умеренные диспептические явления (расстройства пищеварения). К концу периода происходит потемнение мочи, обесцвечивание кала.
Желтушный период
Этот период продолжительностью около одного месяца характеризуется возникновением желтушного окрашивания кожи (различных оттенков) на фоне продолжающегося или ухудшающегося общего состояния. Характерна длительность и стойкость симптоматики. Появляется тяжесть и болезненность в правом подреберье, горечь во рту, тошнота, выражённый зуд кожи (практически не снимаемый никакими средствами). На фоне усиления астеноневротического компонента появляются геморрагические проявления, урежение пульса, гипотензия, отёки (отражает степень интоксикации и нарушения функций печени).
Выздоровление
Следующим этапом в развитии болезни является нормализации общего состояния, спадение желтухи и реконвалесценция, которая в зависимости от конкретной ситуации и состояния иммунной системы может закончиться как выздоровлением, так и движением развития заболевания в хроническое течение, характеризующееся маловыраженой неусточивой симптоматикой, преимущественно в виде слабости, периодического дискомфорта в правом подреберье, бурно сигнализирующим лишь на стадии цирроза и полиорганных осложнений.
- гепатиты другой этиологии;
- желтухи другой этиологии (например, гемолитическая болезнь, токсическое поражение, опухоли);
- малярия; ;
- лептоспироз;
- ревматоидный артрит.
Гепатит В у беременных
Острый гепатит характеризуется более тяжёлым течением у беременной, возникновении повышенного риска преждевременных родов, аномалий развития плода на ранних сроках и кровотечений. Вероятность передачи при острой форме зависит от сроков беременности: в первом триместре риск 10% (но более тяжёлые проявления), в третьем триместре — до 75% (чаще бессимптомное течение после родов). У большинства детей при заражении во внутриутробном и постнатальном периодах происходит хронизация инфекции. [1] [3] [6]
Патогенез гепатита Б
С движением кровяной массы вирус попадает в печеночную ткань, где локализуется в гепатоцитах и теряет свою протеиновую сферу в лизосомах. Происходит выход вирусной ДНК с последующим ресинтезом аномальных протеинов LSP, а параллельно образование новых частиц Дейна.
В процессе эволюции вирусчеловеческого взаимодействия возможно развитие двух вариантов:
При репликативном пути происходит следующее: белки LSP совместно с HbcorAg вызывают увеличение продукции гамма-интерферона, что приводит к активации главного комплекса гисотсовместимости (HLA), проистекает преобразование молекул гистосовместимости 1 и 2 классов, в результате чего клетка становиться для организма враждебной в антигенном формате.
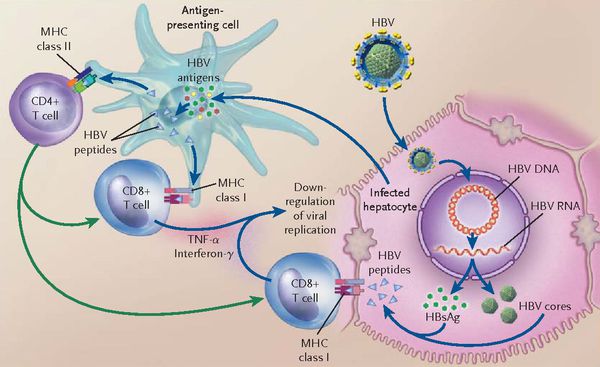
Антигенпрезентирующие макрофаги содействуют изменению В-лимфоцитов в плазматические клетки и экспрессии ими агрессивных белков-антител к посторонним антигенам. В итоге на поверхности печёночных клеток формируются вирусспецифические иммунные комплексы (антиген + антитело + фракция комплемента С3в).
В динамике может реализоваться два сценария:
- в первом варианте запуск каскада комплимента ведёт к появлению в составе иммунных комплексов агрессивной фракции С9 (мембранатакующий комплекс) — наблюдается значительный некроз гепатоцитов без участия лимфоцитов (молниеносная форма гепатита В);
- при альтернативной варианте (наблюдающимся в большинстве случаев) каскад комплемента в силу иммуноиндивидуалистических свойств не активируется — тогда идёт умеренное разрушение Т-киллерами меченых антителами заражённых вирусом гепатоцитов. Образуются ступенчатые некрозы с образованием на месте гибели гепатоцитов соединительной ткани — рубцов (то есть острый гепатит В при плохом иммунном ответе постепенно переходит в хронический).
Непременным атрибутом патогенеза является формирование иммунопатологического процесса. Гибель гепатоцитов, инфицированных вирусом гепатита В, следует за счёт иммунокомпетентных частиц, Т-киллеров и макрофагальных элементов.
Серьёзным значением является нарушение свойств мембраны клеток печени, что сопровождается экскрецией (выделением) лизосомальных ферментов, разрушающих гепатоциты. Сообразно этому, гибель гепатоцитов происходит за счёт иммунокомпетентных клеток, лизосомальных ферментов и противопечёночных гуморальных аутоантител, то есть острая болезнь наступает (и благоприятно заканчивается) только при хорошем иммунитете, а при плохом идёт хронизация.
При тяжёлом цитолитическом синдроме (массивные некрозы гепатоцитов) возникает гипокалиемический алкалоз, острая печёночная недостаточность, печёночная энцефалопатия (ПЭП), церебротоксическое действие, нарушение функции обмена нервной ткани. [2] [3] [6]
Классификация и стадии развития гепатита Б
По цикличности течения:
- острый;
- острый затяжной;
- хронический.
По клиническим проявлениям:
- субклинический (инаппарантный);
- клинически выраженный (желтушный, безжелтушный, холестатический, фульминантный).
По фазам хронического процесса:
Группы риска хронического гепатита B
Хроническим гепатитом чаще страдают дети младше шести лет. При заражении в первый год жизни он развивается в 80–90 % случаев, от года до шести лет — в 30–50 %, у взрослых без сопутствующих заболеваний — менее чем в 5 %. [7]
Осложнения гепатита Б
Чем опасен гепатит Б
Заболевание может привести к острой печёночной недостаточности (синдрому острой печеночной энцефалопатии).
Выделяют четыре стадии болезни:
Диагностика гепатита Б
Многообразие форм, тесная взаимосвязь с иммунной системой человека и зачастую достаточно высокая стоимость исследований часто затрудняют принятие конкретного решения и диагноза в стационарный отрезок времени, поэтому во избежание роковых (для больного) ошибок следует подходить к диагностике с учётом всех получаемых данных в динамическом наблюдении:
- общеклинический анализ крови с лейкоцитарной формулой (лейкопения, лимфо- и моноцитоз, уменьшение СОЭ, тромбоцитопения);
- общий анализ мочи (появление уробилина);
- биохимический анализ крови (гипербилирубинемия в основном за счёт связанной фракции, повышение уровня АЛТ и АСТ, ГГТП, холестерина, щелочной фосфатазы, снижение протромбинового индекса, фибриногена, положительная тимоловая проба);
- маркеры гепатита В: HbsAg, HbeAg, HbcorAg, HbcorAb IgM и суммарные, HbeAb, anti-Hbs, ПЦР в качественном и количественном измерении);
- УЗИ органов брюшной полости, КТ и МРТ диагностика;
- фиброскан (применяется для оценки степени фиброза). [3][4]
Скрининг при хроническом гепатите
Пациентам с хроническим гепатитом В рекомендуется не реже чем раз в полгода проходить обследование: УЗИ органов брюшной полости, клинический анализ крови, АЛТ, АСТ, тест на альфа-фетопротеин. Скрининг позволяет вовремя заметить обострение болезни и начать специфическую терапию.
Лечение гепатита Б
Лечение острых форм гепатита В должно осуществляться в стационаре (учитывая возможность быстрых и тяжёлых форм болезни), хронических — с учётом проявлений.
Диета и режим при гепатите В
В острый период показан постельный режим, печёночная диета (№ 5 по Певзнеру): достаточное количество жидкости, исключение алкоголя, жирной, жареной, острой пищи, всё в мягком и жидком виде.
Медикаментозная терапия
При лёгкой и средней тяжести острого гепатита этиотропная противовирусная терапия (ПВТ) не показана. При тяжёлой степени и риске развития осложнений назначается специфическая противовирусная терапия на весь период лечения и возможно более длительное время.
В лечении хронических форм гепатита показаниями к назначению ПВТ является наличие уровня DNA HBV более 2000 МЕ/мл (при циррозе печении независимо от уровня), умеренное и высокое повышение АЛТ/АСТ и степени фиброза печёночной ткани не менее F2 по шкале METAVIR, высокая вирусная нагрузка у беременных женщин. В каждом конкретном случае показания определяются индивидуально, в зависимости от выраженности процесса, временной тенденции, пола, планирования беременности и другого.
Существует два пути противовирусного лечения:
- терапия пегилированными интерферонами (имеет ряд существенных противопоказаний и серьёзных побочных эффектов — не менее 12 месяцев);
- нуклеозидно-аналоговой терапии NA (используются препараты с высоким порогом резистентности вируса, длительно — не менее пяти лет, удобство применения, хорошая переносимость).
В отдельных случаях может рассматриваться применение комбинированной терапии.
Из средств патогенетической терапии в острый период используются внутривенно вводимые растворы 5% глюкозы, дезинтоксикантов, антиоксидантов и витамины. Показан приём энтеросорбентов, ферментных препаратов, при выраженном холестазе применяются препараты Урсодезоксихолевой кислоты, при тяжёлом течении — глюкокортикостероиды, методы аппаратного плазмофереза.
В хронической стадии заболевания при наличии соответствующей активности процесса и невозможности назначения ПВТ может быть показан приём групп гепатопротекторов и антиоксидантов. [1] [3]
Прогноз. Профилактика
Основное направление профилактики на сегодняшний день — это проведение профилактической вакцинации против гепатита В в младенческом возрасте (в том числе усиленная вакцинация детей, рождённых от матерей с гепатитом В) и далее периодические ревакцинации раз в 10 лет (или индивидуально по результатам обследования). Достоверно показано, что в странах, где была введена вакцинация, резко сократилось количество вновь выявленных случаев острого гепатита В.
Вторая составляющая стратегии профилактики включает обеспечение безопасности крови и её компонентов, использование одноразового или стерилизованного инструментария, ограничение числа половых партнёров и использование барьерной контрацепции. [1] [2]
Читайте также:

