Гепатит после антибиотиков у ребенка
Обновлено: 23.04.2024
Лекарственный (медикаментозный) гепатит – это поражение печени, возникающее вследствие токсического эффекта лекарственных препаратов на клетки печени с развитием в них воспаления и даже некроза.
Среди осложнений лекарственной терапии достаточно часто встречаются поражения и гибель клеток печени, что примерно в 15-20% случаях может быть причиной молниеносной формы острого лекарственного гепатита и может привести к летальному исходу. Острый лекарственный гепатит - одно из показаний к трансплантации печени. Несколько чаще лекарственный гепатит встречается у женщин, чем у мужчин.
Важно!
более 1000 препаратов, могут приводить к развитию медикаментозного гепатита
сочетанный прием 2-3 препаратов увеличивает токсичность действия лекарств
одновременный прием 6 и более препаратов увеличивает вероятность токсического повреждения печени до 80%
скорость развития лекарственного гепатита варьирует от нескольких суток до нескольких месяцев
может протекать бессимптомно (в том числе, и без желтухи)
даже незначительные симптомы исчезают, при отмене препаратов
не заниматься самолечением!
прогноз - благоприятный, но при своевременной отмене лекарственного препарата, вызвавшего поражение печени.
Некоторые группы лекарственных средств вызывают развитие лекарственного гепатита чаще других. К ним относятся:
Нестероидные противовоспалительные средства (Аспирин, Диклофенак, Парацетамол и др.)
Противотуберкулезные средства (Изониазид, Рифампицин)
Антибиотики из группы тетрациклинов (Тетрациклин, Доксициклин, Хлортетрациклин и др.), пенициллинов (Амоксициллин, Бензилпенициллин и др.), макролидов (Эритромицин), сульфаниламиды (Сульфадиметоксин, Бисептол, Котримоксазол и др.)
Гормональные препараты (оральные контрацептивы, половые гормоны, Ретаболил и др.)
Противоязвенные препараты (Омепразол)
Противоэпилептические, противосудорожные средства (Карбамазепин, Фенитоин, Клоназепам и др.)
Противоаритмические препараты (Амиодарон).
Межлекарственные взаимодействия
Как правило, с возрастом при наличии нескольких сопутствующих заболеваний пациенты вынуждены принимать одновременно несколько лекарственных препаратов, что может негативно сказываться как на эффективности лечения, так и приводить к развитию побочных эффектов.
Превращение лекарственных препаратов (детоксикация) осуществляется в печени с участием цитохрома Р450 — группы ферментов, отвечающих за метаболизм чужеродных органических соединений и лекарственных препаратов.
Цитохром Р450 участвует в метаболизме многих лекарственных средств, например:
лекарственные средства, понижающие кислотность желудочного сока (ингибиторы протонной помпы)
противоаллергические (антигистаминные) препараты
лекарственные средства, понижающие артериальное давление (антагонисты кальция)
седативные и транквилизаторы (бензодиазепины)
противовирусные препараты (ингибиторы протеазы)
гиполипидемические препараты (статины).
Важно! 17-23% комбинаций лекарственных препаратов потенциально опасны.
Это может насторожить:
- Тошнота, иногда рвота
- Расстройство стула
- Общее недомогание и слабость
- Боли или тяжесть в правом подреберье
- Желтуха - пожелтение кожи и слизистых оболочек (напр., склер)
- Кожный зуд с последующими расчесами
- Увеличение в размерах печени и селезенки.
Как подтвердить лекарственный гепатит:
Биохимический анализ крови (АСТ, АЛТ, ЩФ, ГГТП, уровень билирубина, фракции глобулинов)
Коагулограмма (МНО, протромбин)
Общий анализ крови
Общий анализ мочи
УЗИ органов брюшной полости;
Пункционная биопсия
Тщательный сбор лекарственного анамнеза!
Важно исключить:
· гепатит А (ссылка на Вирусный гепатит А)
· гепатит В (ссылка на Вирусный гепатит В)
· гепатит С (ссылка на Вирусный гепатит С)
· гепатит D (ссылка на Вирусный гепатит D)
· гепатит Е (ссылка на Вирусный гепатит Е)
Основные принципы лечения лекарственного гепатита:
Отмена лекарственного препарата, вызвавшего гепатит
Подбор соответствующей ему замены
Патогенетическая терапия (восстановление печени с помощью препаратов, улучшающих обмен в печеночных клетках и способствующих их восстановлению)
Диета - стол №5 по Певзнеру (дробное питание, ограничение жиров, но достаточное содержание в пище углеводов, белков, витаминов; запрещаются жирная, жареная и острая пища, алкоголь)
Трансплантация печени проводится пациентам с острой печеночной недостаточностью.
Что необходимо знать пациенту перед началом приема любого лекарственного препарата?
Показания для назначения того или иного препарата.
Как и когда принимать лекарственное средство.
Имеет ли значение пропуск дозы препарата и что следует предпринять в данном случае.
Как долго предполагается принимать лекарственное средство.
Как распознать неблагоприятные побочные реакции.
Риск взаимодействия препарата с алкоголем и курением
Риск взаимодействия препарата с другими лекарственными средствами.
Не откладывайте - обращайтесь за квалифицированной медицинской помощью!
Помните, что правильно и своевременно поставленный диагноз гарантирует эффективность лечения!
Мы подберём лечение для каждого!
Объем исследований определяет врач после очной консультации.
В нашем Центре используются доказанные в клинической практике инновационные методы диагностики и проверенные схемы лечения заболеваний печени.
Эффективность нашей работы связана с разработкой и внедрением в практику современных методов обследования и лечения.
Лекарственный гепатит – реактивное воспалительное поражение печени, вызванное приемом гепатотоксичных медикаментов. Признаками лекарственного гепатита может служить появление тошноты, рвоты, снижения аппетита, запоров или диареи, желтухи, потемнения мочи и осветления кала. Диагностика лекарственного гепатита производится на основании анамнеза, определения уровня печеночных проб, УЗИ печени. Лечение лекарственного гепатита требует отмены фармпрепарата, вызвавшего поражение печени, проведения дезинтоксикационной терапии, назначения гапатопротекторов.
Общие сведения
Медикаментозный (лекарственный) гепатит – это поражение тканей печени в результате токсического повреждения гепатоцитов метаболитами лекарственных веществ, с развитием реактивного воспаления и некроза клеток печени. Лекарственные гепатиты осложняют проводимую фармакотерапию в 1-28% случаев и в 12-25% случаев приводят к развитию цирроза печени и печеночной недостаточности. Женщины болеют лекарственными гепатитами в 2—3 раза чаще, чем мужчины. Изучением и лечением лекарственных гепатитов занимается специальный раздел гастроэнтерологии – гепатология.

Причины
Важнейшей функцией печени в организме является нейтрализация и обезвреживание токсических веществ, поступающих в нее с током крови. Метаболизм и утилизация химических и биологических токсинов происходит под действием ферментативной обезвреживающей системы гепатоцитов, с последующим выведением вредных продуктов из организма. Процесс утилизации токсичных веществ протекает в печени в несколько этапов, в ходе чего образуются метаболиты - промежуточные продукты биотрансформации. Метаболиты некоторых лекарств являются еще более гепатотоксичными, чем сами фармпрепараты. Длительный прием таких медикаментов или их высокая дозировка приводит к истощению обезвреживающих ферментативных систем и повреждению гепатоцитов, в результате чего развивается лекарственный гепатит.
На сегодняшний день известно более тысячи наименований лекарственных препаратов, приводящих к развитию медикаментозного гепатита. Токсичность действия лекарств увеличивается при сочетанном приеме 2-3-х препаратов, а при одновременном приеме 6-ти и более лекарств вероятность токсического повреждения печени увеличивается до 80%. Скорость развития лекарственного гепатита на фоне приема медикаментов варьирует от нескольких суток до нескольких лет.
К факторам риска развития лекарственного гепатита относят генетически детерминированную повышенную чувствительность к какому-либо лекарству; наличие на момент принятия препарата хронического гепатита, вирусного гепатита, аутоиммунного гепатита, асцита; прием алкоголя или токсическое воздействие растворителей, ядовитых газов на фоне медикаментозной терапии; беременность; дефицит белка в пищевом рационе; стресс; почечную недостаточность, сердечную недостаточность и др.
В основные группы препаратов, вызывающих лекарственный гепатит, входят:
- Средства для лечения туберкулеза (рифампицин, изониазид)
- Антибиотики: тетрациклины (тетрациклин, хлортетрациклин, диксициклин), пенициллины (бензилпенициллин, амоксициллин, и др.), макролиды (эритромицин)
- Сульфаниламиды ( сульфаметоксазол + триметоприм, сульфадиметоксин и др.)
- Гормоны (стероидные гормоны, оральные контрацептивы и др.)
- НПВС (диклофенак, ибупрофен)
- Противосудорожные и противоэпилептические средства (фенитоин, карбамазепин, клоназепам и т. д.)
- Противогрибковые препараты (амфотерицин В, кетоконазол, фторцитозин)
- Диуретики (гидрохлоротиазид, фуросемид и др.)
- Цитостатики (метотрексат)
- Препараты для лечения аритмии, сахарного диабета, язвенной болезни и мн. др.
Список лекарственных препаратов, обладающих гепатотоксичным действием, далеко не исчерпывается названными медикаментами. Медикаментозный гепатит может вызываться практическим любым лекарственным средством и особенно – сочетанием нескольких препаратов.
Симптомы лекарственного гепатита
Лекарственный гепатит может протекать в острой или хронической форме. Острые лекарственные гепатиты, в свою очередь, делятся на холестатические, цитолитические (протекающие с некрозом и жировым гепатозом) и смешанные.
Симптоматика лекарственного гепатита аналогична проявлениям других видов гепатита. Доминирующими в клинической картине являются диспепсические расстройства: потеря аппетита, тошнота, отрыжка горечью, рвота, диарея или запор, похудание. Основным клиническим проявлениям может предшествовать продромальный период, протекающий с астеническим или аллергическим синдромом. При лекарственном гепатите беспокоят умеренные боли, тяжесть, дискомфорт в правом подреберье; при пальпации определяется гепатомегалия, болезненность печени. Иногда на фоне лекарственного гепатита развивается желтуха, кожный зуд, лихорадка, осветление кала и потемнение цвета мочи.
В ряде случаев лекарственный гепатит может быть выявлен только на основании изменений в биохимических показателях крови. Острый лекарственный гепатит, протекающий с образованием субмассивных некрозов, довольно быстро приводит к циррозу печени. При массивном некрозе печени развивается печеночная недостаточность.
Диагностика
В процессе диагностики лекарственного гепатита важно исключить вирусный гепатит, желчнокаменную болезнь, опухоли печени, рак поджелудочной железы. При сборе анамнеза важно выяснить причинно-следственную связь поражения печени с приемом гепатотоксичных препаратов.
При подозрении на лекарственный гепатит исследуются биохимические пробы печени, в которых повышается активность трансаминаз (АсАТ, АлАТ) и щелочной фосфатазы, уровень билирубина, фракции глобулинов. Производится исследование коагулограммы, общего анализа мочи и крови, копрограммы.
УЗИ органов брюшной полости позволяет выявить диффузное увеличение печени, однако не позволяет судить о причине гепатита.
Лечение лекарственного гепатита
Первым шагом в лечении лекарственного гепатита является отмена препарата, предположительного вызвавшего поражение печени и его замена на более безопасный аналог. Самостоятельно заменять лекарства пациенту категорически воспрещается. С целью выведения из организма токсичных метаболитов проводится дезинтоксикационная инфузионная терапия, плазмаферез, в тяжелых случаях - гемодиализ.
Для восстановления поврежденных клеток печени назначаются препараты гепатопротекторного действия (эссенциальные фосфолипиды, адеметионин, метионин). При назначении медикаментов с известным гепатотоксическим потенциалом рекомендуется превентивный прием гепатопротекторов, что позволяет предотвратить развитие лекарственного гепатита.
Пациентам с лекарственным гепатитом рекомендуется придерживаться диеты: дробного питания, ограничения жиров, достаточного употребления белка, углеводов, витаминов; исключить алкоголь, жирную, жареную и острую пищу.
Прогноз и профилактика
В тяжелых случаях, при молниеносном развитии лекарственного гепатита или массивном некрозе печеночной паренхимы, развивается цирроз, печеночная недостаточность, иногда – печеночная кома и смерть. При своевременной отмене гепатотоксичного препарата в большинстве случаев, наступает полное выздоровление.
Профилактика лекарственного гепатита заключается в рациональном использовании медикаментов, мониторинге побочных эффектов, приме препаратов только по назначению врача, исключении дополнительных токсических влияний. На фоне длительной лекарственной терапии рекомендуется назначение гепатопротекторов. Пациентам, вынужденным длительное время принимать лекарства, необходимо периодически исследовать уровень трансаминаз с тем, чтобы выявить лекарственный гепатит на ранней стадии.
Показано, что стандартизированный силимарин является рациональным гепатопротективным препаратом, который рекомендуют применять детям с различными заболеваниями печени с профилактической и с лечебной целью.
It is shown that standardized silimarin is a rational Hepatoprotective preparation, which is recommended for use in children with different hepatic diseases with preventive and therapeutic purposes.
Неалкогольная жировая болезнь печени (НАЖБП) является актуальной проблемой современной педиатрии. Следует отметить, что в последние годы отмечается рост числа детей, страдающих НАЖБП. При этом в 23–53% случаев развитие НАЖБП у детей связано с избыточной массой тела или ожирением [1–3].
НАЖБП представлена двумя клиническими формами: жировая дистрофия печени (стеатогепатоз), неалкогольный стеатогепатит (НАСГ). Неалкогольный стеатогепатит — это хроническое заболевание печени с гистологическими признаками алкогольного гепатита у лиц, не употребляющих алкоголь в значимых гепатотоксических дозах [2–5].
Согласно современным представлениям выделяют первичную и вторичную НАЖБП. Первичная НАЖБП наиболее часто развивается при наличии сахарного диабета 2-го типа, ожирения и гиперлипидемии, может являться проявлением метаболического синдрома [6].
Причинами вторичного стеатоза печени и НАСГ у детей могут являться [7]:
- лекарственные препараты (глюкокортикоиды, синтетические эстрогены, противоопухолевые, антибактериальные, нестероидные противовоспалительные препараты и др.);
- синдром мальабсорбции вследствие хирургического вмешательства (как последствия наложения илеоеюнального анастомоза, билиарно-панкреатической стомы, расширенной резекции тонкой кишки и др.);
- хронические заболевания желудочно-кишечного тракта, сопровождающиеся синдромом мальабсорбции (хронический панкреатит, неспецифический язвенный колит);
- длительное (более 2 недель) парентеральное питание;
- быстрое снижение массы тела;
- абеталипопротеинемия, липодистрофия конечностей, болезнь Вебера–Крисчена, болезнь Вильсона–Коновалова;
- синдром избыточного бактериального роста.
Надо отметить, что при НАЖБП у детей в 48–100% случаев могут отсутствовать симптомы, характерные для патологии печени. При этом у 20–30% могут наблюдаться неопределенный дискомфорт, тяжесть, ноющие боли в правом подреберье, астенический синдром. Некоторые дети жалуются на отрыжку и изжогу, что чаще всего связано с ожирением. Гепатомегалия может выявляться в 75% случаев.
В крови обычно наблюдается повышение уровня аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ). При этом соотношение АСТ/АЛТ обычно ниже 1, а возрастание данного соотношения наблюдается при развитии фиброза печени. Кроме того, возможно незначительное повышение щелочной фосфатазы (ЩФ) и гаммаглутамилтрансферазы до двух норм, гипербилирубинемия до 1,5–2 норм и дислипидемия. Гипоальбуминемия и удлинение протромбинового времени могут свидетельствовать о развитии цирроза печени [5, 8, 9].
Проведение компьютерной томографии при НАЖБП позволяет выявить снижение рентгеноплотности печени до 3–5 ед (при норме 50–75 ед). При этом рентгеноплотность печени меньше рентгеноплотности селезенки. Визуализация внутрипеченочных сосудов, воротной и нижней полой вен как более плотных структур по сравнению с печеночной тканью. Для очаговой жировой дистрофии характерно пересечение нормальными кровеносными сосудами печени зон пониженной рентгеноконтрастности [8, 9].
К основным гистологическим признакам НАСГ относятся: 1) жировая дистрофия гепатоцитов (крупно- и мелкокапельная); 2) смешанная воспалительная инфильтрация (нейтрофилы, лимфоциты, макрофаги); 3) фиброз (преимущественно перивенулярный); 4) дополнительные (непостоянные) признаки — тельца Мэллори, фокальные центролобулярные некрозы, отложения железа [8, 9]. Прежде чем говорить о НАЖБП, необходимо провести комплексное обследование ребенка [5].
При подтверждении НАЖБП у ребенка важно подобрать эффективный и безопасный метод лечения для предотвращения прогрессирования заболевания и терапии уже имеющихся нарушений.
Основной целью терапии при НАЖБП является предотвращение прогрессирования болезни и развития цирроза. В настоящее время не существует единого стандарта лечения пациентов с НАЖБП. Основные направления терапии: коррекция ожирения и инсулинорезистентности; уменьшение перекисного окисления липидов и окислительного стресса (табл. 1).
Так, например, в России орлистат не разрешен для применения у детей. Метформин, который в зарубежной практике применяется с 10-летнего возраста при метаболическом синдроме и сахарном диабете 2-го типа, не всегда эффективен. Согласно последним исследованиям, 6-месячный курс терапии данным препаратом улучшал метаболический профиль, но не оказывал влияния на гистологическую картину печени [5].
Достаточно эффективным препаратом, который применяется при НАЖБП, тормозит прогрессирование заболевания и обладает антифибротическим действием, является стандартизированный силимарин — Легалон. Легалон — лекарственное средство из растительного сырья. Активная субстанция выделена из плодов и млечного сока расторопши пятнистой (чертополох молочный). Расторопша в течение тысячелетий использовалась как лекарственное средство, и только в 1968 г. в Мюнхенском институте фармацевтики был расшифрован биохимический состав расторопши пятнистой. Главным составляющим компонентом лекарственного растения расторопша являются флавоноиды с гепатопротекторными свойствами: силибинин, силидианин, силикристин (общее название смеси этих соединений — силимарин). Экстракт силимарина водорастворим и плохо всасывается в кишечнике. Для повышения биодоступности активного вещества лекарственного препарата Легалон используется запатентованный процесс совместной преципитации, при котором биодоступность эталонного силимарина повышается до 85% (биодоступность других силимаринов не более 20%). Во всех странах действует международный патент на галеновую форму стандартизированного силимарина, увеличивающую всасывание активного вещества.
Доказано, что эффективность и безопасность силимарина зависит от соотношения флаволигнанов в лекарственном препарате и дозы силибинина. Отличие состава приводит к изменению в фармакинетике и, следовательно, клинической эффективности при лечении заболеваний печени различной этиологии.
Анализ силимаринсодержащих лекарственных препаратов (профиль высокоэффективной жидкостной хроматографии) установил, что по общему содержанию биологически активных веществ (флаволигнанов) первое место занимает Легалон, а последнее — Карсил, который содержит флавонолигнанов в 5 раз меньше, чем Легалон.
В составе препарата Легалон, по сравнению с другими препаратами, более высокое содержание силикристина и силибинина [15].
Силибинин является основным фармакологически активным веществом. Многочисленные экспериментальные и клинические исследования позволили уточнить механизм действия и клиническую эффективность силимарина при острых и хронических заболеваниях печени. В результате установлено, что эталонный силибинин (Легалон) обладает антифибротической, антиоксидантной, антитоксической, цитопротекторной, противовоспалительной, иммуномодулирующей, противоопухолевой активностью (табл. 2) [10, 11].
Легалон рекомендован для лечения токсических и лекарственных поражений печени.
В Западной Европе на острый лекарственный гепатит приходится 15–20% молниеносных гепатитов, в Японии — 10%, в России — 5%. В этиологическом плане на первом месте находятся противотуберкулезные и антибактериальные средства, затем нестероидные противовоспалительные препараты, лекарства, регулирующие функции нервной системы, гормональные, цитостатические, гипотензивные, антиаритмические препараты.
Патологический процесс начинается при действии гепатотоксикантов — стеатоз, некроз, холестаз, фиброз (цирроз). Лекарственное вещество при биотрансформации недостаточно теряет свою токсичность и/или в процессе метаболизма исходно нетоксичного соединения возникают промежуточные или конечные гепатотоксичные метаболиты. Болезнь возникает при передозировке лекарств, дефиците субстратов конъюгации, коферментов и ферментов, необходимых для детоксикации. При этом токсическое вещество может непосредственно воздействовать на структуру гепатоцита (например, токсический метаболит парацетамола — N-ацетил-р-бензохинон) и/или оказывать опосредованное влияние на специфические метаболические реакции (например, торможение синтеза белка при применении цитостатических антибиотиков). Классическим препаратом с облигатным гепатотоксическим действием является парацетамол. С другой стороны, поражение печени может быть вызвано генетически детерминированными особенностями метаболизма или повышенной восприимчивостью организма к лекарственному веществу, который не является гепатотоксикантом. Этот вид патологии не воспроизводится в эксперименте и не носит дозозависимый характер [12].
В зависимости от степени повышения уровней АЛТ и ЩФ острое повреждение печени классифицируют как гепатоцеллюлярное (цитолитическое), холестатическое или смешанное, сочетающее признаки холестаза и цитолиза (табл. 3).
В детском возрасте чаще встречается гепатоцеллюлярный тип повреждения (в 2/3 случаях).
Повышение АЛТ является наиболее чувствительным тестом ранней диагностики лекарственного гепатита. При митохондриальных гепатоцитопатиях может повышаться и активность аспартатаминотрансферазы (АСТ). При коэффициенте де Ритиса (АСТ/АЛТ) меньше 1 повышение трансаминаз трактуется как воспалительный тип ответа, больше 1 — как некротический тип.
Особенностью холестатических форм лекарственного поражения печени является нередкое отсутствие гипертрансаминаземии. При этом развиваются желтуха и зуд кожи, но общее самочувствие, как правило, не страдает.
Обычно для профилактики и лечения лекарственного гепатита применяются гепатопротекторы. Учитывая механизмы действия, Легалон является препаратом выбора при лекарственном гепатите.
В педиатрии используется следующая схема подбора дозы Легалона: стандартизированный силимарин — 5 мг/кг/сут (3 раза в день с едой, водой). Детям до 40 кг — 70 мг/сут (1 капсула Легалона по 70 мг) в сутки; 41–60 кг — 240 мг/сут (2 капсулы Легалона по 70 мг в сут); 61–70 кг — 320 мг/сут (3 капсулы Легалона по 70 мг в сут) [14].
Клиническое наблюдение
В отделении гастроэнтерологии МНИИ педиатрии и детской хирургии наблюдались дети с НАЖБП — 9 детей (6 мальчиков и 3 девочки) в возрасте от 11 до 15 лет. При поступлении у 4 детей (44%) отмечались периодические боли в животе, у 3 (33%) — изжога, у 5 (56%) — отрыжка. Ожирение наблюдалось у 7 детей (78%). При этом средний индекс массы тела (ИМТ) в данной группе детей равнялся 97,5 ± 1,2 перцентиля.
Все дети были тщательно обследованы с целью уточнения характера поражения печени. В результате обследования у 7 детей был выявлен стеатогепатит, у двоих детей наблюдался стеатогепатоз на фоне гиперлипидемии. При этом у всех детей со стеатогепатитом наблюдалось повышение уровня АЛТ в крови (105 ± 19,5 Ед/л) и только у 5 (71%) наблюдалось повышение уровня АСТ (75,2 ± 11,4 Ед/л). У 4 (57%) детей наблюдалось повышение ЩФ и у 1 (14%) — повышение уровня гамма-глютамилтранспептидазы (ГГТП) в пределах 1,5 норм. Уровень общего билирубина был незначительно повышен у 3 детей (43%).
У одного ребенка со стеатогепатозом наблюдалось повышение уровня холестерина в крови, у второго — повышение холестерина и триглицеридов. При ультразвуковом исследовании у всех детей выявлялись признаки стеатоза — дистальное затухание эхосигнала, диффузная гиперэхогенность печени, нечеткость сосудистого рисунка. При этом у 5 (56%) из них была гепатомегалия.
Всем детям была назначена диетотерапия и Легалон в возрастной дозировке от 5 до 10 мг/кг/сут (1–3 капсулы в сут) на 1,5 месяца. В качестве критериев эффективности рассматривалась динамика клинических (улучшение общего состояния, уменьшение диспепсических расстройств, размеров печени), биохимических (нормализация уровней АЛТ, АСТ, ГГТП) и ультразвуковых (уменьшение размеров печени, улучшение эхоструктуры) показателей.
При обследовании пациентов через 1,5 месяца боли в животе сохранялись у 2 детей (22%), изжога — у 1 ребенка (11%), отрыжка — у 2 детей (22%). Масса тела несколько снизилась у 4 детей (57%) с ожирением, у 3 детей (43%) — масса тела не изменилась. При этом средний ИМТ в данной группе детей составил 96,6 ± 1,0 перцентиля. При исследовании биохимических показателей выявлялось достоверное снижение активности сывороточных трансаминаз (АЛТ — 51,1 ± 18,2 Ед/л, АСТ — 43,5 ± 6,6 Ед/л). При этом у 5 детей (56%) уровень АЛТ нормализовался, а у 2 (22%) снизился. Уровень АСТ нормализовался у 3 детей (33%) и у 2 (22%) — снизился. Уровень ГГТП после лечения был нормальным у всех детей. ЩФ снизилась до нормальных показателей у 2 детей, билирубин — у одного ребенка. У остальных детей данные показатели (ЩФ и билирубин) существенно не менялись.
Что касается детей с гиперлипидемией, у одного пациента после лечения нормализовался уровень холестерина, у второго — уровень триглицеридов.
Более того, на фоне лечения Легалоном наблюдалась положительная динамика ультразвуковой картины в виде уменьшения размеров печени у 3 детей из 5 (60%), а у 5 детей из 9 (56%) — выявлялось улучшение ее эхогенности.
Таким образом, Легалон является эффективным гепатопротекторным препаратом, который способствует достоверному уменьшению трансаминаз в крови и улучшению ультразвуковой картины печени у детей с НАЖБП.
В связи с выраженной положительной динамикой терапия, включающая диету и Легалон, была продолжена еще на 3 месяца с назначением последующего контрольного исследования крови и проведения УЗИ брюшной полости.
Также в нашем отделении наблюдались 4 детей с лекарственным гепатитом, трое из них получали длительную противосудорожную терапию и один ребенок получал парацетамол в течение трех дней, затем ему была назначена антибактериальная терапия на 10 дней. На фоне терапии у детей отмечалось бессимптомное повышение трансаминаз в крови. При этом у всех четверых наблюдалось повышение уровня АЛТ в крови (104,3 ± 14,1 Ед/л), у двоих — повышение АСТ (87,5 ± 11,5 Ед/л). Остальные показатели были в норме.
В связи с этим всем детям на фоне основного лечения был назначен Легалон в качестве гепатопротекторного средства в возрастной дозировке 5 мг/кг/сут.
У ребенка, получавшего парацетамол и антибактериальную терапию, повышение трансаминаз (АЛТ и АСТ) было обнаружено на второй день антибактериальной терапии (лекарственный гепатит мог быть связан и с приемом парацетамола, и с приемом антибактериальний терапии), и в тот же день была назначена гепатопротекторная терапия препаратом Легалон. Через 2 недели (через неделю после окончания приема антибиотика) при повторном исследовании биохимического анализа уровень трансаминаз в крови был в норме. Легалон способствовал более быстрому восстановлению функции печени.
Что касается детей, получавших противосудорожную терапию, то через месяц на фоне приема Легалона уровень трансаминаз полностью нормализовался. С профилактической целью данные дети продолжали получать Легалон на фоне противосудорожной терапии и после нормализации показателей.
Таким образом, стандартизированный силимарин (Легалон) является рациональным гепатопротекторным препаратом, который рекомендуют применять детям с различными заболеваниями печени с профилактической и с лечебной целью. Продолжительность терапии зависит от тяжести заболевания и проводится от месяца и более.
Литература
М. Л. Бабаян, кандидат медицинских наук
А. И. Хавкин, доктор медицинских наук, профессор
Вирусный гепатит А (ГА) традиционно считался преимущественно детским, легким, доброкачественным, самолимитирующим заболеванием и потому не привлекал особого внимания ни клиницистов, ни ученых.
ГА — одно из самых распространенных на земле заболеваний человека, в мире ежегодно регистрируется около 1,4 млн случаев [5]. И в России до настоящего времени заболеваемость ГА остается высокой; в общей структуре острых вирусных гепатитов на его долю приходится более 50%. По экономическим затратам ГА занимает в России 5?е место среди всех регистрируемых инфекций. Неудивительно, что ГА в последние годы привлек внимание как практикующих врачей различных специальностей (инфекционистов, педиатров, гастроэнтерологов, терапевтов), так и представителей медицинской науки. В июне 2010 г. в Москве состоялась Всероссийская научно-практическая конференция, на которой были обобщены современные аспекты эпидемиологии, клиники, специфической лабораторной диагностики и профилактики гепатита А [1].
Возбудитель гепатита А — вирус (ВГА, Hepatitis A virus, HAV), впервые идентифицирован Файнстоуном с соавторами в 1973 г.; является гепатотропным, обладает слабым цитопатогенным действием на печеночные клетки. ВГА относится к числу наиболее устойчивых к факторам внешней среды вирусов человека, способен длительно сохраняться в воде, пищевых продуктах, сточных водах, на различных объектах внешней среды [2, 6].
Эпидемиология. ГА — классический антропоноз, единственным источником (резервуаром) возбудителя инфекции является человек. Вирус выделяется больными с различными формами заболевания, в том числе наиболее частыми (особенно у детей): безжелтушной и стертой, которые обычно не диагностируются, соответственно, заболевшие этими формами не госпитализируются, ведут активный образ жизни и могут заражать окружающих. От больных желтушной формой вирус выделяется с фекалиями наиболее интенсивно в конце инкубационного и в течение преджелтушного периодов, т. е. тоже еще до распознавания ГА. С появлением желтухи в большинстве случаев заразительность больных значительно уменьшается. Именно эта особенность — наиболее активное выделение вируса из организма больного до появления желтухи в сочетании с высокой устойчивостью ВГА во внешней среде обуславливает широкое распространение гепатита А. Вирус ГА обладает высокой инфекционностью, для заражения гепатитом А достаточно всего нескольких вирусных частиц [7–9].
ГА — типичная кишечная инфекция с фекально-оральным механизмом передачи возбудителя. Пути передачи: водный, пищевой и бытовой. Факторами передачи, как при всех кишечных инфекциях, являются различные пищевые продукты (в том числе морепродукты, замороженные овощи и фрукты), не подвергающиеся термической обработке, а также вода и грязные руки. Крупные вспышки ГА связаны с загрязнением фекалиями водоемов, являющихся источником водоснабжения, или с попаданием сточных вод в водопроводную сеть. В детских коллективах большое значение имеет контактно-бытовой путь передачи через грязные руки и различные предметы обихода: игрушки, посуду, белье и т. д. Водные и пищевые вспышки неоднократно регистрировались в России (в том числе в Москве, Санкт-Петербурге, Нижнем Новгороде, Тверской обл.) в 2005–2010 гг. [1].
Восприимчивость людей к гепатиту А всеобщая. В регионах с широким распространением вируса ГА (страны Африки, Юго-Восточной Азии, Латинской Америки) большинство случаев инфицирования приходится на детей раннего возраста [8, 11].
В развитых странах первая встреча с вирусом ГА может произойти в подростковом возрасте и позже. Особенно велик риск заражения при выезде в жаркие страны (туризм, путешествия) с дефицитом воды, плохой системой канализации и водоснабжения и низким уровнем гигиены местного населения. Не случайно ГА называют болезнью путешественников. Развитие массового туризма, посещение регионов мира, эндемичных по ГА, представляют повышенный риск инфицирования для россиян. Массовая миграция также способствует активной циркуляции ВГА на территории России.
В России прежде ГА был преимущественно детской инфекцией, но в последние годы вследствие ряда причин (снижение рождаемости, уменьшение числа детей, посещающих детские дошкольные учреждения, и др.) заболеваемость ГА сместилась на более старшие возрастные группы.
Иммунитет после перенесенного гепатита А прочный и длительный, практически пожизненный.
Клиника. Продолжительность инкубационного периода колеблется от 7 до 50 дней, составляя в среднем около одного месяца.
Клиническая классификация ГА предусматривает выделение нескольких вариантов: желтушного, безжелтушного, стертого и субклинического (инаппарантного).
В конце преджелтушного периода, продолжительность которого чаще всего от трех до семи дней (с колебаниями от двух до 14) моча становится темно-желтой, а кал — осветленным. Однако эти очень важные для своевременной диагностики гепатита А симптомы не всегда замечаются больными.
У детей уже в преджелтушном периоде может быть выявлено увеличение печени.
В сыворотке крови заболевших ГА в преджелтушном периоде значительно (в 10 и более раз) повышается активность аминотрансфераз — АЛТ и АСТ, а в моче увеличивается содержание уробилина. Через 3–5 дней от дебюта болезни температура тела обычно нормализуется, но появляется иктеричность — вначале склер, затем кожи. Начинается желтушный период. Впрочем, в 2–5% случаев описанные выше симптомы преджелтушного периода не выявляются, и тогда ГА начинается с изменения окраски испражнений и желтушного окрашивания склер.
Обычно с появлением желтухи самочувствие больных довольно быстро начинает улучшаться, нормализуется температура тела, исчезают симптомы преджелтушного периода. Дольше остальных сохраняются слабость и снижение аппетита. В последние годы нередко у больных ГА на фоне появившейся желтухи продолжается лихорадка и нарастают симптомы интоксикации; обычно это бывает у пациентов с хронической алкогольной интоксикацией или наркотической зависимостью.
Желтуха при ГА нарастает быстро, достигая максимума обычно за 3–5 дней, в последующие 5–10 дней держится на одном уровне, а затем интенсивность ее уменьшается. В среднем продолжительность желтушного периода около двух недель. При осмотре выявляется увеличение печени, которая уплотнена, с закругленным краем, чувствительна при пальпации; увеличение селезенки отмечается в 10–15% случаев, у детей чаще. На высоте желтухи характерна брадикардия.
По мере уменьшения интенсивности желтухи нормализуется окраска кала и мочи, постепенно уменьшаются размеры печени.
В желтушном периоде сохраняется выраженная гиперферментемия с преимущественным повышением активности АЛТ по сравнению с АСТ (соответственно коэффициент де Ритиса всегда менее 1). Гипербилирубинемия обычно умеренная и непродолжительная, обусловлена преимущественно связанной фракцией билирубина. Характерно значительное повышение показателя тимоловой пробы.
В гемограмме отмечаются нормоцитоз или лейкопения, относительный лимфоцитоз; СОЭ нормальная.
Период реконвалесценции характеризуется обычно достаточно быстрым исчезновением клинических и биохимических признаков вирусного гепатита, в частности гипербилирубинемии. Позднее нормализуются показатели активности АЛТ и АСТ; повышение тимоловой пробы может сохраняться долго, в течение нескольких месяцев. Самочувствие переболевших ГА, как правило, бывает удовлетворительным, возможны утомляемость после физической нагрузки, неприятные ощущения в животе после еды, иногда сохраняется незначительное увеличение печени. Продолжительность этого периода в большинстве случаев не превышает трех месяцев.
В некоторых случаях период реконвалесценции может затягиваться до 6–8 и более месяцев, возможны обострения (ферментативные или клинические), а также (в 3–20%) рецидивы. Последние возникают обычно у лиц 20–40 лет через 1–3 месяца после основной волны и протекают, как правило, легче, чем первая волна заболевания. Впрочем, описаны рецидивы с острой почечной недостаточностью, а также с летальным исходом.
Описанный выше желтушный вариант ГА чаще всего протекает в легкой или среднетяжелой формах. Тяжелая форма ГА встречается не более чем у 1% больных, преимущественно у лиц старше 40 лет, у пациентов с хронической алкогольной интоксикацией или наркотической зависимостью, хроническими вирусными гепатитами иной этиологии (В, D, С). Среди детей тяжелая форма ГА регистрируется в период полового созревания, а также на фоне ожирения и отягощенного аллергологического анамнеза.
Фульминантная форма ГА с развитием острой печеночной недостаточности, энцефалопатией встречается редко, в 0,1–1% всех случаев.
Иногда, особенно у лиц старших возрастных групп, ГА сопровождается выраженным холестатическим компонентом, при этом желтушный период удлиняется до нескольких месяцев, интенсивность желтухи велика, болезнь сопровождается зудом кожи, в сыворотке крови значительно повышается активность щелочной фосфатазы [3, 6].
Синдром холестаза характерен и для ГА с аутоиммунным компонентом, сочетаясь в этом случае с другими системными иммунными нарушениями, как то васкулит, нефрит, полиартралгия, пурпура, острая гемолитическая анемия, лихорадка и др. В сыворотке крови появляются криоглобулины и ревматоидный фактор, повышены показатели ЦИК, гамма-глобулиновой фракции белкового спектра, могут выявляться аутоантитела (в частности, к гладкой мускулатуре).
Безжелтушный вариант характеризуется теми же клиническими и лабораторными признаками, что и желтушный, однако отсутствие одного из самых заметных проявлений гепатита — желтухи и соответственно гипербилирубинемии затрудняет диагностику. Клиническая симптоматика безжелтушного варианта соответствует проявлениям преджелтушного периода классического желтушного варианта. Возможны кратковременное повышение температуры тела, диспепсические явления, слабость, катаральный синдром и др. в течение 3–5 дней. Увеличивается и становится слегка болезненной при пальпации печень, может быть потемнение мочи. Выявляется гиперферментемия, показатели АЛТ и АСТ повышаются почти так же существенно, как и при желтушной форме, увеличивается показатель тимолового теста.
Безжелтушный вариант развивается в десятки раз чаще, чем желтушный, однако регистрируется редко, обычно только при целенаправленном обследовании детских коллективов и в эпидемических очагах ГА. Чем младше ребенок, тем больше вероятность именно безжелтушного варианта ГА; у подростков и взрослых преобладает желтушный.
Стертый вариант проявляется минимальными и быстро проходящими клиническими симптомами (в том числе желтухой) в сочетании с гиперферментемией и повышенной тимоловой пробой.
При субклиническом (инаппарантном) варианте, в отличие от безжелтушного и стертого, самочувствие заболевших не нарушается, печень не увеличивается, желтуха не появляется, но показатели активности АЛТ и АСТ повышены, в сыворотке крови определяются специфические маркеры ГА.
В последние годы в России наблюдался рост заболеваемости не только гепатитом А, но и вирусными гепатитами другой этиологии (прежде всего В и С), а также ВИЧ-инфекцией. Следствием является учащение случаев гепатитов смешанной этиологии, отличающихся по течению и исходом от моноинфекции, вызванной ВГА. В частности, в одной из первых работ, посвященных особенностям ГА у лиц с вирусным гепатитом С (ВГС-инфекцией), отмечено: волнообразная гиперферментемия у реконвалесцентов ГА с ВГС наблюдается в 68% случаев в течение 6 месяцев и в 41% — до года. С другой стороны, при ко-инфекции ВГА и ВГС выявлено конкурирующее взаимодействие вирусов, что приводит к временному подавлению репликации ВГС.
ГА и хроническая алкогольная интоксикация оказывают взаимоотягощающее влияние. При таком сочетании лихорадка может продолжаться более двух недель на фоне желтухи, нередко сочетание клинических признаков ГА и алкогольного абстинентного синдрома вплоть до метаалкогольного психоза; часто развивается декомпенсация алкогольной болезни печени, возможен летальный исход, что подтверждают наши наблюдения.
Летальный исход от ГА представляет исключительную редкость, тем не менее возможен у лиц старших возрастных групп и пациентов с предшествующими заболеваниями печени (алкогольной болезнью печени, хроническими гепатитами различной этиологии). Причиной смерти может быть отек мозга у больных с острой печеночной недостаточностью.
Таким образом, основными особенностями современного гепатита А являются:
- увеличение среди заболевших удельного веса взрослых, в том числе старших возрастных групп;
- частое сочетание с хронической алкогольной интоксикацией, хроническими гепатитами В и С, ВИЧ-инфекцией;
- наличие холестатического синдрома и аутоиммунного компонента;
- более частое развитие среднетяжелой, тяжелой и фульминантной форм;
- склонность к затяжному течению с обострениями и рецидивами.
Диагностика. Диагноз гепатита А устанавливают с учетом клинических, эпидемиологических и лабораторных данных. Основанием для предположения о ГА являются:
- острое начало болезни с высокой температурой тела, диспепсическими и астеновегетативными явлениями;
- короткий преджелтушный период;
- увеличение печени;
- улучшение самочувствия, нормализация температуры при появлении желтухи;
- гиперферментемия (АЛТ, АСТ) с коэффициентом де Ритиса менее 1;
- гипербилирубинемия (преимущественно за счет связанной фракции);
- высокий показатель тимоловой пробы;
- указание на контакт с больным(и) желтухой за 7–50 дней до заболевания или употребление сырой воды из случайных источников, немытых овощей и фруктов и т. д.; случаи ГА в коллективе, местности, где находился пациент в соответствующие инкубационному периоду сроки, выезд в страны Африки, Азии, Латинской Америки.
В последние годы появилась возможность тестирования РНК ВГА с помощью молекулярно-генетических методов (полимеразная цепная реакция (ПЦР)). РНК ВГА в сыворотке крови может быть выявлена за несколько дней до повышения активности АЛТ, то есть ПЦР — высокоспецифический ранний метод диагностики ГА, но на практике пока используется редко.
Лечение. Больные гепатитом А, протекающим в легкой форме, могут лечиться на дому; остальные подлежат госпитализации и лечению в инфекционных больницах или отделениях. Этиотропная терапия не разработана, противовирусные препараты не используются [4].
При легкой форме ограничиваются базисной терапией, которая включает в себя соответствующую диету и щадящий режим. Из рациона исключают жареные, копченые, маринованные блюда, тугоплавкие жиры (свинина, баранина). Категорически запрещается алкоголь в любых видах. Рекомендуется обильное питье (до 2–3 литров в сутки) некрепко заваренного чая с молоком, медом, вареньем, а также отвара шиповника, свежеприготовленных фруктовых и ягодных соков, компотов, щелочных минеральных вод.
Больным среднетяжелой формой ГА с целью дезинтоксикации назначают энтеросорбенты (Энтеродез, Энтеросгель и др.), а при тошноте, отказе от питья внутривенно капельно 5% раствор глюкозы, раствор Рингера и др.; при тяжелой форме проводится интенсивная патогенетическая терапия, включая плазмаферез. В случаях с выраженным холестатичесим синдромом рекомендуются жирорастворимые витамины А и Е, энтеросорбенты, препараты урсодезоксихолиевой кислоты.
Пациентам ГА с хронической алкогольной интоксикацией показан адеметионин в первые две недели внутривенно по 800–1600 мг ежедневно, затем по 2–4 таблетки в день.
Потребность в витаминах должна обеспечиваться за счет натуральных пищевых продуктов. Если это невозможно, дополнительно назначаются поливитаминные препараты (Аевит, Аскорутин, Ундевит и др.) 3 раза в день после еды. Необходимо следить за ежедневным опорожнением кишечника. При запорах следует использовать лактулозу, дозу которой подбирают индивидуально (30–60 мл/сутки) таким образом, чтобы стул был ежедневно, оформленный или кашицеобразный.
Все реконвалесценты ГА должны находиться на диспансерном наблюдении в течение 3–6 месяцев в зависимости от их самочувствия, быстроты нормализации размеров печени и динамики результатов биохимических исследований. При отсутствии у реконвалесцентов каких-либо клинических и лабораторных отклонений от нормальных показателей они могут быть сняты с учета с рекомендацией освобождения от тяжелой физической работы и занятий спортом. В течение шести месяцев противопоказаны профилактические прививки, кроме (при наличии показаний) противостолбнячного анатоксина и антирабической вакцины. Нежелательно проведение плановых операций, противопоказано назначение гепатотоксичных медикаментов в течение полугода после перенесенного ГА.
При возобновлении у реконвалесцента ГА желтухи и гиперферментемии (АЛТ, АСТ) необходима повторная госпитализация для разграничения возможного рецидива ГА от манифестации гепатита иной этиологии (в т. ч. аутоиммунного). Реконвалесцентам со стойким умеренным повышением активности АЛТ и АСТ целесообразно назначение одного из гепатопротекторов: Фосфоглива по 1 капсуле 3 раза/сутки, силибинина (Карсила), Эссенциале Н по 1–2 капсуле 3 раза/сутки, адеметионина по 2–4 таблетки/сутки, урсодезоксихолиевой кислоты по 15 мг/кг/сутки.
Прогноз при ГА благоприятный. В подавляющем большинстве случаев наступает полное выздоровление в течение одного-трех месяцев после выписки из стационара. Среди других исходов ГА возможны остаточные явления в виде затянувшейся реконвалесценции (на протяжении 3–6 месяцев сохраняются астенический синдром, функциональные расстройства желудочно-кишечного тракта, небольшое повышение активности аминотрансфераз и/или тимоловой пробы). В некоторых случаях в периоде реконвалесценции ГА впервые проявляется синдром Жильбера. Кроме того, после перенесенного ГА могут выявиться дискинезия или воспаление желчевыводящих путей.
В любом случае гепатит А, протекающий в виде моноинфекции, заканчивается полным выздоровлением, формирование хронического гепатита не происходит.
Профилактика ГА, как и других кишечных инфекций, включает санитарно-гигиенические мероприятия (в т. ч. соблюдение личной гигиены, регулярное мытье рук, употребление только кипяченой воды), обеспечение населения доброкачественными питьевой водой и продуктами питания, надлежащая утилизация сточных вод. Ранняя диагностика ГА и изоляция заболевших еще до появления у них желтухи может предотвратить заражение окружающих.
Специфическая профилактика осуществляется инактивированными вакцинами, как отечественными, так и зарубежными. В России в Национальный календарь профилактических прививок вакцинация против ГА включена по эпидемическим показаниям. Прививкам подлежат: дети с трех лет, проживающие на территориях с высоким уровнем заболеваемости гепатитом А; медицинские работники, воспитатели и персонал детских дошкольных учреждений; работники сферы общественного питания; рабочие, обслуживающие водопроводные и канализационные сооружения; лица, выезжающие в гиперэндемичные по ГА регионы и страны, а также контактные в очаге гепатита А. Вакцинируются и воинские контингенты, дислоцированные в полевых условиях [1].
Вакцинация против гепатита А показана также пациентам с хроническими заболеваниями печени, в том числе бессимптомным носителям австралийского антигена (НВsAg), больным хроническими гепатитами В и С. Высокая эпидемиологическая и экономическая эффективность вакцинопрофилактики определяют ее в настоящее время как наиболее эффективное средство контроля за вирусным гепатитом А.
Литература
Г. Н. Кареткина, кандидат медицинских наук, доцент
МГМСУ, Москва
Что такое синдром Жильбера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Синдром Жильбера — это генетический пигментный гепатоз с аутосомно-доминантным типом наследования, протекающий с повышением уровня неконъюгированного (свободного) билирубина, чаще проявляющееся в период полового созревания и характеризующийся доброкачественным течением [1] .
Краткое содержание статьи — в видео:
Синонимы названия болезни: простая семейная холемия, конституциональная или идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха.
По распространённости данное заболевание встречается не менее, чем у 5 % населения, в соотношении мужчин и женщин — 4:1. Впервые заболевание описал французский терапевт Августин Жильбер в 1901 году.
Чаще синдром Жильбера проявляется в период полового созревания и характеризуется доброкачественным течением. Основным проявлением этого синдрома является желтуха.
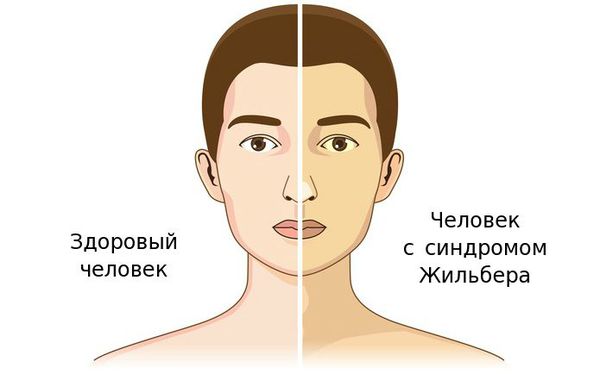
К провоцирующим факторам проявления синдрома можно отнести:
- голодание или переедание;
- жирную пищу;
- некоторые лекарственные средства;
- алкоголь;
- инфекции (грипп, ОРЗ, вирусный гепатит);
- физические и психические перегрузки;
- травмы и оперативные вмешательства.
Причина заболевания — генетический дефект фермента УДФГТ1*1, который возникает в результате его мутации. В связи с этим дефектом функциональная активность данного фермента снижается, а внутриклеточный транспорт билирубина в клетках печени к месту соединения свободного (несвязанного) билирубина с глюкуроновой кислотой нарушается. Это и приводит к увеличению свободного билирубина.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Жильбера
Некоторые специалисты трактуют синдром Жильбера не как болезнь, а как физиологическую особенность организма.
До периода полового созревания данный синдром может протекать бессимптомно. Позже (после 11 лет) возникает характерная триада признаков:
- желтуха различной степени выраженности;
- ксантелазмы век (жёлтые папулы);
- периодичность появления симптомов [1] .
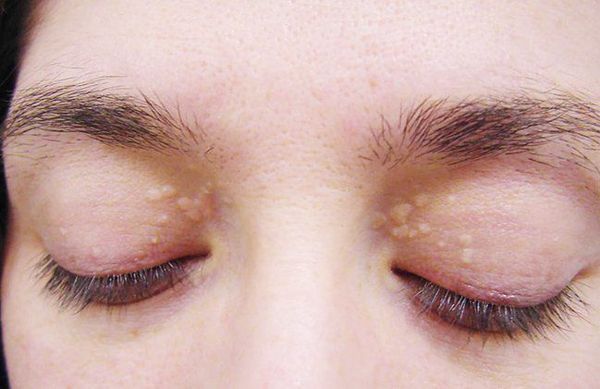
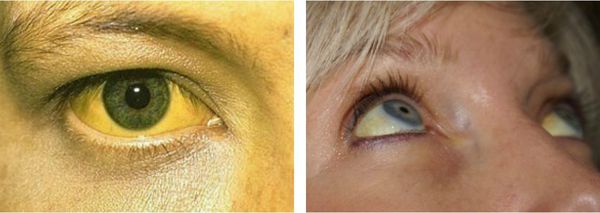
Желтуха чаще всего проявляется иктеричностью (желтушностью) склер, матовой желтушностью кожных покровов (особенно лица), иногда частичным поражением стоп, ладоней, подмышечных впадин и носогубного треугольника.
Заболевание нередко сочетается с генерализованной дисплазией (неправильным развитием) соединительной ткани.
Усиление желтухи может наблюдаться после перенесения инфекций, эмоциональной и физической нагрузки, приёма ряда лекарственных препаратов (в частности, антибиотиков), голодания и рвоты.
Клиническими проявлениями заболевания общего характера могут быть:
- слабость;
- недомогание;
- подавленность;
- плохой сон;
- снижение концентрации внимания.
В отношении ЖКТ синдром Жильбера проявляется снижением аппетита, изменением привкуса во рту (горечь, металлический привкус), реже возникает отрыжка, тяжесть в области правого подреберья, иногда наблюдается боль ноющего характера и плохая переносимость лекарственных препаратов.
При ухудшении течения синдрома Жильбера и существенном повышении токсичной (свободной) фракции билирубина может появляться скрытый гемолиз, усиливая при этом гипербилирубинемию и добавляя в клиническую картину системный зуд.
Патогенез синдрома Жильбера
В норме свободный билирубин появляется в крови преимущественно (в 80-85 % случаев) при разрушении эритроцитов, в частности комплекса ГЕМ, входящего в структуру гемоглобина. Это происходит в клетках макрофагической системы, особенно активно в селезёнке и купферовских клетках печени. Остальная часть билирубина образуется из разрушения других гемсодержащих белков (к примеру, цитохрома P-450).
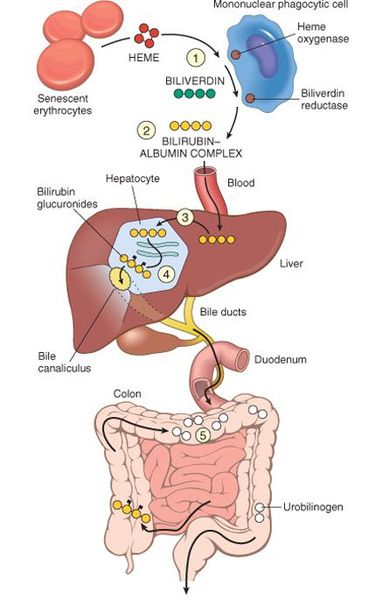
У взрослого человека в сутки образуется приблизительно от 200 мг до 350 мг свободного билирубина. Такой билирубин слаборастворим в воде, но при этом хорошо растворяется в жирах, поэтому он может взаимодействовать с фосфолипидами ("жирами") клеточных мембран, особенно головного мозга, чем можно объяснить его высокую токсичность, в частности токсичное влияние на нервную систему.
Первично после разрушения комплекса ГЕМ в плазме билирубин появляется в неконъюгированной (свободной или несвязанной) форме и транспортируется с кровью при помощи белков альбуминов. Свободный билирубин не может проникнуть через почечный барьер за счёт сцепления с белком альбумином, поэтому сохраняется в крови.
В печени несвязанный билирубин переходит на поверхность гепатоцитов. С целью снижения токсичности и выведения в клетках печени свободного билирубина при помощи фермента УДФГТ1*1 он связывается с глюкуроновой кислотой и превращается в конъюгированный (прямой или связанный) билирубин. Конъюгированный билирубин хорошо растворим в воде, он является менее токсичным для организма и в дальнейшем легко выводится через кишечник с желчью.
При синдроме Жильбера связывание свободного билирубина с глюкуроновой кислотой снижается до 30% от нормы, тогда как концентрация прямого билирубина в желчи увеличивается.
В основе синдрома Жильбера лежит генетический дефект — наличие на промонторном участке A(TA)6TAA гена, кодирующего фермент УДФГТ1*1, дополнительного динуклеотида ТА. Это становится причиной образования дефектного участка А(ТА)7ТАА. Удлинение промонторной последовательности нарушает связывание фактора транскрипции IID, в связи с чем уменьшается количество и качество синтезируемого фермента УДФГТ1, который участвует в процессе связывания свободного билирубина с глюкуроновой кислотой, преобразуя токсичный свободный билирубин в нетоксичный связанный.
Вторым механизмом развития синдрома Жильбера является нарушение захвата билирубина микросомами сосудистого полюса клетки печени и его транспорта глутатион-S-трансферазой, которая доставляет свободный билирубин к микросомам клеток печени.
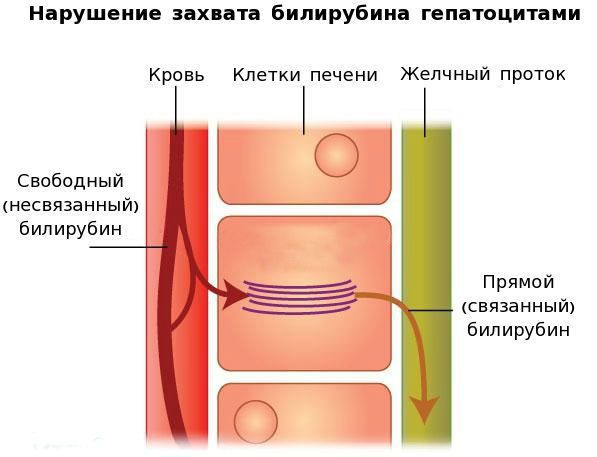
В конечном итоге вышеперечисленные патологические процессы приводят к увеличению содержания свободного (несвязанного) билирубина в плазме, что обуславливает клинические проявления заболевания [6] .
Классификация и стадии развития синдрома Жильбера
Общепринятой классификации синдрома Жильбера не существует, однако условно можно разделить генотипы синдрома по полиморфизму.
Читайте также:

