Гепатит с лекция для школьников
Обновлено: 18.04.2024
Гепатит С (ГС) – вирусный гепатит с парентеральным механизмом передачи. Характеризуется наклонностью к хронизации процесса, обусловленной способностью возбудителя перманентно изменять свою антигенную структуру.
Историческая справка. Вопрос о существовании посттрансфузионного вирусного гепатита, не связанного с гепатитом В, возник в 70-е годы. В то время стал проводиться тщательный контроль препаратов крови на маркеры ГВ, и это привело к его резкому сокращению. В то же время врачи стали регистрировать значительное число случаев посттрансфузионного гепатита другой, неизвестной этиологии. Детальный анализ ряда случаев посттрансфузионного гепатита, при которых не удавалось обнаружить маркеры HBV, позволил установить клинические и эпидемиологические особенности болезни, на основании которых, в свою очередь, стало возможным постулировать существование другой нозологической формы посттрансфузионного гепатита, названного гепатитом ни А ни В.
До последнего времени диагностика парентерального гепатита ни А ни В была основана на исключении маркеров известных гепатитов, особенностях клинической картины и эпидемиологии. Значительный прогресс в изучении гепатита ни А ни В был достигнут в 1989 г., когда появилась коммерческая тест-система для выявления анти-НСV-антител к вирусу гепатита С - так стали называть вирус парентерального гепатита ни А ни В. Эта тест-система стала широко использоваться во многих лабораториях мира для анализа крови доноров, больных хроническим гепатитом, а также пациентов с циррозом и первичным раком печени.
Накопленные к настоящему времени данные свидетельствуют о том, что ГС распространен в мире достаточно широко. При обследовании здорового населения наиболее часто анти-HCV выявлялись в Японии (1%) и странах Южной Европы: в Бельгии, Франции, Италии, Испании (0,9-1%). В Центральной и Северной Европе (Швейцария, Германия, Дания, Скандинавия, Англия) анти-HCV обнаруживается реже -у 0,23-0,48% здоровых лиц, приблизительно с такой же частотой, как в Канаде (0,39%) и США (0,6%). К неблагополучным по степени распространенности ГС регионам следует отнести страны Африки.
Частота выявления анти-HCV коррелирует с распространением на изучаемых территориях других парентеральных гепатитов, в частности ГВ. Наиболее широко HCV-инфекция распространена в странах Средней Азии: в Туркмении анти-HCV выявлены у 5,3%, в Таджикистане – у 3,9%, в Киргизии – у 9,2% здорового населения. Кроме того, достаточно широко ГС встречается в восточных регионах России: анти-HCV выявлены в Туве у 3%, а в Якутии – у 2,5% обследованных доноров. В Москве антитела к HCV обнаружены у 1,3%, в Сумах – у 3,1% здоровых лиц.
2. Этиология
HCV представляет собой мелкий вирус с однонитчатой линейной РНК. Вопрос о таксономической принадлежности его к тому или иному вирусному семейству в настоящее время нельзя считать окончательно решенным. Морфология вирусной частицы не изучена, так как до настоящего времени не получен препарат вируса.
Данные о размере и морфологии вириона гепатита С весьма неоднозначны, тем не менее определены некоторые физико-химические характеристики вируса. Так, диаметр HCV составляет 30-60 нм (по данным фильтрования через миллипоры).
Сегодня можно говорить лишь о части свойств HCV, по которым обычно классифицируют вирусы.
Опубликованы сведения о последовательности нескольких штаммов HCV, выделенных от различных вирусоносителей и экспериментально зараженных животных, и появилась возможность сравнить первичные структуры различных штаммов. Оказалось, что геном HCV значительно различается от штамма к штамму. По европейской классификации выделяют 1а, 1в, 1с, 2а, 2в, 2с, За, Зв, 4а, 5а, 6а варианты генома HCV. Возможно, генотип вируса определяет тяжесть заболевания и чувствительность к интерферонотерапии. Отличительной особенностью HCV является способность к длительной персистенции в организме, что обусловливает высокий уровень хронизации.
3. Эпидемиология
Источником возбудителя является человек, больной острым или хроническим ГС. Восприимчивость к данной инфекции различных людей неодинакова и в большой степени определяется инфицирующей дозой. Пути передачи разнообразны. ГС был выделен из группы поспрансфузионного гепатита ни А ни В, поэтому при данном заболевании следует ожидать те же пути и механизмы передачи, что и при других парентеральных гепатитах: с кровью и продуктами крови, инъекционный, половой, внутрисемейный. Группу риска представляют больные, имеющие гемотрансфузии в анамнезе, больные гемофилией, длительно получающие препараты крови (факторы VIII и IX), пациенты гемодиализных центров, медицинские работники, а также наркоманы, использующие парентеральный путь введения наркотиков, и лица, имеющие сексуальные контакты со многими партнерами. Инфицированность HCV наркоманов достигает 75-83%. Трансфузии крови и ее компонентов являются причиной развития 80-90% случаев посттранс-фузионного ГС, в 1% случаев заражение происходит при гемодиализе и трансплантации органов. Благодаря низкому уровню виремии непарентеральные механизмы передачи возбудителя (половой, бытовой) составляют 10%, профессиональный - 2-6%. Вертикальный путь передачи играет незначительную роль. В 40-50% спорадических случаев выявить путь заражения не удается.
4. Патогенез
Патогенез ГС изучен недостаточно, что обусловлено в первую очередь отсутствием в настоящее время выделенного вируса, а также сравнительно недавней идентификацией этого гепатита.
Развитие гепатита происходит после проникновения HCV в гепатоцит и начала его репликации. До последнего времени единственной возможностью изучения особенностей размножения HCV являлось заражение экспериментальных животных. Для изучения ранних событий, происходящих при инфицировании HCV, двум шимпанзе внутривенно вводили 0,5 мл неразведенной плазмы от больного острым вирусным гепатитом ни А ни В. Эксперимент показал, что репликация HCV начинается в первые дни после инфицирования. Появление обнаруживаемых количеств вирусной РНК зафиксировано на 3-4-й день после инфицирования, точное время пика репликации вируса неизвестно. Повышение активности АлАТ и АсАТ также наблюдали сравнительно рано - на 1-3-й неделе после заражения, причем как у экспериментально зараженных животных, так и при естественном течении инфекции у людей. Пик повышения активности ферментов совпадал по времени с максимальным синтезом РНК HCV.
В патогенезе поражения органов при ГС имеют значение прямое цитопатическое действие вируса и вызванные им иммунологические реакции, репликация вируса вне печени (например, в лейкоцитах). Репликация вируса в иммунокомпетентных клетках нарушает их функции.
Многие исследователи считают, что HCV-инфекция способна индуцировать аутоиммунные процессы в организме. В частности, предполагают, что развитие таких аутоиммунных заболеваний, как синдром Сьегрена, криоглобулинемия, красный плоский лишай, кожная порфи-рия, связаны с HCV-инфекцией. Возможно, что и в развитии ГС, особенно его хронических форм, определенная роль принадлежит аутоиммунным механизмам.
Особенностью HCV является способность ускользать из-под иммунного надзора вследствие перманентного изменения антигенной структуры и наличия в организме больного одновременно множества антигенных вариантов его. Данная особенность с успехом заменяет HCV-выживаемость путем интеграции с геномом гепатоцита, свойственную HBV и невозможную для HCV.
5. Патологическая картина
Патогаомоничных для HCV признаков поражения печени не описано. При развитии хронической инфекции, проведя гистологическое исследование биоптата печени, можно наблюдать весьма широкий спектр морфологических изменений. Преимущественно регистрируется хронический активный гепатит (ХАГ). На начальных этапах формирующегося хронического гепатита дистрофические и фиброзирующие процессы минимальны. Характерны лимфоидно-клеточная пролиферация портальных трактов, поражение желчных канальцев, эпителий которых также инфильтрируется лимфоцитами. По мере длительности течения хронического гепатита начинают преобладать процессы фиброгенеза.
6. Клиническая картина
При ГС инкубационный период ГС составляет в среднем 6-8 нед, однако в ряде случаев он может быть от 2 до 26 нед. Заболевание, как правило, начинается постепенно. У 20% больных преджелтушный период отсутствует, и первым проявлением болезни является желтуха.
Клинические симптомы острого ГС (ОГС) принципиально не отличаются от таковых при других парентеральных гепатитах. Основными симптомами преджелтушного периода являются слабость и снижение аппетита (вплоть до анорексии). Они отмечаются чаще других. Кроме того, часто больные жалуются на дискомфорт в эпигастралыгой области и правом подреберье. Реже появляются такие симптомы, как кожный зуд, боль в суставах, головная боль, головокружение, расстройства стула, повышение температуры тела.
Желтушный период при ОГС протекает значительно легче, чем при других парентеральных гепатитах. После появления желтухи самочувствие больных, как правило, не улучшается. Ведущими симптомами являются слабость, снижение аппетита и тяжесть в животе. Тошнота и кожный зуд встречаются у трети больных, головокружение и головная боль - у каждого 5-го, рвота - у каждого 10-го больного. Практически у всех больных увеличена печень, у 20% больных – селезенка.
Для ОГС характерны такие же изменения биохимических показателей, как при других парентеральных гепатитах. Особенностью является волнообразный характер гиперферментемии, выявляемый почти у половины больных в первые 60 дней от начала желтухи. Как правило, это не сопровождается ухудшением самочувствия. В большинстве случаев уровень билирубина нормализуется к 30-му дню после появления желтухи. Другие биохимические показатели (осадочные пробы, уровень общего белка и белковых фракций, протромбина, холестерина, щелочной фосфатазы) обычно остаются в пределах нормы. Часто регистрируется увеличение содержания гамма-глутамилтранспептидазы.
В периферической крови не отмечается каких-либо отклонений от нормы.
ОГС протекает преимущественно в среднетяжелой форме, примерно у 33% больных - легко. Однако описаны случаи фульминантного гепатита С с летальным исходом.
Для ОГС характерен высокий удельный вес безжелтушных форм (83%), протекающих без клинических проявлений. Однако, несмотря на кажущуюся легкость течения, прогноз при ОГС серьезный, поскольку исходом заболевания часто является развитие хронического гепатита: у 80% больных при безжелтушной форме и у 42% больных при желтушной форме. По мнению некоторых исследователей, хронический гепатит (ХГС) формируется у 100%, перенесших ОГС. Очень часто ХГС протекает бессимптомно, хотя, при морфологическом исследовании биоптатов печени больных ХГС, более чем в 2/3 случаев диагностируется ХАГ. Японскими исследователями показано, что в большинстве случаев по данным пункционной биопсии печени ХАГ обнаруживают даже у пациентов, длительно наблюдающихся как "здоровые носители", у которых определяется РНК HCV при нормальном уровне АлАТ в сыворотке крови. По данным литературы, ХГС в 20% случаев приводит к развитию цирроза печени.
Особенностью формирования ХГС является наличие у абсолютного большинства пациентов феномена мнимого выздоровления, который мрактеризуется нормализацией клинико-биохимических показателей вслед за острым периодом и последующим появлением гиперферментемии в различные сроки от начала болезни. Длительность такого мнимого выздоровления может быть различной - от нескольких недель до нескольких месяцев. При обследовании в этот период пациенты могут быть признаны как выздоровевшими. В связи с этим понятной необходимость длительного и регулярного наблюдения данной категории больных.
До настоящего времени считалась доказанной роль HBV в возникновении первичного рака печени (ПРП). Данные об обнаружении генома HCV в опухолевых клетках является убедительным свидетельством Того, что и HCV играет определенную роль в возникновении ПРП. Вероятность развития ПРП особенно высока при одновременном инфицировании HBV и HCV, однако и один HCV может быть причиной этого заболевания.
Важное место в клинической картине ХГС занимают внепеченочные проявления, которые наблюдаются более чем у 40% больных, нередко выступают на первый план и определяют прогноз болезни. Чаще всего наблюдается криоглобулинемия смешанного типа. Криоглобулины обнаруживают у 42-96% больных, у 10-42% имеются клинические проявления (слабость, артралгии, пурпура, полиневропатия, синдром Рейно, гипертония, поражение почек). Частым проявлением криоглобулинемии является мембранопролиферативный гломерулонефрит.
Показана роль HCV в развитии В-клеточных лимфом, идиопатической тромбоцитопении, поражении эндокринных и слюнных желез, органа зрения, кожи, мышц, суставов, нервной системы.
Диагноз и дифференциальный диагноз. ГС диагностируют на основании анализа эпидемиологических показателей (наличие гемо-трансфузий, парентеральных манипуляций амбулаторно и в стационаре и течение последних 6 мес), клинических данных (постепенное начало, слабая выраженность клинических симптомов в преджелтушном и желтушном периодах, увеличение печени), а также лабораторных показателей. Кроме типичных биохимических показателей (гипербилирубинемия, гиперферментемия и нередко ее волнообразный характер), важны результаты серологических методов, выявление антител к HCV с помощью специальных тест-систем.
Тест-система первого поколения была создана на основе одного белка (с-100-3) из неструктурной зоны.
В 1990 г. фирмой "Ortho" для выявления антител к HCV были разработаны диагностическая иммуноферментная тест-система второго поколения и иммуноблот для подтверждения результатов. В отличие от тест-системы первого поколения в состав данной тест-системы наряду с неструктурным белком входит и структурный - core белок HCV. Учитывая возможность неспецифических взаимодействий при выявлении анти-HCV иммуноферментным методом, был разработан подтверждающий тест-иммуноблот "RIBA-2", представляющий собой нитроцеллюлозные полоски с нанесенными отдельно 4 белками HCV. С 1993 г. коммерческие фирмы выпускают иммуноферментные тест-системы и иммуноблот третьего поколения. Использование тест-систем второго и третьего поколений значительно увеличило выявление анти-HCV среди лиц, инфицированных HCV.
Динамика появления анти-HCV в крови инфицированных вариабельна. Средний интервал от начала болезни до появления анти-HCV у больных составляет около 15 нед (4-32 нед), а от переливания крови до появления анти-HCV проходит около 22 нед (10-30 нед). Анти-HCV у больных ХГС выявляются пожизненно. Персистенция анти-HCV у перенесших ГС составляет в среднем 4 года.
Обнаружение анти-HCV в сыворотке крови человека представляет безусловную диагностическую ценность. Однако не всегда удается, используя эти методики, идентифицировать все сыворотки, содержащие HCV. Это объясняется тем, что анти-HCV могут появляться в крови инфицированных сравнительно поздно. Наиболее информативно выявление в крови самого вируса. Реальным на сегодняшний день является определение последовательности РНК HCV. Этот метод - высокоспецифичный диагностический тест, позволяющий верифицировать HCV. Установление РНК HCV представляет определенные трудности, связанные с тем, что концентрация HCV в крови очень незначительна. Поэтому при проведении этого исследования используют высокочувствительную ГЩР, которая позволяет in vitro многократно увеличить количество анализируемого материала (в данном случае РНК HCV). В некоторых случаях последовательность РНК HCV удается обнаружить в сыворотках, не содержащих анти-HCV, в частности, в сыворотках больных хроническим гепатитом ни А ни В. При этом для ОГС было показано, что время определения РНК HCV и пик АлАТ совпадают, а анти-HCV начинают определяться лишь через 20-60 дней после максимального повышения активности АлАТ и АсАТ. Большинство исследователей считают, что высокий уровень РНК HCV в крови как отражение интенсивной репликации вируса коррелирует с прогрессивным течением
Необходимо подчеркнуть, что антитела, обнаруживаемые с помощью описанных тест-систем, подтверждают лишь факт инфицирования, но не позволяют судить об активности инфекционного процесса, сроках инфицирования, прогнозе заболевания. Более того, не ясно, насколько заразна кровь, содержащая анти-HCV, поскольку антитела к вирусу ГС обнаруживают как в сыворотке крови больных острым и хроническим гепатитом С, так и у тех пациентов, кто переболел и выздоровел. Однако известно, что у выздоровевших при наличии анти-HCV в сыворотке крови не выявляются вирусспецифические РНК. Определение РНК HCV, к сожалению, в настоящее время еще не стало рутинной методикой и в практической деятельности приходится ориентироваться лишь на данные о наличии или отсутствии анти-HCV. В связи с этим принято считать, что эпидемиологическую опасность представляют все лица, в сыворотке крови которых тестируется анти-HCV (поэтому из донорской службы исключают кровь всех анти-НСV-позитивных доноров).
Дифференциальный диагноз ГС проводят с другими парентеральными гепатитами, прежде всего с ГВ. При постановке диагноза ГС учитывают свойственное ГС относительно легкое течение болезни с быстрой нормализацией биохимических показателей. Волнообразный характер гиперферментемии позволяет исключать возможность гепатита D, При этом необходимо учитывать отсутствие выраженной лихорадочной реакции и болевого синдрома, а также в значительно меньшей степени выраженный синдром интоксикации. Большое значение имеют данные лабораторных исследований: нормальный уровень тимоловой пробы, обнаружение анти-HCV в сыворотке крови.
В остром периоде ГС, если заболевание протекает в легкой или среднетяжелой форме, медикаментозная терапия, как правило, не проводится. Рекомендуются соблюдение режима, диеты (стол № 5), дезинтоксикационная терапия в виде дробного обильного питья или внутривенных инфузий. При гиперферментемии свыше 6 мес пациентов госпитализируют повторно. В зависимости от данных, полученных при пункционной биопсии печени, решают вопрос о целесообразности противовирусной терапии. Назначают препараты интерферонового ряда (в основном препараты рекомбинантного альфа-2-интерферона) в дозе 1000000-6000 000. ME 3 раза в неделю в течение 6-18 мес. Около 10% больных резистентны к терапии интерфероном, устойчивый эффект наблюдается только у 25% больных. В связи с этим в последние годы изучается терапевтическая эффективность комбинированной терапии альфа-2-интерфероном и рибавирином (виразол), которая, возможно, повысит процент стабильных положительных результатов. Кроме того, используют сочетание интерфероновых препаратов с иммуностимуляторами. Критериями эффективности терапии являются динамика уровня АлАТ, наличие РНК HCV, динамика морфологических изменений в печени. Успех терапии препаратами интерферонового ряда, по-видимому, зависит от варианта генотипа вируса, которьм инфицирован больной, и от давности заболевания. Ряд исследователей полагают, что начинать терапию интерфероном необходимо как можно раньше, в желтушном периоде ОВГ, и проводить ее не менее 12 мес.
Профилактика. Мероприятия по предупреждению ГС такие же, как и при других парентеральных гепатитах. Ожидается, что тестирование донорской крови на наличие антител к HCV позволит существенно снизить заболеваемость ГС. Разработка вакцины против ГС находится на начальном этапе.
Почему вирусный гепатит С чаще принимает хроническое течение? Почему в острой стадии вирусный гепатит С диагностируется редко? Какие препараты используются при лечении вирусного гепатита С? Сегодня гепатит C во всем мире представляет собой одну из наи
Почему вирусный гепатит С чаще принимает хроническое течение?
Почему в острой стадии вирусный гепатит С диагностируется редко?
Какие препараты используются при лечении вирусного гепатита С?
Сегодня гепатит C во всем мире представляет собой одну из наиболее значимых медико-социальных проблем. Вирусом гепатита С на данный момент инфицированы 150—200 млн. человек на земном шаре. В США и странах Европы вирус гепатита С (ВГС) является этиологическим агентом в 20% случаев острого гепатита, 70% — хронического гепатита, 40% — цирроза печени, 65% — первичной гепатоцеллюлярной карциномы. Более 30% производимых в мире трансплантаций печени причинно связаны с ВГС.
Эти особенности вируса в большой степени предопределяют тот факт, что гепатит С часто принимает хроническое течение (в 75—80% случаев) и, кроме того, возможно, пожизненное носительство, в связи с чем именно хронический гепатит С (ХГС) в последние годы становится все более актуальной проблемой, в том числе и для педиатров.
ХГС, представляющий собой инфекцию с парентеральными путями передачи, все чаще выявляется среди детей и подростков. Как правило, за этим стоят гемоплазмотрансфузии, проведенные до 1997 года, когда вводимые гемопрепараты в нашей стране не тестировались на ВГС, а в последнее время распространение инфекции связано с волной наркомании, захлестнувшей наших подростков, а также с вошедшими в моду татуировкой и пирсингом, не всегда проводимыми в надлежащих условиях. Сегодня, в эпоху разового инструментария, среди медицинских манипуляций в распространении ВГС сохраняют свое значение стоматологические и эндоскопические вмешательства.
Клинические проявления гепатита С чаще всего минимальны. Именно поэтому в острой стадии ВГС обычно не выявляется и, как правило, определяется случайно, при обследовании, например перед операцией, проведением эндоскопии и т. д. Заболевание у детей протекает первично-хронически, долгие годы не сопровождаясь манифестными симптомами, такими как желтушность покровов, увеличение селезенки, подчеркнутая венозная сеть на животе и т. д., которые появляются поздно, знаменуя собой уже переход в цирротическую фазу.
Проведенные в настоящее время серьезные мультицентровые международные исследования показали, что ХГС у детей представляет собой фибротическое прогрессирующее заболевание: более чем у половины детей при повторных пункционных биопсиях печени выявляется нарастание фиброза, причем основным фактором, определяющим темпы этого нарастания (в отсутствие кo-факторов гапатотоксичности, таких как алкоголь, наркотики, сопутствующие тяжелые заболевания и нарушения обмена, медикаментозная нагрузка, стрессы и т. д.), является продолжительность инфицирования, особенно при наличии вирусной репликсации. Согласно результатам исследования, проведенного в клинике акад. РАМН, проф. В. Ф. Учайкина, из 204 детей с ХГС через 10—13 лет у 97% было обнаружено фиброзирование ткани печени, а в 10% случаев уже в первые 5—8 лет сформировался цирроз печени. Длительная спонтанная ремиссия наблюдается лишь у 8% детей. У 82% больных ХГС протекает малосимптомно, но с длительно сохраняющейся активностью процесса (повышение активности АЛТ) и вирусной репликацией (обнаружение РНК ВГС в ПЦР), что и должно служить основанием для постановки диагноза ХГС и вопроса о противовирусном лечении.
Главной целью лечения ХГС, согласно современным представлениям, является прекращение вирусной репликации, ведущее к снижению активности процесса, уменьшению темпов фиброзирования и замедляющее переход в цирроз печени и гепатокарциному. По сравнению со взрослыми пациентами, педиатры ограничены в выборе противовирусных препаратов, далеко не все из которых разрешены к применению у детей.
В настоящее время в лечении ХГС у детей безальтернативным является использование препаратов α-интерферонов, обладающих прямым и сложно-иммунопосредственным противовирусным, иммуномодулирующим и антифибротическим действием.
Показания и противопоказания к интерферонотерапии (ИФН-терапия) приведены ниже. Вопрос о применении ИФН при остром ГС (в редких случаях, когда его удается диагностировать) по-прежнему дискутируется, однако в последние годы мировое сообщество гепатологов склоняется к необходимости ИФН-терапии острого ГС в расчете на уменьшение риска хронизации.
Показания к интерферонотерапии гепатита С у детей
- Острый гепатит С.
- Хронический гепатит С.
- Обнаружение в ПЦР РНК ВГС.
- Уровень АЛТ в 1,5-2 раза превышает норму. (нормальная активность АЛТ - только индивидуальное решение в условиях клинических испытаний).
- Наличие некровоспалительных изменений и фиброза в пунктате печени.
Противопоказания к интерферонотерапии у детей
- Психозы, эписиндромы (в настоящее время и/или в анамнезе).
- Выраженные нейтро- и тромбоцитопения.
- Декомпенсированный цирроз печени.
- Возраст до 2 лет.
- Декомпенсированный диабет.
- Аутоиммунные заболевания.
Принимать решение о целесообразности проведения ИФН-терапии врач должен, не только исходя из наличия показаний и отсутствия противопоказаний, но и с учетом так называемых предикторов эффективности, то есть факторов, которые повышают эффективность лечения, а также шансы достичь ремиссии: полной первичной (если РНК ВГС не определяется, а АЛТ нормализовалась в конце лечения) или полной стабильности (те же показатели сохраняются через 6—12 месяцев после окончания лечения).
Перечень предикторов эффективности ИФН-терапии при ХГС следующий.
- Не-1-й генотип вируса.
- Сравнительно малая (до 3 лет) длительность инфицирования.
- Высокая активность трансаминаз (АЛТ) перед началом лечения.
- Низкая вирусная нагрузка (число копий РНК ВГС в количественном методе ПЦР менее 2 млн).
- "Горизонтальный" (в отличие от "вертикального", от больной матери - новорожденному) путь передачи.
- Отсутствие иммуносупрессии.
Исходя из набора предикторов, уже на старте врач может составить некоторое представление о том, каковы шансы на успех ИФН-терапии, и соответственно, подкорректировать режим лечения (дозы, схемы, комбинированная терапия и т. д.).
Стандартное лечение, рекомендуемое Международным консенсусом гепатологов (Париж, 1999): 3 млн МЕ три раза в неделю в течение 12 месяцев. Этот режим может использоваться у детей всех возрастов начиная с 2 лет с любым генотипом вируса, кроме первого.
Среди парентеральных форм интерферонов заслуживает внимание интерферон α-2а - Роферон-А. В настоящее время представляется перспективным использование многодозных картриджей, содержащих готовый раствор препарата без альбумина, что полностью исключает его контаминацию вирусами или их частицами.
При неблагоприятном наборе предикторов терапия ужесточается за счет повышения дозы ИФН, увеличения частоты введения (например, ежедневно в течение первых 2–3 месяцев) или назначения комбинированной противовирусной терапии (см. далее).
Важно отметить, что это лишь схемы, коррекция которых необходима на всех этапах лечения, но для каждого ребенка индивидуально, в зависимости от соотношения показателей эффективности лечения и его переносимости.
Успех лечения напрямую зависит от адекватности применяемых режимов терапии. По данным нашей клиники, полная клиническая ремиссия ХГС достигается у 56–64% детей, при том что спонтанная ремиссия (без противовирусного лечения) регистрируется лишь у 0–4% детей.
Показатель достижения клинической ремиссии у детей значительно выше, чем у взрослых пациентов (до 20–30% успеха), что говорит о перспективности и целесообразности ИФН-терапии ХГС у детей. Полная стойкая ремиссия при ХГС отмечается в среднем у 32–40% детей, получающих препараты ИФН, и у 0–3% не получающих противовирусного лечения, при этом следует подчеркнуть, что показатели эффективности лечения ХГС у детей сильно различаются. Так, при 1 b-генотипе ВГС она не превышает (при монотерапии препаратами ИФН) 20–35%, а при других генотипах (2а, 3а и др.) достигает 70–80%.
Достижение ПСР прямо зависит от исходной активности трансаминаз (57% успеха при высокой АЛТ против 32% при низкой) и в обратной пропорции — от исходной вирусной нагрузки (55% — при низкой и 16% — при высокой).
Но наиболее значимым фактором (после генотипа вируса), влияющим на эффективность ИФН-терапии, является давность заболевания: 64% успеха у детей с давностью заболевания до 3 лет и 11% — при сроке заболевания более 5—10 лет.
Эти факторы говорят о необходимости как можно более раннего выявления и лечения ХГС у детей.
У 16–28% детей в течение первого полугодия после окончания ИФН-терапии может развиться рецидив. В этих случаях терапия возобновляется на 6 месяцев и чаще в виде комбинированного противовирусного лечения.
Таким образом, комбинированная противовирусная терапия является методом выбора:
- у ранее не лечившихся пациентов в случае, когда оценка предикторов предполагает низкую эффективность ИФН-монотерапии;
- у получивших лечение пациентов;
- в случае отсутствия ответа в течение 3-6 месяцев или развития рецидива.
В качестве второго противовирусного препарата у детей в возрасте от 7 лет может применяться препарат ремантадин (амантадин, римантадин, альгирем), который оказывает противовирусное действие в отношении РНК-содержащих вирусов, прерывая транскрипцию генома вируса и выход вирусных частиц из клетки.
Препарат усиливает противовирусное действие ИФН и при ХГС применяется только в сочетании с ним.
Дозы ремантадина при ХГС у детей:
- 7-11 лет - 100 мг (2 табл.) в сутки;
- 12-14 лет - 150 мг (3 табл.) в сутки;
- старше 14 лет - 200 мг (4 табл.) в сутки.
Длительность лечения — 6 месяцев.
Перед началом ИФН-терапии родителям ребенка следует подробно рассказать о возможных побочных эффектах назначаемого лечения. Последние тем чаще и выраженнее, чем выше доза ИФН и моложе ребенок. Почти у всех детей после первых 3–5 инъекций появляется гриппоподобная реакция: подъем температуры до 38–39°, головная боль, ломота в суставах и мышцах и т. д. В связи с этим мы рекомендуем начинать ИФН-терапию в стационаре, а перед первыми инъекциями назначать антипиретики (парацетамол). В дальнейшем в качестве побочных эффектов может развиться миелосупрессия, в частности наблюдается падение гемоглобина и эритроцитов, особенно тромбоцитов (анализ крови следует проверять ежемесячно), снижение аппетита, похудение, усиление выпадения волос, нервозность. Все эти явления обратимы. В случае их значительной выраженности требуется снижение дозы ИФН или его временная отмена.
Комбинация ИФН с ремантадином не увеличивает опасности возникновения побочных эффектов противовирусной терапии ни качественно, ни количественно.
Эффективность комбинированной терапии существенно выше, чем ИФН-монотерапии: ППР — до 66%, а ПСР — до 58% против 26%, главным образом за счет значимого снижения частоты рецидивов (с 26 до 8%).
Помимо собственно противовирусной терапии, важное значение в лечении ХГС придается применению современных гепатопрепаратов, среди которых препаратом выбора при ХГС является урсодезоксихолевая кислота (УДХК).
Препараты УДХК широко применяются в лечении заболеваний, протекающих с манифестным холестазом (синдром Алажиля, болезнь Байлера и другие врожденные дуктопении, первичный склерозирующий холанит, муковисцидоз, желчнокаменная болезнь и т. д.).
Однако в последние годы стало известно, что благоприятное воздействие УДКХ проявляется не только при лечении вышеперечисленных заболеваний. Наряду с уменьшением холестаза (в том числе субклинического, играющего большую роль в патогенезе хронических гепатитов, и особенно ХГС), УДХК обладает мембраностабилизирующим, гепатопротективным действием (уменьшение токсического повреждения гепатоцитов и эпителия желчных протоков, выражающееся в снижении активности АЛТ и ЩФ). Кроме того, УДХК на разных уровнях блокирует патологический каскад медиаторов, запускающих апоптоз, устраняя или частично нейтрализуя этот важнейший механизм прогрессирования ХГС, а также способствует уменьшению фиброза, что является одной из главных целей лечения ХГС, в том числе противовирусного.
Известное гипохолестеринемическое действие УДХК также весьма благоприятно при ХГС, так как ожирение и стеатоз (см. предикторы) вдвое снижают эффективность противовирусной, в том числе ИФН-терапии.
Поэтому наряду с ИФН-терапией или комбинированным противовирусным лечением назначение УДХК целесообразно при ХГС у детей. Доза УДХК при ХГС 10–12 мг/кг/сутки. Длительность курса от 3–6 до 12 месяцев.
По последним данным, присоединение УДХК, не обладающей собственной противовирусной активностью, к противовирусной терапии ХГС у детей потенцирует противовирусный эффект препаратов ИФН, повышая его с 33,0 до 56,5%.
Кроме того, УДХК в 3,5 раза уменьшает частоту и выраженность побочных эффектов ИФН в отношении ЖКТ (боли в животе, анорексия, похудение): с 29 до 7,8%.
УДХК отличается хорошей переносимостью. Применение ее целесообразно при всех формах ХГС.
Несмотря на открывающиеся сегодня возможности, связанные с успехами противовирусного лечения ХГС, нельзя не признать, что оно не обеспечивает стопроцентного эффекта, сопряжено с необходимостью длительных инъекций, выраженными побочными эффектами и большими материальными затратами.
Весь мир работает над совершенствованием методов терапии ХГС, но, естественно, оптимальным способом могла бы стать профилактика ГС. Однако вакцинопрофилактика этой инфекции значительно затруднена из-за гетерогенности и изменчивости вируса, в связи с чем вакцина против ГС до сих пор не создана.
Таким образом, на сегодняшний день наиболее доступный способ профилактики ХГС — это пусть не очень эффективная, но необходимая работа с детьми, подростками и их родителями с целью предотвращения парентеральных путей передачи этой весьма серьезной инфекции.
А.Р. Рейзис, доктор медицинских наук, профессор ЦМИИ эпидемиологии, Москва
До создания своей научной группы я работал в лаборатории молекулярных основ действия физиологически активных соединений, которая занимается противовирусными препаратами, исследованиями и поиском самых разных лекарств против ВИЧ, герпеса и других вирусов. Там в 1980–1990-е годы создали препарат против СПИДа, который используется врачами с 1999 года. В лаборатории также разработали нуклеозидный препарат, который сейчас проходит третью стадию клинических испытаний.
О вирусе гепатита
Существует пять вирусных гепатитов: А, В, С, D, E.
А и E стоят особняком. Гепатит А — это болезнь грязных рук, болезнь Боткина. Всегда проявляется в острой стадии, всегда сопровождается желтухой глаз и кожного покрова. У 0,5–1% больных бывают осложнения в виде фульминантного гепатита, когда отказывает печень, но в целом после излечения человек получает пожизненный иммунитет. Гепатит E примерно такой же. Против гепатита А существует хорошая вакцина, в Китае есть препарат против гепатита E.
Хронические заболевания вызывают три остальных вида гепатита: В, С и очень странный полувирус (его называют вироидом) гепатита D. D — это паразит при паразите, сателлит гепатита B. Он может инфицировать людей, зараженных гепатитом В, использовать его белки для создания вирионов. Важно, что он ухудшает прогноз течения заболевания, ускоряет прогрессию к циррозу и раку печени.
Если сравнить гепатиты В и С, то можно отметить, что гепатит В во многих случаях вызывает желтуху, а у значительного числа пациентов (зависит от возраста) — переходит в хроническую стадию. Гепатит C крайне редко сопровождается симптомами при остром заболевании, но в 80% случаев становится хроническим.
Сколько больных гепатитом в мире?
То, что нет точной информации, сколько действительно пациентов, больных гепатитами B и С, в мире и, в частности, в нашей стране, — большая проблема. Тестируют только тех, кто приходит в больницы, проверяя их на гепатиты В, С и ВИЧ. Некоторые работы по оценке количества заболевших делались, например, на основе тестирования призывников и заключенных.
Однако в целом в России не проводится скрининг среди разных возрастов в разных регионах. Скорее всего, реальная цифра в РФ — 1 млн с лишним, но, конечно, эту оценку стоило бы верифицировать.
По информации ВОЗ, сейчас в мире 71 млн хронически больных гепатитом. Можно сказать, что количество больных уменьшается.
Открытие вирусов гепатитов
Так как гепатит А проявляет себя открыто, его вирус давно изучен. Гепатит B тоже открыто проявляется, его вирус также известен. В 1970-е годы был охарактеризован патоген гепатита D.
Сложнее было с вирусом гепатита C. Медики знали, что у немалого количества пациентов есть заболевание, сходное с гепатитом В. Понимали, что это хроническая болезнь печени; скорее всего, вызывается вирусом; что это не гепатиты А, В или D. Было известно, что часто им заболевали те, кому неоднократно делали переливание крови.
Возникает вопрос: а вызывает ли найденный вирус заболевание? Да, он есть, но вирус — не значит болезнь. Над этим вопросом работали несколько исследовательских групп. Одна из них — группа Чарлза Райса (Charles M. Rice), которая охарактеризовала недостающий фрагмент вирусной геномной РНК. Далее они получили полную РНК вируса гепатита C и инфицировали шимпанзе. Эксперимент показал, что у шимпанзе возникает болезнь, сходная с гепатитом C.
К сожалению, многие исследователи в этой области остались за кадром нобелевской награды. Большая часть важных работ того же Чарлза Райса датируется 2000-ми годами, и премию ему дали немножко не за то. Эксперименты с шимпанзе в 1990-е вели и другие группы ученых, например группа Йенса Буха, которая работала с другими командами.
Итак, в 1989 году был охарактеризован вирус гепатита C. Какие важные открытия были сделаны потом? Все 1990-е годы ученые бились над созданием его клеточных моделей: добавляли вирус к самым разным культурам клеток, а репликации не было. Ни на какой линии клеток! То есть что-то там через сутки видно, но через три дня уже этого вируса нет.
В 1997 году группа Чарлза Райса смогла инфицировать гепатитом C шимпанзе. Но и это не позволило реплицировать вирус в культуре клеток.
Прорывной была работа группы Ральфа Бартеншлагера (Ralf Bartenschlager), профессора кафедры инфекционных заболеваний Гейдельбергского университета, результаты которой опубликованы в журнале Science в 1999 году. Они смогли найти уникальную линию клеток гепатомы печени, которая поддерживала только репликацию, т. е. центральную стадию жизненного цикла вирусной РНК — что полноразмерной, что усеченной, когда удалены структурные белки (которые и образуют оболочку вириона). Но и в этих экспериментах была проблема эффективности: ученые брали огромное количество вирусной РНК, несколько миллионов клеток, а количество клеток, поддерживающих репликацию, оказалось мизерным. То есть даже в этой линии лишь совсем небольшая доля клеток является пермиссивными к вирусу.
Дальше шла работа над поиском системы репликонов, которые поддерживают репликацию без сборки вирионов. Тогда же начался скрининг ингибиторов. Группа Бартеншлагера оставалась в Европе в числе лидеров по исследованию вируса гепатита C и родственному ему. Чарлз Райс и его американская научная группа также остаются лидерами в этой области.
Чарлз М. Райс. Фото с сайта rockefeller.edu
В чем заслуга Райса? Он был тем исследователем, который сделал сходный репликон через полгода после публикации Бартеншлагера в Science. А после лаборатории Чарлза и Ральфа начали работать параллельно, характеризуя то, как происходит репликация этого вируса, как адаптируется вирус к клеткам, клетки — к вирусу и т. д. Следующее, что сделала группа Райса, — один из вариантов этой линии, который был уже более пермиссивным, лучше поддерживал репликацию: не считанного количества, а 40% клеток.
Еще одно суперважное открытие, сделанное в 2000 году: в Японии был характеризован уникальный пациент с фульминантным гепатитом — массовым некрозом печени. В норме вирус не вызывает никаких проявлений в острой стадии, а тут была массовая гибель гепатоцитов.
Наверняка кто-то из наших читателей сдавал печеночные пробы, где важны показатели АЛТ и АСТ ( аланинаминотрансферазы и аспартатаминотрансферазы ), и знает, что граница по АЛТ равна 42. Эти показатели стандартно входят в биохимический анализ крови. У японского пациента АЛТ был равен 15 тыс. Почему это интересно? В этой части исследования участвовал Такадзи Вакита (Takaji Wakita), который охарактеризовал вирус этого больного в 2003 году и показал, что такой репликон тоже суперрепликационно активен. А в 2005 году группа Вакиты вместе с Райсом продемонстрировала, что в клетках с таким полногеномным репликоном происходит сборка инфекционных частиц, т. е. вирус от этого пациента в этой линии клеток проходит полный клеточный цикл. И дальше вся биология патогена исследовалась в вышеуказанной клеточной инфекционной системе.
Нобелевский комитет, к сожалению, не отметил заслуг ни Ральфа Бартеншлагера, ни Такадзи Вакиты. Хотя они, с моей точки зрения, достойны награды, и многие специалисты в этой области исследований считают, что они могли бы стать лауреатами Нобелевской премии.
Лечение гепатита C
Борьба с вирусом гепатита C шла долго. От открытия вирусов в 1989 году до создания репликонов прошло 10 лет, и 16 лет — до появления инфекционной системы, она была сделана в 2005 году. А уже в 2011-м в клинику вошли первые противовирусные препараты прямого действия.
Гепатиты В и С — онкогенные вирусы, вызывающие рак печени, а именно гепатоклеточную, или гепатоцеллюлярную, карциному. Считается, что именно эти два вируса обуславливают до 80% случаев этого рака печени. Люди умирают не только от рака, но и от цирроза печени. Это сотни тысяч смертей в год. Поэтому с вирусами гепатитов В и С надо бороться. От гепатита В есть профилактическая вакцина, а от гепатита C нет и, по-видимому, не будет. Тем не менее, существуют эффективные лекарства.
В конце 1990-х — начале 2000-х гепатит C начали лечить рекомбинантными интерферонами. Курс длился от полугода до года в зависимости от генотипа вируса. Терапия интерферонами очень плохо воспринималась, потому что они вызывают гриппоподобное состояние. К тому же такое лечение было малоэффективным: больной проходил полный курс, но вылечивался лишь в 40% случаев; к 60% пациентов вирус возвращался.
Что есть сейчас? Несколько препаратов, направленных на три вирусных белка: полимеразу (NS5B), протеазу (NS3) и регуляторный белок NS5A. При помощи этих препаратов можно вылечить любого пациента; эффективность 99%. Как говорят на конференциях, во многих случаях недостающие 1% или 2% обусловлены не столько устойчивостью вируса, сколько тем, что ряд пациентов не приходит сдавать анализы через полгода, а по медицинским стандартам излечением считается отсутствие вирусной РНК через шесть месяцев после окончания лечения.
Нужно подчеркнуть, что гепатит C в отличие от гепатита В излечим. Если вирусной РНК нет через полгода после окончания терапии, он не возродится, а если вирус опять обнаруживается, то имеет место случай реинфекции, что подтверждается секвенированием. Соответственно, теперь вылечить от гепатита C можно любого человека.
Уже в середине 2010-х годов стало понятно, что при помощи вышеописанных препаратов можно лечить случаи коинфекции с гепатитом В или ВИЧ. Единственное, что нужно при этом учитывать, — взаимодействие лекарств. Можно вылечить и гепатит C, и многие случаи цирроза печени, в этой области также имеется огромный прогресс.
Стоит отметить, что излечение от инфекции действительно снижает риски появления рака печени. Однако для таких пациентов эти риски всё равно остаются повышенными. И особенно высокими в случае, если уже появились цирроз или фиброз. Но у многих пациентов может происходить и регрессия фиброза.
Полученные наработки можно использовать для борьбы с коронавирусами
— На ваш взгляд, почему Нобелевскую премию за открытие вируса гепатита C вручили в этом году? Это как-то связано с пандемией коронавируса?
— Вы исследуете коронавирус?
— Мы сделали первую систему проверки на антитела в Москве. Помогали коллегам одного из ФНКЦ ФМБА, которые работали в первую волну, искать доноров плазмы. Но наши усилия были ограничены тем, что наш институт относится к Миннауки, и у нас всех женщин с детьми до 14 лет, всех пожилых отправили на удаленку. В нашей лаборатории работали очно всего два человека.
На мой взгляд, в борьбе с COVID-19 нужно искать противовирусные препараты. Все ударились в создание вакцин, но что там с вакциной получится. У меня легкий скептицизм, к тому же, например, у меня аутоиммунное заболевание, что является противопоказанием к этой вакцинации.
Мы хотим и пытаемся анализировать полиморфизмы человека, которые могут определять устойчивость или чувствительность к инфекции или чувствительность к заболеванию, потому что те же полиморфизмы с интерфероном лямбда, они же интерлейкины-28В, возможно, будут играть важную роль. Это сейчас очень горячая тема, и все вирусологи что-то в этой области делают.
— Путь до победы над коронавирусом может занять десятилетия, как это было с вирусом гепатита C?
— Да, над гепатитом C мучались почти 30 лет. Но на самом деле работа шла с 1999 по 2011 год. Как говорят западные клиницисты, которые работают с гепатитом C, денег при этом выделялось намного меньше, чем на борьбу с ВИЧ. Ученые чрезвычайно быстро разобрались с вирусом гепатита C очень малыми усилиями при очень маленьком финансировании. Нашли четыре рецептора, которые необходимы, уникальную клеточную линию, которую можно заразить; разобрались, что определяет чувствительность этой линии; обнаружили, что адаптация вируса под эту линию делает его неинфекционной к животным. Правда, пока работали только с шимпанзе. Следующая модель — это так называемые голые мыши, иммунодефицитные мыши, которым в раннем возрасте приживляют человеческие гепатоциты, и у них вырастает химерная человеческая печень, состоящая на 80% из клеток человека. Это работа группы Лорна Тиррелла (Lorne Tyrrell) из Альбертского университета (Канада), где работает Майкл Хоутон. И это ближайшая модель из существующих.
Что такое гепатит А (болезнь Боткина)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит А (Hepatitis A viruses, HAV) — острое инфекционное заболевание, вызываемое вирусом гепатита А, клинически характеризующееся синдромом общей инфекционной интоксикации, синдромом нарушения пигментного обмена, синдромами энтерита, холестаза, увеличением печени и в некоторых случая селезёнки, сопровождающееся нарушением функции печени, преимущественно доброкачественного течения.
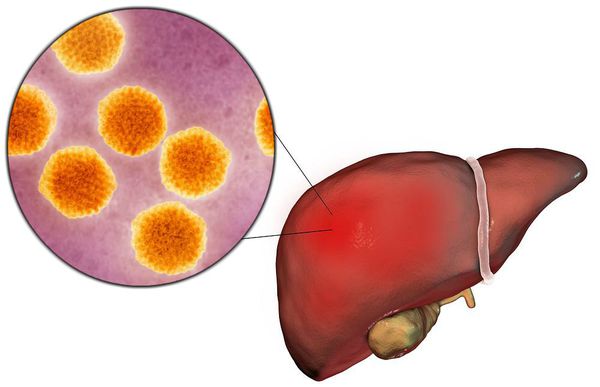
Этиология
семейство — пикорнавирусы (Picornaviridae)
вид — вирус гепатита А (HAV)
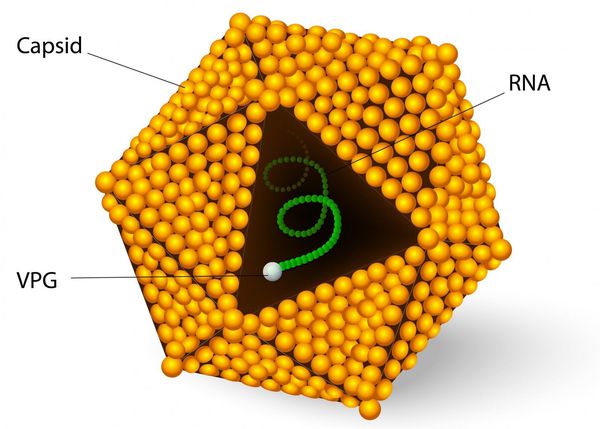
Во внешней среде очень устойчив: при температуре окружающей среды около 4°C сохраняется несколько месяцев, при 2°C — несколько лет, при замораживании очень длительно, при комнатной температуре — несколько недель. В растворе хлорсодержащих средств (0,5-1 мг/л) гибнет в течение часа, при 2,0-2,5 мг/л — в течение 15 минут, ультрафиолетовое облучение приводит к гибели в течение минуты, при кипячении сохраняется до 5 минут. В кислой среде желудка не погибает.
Наиболее значимым маркером вирусного гепатита А являются антитела класса М (анти-HAV IgM), которые образуются в начальный период заболевания и выявляются до 5 месяцев. Появление анти-HAV IgG (маркера перенесённой ранее инфекции) начинается с 3-4 недели заболевания. Антиген вируса выявляется в каловых массах за 7-10 дней до начала манифестных (явно выраженных) проявлений болезни. [1] [2] [4]
Эпидемиология
Заражение гепатитом А происходит при контакте с источником инфекции — живым человеком (больной различными формами заболевания и вирусоноситель). Больные с типичными формами являются главным источником распространения вируса (от конца скрытого и всего желтушного периодов).
Ежегодно в мире регистрируется примерно 1,5 млн случаев заболевания (количество субклинических и бессимптомных форм сложно даже представить). Смертность по миру в 2016 г., по данным ВОЗ, составила 7134 человек [10] .
Условно существует территориальное распределение по уровням инфицирования населения: высокий, средний и низкий.
Районы с высоким уровнем инфицирования это преимущественно Юго-Восточная Азия, Средняя Азия, Африка, Центральная Америка (плохие санитарные условия и низкий доход) — большинство населения к периоду взросления уже переболели и имеют иммунитет, вспышки болезни встречаются редко.
Районы со средним уровнем инфицирования — страны с переходной экономикой, развивающиеся, имеющие различия в санитарно-гигиенических условиях на территории одного региона, например Россия (большая часть населения к периоду взросления не болела и не имеет иммунитета к вирусу, возможны большие вспышки болезни).
Районы с низким уровнем инфицирования — развитые страны с высоким уровнем дохода и хорошими санитарно-гигиеническими условиями, например США, Канада, Европа, Австралия. Большинство людей не имеет иммунитета и не болела, вспышки случаются редко и чаще среди групп риска [7] .
В окружающую среду вирус выделяется преимущественно с фекалиями.
Механизм передачи: фекально-оральный (пути — водный, контактно-бытовой, пищевой), парентеральный (редко при переливании крови), половой (орально-анальный контакт).
Восприимчивость населения высокая.
Факторы риска заражения:
- высокая скученность населения;
- несоблюдение правил личной гигиены и правил хранения, обработки и приготовления продуктов питания;
- неудовлетворительное состояние объектов водоснабжения;
- бытовой очаг заболевания.
Кто находится в группе риска
- путешественники (особенно в страны жаркого климата и с плохими социальными условиями);
- гомосексуалисты;
- люди, употребляющие наркотики (любые), алкоголики;
- медработники (непривитые и не болевшие);
- бездомные;
- люди, имеющие постоянные контакты (в силу профессии или иных причин) с мигрантами из неблагополучных по гепатиту А регионов.
Характерна осенне-весенняя сезонность, повышенная привязанность к жарким южным регионам.
Иммунитет после перенесённого заболевания стойкий, пожизненный, то есть повторно заболеть нельзя [1] [3] [4] [7] [10] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита А
Заболевание начинается постепенно. Инкубационный период гепатита А протекает 7-50 дней.
Синдромы вирусного гепатита А:
- общей инфекционной интоксикации;
- нарушения пигментного обмена (желтуха);
- энтерита (воспаление слизистой тонкой кишки);
- холестаза (уменьшение количества желчи, поступающей в двенадцатиперстную кишку);
- гепатолиенальный (увеличение печени и селезёнки);
- отёчный;
- нарушения функции печени.
Типичное течение болезни — это желтушная форма болезни средней степени тяжести (устаревшее название — желтуха или болезнь Боткина).
Начальный период болезни (преджелтушный) имеет продолжительность от 2 до 15 дней и может протекать по нескольким вариантам:
При осмотре обнаруживается увеличение печени и, в меньшей степени, селезёнки, чувствительность края печени, повышение ЧСС (пульса), носовые кровотечения. В конце периода моча темнее, а кал становится светлее.
Следующий период (желтушный) длительностью около 7-15 дней характеризуется снижением выраженности симптомов предшествующего периода (то есть с появлением желтухи самочувствие улучшается). Усиливается желтушное окрашивание склер, кожных покровов и слизистой оболочки ротоглотки. Моча приобретает цвет тёмного пива, кал белеет. Присутствует общая слабость, недомогание, плохой аппетит, чувство тяжести и переполненности в правом подреберье, больной расчёсывает себя из-за зуда кожи (лихенификация), появляются петехии (мелкие кровоизлияния) на коже.
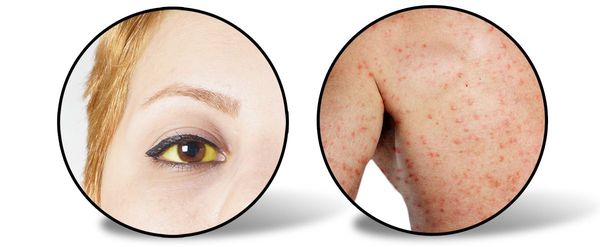
При врачебном исследовании выявляется увеличение печени и селезёнки, явственно положителен симптом Ортнера (болезненность при поколачивании ребром ладони по правой рёберной дуге), гипотония (может быть и нормотония), токсическая брадикардия (снижение ЧСС), появляются периферические отёки, возможны боли в суставах (артралгии).
Далее при благоприятном течении заболевания (которое наблюдается в большинстве случаев) происходит регресс клинической симптоматики, осветление мочи и потемнение кала, более медленное спадение желтушности кожи, склер и слизистых оболочек.
Под нетипичным течением болезни подразумеваются лёгкие безжелтушные формы гепатита А (отсутствие симптомов или лёгкая слабость без желтухи, тяжесть в правом подреберье), фульминантные формы.
Факторы, увеличивающие риск тяжёлого течения гепатита А:
Последствия для беременных
У беременных гепатит А протекает в целом несколько тяжелее, чем у небеременных. Примерно в 36 % случаев возможно развитие слабости родовой деятельности, преждевременные роды (31-37 неделя) и послеродовые кровотечения. Вирус не проникает через плаценту, то есть какого-то специфического действия на плод не оказывает. В грудном молоке вирус не содержится [1] [2] [4] [7] .
Патогенез гепатита А
Воротами для проникновения вируса является слизистая оболочка органов желудочно-кишечного тракта, где происходит его первичное размножение в эндотелиальной выстилке тонкого кишечника и мезентериальных лимфоузлах.
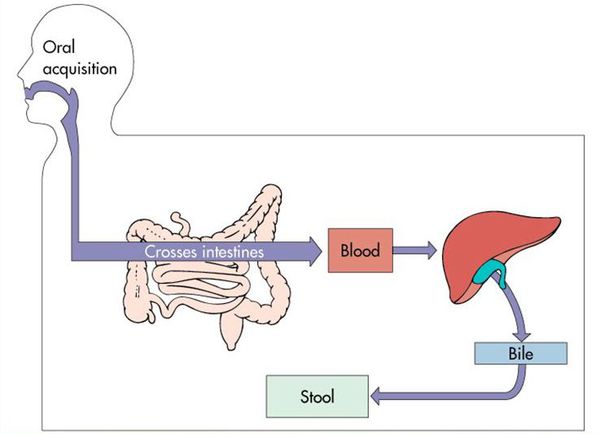
Далее происходит гематогенное распространение вирусных частиц и проникновение их в печень, где они локализуются в ретикулогистиоцитарных клетках Купфера и гепатоцитах. В результате этого происходит повреждение клеток:
- проникновение вируса в клетку;
- захват лизосомой;
- разрушение белковой оболочки вируса;
- сборка белков по программе вирусной РНК;
- встраивание этих белков в цитолемму клетки;
- образование патологических пор в оболочке клетки;
- поступление внутрь клетки ионов натрия и воды;
- баллонная дистрофия (разрушение ультраструктур клетки и образование крупных вакуолей) с последующим некрозом (его объём, как правило, ограничен);
- гибель клетки и лимфоцитарная иммунная реакция, приводящая к основному объёму поражения.
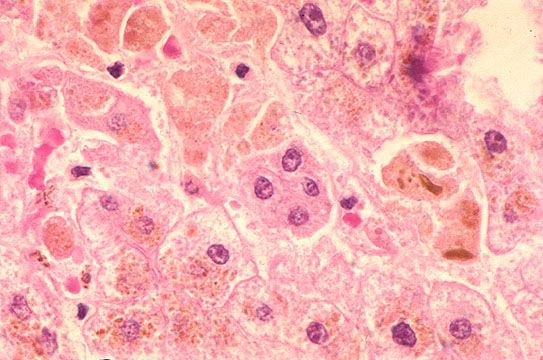
В дальнейшем вирус попадает в желчь, с ней он проникает в кишечник и выводится в окружающую среду с фекалиями. Вследствие компетентных реакций иммунной защиты размножение вируса заканчивается, и он покидает организм больного. [2] [3] [4]
Классификация и стадии развития гепатита А
По степени разнообразия проявлений выделяют две формы гепатита А:
- клинически выраженная (желтушная, безжелтушная, стёртая);
- субклиническая (инаппарантная).
По длительности течения также выделяют две формы гепатита А:
- острая циклическая (до трёх месяцев);
- острая затяжная (более трёх месяцев).
Степени тяжести гепатита А:
- лёгкая;
- среднетяжёлая;
- тяжёлая;
- фульминатная (молниеносная).
Согласно МКБ-10 (Международной классификации болезней десятого пересмотра), заболевание подразделяют на три вида:
- В15. Острый гепатит А;
- В15.0. Гепатит А с печёночной комой;
- В15.9. Гепатит А без печёночной комы. [2][4]
Осложнения гепатита А
Заболевание может привести к следующим осложнениям:
- печёночная кома (дисфункция центральной нервной системы, связанная с тяжёлым поражением печени — встречается крайне редко);
- холецистохолангит (выраженные боли в правом подреберье, нарастание желтухи и зуда кожи);
- гемолитико-уремический синдром, преимущественно у детей (гемолитическая анемия, тромбоцитопения, острая почечная недостаточность);
- развитие аутоиммунного гепатита I типа.
Гепатит А не приводит к формированию хронических форм, однако из-за выраженного воспалительного процесса возможно появление длительных резидуальных (остаточных) явлений:
- дискинезия (нарушение моторики) желчевыводящих путей;
- постгепатитная гепатомегалия (увеличение размеров печени из-за разрастания соединительной ткани);
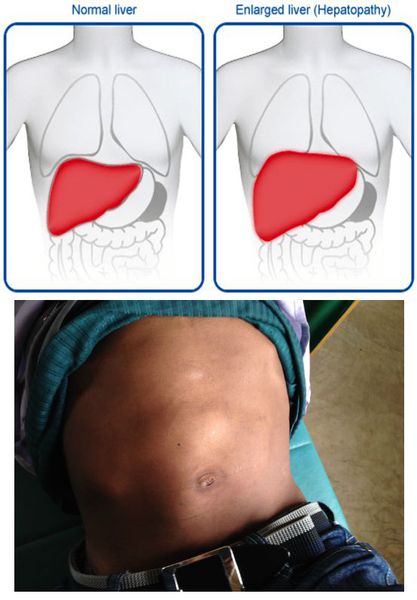
- постгепатитный синдром (повышенная утомляемость, аснено-невротические проявления, тошнота, дискомфорт в правом подреберье). [1][5]
Диагностика гепатита А
Методы лабораторной диагностики:
- Клинический анализ крови — нормоцитоз или лейкопения, лимфо- и моноцитоз, нейтропения, СОЭ в норме или снижена.
- Биохимический анализ крови — повышение общего билирубина и в большей степени его связанной фракции (реакция Эрлиха), повышение аланинаминотрансферазы и аспартатаминотрансферазы, снижение протромбинового индекса, повышение тимоловой пробы (снижение альбуминов и повышение гамма-глобулинов), повышение гамма-глутамилтранспептидазы, щелочной фосфатазы и другие показатели.
- Биохимический анализ мочи — появление уробилина и желчных пигментов за счёт прямого билирубина. Ранее, особенно в вооруженных силах, для выявления больных на начальной стадии практиковалось использование пробы Разина: утром производится опускание индикаторной полоски в мочу (при наличии уробилина она меняет цвет), и военнослужащий с подозрением на заболевание госпитализировался для углублённого обследования. Тест на уробилин становится положительным в самом начале заболевания — в конце инкубационного периода из-за болезни печёночной клетки.
- Серологические тесты — выявления анти-HAV IgM и анти-HAV IgG методом ИФА (иммуноферментного анализа) в различные периоды заболевания и HAV RNA с помощью ПЦР-диагностики (полимеразной цепной реакции) в острый период.
- Ультразвуковое исследование органов брюшной полости — увеличение печени и иногда селезёнки, реактивные изменения структуры печёночной ткани, лимфаденопатия ворот печени.
Обследование лиц, бывших в контакте с больным
Лица, контактирующие с больным вирусным гепатитом А, подлежат осмотру врачом-инфекционистом с последующим наблюдением до 35 дней со дня разобщения с больным. Наблюдение включает термометрию, осмотр кожных покровов, определение размеров печени и селезёнки, а также лабораторное обследование (АЛТ, общий билирубин, антитела классов М и G к вирусу гепатита А вначале и через три недели от первичного обследования).
Дифференциальная диагностика проводится со следующими основными заболеваниями:
- в начальный период: ;
- гастрит, гастроэнтероколит;
- полиартрит;
- энтеровирусная инфекция;
- в желтушный период: ;
- псевдотуберкулёз; ;
- желтухи другой этиологии (гемолитическая болезнь, токсические поражения, опухоли ЖКТ и другие заболевания);
- гепатиты другой этиологии (вирусные гепатиты В, С, Д, Е и другие, аутоиммунные гепатиты, болезнь Вильсона — Коновалова и т.п.) [1][2][3][4][9] .
Лечение гепатита А
Этиотропная терапия (направленная на устранение причины заболевания) не разработана.
Медикаменты
В зависимости от степени тяжести и конкретных проявлений назначается инфузионная терапия с глюкозо-солевыми растворами, обогащёнными витаминами. Показано назначение сорбентов, препаратов повышения энергетических ресурсов, при необходимости назначаются гепатопротекторы, в тяжёлых случаях — гормональные препараты, препараты крови, гипербарическая оксигенация и плазмаферез.
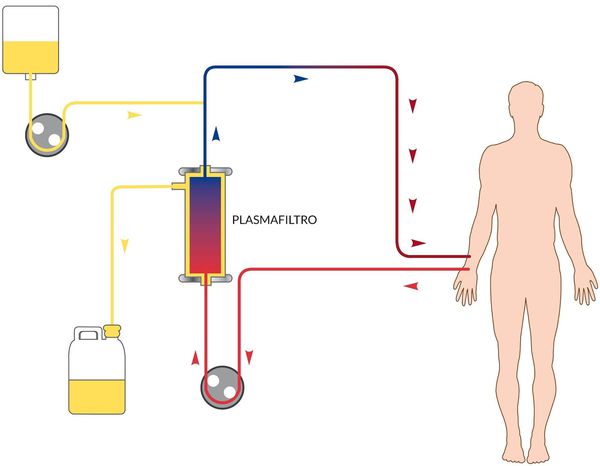
Нужна ли госпитализация
В случае лёгких форм гепатита А лечение может проводиться на дому (при наличии условий). Госпитализация потребуется, начиная со среднетяжёлых форм, лицам групп риска по тяжёлому течению, пациентам с осложнёнными формами, беременным и детям. Каких-либо особенностей при дальнейшем лечении вирусного гепатита А у детей нет.
Режим постельный или полупостельный. При гепатите А нарушаются процессы образования энергии в митохондриях, поэтому предпочтителен длительный отдых.
Лечение в стационаре и выписка
Лечение гепатита А проходит в инфекционном отделении больницы. Выписка пациентов происходит после появления стойкой и выраженной тенденции к клиническому улучшению, а также улучшения лабораторных показателей.
Критерии выписки больных:
- стойкая и выраженная тенденция к клиническому улучшению (отсутствие интоксикации, уменьшение размеров печени, регресс желтухи);
- стабильное улучшение лабораторных показателей (нормализация уровня билирубина, значительное снижение уровня АЛТ и АСТ).
При неосложнённых формах реконвалесценты (выздоравливающие больные) подлежат наблюдению в течении трёх месяцев с осмотром и обследованием не реже одного раза в месяц. [2] [3] [6]
Физиотерапия
В фазе реконвалесценции, особенно при затяжных формах болезни, возможно применение физиотерапевтических методов лечения:
- грязевых аппликаций на область правого подреберья;
- акупунктуры;
- массажа проекции области печени, желчного пузыря, желчевыводящих протоков.
Диета
Показана диета № 5 по Певзнеру — механически и химически щадящая, употребление повышенного количества жидкости и витаминов, запрет алкоголя. Исключается острое, жареное, копчёное, ограничивается кислое и соль. Все блюда готовятся на пару, тушатся, отвариваются и подаются только в тёплом виде.
Прогноз. Профилактика
Прогноз заболевания, как правило, благоприятный. Пациенты выздоравливают спустя 1-3 месяца после выписки из стационара. В редких случаях заболевание приобретает затяжной характер.
Критерии излеченности:
- отсутствие интоксикации;
- полная нормализация уровня билирубина, АЛТ и АСТ;
- нормализация размеров печени и селезёнки;
- появление в крови антител к вирусу гепатита А класса G (Anti-HAV-IgG).
Неспецифические мероприятия, позволяющие снизить количество случаев инфицирования:
- обеспечение условий и факторов потребления безопасной питьевой воды (водоснабжение);
- обеспечение и контроль за соблюдением утилизации сточных вод (канализационное хозяйство);
- контроль за качеством обследования персонала, связанного с пищевой промышленностью;
- контроль и соблюдение технологии хранения, приготовления и транспортировки пищевых продуктов и воды.
К личным профилактическим мерам относится тщательное мытьё рук после посещения туалета, смены подгузников, а также перед приготовлением или приёмом пищи.
Вакцинация
Специфическим профилактическим мероприятием является проведение иммунизации против гепатита А: практически у 100% привитых двукратно людей вырабатывается стойкий иммунитет, предотвращающий развитие заболевания. Вакцинация — это самый лучший способ предотвратить заражение.
Читайте также:

