Гепатит с при сердечной недостаточности
Обновлено: 23.04.2024
Хронический гепатит С – заболевание печени, вызванное вирусом гепатита С, длительностью 6 и более месяцев. В 10 – 40% случаев хронический гепатит С прогрессирует до цирроза печени, а в 5% случаев до гепатоцеллюлярной карциномы (чаще у пациентов с циррозом или выраженным фиброзом).
Пользователи протокола: гастроэнтерологи, инфекционисты, терапевты, врачи общей практики, а также врачи смежных специальностей, осуществляющие ведение и лечение пациентов с гепатитом С на разных стадиях заболевания.
Методология: Протокол разработан на основе Клинических руководств ведущих международных сообществ (EASL, AASLD, CASL, SASL, FASL, EACS, РОПИП) и адаптирован с учетом используемых на территории Казахстана методов диагностики и лечения. Классификация рекомендаций, использованная в данном протоколе, представлена в Таблице 1.
Таблица 1. Классификация рекомендаций
Классификация
Клиническая классификация
Общепринятой классификации ХГС не существует. При постановке диагноза необходимо указывать вирусологический статус (генотип и вирусную нагрузку), активность (биохимическую и/или гистологическую), а также стадию заболевания (по данным непрямой эластографии или морфологического исследования).
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Перечень основных и дополнительных диагностических мероприятий
(+) исследования необходимые для пациентов с ЦП
Хронический гепатит С протекает бессимптомно или малосимптомно и может сопровождаться такими неспецифичными симптомами как:
• Депрессия (оценивается у всех пациентов с использованием шкалы Бека)
• сахарный диабет 2 типа
При сборе анамнеза следует учитывать указания на гемотрансфузии, трансплантацию органов и тканей, небезопасные инвазивные (немедицинские) манипуляции, принадлежность в группам риска (потребители наркотиков, лица с беспорядочными половыми связями, пациенты, находящиеся на хроническом гемодиализе, пациенты с онкогематологическими заболеваниями, лица, живущие с ВИЧ и другими парентеральными инфекциями, сексуальные партнеры лиц с ВГС, медицинские работники, дети, рожденные от HCV-инфицированных матерей, лица с измененными функциональными пробами печени). Лицам с указанными факторами риска необходим профилактический скрининг на наличие ВГС (anti-HCV).
При физикальном обследовании на начальной стадии ХГС патологии не выявляется, за исключением незначительной гепатомегалии. По мере прогрессирования заболевания может отмечаться увеличение и уплотнение печени. Спленомегалия и другие стигмы хронического заболевания печени могут проявляться на более поздних стадиях.
Вирусный гепатит С преимущественно протекает бессимптомно. При переходе хронического гепатита С в цирроз в 6,4% случаев отмечаются симптомы, обусловленные дисфункцией печени и портальной гипертензией:
В ряде случаев ВГС выявляется у пациентов с ГЦК, которая, как правило, протекает бессимптомно, кроме случаев запущенной стадии, когда опухоль достигает значительных размеров, вызывая ухудшение функции печени (желтуха, асцит, печеночная энцефалопатия), боли в верхнем правом квадранте, астенизацию и потерю веса.
ОАК с подсчетом тромбоцитов. Могут быть выявлены анемия (в результате гиперспленизма, кровотечений из ВРВ), лейкопения, тромбоцитопения (в результате гиперспленизма и прямого миелодепрессивного влияния ВГС), ускорение СОЭ (при инфекционных осложнениях).
Биохимический профиль включает определение показателей АЛТ, АСТ, ГГТП, альбумина, билирубина, щелочной фосфатазы, МНО или ПВ, а также рутинных (глюкозы, креатинина, холестерина) и некоторых специфических показателей, таких как, гамма-глобулины, IgG (скрининг аутоиммунного гепатита), сывороточное железо и ферритин (скрининг гемохроматоза и вторичной перегрузки железом), церулоплазмин (скрининг болезни Вильсона-Коновалова), АФП (скрининг ГЦК). Активность АЛТ и АСТ может быть минимальной ( < ВГН), слабовыраженной (< 5 ВГН), умеренной (5-10 ВГН), выраженной (>10 ВГН) и не всегда коррелирует с гистологической активностью. Уровень билирубина при ХГС, как правило, нормальный. Его увеличение может наблюдаться при остром гепатите или свидетельствовать об ухудшении деятельности печени на поздней стадии заболевания, что также сопровождается снижением уровня альбумина и увеличением МНО или ПВ. Показатели щелочной фосфатазы и ГГТП могут увеличиваться при остром гепатите и оставаться на уровне нормы при хроническом гепатите.
В план клинического лабораторного обследования включаются также ОАМ, копрограмма.
- anti-HCV, маркеры других парентеральных инфекций таких как ВГВ (HBsAg, HBeAg, anti-HBs, anti-HBe, anti-HBc total/IgM), ВГD (anti-HDV у носителей HBsAg), ВИЧ (anti-HIV), а также (при подозрении на острый гепатит) ВГА (anti-HAV) и ВГЕ (anti-HEV)
Качественное определение HCV RNA с помощью высокочувствительной ПЦР в режиме реального времени с нижним лимитом определения 15 МЕ/мл на автоматических анализаторах закрытого типа.
• В случае подозрения на острый ВГС или у иммуносупрессивных пациентов необходимо определение HCV RNA (рекомендация А1)
• Если тест на anti-HCV положительный, необходимо определить HCV RNA, чувствительным молекулярным методом (рекомендация А1)
• Пациенты с положительным тестом anti-HCV и отрицательным молекулярным тестом на HCV RNA должны быть протестированы на HCV RNA через 3 месяца для подтверждения элиминации вируса (рекомендация А1).
− ИФА (+) в 50% в момент острых проявлений, поэтому ПЦР при подозрении на ОГС проводится во всех, в том числе, ИФА (–) случаях
Количественное определение HCV RNA с помощью высокочувствительной ПЦР в режиме реального времени с нижним лимитом определения 15 МЕ/мл на автоматических анализаторах закрытого типа, а также определение генотипа ВГС.
В настоящий момент известно 6 различных типов вируса, которые обозначаются цифрами от 1 до 6. Также существует подтипы, обозначаемые буквами (например, подтип 1а и 1b). На территории РК преимущественно распространенны генотипы 1b, 2 и 3.
Функциональные пробы щитовидной железы (ТТГ)
Тест на беременность
Определение полиморфизма гена интерлейкина – 28В. Результат анализа полиморфизма в гене ИЛ28В полезен в прогнозе эффективности лечения и принятии решения о выборе режима терапии у пациентов с ВГС 1 генотипа. 1
Инструментальные исследования
Радиологическое исследование
Радиологическое исследование печени (в первую очередь УЗИ) позволяет идентифицировать признаки стеатоза, выраженного фиброза и перехода в цирроз печени (закругление контуров печени, неравномерность поверхности и крупнозернистость паренхимы печени), признаки портальной гипертензии и тромбоза (увеличение диаметра, кавернозная трансформация, наличие тромбов воротной и селезеночной вен, асцит, спленомегалия), а также наличие объемных образований (ГЦК). Могут использоваться и другие визуализирующие технологии (КТ, МРТ).
Эндоскопическое исследование
При прогрессировании хронического гепатита С в цирроз диагностика портальной гипертензии может, помимо прочих методов, осуществляться путем эндоскопического обследования, позволяющего выявить варикозное расширение вен (пищевода и желудка) и портальную гастропатию.
Оценка тяжести заболевания печени должна проводиться до ПВТ. Выявление пациентов с циррозом печени имеет особое значение, так как эффективность ПВТ обратно пропорциональна стадии фиброза. Отсутствие выраженного фиброза имеет значение при принятии решения о времени начала ПВТ. Пациенты с явными клиническими признаками цирроза не нуждаются в биопсии печени для оценки стадии фиброза. Пациенты с признаками цирроза печени должны быть обследованы на ГЦК. Выраженный фиброз может быть у пациентов с нормальной активностью АЛТ, поэтому оценка степени тяжести заболевания должна проводиться независимо от показателей АЛТ. Пункционная биопсия остается эталонным методом оценки стадии фиброза печени. Риск тяжелых осложнений при биопсии очень низок (от 1/4000 до 1/10000). У пациентов с нарушением свертываемости крови можно использовать трансюгулярную биопсию печени с одновременной оценкой давления в портальной вене. При ХГС альтернативные, неинвазивные методы (непрямая эластография и биомаркеры) могут быть использованы вместо биопсии. Непрямая эластография может быть использована для оценки стадии фиброза печени у пациентов с ХГС, но необходимо учитывать факторы, которые могут повлиять на достоверность результатов, например выраженная активность заболевания, ожирение. Оба метода (непрямая эластография и биомаркеры) точны при оценке цирроза и нулевого фиброза, но менее точны при промежуточных стадиях фиброза. Комбинирование биомаркеров и непрямой эластографии повышает точность оценки стадии фиброза и уменьшает необходимость в проведении ункционной биопсии. В случае противоречивых результатов биомаркеров и непрямой эластографии, можно использовать пункционную биопсию печени. Гистологическая оценка также необходима при смешанной этиологии (например, ВГС с ВГВ, метаболическим синдромом, алкоголизмом или аутоиммунными заболеваниями).
Пункционная биопсия печени (ПБП) – относительно безопасный метод оценки морфологических изменений печени у пациентов с ХГС. ПБП позволяет оценить выраженность фибротического процесса и некровоспалительных изменений. Результаты ПБП легко интерпретируются и поддаются полуколичественной оценке. ПБП проводится в динамике с целью оценки прогрессирования поражения печени при ХГС. ПБП – единственный доступный метод, позволяющий оценить вклад сопутствующих заболеваний (стеатогепатит, гемохроматоз, аутоиммунный гепатит и т.д.) в патологическом процессе и их влияние на течение и эффективность лечения ХГС. Необходимо помнить, что ПБП имеет ряд ограничений. В частности, имеет значение опыт врача, проводящего пункцию, и морфолога, оценивающего морфологические изменения; малый объем образцов ткани печени; инвазивность и дискомфорт для пациентов; риск развития осложнений. ПБП требует строгого выполнения правил ее выполнения в условиях специализированных отделений и наличия квалифицированных морфологов.
2. Всем пациентам перед выполнением биопсии печени должно быть выполнено УЗИ ОБП. Данное исследование позволяет выявить анатомический вариант строения печени и наличие очаговых образований в ее паренхиме, что может потребовать проведения прицельной биопсии под визуальным контролем.
3. В течение недели перед проведением пункции необходимо определить количество тромбоцитов и протромбиновое время (ПВ), либо протромбиновый индекс (ПИ)
• Если количество тромбоцитов ≥90 000 /мм3, то манипуляцию можно выполнять рутинным способом (чрескожная биопсия печени)
• Если ПВ удлинено менее чем на 3 сек. в сравнении с контрольным значением (предоставляется лабораторией, в которой выполняется исследование образца крови), ПИ не менее 70%, тромбиновое время (ТВ) и активированное частичное тромбопластиновое время (АЧТВ) не превышают 1,5 нормы, биопсию можно проводить чрескожным доступом
• Во всех других случаях решение о выполнении биопсии печени принимается на индивидуальной основе путем оценки пользы и риска от планируемой манипуляции. В случае строгой необходимости в проведении биопсии печени у пациентов с гипокоагуляцией или низким количеством тромбоцитов в некоторых случаях может быть оправдана заместительная терапия
4. Перед биопсией необходимо подписать у пациента информированное согласие, в котором доступно описана методика манипуляции и возможные осложнения.
5. Во время выполнения биопсии врач и пациент должны быть в постоянном контакте. Больной четко и своевременно должен выполнять команды врача. При повышенной возбудимости пациента и отсутствии признаков печеночной недостаточности возможно назначение седативных препаратов.
6. Выбор иглы для биопсии целесообразно осуществлять с учетом личного опыта оператора. В повседневной практике удобны в применении иглы Менгини и иглы типа Tru-cut.
7. Врачи, личный опыт которых не превышает 20 манипуляций, выполняют биопсию в присутствии и под контролем более опытного доктора в условиях специализированного гепатологического центра.
9. Активное наблюдение пациентов в течение 8 часов и первой ночи после манипуляции должно проводиться в условиях медицинской организации. Оценка результатов ПБП проводится с применением полуколичественных шкал описания степени некро-воспалительных изменений и стадии фиброза ткани печени (см. Таблицы 3 и 4).
Таблица 3. Морфологическая диагностика степени некровоспалительной активности гепатита
*Для определения стадии заболевания печени чаще применяется шкала METAVIR
К преимуществам метода относятся:
• Неинвазивность
• Воспроизводимость
• Больший чем при биопсии оцениваемый объем ткани печени (в 100-200 раз больше)
• Быстрота и удобство применения (обследование занимает в среднем 5 мин)
• Немедленный результат
• Оценка эффективности терапии
• Возможность обследования детей
• Высокой биохимической активности (АЛТ/АСТ выше верхнего лимита нормы в 3 и более раз)
• Не менее 60% успешных измерений.
Таблица 5. Интерпретация результатов непрямой эластографии
ПВТ — противовирусная терапия
СН — сердечная недостаточность
ХГС — хронический гепатит С
HCV — вирус гепатита С
NT-pro-BNP — N-концевой предшественник мозгового натрийуретического пептида
Хронический гепатит С (ХГС) — актуальная междисциплинарная проблема. Хорошо изучены различные внепеченочные проявления ХГС, такие как смешанная криоглобулинемия, гломерулонефрит, поздняя кожная порфирия, красный плоский лишай, синдром Шегрена и др. Однако существует целый ряд системных проявлений, которые нуждаются в более тщательном изучении, в частности поражение сердца. При ХГС описаны миокардит, гипертрофическая (ГКМП) и дилатационная (ДКМП) кардиомиопатии, коронарит вследствие криоглобулинемического васкулита мелких сосудов сердца, аритмогенная дисплазия правого желудочка, аневризма левого желудочка, раннее развитие атеросклероза и ишемической болезни сердца [1—6]. Возможно развитие цирротической кардиомиопатии (КМП), которая наблюдается при циррозах печени различной этиологии, в том числе вирусной. Развивается диастолическая дисфункция миокарда и синдром удлиненного интервала Q—T, выраженность которого увеличивается по мере нарастания декомпенсации функции печени [7—11]. Наконец, широко используемая противовирусная терапия (ПВТ) ХГС может сопровождаться кардиотоксичностью интерферона (ИФН), имеющей клинические особенности и нередко проявляющейся развитием декомпенсации деятельности сердца.
Миокардит является одним из мало изученных внепеченочных проявлений ХГС [3, 4]. В клинике им. Е.М. Тареева описана серия наблюдений из 22 больных хроническим гепатитом вирусной этиологии с миокардитом, у 13 из которых диагностирован цирроз печени. Поражение сердца у 4 больных стало причиной летального исхода. В 3 наблюдениях на аутопсии выявлена картина хронического активного миокардита: обширные очаги лизиса кардиомиоцитов (КМЦ) с очаговой лимфогистиоцитарной инфильтрацией; многочисленные продуктивные и продуктивно-деструктивные эндофлебиты; диффузный фиброз стромы; лимфогистиоцитарная инфильтрация стромы. В одном случае диагностированы диффузный кардиосклероз, миокардиофиброз, диффузный склероз эндокарда. Особенностью двух других наблюдений явились выраженные изменения в проводящей системе сердца: волокна проводящей системы замурованы в грубоволокнистую фиброзную ткань, отмечены резко выраженная дистрофия и некробиоз КМЦ. У этих больных наблюдались различные нарушения проводимости [4].
Первичные КМП представляют собой гетерогенную группу заболеваний миокарда различной этиологии. Наибольший интерес к проблеме миокардитов и КМП, ассоциированных с HCV-инфекцией, отмечен у исследователей из Японии. Выявлена высокая распространенность HCV-инфекции у больных ГКМП, ДКМП и миокардитом [17—20]. При многоцентровом исследовании по программе Комитета по изучению идиопатических КМП в Японии, антитела HCV в сыворотке выявлены у 74 (10,6%) из 697 больных ГКМП и у 42 (6,3%) из 633 больных ДКМП, значительно превышая частоту обнаружения антител HCV у сопоставимых по возрасту доноров крови (2,4%) [20].
По данным A. Matsumori [1], у 113 больных ГКМП, HCV-инфекция диагностирована у 16 (14,1%), причем ни у одного из них не было семейного анамнеза по ГКМП. В 4 наблюдениях имелись указания на гемотрансфузии в анамнезе, у 10 больных определялся повышенный уровень трансаминаз в сыворотке, у 7 выявлен гепатоцеллюлярный рак. При морфологическом исследовании отмечены умеренная или выраженная гипертрофия правого и левого желудочков, фиброз различной степени и умеренная клеточная инфильтрация миокарда. РНК HCV генотипа 1b выявлена в сыворотке у 7 больных, РНК HCV в ткани миокарда — у 6, минус-цепи РНК HCV обнаружены в биоптатах сердца у 2 больных. Другая группа исследователей выявила антитела HCV у 18 (22,5%) из 80 больных ГКМП [21].
Многоцентровое исследование, проводимое научным комитетом по изучению КМП Всемирной федерации заболеваний сердца, ставило задачу выявления вирусных геномов энтеровирусов, аденовируса, цитомегаловируса и HCV в формалиновых срезах ткани сердца. Геном HCV выявлен в 2 (18%) из 11 биоптатов больных ДКМП и миокардитом в Италии и у 4 (36%) из 11 больных в США, у 2 из них выявлен миокардит и у 2 — аритмогенная дисплазия правого желудочка. Несмотря на то что метод выявления генома HCV в парафиновых (фиксированных в формалине) срезах менее чувствительный, чем в замороженных образцах, предполагается, что HCV-инфекция может быть более частой причиной ряда заболеваний миокарда, в первую очередь миокардита [22]. Показано также, что частота развития КМП, обусловленных HCV, варьирует в различных регионах мира и различных популяциях. Среди больных КМП в Канаде (Ванкувер) РНК HCV не обнаружена ни в одном из 24 образцов ткани сердца. Ряд европейских исследователей также высказываются против связи HCV-инфекции и заболеваний сердца [23].
В последние годы также изучается вопрос о взаимосвязи ХГС и уровня натрийуретических пептидов. Так, в крупном ретроспективном исследовании антитела к HCV выявлены у 59 (4,4%) из 1355 больных с СН неясной этиологии, что значительно превышало частоту НCV-инфекции в общей популяции (1,8%). Уровень N-концевого предшественника мозгового натрийуретического пептида (NT-pro-BNP) в сыворотке у больных с СН и ХГС достоверно выше, чем у больных с СН без маркеров HCV (р<0,0001) [24]. Интересным представляется исследование А. Antonelli и соавт. [25], которые выявили повышенный уровень NT-pro-BNP у 34% больных ХГС, в то время как в группе неинфицированных, сопоставимых по полу и возрасту, повышение данного лабораторного показателя отмечалось лишь в 6% наблюдений. Это может свидетельствовать в пользу субклинического поражения сердца у некоторых больных ХГС.
Генетические факторы и патогенетические звенья поражения сердца при HCV. Несмотря на то что в последнее время в литературе описываются клинические наблюдения ДКМП и ГКМП, ассоциированных c HCV [1, 6, 18, 21]; механизм, посредством которого HCV приводит к их развитию, полностью не изучен. У ряда пациентов с ассоциированной с HCV КМП идентифицированы HLA- и не-HLA-гаплотипы, которые дают основание полагать, что фактором развития данного вида поражения сердца является генетическая предрасположенность. Так, в развитии ДКМП участвует α-фактор некроза опухоли (α-ФНО) — один из ключевых цитокинов, усиление синтеза которого наблюдается при HCV-инфекции [26].
Причиной миокардита, приводящего к ДКМП и СН, могут быть некоторые вирусы, обладающие тропизмом к миокарду [27, 28]. Считается, что в основе развития вирусного миокардита и прогрессирования его в КМП лежат механизмы смерти клетки в результате апоптоза, а также индуцированные вирусами иммунные реакции [29]. Предполагаемым иммунным механизмом является постоянное обновление иммунокомпетентных клеток и продуцируемых ими цитокинов [30, 31]. Среди всех цитокинов, участвующих в развитии и прогрессировании миокардита, наиболее важную роль играет α-ФНО [32—34]. Отдельные исследования показали, что имеется связь как между сниженной функцией миокарда и повышенной экспрессией α-ФНО, так и между концентрацией α-ФНО в плазме и миокарде у больных миокардитом [35] и ДКМП [36]. С помощью иммуногистохимического анализа установлено, что α-ФНО продуцируется КМЦ при вирусных миокардитах, ассоциированных с аденовирусом, цитомегаловирусом, вирусом Эпштейна—Барр, вирусами гриппа, А и B, а также HCV [35, 37]. Отрицательный инотропный эффект α-ФНО обусловлен связыванием α-ФНО со специфическими рецепторами TNFR1 и TNFR2, которые экспрессируются на мембране КМЦ [38]. Также вероятно, что α-ФНО ингибирует кальциевые каналы L-типа, что приводит к снижению систолической функции миокарда [39]. Другим механизмом, посредством которого α-ФНО влияет на миокард, является стимулирование продукции оксида азота (NO), который оказывает отрицательное инотропное действие на миокард, действуя как эндогенный ингибитор и фактически уменьшая положительный инотропный ответ на β-адренергическую стимуляцию [40].
Некоторые гены, например гены системы HLA, причастны к клиренсу и персистенции HCV-инфекции [41]. В нескольких исследованиях сообщалось, что ДКМП и ГКМП ассоциируются с некоторыми аллелями системы HLA. Так, у инфицированных HCV пациентов, у которых развивается ДКМП, более часто выявляются гаплотипы HLA-DPB1*0901 и HLA-DRB1*1201, а у инфицированных HCV пациентов с ГКМП — гаплотипы HLA DRB1*0901 и DQB1*0303 [1, 42]. По данным других авторов, развитие ДКМП, ассоциированной с HCV, наиболее отчетливо коррелирует с аллелями не-HLA-генов, чем с генами системы HLA [43]. Таким образом, пилотные исследования демонстрируют, что имеется генетическая предрасположенность к развитию поражения миокарда у пациентов с ХГС (рис. 1).

Рис. 1. Генетическая предрасположенность к поражению миокарда при HCV-инфекции.
По данным N. O’Garra и соавт. [44], в печени развивается выраженный CD4+ Th1 клеточный ответ, наиболее вероятно индуцируемый интерлейкином (ИЛ) 12, ИФН-α и ИФН-β, которые продуцируются моноцитами, нейтрофилами и макрофагами после стимуляции Toll-like-рецепторов HCV производными продуктами. Если определенные гаплотипы кодируют молекулы главного комплекса гистосовместимости (ГКГ) II класса с более высоким сродством к производным пептидам HCV, то их функция как молекул, презентирующих антигены клеткам Th1 CD4+, повышается. После активации клетки Th1 CD4+ продуцируют ИФН-γ, который активирует макрофаги к продукции провоспалительных цитокинов [44]. Главными цитокинами, продуцируемыми макрофагами, являются ИЛ-1 и α-ФНО [45], которые могут приводить к обновлению иммунных клеток и высокой концентрации α-ФНО в миокарде.
Другим механизмом, посредством которого гаплотипы HLA могут влиять на развитие ДКМП, ассоциированной с HCV, в контексте α-ФНО является так называемая неклассическая функция клеток ГКГ II класса, т. е. их роль в качестве сигнальных трансдукционных молекул, активируемых суперантигенами в клетках некоторых типов [46, 47]. Суперантигены являются протеинами бактериального или вирусного происхождения, которые активируют до 20% Т-клеточной популяции путем одновременного связывания Т-клеточных рецепторов и молекул ГКГ II класса, что приводит к массивному высвобождению цитокинов, которые секретируются как Т-клетками, так и антигенпрезентирующими клетками [48—50]. В контексте полиморфизма HLA предполагалось, что они принимают непосредственное участие в исходе, к которому приводит продукция цитокинов, стимулируемая суперантигенами [51, 52]. Можно предположить, что определенные гаплотипы HLA кодируют эпитопы молекул ГКГ II класса с высоким сродством к производным HCV суперантигенам или антителам, а это ведет к чрезмерной продукции цитокинов, в частности α-ФНО. Более активное обновление иммунных клеток может привести у генетически предрасположенных инфицированных HCV пациентов к развитию миокардита и впоследствии к ДКМП. Следует отметить, что часто при ассоциированном с HCV хроническом активном миокардите у пациентов отмечался нормальный уровень активности печеночных трансаминаз в сыворотке крови вплоть до формирования терминальной стадии СН [53].
Развитие и прогрессирование вирусного миокардита, в том числе у больных ХГС, осуществляется через различные патогенетические звенья (рис. 2): 1) прямое действие вируса на миокард; 2) непрямое (иммунологическое) действие; 3) смерть клеток в результате апоптоза.

Рис. 2. Механизмы поражения миокарда при HCV-инфекции. АФК — активные формы кислорода.
Воздействие HCV на миокард. Ряд исследователей указывают на возможность прямого воздействия HCV на миокард. Показано, что HCV реплицируется в миокарде, о чем свидетельствует выявление там негативных цепей РНК [53—55]. Механизм, посредством которого протеин HCVcorе вызывает повреждение миокарда, остается неясным; однако он может быть сходным с механизмом поражения печени. Показано, что изменения в структуре рецепторов TNFR1, вызываемых протеином HCVcorе, повышают чувствительность клеток к цитолизу, опосредованному α-ФНО [56]. Кроме того, протеин HCVcorе вызывает дисфункцию митохондрий, что приводит к развитию окислительного стресса клеток печени [57, 58]. Фактически, протеин HCVcore ограничивает свое действие в митохондриях, в частности он взаимодействует с наружной мембраной митохондрий, повышает поглощение кальция митохондриями и вызывает окисление глутатиона, что приводит к дальнейшему повышению продукции АФК [59, 60]. Повышение образования АФК инициирует продукцию α-ФНО [61], который, как отмечено ранее, оказывает отрицательное инотропное действие на миокард. В некоторых ранее проводимых исследованиях продемонстрировано, что у пациентов с острой и хронической СН, развившихся в исходе КМП, в миокарде определяется повышение выработки АФК [62, 63].
К тому же ряд исследований на животных подтверждают роль протеина HCVcore в развитии КМП. В частности, развитие КМП наблюдалось у трансгенных мышей, носителей гена HCVcore, в возрасте 12 мес. Гистологический анализ миокарда этих мышей выявил гипертрофию КМЦ, кардиальный фиброз, дезорганизацию, дефицит и лизис миофибрилл, вакуолизацию и деформацию ядер, повышенное количество митохондрий неправильной формы [55], что убедительно подтверждает определяющие действие протеина HCVcore на развитие КМП, ассоциированной с HCV.
Непрямой иммунологический механизм поражения миокарда включает вовлечение в патологический процесс В-клеток, Т-клеток и макрофагов. Участие В-клеток в КМП, ассоциированной с HCV, предположено в результате обследования 3 пациентов с ассоциированным с HCV миокардитом, ответивших на иммуносупрессивную терапию. В сыворотке крови этих больных выявлены антитела к миокарду, что дало основание предполагать иммунологический механизм повреждения клеток. В дальнейшем подтверждение иммуноопосредованного механизма КМП, ассоциированной с HCV, было основано на эффективности иммуносупрессивных препаратов (преднизолон и азатиоприн), терапия которыми привела к нормализации размеров камер сердца и регрессу признаков СН, несмотря на продолжающуюся персистенцию HCV [54].
Прямой и непрямой механизмы развития ДКМП, ассоциированной с HCV, связаны со смертью клеток через апоптоз. Благодаря способности повышать продукцию АФК, протеин HCVcore может инициировать митохондриальный путь апоптоза. АФК могут вызывать диссоциацию цитохрома С на внутренней мембране митохондрий, что приводит к активации каспаз, результатом чего является фрагментация геномной ДНК и смерть клетки [64]. В результате связывания лигандов с внеклеточными рецепторами суперсемейства рецепторов α-ФНО происходит активация рецепторзависимого сигнального пути апоптоза [65]. Наиболее важными лигандами этих рецепторов являются α-ФНО и Fas-лиганд (FasL). Высокий уровень α-ФНО в миокарде у пациентов с ассоциированным с HCV миокардитом может активировать данный механизм смерти клеток путем взаимодействия с рецепторами ФНО [66].
Заключение
Имеются убедительные доказательства того, что поражение сердца служит одним из внепеченочных проявлений HCV-инфекции. Механизм, посредством которого HCV может приводить к поражению миокарда у генетически предрасположенных пациентов, является многофакторным и включает прямое повреждающее действие вируса, аутоиммунный механизм и апоптоз.
Поражение миокарда при ХГС может прогрессировать в хронический персистирующий миокардит через прямой (вирусный) и непрямой (иммунный) механизмы повреждения, которые приводят к активации зависимой от рецепторов смерти КМЦ, результатом чего является развитие фиброза миокарда с возможной трансформацией в ДКМП. Кроме того, описаны случаи взаимосвязи HCV и ГКМП.
До настоящего момента HCV-инфицированным больным с вовлечением сердца ПВТ, как правило, не проводилась из-за побочных эффектов ИФН. Однако за последние несколько лет в ПВТ вирусного гепатита С произошли кардинальные изменения. Длительное изучение механизмов репликации HCV привело к созданию ингибиторов протеаз HCV (NS¾A, NS5A, NS5B), которые позволяют достичь элиминации вируса у 90—99% пациентов за существенно более короткий срок (как правило, 12 нед) без применения препаратов ИФН (так называемая безинтерфероновая терапия). Это делает данную терапию гораздо более безопасной и хорошо переносимой, в том числе в отношении миокарда [67—69].
Нуждается в отдельном изучении вопрос эффективности и безопасности ПВТ у пациентов с ХГС и ассоциированного с ним поражения сердца, включая сравнение только ПВТ и сочетания ПВТ с сердечно-сосудистыми препаратами и/или иммуносупрессорами. Выявление антител к миокарду и определение уровня α-ФНО в сыворотке крови во время терапии может быть использовано для оценки влияния терапии на данные маркеры.
Поражение печени при хронической сердечной недостаточности (ХСН) у пациентов с нарушениями углеводного обмена (НУО) развивается в достаточно большом числе случаев. Показатели ремоделирования сердца и структурно-функциональные изменения печени при этом тесно взаимосвязаны и взаимообусловлены, а тяжелое поражение печени ассоциируется с плохим прогнозом при ХСН [1]. При этом механизмы формирования структурных и функциональных нарушений печени при ХСН ишемического генеза при ее сочетании с НУО имеют определенные особенности, опосредуемые присутствием как ХСН, так и неалкогольной жировой болезни печени (НАЖБП). НАЖБП наиболее распространена прежде всего в популяции пациентов с мета- болическим синдромом (МС) и сахарным диабетом (СД) 2-го типа [2]. В основе формирования поражения печени у пациентов с ХСН ишемического генеза лежат прежде всего гемодинамические механизмы, что сопровождается повышением механического давления в печеночных синусоидах и желчных канальцах, повышением уровня γ-глутамилтранспептидазы (ГГТП) и щелочной фосфатазы (ЩФ) в сыворотке крови даже при начальных проявлениях сердечной недостаточности, а выраженность холестаза коррелирует с классом ХСН [3]. По данным исследования CHARM (2009) [4], повышенный уровень билирубина был наиболее важным предиктором госпитализаций по поводу декомпенсации ХСН и кардиоваскулярной смертности. Венозный застой, ишемия за счет снижения сердечного выброса, артериальная гипоксемия приводят к формированию гипоксии печеночной ткани и ее ишемическому повреждению. Клиническими форма- ми поражения печени при ХСН ишемического генеза являются: застойная гепатопатия, ишемический гепатит, кардиальный фиброз и цирроз печени [5].
Поэтому для оценки особенностей гепатокардиальных взаимоотношений у пациентов с ХСН и НАЖБП в рамках МС или СД в клинике внутренних болезней Волгоградского государственного медицинского университета было проведено проспективное исследование в параллельных группах, в которое были включены 410 па- циентов в возрасте от 45 до 65 лет. Все больные проходили стационарный этап реабилитации после перенесенного инфаркта миокарда (ИМ).
В зависимости от наличия МС или СД пациенты были рандомизированы в группы. 1-я группа (n=50) была представлена пациентами с ХСН I–III функционального класса (ФК) по классификации ОССН (2002) на 22–30-е сут после перенесенного ИМ с клинико-лабораторными проявлениями МС (ВНОК, 2009) без нарушений углеводного обмена (33 мужчины, 17 женщин, средний возраст – 56,4±3,5 года).
2-я группа (n=50) включала пациентов с ХСН и МС с нарушениями углеводного обмена (17 мужчин, 33 жен- щины, средний возраст – 57,4±3,6 года), из которых 32% пациентов имели нарушение гликемии натощак, 68% – нарушение толерантности к углеводам. 3-я группа включала 210 пациентов в возрасте от 45 до 65 лет (средний возраст – 60,8±4,8 года) с ХСН I–III ФК на 22–30-е сут после перенесенного ИМ и СД 2-го типа. На момент включения в исследование у пациентов имелась компенсация углеводного обмена, достигнутая с помощью диеты и пероральных сахароснижающих средств в соответствии с клиническими рекомендациями Российской ассоциации эндокринологов (2011). 4-я группа (n=100) была представлена пациентами в возрасте от 45 до 65 лет (средний возраст – 58,6±4,2 года) с ХСН I–III ФК на 22–30-е сут после перенесенного ИМ без клинико-лабораторных проявлений МС или СД 2-го типа (группа контроля).
Все пациенты получали базисную терапию сердечной недостаточности (бисопролол, периндоприл, ацетилсалициловая кислота, клопидогрел, симвастатин, диуретики (фуросемид или индапамид), спиронолактон, при необходимости – нитраты) и базисную сахароснижающую терапию (метформин и/или глибенкламид). Средние дозы базисных препаратов, применяемых для лечения ХСН и СД 2-го типа, статистически достоверно не различались между группами.
Оценка структурного состояния печени проводилась на ультразвуковом сканере My Lab-90 (Esaote, Италия). Изучение функционального состояния печени включало определение активности аланиновой (АЛТ) и аспарагиновой (АСТ) аминотрансфераз, ЩФ и ГГТП, общего белка и альбумина, общего билирубина, тимоловой пробы и протромбинового индекса в сыворотке крови по общепринятым методикам на биохимическом анализаторе Liasys-2 (AMS, Италия). Рассчитывали индекс стеатоза печени по Lee Jeong-Hoon et al. (2010) по формуле:
ИС = 8 × (AЛТ/AСT) + ИМТ (+2 у женщин; +2 при наличии СД),
где ALT – показатель активности АЛТ в Е/л, AST – показатель активности АСТ в Е/л, ИМТ – индекс массы тела (кг/ м 2 ).
Изучение состояния углеводного и липидного обмена, оценка ИР проводились с помощью общепринятых методик.
Статистическая обработка результатов исследования осуществлялась при помощи пакета прикладных программ для обработки медицинской и биологической информации Statistica 7.0 (StatSoft, Inc., США) с привлечением встроенных функций программы MC Excel и программы Statistica 7.0 (StatSoft,Inc. При поиске патогенетических особенностей ХСН при разной степени выраженности нарушения углеводного обмена в целях удобства анализа снижение размерности фазового пространства до фазовой плоскости использовали с привлечением либо аппарата пошагового линейного дискриминантного анализа, либо канонической корреляции.
Программа и протокол исследования рассмотрены и одобрены региональным этическим комитетом (протокол № 154-212 от 12 марта 2011 г.).
Примечание: SDNN (мс) – стандартное отклонение величин интервалов RR за весь рассматриваемый период;
IC (%) – индекс централизации регуляторных систем;
HF, LF, VLF (%) – соответственно мощность спектра высокочастотного, низкочастотного и очень низкочастотного компонента
вариабельности в % от суммарной мощности колебаний
Рис. 2. Относительный вклад групп показателей, отражающих состояние синдрома кардиальной дисрегуляции и нарушения функционального состояния печени у пациентов исследуемых групп, в первый набор функций
Анализ полученных в ходе исследования данных свидетельствуют о том, что повышение активности СНС в группе пациентов с ХСН и МС с НУО и ХСН и СД 2-го типа, опосредованное как наличием ХСН, так и присутствием МС, сопровождается нарастанием индекса стеатоза печени и повышением уровня ГГТП. С другой стороны, по данным L. Puthtmana et al. (2001) [12], НАЖБП может способствовать дальнейшему прогрессированию автономной дисфункции, что приводит к формированию факторов дополнительного кардиоваскулярного риска у пациентов с ХСН и НУО, а также может усугублять структурно-функциональные нарушения co стороны сердца. В ходе исследования было показано: показатель индекса стеатоза печени, а также частота встречаемости гиперферментемии ГГТП, АСТ и АЛТ в группах больных с ХСН и МС, СД 2-го типа оказались взаимосвязанными с различными типами ремоделирования сердца, что может говорить о существовании гепатокардиального континуума.
Безусловно, основой профилактики ремоделирования и развития фиброза сердца и печени у пациентов с ХСН является использование препаратов, влияющих на активность ренин-ангиотензин-альдостероновой системы (РААС). [13], что связано с существенной ролью внутриорганной РААС в регуляции роста, пролиферации, апоптоза клеток, образования активных форм кислорода, воспаления и фиброгенеза. Однако присутствие НАЖБП у пациентов с ХСН и особенности формирования гепатокардиальных взаимоотношений диктуют необходимость использования дополнительной гепатопротекторной терапии у этой категории пациентов. Интерес представляют экспериментальные данные, свидетельствующие о гепатопротекторных свойствах таурина в лечении НАЖБП. зхРезультаты экспериментального исследования Gentile et al. (2011) говорят о возможности таурина снижать выраженность стресса эндоплазматического ретикулума, окислительного стресса, подавлять активность каспазы-3 и апоптоз гепатоцитов, проявления хронического системного воспаления в гепатоцитах.
Кроме того, таурин подавлял аккумуляцию ТГ в гепатоцитах, что позволяет рассматривать его как перспективный препарат для профилактики и лечения НАЖБП [14]. На модели НАСГ у крыс было показано, что при диете, обогащенной жирами, таурин существенно уменьшает вес печени, активность трансаминаз в сыворотке, уровень ТГ и глюкозы, окислительный стресс, количество экспрессируемой mRNA фактора некроза опухоли α, трансформирующего ростового фактора β и проколлагена 1; значительно увеличивает экспрессию адипонектина по сравнению с таковой в опытной группе.
Исходно повышение активности АСТ и АЛТ выше нормальных значений (но не более 3-кратного превышения верхней границы нормы) отмечалось в 20% случаев во 2-й группе и в 23,3% – в 1-й группе. Через 16 нед. приема таурина в составе комбинированной терапии СД 2-го типа и ХСН и ни у одного пациента во 2-й группе не регистрировалась гиперферментемия, тогда как в 1-й группе в 10% случаев сохранилось повышение уровня активности АСТ. Различие между группами статистически значимо. Кроме того, отмечено достоверное снижение активности АСТ и АЛТ во 2-й группе пациентов, дополнительно принимающих таурин ( Δ, % = -39,06 и -26,93 соответственно vs Δ , % = - 4,1 и -0,98 в 1-й группе).
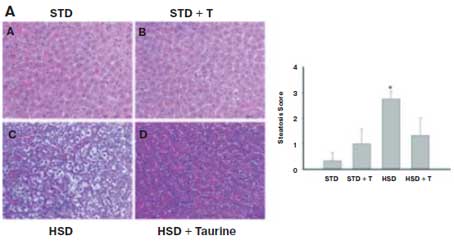
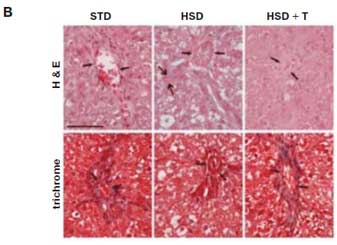
Рис. 3. Эффект таурина на стеатоз у крыс, индуцированный высококрахмалистой (STD) или высокосахарозной диетой (HSD).
Гистологическая картина печени. Окраска гематоксилином и эозином (Н&Е) и трихромом.
Длительность исследования и включение таурина (Т) в диету – 4 нед. [14]
* - р
Выявлено снижение активности как ЩФ, так и ГГТП у пациентов, получающих комбинированную терапию с включением таурина. Активность ЩФ снизилась на 22,7% во 2-й vs 0,34% в 1-й группе (р Таблица 1.
Динамика показателей функционального состояния печени у больных ХСН и СД 2-го типа при приеме Дибикора в составе комбинированной терапии
Установленное в ходе исследования положительное влияние таурина на функциональные показатели, характеризующие синдром цитолиза и холестаза, по-видимому, обусловлено доказанными антиоксидантными и противовоспалительными свойствами таурина [18].
Нами проводилась оценка индекса стеатоза печени (FLI) [19] и фиброза печени (NFS) [20], рекомендованного EASL – ALEN для неинвазивной диагностики тяжести поражения печени (2015) в различных клинических ситуациях [21].
FLI = (e 0,953*loge (ТГ) + 0,139*ИМТ + 0,718*loge (ГГТП) + 0,053*ОТ – 15,745) / (1 + e 0,953*loge (ТГ) + 0,139*ИМТ + 0,718*loge (ГГТП) + 0,053*ОТ – 15,745 ) * 100 и NAFLD Fibrosis Score (NFS) = (-1,675 + 0,037 x воз- раст (года) + 0,094 x ИМТ (кг/м 2 ) + 1,13 x НТГ/СД (да = 1, нет = 0) + 0,99 x АСТ/AЛТ отношение – 0,013 x число тромбоцитов (x10 9 /л) – 0,66 x альбумин г/дл).
Полученные результаты свидетельствуют о том, что назначение таурина в составе комбинированной терапии пациентам с ХСН и СД 2-го типа с НАЖБП сопровождалось достоверным снижением индекса стеатоза печени на Δ, % = -12,4% vs Δ,% = 0,68% в контрольной группе. Различия между группами достигли статистической значимости. Результаты согласуются с данными экспериментального исследования C.L. Gentile et al. (2011), которые показали высокий терапевтический потенциал таурина при неалкогольном стеатозе печени [14] (рис. 3).
Таким образом, применение таурина в клинике и эксперименте свидетельствуют о его значимых органо-гепатопротекторных эффектах и может быть использовано для коррекции метаболических нарушений и усиления липидоснижающего действия статинов при НАЖБП.
Литература
Хроническое пассивное полнокровие печени - состояние, включающее в себя спектр печеночных расстройств, которые возникают в условиях правосторонней сердечной недостаточности.
Хроническое пассивное полнокровие печени почти никогда не бывает единственным или основным диагнозом, чаще фигурируя в качестве осложнения основного заболевания.
Примечание. В данную подрубрику включены следующие клинические понятия:
- кардиальный цирроз печени;
Классификация
Выделено 3 стадии изменений в печени:
1. Стадия мускатной печени. Орган увеличен, уплотнен. На разрезе ткань имеет пеструю окраску (как ядро мускатного ореха) - на серо-желтом фоне (результат жировой дистрофии гепатоцитов) видны множественные мелкие темно-красные участки (полнокровные центры долек).
2. Стадия мускатного (застойного) фиброза. Печень плотная за счет разрастания волокнистой ткани. На разрезе ткань пестрая ("мускат наоборот") - на темно-красном фоне (результат смещения полнокровия из центра долек на периферию) обнаруживаются многочисленные мелкие серые очаги (фиброз в центре долек).
3. Стадия сердечного (застойного) цирроза. О данной стадии говорят в случае деформации печени (поверхность ее становится бугристой).
Этиология и патогенез
Этиология и патогенез
Застойное (пассивное) полнокровие печени чаще всего является результатом повышения давления в системе нижней полой вены, связанного с декомпенсацией функции правого желудочка или обоих желудочков. Состояние является клинико-морфологическим проявлением сердечной или легочно-сердечной недостаточности.
К непосредственным причинам правожелудочковой недостаточности могут относиться констриктивный перикардит, митральный стеноз, трикуспидальная регургитация, легочное сердце, кардиомиопатии Кардиомиопатии (син. кардиопатия) — заболевания миокарда, при которых сердечная мышца структурно и функционально изменена в отсутствие патологии коронарных артерий, артериальной гипертензии и поражения клапанного аппарата
.
Патофизиологическая сущность общего венозного полнокровия состоит в перераспределении объема крови в общем круге кровообращения с накоплением ее в венозной части большого круга кровообращения (полых венах, а иногда и в сосудах легких) и уменьшением в артериальной части. Повышенное венозное давление в правом предсердии передается на печень через нижнюю полую вену и печеночные вены.
На клеточном уровне венозный застой препятствует эффективному синусоидальному кровотоку в терминальных печеночных венулах. Результаты возникающего синусоидального застоя венозной крови проявляются виде паренхиматозной атрофии, некроза, отложения коллагена, и, в конечном счете, фиброза.
Альтернативная теория предполагает, что сердечный цирроз - это не только ответ на хроническое повышение венозного давления и синусоидальный застой. Для развития фиброза печени может потребоваться более высокая степень обструкции сосудов, такая как, например, внутрипеченочный тромбоз. Тромбоз, в этом случае, может распространяться от синусоидов печеночных венул на средние вены печени и далее на ветви портальной вены, в результате постепенного отмирания паренхимы и фиброза.
Морфология: печень увеличена, капсула напряжена, передний край тупой, ложе желчного пузыря отечно; на разрезе - подчеркнутый рисунок долек.
Микроскопически: центральные вены и прилежащие капилляры расширены, заполнены кровью; печеночные пластинки раздвинуты, сдавлены; ретикулиновая строма сохранена.
При подостром застойном полнокровии печень уменьшена, края ее острые. На разрезе центр долек - темно-красный, запавший, периферия - желто-коричневая (мускатная печень). Микроскопически: печеночные пластинки в центре долек атрофированы, иногда до полного исчезновения.
Эпидемиология
Признак распространенности: Редко
Соотношение полов(м/ж): 1.2
Эпидемиология заболевания неизвестна, так как признаки "мускатной печени" достоверно обнаруживаются в основном на аутопсии, а при жизни маскируются симптомами основного заболевания. Считается, что с развитием кардиохирургии и трансплантологии, количество случаев сердечного цирроза печени в развитых странах сокращается.
Пол. Считается, что имеет место небольшое преобладание мужского пола. В старческом возрасте возможно небольшое преобладание женщин.
Возраст. Хотя признаки правосторонней сердечной недостаточности могут встречаться в любом возрасте (например, у младенцев в силу врожденных пороков сердца), преобладающим возрастом считается зрелый и старческий. Это связано с превалированием ишемической болезни сердца и других причин. Таким образом, распространенность увеличивается с возрастом.
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
дискомфорт в правом подреберье; желтуха; гепатомегалия; спленомегалия; гипотрофия; анорексия; асцит; отеки нижних конечностей; анасарка; вздутие шейных вен; расширение вен нижних конечностей; цианоз нижних конечностей; снижение температуры нижних конечностей; пигментация кожи нижних конечностей; шумы в сердце; расширение границ сердца вправо; хрипы в легких; плеврит; одышка; тошнота
Cимптомы, течение
I. Общая информация
2. Симптомы со стороны сердца могут быть разделены на те, которые сопровождают недостаточность правого желудочка сердца и бивентрикулярную недостаточность.
При физикальном обследовании преобладают признаки сердечной недостаточности.
2. Повышенное давление в яремной вене:
2.1 Вздутие шейных вен может быть вызвано применением давления в области правого подреберья в течение 1 минуты (гепатоюгулярный рефлюкс).
2.2 Парадоксальный рост венозного давления в яремной вене во время вдоха (симптом Куссмауля) может указывать на констриктивный перикардит, дисфункцию правого желудочка сердца, стеноз трехстворчатого клапана или легочное сердце Сердце легочное - патологическое состояние, характеризующееся гипертрофией и (или) дилатацией (стойкое диффузное расширение просвета) правого желудочка сердца в результате легочной гипертензии; возникает, как правило, при поражениях бронхов, легких, легочных сосудов, диафрагмы, плевры и грудной клетки
.
3. Хрипы в легких вследствие бивентрикулярной недостаточности и равномерное ослабление дыхания вследствие плеврита.
4. Аускультативная картина клапанной недостаточности или стеноза (в зависимости от этиологии). Перкуторная картина расширения границ сердца вправо или вправо и влево.
Диагностика
Диагноз хронического пассивного полнокровия печени выставляется на основании:
- подтвержденного (инструментально, клинически) факта хронической сердечной недостаточности (правожелудочковой или бивентрикулярной);
- умеренных изменений лабораторных показателей (печеночные пробы);
- исключения других причин формирования фиброза печени.
Неинвазивные исследования
1. Обзорная рентгенография органов грудной клетки:
- признаки кардиомегалии;
- признаки легочной венозной гипертензии;
- признаки отека легких или плеврита; плевральный выпот обычно больше справа.
2. Трансторакальная допплеровская ЭхоКГ может помочь в установлении причин хронической сердечной недостаточности: определить массу и размеры желудочков сердца, патологию клапанов, функцию сократимости сердечной стенки.
3. Допплерография нижней полой вены может показать уменьшение ее размера на вдохе и диаметр равный или более 2,3 см, что характерно для правожелудочковой недостаточности.
При исследовании печеночных вен может вывляться обратный систолический ток, что весьма специфично для трикуспидальной регургитации.
Метод показан для оценки результатов лечения хронической сердечной недостаточности и степени регрессии сердечного цирроза. Если регрессии не происходит, следует рассмотреть вариант синдрома Бадда-Киари (см. "Веноокклюзионная болезнь печени" - K76.5).
4. Радионуклидные методы исследования (с таллием или технецием) применяются для выявления обратимой ишемии миокарда у пациентов с кардиальным циррозом при декомпенсированной сердечной недостаточности. Использование технеция и позитронно-эмиссионной томографии (ПЭТ) могут определить дилатационную кардиомиопатию.
5. КТ и МРТ наиболее предпочтительны для диагностики констриктивных заболеваний перикарда. Оба исследования могут измерять фракцию выброса и эффективно исключить или подтвердить наличие кардиального цирроза печени. При кардиальном циррозе также выявляется гепато- и спленомегалия.
6. Электрокардиография:
6.1 Часто выявляются признаки ишемии миокарда, гипертрофии желудочков и расширение правого предсердия.
6.2 Гипертрофия правого желудочка, отклонение электрической оси вправо, блокада правой ножки пучка Гиса позволяют предложить хроническую перегрузку правого желудочка давлением.
Инвазивные исследования
Диагностический парацентез может помочь различить этиологию асцита. Полученная информация будет особенно полезна для больных с алкоголизмом и неуточненными заболеваниями сердца.
Как правило, "кардиальный асцит" показывает высокое содержание альбумина с градиентом по отношению к сыворотке (SAAG) более 1,1 г/дл и высокое содержание общего белка (более 2,5 г / дл) в асцитической жидкости.
У пациентов с некардиальным цирротическим асцитом также имеется высокое значение SAAG, но в асцитической жидкости общий белок будет больше, чем 2,5 г/л только у 10%.
С терапевтической целью (эвакуация асцита) лапароцентез рекомендуется применять только при терапии, рефрактерной к диуретикам. Поскольку синтетическая функция печени при кардиальном циррозе обычно сохранена, парентерального введения альбумина после пункции обычно не требуется.
2. Катетеризация сердца / коронарная ангиография.
Процедура может быть показана пациентам с кардиальным циррозом и сердечной недостаточностью в контексте известной или подозреваемой ИБС. Исследование используется преимущественно для оценки анатомии коронарных артерий и определения потребности в реваскуляризации.
Катетеризация правых отделов сердца для диагностики легочной гипертензии проводится при наличии клинических и УЗИ признаков.
Менее чем у 1% пациентов с хронической печеночной недостаточностью легочная гипертензия развивается в отсутствие базовой легочной и/или сердечной патологии (идиопатическая портопульмональная гипертония). Это состояние может прогрессировать до правожелудочковой недостаточности и затруднять ответ на вопрос: является ли печеночная недостаточность следствием заболевания печени или сердца.
Лабораторная диагностика
I. Лабораторная оценка тяжести повреждения печени включает определение:
- печеночных трансаминаз;
- щелочной фосфатазы;
- общего билирубина и альбумина.
1.1 Повышение билирубина в сыворотке крови.
Наблюдается у 15-50 % пациентов с сердечной недостаточностью.
Повышение, как правило, умеренное, обычно менее 4,5 мг/дл (80 ммоль/л). Примерно 50-60% сывороточного билирубина при этом составляет неконъюгированный билирубин (связано с комбинацией легкого гемолиза и нарушений процессов поглощения и конъюгации).
Значительное повышение уровня билирубина в сыворотке крови может наблюдаться при острой правосторонней сердечной недостаточности.
После улучшения печеночного кровотока билирубин в сыворотке крови может довольно быстро снизиться с нормализацией в среднем в течение 3-7 дней.
У пациентов с хронической сердечной недостаточностью (ХСН) уровень билирубина может не вернуться к нормальным показателям в течение длительного времени, даже после нормализации кровотока вследствие образования ковалентной связи билирубина с альбумином, которая формирует дельта билирубин, имеющий длительный период полураспада (21 день).
Повышение уровня общего билирубина является независимым предиктором неблагоприятного прогноза у больных с сердечной недостаточностью.
У пациентов, которые подвергаются пересадке сердца, повышение уровня билирубина более чем в 3 раза выше нормы является значительным негативным прогностическим индикатором выживаемости после выписки.
1.2. Трансаминазы.
Трансаминазы повышаются умеренно - от 2 до 4-х раз.
В стадии компенсации ХСН повышение трансаминаз встречается редко (у 10% пациентов).
Аномальные значения чаще встречаются у пациентов со средним давлением в правом предсердии (свыше 10 мм рт.ст.) и сердечном индексе менее 1,5 л/мин/м 2 , то есть в стадии суб- или декомпенсации.
Увеличение трансаминаз более чем в 10 раз от нормы наблюдается у пациентов с острой декомпенсацией ХСН, артериальной гипотонией, шоком или указывает на гепатит.
Повышение уровня АСТ, как правило, немного выше, чем АЛТ и возникает раньше.
Очень высокие уровни АСТ могут быть найдены у пациентов с медикаментозным или вирусным гепатитами. Однако при вирусных гепатитах уровень АЛТв основном выше, чем уровень АСТ.
При улучшении кровообращения АСТ быстро нормализуется, что также отличает кардиальный цирроз от токсических и вирусных гепатитов.
Умеренное увеличение уровня AСT может быть вызвано инфарктом миокарда. Последующая дисфункция миокарда и сердечная недостаточность могут усложнить интерпретацию повышения АСТ.
1.3. Повышение уровня щелочной фосфатазы.
Отмечается редко при сердечной недостаточности и носит очень умеренный характер (выше норме не более, чем в 2 раза). Более высокие показатели требуют проведения дифференциальной диагностики с синдромом холестаза Холестаз - нарушение продвижения желчи в виде застоя в желчных протоках и (или) проточках.
.
Точный механизм, приводящий к увеличению ЩФ у больных с кардиальным циррозом, неизвестен.
При узловой регенеративной гиперплазии, осложненной сердечной недостаточностью, повышенный уровень ЩФ может быть единственным биохимическим признаком процесса.
1.4. Снижение альбумина наблюдается у 30-50% пациентов. Уровень нормализуется спустя месяц после компенсации ХСН.
1.5. Протромбиновое время: принято считать, что удлинение ПТ и МНО наблюдается у 80% пациентов с острой или хронической правосторонней сердечной недостаточностью. Нормализация показателя происходит в течение 2-3 недель, после достижения стойкой компенсации.
2.2 Определение уровня тиреотропного гормона показано пациентам с необъяснимыми признаками кардиального цирроза и фибрилляцией предсердий.
III. У пациентов с сердечным циррозом, особенно при обострении (усилении симптомов), следует дополнительно определить маркеры повреждения миокарда, исследовать электролиты и креатинин сыворотки, провести общие анализы крови (количество эритроцитов) и мочи.
Дифференциальный диагноз
Осложнения
Лечение
Общие правила
Терапия направлена в первую очередь на лечение этиологически значимого фактора, то есть состояния, вызвавшего хроническое венозное полнокровие. Наличие кардиального цирроза само по себе редко влияет на исход сердечной недостаточности и какой-либо самостоятельной терапии, как правило, не подлежит.
Диета. Ограничение натрия менее 2 г/сут. - фундаментальный принцип немедикаментозной терапии.
Режим. Умеренные нагрузки, определенные кардиологом, на фоне корректируемой сердечной недостаточности более полезны, чем строгий постельный режим.
Медикаменты
1. Наиболее общие рекомендации включают в себя парентеральное применение диуретиков (в условиях стационара). Диуретическая терапия является краеугольным камнем медикаментозной терапии. Спиронолактон особенно показан при сердечно-сосудистой недостаточности III-IV класса (по классификации Нью-Йоркской кардиологической ассоциации).
2. При достижении нормоволемии, если левожелудочковая недостаточность является основной причиной, показаны бета-блокаторы и ингибиторы АПФ.
3. Правожелудочковая или бивентрикулярная недостаточность лечатся по стандартным схемам.
Прогноз
Влияние кардиального цирроза на выживаемость пациентов с хронической сердечной недостаточностью неизвестно, однако цирроз является одним из относительных противопоказаний к пересадке сердца.
Тем не менее, исследования по изучению обратимости сердечного цирроза у пациентов, перенесших пересадку сердца, показали, что синтетическая функция печени значительно улучшилась в течение 3 месяцев после пересадки.
Госпитализация
За редким исключением пациенты с кардиальным циррозом и симптомами острой сердечной недостаточности требуют госпитализации. Это особенно важно при впервые выявленной сердечной недостаточности. Госпитализация также показана, когда хронические симптомы становятся невосприимчивыми к амбулаторной терапии и большие дозы оральных диуретиков не обеспечивают адекватного диуреза, что сопровождается усилением отеков и прибавкой в весе более 800 г/сутки или 2 кг/неделю.
Помимо этого, показанием к госпитализации служит уменьшение переносимости стандартной физической активности (например, уменьшение дистанции, пройденной за определенной время).
Читайте также:

