Гепатоцеллюлярная карцинома как исход гепатита
Обновлено: 18.04.2024
Злокачественные новообразования печени могут быть первичными и вторичными. Вторичные опухоли – это метастазы, которые возникают при распространении злокачественного процесса на IV стадии. Чаще всего в печень метастазирует колоректальный рак. Первичный рак печени развивается непосредственно из ткани органа, и здесь выделяют две разновидности новообразований:
-
. Она происходит непосредственно из печеночных клеток.
- Холангиокарцинома — ее субстратом являются клетки, выстилающие печеночные протоки, выводящие желчь.
По сути, это две совершенно разные опухоли, и объединяет их только то, что они обе изначально локализуются в печени. Далее в этой статье мы будем говорить о гепатоцеллюлярном раке, поскольку это новообразование встречается намного чаще, чем холангиокарцинома.
Симптомы рака печени
Рак печени может долгое время протекать бессимптомно. У многих пациентов его обнаруживают при проведении контрольных обследований или случайно, при обследовании по поводу другой патологии. Описаны случаи, когда у пациента была опухоль размером 15 см, а никаких клинических признаков при этом не было.
Уже на распространенных стадиях присоединяются следующие симптомы:
- Тяжесть и тупая боль в правом боку.
- Нарастающая слабость, быстрая утомляемость.
- Нарушение аппетита, тошнота, рвота.
- Увеличение объема живота из-за скапливающейся в брюшной полости жидкости (асцита).
- Расширение вен в области стенки живота.
- Пожелтение кожи и склер.
- Боль. Боль тем сильнее, чем больше растянута капсула печени. В ряде случаев она может отсутствовать.
Из клинических признаков присутствуют следующие:
- Увеличение размеров печени.
- Увеличение уровня билирубина. Он может быть повышен и на фоне цирроза.
- Увеличение размеров селезенки.
- Лихорадка, устойчивая к действию антибиотиков и противовоспалительной терапии.
- Желудочно-пищеводные кровотечения из варикозно-расширенных вен пищевода.
Стадии рака печени
Около 10-15% пациентов имеют признаки паранеопластического синдрома:
- Гипогликемия.
- Кожный зуд без желтухи.
- Остеопороз.
- Нарушение работы щитовидной и паращитовидной желез.
В ряде случаев первичные признаки со стороны печени отсутствуют, а симптомы появляются при развитии отдаленных метастазов, например, в легких, костях или головном мозге.
Диагностика рака печени
В рамках диагностики рака печени проводятся исследования, направленные на обнаружение новообразования, определение стадии распространенности опухолевого процесса, а также оценку функциональных резервов печени.

В рамках обнаружения рака проводят следующие исследования.
УЗИ печени. Метод прост, безопасен, доступен и обладает достаточной чувствительность и специфичностью. Также УЗИ позволяет определить инвазию рака в прилежащие к печени ткани, вовлеченность в процесс ворот печени, регионарные метастазы и наличие свободной жидкости в брюшной полости. Также аппараты экспертного класса позволяют оценивать степень фиброза печеночной ткани.
МРТ с контрастным усилением преобладает большей чувствительностью и специфичностью, по сравнению с УЗИ и позволяет обнаружить новообразования меньше 1 см на фоне цирроза.
Для верификации диагноза проводится биопсия опухолевого новообразования под контролем УЗИ.
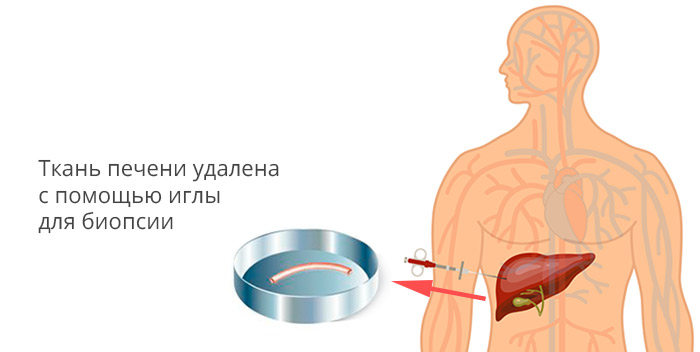
Пункционная биопсия печени
Для поиска метастазов рака печени проводится УЗИ брюшной полости, обзорная рентгенограмма органов грудной клетки или КТ ОГК. Также назначается КТ или МРТ головного мозга и сцинтиграфия костей.
Для определения функционального резерва печени при наличии цирроза проводится ряд тестов, которые учитывают наличие асцита, энцефалопатии, уровень альбумина и билирубина в сыворотке крови, а также МНО и протромбиновый индекс.
Лечение рака печени
При определении тактики лечения рака печени учитываются следующие факторы:
- Распространенность опухолевого процесса
- Функциональные резервы печени.
Возможные варианты лечения следующие:
- Хирургия — удаление пораженной части печени.
- Рентгенэндоваскулярные методы.
- Абляционные методы.
- Лучевая терапия.
- Медикаментозная терапия.
Хирургия
Если опухоль резектабельна, то предпочтение отдается резекции печени. Можно удалить до 75-80% печеночной ткани, и при этом сохранится ее функция, и пациент сможет жить. Но у больных с циррозом ввиду фибротических изменений, возможности хирургического лечения ограничены.
Развитие гепатоцеллюлярной карциномы на фоне цирроза печени
Трансплантация печени показана пациентам с циррозом, у которых соблюдаются следующие условия:
- Имеется одиночная опухоль размером менее 5 см.
- Наличие 2-3 очагов опухоли размером менее 3 см.
- Нет признаков прорастания рака в кровеносные сосуды.
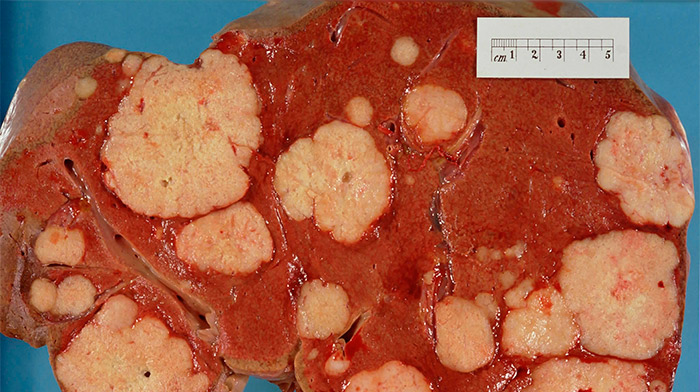
Удаленная печень со множественными злокачественными очагами
Абляция рака печени
В основе абляционных методов лечения лежит повреждение опухоли с помощью физических или химических агентов. Лечение проводится при единичных узлах. Применяются следующие методы:
- Лазер.
- Ультразвук.
- Радиочастотное воздействие.
- Микроволновое воздействие.
- Криоабляция — применение низких температур.
- Фотодинамическое воздействие.
- Введение в опухоль 96% этанола.
На практике чаще всего применяется радиочастотная или микроволновая абляция. Показанием к применению такого метода лечения являются единичные опухолевые узлы размером менее 5 см.

Рентгенэндоваскулярные методы
Применяются в рамках терапии первой линии при распространенной неоперабельной форме рака печени в комбинации с другими противоопухолевыми методами лечения при соблюдении следующих условий:
- Нет признаков прорастания рака в магистральные сосуды печени.
- Нет отдаленных метастазов.
- Нет признаков тромбоза магистральных сосудов печени.
Метод противопоказан в следующих случаях:
- Декомпенсированный цирроз.
- Коагулопатии с кровотечениями.
- Тромбоз или прорастание рака в магистральные сосуды печени.
- Внепеченочные очаги.
- Некупируемый асцит.
Суть лечения заключается во введении в опухоль химиопрепарата. Это возможно благодаря тому, что печень имеет двойное кровоснабжение. В нее входит воротная вена, которая приносит венозную кровь для фильтрации, и печеночная артерия, которая кровоснабжает саму печень и, соответственно, опухоль. Если блокировать артериальный кровоток в опухолевом узле, то это вызовет ее ишемию и, как следствие, уменьшение ее размеров. А если дополнительно в опухоль ввести химио-или радиопрепарат, то получается двойной эффект – от действия химиопрепарата и от ограничения кровотока.
Вначале вводится рентгеноконтрастный препарат, чтобы понять, какие ветви кровоснабжают опухоль. Затем в просвет сосуда доставляется масляный раствор с химиопрепаратом или специальные микросферы, насыщенные лекарственным средством. Таким образом, создается максимально высокая концентрацию препарата в опухоли плюс блокируется его кровоток.
Лучевая терапия рака печени
Лучевая терапия при лечении рака печени носит паллиативный характер и применяется у пациентов, имеющих противопоказания к вышеперечисленным методам лечения. У пациентов с единичными опухолевыми узлами возможно проведение стереотаксического облучения, которое позволяет подвести максимальную лучевую дозу непосредственно к опухолевому очагу, минимально затрагивая окружающие ткани.
Медикаментозная терапия гепатоцеллюлярного рака
Химиотерапия рака печени является малоэффективным методом лечения и помогает только 20% больных. Поэтому сейчас в рамках медикаментозной терапии применяется таргетная- и иммуно терапия, которая достоверно повышает продолжительность жизни таких пациентов. Терапией первой линии является сорафениб, либо комбинация таргетных и иммунопрепаратов: бевацизумаба и атезолизумаба. Также хорошие результаты показывает терапия регорафенибом.
Факторы риска рака печени
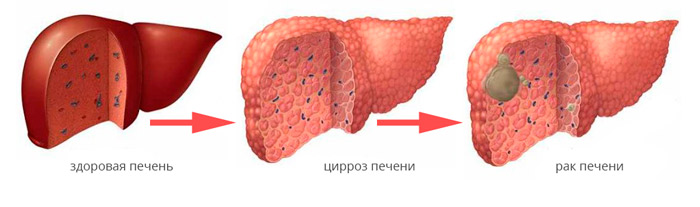
Основным фактором риска развития рака печени является цирроз самой разной этиологии. По сути цирроз является исходом хронического заболевания печени, которое в ряде случаев может длиться годами. Основными причинами развития цирроза являются:
- Хронические гепатиты В и С.
- Алкоголизм. При длительном и обильном употреблении алкоголя может развиться острый гепатит с трансформацией в хронический.
- Некоторые паразитарные инвазии.
- Гемохроматоз.
- Аутоиммунные гепатиты.
- Токсическое отравление афлотоксинами или винилхлоридом.
- Инсулинрезистентный сахарный диабет.
Только у 10% пациентов с раком печени опухоль развивается на фоне здоровой печеночной ткани.
Профилактика рака печени
Учитывая то, что рак печени в основном развивается на фоне цирроза, всем таким пациентам показано регулярное обследование. Проводится анализ на определение уровня онкомаркера альфа-фетопротеина и выполнение УЗИ печени.
Пациентам не из группы риска, т. е. у которых нет цирроза и сопутствующих заболеваний, можно предложить следующие мероприятия:
- Вакцинация против гепатита В.
- Регулярное обследование на определение маркеров вирусных гепатитов, и при постановке диагноза проведение своевременной антивирусной терапии.
- Отказ от употребления алкоголя.
- Соблюдение принципов рационального питания.
- Контроль веса и диабета.
- Контроль метаболического синдрома.
Популярные вопросы
Как можно предотвратить рак печени
В первую очередь, необходимо позаботиться о том, чтобы избежать хронических заболеваний печени, которые могут привести к циррозу. Если он уже есть, то необходимо раз в полгода сдавать анализы на альфа-фетопротеин и выполнять УЗИ брюшной полости.
Какие первые симптомы рака печени?
Первые симптомы могут развиться уже на распространенных стадиях, к тому же они могут маскироваться под признаки цирроза. Поэтому для ранней диагностики необходимо инструментальное обследование. Из симптомов чаще присутствует желтуха, нарушение аппетита, боль и тяжесть в правом подреберье.
Влияет ли цирроз на лечение рака печени?
Да, причем цирроз сам по себе может быть проблемой более серьезной, чем рак, поскольку при выраженной печеночной недостаточности происходит нарушение метаболизма различных соединений и синтеза многих белков, что само по себе приводит к развитию тяжелых состояний. Кроме того, цирроз может оказывать влияние на выбор тактики лечения онкологических пациентов.
Ключевые слова: хронический гепатит С, цирроз печени, гепатоцеллюлярная карцинома.
V.V. Makashova 1,2 , H.G. Omarova 1 , O.N. Hohlova 1 , T.N. Lukashenko 3
1 Central Research Institute of Epidemiology, Moscow
2 Clinical Hospital for the Infectious Diseases, Moscow
3 Outpatient Clinic № 5, Moscow
The article presents a clinical case of a patient with a diagnosis of liver cirrhosis of Child-Pugh class B in the outcome of chronic hepatitis C, treated with interferon and ribavirin for 18 months. In the course of antiviral therapy, RNA of the hepatitis C virus became negative after 8 weeks and remained steadily negative for 2 years. Subsequently, on the background of stress, 3 months after the end of treatment, a relapse of chronic hepatitis C appeared with moderate biochemical and virological activity. 6 months after the relapse, a liver cancer was suspected during an ultrasound examination and histological confirmation was obtained. After a few months, hemorrhage from esophageal varicose veins dilatation (EVVD) occurred in the patient, and after another 1 month, there was repeated hemorrhage from EVVD. The patient was monitored and treated in the intensive care department. Ascites, bilateral pneumonia, fever, leukocytosis appeared. The patient’s condition progressively worsened and with increasing psychomotor agitation, progressive respiratory and cardiovascular insufficiency, biological death was recorded.
There was a divergence of diagnoses, category II. The cause of the fatal outcome was purulent intoxication, as a result of ulcers perforation of the esophagus, purulent mediastinitis with pleural empyema on the left.
Актуальность
Клиническое наблюдение
Пациент Т., 1948 г. р., 22.01.2009 г. обратился в поликлинику к инфекционисту в связи с лейкопенией (до 3,2×10 9 /л), тромбоцитопенией (60–120×10 9 ). Со слов пациента, антитела к HCV впервые выявлены в 1998 г. Не обследовался, не лечился. Впервые обследовался в поликлинике ФСБ № 5 в 2009 г., выявлена РНК HCV+, 1в генотип, вирусная нагрузка — 1,3×10 6 коп/мл.
Жалобы на периодически возникающую слабость и утомляемость.
Перенесенные заболевания: 1972 г. — аппендэктомия, 1992 г. — острый вирусный гепатит А, 1995 г. — оперирован по поводу синдрома Меллори — Вейса. В это же время были гемотрансфузии. 1996 г. — грыжесечение, 1997 г. — повторное грыжесечение, 2004 г. — язвенная болезнь 12-перстной кишки, 2005 г. — правостороннее воспаление легких, хронический бронхит, 2007 г. — повторная пневмония, 2007 г. — сильное кровотечение при удалении зубов, гипертоническая болезнь, сахарный диабет 2-го типа.
Аллергоанамнез — не отягощен.
Наследственность: у отца — цирроз печени алкогольного генеза, у матери — инсульт, у брата — хронический вирусный гепатит В.
Вредные привычки: не курит, алкоголь употреблял часто, но немного (со слов), крепкие напитки (виски, коньяк).
Объективно при осмотре: сосудистые звездочки в области грудной клетки, умеренная пальмарная эритема, иктеричность склер. Печень пальпаторно и перкуторно увеличена — выступает на 4–5 см ниже реберной дуги, селезенка не пальпируется.
Рост — 173 см, вес — 80 кг.
Динамика основных показателей общего и биохимического анализов крови, данные ПЦР-диагностики представлены в таблице 1.
Заключение
Подводя итог всей истории болезни пациента Т., 63 лет, можно констатировать, что имел место ЦП, класс В по Чайлд — Пью в исходе ХГС, пролеченного препаратами интерферона и рибавирина в течение 18 мес. На фоне противовирусной терапии РНК HCV стала отрицательной через 8 нед. и оставалась стойко отрицательной на протяжении 2 лет. В последующем на фоне стресса — через 3 мес. после окончания лечения возник рецидив ХГС с умеренной биохимической и вирусологической активностью. С февраля по май 2012 г. проводилось обследование по поводу подозрения на рак печени. Было получено гистологическое подтверждение в институте им. Герцена — развитие ГЦК в 5–6 сегментах печени. В августе 2012 г., после поездки в Крым у больного возникли острый простатит, уретрит, по поводу чего получал антибактериальную терапию. В конце августа — кровотечение из ВРВП с последующим их лигированием в ГКБ № 57. Повторное кровотечение из ВРВП возникло в октябре с дальнейшей госпитализацией в ЦКВГ, где дважды повторилось, несмотря на проводимую терапию. Пациент наблюдался и лечился в реанимационном отделении. Появились асцит, двусторонняя пневмония, лихорадка, лейкоцитоз. Для исключения острого панкреатита была выполнена диагностическая лапароскопия, при которой патологии выявлено не было. Состояние больного прогрессивно ухудшалось, и при нарастающем психомоторном возбуждении, прогрессирующей дыхательной и сердечно-сосудистой недостаточности 26.10.2012 г. была зафиксирована биологическая смерть.
Имело место расхождение диагнозов, категория II.
Проанализировав историю болезни, считаем справедливым заметить, что пациент по записи в истории болезни поступил в состоянии средней тяжести. Скорее всего, тяжесть состояния была недооценена: не учитывался длительный анамнез заболевания, повторные кровотечения из ВРВП, наличие ГЦР. В госпитале не было проведено лигирование вен пищевода, и мы считаем, что больного в первые же дни после поступления необходимо было переводить в специализированное отделение для проведения этой манипуляции и, возможно, пересадки печени.
Трудно оценить адекватность терапии, т. к. в посмертном эпикризе не указано лечение.
В клиническом посмертном эпикризе даже нет упоминания о наличии ГЦР, только упомянута гемангиома 4 сегмента печени, несмотря на то, что пациент предоставил все выписки предыдущих исследований.
При патологоанатомическом вскрытии отсутствуют данные о послойном исследовании ткани печени и наличии ГЦР, а также гистологическом исследовании на наличие опухоли.
Очень важно и крайне необходимо обсуждать все эти вопросы для исключения дальнейших ошибок в ведении и лечении таких сложных пациентов.
Для цитирования: van Nieuwkerk C.M.J., Rauws E.A.J., Tytgat G.N.J. и др. ДИАГНОСТИКА И ЛЕЧЕНИЕ ГЕПАТОЦЕЛЛЮЛЯРНОЙ КАРЦИНОМЫ: НОВЫЕ ПОДХОДЫ. РМЖ. 1997;10:4.
В обзоре рассматриваются вопросы скрининга, новые диагностические возможности и лечение резецируемой и нерезецируемой гепатоцеллюлярной карциномы (ГЦК). Авторы отмечают, что доля ГЦК, обнаруживаемых в ранней стадии, растет, следовательно, увеличивается и число пациентов, у которых в принципе возможна куративная резекция. При опухолях диаметром менее 5 см шансы на излечение после резекции хорошие. В случае наличия маленьких нерезецируемых ГЦК, ограниченных печенью, возможна ортотопная трансплантация печени, которая в комбинации с адъювантной химиотерапией также дает относительно хорошие результаты. В качестве паллиативного лечения может использоваться транскатетерная липидоловая химиоэмболизация печеночной артерии; хорошей альтернативой данному методу является чрескожное введение этинола в опухоль и окружающие ткани.
The review deals with the problems of screening, new diagnostic potentialities and treatment of resectable and unresectable hepatocellular carcinoma(HCC). The authors note that the proportion of early detectable HCC becomes high, thus increasing the numer of patients who may undergo curative resection.In tumors, less than 5cm in dimeter, potresectonal chances of recovery are goo. In small unresectable HCC limited by the liver, there may be orthotopic hepatic transplataton which in combination with adjuvant chemotherapy may also yield relatively good results. Transcatheter lipidol embolization of the hepatic artery may be used as palliative treatment; transcutaneous injection of ethnol into the thet umor and its adjacent tissues is a good alternativ to the above method.
Г-жа C.M.J. van Nieuwkerk, специалист по внутренним болезням; д-р. E.A.J. Rauws
и проф. д-р. G.N.J. Tytgat, гастроэнтерологи; д-р. J.W.A.J. Reeders, радиодиагност;
д-р. A.E. Jones, гепатолог; проф. д-р. D.J. Gouma, хирург.
University of Amsterdam, Academic Medical Centre, dep. of Gastrointestinal and Hepatic Diseases, Meibergdreef 9, 1105 AZ Amsterdam, Netherlands.
Г епатоцеллюлярная карцинома (ГЦК) - одна из гастроинтестинальных опухолей с плохим прогнозом. Распространенность варьирует от 2 на 100 000 населения в год в регионах с низким риском (Северо-Западная Европа и Северная Америка) до 30 на 100 000 населения в год в регионах с высоким риском (Юго-Восточная Азия и Южная Африка). Приблизительно в 70% случаев ГЦК сопровождается циррозом и, как правило, является следствием гепатита В или С. При естественном течении очень быстро наступает фатальный исход. Средняя выживаемость после постановки диагноза составляет в Азии всего 7 нед, в Европе - 15 нед, однолетняя выживаемость - 13%. При асимптоматической ГЦК диаметром менее 3 см естественное течение менее неблагоприятно; в некоторых наблюдения 2-летняя выживаемость составила 44 - 55%, 3-летняя - 13%. Благодаря интенсивному скринингу больных циррозом доля пациентов с резецируемыми опухолями возросла до 30%. В последние годы также появилось много данных о новых куративных и паллиативных возможностях лечения.
Цель данного обзора - показать, что ГЦК имеет менее фатальный прогноз, чем до сих пор было принято считать. Мы рассматриваем скрининг, новые диагностические возможности и лечение резецируемой и нерезецируемой ГЦК.
Благодаря интенсивному скринингу больных циррозом ГЦК все чаще выявляется в ранней стадии. Ежегодная заболеваемость ГЦК при циррозе составляет 3 - 6%; в исследовании Eurohep при компенсированном циррозе типа В по классификации Child через 5 лет после постановки диагноза частота ГЦК составила 6%. Согласно классификации Child, тяжесть болезни печени, определяемая на основании лабораторных показателей (уровень билирубина, альбумина и протромбиновое время) и клинического состояния (асцит и энцефалопатия), последовательно возрастает от класса А к классу С. У пациентов с циррозом степени А по Child, у которых в принципе возможна куративная резекция, рекомендуется каждые 6 мес проводить эхографию и определять концентрацию a-фетопротеина (АФП) в сыворотке. Как показало исследование Pateron и соавт., чувствительность и специфичность определения АФП составляют при уровне более 100 нг/мл соответственно 21 и 93%. Большой размер опухоли не всегда соответствует более высоким показателям, а уровень АФП от 50 до 400 нг/мл часто свидетельствует о наличии еще не обнаруживаемой ГЦК (однако может также указывать на регенерационную активность), в связи с чем частое проведение скрининга оправдано. Эхография - более чувствительный и специфичный метод: эти показатели составляют соответственно 78 и 93%. Данные литературы свидетельствуют о том, что 31% ГЦК диаметром менее 2 см не обнаруживаются при эхографическом исследовании. Дес-гамма-карбоксипротромбин (ДКП) является новым маркером опухоли для ГЦК.
Пока еще неясно, снижается ли смертность благодаря скринингу, представляется целесообразным осуществлять скрининговые обследования пациентов с высоким риском посредством эхографии, определения уровня АФП и, возможно, ДКП.
Диагностика
При эхографически выявленном очаге в печени и повышенном уровне АФП можно с уверенностью диагностировать ГЦК. В случае сомнения может быть выполнена цитологическая пункция. Для оценки точной локализации и распространенности опухоли обычно выполняют спиральную компьютерную томографию (КТ). Также может быть выполнена контрастная ангиография в сочетании с КТ. Для этого используется маслосодержащее контрастное вещество (йодированный жирно-кислотный этиловый эфир, липиoдол), которое селективно впрыскивается в a. hepatica, а затем задерживается в ткани ГЦК. В течение 3 нед липиодол вымывается из нормальных тканей, после чего проводится повторная контрольная КТ (см. рисунок). Этот метод не обладал 100% специфичностью, однако характеризуется высокой чувствительностью и является важным диагностическим средством для выявления мультифокальных и очень маленьких ГЦК. Для исключения наличия отдаленных метастазов должны быть выполнены рентгенограмма грудной клетки и сканирование костей. Если опухоль резецируема и резекция возможна у данного пациента (учитывая операционный риск, метастазы и состояние больного), может быть выполнена диагностическая лапароскопия с интраабдоминальной эхографией для исключения перитонеальных метастазов и мелких патологических очагов на противоположной стороне, а также для оценки степени тяжести цирроза, который часто уже определен по классификации Child. Стадию опухоли определяют по TNM или Okuda (табл.1).
Лечение резецируемых опухолей
Частичная резекция печени. Выживаемость после резекции определяется не только наличием или отсутствием оболочки опухоли и ее толщиной, величиной, числом, местом и прорастанием очагов, которые определяют объем резекции, но также функциональной остаточной способностью печени. Цирроз имеется у 70% больных с ГЦК. Оперативная смертность составляет менее 3% у пациентов без цирроза и 7 - 25% у пациентов с циррозом. При циррозе стадии Child A остаточная способность печени достаточна для выполнения резекции. При лечении пациентов с циррозом отдается предпочтение ограниченным сегментарным или клиновидным резекциям. Резекция противопоказана пациентам с циррозом степени Сhild C из-за высокого оперативного риска и короткой ожидаемой продолжительности жизни. В табл. 2 перечислены отдельные исследования, в которых изучали различные факторы риска, а также отражена выживаемость после частичной резекции печени. Однолетняя выживаемость составляет от 56 до 92%, а 5-летняя - от 22 до 66%. Однако необходимо помнить, что неясно, имеет ли ГЦК в Западной Европе такое же естественное течение, как и в Юго-Восточной Азии.
ГЦК резецируема лишь у 3 - 30% пациентов, и после резекции сохраняется высокий процент рецидива (57), вероятно, частично вследствие мультифокальности опухоли или наличия предзлокачественных очагов. Японские исследователи оценили эффект периоперативной селективной эмболизации a. hepatica, целью которой было уменьшение объема опухоли и ограничение объема резекции; предполагалось также, что таким образом можно уменьшить риск рецидива опухоли. Результаты не оправдали ожиданий. Эффективность пре- или постоперативной химиоэмболизации еще должна быть исследована.
Ортотопная трансплантация печени. В настоящее время в Европе приблизительно 12% пересадок печени (около 200 в год) проводится в связи со злокачественными опухолями, послеоперационная смертность составляет 8%. Культурные различия и малое количество доступных органов являются соопределяющими факторами при определении показаний к пересадке. Другим определяющим фактором является необходимость иммуносупрессии, которая, вероятно, связана с повышенным риском рецидива опухоли. Таким образом, показания к пересадке остаются противоречивыми и критерии для нее еще однозначно не определены. Общепринятыми показаниями к ортотопной пересадке печени являются маленькие опухоли (диаметр менее 3 см), которые не могут быть резецированы по анатомическим причинам (локализация в толще печени), а также маленькие ГЦК, которые технически можно резецировать, однако этому препятствуют функциональные ограничения (больные с циррозом).
Данные литературы трудно интерпретировать из-за плохой сравнимости групп пациентов. Выживаемость пациентов с маленькими уни- или бинодулярными опухолями (менее 3 см) после ортотопной трансплантации печени лучше, чем после резекции (5-летняя выживаемость составляет 83% против 18%; р < 0,001). С учетом этого уже были расширены показания к трансплантации. Недавно сообщалось о благоприятных результатах местной интраартериальной или системной химиотерапии, применявшейся в качестве дополнительного лечения, предшествовавшего трансплантации. Вероятно, в будущем показания к пересадке печени при ГЦК станут еще шире.
Лечение нерезецируемых опухолей
Большинство ГЦК обнаруживаются в поздней стадии, когда резекция часто уже невозможна из-за распространенности опухоли, прорастания в сосуды, тромбоза воротной вены, метастазов, возраста, общего состояния больного, наличия других внепеченочных заболеваний или недостаточного функционального резерва оставшейся неповрежденной части печени. Для этой группы пациентов возможно лишь паллиативное лечение. Ранее описаны многочисленные методы лечения; результаты их применения сильно различались, главным образом в неконтролированных исследованиях.
Таблица 1. Определение стадий ГЦК по системе Okuda
Таблица 2. Выживаемость пациентов с ГЦК после частичной резекции печени
Таблица 3. Выживаемость пациентов с ГЦК (1 очаг) после лечения чрескожными инъекциями этанол
Благодаря все более широкому проведению интенсивного скрининга больных циррозом доля ГЦК, обнаруживаемых в ранней стадии, растет. Ежегодная заболеваемость ГЦК при циррозе составляет 3 - 6%. У пациентов с циррозом стадии Child A, у которых в принципе возможна куративная резекция, рекомендуется каждые 6 мес проводить эхографическое обследование и определять уровень АФП. При уровне АФП от 50 до 400 нг/мл без обнаруживаемой ГЦК оправдан более частый эхографический скрининг. В качестве дополнительного метода обследования в большинстве случаев выполняется спиральная КТ. В диагностике сателлитной патологии важную роль играет липидоловая ангио-КТ. Диагностическая лапароскопия в комбинации с лапароскопической эхографией дает важную дополнительную информацию перед резекцией в отношении сателлитных опухолей в другой половине печени, перитонеальных метастазов и цирроза. Резекция показана жизнеспособным больным с резецируемыми ГЦК и с хорошей функциональной способностью остаточной части печени. При опухолях диаметром менее 5 см шансы на излечение после резекции хорошие.
При циррозе стадии Child B может быть выполнена ограниченная резекция, например сегментов II/III слева или периферийно справа (разделение на функциональные сегменты печени по Couinaud). Ортотопная трансплантация печени является альтернативным методом лечения при нерезецируемых ГЦК (маленьких), ограниченных печенью, главным образом, при циррозе стадии Child B. При таком лечении в комбинации с дополнительной химиотерапией прогноз относительно хороший. В качестве паллиативного лечения не всегда следует прибегать к транскатетерной липидоловой артериальной химиоэмболизации. Чрескожные инъекции этанола, характеризующиеся низкой частотой осложнений, представляются хорошей альтернативой. При нерезецируемых маленьких опухолях (менее 5 см) без внепеченочных проявлений при циррозе стадии Child A/B 3-летняя выживаемость при использовании этого метода составляет около 70%. При наличии нескольких мелких очагов (3 или менее) и при рецидивах после резекций этаноловая терапия также является хорошим выбором. Химио- и радиотерапия не дают хороших результатов, однако будущее, возможно, принадлежит иммунотерапии.
Возможности лечения как резецируемых, так и нерезецируемых ГЦК явно расширились. Новые методы лечения характеризуются гораздо меньшими заболеваемостью и смертностью, причем достигается более длительная выживаемость. Таким образом, прогноз при ГЦК не всегда столь безнадежен, как многие все еще думают.
Адрес для корреспонденции: г-жа C.M.J. van Nieuwkerk.
Взято из Ned Tijdschr Geneeskd 1996;140(17):922-6 с разрешения главной редакции и авторов.
Гепатоцеллюлярная карцинома (ГЦК) — это первичный рак печени, который развивается из паренхиматозных клеток органа.
Причины
Гепатоцеллюлярный рак в подавляющем большинстве случаев развивается на фоне имеющихся хронических заболеваний печени:
- Хронические вирусные гепатиты В и С. Ими страдают до 80% больных ГЦК. Наиболее опасен в этом плане гепатит С.
- Цирроз печени, неважно какой этиологии.
- Токсическое воздействие на печень алкоголя, афлатоксина – содержится в злаках и орехах при их неправильном хранении.
- Стеатогепатит.
- Метаболический синдром, диабет.
- Некоторые паразитарные инвазии печени, например, шистосомоз.
- Гемохроматоз.

При наличии хронического вирусного гепатита увеличивают риск развития гепатоцеллюлярного рака следующие факторы:
- Высокая вирусная нагрузка.
- Мужской пол и пожилой возраст.
- Пьянство.
- Ожирение.
- Цирроз печени.
- Инсулинорезистентный сахарный диабет.
Стадии
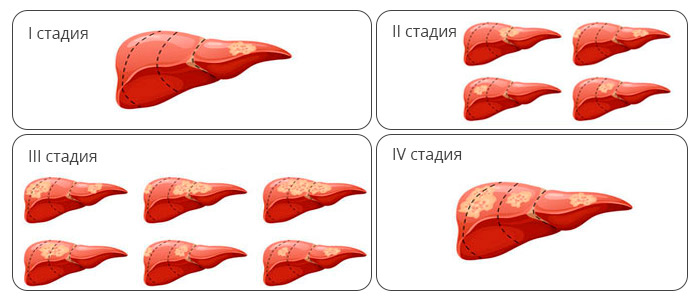
Стадирование гепатоцеллюлярного рака оценивают по системе TNM:
- 1 стадия — имеется одиночная опухоль, которая затрагивает только паренхиму печени. Она не прорастает ни в кровеносные ни в лимфатические сосуды.
- 2 стадия — одиночная опухоль, которая проросла в кровеносные сосуды. Ко второй стадии относятся и наличие нескольких опухолей, не превышающих в диаметре 5 см.
- 3 стадия. К ней относятся следующие варианты гепатоцеллюлярного рака: IIIa стадия — имеется насколько очагов опухоли, хотя бы один из которых превышает в размерах 5 см. IIIb — опухоль прорастает в крупные вены печени. IIIc — опухоль распространяется за пределы органа, поражая фиброзную оболочку печени или близлежащие ткани, но данных за наличие метастазов в регионарные лимфатические узлы или отдаленные органы нет.
- 4 стадия — имеются метастазы в регионарные лимфатические узлы или отдаленные органы.
Данная классификация учитывает только особенности распространения опухолевого процесса. Но гепатоцеллюлярная карцинома нередко приводит к нарушению работы незатронутой опухолью ткани печени. Кроме того, большинство опухолей развивается на фоне цирроза, что также необходимо учитывать при планировании лечения и прогнозах развития заболевания.
В зависимости от морфологических особенностей опухоли, выделяют следующие формы ГЦК:
- Узловая. Имеются единичные новообразования, которые при росте приводят к сдавлению паренхимы печени. По мере прогрессирования процесса, количество опухолей увеличивается.
- Массивная форма. Имеется несколько новообразований, как правило, они развиваются на фоне цирроза печени.
- Диффузная форма. Поражена вся печень, при этом невозможно установить какой узел был первичным.
- Комбинированный тип. Опухоль имеет признаки сразу нескольких типов ГЦК.

Симптомы
Общими симптомами гепатоцеллюлярной карциномы являются:
- Быстрое ухудшение состояния больного: значительная потеря веса, нарастающая слабость.
- Тяжесть и боль в области правого подреберья, по мере растяжения печеночной капсулы боль усиливается.
- Быстрое увеличение размеров печени, в ряде случаев ее нижний край может доходить до пупка.
- Желтуха.
- Расширение поверхностных вен живота.
- Асцит — скопление свободной жидкости в брюшной полости.
- Может быть потеря аппетита, тошнота, рвота.

Диагностика
Анализы
В рамках лабораторной диагностики назначается множество анализов, которые помогают в постановке диагноза, оценке печеночной функции, общего состояния пациента, эффективности лечения и своевременного обнаружения рецидива. Отслеживают следующие показатели:
- Уровень альфа-фетопротеина — этот маркер помогает в выборе лечения, а также отслеживании его эффективности.
- Печеночные пробы.
- Оценка работы кровесвертывающей системы — многие факторы свертывания крови вырабатываются печенью. При нарушении ее работы могут возникнуть серьезные проблемы с гемостазом.
- Электролитный баланс.
Методы визуализации опухоли:
- УЗИ — применяется для обнаружения карциномы. Регулярное УЗИ печени рекомендуют проходить всем пациентам из группы риска для своевременного обнаружения опухоли на стадии, когда она еще не дает клинической симптоматики.
- КТ и МРТ помогают уточнить локализацию и размер опухоли, а также ее взаимодействие с окружающими тканями (прорастание в кровеносные сосуды печени).
- Биопсия печени. Окончательный диагноз устанавливается только после изучения фрагмента опухоли под микроскопом. Чтобы получить такой материал, проводят биопсию — с помощью тонкой иглы, под контролем УЗИ или КТ производят забор кусочка опухолевой ткани и отправляют его в лабораторию для дальнейшего изучения.
Лечение
Гепатоцеллюлярная карцинома сложно поддается лечению традиционными для онкологии методами, поскольку помимо опухоли, присутствует поражение печеночной паренхимы.
Лучевая терапия
Лучевая терапия не нашла широкого применения при лечении рака печени. Дело в том, что высокие дозы ионизирующего излучения, необходимые для уничтожения опухоли, оказывают губительное действие на паренхиму органа, а это чревато серьезной печеночной недостаточностью.
Химиотерапия
Системная химиотерапия при первичном раке печени не оказывает существенного эффекта, не улучшает продолжительность жизни и ее качество, поэтому она практически не применяется или используется в рамках паллиативного лечения.
Более широкое распространение получила локальная терапия, при которой химиопрепарат подается непосредственно в опухоль. Это позволяет добиться высоких концентраций цитостатиков непосредственно в пораженном органе без системного воздействия на организм.
Существенным недостатком данного метода является то, что для введения препарата необходимо проводить операцию по катетеризации печеночной артерии, а по состоянию здоровья ее могут перенести далеко не все пациенты.
Из системной терапии применяется таргетное лечение препаратом сорафениб. Он прицельно действует на клеточные процессы, обеспечивающие жизнедеятельность злокачественных новообразований. Данное лечение назначается после определения молекулярно-генетического профиля опухоли.
Радиочастотная аблация
Аблационные методики являются методом выбора в случаях, когда у пациента имеется очаговая форма гепатоцеллюлярной карциномы при наличии противопоказаний к операции. Суть метода заключается в том, что в опухолевый очаг вводят радиоволновой электрод. При подаче на него радиоволн заданной частоты, происходит нагревание и деструкция опухолевой ткани, в итоге она погибает. Поскольку при нагревании происходит деструкция небольших фрагментов близлежащих тканей, это методику не рекомендуется применять на опухолях, расположенных вблизи кровеносных сосудов.
В качестве самостоятельного метода лечения радиочастотную аблацию применяют на опухолях, не превышающих в размере 3 мм. Если опухоль имеет большие размеры, используется комбинированное лечение, например, РЧА совместно с локальной химиотерапией.

Хирургическое вмешательство
В рамках хирургического лечения применяются следующие операции:
- Трансплантация печени. Является золотым стандартом лечения, но позволить себе его могут только высокоразвитые страны. В подавляющем большинстве случаев такой метод лечения не применяется ввиду дороговизны и малой доступности донорского материала. Во время операции удаляется часть печени вместе с опухолью. Данная операция подходит очень малому количеству пациентов, поскольку в большинстве случаев на фоне опухоли имеется поражение паренхимы органа и снижение его функции. Удаление части паренхимы еще больше усугубит состояние пациента. Кроме того, после операции часто развиваются рецидивы ввиду того, что печеночная ткань у таких больных изначально нездорова и склонна к малигнизации.
Процесс восстановления после лечения гепатоцеллюлярного рака зависит от метода лечения. Наиболее травматичное — резекция печени. Более щадящее — аблативные методики. В целом, период восстановления определяется исходным состоянием пациента.
Осложнения и рецидивы
Наиболее частыми осложнениями при печеночной карциноме является механическая желтуха и асцит. Кроме того, опухоли печени могут приводить к сдавлению печеночных протоков и нарушению оттока желчи, что сопровождается увеличением уровня билирубина в крови. Такое состояние называется механической желтухой, оно очень опасно для организма, поскольку билирубин является токсическим веществом, нарушает работу внутренних органов и может привести к смерти больного. Для борьбы с этим осложнением производят стентирование желчных протоков. С этой целью проводят специальную операцию, во время которой в просвет сужения желчного протока вставляют специальный каркас (стент), который будет поддерживать его в расправленном состоянии.
Асцит — состояние, при котором в брюшной полости скапливается свободная жидкость. В ряде случаев ее объем может достигать десятков литров. Для устранения этой жидкости проводится комплексное лечение:
- Лапароцентез — эвакуация жидкости через прокол стенки живота. На терминальных стадиях, когда жидкость образуется непрерывно и в больших объемах, устанавливают катетер для дренирования.
- Применение системной и внутриполостной химиотерапии.
- Назначение диеты с ограничением жидкости и соли.
Прогноз и профилактика
Гепатоцеллюлярная карцинома – это агрессивная опухоль с неблагоприятным прогнозом. При локализованных опухолях пятилетняя выживаемость колеблется в пределах 21%, при регионарных формах — 6%, а при наличии отдаленных метастазов всего 2%.
Поскольку известны причины возникновения заболевания, большая роль отводится его профилактике. И здесь выделяют два больших направления:
Читайте также:

