Гепатопротекторы при вирусном циррозе печени
Обновлено: 06.05.2024
Эссенциальные фосфолипиды широко применяются в России в качестве гепатопротекторов. Описываются основные функции фосфолипидов, механизмы их защитного действия при заболеваниях печени различной этиологии. Обсуждается эффективность применения таких препаратов, как силимарин, адеметионин, урсодезоксихолевая кислота, глицирризин, в частности препарат Фосфоглив. Последний как препарат с активным гепатопротективным действием рекомендуется использовать прежде всего в виде инъекций у пациентов с вирусными поражениями печени.
Патогенетические механизмы повреждения печени весьма многообразны, однако все они характеризуются клеточным повреждением, сопровождающимся воспалительной реакцией, цитолизом и развитием фиброза. Подобный сценарий развития патологического процесса, правда с разным инициирующим механизмом на старте, может развиваться при вирусных гепатитах, токсическом повреждении печени, аутоиммунном гепатите, метаболическом синдроме и других формах острого и хронического повреждения печени. При этом очевидно, что во всех упомянутых случаях центром органопатологии остается гепатоцит – основная клетка печеночной паренхимы. И если для ряда заболеваний, прежде всего вирусных гепатитов, на сегодняшний день разработана этиотропная терапия, способная оказывать и патогенетическое воздействие (доказанное уменьшение воспаления, цитолиза и фиброза под воздействием, например, интерферонов a или нуклеозидных аналогов), то в большинстве других случаев повреждения печеночной паренхимы доказательной базы в отношении эффективности применения различных групп лекарственных средств, претендующих на роль спасителя гепатоцита, пока не сложилось [6, 8, 10].
Тем не менее существует достаточно широкий спектр лекарственных средств, называющихся “гепатопротекторами”. Исходя из названия, данные препараты должны каким-то универсальным способом защищать печеночную клетку при самых различных механизмах повреждения [1]. Гепатопротекторы весьма гетерогенны по своему химическому составу и оказывают разнонаправленное, как следует из инструкций препаратов, воздействие на метаболические процессы. Несмотря на многолетний клинический опыт и многочисленные научные исследования (в большинстве случаев не отвечавшие принципам клинических исследований с высоким уровнем доказательности), границы применения гепатопротекторов до сих пор не очерчены. В данной публикации авторы постарались дать фармакологическую характеристику основных гепатопротекторов и оценить результаты их практического применения у пациентов с хроническими повреждениями печени [1, 6, 10].
В России данная группа лекарственных средств является основным видом гепатопротекторов, хотя в Европейском Союзе она малоизвестна широкому кругу практикующих врачей. Для понимания механизма защитного действия эссенциальных фосфолипидов следует учесть, что все клеточные мембраны имеют достаточно типичное строение и примерно на 75 % (мембрана митохондрий на 92 %) состоят из фосфолипидов, основу которых составляет фосфатидилхолин. Помимо структурной функции фосфолипиды участвуют в процессах молекулярного транспорта, делении и дифференцировке клеток, стимулируют активность различных ферментных систем [1]. Непосредственное повреждение клеточной мембраны вызывают этанол, некоторые яды и лекарственные препараты. В целом повреждение мембраны гепатоцитов происходит всегда и при любом печеночном повреждении, однако реализуется оно через более сложные и тонкие механизмы путем взаимодействия с циркулирующими иммунными комплексами, аутоантителами и др. В связи с этим рассчитывать на стабилизацию печеночного повреждения, лишь укрепляя клеточную мембрану гепатоцита путем поставки извне “строительного материала” (фосфолипидов), не устранив при этом основную патогенетическую причину гепатоцитарного лизиса, не приходится. Например, при классическом аутоиммунном гепатите или вирусном гепатите В, в основе которых лежат иммунные механизмы повреждения печени, совершенно очевидно, что основными этиопатогенетическими средствами будут кортикостероиды и/или цитостатики, а использование эссенциальных фосфолипидов в этих случаях представляется весьма эфемерным.
Основные функции фосфолипидов заключаются в поддержании нормальной текучести и репарации клеточных мембран, антиоксидантном действии, защите митохондриальных и микросомальных ферментов от повреждения, замедлении синтеза коллагена и повышении активности коллагеназы. Эти механизмы лежат в основе их физиологического антифибротического эффекта. С учетом основных механизмов этиопатогенеза различных заболеваний печени данная группа лекарственных средств может применяться, например, при алкогольном стеатозе печени и неалкогольной гепатопатии в рамках метаболического синдрома [1, 10].
Как показывают некоторые исследования, данная группа препаратов улучшает биохимические показатели, общее самочувствие больных, но в ряде случаев фосфолипиды могут индуцировать развитие холестаза [1, 5].
Силимарин. Комплексный препарат cилимарин содержит смесь алкалоидов расторопши пятнистой, основным действующим веществом является силибинин. Как следует из инструкции, препарат обладает гепатопротективными и антитоксическими свойствами. Механизм его действия связан с подавлением перекисного окисления липидов, вследствие чего предотвращается повреждение клеточных мембран. В гепатоцитах препарат стимулирует синтез белков и фосфолипидов, что приводит к стабилизации клеточных мембран и уменьшению их проницаемости. В итоге силимарин предотвращает потери компонентов клетки, в т. ч. трансаминаз, что клинически проявляется уменьшением цитолитического синдрома. Кроме того, силимарин препятствует проникновению в клетку некоторых гепатотоксических веществ, в частности ядов бледной поганки – фаллоидина и аманитина. Однако убедительных данных, демонстрирующих достоверное повышение выживаемости пациентов с острым токсическим гепатитом, вызванным бледной поганкой, на фоне приема силимарина в доступной литературе нет. В последнее время стали появляться работы, в которых обнаружены антифибротические свойства силимарина, правда, основным объектом этих исследований являются пациенты с метаболическими нарушениями и печеночным стеатозом [5, 8].
Адеметионин (S-аденозил-L-метионин) является природным веществом, эндогенно синтезируемым из метионина и аденозина. Адеметионин участвует по крайней мере в трех типах биохимических реакций: трансметилировании, транссульфурировании и синтезе полиаминов. Реакции трансметилирования являются важным этапом синтеза фосфолипидов (в первую очередь фосфатидилхолина), обеспечивающих текучесть мембран и их поляризацию, которая играет заметную роль в синтезе желчи. Нарушение транссульфурирования приводит к дефициту глутатиона – важнейшего клеточного антиоксиданта. Недостаток глутатиона снижает устойчивость гепатоцитов к повреждающему действию свободных радикалов. Помимо этого адеметионин служит предшественником других тиоловых соединений, таких как цистеин, таурин, коэнзим А. Наконец, третья группа реакций, в которой принимает участие адеметионин, – синтез полиаминов – имеет непосредственное отношение к процессам пролиферации гепатоцитов и регенерации печени. Экспериментальные и клинические данные свидетельствуют об антиоксидантном и детоксицирующем действии адеметионина, а также об ускорении под его влиянием регенерации печеночной ткани и замедлении развития фиброза.
Наиболее убедительные клинические результаты применения адеметионина получены при алкогольной болезни печени. На фоне применения адеметионина у больных алкогольным циррозом отмечено повышение исходно сниженных концентраций глутатиона, цистеина и таурина в сыворотке крови и ткани печени, что свидетельствует о нормализации метаболических процессов. Известно, что основной токсический продукт метаболизма этанола ацетальдегид блокирует систему восстановления глутатиона, что обусловливает повреждение гепатоцитов продуктами перекисного окисления липидов. Адеметионин, являясь донатором сульфгидрильной группы, способствует ликвидации дефицита глутатиона. Помимо достоверного снижения уровня сывороточного билирубина, трансаминаз и g-глутамилтранспептидазы имеются предварительные данные о статистически значимом повышении выживаемости больных алкогольным циррозом.
Другая область применения адеметионина – холестатические заболевания печени, при которых удается достичь значительного уменьшения зуда и снижения ферментов холестаза. Имеются сведения о выраженном положительном эффекте адеметионина при лекарственном холестазе. Кроме гепатопротективных свойств адеметионин обладает также антидепрессивным эффектом, механизм которого далек от полного понимания [1, 5, 8].
Урсодеоксихолевая кислота (УДХК) – вещество, относящееся к группе гидрофильных желчных кислот. Механизмы действия УДХК сложны и на сегодняшний день окончательно не изучены. Наиболее вероятными представляются цитопротективный и холеретический эффекты вследствие конкурентного ингибирования всасывания токсических гидрофобных желчных кислот в подвздошной кишке. Как было установлено, цитопротективное влияние УДХК на клетки билиарного эпителия реализуется путем предотвращения выхода цитохрома С из митохондрий, что в свою очередь блокирует активацию апоптоза холангиоцитов и каспаз. УДХК обладает также иммуномодулирующим действием, уменьшая экспрессию молекул HLA (Human Leucocyte Antigen) I и II классов на клетках билиарного эпителия и снижая продукцию провоспалительных цитокинов (интерлейкинов -1, -2, -6, интерферона-гамма). УДХК снижает насыщенность желчи холестерином за счет угнетения его абсорбции в кишечнике, подавления синтеза в печени и уменьшения секреции в желчь; повышает растворимость холестерина в желчи посредством образования жидких кристаллов; снижает литогенный индекс желчи, увеличивая содержание в ней желчных кислот. Столь разнообразные механизмы действия вызваны многообразием показаний к назначению УДХК.
При первичном билиарном циррозе УДХК является препаратом выбора, не только улучшающим клинические (уменьшение слабости, зуда, желтухи), биохимические (снижение ферментов цитолиза и холестаза) и гистологические (уменьшение воспаления ткани печени) показатели, но и увеличивающим продолжительность жизни больных, что продемонстрировано в многочисленных клинических исследованиях [1, 5, 8]. Назначение препарата патогенетически обосновано при заболеваниях, сопровождающихся внутрипеченочным холестазом, таких как первичный склерозирующий холангит, хронический гепатит с холестатическим компонентом (особенно алкогольный и лекарственный), муковисцидоз, атрезия внутрипеченочных желчных путей, посттрансплантационный холестаз, холестаз при парентеральном питании. Кроме того, УДХК применяют с целью растворения холестериновых желчных камней и при билиарном рефлюкс-гастрите.
Глицирризиновая кислота. Первое упоминание о лечебных свойствах этого соединения встречается еще в папирусах древнеегипетского врача Эберуса, где он сообщает о лечебных свойствах солодки, применявшейся при ряде заболеваний. В середине прошлого века чешский ученый Л. Ружичка расшифровал химическую структуру глицирризиновой кислоты, подчеркнув ее сходство со стероидной структурой. Глицирризин представляет собой кальциевую или калиевую соль трехосновной глицирризиновой кислоты, агликоном которой является глицирретовая кислота, а углеводная часть представлена двумя молекулами глюкуроновой кислоты. К настоящему времени описаны противовоспалительное, антиаллергическое, антивирусное и иммуномодулирующее свойства этого соединения. Впервые об антивирусном действии глицирризина в отношении вируса простого герпеса (herpes simplex), вируса ветряной оспы (varicella zoster) и др. сообщили Pompei R. и соавт. Исследования вначале проводились in vitro, а впоследствии эти данные были подтверждены на лабораторных животных другими исследователями, в частности в отношении вирусов гепатитов А (HAV) и В (HBV) уток [3, 4].
Takahara T. и соавт. изучали влияние глицирризина на HBV. Установлено, что глицирризиновая кислота модифицирует гликозилирование и сиалирование поверхностного антигена вируса гепатита В (HBsAg), приводя к его задержке в аппарате Гольджи, чем, видимо, и объясняется его положительное влияние при лечении HBV-инфекции [11]. Механизмы антивирусного действия глицирризина при HCV-инфекции до настоящего времени остаются неизвестными. Однако стимуляция глицирризином синтеза интерферона-гамма с последующей активацией макрофагов и В-лимфоцитов, усилением фагоцитоза и продукцией антител, активацией NK-клеток, несомненно, вносит вклад в течение хронического гепатита С. В то же время ингибирование глицирризином протеинкиназы Р влечет за собой угнетение фосфорилирования белков, кодируемых вирусом в инфицированных клетках, вызывает цитотоксичность, опосредованную CD4 +
Т-клетками и фактором некроза опухоли альфа. Глицирризин рецепторных участков мембраны ингибирует проникновение вируса в клетку за счет блокирования углеводных ферментов, что указывает на возможное подавляющее действие непосредственно на РНК вируса (HCV RNA) [8, 9]. Кроме того, Abe Y. и соавт. сообщают, что в отличие от интерферона-альфа, ингибирующего позднюю стадию цикла репликации вируса, глицирризиновая кислота активна на его ранней стадии [3].
Результаты клинических исследований эффективности применения глицирризиновой кислоты у больных хроническими гепатитами остаются неоднозначными. Во-первых, практически отсутствуют рандомизированные плацебо-контролируемые исследования, во-вторых, в большинстве работ не учитывается влияние глицирризиновой кислоты на вирусную нагрузку и гистологию печени, в-третьих, не получен стойкий ответ на применение глицирризина и отсутствуют данные об эффективности его применения по сравнению с интерфероном-альфа. Наибольший опыт практического использования глицирризина, по данным литературы, имеют японские врачи, однако очевидно, что глицирризин обладает доказанным позитивным действием в отношении уменьшения риска развития гепатоцеллюлярной карциномы у пациентов с хроническими вирусными гепатитами, особенно не отвечающих на лечение интерфероном альфа [7, 12, 13].
Чрезвычайно интересным в этом смысле является недавняя публикация немецких исследователей о результатах II фазы слепого плацебо-контролируемого рандомизированного исследования эффективности применения глицирризина у пациентов с хроническим гепатитом С, не ответивших ранее на противовирусную терапию интерфероном-альфа. В нем продемонстрирован очень быстрый биохимический ответ (через две недели лечения), правда без существенного влияния на виремию. У части пациентов через 6 месяцев терапии проведено гистологическое исследование печени, однако достоверного влияния препарата на степень фиброза выявлено не было [9]. В то же время III фаза клинических исследований, где использование глицирризина продолжалось не менее 12 месяцев, продемонстрировала наряду с безусловным биохимическим ответом на лечение более чем 78 % пациентов редукцию фиброза у 2/3 этих пациентов [2].
Отечественной лекарственной формой глицирризина является препарат Фосфоглив, состоящий из фосфолипидов, получаемых из бобов сои или семян подсолнечника, и собственно глицирризина. Для повышения биодоступности фосфолипидов впервые в производстве препаратов подобной группы использованы, по сути, нанотехнологии. Препарат можно рассматривать как эквивалент японского препарата Неоминофаген, но в отличие от последнего Фосфоглив выпускается в двух лекарственных формах – таблетках и порошке для приготовления раствора. Наиболее перспективна инъекционная лекарственная форма препарата, продемонстрировавшая эффективность в отношении достаточно быстрой редукции цитолиза и иммунного воспаления у пациентов с хроническими вирусными гепатитами. Это, по мнению автора, объясняется именно действием глицирризина, содержание и биодоступность которого в инъекционной форме выше. Таблетированную же форму препарата можно отнести к средствам, содержащим фосфолипиды, поскольку количество глицирризина, заявленное производителем в таблетированной форме, а также особенности фармакокинетики и фармакодинамики глицирризина, введенного перорально, не предполагают выраженного биохимического ответа.
Собственный опыт применения Фосфоглива и опыт коллег позволяют позиционировать его как препарат с активным гепатопротективным действием, прежде всего у пациентов с вирусными поражениями печени, в качестве дополнительного средства к стандартному противовирусному лечению либо в качестве основного и, увы, единственного средства для пациентов, которым противовирусное лечение интерфероном-альфа не показано в силу каких-либо причин (хронический гепатит С при трансплантированной почке, далеко продвинутая стадия вирусного гепатита и т. д.) [2].
Кроме того, практически все исследователи подчеркивают, что назначение препарата Фосфоглив на фоне традиционной противовирусной терапии интерфероном-альфа в значительной степени минимизирует побочные эффекты последнего. Фосфоглив должен применяться длительно, пациента следует ориентировать на терапию сроком от года и более. При этом необходимо контролировать уровень артериального давления и содержание калия в сыворотке крови, поскольку глицирризин способен вызывать у части пациентов симптомы гиперальдостеронизма, которые, однако, быстро и надежно купируются минимальными дозами спиронолактона в день инъекции и на следующий день после нее. Длительное введение Фосфоглива в виде инъекций не вызывает развития флебита, что, по-видимому, связано с выраженным противовоспалительным действием препарата.
Безусловно, эффективность Фосфоглива у пациентов с хроническими диффузными заболеваниями печени, прежде всего вирусными, необходимо изучать. С учетом стероидоподобных химической структуры и биологического действия глицирризина, на наш взгляд, было бы чрезвычайно интересным изучить действие инъекционной формы препарата Фосфоглив у пациентов с атаками острого алкогольного гепатита или аутоиммунным гепатитом.
Несмотря на достаточно широкий спектр препаратов с гепатопротективными свойствами, назначать их нужно взвешенно и строго дифференцированно. Необходимо не только четко представлять химическую структуру конкретного препарата, но и знать результаты его использования как по данным литературы, так и с учетом опыта коллег. В этом случае гепатопротективные препараты получат действительно объективную оценку профиля эффективности и безопасности.
Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов.

Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов. Медленное нарастание фиброза при ХГ С наблюдается у женщин молодого возраста в отсутствие таких факторов, как стеатоз печени, синдром перегрузки железом, злоупотребление алкоголем. Ряд причин обусловливает быстрое формирование ЦП: пожилой возраст при инфицировании, мужской пол, систематическое употребление алкоголя более 50 г/сут, наличие коинфекции вирусов гепатита В и/или ВИЧ, избыточная масса тела (> 28 кг/мІ), гетерогенность по гену гемохроматоза, полиморфизм генов ряда цитокинов, играющих ключевую роль в фиброгенезе. Среднее время развития ЦП у лиц, инфицированных в возрасте после 40 лет и злоупотребляющих алкоголем, составляет 13 лет, а у молодых женщин в отсутствие приема алкоголя ЦП формируется через 42 года. У 32% больных ХГ С протекает стабильно и не сопровождается прогрессированием болезни.
Важным фактором фиброгенеза является сохраняющаяся активность ХГ С по лабораторным данным и морфологическим признакам. У больных со стойко нормальным уровнем трансаминаз сыворотки риск развития ЦП С составляет 5%, в то время как наличие 3–5-кратного повышения АЛТ сыворотки ассоциируется с быстрым формированием ЦП С у 50% больных. Показано также, что факторами риска прогрессирования фиброза являются: наличие фиброза в ткани печени при первой биопсии, стеатоз печени и возраст больных. Быстрота прогрессирования фиброза определяется предшествующим фиброзом, стеатозом и лобулярным гепатитом [1]. При ХГ С низкой степени активности (ИГА по Knodell 4–8 баллов) риску развития ЦП С подвержены 7–10% больных, при ХГ С высокой степени активности (ИГА — более 13 баллов) у 71% больных цирроз может развиться уже через 7 лет. Проспективное изучение 404 больных компенсированным ЦП С показало, что за 85,7±36 мес наблюдения у 28% больных развивается хотя бы одно осложнение ЦП С, в том числе гепатоцеллюлярная карцинома (ГЦК) — у 19%, асцит — у 17%, кровотечение из варикозно расширенных вен пищевода (ВРВП) — у 5%, декомпенсация ЦП С (Чайлд В/С) — у 17%, энцефалопатия — у 2% [2].
Высокая частота развития ЦП С при хронической HCV-инфекции и риск серьезных осложнений в этой группе больных определяют задачи противовирусной терапии (ПВТ). Основная задача лечения — эрадикация вируса гепатита С и достижение стойкой ремиссии ХГ С, однако возможности достижения устойчивого вирусологического ответа (УВО) у больных ЦП С значительно ниже, чем при ХГ С. Исследования последних лет показали, что ПВТ способствует уменьшению выраженности фиброза, поэтому у больных ЦП С без вирусологического ответа целью противовирусного лечения является замедление прогрессирования болезни, снижение риска декомпенсации ЦП и развития его осложнений, в том числе ГЦК, В-клеточной лимфомы, криоглобулинемии, внепеченочных проявлений, портальной гипертензии и печеночно-клеточной недостаточности.
Представляют интерес исследования M. Curry и соавторов (2005), изучивших влияние длительной терапии пегинтерфероном α-2b в малых дозах на динамику портальной гипертензии у больных ХГ С со стадией фиброза F3 и ЦП С (F4). В исследование COPILOT были включены 267 больных, получавших колхицин 0,6 мг 2 раза в день, и 270 больных, которым проводится лечение пегинтроном 0,5 мкг/кг 1 раз в неделю в течение 4 лет. Обе группы были представлены больными, не ответившими на комбинированную терапию интерфероном и рибавирином. 83% больных в каждой группе имели ЦП С, у 40% из них имелись признаки портальной гипертензии, выявленные при эндоскопии (ВРВП или портальная гастропатия). ЭГДС проводилась с интервалом в 2 года. Опубликованы предварительные результаты исследования.
У 5 больных ЦП С, не получавших β-блокаторы с целью коррекции портальной гипертензии, до лечения пегинтроном провели измерение портального давления. Спустя 2 года лечения при повторной ЭГДС новые ВРВП появились у 11 из 66 больных, получавших колхицин, и сохранялись у 5 из 66 больных, получавших монотерапию пегинтроном. У всех 5 больных первоначальное портальное давление составляло 15 мм рт. ст., через 24 нед лечения составило в среднем 6 мм рт. ст. Кровотечение из ВРВП через 2 года отмечено у 11 (9%) больных, получавших колхицин, и у одного (1%) больного, получавшего пегинтрон. Асцит и печеночно-клеточная недостаточность также чаще выявлялись при лечении колхицином (20 больных), чем пегинтроном (13 больных). Таким образом, длительное лечение малыми дозами пегинтрона больных ЦП С может замедлить формирование ВРВП, снизить портальное давление, предотвратить кровотечение из ВРВП и другие осложнения портальной гипертензии у больных ЦП С, не достигших УВО на предшествующую комбинированную терапию интерфероном и рибавирином [3].
В последние годы ПВТ претерпела существенные изменения: с 2000 г. комбинированная терапия пегилированными интерферонами α-2a и 2b и рибавирином заняла ведущие позиции в лечении ХГ С и компенсированного ЦП С. Изучены прогностические факторы ответа на лечение, появились возможности коррекции ряда побочных эффектов ПВТ, что позволило достичь УВО у 56–63% больных ХГ С, включенных в лечение. Приверженность больных к лечению, адекватные дозы препаратов и длительность ПВТ позволяют повысить УВО до 72–75% [4, 5]. Наибольший эффект комбинированной терапии ХГ С отмечается у больных с генотипами 2 или 3 HCV: непродолжительный курс лечения (24 нед) при высокой приверженности к лечению пегилированными ИФН α и рибавирином позволяет достичь успеха в 84–94% случаев.
Несмотря на достижения последних лет, остаются категории трудных для лечения больных ХГ С, к которым относятся пациенты с генотипом 1 HCV и высокой вирусной нагрузкой и больные ЦП С.
Генотип 1 HCV и высокая вирусная нагрузка оказались независимыми прогностическими факторами слабого ответа на лечение. Причины этого до конца не ясны. Изучается значение мутаций в E2 и NS5A генах HCV (неструктурный регион NS5A определяет чувствительность к интерферону). Элиминация гепатоцитов, инфицированных генотипом 1 HCV, в процессе ПВТ происходит медленнее, чем при других генотипах. В первые 1–2 нед терапии вирусная нагрузка снижается на 1,6 log копий/мл при генотипе 1 HCV и на 2,9 log копий/мл при генотипе 2. Скорость гибели инфицированных гепатоцитов составляет 0,1 в день у больных с генотипом 1 и 0,26 в день при генотипе 2, что объясняется различиями в иммунном ответе у больных и дает основание для обсуждения необходимости более агрессивной и, возможно, более длительной ПВТ при генотипе 1 HCV [5].
Стратегия лечения больных ЦП и ХГ С, инфицированных генотипом 1 HCV и имеющих высокую вирусную нагрузку, тесно связана. УВО при лечении ИФН α в стандартном режиме больных ХГ С с генотипом 1 HCV не превышает 10% независимо от сроков лечения — 24 или 48 нед. При использовании комбинированной терапии (ИФН α/рибавирин) в течение 48 нед УВО у таких больных возрастает до 28–36%, оставаясь значительно ниже УВО при генотипах 2 и 3 HCV (64–79%). Лечение ХГ С с генотипом 1 HCV в течение 48 нед дает более высокие результаты (46–52%), чем 24 нед (29–42%). Таким образом, генотип вируса HCV определяет стратегию ПВТ ХГ С и ЦП С.
Уровень вирусной нагрузки, как и генотип вируса, не влияет на вариант и тяжесть течения ХГ C. Высокая вирусная нагрузка (более 2х10 6 копий/мл или более 800 000 МЕ/мл) может быть выявлена при хроническом гепатите низкой, умеренной, высокой степени активности, при минимальных изменениях в печени или при ЦП С. Однако уровень виремии отчетливо влияет на частоту достижения УВО: пегилированный ИФН α-2b 1,5 мкг/кг 1 раз в неделю в комбинации с рибавирином в дозе 800 мг/сут при высокой вирусной нагрузке обеспечивает УВО в 42% случаев, а при низкой — в 78%.
В последние годы разработан метод оценки успеха терапии на основании изучения вирусной кинетики на ранней стадии ПВТ. Ранний вирусологический ответ позволяет прогнозировать УВО. Высокая приверженность больных ХГ C к лечению и оценка прогноза ПВТ на основании данных раннего вирусологического ответа на 4-й или 12-й неделе позволили повысить результативность терапии в группе всех леченных больных ХГ С до 90%. Отказ от стандартных схем лечения ИФН α (3 млн МЕ 3 раза в нед) с переходом на комбинированную ПВТ также способствует повышению количества больных с ранним вирусологическим ответом.
Изучение раннего вирусологического ответа на основании количественного анализа HCV-РНК с помощью высокочувствительной ПЦР позволяет идентифицировать больных, которые не ответят на ПВТ. Если после 12-недельной ПВТ пегилированными ИФН α и рибавирином уровень HCV-РНК снизился на два и более десятичных логарифмов, но РНК вируса по-прежнему выявляется в крови, то целесообразно продолжить ПВТ еще в течение 12 нед, а затем провести повторное исследование HCV-РНК. При его отрицательном результате УВО колеблется от 42 до 78% в зависимости от вирусной нагрузки. Представляется целесообразным 72-недельный курс ПВТ, т. е. продление лечения до 1,5 лет, что позволяет значительно улучшить результаты лечения. При сохраняющейся виремии с падением ее уровня на 12-й неделе менее чем на два десятичных логарифма УВО составляет от 0 до 5%, что позволяет уже на ранних этапах либо отказаться от бесперспективной терапии при генотипе 1 HCV, либо модифицировать ее, либо перейти на поддерживающую терапию пегилированным ИФН α-2а (90 мкг) или ИФН α-2b (0,5 мкг/кг) с целью замедления прогрессирования ЦП С и профилактики развития ГЦК и лимфомы.
Тройная схема комбинированной ПВТ с включением помимо пегилированного ИФН α и рибавирина 200 мг амантадина не имеет преимуществ перед обычной схемой в лечении ХГ C генотипа 1b с высокой вирусной нагрузкой.
Обоснованием для лечения ХГ C с продвинутой стадией фиброза или сформировавшимся ЦП С стали данные о снижении риска декомпенсации ЦП и развития ГЦК, а также регрессе фиброза у 60% больных, получающих ПВТ. Наличие портального фиброза или ЦП С считается независимым фактором низкой частоты УВО у HCV-инфицированных больных. Пациенты с ЦП C обычно плохо отвечают на стандартную монотерапию ИФН α: УВО составляет от 5 до 20%. Эффективность комбинированной терапии ИФН α и рибавирином составила в этой группе 5–29%. Применение пегилированных ИФН α в составе комбинированной терапии компенсированного ЦП C или ХГ С с мостовидным фиброзом позволило повысить УВО до 44–50%.
Следует отметить, что даже при монотерапии пегилированным ИФН α можно достигнуть гистологического улучшения у 54% больных компенсированным ЦП С. В сравнительном исследовании эффективности пегилированных ИФН α-2a и 2b у больных ЦП C наличие мостовидного фиброза являлось отрицательным прогностическим фактором достижения раннего вирусологического ответа. В конце 24-недельной ПВТ вирусологический ответ в 1-й группе больных ЦП C составил 83%, во 2-й — 60%. Таким образом, пегилированный ИФН α-2a может быть препаратом выбора в комбинированной терапии ЦП C [8]. Даже при отсутствии вирусологического ответа на комбинированную ПВТ при ЦП C отмечается улучшение гистологической картины в печени (снижение ИГА и ГИС).
Наиболее значимое улучшение морфологических данных имеет место при достижении УВО, что сопровождается улучшением качества жизни больных ЦП С, несмотря на наличие продвинутой стадии болезни. Интерес представляют данные Poynard и соавторов (2000), наблюдавших 3010 больных ХГ С с повторной биопсией печени (до начала ПВТ и спустя 6–12 мес после ее окончания) при использовании различных режимов лечения: монотерапии ИФН α-2b, комбинированной ПВТ ИФН α или пегилированным ИФН α-2b и рибавирином в течение 48 нед. Более чем у трети больных, у которых был достигнут УВО, улучшилась гистологическая картина (ГИС и ИГА) в печени, морфологическая динамика отмечена также у трети больных без вирусологического ответа [9]. Анализ биопсий печени у больных ХГ С, участвовавших в четырех многоцентровых исследованиях, показал, что у 75 (49%) из 153 пациентов ЦП С после окончания терапии ГИС (уровень фиброза) снизился на 1–3 балла, что позволяет говорить о возможности регресса фиброза при ЦП С под влиянием настойчивой целенаправленной ПВТ [10].
В последние годы предпринимаются попытки противовирусного лечения декомпенсированного ЦП С (Чайлд В и С). Известно, что 40% всех ортотопических трансплантаций печени проводится в связи с ЦП С. Больные с сохраняющейся виремией имеют высокий риск реакций отторжения трансплантата и инфицирования донорской печени вирусом гепатита С с быстрым развитием (в течение 5–7 лет) ЦП С и/или ГЦК в пересаженной печени. В 2003–2004 гг. появились первые публикации использования ПВТ малыми дозами интерферона и рибавирина при декомпенсированном ЦП С у кандидатов на трансплантацию печени. Предлагается начинать лечение ИФН α 3 млн МЕ ежедневно и рибавирином 800 мг/сут за 4 мес до предполагаемой операции. Режим ежедневного введения интерферона позволяет уменьшить частоту гриппоподобного синдрома, лечение в течение 4 мес позволяет добиться максимального снижения виремии (до операции). У 9 (30%) из 30 больных декомпенсированным ЦП С (Чайлд В или С) удалось достичь вирусологического ответа на 12-й неделе, у 6 из них (20%) авиремия сохранялась после трансплантации печени [11]. Аналогичные данные о возможности развития УВО в 18–20% случаев декомпенсированного ЦП С опубликованы рядом авторов, длительность наблюдения за такими больными продолжается более 3,9 лет.
Известно, что употребление алкоголя значительно повышает смертность при вирусных ЦП: пятилетняя выживаемость больных достигает лишь 43%, значительно отличаясь в группах ЦП Чайлд А (66%), Чайлд В (50%) и Чайлд С (25%). При продолжающемся приеме алкоголя риск смерти у больных ЦП С повышается в случае наличия таких факторов, как пожилой возраст, печеночно-клеточная дисфункция (Чайлд В или С), желудочно-кишечное кровотечение, коинфекция (HBV, HCV), курение и отсутствие признаков острого алкогольного гепатита при биопсии печени. Среди механизмов влияния алкоголя на прогрессирование HCV-инфекции отмечают активацию репликации, повышение разнообразия квазивидов и мутаций вируса, усиление апоптоза гепатоцитов, подавление иммунного ответа хозяина, нарастание стеатоза и уровня железа в печени. Все это ведет к быстрому развитию болезни, высокой частоте формирования ЦП С и ГЦК и низкой эффективности интерферонотерапии. Эффективность ПВТ при ХГ С у лиц, употребляющих алкоголь, в 3 раза ниже стандартных показателей УВО: при монотерапии ИФН УВО снижается до 7–8% по сравнению с 25% у больных, не употребляющих алкоголь; при комбинированной терапии — до 12–4% по сравнению с 41%. Не существует безопасных доз алкоголя для больных ХГ С. Рекомендуется полный отказ от его приема за 6 мес до предполагаемой ПВТ, что улучшает результаты противовирусного лечения, однако УВО не достигает показателей, свойственных больным, не употреблявшим алкоголь в прошлом. Возврат к приему алкоголя после окончания ПВТ повышает риск обострения ХГ С и возврата виремии.
У больных ХГ С на стадии цирроза или при наличии мостовидного фиброза (F3) риск развития побочных эффектов интерферонотерапии выше, чем при менее продвинутых стадиях фиброза. Показано, однако, что частота их выявления и необходимость прекращения ПВТ существенно не отличаются в группах больных, леченных пегилированным ИФН α или ИФН α в стандартном режиме. Пегилированный ИФН α-2а обладает более выраженным миелосупрессивным действием, чем ИФН α-2b. Гематологическая токсичность при применении пегилированных ИФН α проявляется в первые 4 нед лечения, затем достигается устойчивый уровень лейкоцитов и тромбоцитов. Особенно быстро их число снижается после первой дозы препаратов. ПВТ назначают больным компенсированным ЦП С с уровнем лейкоцитов 3000/ммЁ и тромбоцитов 50 000/ммЁ. При снижении уровня нейтрофилов до 600/ммЁ, а уровня тромбоцитов до 20 000/ммЁ ИФН α отменяют.
Модификация дозы пегилированного ИФН α или рибавирина (снижение дозы или отмена препарата) в связи с побочными эффектами отмечена у 50% больных ЦП С. В зависимости от достижения раннего вирусологического ответа на 12-й неделе лечения предложены различные варианты лечения ЦП С: продолжение комбинированной терапии в максимально эффективных дозах в течение 36 нед при достижении раннего вирусологического ответа; лечение небольшими дозами пегилированного ИФН α-2b (0,5 мкг/кг) в течение 5 лет при отсутствии такого ответа на 4-й нед (EPIC3) или малыми дозами пегилированного ИФН α-2а (90 мкг) в течение 4 лет (HALT-С).
Определены показания к повторным курсам ПВТ: наличие генотипов 2 или 3 НСV; частичный ответ при предшествующем курсе ПВТ, F3- и F4-стадии фиброза. Противопоказаниями к повторным курсам лечения являются: пожилой возраст, генотип 1, ЦП С с гипербилирубинемией, высокая вирусная нагрузка, высокий индекс массы тела, минимальные изменения в печени при биопсии (ИГА менее 4 баллов) и продолжающееся употребление алкоголя или наркотиков.
Таким образом, ПВТ компенсированного и декомпенсированного ЦП при ХГ С решает ряд следующих задач: замедление декомпенсации цирроза, снижение смертности от его осложнений (кровотечение из варикозно расширенных вен, печеночно-клеточная недостаточность и т. д.), предотвращение развития ГЦК и профилактику реактивации инфекции после трансплантации печени, а также улучшение качества жизни больных и обеспечение их социальной реабилитации. Несомненно, что на ранних стадиях HCV-инфекции ПВТ дает лучшие результаты: частота УВО при лечении острого гепатита С достигает 90%, ХГ С — 60–70%, что превышает эффективность лечения ЦП С пегилированными ИФН α и рибавирином (30–50%). Наш опыт ПВТ ХГ С низкой степени активности позволяет говорить о высокой эффективности лечения данной категории больных. Используя пегилированный ИФН α-2b (1,5 мкг/кг) и рибаверин (более 10,6 мг/кг) при лечении первичных больных с небольшим сроком заболевания (5,9±5,7 лет), преимущественно низкой степени активности и слабым фиброзом (F1), а также низкой вирусной нагрузкой, мы получили устойчивый вирусологический ответ в 86 % случаев, в том числе у 77% пациентов с генотипом 1 HCV, включая 5 больных на стадии ЦП С [12].
Литература
Т. Н. Лопаткина, кандидат медицинских наук, доцент
Цирроз – это тяжелое заболевание печени, которое выражается в постепенном замещении её функциональных клеток, гепатоцитов, клетками фиброзной (соединительной) ткани. По мере того, как число гепатоцитов сокращается, печени становится все труднее справляться со своими главными обязанностями – углеводно-липидным обменом и очищением организма от токсинов. Поэтому больной циррозом человек приобретает желтушный цвет лица и масштабные сбои в работе всей пищеварительной системы.
При циррозе печени меняется размер, форма, плотность и внутренняя структура органа. Фиброзные волокна пронизывают и сжимают печень, а выжившие гепатоциты усиленно размножаются, пытаясь компенсировать дефицит. В результате печень становится маленькой, твердой и бугристой, но это ещё не самое страшное. Хаотичный рост гепатоцитов нередко приводит к мутации их клеточной структуры, и тогда они превращаются в раковые клетки.
Существует несколько типов цирроза печени, в зависимости от причин, вызвавших заболевание:
Вирусный цирроз выступает осложнением вирусного гепатита;
Застойный цирроз обусловлен венозным застоем в печени из-за хронической сердечной недостаточности;
Билиарный цирроз связан с закупоркой желчных протоков;
Алкогольный цирроз является результатом длительного злоупотребления спиртным;
Токсический цирроз развивается под действием лекарств или ядов, разрушающих печень;
Идиопатический цирроз называется так потому, что не имеет объяснимой причины.
Медикаментозное лечение цирроза печени
От типа и стадии заболевания зависит тактика консервативного лечения цирроза:
Неактивная компенсированная стадия цирроза печени не требует назначения никаких лекарственных препаратов, кроме витаминных комплексов. Больному показана диета и следование здоровому образу жизни, чтобы развитие болезни остановилось окончательно;
Активная компенсированная стадия цирроза печени лечится не только витаминотерапией, но и гепатопротекторами – эссенциальными фосфолипидами и растительными препаратами на основе экстракта плодов расторопши. Назначают обычно липоевую кислоту по 1 таблетке 4 раза в день, карсил или его аналог по 2 таблетки 3 раза в день и эссенциале по 2 капсулы 3 раза в день на протяжении 1-2 месяцев;
Декомпенсированная стадия цирроза печени требует увеличения дозировки вышеозначенных гепатопротекторов в 2-3 раза и перевода их из пероральной формы в инъекционную для обеспечения наилучшей всасываемости. Дополнительно назначают липотрофные вещества (аргинин, орнитин, лецитин и прочие), а также, если требуется, гепатопротекторы животного происхождения. Курс лечения занимает не менее трех месяцев;
Вирусный цирроз печени средней и высокой степени активности лечится с помощью кортикостероидных гормонов. Как правило, назначают преднизолон (30 мг/сут), а затем каждые две недели снижают дозировку на 2,5 мг, пока не выйдут на уровень поддерживающей терапии (7,5-15 мг). Курс лечения длится 2-3 года;
Цирроз печени с асцитом требует отказа от соли и ежедневного контроля над диурезом – он должен быть ниже 500 мл/сут. В противном случае больному назначают диуретики и калийсберегающие препараты в дозировке 150-200 мг/сут с последующим переходом к поддерживающей терапии (100 мг/сут). Лечение цирроза с асцитом подразумевает постоянный приём мочегонных средств на протяжении нескольких лет;
Первичный билиарный цирроз печени неизлечим. Стероидные гормоны незначительно замедляют течение болезни. Синтетические желчные кислоты и ингибиторы протеолиза оказывают симптоматическое облегчающее действие. Поддержать организм помогут также витамины, липотропы и сеансы плазмофореза. Показана пересадка печени.
Гепатопротекторы

Для лечения цирроза применяются следующие типы гепатопротекторов:
Из нашей статьи вы узнаете абсолютно все о гепатопротекторах и других препаратах для лечения цирроза печени: наименования и цены, состав и фармакологическое действие, показания и противопоказания, способы применения и побочные эффекты.
Эссенциальные фосфолипиды
В кровеносной системе происходит постоянный обмен фосфолипидами между плазмой крови и красными кровяными тельцами – эритроцитами. Этот процесс позволяет удерживать неполярные липиды в растворенном состоянии и транспортировать их по всему организму. Таким образом, без эссенциальных фосфолипидов был бы невозможен правильный баланс углеводов, жиров и холестерина.
Важнейшее значение для человека имеют три типа фосфолипидов:
Но почему эссенциальные фосфолипиды, получаемые из сои, выступают препаратами первой очереди именно при лечении цирроза печени? Дело в том, что они угнетают синтез коллагена, и одновременно активизируют коллагеназу – фермент, разрушающий коллаген. А ведь именно коллаген отвечает за преобразование нескольких типов функциональных клеток в фиброзную ткань.
Эссенциале форте Н
Аналоги: Резалют Про, Энерлив, Эслидин
Ценовой диапазон: 200-800 рублей
Действующие вещества: эссенциальные фосфолипиды
Фармакологическое действие: сохраняет и восстанавливает клеточную структуру гепатоцитов, тормозит их замещение клетками соединительной ткани, нормализует углеводно-липидный обмен, поддерживает детоксикационную функцию печени.
Применение и дозировка: взрослым и детям старше 12 лет и с массой тела более 43-х кг принимать по 2 капсулы препарата 3 раза в день во время еды, не разжевывая и запивая полным стаканом воды. Курс лечения: не менее 3-х месяцев.
Жировая дистрофия печени;
Токсические и алкогольные поражения печени;
Печеночные дисфункции при других соматических заболеваниях;
Профилактика камнеобразования в желчном пузыре;
Симптоматическое лечение псориаза;
Восстановление после радиационного облучения.
Возраст до 12 лет;
Индивидуальная непереносимость соевого фосфатидилхолина.
Побочные эффекты: очень редко – диспепсические расстройства и зудящая кожная сыпь.
Особые указания: хорошо переносится, не вступает в нежелательные взаимодействия с другими препаратами.
Эссливер форте

Аналоги: Ливолин форте, Гепагард
Действующие вещества: эссенциальные фосфолипиды, тиамин, пиридоксин, рибофлавин, цианкобаламин, токоферол, никотинамид.
Ценовой диапазон: 380-450 рублей
Фармакологическое действие: защищает клетки печени, замедляет трансформацию гепатоцитов в фиброзные клетки, насыщает организм всеми витаминами, необходимыми для поддержания здоровья печени и её нормального функционирования.
Применение и дозировка: взрослым и детям старше 12-ти лет по 2 капсулы 2-3 раза в день во время еды, не разжевывая и запивая полным стаканом воды. Курс лечения: 3-6 месяцев.
Жировая дистрофия печени;
Хронический гепатит и цирроз;
Нарушения углеводно-липидного обмена;
Токсические, лекарственные, алкогольные и радиационные отравления организма;
Псориаз (в качестве дополнения к основной терапии).
Возраст до 12 лет;
Индивидуальная непереносимость фосфолипидов и/или аллергия на витамины, находящиеся в составе препарата.
Побочные эффекты: очень редко – крапивница и чувство тяжести в эпигастрии.
Особые указания: возможно назначение детям младше 12 лет по показаниям и под контролем врача.
Фосфоглив
Аналоги: Фосфоглив форте, Фосфоглив лиофилизат
Действующие вещества: эссенциальные фосфолипиды, натрия глицирризинат
Ценовой диапазон: 420-1400 рублей
Фармакологическое действие: оказывает комбинированное гепатопротекторное и противовирусное действие, используется для лечения гепатитов и циррозов вирусной этиологии.
Применение и дозировка: взрослым и детям старше 12 лет по 1-2 капсулы 2-3 раза в день во время еды, не разжевывая и запивая полным стаканом воды. Лиофилизат вводится внутривенно по 10 мл 2 раза в сутки в течение 10 дней с последующим переходом к пероральному приему. Курс лечения: 2 месяца и более.
Алкогольные и токсические поражения печени;
Псориаз, экзема, нейродермит (как дополнительное средство).
Возраст до 12-ти лет;
Индивидуальная непереносимость компонентов препарата.
Побочные эффекты: очень редко – зудящая кожная сыпь.
Особые указания: у больных с портальной гипертензией применять с осторожностью, лиофилизат не смешивать с физраствором или глюкозой.
Фосфонциале
Аналоги: Натуркарсевт
Действующие вещества: эссенциальные фосфолипиды, силимарин
Ценовой диапазон: 380-450 рублей
Фармакологическое действие: комбинированный препарат, сочетающий в себе гепатопротекторное действие фосфолипидов и экстракта расторопши пятнистой. Одновременно улучшает функции печени и защищает её клетки от повреждений, а также препятствует их трансформации в фиброзную ткань.
Применение и дозировка: по 2 капсулы 2-3 раза в день во время еды, не разжевывая и запивая полным стаканом воды. Курс лечения: не менее 3-х месяцев.
Острый и хронический гепатит любой этиологии;
Нарушения жирового обмена;
Токсические и алкогольные поражения печени;
Псориаз, нейродермит и экзема (как сопутствующая терапия).
Противопоказания: индивидуальная непереносимость компонентов препарата
Побочные эффекты:пищеварительные расстройства и кожные высыпания.
Особые указания: детям и беременным женщинам разрешено применение под контролем врача.
Растительные препараты для лечения цирроза печени
Главным действующим компонентом подавляющего числа гепатопротекторов этой группы является экстракт удивительного лекарственного растения – расторопши пятнистой. Именно расторопша наиболее богата силимарином – веществом, которое подобно щиту выстраивается вокруг гепатоцитов и защищает их от повреждений.
Прямой родственник силимарина – цинарин, который обладает аналогичным гепатопротекторным действием, в большом количестве содержится в семенах артишока, поэтому на втором месте по численности стоят растительные препараты для лечения цирроза печени на основе именно этой овощной культуры.
Прекрасный оздоровительный эффект оказывают также экстракты кассии, березы, дымянки, пижмы, тысячелистника и многие другие натуральные компоненты, поэтому состав комплексных растительных препаратов для защиты и восстановления печени может быть очень богат. Ниже представлена самая полная информация о лекарственных средствах для лечения болезней печени на растительной основе.
Карсил
Аналоги: Карсил форте, Легалон, Силимар, Силимарин, Силибинин
Действующие вещества: экстракт плодов расторопши пятнистой
Ценовой диапазон: 350-420 рублей
Фармакологическое действие: силимарин, получаемый из экстракта расторопши, вступает в конкурентное взаимодействие с токсинами, атакующими гепатоциты, и, тем самым, защищает клетки печени от разрушения.
Применение и дозировка: взрослым и детям старше 12-ти лет по 2-4 драже 3 раза в сутки. Курс лечения: не менее 3-х месяцев.
Хронический невирусный гепатит и период после него;
Токсические и алкогольные поражения печени.
Возраст до 12-ти лет;
Индивидуальная непереносимость силимарина.
Побочные эффекты: редко – кожная сыпь, зуд, расстройства пищеварения, обострение вестибулярных расстройств.
Особые указания: при беременности и эндометриональных новообразованиях применять с осторожностью. Препарат может уменьшать всасывание контрацептивов и других гормональных средств, а также усиливать действие диазепама и родственных успокоительных препаратов.
Цинарикс
Аналоги: Артихол
Действующие вещества: экстракт артишока
Ценовой диапазон: 320-500 рублей
Фармакологическое действие:защищает клетки печени, снижает уровень холестерина в крови, стимулирует продукцию желчи, усиливает перистальтику кишечника.
Применение и дозировка: взрослым и детям старше 12-ти лет по 1-2 таблетки 3 раза в день во время еды. Курс лечения: 2 недели и более.
Дискинезия желчных путей;
Алкогольная интоксикация и лекарственные поражения печени.
Тяжелая печеночная недостаточность;
Эмпиема желчного пузыря;
Окклюзия желчных путей;
Индивидуальная непереносимость цинарина.
Побочные эффекты: редко – диарея и кожная сыпь.
Особые указания: экстракт артишока не имеет официального статуса лекарственного препарата, это биологически активная добавка к пище. Во время беременности приём разрешен, но только после консультации с врачом.
Аллохол
Действующие вещества: уголь активированный, желчь животных сушеная, экстракты чеснока и крапивы
Ценовой диапазон: 50-80 рублей
Фармакологическое действие: желчегонное средство, также усиливает секреторную деятельность печени и моторную активность кишечника, предотвращает процессы гниения в пищеварительном тракте.
Применение и дозировка: взрослым и детям старше 3-х лет по 1-2 таблетки 3 раза в день после еды. Курс лечения: от 3-х недель до 2-х месяцев.
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
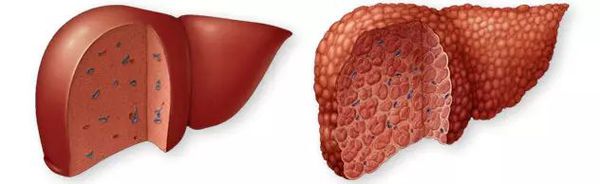
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
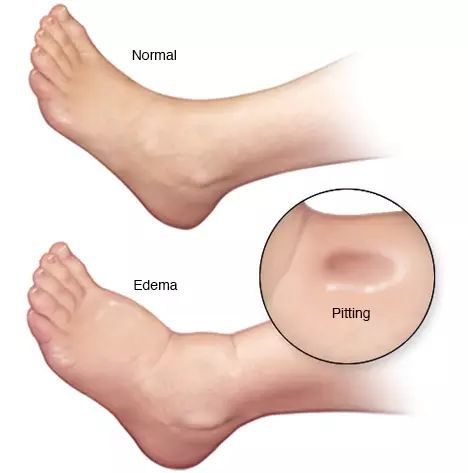
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
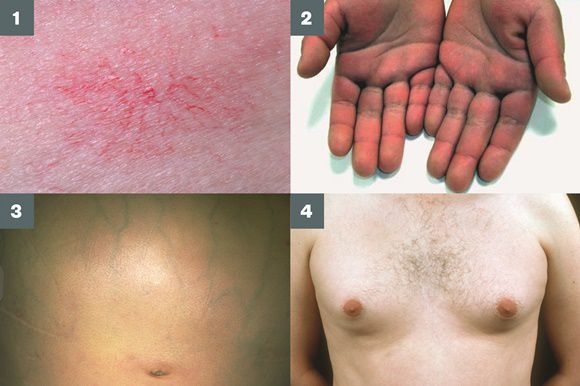
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
Читайте также:

