Герпес 6 типа микробиология
Обновлено: 23.04.2024
Представлен обзор литературы, посвященной вопросу изучения герпеса 6-го типа. Приведены эпидемиологические данные и характеристики структуры вируса. Особое внимание уделено диагностике вируса герпеса 6-го типа, его клиническим формам и проявлениям.
- КЛЮЧЕВЫЕ СЛОВА: инфекции, герпес, цитомегаловирус, экзантема, судороги, усталость, депрессия, гепатит, лимфома
Представлен обзор литературы, посвященной вопросу изучения герпеса 6-го типа. Приведены эпидемиологические данные и характеристики структуры вируса. Особое внимание уделено диагностике вируса герпеса 6-го типа, его клиническим формам и проявлениям.
Как известно, герпесвирусные инфекции являются причиной развития многих соматических и онкологических заболеваний, занимают ведущее место среди причин мертворождаемости, преждевременных родов, младенческой смертности, заболеваемости новорожденных, способствуют ранней инвалидизации детей [1]. Это обусловлено повсеместным распространением герпесвирусов, наличием разных форм (острых, хронических, латентных), многообразием вызываемых ими заболеваний.
Герпесвирусы (Herpesviridae) – большое семейство ДНК-содержащих вирусов, вызывающих разнообразные болезни не только у человека, но и других млекопитающих. Одним из восьми представителей семейства герпесвирусов является вирус герпеса человека 6-го типа (ВГЧ-6).
Ученые изучали роль ВГЧ-6 как этиологического агента возникновения фебрильных судорог у детей. Установлено, что на долю судорог, обусловленных ВГЧ-6, приходится 20–40% [4–6].
История открытия ВГЧ-6
Эпидемиология
Инфицирование обычно происходит на первом или втором году жизни. Соответственно около 95% взрослых имеют антитела к ВГЧ-6 [8]. В США и Японии приобретенная ВГЧ-6-инфекция встречается преимущественно у младенцев 6–18 месяцев жизни. Почти все дети инфицируются в возрасте до трех лет и сохраняют иммунитет на всю жизнь. Примечательно, что эта инфекция, приобретенная в детском возрасте, приводит к высокой частоте серопозитивности у взрослых [7, 8]. По данным российских авторов, у 80% здоровых доноров, 65% ВИЧ-инфицированных и 73% онкологических больных выявляются антитела к ВГЧ-6. Большинство детей при рождении серопозитивны за счет материнских антител, титр которых снижается к пяти месяцам [3]. Однако к концу первого года жизни процент серопозитивных малышей оказывается таким же, как среди детей более старшего возраста и взрослых. Высокая частота выявления антител и ранний возраст инфицирования указывают на присутствие вируса в ближайшем окружении [2].
Структура вируса
От остальных герпесвирусов ВГЧ-6 отличается биологическими и иммунологическими свойствами, спектром чувствительных клеток, антигенной структурой, составом генома, количеством и молекулярной массой структурных вирусных белков. Диаметр вириона равен 160–200 нм, тип симметрии икосаэдрический, содержит 162 капсомера, имеет суперкапсидную липидосодержащую оболочку. Геном представлен двунитчатой ДНК. Рестрикционный анализ ДНК ВГЧ-6 показал вариабельность генома различных изолятов вируса. При сравнении первичной структуры геномов определенное сходство прослеживается скорее между ВГЧ-6 и цитомегаловирусом (ЦМВ), чем между ВГЧ-6 и другими герпесвирусами [9]. Очевидно, именно данной степенью гомологии объясняется наибольшая способность к сосуществованию ВГЧ-6 и ЦМВ [9].
Исследования изолятов ВГЧ-6 от людей с различной патологией показали принадлежность к двум вариантам – А или B (ВГЧ-6А и ВГЧ-6В). Варианты различаются клеточным тропизмом in vitro, рестрикционным эндонуклеазным профилем, нуклеотидной последовательностью, реактивностью с моноклональными антителами, сероэпидемиологией и причастностью к различным заболеваниям. Инфекция, индуцированная ВГЧ-6А, наблюдается реже. Роль данного варианта вируса в патологии человека недостаточно ясна. Предположительно штаммы ВГЧ-6А нейровирулентны, тогда как ВГЧ-6В является основным этиопатогеном внезапной экзантемы и чаще выделяется у пациентов с лимфопролиферативными и иммуносупрессивными заболеваниями [10].
Выделение ВГЧ-6, определение вирусных белков и ДНК в образцах слюны и мокроты указывают на то, что вирус находится в организме человека в слюнных железах. Эксперименты in vitro показали, что ВГЧ-6 в латентной фазе сохраняется в моноцитах/макрофагах. В естественных условиях основным путем передачи вируса является воздушно-капельный. Не исключен вертикальный путь заражения: антигены вируса обнаружены в абортивном материале при спонтанных абортах. Возможны половой путь передачи вируса и перинатальная инфекция. Длительная репродукция при острой инфекции и персистенция ВГЧ-6 в клетках крови внешне здоровых людей, включая доноров, являются серьезными факторами риска передачи вируса при переливании крови и ее компонентов, трансплантации органов и тканей [3]. Результаты экспериментальных исследований свидетельствуют о том, что ВГЧ-6 латентно инфицирует моноциты и макрофаги разных тканей, а также стволовые клетки костного мозга, из которых впоследствии происходит его реактивация [7, 8].
У новорожденных при наличии материнских антител может существовать относительная защита против ВГЧ-6. Первичная инфекция отличается виремией, которая стимулирует продукцию нейтрализующих антител, что приводит к прекращению виремии [11, 12]. Специфические антитела IgM появляются в течение первых пяти дней от начала клинических симптомов, в последующие один-два месяца снижаются и в дальнейшем не определяются. Специфические IgM могут присутствовать при реактивации инфекции в небольшом количестве у здоровых людей. Уровень специфических IgG повышается в течение второй-третьей недели, при этом возрастает их авидность. IgG к ВГЧ-6 персистируют всю жизнь, но в более низких количествах, чем в раннем детстве. Уровни антител могут колебаться после перенесенной первичной инфекции, скорее всего из-за реактивации латентного вируса. Значительное возрастание уровня антител наблюдается в случае заражения другими вирусами с похожими ДНК, например ВГЧ-7 и ЦМВ [7, 13, 14]. Исследователи отмечают, что у детей в течение нескольких лет после первичной инфекции титр IgG к ВГЧ-6 может четырехкратно увеличиваться, иногда вследствие острого заражения другим агентом. В этом случае не стоит исключать возможную реактивацию латентного ВГЧ-6 [7, 8].
Клеточный иммунитет важен в контроле первичной инфекции ВГЧ-6 и впоследствии в поддержании латентного состояния. Реактивация ВГЧ-6 у иммунологически скомпрометированных больных подтверждает значимость клеточного иммунитета. Острая стадия первичной инфекции связана с увеличенной клеточной активностью естественных киллеров, возможно через интерлейкин (ИЛ) 15 и индукцию интерферона (ИФН) альфа. Согласно результатам исследования ВГЧ-6 в условиях in vitro, репликация вируса снижается под влиянием экзогенного ИФН. Установлено, что ВГЧ-6 индуцирует ИЛ-1-бета и фактор некроза опухоли альфа. Это говорит о том, что ВГЧ-6 способен модулировать иммунный ответ при первичной инфекции и реактивации посредством стимуляции продукции цитокинов [8].
После первичной инфекции сохраняется персистенция вируса в латентном состоянии или в виде хронической инфекции с продукцией вируса. Компоненты иммунного ответа, имеющего значение в контроле хронической инфекции, неизвестны. Реактивация латентного вируса наблюдается у иммунологически скомпрометированных больных, но иногда и у иммунокомпетентных людей по неизвестным причинам. ВГЧ-6 ДНК часто обнаруживается после первичной инфекции в моноядерных клетках периферической крови и секретах здоровых людей, но главное местоположение латентной инфекции ВГЧ-6 неизвестно.
Диагностика
Лабораторный диагноз первичной инфекции ВГЧ-6 в настоящий момент устанавливается с помощью современного лабораторного оборудования. Трудности в диагностике связаны с персистирующей и латентной формами инфекции. ВГЧ-6 ДНК может обнаруживаться в лимфоцитах периферической крови или других тканях методом гибридизации. Саузерн-блот-гибридизация менее чувствительна, чем полимеразная цепная реакция (ПЦР). Однако обнаружение ВГЧ-6 ДНК в этих тканях не всегда указывает на первичную инфекцию, чаще это проявление персистирующей инфекции, которая возникла после первичной инфекции и не сопровождается виремией [8, 14]. Обнаружение ВГЧ-6 ДНК в плазме и определение высокого титра вируса – более чувствительный метод для диагностики первичной инфекции (около 90%), но это может свидетельствовать и о реактивации инфекции. ПЦР с обратной транскриптазой позволяет надежно дифференцировать латентную инфекцию ВГЧ-6 и реактивацию инфекции [7, 8]. Существует ряд серологических методов определения ВГЧ-6-инфекции: иммунофлуоресцентный, иммуноферментный анализ (ИФА), иммуноблот, иммунопреципитация. ИФА используются чаще, однако серологический диагноз имеет ряд недостатков и редко помогает в диагностике клинической манифестации. Определение титра специфических IgM используют для диагностики острой инфекции или реактивации. Между тем не у всех детей с первичной инфекцией отмечается продукция антител IgM, а приблизительно у 5% здоровых взрослых обнаруживаются антитела IgM к ВГЧ-6 [8]. В связи с тем что практически у всех взрослых выявляют IgG к ВГЧ-6, обнаружение специфических антител в одном образце незначимо. К тому же повышение их титра не свидетельствует о новой инфекции или реактивации. Возможно также выявление перекрестно реагирующих антител к другим ДНК-вирусам, особенно ВГЧ-7 [8]. Доступные в настоящий момент серологические тест-системы не позволяют дифференцировать варианты A и B ВГЧ-6. У детей диагноз первичной инфекции, вызванной ВГЧ-6, требует обнаружения виремии (изоляции ВГЧ-6 в моноядерных клетках периферической крови) и существенного нарастания серологических тестов. ВГЧ-6-виремия наблюдается относительно редко у здоровых детей по сравнению с детьми с первичной инфекцией. Изоляция ВГЧ-6 требует культивации со стимулированными клетками крови пуповины и последующей идентификации на оборудовании, доступном только исследовательским лабораториям [8].
Реинфекция ВГЧ-6 наблюдается у больных с нарушенным иммунным статусом, иммуносупрессией (трансплантация органов, СПИД и др.) [3].
Клиническая симптоматика
Клинически герпес 6-го типа проявляется полиморфизмом и может скрываться под различными масками. Это обусловлено не только формой инфекции, но и штаммовыми различиями вируса [3]. Так, к заболеваниям, ассоциированным с первичной острой ВГЧ-6-инфекцией, относятся:
- синдром хронической усталости (миалгический энцефаломиелит) (значение ВГЧ-6 в возникновении данного синдрома обсуждается различными авторами, но доказательства, подтверждающие эту гипотезу, неоднозначны);
- внезапная экзантема у новорожденных и более старших детей;
- судороги с фебрильной провокацией;
- инфекционный мононуклеоз у подростков и взрослых, не связанный с инфекцией, вызванной вирусом Эпштейна – Барр; гистиоцитарный некротический лимфаденит, некоторые заболевания центральной нервной системы (ЦНС), в частности энцефалит, ассоциированный с ВГЧ-6, и др. [15].
Выделяют также заболевания, ассоциированные с персистирующей ВГЧ-6-инфекцией:
- лимфопролиферативные (иммунодефицит, лимфаденопатия, поликлональная лимфопролиферация);
- злокачественные лимфомы (неходжкинская лимфома, периферическая Т-клеточная лейкемия, В-клеточная лимфома, дерматопатическая лимфаденопатия, болезнь Ходжкина, синусоидальная В-клеточная лимфома, плеоморфная Т-клеточная лимфома).
Внезапная экзантема – самая характерная манифестация первичной инфекции ВГЧ-6 и, по мнению большинства исследователей, главное проявление первичной ВГЧ-6-инфекции. Типичное течение внезапной экзантемы характеризуется начальными проявлениями в виде высокой лихорадки, интоксикационного синдрома, лимфаденопатии с увеличением шейных и затылочных лимфоузлов, небольшой инъекцией в зеве, иногда энантемой в виде мелкой макулопапулезной сыпи на мягком небе и язычке (пятна Nagayama’s), гиперемией и отечностью конъюнктивы век. Барабанные перепонки часто гиперемированы, отчасти из-за лихорадки и легкого катарального отита [15]. Экзантема появляется при снижении температуры. Иногда сыпь наблюдается перед снижением лихорадки или после отсутствия у ребенка температуры в течение дня. Высыпания розеолезного, макулезного или макулопапулезного характера розовой окраски до 2–3 мм в диаметре бледнеют при надавливании, редко сливаются, не сопровождаются зудом. Высыпания обычно сразу появляются на туловище с последующим распространением на шею, лицо, верхние и нижние конечности. В некоторых случаях они располагаются преимущественно на туловище, шее и лице. Продолжительность высыпаний – от нескольких часов до 1–3 дней, исчезают бесследно. Иногда отмечается экзантема в виде эритемы.
Основной причиной поражения ЦНС в 20–27% случаев является ЦМВ, в 10–15% – вирус Эпштейна – Барр, в 15–20% – вирус простого герпеса [16–20]. Как известно, герпетические поражения ЦНС протекают особенно тяжело. Болезни, обусловленные вирусом простого герпеса, занимают второе место после гриппа как причина смерти от вирусных инфекций. Подавляющее большинство спорадических случаев острых вирусных энцефалитов, особенно у детей, имеет герпетическую этиологию [20].
Неврологическими осложнениями ВГЧ-6, кроме фебрильных судорог, являются нейроинфекции (менингит, энцефалит). Не исключено развитие эпилепсии [6], но данная тема полностью не изучена. Причиной фебрильных судорог может быть как прямое повреждающее воздействие на ЦНС, так и опосредованное за счет активации ИЛ-8 в ликворе [6]. Вместе с тем в проведенных исследованиях по выявлению ВГЧ-6 в спинномозговой жидкости у детей определение ДНК этих вирусов в ликворе было очень низким или количество ВГЧ-6 крайне малым [6].
Некоторые ученые называют ВГЧ-6 причиной развития рассеянного склероза, синдрома полиорганной недостаточности, розового лишая, гепатита, вирусного гемофагоцитоза, идиопатической тромбоцитопенической пурпуры, синдрома чрезмерной чувствительности к лекарственным препаратам, особенно антибактериальным. Однако подобные утверждения носят спорный характер и требуют дальнейшего всестороннего изучения.
Е.И. Веселова и соавт. изучали у 102 детей раннего возраста (от 1,5 месяца жизни до двух лет десяти месяцев) клинические особенности течения острых инфекций, ассоциированных с герпесом 6-го типа. Был сделан вывод о полиморфизме клинических проявлений. Основными клиническими вариантами течения были острые респираторные вирусные инфекции с гипертермией, внезапная экзантема, поражение слизистой полости рта, нижних дыхательных путей, ЦНС, кожи [21].
Представляют интерес результаты обследования плодов и новорожденных с экстремально низкой массой тела на вирусы герпеса и краснухи как причины летальных исходов. Исследовались мазки-отпечатки органов 109 погибших плодов и новорожденных с помощью реакции непрямой иммунофлуоресценции на герпетические вирусы и вирус краснухи. Установлено, что среди всех исследуемых вирусов ВГЧ-6 занимает далеко не последнее место (41,6%) [22].
В настоящее время инфекция, обусловленная вирусом герпеса 6-го типа, в нашей стране особенно актуальна. Последние годы отечественные и зарубежные специалисты активно изучали строение вируса, методы диагностики инфекции, ее комбинации с другими герпесвирусами, особенности клинических форм и вариантов течения. Установлено, что при распространении инфекции ведущая роль принадлежит ближайшему окружению. Выявлено наиболее частое сочетание ВГЧ-6 с ЦМВ. Актуальной является диагностика данной инфекции с преобладанием методик, основанных на выявлении ДНК ВГЧ-6 в плазме и других средах организма. В перспективе – разработка и других методов диагностики (ИФА, энзимные методы и др.). Однако обязательным остается динамическое обследование, поскольку результаты однократно взятого анализа не всегда объективны. Последние годы активно разрабатываются методы противовирусного лечения заболеваний, вызванных данной инфекцией, в частности с применением иммуномодулирующих препаратов. Тем не менее четких позиций по данному вопросу пока не выработано.
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано с их значительной эпидемиологической ролью и социальной значимостью в современном мире. Неуклонный рост числа герпетических заболеваний у взрослых и детей обусловливает необходимость всестороннего изучения герпетической инфекции и разработки эффективных методов профилактики и лечения разнообразных форм этой инфекции. Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия клинических проявлений, как правило, хронического течения, а также различных путей передачи вирусов.
Он входит в число наиболее распространенных и плохо контролируемых инфекций человека. Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом. По данным ВОЗ, смертность от герпетической инфекции среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%).
Герпес-вирусы объединены в обширное семейство Herpesviridae и в настоящее время наиболее четко классифицированы. Семейство Herpesviridae включает в себя более 80 представителей, 8 из которых для человека наиболее патогенны (human herpes virus-HHV). Герпес-вирусы — филогенетически древнее семейство крупных ДНК-вирусов — подразделяются на 3 подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ (табл. 1, по данным Н. Г. Перминова, И. В. Тимофеева и др., Государственный научный центр вирусологии и биотехнологий).
α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV, характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпес-вирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в ганглиях.
β-герпес-вирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму, в культуре клеток легко возникает персистентная инфекция. К этой группе относятся CMV, HHV-6, HHV-7.
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере, EBV и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
В эпидемиологическом плане наиболее интересны следующие сведения о герпес-вирусах: вирионы чрезвычайно термолабильны — инактивируются при температуре 50–52°С в течение 30 мин, при температуре 37,5°С — в течение 20 ч, устойчивы при температуре 70°С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50-процентном растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, во влажных медицинских вате и марле — до их высыхания при комнатной температуре (до 6 ч).
Уникальными биологическими свойствами всех герпес-вирусов человека является тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпес-вирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создает постоянную угрозу развития инфекционного процесса. Латенция герпес-вирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпес-вируса) ганглиев чувствительных нервов. Штаммы герпес-вирусов обладают неодинаковой способностью к персистенции и латенции и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпес-вируса свой темп персистенции и латенции. Среди изучаемых наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна-Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпштейна-Барр, герпеса человека 6 и 8 типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Герпес-вирусные инфекции широко распространены в мире и имеют тенденцию к неуклонному росту. Особенностью герпес-вирусной инфекции является возможность вовлечения в инфекционный процесс многих органов и систем, чем и обусловлено многообразие вызываемых герпес-вирусами заболеваний, варьирующих от простых кожно-слизистых до угрожающих жизни генерализованных инфекций. Важное свойство герпес-вирусов — это способность после первичного инфицирования в детском возрасте пожизненно персистировать в организме и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов.
Инфицирование человека указанными герпес-вирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: внезапная эритема (вирус герпеса человека 6 типа), афтозный стоматит (вирусы простого герпеса 1 или 2 типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейна-Барр), мононуклеозоподобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпес-вируса, влияние на течение острых и рецидивирующих герпес-вирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онкогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
Часто, особенно при снижении иммунореактивности организма, герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями, течению основного заболевания. Вирусы простого герпеса 1 и 2 типов, а также ЦМВ входят в число возбудителей TORCH-инфекций. Они играют важную роль в нарушении репродуктивной функции человека, развитии серьезных заболеваний матери, плода, новорожденного и детей младшего возраста.
Вызываемые вирусами ВПГ, CMV, ВЭБ заболевания рассматриваются как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. В 1988 г. они включены в расширенное определение случаев, подлежащих эпидемиологическому надзору по поводу СПИДа. Результаты исследований последних лет свидетельствуют о роли некоторых герпес-вирусов (ВГЧ-8, ЦМВ, ВЭБ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, рака груди, аденокарциномы кишечника и простаты, карциномы цервикального канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации — 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
Диагностика герпетической инфекции
Все методы индикации и идентификации вирусов основаны на следующих принципах:
- выявление вируса per se (электронная микроскопия);
- выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках);
- выявление и идентификация вирусов с помощью антител (МФА, ИФА, РАЛ, ИБ, РН, РСК);
- выявление и идентификация нуклеиновых кислот (ПЦР, МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить ГВ или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит
в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпес-вирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке.
Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ.
Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из различных клеточных культур.
Для обнаружения вируса герпеса используют молекулярно-биологические методы: полимеразную цепную реакцию и реакцию молекулярной гибридизации, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение герпетической инфекции
Лечение герпетической инфекции до настоящего времени остается сложной задачей. Хроническое течение процесса приводит к иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакции клеточного иммунитета, снижению неспецифической защиты организма. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения герпетической инфекции, лекарственных средств, обеспечивающих полное излечение от герпеса, не существует. Герпес-вирусная инфекция относится к трудно контролируемым заболеваниям. Это связано, в первую очередь, с разнообразием клинических поражений, развитием резистентности вируса к лекарственным средствам, наличием у герпес-вирусов молекулярной мимикрии. Поэтому для успешного лечения герпетической инфекции необходимо правильно подобрать противовирусный препарат, его дозу и длительность лечения, использовать комбинацию различных лекарств. В схемы терапии для повышения эффективности лечения необходимо также включать иммунобиологические препараты, способствующие коррекции иммунного статуса, а также патогенетические средства, облегчающие состояние пациента.
В настоящее время все антигерпетические средства подразделяются на 3 основные группы антивирусных препаратов (табл. 3).
Механизм действия химиопрепаратов (аномальных нуклеозидов: валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
В препаратах-иммуномодуляторах (алпизарин, имунофан, ликопид, полиоксидоний) активно действующие вещества обладают иммуностимулирующими свойствами в отношении клеточного и гуморального иммунитетов, окислительно-восстановительных процессов, синтеза цитокинов.
Препараты-индукторы ИФН (амиксин, неовир, циклоферон) сочетают этиотропный и иммуномодулирующий эффекты действия. Препараты индуцируют образование эндогенных ИФН (α, β, γ) Т- и В-лимфоцитами, энтероцитами, гепатоцитами.
Особое место среди средств антигерпес-вирусной терапии занимает герпетическая вакцина для активации клеточного иммунитета, его иммунокоррекции в фазе ремиссии. Вакцинация преследует 2 цели: предупреждение первичной инфекции и возникновения состояния латентности, а также предупреждение или облегчение течения заболевания.
Однако, несмотря на наличие обширного списка антигерпетических препаратов, герпес остается до сих пор плохо контролируемой инфекцией. Это обусловлено и генотипическими особенностями возбудителя, и длительной персистенцией вируса в организме, и формированием штаммов, устойчивых к антивирусным препаратам. Максимальный клинический эффект может быть получен только при рациональной комплексной терапии лекарственных средств с различным механизмом действия.
Санкт-Петербургской группой ученых вирусологов и инфекционистов во главе с В. А. Исаковым предложена программа лечения и профилактики герпетической инфекции (табл. 4).
Преимущества комплексной терапии ГИ.
- Сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект.
- Благодаря снижению дозы противовирусного ХПП уменьшается вероятность развития побочных эффектов, сокращается токсическое воздействие на организм больного.
- Снижается вероятность возникновения устойчивых штаммов герпес-вирусов к данному препарату.
- Достигается иммунокорригирующий эффект.
- Сокращается продолжительность острого периода болезни и сроков лечения.
Таким образом, терапия ГИ является сложной и многокомпонентной задачей.
По вопросам литературы обращайтесь в редакцию.
Т. К. Кускова, кандидат медицинских наук
Е. Г. Белова, кандидат медицинских наук
МГМСУ, Москва
Инфекции вызванные вирусом Эпштейна—Барр, вирусами герпеса типа 6,7,8: клиника, диагностика
Геном вируса Эпштейна—Барр кодирует характерный для него ядерный антигенный комплекс, латентный мембранный белок, терминальный протеин, мембранный антигенный комплекс, ранний и вирусный капсидный антигены.
Эпидемиология и патогенез инфекции вызванной вирусом Эпштейна—Барра. Как и цитомегаловирус, вирус Эпштейна—Барр широко распространён среди маленьких детей развивающихся стран и среди взрослого населения индустриальных стран. Попадая в организм человека через носоглотку, он поражает В-лимфоциты и распространяется по всему организму.
Вирус способен продлевать жизнь В-лимфоцитам, что приводит к развитию неоплазии, например лимфомы Беркитта (мелкоклеточная лимфома с нерассечёнными ядрами, которую регистрируют в Африке, ниже Сахары, в регионах с высокой заболеваемостью малярией), носоглоточной карциномы (распространена в Китае) и лимфомы (у пациентов со сниженным иммунитетом).
Кроме того, возбудитель может стать причиной лимфопролиферативных заболеваний у пациентов после трансплантации.
Клинические признаки инфекции вызванной вирусом Эпштейна—Барра. Основные признаки инфекции — повышение температуры, общее недомогание, боль в горле, лимфаденопатия и иногда гепатит. Длительность заболевания около 2 нед, но у некоторых пациентов наблюдают симптомы персистирующей инфекции. Эпштейна—Барр инфекция ассоциируется с возникновением опухолей.
Диагностика инфекции вызванной вирусом Эпштейна—Барра. Методы: быстрая реакция агглютинации на предметном стекле. Для подтверждения диагноза применяют ИФА (определение специфического IgM к вирусному капсидному антигену) и молекулярно-генетический метод.
Инфекции вызванные вирусами герпеса человека типа 6 и 7
Впервые выделенные в 1980-х годах, эти бета-герпес-вирусы — единственные представители рода Roseolovirus. Выделяют два подтипа ВГЧ-6, поражающих Т-лимфоциты человека, — А и В. Заражение происходит при контакте со слюной инфицированных лиц.
К концу второго года жизни вирус присутствует в организме практически всех людей. Отмечают внезапное возникновение экзантемы (шестая болезнь), лихорадки (в течение 3—5 дней).
Описано течение болезни без возникновения высыпаний. ВГЧ-6 играет большую роль в развитии фебрильных судорог и энцефалита у детей. Последний, наряду с молниеносным гепатитом, — достаточно редкое осложнение. Диагностические мероприятия включают обнаружение IgG с помощью ИФА и молекулярно-генетический метод.
Практически все дети в возрасте до пяти лет заражены ВГЧ-7. До настоящего времени клинические признаки чётко не описаны, но существуют доказательства связи заболевания с развитием энцефалита.
В основе диагностики — определение специфических антител в ИФА (исследование парных сывороток).
Инфекция вызванная вирусом герпеса человека типа 8 - саркомавирусом Капоши
ВГЧ-8 относят к у-герпес-вирусам. Он имеет много общего с вирусом герпеса обезьян. Механизм передачи — вертикальный и контактный. На начальной стадии заболевание протекает в виде мононуклеозоподобного синдрома. Позже у пациентов со сниженным иммунитетом (особенно у ВИЧ-инфицированных) развивается саркома Капоши.
Диагностика: молекулярно-генетический метод (в образцах поражённых тканей), ИФА, реакция непрямой флюоресценции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Поражения вирусом герпеса типа 6 гематологических больных - диагностика, лечение
Герпес-вирус человека типа 6 впервые был выделен из мононуклеаров крови больного СПИДом в 1986 г., а в 1988 г. выявлена его связь с одной из сыпных инфекций детского возраста — внезапной экзантемой (roseola infantum), или шестой детской экзантемой. Выделяют два генотипа вируса — А и В, гомология ДНК которых составляет 90 %.
Генотип В выявляется значительно чаще. Первичное инфицирование HHV-6 происходит обычно у детей в первые 2 года жизни через слюну и чаще всего манифестирует высокой лихорадкой неясной этиологии и лимфаденопатией, хотя у части детей наблюдается типичная клиническая картина внезапной экзантемы, когда появление пятнисто-папулезной сыпи на 5—7-й день от начала лихорадки является предвестником выздоровления.
Типично для первичной инфекции развитие фебрильных судорог: примерно у трети больных детей в возрасте до 1,5 года. Это значительно больше, чем у детей с такой же высокой лихорадкой, но не ассоциированной с HHV-6-инфекцией. Возможно, судороги являются следствием специфического вирусного поражения головного мозга, поскольку геном HHV-6 обнаруживается в ткани мозга иммунокомпетентных индивидуумов.
После перенесенной первичной инфекции HHV-6 развивается пожизненная латенция. HHV-6 отличается выраженным лимфотропизмом; его резервуаром являются мононуклеары крови, в частности CD4+-лимфоциты, дендритные клетки, NK-клетки и, возможно, клетки миелоидной линии. Помимо этого, вирус может инфицировать клетки нейроглии и некоторые другие, в частности клетки протоков слюнных желез.

Ганцикловир активен в отношении вируса герпеса типа 6
С последним обстоятельством связана возможность длительной секреции вируса в слюну, которая является основным источником передачи вируса и первичного заражения детей.
Клиническое значение HHV-6 для гематологических больных изучено достаточно слабо. В связи со всеобщей ранней инфицированностью HHV-6 у гамотологических больных первичная инфекция этим вирусом встречается редко, ее клинические признаки неизвестны. Ранняя реактивация HHV-6, выявляемая по виремии, регистрируется у 30—45 % реципиентов аллогенных ТГСК.
Клиническими проявлениями реактивации являются сыпь, лихорадка, замедление становления функции трансплантата и повышение активности печеночных ферментов.
Эти признаки, конечно, крайне неспецифические и могут быть отнесены к проявлениям реактивации HHV-6 только по исключении других причин (CMV-инфекция, РТПХ) и при документации реактивации HHV-6. Данных о влиянии реактивации на исход трансплантации неясен, также неясны подходы к мониторингу и терапии HHV-6.
Ацикловир неактивен в отношении HHV-6, в то время как ганцикловир эффективно ингибирует репликацию вируса.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Герпесвирусы. Виды герпесвирусов. Систематика герпесвирусов.
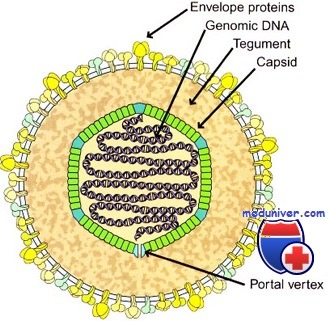
Герпесвирусы [греч. herpes, ползучее поражение кожи] представлены группой сравнительно крупных ДНК-геномных вирусов диаметром 150-200 нм.
Нуклеокапсид герпесвирусов организован по типу кубической симметрии; геном представлен двухнитевой молекулой ДНК, содержащей короткий (18%) и длинный (82%) компоненты. В отличие от прочих одетых вирусов, суперкапсиды герпесвирусов образованы фрагментами ядерных мембран, так как созревание дочерних популяций происходит на внутренней мембране ядер заражений клетки.
Суперкапсид герпесвирусов пронизывают гликопротеиновые шипы, образованные белками внутренней ядерной мембраны поражённых клеток. Между нуклеокапсидом и суперкапсидом герпесвирусов расположен покровный слой-тегумен [лат. tegumentum, покрытие], толщина которого варьирует у различных вирусов.

Герпесвирусы относительно нестабильны при комнатной температуре, термолабильны и быстро инактивируются растворителями и детергентами.
Герпесвирусы вызывают острые и латентные инфекции, а также обладают определённым онкогенным потенциалом. Доказана роль герпесвирусов в развитии болезней злокачественного роста у животных (например, болезнь Марека у цыплят), а также эпидемиологическая связь с образованием некоторых опухолей у человека. Современная систематика разделяет семейство Herpesviridae на подсемейства Alphaherpesviruses, Betaherpesviruses и Gammaherpesviruses.
• Альфагерпесвирусы проявляют высокую цитопатическую активность и патогенны для большого числа хозяев. Патогенные для человека виды включены в состав родов Simplexvirus (вирусы герпеса 1-го и 2-го типа, вирус В герпеса) и VariceUovims (вирус герпеса 3-го типа).
• Бетагерпесвирусы проявляют менее выраженную цитопатичность и патогенны для более узкого круга хозяев. Патогенные для человека виды включены в состав родов Cytomegalovirus (вирус герпеса 5 типа) и Roseolovirus (вирусы герпеса 6А, 6В и 7 типов).
• Гаммагерпесвирусы также патогенны для небольшой группы хозяев и способны размножаться в лимфоидных клетках. Патогенные для человека виды включены в состав рода Lymphocryptovirus (вирус герпеса 4 типа).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

