Герпес и задержка развития ребенка
Обновлено: 23.04.2024
Санталова Г.В., Гасилина Е.С., Валеева Г.Р., Шарыпова М.А., Ефимова И.Л., Плахотникова С.В., Сошникова Л.Н.
В последнее время вследствие высокой инфицированности населения вирусными инфекциями растет интерес к их возбудителям, в частности к вирусам семейства Herpes, под влиянием которых часто происходят внутриутробное инфицирование плода и повреждение плаценты. При хронических и рецидивирующих инфекциях частота внутриутробного инфицирования невелика, однако фетоплацентарная недостаточность и потери плода встречаются примерно с той же частотой, что и при острых формах. Исследования последних лет позволяют говорить о значимости внутриутробной инфекции в патогенезе патологических состояний, формирующихся в последующие годы жизни. Крайне важной остается проблема ранней диагностики внутриутробной инфекции и исхода её развития. В связи с этим не вызывает сомнения необходимость разработки комплексного подхода к решению вопроса о прогнозировании инфекции у новорожденного путем своевременной диагностики и проведения соответствующих лечебно–профилактических мероприятий с целью предупреждения формирования тяжелой соматической патологии и инвалидизации у детей.
Целью исследования явилось изучение состояния новорожденных детей, родившихся от герпес-инфицированных матерей.
Обследовано 216 новорожденных. Проведен анализ состояния здоровья детей; оценивалось состояние фетоплацентарной системы беременных. Новорожденные дети были распределены на 3 группы: в 1-ю вошли 73 ребенка от матерей с фетоплацентарной недостаточностью (ФПН) и латентным течением герпетической инфекции; 2-ю составили 68 детей от матерей с латентной герпетической инфекцией без признаков ФПН, 3-ю – 75 новорожденных от матерей, не имевших в анамнезе герпеса и с отрицательными результатами обследования на герпетическую инфекцию (ГИ).
У матерей с герпетической инфекцией недоношенными родились 28 (13,0%) детей, у неинфицированных – 8 (3,7%). Гестационный возраст во всех группах колебался от 29 до 42 недель; масса тела при рождении – от 1850 до 4300 граммов. Среди родившихся выявлено значительное число детей с синдромом внутриутробной задержки развития плода (ВЗРП): 44 (20,4%) – из I группы (чаще встречались дети с ВЗРП II и III степеней) и 10 (4,6%) – из III (преобладали дети с ВЗРП I степени). У большинства новорожденных были диагностированы перинатальное поражение ЦНС, синдром пролонгированной желтухи, синдром дыхательных расстройств, гипотрофия, анемия, дисбиоз кишечника, аномалии и пороки развития. У детей I и II групп эти изменения встречались чаще. Следует отметить, что такая патология, как кисты сосудистых сплетений головного мозга, кальцинаты вещества головного мозга, герпетическая экзема, врожденный хориоретинит, герпетический гепатит, нефрит, встречалась только у детей с подтвержденной на 2-8 день жизни герпетической инфекцией. Из I группы таких случаев было 44 (20,4%), из II – 9 (4,2%).
Таким образом, оценивая состояние здоровья новорожденных детей, родившихся от герпес-инфицированных матерей, важно учитывать состояние фетоплацентарного комплекса.
Каковы возможные последствия инфицирования ВПГ во время беременности? Какие формы герпетической инфекции у беременной женщины наиболее опасны для плода и новорожденного? Каковы возможные варианты клинических проявлений герпетической инфекции у н
Каковы возможные последствия инфицирования ВПГ во время беременности?
Какие формы герпетической инфекции у беременной женщины наиболее опасны для плода и новорожденного?
Каковы возможные варианты клинических проявлений герпетической инфекции у новорожденных?
Частота распространенности вируса простого герпеса (ВПГ) среди беременных в США составляет 22-36%, в Европе — 14-19%. За период с 1966 по 1993 год частота случаев герпеса у новорожденных также возросла с 2,4 до 28,2 случаев на 100 тыс. новорожденных [19]. В России распространенность ВПГ среди популяции увеличилась в период с 1993 по 1997 год с 8,5 до 14,1 случаев на 100 тыс. населения [5]. Однако истинная частота врожденного герпеса и герпеса новорожденных остается неустановленной, так как в большинстве стран мира отсутствуют правила обязательной регистрации герпетической инфекции [17].
Герпетическая инфекция может протекать атипично, латентно, что представляет большие трудности для своевременного ее распознавания и является причиной диагностических ошибок.
Общепринятые бактериологические и микробиологические исследования не всегда позволяют выявить возбудителя в острой фазе заболевания, и нередко болезнь принимает хроническое течение, а женщины становятся носителями вирусной инфекции. Специфическая локализация ВПГ приводит к хроническим воспалительным процессам (эндометриту, цервициту, вульвовагиниту), а во время беременности – к поражению плаценты, плода и невынашиванию [2, 3, 7].
-
Установлено, что внутриутробное инфицирование плода ВПГ может происходить:
- трансплацентарно, трансцервикально или восходящим путем из инфицированного родового канала и гениталий;
- трансовариально — из полости малого таза по маточным трубам. Инфицирование новорожденного может происходить:
- в процессе родов — при прохождении плода через родовые пути;
- после родов (аэрогенно или при контакте с инфицированным медицинским персоналом, инструментарием, при нарушении санитарно-противоэпидемического режима, через молоко) [1, 9].
Внутриутробная герпетическая инфекция в ранний период беременности обычно заканчивается развитием уродства плода и самопроизвольным выкидышем. Инфицирование плода во II-III триместрах беременности может привести к развитию клинически манифестирующего герпеса у новорожденного в виде генерализованных или локальных проявлений (поражение ЦНС, глаз, кожи, ротовой полости) и латентного носительства [2, 4, 7, 10].
Влияние герпетической инфекции на течение беременности и состояние плода обусловлено двумя основными механизмами.
Во-первых, возможно инфицирование плаценты, околоплодных вод и оболочек, а также самого плода. Это может привести к повреждению плаценты, оболочек, тератогенным изменениям в тканях эмбриона и плода, к развитию локальных или генерализованных поражений, а также к латентной инфекции плода, с последующими клиническими проявлениями в постнатальном периоде.
Во-вторых, возможно влияние ГИ с развитием у беременной лихорадки, нарушений функции фетоплацентарной системы, гомеостаза, гормонального баланса. Указанные причины могут приводить к ранним и поздним выкидышам, задержке развития беременности, преждевременным родам, антенатальной гипотрофии, гипоксии, уродствам и гибели плода, развитию врожденных форм инфекции у новорожденных [6, 8, 11].
Многообразие клинических проявлений обусловлено длительностью и формой манифестации инфекции у беременной, свойствами и вирулентностью вируса, состоянием плацентарного барьера и защитных сил как матери, так и плода [6].
Изучение влияния герпетической инфекции на течение беременности, развитие плода и новорожденного показало, что наиболее серьезную опасность в любом триместре беременности представляют генерализованные формы ГИ у женщин и первичная инфекция во время родов.
Частота инфицирования новорожденного при наличии у беременной первичной герпетической инфекции достигает 40-50%, тогда как при рецидивирующей – 5% [12, 15, 20]. Такое различие обусловлено тем, что при рецидивирующей форме инфекции интенсивность и продолжительность выделения вируса меньше, чем при первичной. Кроме того, защитное действие оказывают специфические антитела, пассивно передающиеся новорожденному от матери, страдающей рецидивирующей формой герпетической инфекции. Следует иметь в виду, что внутриутробное инфицирование плода может происходить как при первичной, так и при рецидивирующей герпетической инфекции. При массивной вирусемии создаются благоприятные условия для трансплацентарного проникновения ВПГ в плод.
| Герпетические инфекции у беременных относятся к числу самых распространенных заболеваний, определяющих внутриутробное инфицирование, эмбрио- и фетопатии, акушерскую патологию. В последние годы отмечена тенденция к увеличению инфицирования беременных вирусом простого герпеса и способностью ГИ, при определенных условиях, к эндемическому распространению |
Поскольку беременность сопровождается иммуносупрессией, она может быть одним из естественных предрасполагающих факторов реактивации латентной герпетической инфекции и способствовать более частому рецидивированию, диссеминации ВПГ в организме, развитию генерализованной инфекции. Основные функциональные системы оказываются в “режиме предельной загруженности” и не могут адекватно и надежно реагировать на развитие инфекции. Решающее значение в этом сложном патологическом процессе, по-видимому, принадлежит состоянию иммунологической реактивности организма беременной.
По особенностям клинической картины течения заболевания выделяют: первичный (острый) и рецидивирующий (хронический) герпес [1].
Первичный генитальный герпес в типичных случаях начинается с локальных симптомов: болей, высыпаний на коже больших и малых половых губ, промежности, слизистой влагалища и шейке матки, дизурии, уретральных и вагинальных выделений, болезненности в паху. Инкубационный период, как правило, колеблется от трех до семи суток. Очень высок процент (до 60%) атипичного течения, когда единственным симптомом инфекции являются вагинальные выделения. Изменения могут проявляться в виде зуда, жжения, эритемы, отечности, единичных или сгруппированных везикул и папул, эрозии и язв, которые разрешаются к 6–12 дню. После отторжения корочек происходит эпителизация пораженных участков без существенных изменений кожи и слизистых оболочек. Иногда в области пузырьков некоторое время сохраняется гиперемия и пигментация [1, 6].
Больные с генитальным герпесом нередко жалуются на плохое общее самочувствие, быструю утомляемость, головные боли, бессонницу, субфебрильную температуру. Эти симптомы максимально выражены в продроме и в первые два дня после появления элементов поражений, и постепенно ослабевают в течение первой недели заболевания.
Средняя продолжительность активного выделения ВПГ из шейки матки и уретры — 5–6 дней от момента появления элементов поражения. В то же время следует иметь в виду, что выделение вируса может происходить достаточно длительно и при отсутствии видимых изменений слизистой оболочки.
Рецидивирующий герпес характеризуется длительным и упорным течением. Постоянные обострения процесса чередуются с периодами ремиссии различной продолжительности. Обострение рецидивирующего герпеса происходит после различного рода внешних воздействий или снижения защитных сил организма.
Частота рецидивов и продолжительность ремиссий весьма вариабельна: от одного раза в два-три года до ежемесячных обострений.
Клиническая картина при рецидивирующем генитальном герпесе напоминает вариант острого его течения. При рецидивах обычно слабее, чем при первичной острой инфекции, выражены экссудативные процессы, более длительно протекает заживление [1, 5, 6].
Многолетнее течение генитального герпеса может обусловить возникновение стойких локальных изменений в виде гиперпигментации кожи и слизистых оболочек. Частые рецидивы генитального герпеса, сопровождающиеся зудом, чувством жжения, болями, наиболее тяжело переносятся больными и нередко приводят к развитию невротических состояний. В зависимости от локализации генитальной герпетической инфекции выделяют следующие уровни герпетического поражения органов малого таза:
- поражение наружных половых органов;
- герпетические кольпиты, цервициты, уретриты, циститы;
- герпетические эндометриты, сальпингоофориты.
Клинические проявления герпетических поражений внутренних половых органов не имеют специфических особенностей по сравнению с воспалительными процессами невирусной этиологии. Больные отмечают боль и чувство тяжести внизу живота и в крестце, умеренные серозные выделения из половых путей. Как первичный, так и рецидивирующий генитальный герпес могут сочетаться с другими видами герпетической инфекции. Однако первичная инфекция во время беременности представляет большую угрозу для жизни самой женщины и плода, поскольку возрастает риск диссеминации ВПГ и развития герпетического энцефалита, гепатита.
Наиболее тяжело протекает генерализованная форма герпетической инфекции, характеризующаяся множественным поражением органов и систем организма.
Анализ наблюдений свидетельствует о том, что генерализованная герпетическая инфекция у женщин развивается преимущественно в III триместре беременности и почти всегда ассоциируется с первичным заражением вирусом простого герпеса. Генерализация инфекции происходит постепенно. Первыми вовлекаются в патологический процесс половые органы, влагалище и шейка матки, являющиеся входными воротами инфекции. В 1/3 случаев первичный очаг локализуется на губах, в полости рта, гортани, иногда на коже [1, 3].
От момента первичного заражения или peaктивации латентной герпетической инфекции до генерализации проходит от одного-двух дней до недели и более. Такая вариабельность сопоставима с основными этапами патогенеза ВПГ-инфекции: миграцией вируса, вирусемией различной продолжительности и интенсивности, поражением кожи или слизистой оболочки. Клиническая картина генерализованного герпеса характеризуется бурным и полиморфным течением. Однако четко можно выделить выраженные симптомы общей интоксикации: лихорадку, озноб, мышечные боли, общую слабость.
Почти всегда первой поражается печень. Развивающийся гепатит (в 80–90% случаев), по-видимому, характеризует классическое течение генерализованного герпеса и требует внимательного отношения при проведении дифференциального диагноза с вирусными гепатитами, холециститом и поражением печени на фоне нефропатии. Редко выявляются клинические признаки миокардита, панкреатита, энцефалита, нефрита [13, 18, 21].
Часто генерализованная герпетическая инфекция во время беременности сопровождается умеренной лейкопенией на фоне нейтрофилеза, тромбоцитопенией, повышением уровня ферментов печени. При отсутствии специфической терапии летальность очень высока (до 70 – 85%).
Герпетическая инфекция у новорожденного может быть проявлением как внутриутробного (врожденная), так и перинатального (интра- и постнатального) инфицирования. В результате анте-, интра- или постнатального инфицирования может развиться генерализованная или локальная форма заболевания, проявляющиеся симптомами поражения ЦНС, глаз, кожи, ротовой полости. Врожденная герпетическая инфекция характеризуется широким полиморфизмом и выявляется при рождении либо в первые 24 – 48 ч жизни новорожденного.
Инкубационный период герпетической инфекции, приобретенной новорожденным во время или после родов, колеблется от 2 до 30 дней [1, 12].
-
Клиническая картина в основном характеризуется синдромными патогномоничными поражениями:
- кожи и слизистых оболочек;
- центральной нервной системы (повышение внутричерепного давления, гипотония, гипорефлексия, апноэ, нарушение терморегуляции, двигательная гиперреактивность, судорожный синдром);
- органов дыхания (цианоз, одышка, пневмония);
- печени (гепатоспленомегалия, желтуха, повышение уровня трансаминаз, прогрессирующая гипербилирубинемия, врожденные пороки развития печени и желчевыводящих путей);
- ДВС-синдромом (кровотечения).
Локализованные поражения кожи, слизистой оболочки глаз или полости рта обычно проявляются на 10 – 11-е сутки после рождения и составляют 20 – 30% всех форм манифестации герпетической инфекции у новорожденных. При локализованной форме болезни имеются единичные или сгруппированные везикулярные высыпания, располагающиеся чаще на коже лица и конечностей. Везикулы быстро вскрываются, и образуются мелкие эрозии. Кроме везикулярных повреждений, может быть пятнистая эритема. Иногда наблюдается повторное появление свежих высыпаний.
Кожные проявления герпетической инфекции у новорожденных обычно протекают благоприятно, однако в ряде случаев (до 20%) наблюдаются неврологические нарушения. При этом клинические признаки поражения ЦНС отчетливо выявляются в более поздние сроки. Поражения глаз проявляются кератоконъюнктивитом и хориоретинитом. Герпетические проявления инфекции в полости рта у недоношенных наблюдаются в три раза чаще, чем у новорожденных, родившихся в срок. При этом в большинстве случаев характерным является поражение слизистой оболочки неба в виде участков поверхностного некроза эпителия, которые преимущественно локализуются на границе твердого и мягкого неба, симметрично с обеих сторон, реже – на небных дужках. Инкубационный период заболевания колеблется от 2 до 12 дней. У некоторых детей герпес в полости рта может проявляться в более поздние сроки — от 10 до 30 дней [8, 19, 22].
Локализованные поражения ЦНС встречаются у 30 – 35% новорожденных, проявляются в основном в 15 – 17-дневном возрасте и характеризуются более высокой летальностью – до 50 – 70%. Сочетание симптомов поражения герпетической инфекцией ЦНС с локализованными формами является неблагоприятным прогностическим признаком.
Особенно тяжело протекает генерализованная герпетическая инфекция у недоношенных детей. Летальность достигает 80 – 95%. При этой форме заболевания выявляются повреждения практически в каждом органе ребенка, однако наиболее выражены они в головном мозге, печени, легких, надпочечниках. Примерно у 60 – 70% детей генерализованная инфекция характеризуется поражением ЦНС.
При анализе клинической картины генерализованной герпетической инфекции и локализованного поражения ЦНС у новорожденных необходимо учитывать тот факт, что 20% из них могут не иметь никаких признаков поражения кожи, а это в значительной степени затрудняет диагностику заболевания.
Таким образом, у беременных с герпетической инфекцией должен быть предусмотрен комплекс диагностических, профилактических и лечебных мероприятий, направленных на исключение или уменьшение случаев возникновения врожденной внутриутробной инфекции, что должно быть обязательным условием создания эффективной системы профилактики и охраны здоровья матери и ребенка.
В статье рассматриваются некоторые аспекты этиопатогенеза герпесвирусных заболеваний у детей, современные подходы к лекарственной терапии и профилактике рецидивов.
This article discusses some aspects of the pathogenesis of herpes-associated diseases in children, modern approaches to drug therapy and relapse prevention.
В последние годы среди основных возбудителей вирусных инфекций у детей особое место занимают герпес-вирусы, что связано с их повсеместным распространением, широким разнообразием, полиорганностью поражения, многообразием клинических проявлений, а также высокой частотой хронического течения. Герпес-ассоциированные заболевания входят в число наиболее распространенных и плохо контролируемых инфекций человека. Это связано с тем, что герпес-вирусы могут длительно бессимптомно циркулировать в организме человека с нормальной иммунной системой, а при иммуносупрессии способствовать развитию тяжелых заболеваний, вплоть до угрожающих жизни генерализованных инфекций. Так, по данным Всемирной организации здравоохранения (World Health Organization, WHO), смертность от герпетической инфекции составляет около 16% и находится на втором месте после гепатита среди вирусных заболеваний [1].
.jpg)
Вирионы герпес-вирусов термолабильны — они инактивируются в течение 30 мин при температуре 50–52 °C, в течение 20 ч — при температуре 37,5 °C, но хорошо переносят лиофилизацию. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, на влажных медицинских материалах (вата и марля) — до их высыхания при комнатной температуре (до 6 ч). Уникальность герпес-вирусов заключается в том, что они способны непрерывно или циклично размножаться в инфицированных клетках тропных тканей (персистенция), а также пожизненно сохраняться в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных нервных ганглиев (латенция) и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов. Однако способность к персистенции и латенции у различных штаммов неодинаковая: наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна–Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами вирусов. Основной путь инфицирования — воздушно-капельный, при прямом контакте или через предметы обихода (общие посуда, полотенца, носовые платки и пр.). Отмечается также оральный, генитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции. ВПГ 1-го и 2-го типов, цитомегаловирус входят в число возбудителей TORCH-инфекций, способствуют развитию серьезных заболеваний новорожденных и детей младшего возраста. Вирусы простого герпеса, цитомегаловирус, вирус Эпштейна–Барр рассматриваются как индикаторы СПИДа в связи с их частым обнаружением при данном заболевании [3, 4]. С герпес-вирусами связывают развитие синдрома хронической усталости (Chronic fatigue syndrome — CFS) [5].
Клинически герпес-инфекция у детей может протекать в виде ветряной оспы (вирус варицелла зостер), инфекционного мононуклеоза (вирус Эпштейна–Барр), внезапной экзантемы (вирус герпеса человека 6-го и 7-го типов), афтозного стоматита (ВПГ 1-го или 2-го типа), мононуклеозоподобного синдрома (цитомегаловирус). У подростков и взрослых людей часто инфекция протекает бессимптомно, что объясняется как биологическими свойствами штаммов, так и индивидуальными особенностями иммунного ответа. Часто при снижении иммунореактивности организма герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому течению основного заболевания, развитию осложнений. Велика роль герпесвирусных инфекций, особенно цитомегаловирусной, в формировании младенческой смертности. Наибольшую угрозу для жизни и здоровья детей представляют герпетические нейроинфекции — летальность при них достигает 20%, а инвалидизация — 50%. Тяжело протекают офтальмогерпес (развитие катаракты или глаукомы — до 50%), генитальный герпес, генерализованная форма Эпштейна–Барр-вирусной инфекции (инфекционного мононуклеоза) [1, 6].
Герпесвирусная инфекция относится к трудноконтролируемым заболеваниям. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения данной патологии, средств, обеспечивающих полное излечение, не существует. Это обусловлено генотипическими особенностями возбудителя, формированием резистентности герпес-вирусов и молекулярной мимикрией.
Открытые с помощью методов молекулярной биологии механизмов репликации герпес-вирусов, а также изучение взаимодействия вируса с клеткой позволили создать целый ряд эффективных химиотерапевтических средств, обладающих противогерпетической активностью. Однако, эффективно купируя острые проявления инфекции, они не предотвращают рецидивирования, не всегда снижают частоту рецидивов.
Учитывая, что при герпес-ассоциированных инфекциях, как и при других хронических заболеваниях с длительной персистенцией вируса, развиваются иммунодефицитные состояния, для повышения эффективности лечения в схемы терапии наряду с противовирусными препаратами приходится включать препараты, способствующие коррекции иммунного статуса больного. Все это диктует необходимость правильно подбирать лекарственное средство, его дозу и длительность приема, при необходимости использовать комбинацию различных препаратов, избегая при этом полипрагмазии. Определенную сложность терапии в детском возрасте вызывают возрастные ограничения для ряда лекарственных средств, наличие нежелательных лекарстввенных реакций (НЛР) и противопоказаний.
В настоящее время для лечения герпесвирусных заболеваний и профилактики рецидивов используют следующие группы препаратов (табл.).
При лечении герпес-инфекций следует придерживаться комплексного подхода. Длительность и интенсивность терапии определяются возрастом больного, клинической формой заболевания, тяжестью его течения, а также наличием осложнений и сопутствующей патологии. Лечебно-профилактические мероприятия следует разделять на несколько этапов.
- Острый период болезни (рецидив) — охранительный режим, лечебное питание, противовирусные препараты, интерфероны и их индукторы. По показаниям назначаются иммуноглобулины, антибактериальные препараты местного и системного действия, глюкокортикоиды, нейро- и ангиопротекторы, гепатопротекторы, кардиотропные препараты, ингибиторы протеаз. Симптоматическая терапия может включать жаропонижающие, отхаркивающие и муколитические препараты.
- Ремиссия, стихание основных клинических проявлений (иммуномодуляторы, адаптогены растительного происхождения, пре- и пробиотики, витамино-минеральные комплексы).
- Профилактика рецидивов (специфическая профилактика — вакцинация, санация хронических очагов инфекции, восстановление иммунного статуса и пр.).
Следует отметить, что сочетанное применение противовирусных препаратов и иммунобиологических средств имеет ряд преимуществ. Во-первых, комплексная терапия обеспечивает синергидный эффект. Во-вторых, позволяет снизить дозу противовирусного химиопрепарата, уменьшая вероятность развития НЛР, сокращая его токсическое воздействие на организм и снижая вероятность возникновения устойчивых штаммов герпес-вирусов. Кроме того, это значительно сокращает продолжительность острого периода болезни и сроки лечения.
Одним из препаратов, показавшим свою эффективность при лечении герпес-ассоциированных заболеваний у детей, является инозин пранобекс. Инозин пранобекс — это синтетическое комплексное производное пурина, обладающее иммуностимулирующей активностью и неспецифическим противовирусным действием. Препарат восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитарных клеток, стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов, оказывает стимулирующее влияние на активность цитотоксических Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию иммуноглобулина G, интерферонов, интерлейкинов (ИЛ-1 и ИЛ-2), снижает образование провоспалительных цитокинов (ИЛ-4 и ИЛ-10), потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов. Механизм противовирусного действия препарата связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации, усилении подавленного вирусами синтеза мРНК лимфоцитов, что сопровождается угнетением биосинтеза вирусной РНК и трансляции вирусных белков.
Инозин пранобекс малотоксичен, хорошо переносится, в России рекомендован в виде таблеток детям с 3-летнего возраста (масса тела более 15 кг). За рубежом он доступен и в форме сиропа и не имеет возрастных ограничений. Препарат назначается по 50–100 мг/кг/сут внутрь в 3–4 приема в течение всего острого периода болезни (5–10 дней в зависимости от длительности вирусемии и выраженности синдрома интоксикации). В качестве поддерживающей терапии для восстановления иммунологических показателей возможно назначение препарата по иммуномодулирующей схеме (50 мг 2 раза в день в течение 14–28 дней). Доказана высокая эффективность курсовой терапии инозином пранобексом (50 мг/кг массы тела в сутки в 3–4 приема внутрь, три курса лечения по 10 дней с интервалом 10 дней) [7], комбинированной курсовой терапии с использованием инозина пранобекса и рекомбинантного интерферона α-2β (3 курса по 10 дней с интервалом 14 дней) у детей с микст-вирусными инфекциями [8].
Применение инозина пранобекса как препарата с иммунотропным и противовирусным действием на различных этапах лечебно-профилактических мероприятий позволяет избежать полипрагмазии, тем самым снизить медикаментозную нагрузку на организм и уменьшить риск нежелательных эффектов.
Литература
- Кускова Т. К., Белова Е. Г. Семейство герпес-вирусов на современном этапе // Лечащий Врач. 2004, № 5, с. 64–69.
- Hjalgrim H., Askling J., Rostgaard K. et al. Characteristics of Hodgkin’s lymphoma after infectious mononucleosis // N. Engl. J. Med. 2003; 349: 1324–1332.
- Никольский И. С., Юрченко В. Д., Никольская К. И. Характеристика активной хронической Эпштейна–Барр вирусной инфекции: клинико-иммунологический синдром // Современные инфекции. 2003, № 3, с. 60–62.
- Katz B. Z., Shiraishi Y., Mears C. J., Binns H. J., Taylor R. Chronic fatigue syndrome after infectious mononucleosis in adolescents // Pediatrics. 2009, Jul; 124 (1): 189–193.
- Lerner A. M., Begar S. N., Deeter R. G. IgM serum antibodies to Epstein-Barr virus are uniquely present in a subset of patients with the chronic fatigue syndrome // In Vivo. 2004, Mar-Apr; 18 (2): 101–106.
- Maakaroun N. R., Moanna A., Jacob J. T., Albrecht H. Viral infections associated with haemophagocytic syndrome // Rev. Med. Virol. 2010, Mar; 20 (2): 93–105.
- Симованьян Э. Н., Денисенко В. Б., Григорян А. В. Эффективность применения инозина пранобекс у часто болеющих детей с хронической Эпштейна-Барр вирусной инфекцией: результаты рандомизированного исследования // Вопросы современной педиатрии. 2011, Т. 10, № 2, С. 16–21.
- Нестерова И. В., Ковалева С. В., Чудилова Г. А., Ломтатидзе Л. В., Клещенко Е. И., Шинкарева О. Н. Динамика изменений фенотипа и функциональной активности нейтрофильных гранулоцитов у иммунокомпрометированных детей с повторными ОРВИ, ассоциированными с герпесвирусными инфекциями, на фоне комбинированной интерфероно- и иммунотерапии // Цитокины и воспаление. 2014, Т. 13, № 1, с. 113.
Т. А. Бокова, доктор медицинских наук, профессор
Для цитирования: Тютюнник В.Л., Зайдиева З.С., Алиева С.А. Подготовка и планирование беременности при герпетической инфекции. РМЖ. 2005;1:28.
В настоящее время во многих странах мира, в том числе и в России, отмечен рост инфекций, передаваемых половым путем, которые прочно занимают ведущее место в структуре акушерско–гинекологической заболеваемости. Чаще всего половая инфекция бывает обусловлена несколькими патогенными факторами – вирусами, микробами, грибами, простейшими, которые вызывают похожие по клиническому течению, но различные по патогенезу и методам лечения заболевания.
Среди вирусных поражений урогенитального тракта женщин наиболее распространены герпетическая, цитомегало– и папилломавирусная инфекции, в связи с чем Европейским региональным бюро ВОЗ они внесены в группу болезней, которые определяют будущее инфекционной патологии.
В возникновении герпетических заболеваний половых органов основная роль принадлежит вирусу простого герпеса, единственным резервуаром которого являются зараженные им люди, которые распространяют его среди населения. Попав в организм человека, вирус простого герпеса сохраняется в нем на протяжении всей жизни, периодически вызывая заболевания различной степени тяжести.
Учитывая, что генитальный герпес относится к пожизненно персистирующим инфекциям, существует несколько видов клинических проявлений. Рецидивы заболевания наступают в результате периодически возникающего иммунодефицита у практически здоровых людей под влиянием провоцирующих факторов. Рецидивирующий характер генитальный герпес приобретает у трети инфицированных людей. Заражение вирусом простого герпеса возможно не только в острой стадии заболевания, но и в стадии глубокой ремиссии.
Генитальный герпес относится к заболеваниям, передаваемых половым путем (в 99,9% случаев). Аутоинокуляция может наблюдаться в тех случаях, когда больной сам переносит вирус из очага инфекции на незараженные части тела. Вертикальный путь передачи возможен в случае трансплацентарного инфицирования плода. Возбудителю этой инфекции отводится определенная роль в этиологии спонтанных абортов и преждевременных родов, а также в нарушении эмбриогенеза и врожденной патологии новорожденных и др., что считается результатом внутриутробной вирусной инфекции.
Знание принципов отбора пациентов, нуждающихся в углубленном обследовании с целью верификации диагноза генитального герпеса, позволяет в значительной мере повысить эффективность профилактических мероприятий, направленных на предупреждение осложненного течения беременности, а также внутриутробной инфекции.
Работы, посвященные вопросам подготовки к беременности женщин с хронической рецидивирующей герпетической инфекцией, крайне малочисленны и направлены, как правило, на коррекцию отдельных звеньев патологического состояния.
Исходя из вышеизложенного, важнейшим и неотъемлемым этапом является правильная предгравидарная подготовка этих женщин. Поэтому проведение мероприятий по борьбе с инфекцией необходимо начинать до наступления беременности.
Общеизвестно, что лечение герпетической инфекции должно быть своевременным, этиотропным и комплексным. При выявлении генитальной герпетической инфекции, независимо от уровня поражения репродуктивной системы, показано проведение как базисных видов терапии (комплекс противовирусного лечения), так и лечение сопутствующих герпесу заболеваний.
Основными задачами противогерпетической терапии являются:
• уменьшение клинических проявлений инфекции;
• предупреждение рецидивов;
• предупреждение передачи инфекции половому партнеру или новорожденному.
Стратегия лечения больных с рецидивирующим герпесом определяется рядом факторов: частотой рецидивов и тяжестью клинических симптомов (на основании субъективной оценки больного), состоянием иммунной системы, психосоциальными особенностями, наличием риска передачи инфекции половому партнеру или новорожденному, а также экономическими аспектами терапии. В настоящее время существует два варианта терапии генитального герпеса с использованием аналогов нуклеазидов: эпизодическая и превентивная (супрессивная) терапия.
Накопленный нами опыт подготовки к беременности женщин с генитальным герпесом показывает, что одним из современных и самых эффективных противовирусных препаратов является Алпизарин – противовирусное средство, получаемое из травы копеечника. Препарат активен в отношении ДНК–содержащих вирусов (Herpes simplex I и II типа, Varicella zoster, в меньшей степени – цитомегаловируса и вируса иммунодефицита человека). Алпизарин ингибирует репродукцию вируса простого герпеса на ранних этапах его развития, подавляет бактериальную нуклеазу без выраженного ингибирующего действия на вирусную нейраминидазу, оказывает умеренное бактериостатическое действие в отношении грамположительных и грамотрицательных бактерий, простейших и микобактерий туберкулеза. Препарат обладает иммуностимулирующим действием в отношении клеточного и гуморального иммунитета, индуцирует продукцию g–интерферона в клетках крови.
Абсорбция Алпизарина – высокая, время наступления Cmax – 1–3 ч, препарат хорошо проникает в органы и ткани печени, почек, сердца, селезенки; через 12 ч обнаруживается в небольшом количестве в тканях мозга, выводится почками и через желудочно–кишечный тракт.
Показаниями к применению препарата являются: инфекции кожи и слизистых оболочек, вызванные вирусами Herpes simplex и Varicella zoster.
Алпизарин назначают внутрь (независимо от приема пищи) по 0,1–0,2 г 3–4 раза в сутки в течение 5–10 дней. Одновременно назначают местные аппликации 5% мази на кожу и 2% мази – на слизистые оболочки. Мазь наносят на пораженные участки кожи без повязки 2–6 раз в сутки. Терапевтическое действие более выражено при его использовании в ранние сроки заболевания. Длительность лечения – 10–30 дней. При рецидиве курс повторяют. При острых и рецидивирующих формах простого герпеса экстрагенитальной локализации при единичных высыпаниях мазь наносят на очаг поражения 2–3 раза в день в течение 3–5 сут. В случае распространенных высыпаний, а также при наличии лихорадки, лимфаденопатии назначают одновременно внутрь и в виде мази в течение 5–14 дней. При генитальном герпесе 2% мазь наносят на пораженные участки 4–6 раз в день в течение 7–10 сут, при рецидивирующем течении заболевания – дополнительно внутрь в течение 5–14 сут. Для профилактики рецидивов простого герпеса назначают пероральный курс через 1 мес после окончания лечения и затем в межрецидивные периоды курсами по 10–14 дней.
Эпизодическая терапия подразумевает пероральный прием препаратов в момент обострения инфекции. Такой метод терапии показан больным с редкими, клинически невыраженными обострениями и при наличии четко определяемого продромального синдрома, во время которого следует начинать прием препаратов. Применение во время рецидива генитального герпеса Алпизарина по 0,2 г 4 раза в сутки в течение 5 дней значительно уменьшает болевые ощущения и дискомфорт в зоне поражения, сокращает время заживления герпетических высыпаний на 1–2 дня и период вирусовыделения.
Супрессивная терапия показана больным с редкими, но тяжелыми рецидивами, в дискордантных по генитальному герпесу парах с целью профилактики передачи инфекции, при наличии выраженных психосоциальных и психосексуальных реакций на рецидивы, а также при значительном влиянии инфекции на качество жизни больного. Препараты применяют ежедневно в непрерывном режиме в течение длительного времени. При проведении превентивной (супрессивной) терапии Алпизарин назначают по 0,2 г 4 раза в сутки.
Важным условием правильной подготовки к беременности является нормализация иммунного и интерферонового статуса больной. Поэтому на фоне блокады репликации вируса перспективным направлением профилактики и лечения герпетической инфекции является стимуляция неспецифической резистентности организма в зависимости от показателей иммунного и интерферонового статуса больных (препараты иммуноглобулина, индукторы интерферона, энзимотерапия и др.).
Так как наличие очагов хронической инфекции сопровождается нарушением процессов энергетики и метаболизма на клеточном, тканевом и органном уровнях, предгравидарная подготовка должна обязательно включать метаболическую терапию. С этой целью назначают комплекс препаратов, стимулирующих биоэнергетические процессы в клетках и тканях – метаболическую терапию, состоящую из 2–х комплексов лечения:
I комплекс (с 8–9–го дня по 13–14–й день менструального цикла):
1. Кокарбоксилаза по 0,1 г 1 раз внутримышечно или бенфотиамин по 0,01 г 3 раза в сут.
2. Рибофлавин мононуклеотид по 1–2 (0,005–0,01 г) табл. 3 раза в сут. или 1 мл внутримышечно 1 раз в сут.
3. Пантетонат кальция по 1 табл. 3 раза в сут. или 20% раствор 2 мл внутримышечно 1 раз в сут.
4. Липоевая кислота по 1 (0,025 г) табл. 3 раза в сут. или 0,5% раствор 4 мл внутримышечно 1 раз в сут.
5. a–токоферола ацетат по 1–2 (0,05–0,1 г) капсуле 3 раза в сут. или 1 мл внутримышечно.
II комплекс (с 15–го дня по 22–й день менструального цикла):
1. Рибоксин по 0,2 г 3 раза в сут.
2. Пиридоксин по 1 (0,02 г) табл. 3 раза в сут.
3. Фолиевая кислота по 1 (0,001 г) табл. 3 раза в сут.
4. Оротат калия по 1 (0,5 г) табл. 3 раза в сут.
5. a–токоферола ацетат по 1–2 (0,05–0,1 г) капсуле 3 раза в сут. или 1 мл внутримышечно.
Метаболическую терапию назначают в течение 3 месяцев подряд до наступления беременности.
Иммуно– и интерферонокорригирующую и антибактериальную терапию целесообразно проводить на фоне приема энзимопрепаратов. Основанием для применения системной энзимотерапии является ее иммуномодулирующий и противовоспалительный эффект, способность ограничивать проявления аутоиммунных процессов, нормализация микроциркуляции. Кроме того, применение ферментативного комплекса способствует более глубокому проникновению антибиотиков в очаг воспаления.
При проведении вышеизложенной терапии возможно одновременное или последовательное использование пассивной иммунизации специфическими противогерпетическими иммуноглобулинами в титре 1:320 или 1:640. Пациентам с острыми проявлениями генитального герпеса специфический противогерпетический иммуноглобулин назначали по 2 дозы с интервалом в 3–4 дня на курс 5 внутримышечных инъекций.
Для профилактики рецидивов герпетической инфекции может также применяться вакцинотерапия. В настоящее время все существующие вакцины подразделяются на живые, инактивированные (цельновирусные и субъединичные) и рекомбинантные. Теоретической предпосылкой для использования вакцинотерапии при генитальном герпесе явилось предположение о возможности усиления специфического противогерпетического иммунитета на фоне повторного введения вирусного антигена. Вакцина представляет собой выращенный на культуре клеток куриного эмбриона и инактивированный формалином вирус простого герпеса 1–го и 2–го антигенного типа. Важной методологической особенностью использования вакцины является ее применение с целью профилактики рецидивов заболевания только в периоде затухания острых его явлений, что позволяет получить стойкий противорецидивный эффект. Поэтому вакцину следует назначать сразу после курса химиопрепаратов и иммуноглобулинов.
Помимо лечения герпетической инфекции, показано проведение дополнительной терапии. Лечение скрыто протекающего хронического воспалительного процесса в эндометрии (вирусно–бактериальной этиологии) должно проводиться на фоне базисной терапии и быть этиотропным и патогенетически обоснованным. Учитывая превалирование анаэробно–аэробных ассоциаций, а также мико– уреаплазменной и хламидийной инфекций, показано использование антибиотиков широкого спектра действия.
Таким образом, планирование и подготовка к беременности возможны только при стойкой и длительной (более 6 месяцев) ремиссии герпетической инфекции, а также после устранения нарушений в репродуктивной системе с учетом основных факторов прерывания беременности. Проведение ранней диагностики, профилактики и лечения инфекционной патологии репродуктивной системы женщин до наступления беременности, предгравидарная подготовка и планирование беременности позволяют снизить частоту осложнений гестационного периода, тяжесть течения (частоту и длительность рецидивов) инфекционного процесса при беременности, тяжелые формы неонатальной инфекции, перинатальную заболеваемость и смертность.
Что такое задержка речевого развития? Причины возникновения, диагностику и методы лечения разберем в статье доктора Гавриловой Татьяны Алексеевны, детского невролога со стажем в 21 год.
Над статьей доктора Гавриловой Татьяны Алексеевны работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Задержка речевого развития (ЗРР) — более позднее в сравнении с возрастными нормами овладение ребёнком устной речью [2] . Например, в среднем в два года дети уже объединяют слова в небольшие фразы, в три — строят предложения, а в четыре — соединяют их в рассказ.
Задержка речевого развития может сопровождать следующие нарушения:
- расстройство экспрессивной речи — ребёнок не произносит слова, не строит диалог;
- проблемы с рецептивной речью — не воспринимает речь;
- отклонение в речевой артикуляции — не произносит звуки;
- афазия при аутизме — не говорит и не понимает речь;
- умственная отсталость — нарушены интеллект и поведение, не развиты социально-бытовые навыки;
- глухота.
ЗРР могут вызывать причины, возникшие во время беременности. Основные из них:
- хроническая внутриутробная гипоксия плода;
- поражение центральной нервной системы из-за недостатка кислорода в органах и тканях;
- внутриутробное инфицирование; (избыток спинномозговой жидкости в полости черепа);
- генетические заболевания, в том числе синдром Дауна;
- недоношенность;
- родовая травма;
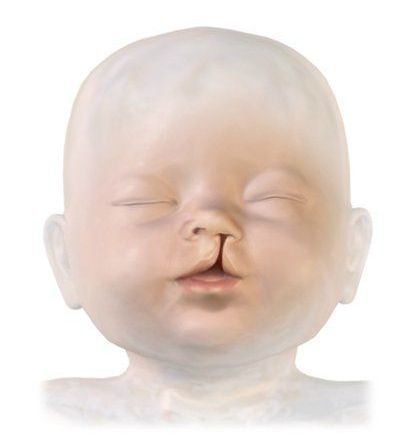
- аномалии развития, например волчья пасть, заячья губа, микрогнатия (недоразвитая нижняя челюсть), которые затрудняют работу органов артикуляции [2][4].
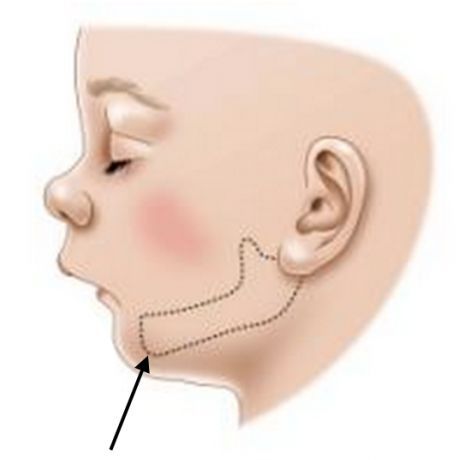
Факторы, приводящие к ЗРР после рождения:
- нейроинфекция, например менингит , менингоэнцефалит;
- снижение слуха после отита;
- дефицит общения;
- тяжёлая болезнь, госпитализация, сильный стресс — ребёнок может отставать в развитии после ожога, сильного испуга, потери близкого человека;
- генетическая предрасположенность — высокая чувствительность речевых зон мозга к повреждающим факторам [3][11].
Диагноз "задержка речевого развития" не ставят до двух лет, так как речь может спонтанно появиться без помощи специалистов. С двух до трёх лет ребёнку могут диагностировать "замедление темпов речевого развития". В таком случае ему желательно начать заниматься с логопедом.
Если в три года постановлен диагноз "задержка речевого развития", необходима комплексная медико-педагогическая реабилитация. Без лечения к пяти годам ребёнок начинает заметно отставать в психоречевом развитии. Это возникает из-за того, что он не общается с другими детьми и взрослыми, не задаёт вопросов, расширяющих кругозор. В дальнейшем это приводит стойкому речевому и интеллектуальному дефектам, и ребёнок сможет обучаться только в специальной коррекционной школе.
Таким образом, важно своевременно выявить задержку и начать развивать речь. Оптимальный возраст для педагогического и медицинского воздействия — 3-5 лет.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы задержки речевого развития
Отставание в развитии проявляется различными симптомами [2] [8] [9] [11] :
- При задержке речевого развития (ЗРР) — ребёнок говорит, но словарный запас и построение фраз соответствуют более младшему возрасту. Например в три года он не составляет фразы, а использует единичные слова, как годовалые дети; у ребёнка нарушена дикция и его понимают только близкие родственники.
- При задержке психоречевого развития (ЗПРР) — дети воспринимают речь на бытовом уровне, но не понимают сложные предложения и не вступают в диалог. Игры примитивные, чаще подвижные или разрушительные без сложного ролевого компонента. С опозданием формируются бытовые навыки — ребёнок не умеет самостоятельно есть, одеваться, ходить в туалет.
- При моторной алалии — ребёнок понимает речь, выполняет просьбы и сложные задания педагога, но не говорит. Интеллект, как правило, сохранен, бытовые навыки сформированы.
- При сенсомоторной алалии— ребёнок слышит звуки, но не понимает речь. Отсутствует пассивный словарный запас: дети не запоминают названия предметов на слух. В результате нет и активного словарного запаса: ребёнок не произносит слова.
- При нарушении дикции(дизартрии)— у детей часто приоткрыт рот, нарушено звукопроизношение, усилено слюнотечение. Патология связана с повреждением отделов головного мозга: коры, мозжечка, стволовых и подкорковых структур, проводящих путей. При мозжечковой дизартрии нарушен темп речи (брадилалия — замедление темпа), ребёнок говорит тихим голосом, произносит слова по слогам. Это вызвано ослабленным речевым дыханием.
- При аутизме ребёнок может механически произносить слова и фразы (эхолалия), не понимать смысл сказанного, либо же понимать речь, но не отвечать на неё. Заболевание проявлено характерными чертами: стереотипными движениями и играми, аутоагрессией (ребёнок бьёт и кусает себя). Дети не смотрят в глаза, не обращаются с просьбами, избирательны в пище, избегают контакта с посторонними людьми.
Патогенез задержки речевого развития
Патогенез зависит от причины, которая привела к задержке речевого развития [2] [3] [4] :
- При перинатальном поражении головного мозга ( гипоксии, внутриутробном инфицировании, кровоизлиянии при родах) часть клеток головного мозга погибает, а оставшиеся повреждены и не формируют между собой новые связи. Взаимодействие между нейронами — необходимое условие для того, чтобы сформировались речевые навыки. В зависимости от пострадавших зон головного мозга, возникают различные нарушения. Например, если повреждена зона Вернике, то ребёнок не понимает речь и у него не формируется пассивный словарный запас — он не запоминает названия предметов и действий. Если пострадала зона Брока, то не пополняется активный словарный запас и ребёнок не произносит слова.
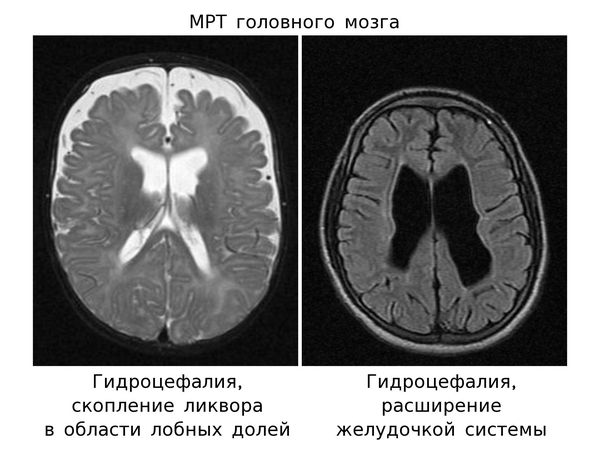
- При гидроцефалии повышенное внутричерепное давление приводит к расширению желудочковой системы с истончением белого вещества головного мозга. Происходит сдавление проводящих путей, которые связывают различные зоны мозга. Нарушается взаимодействие речевых зон, необходимое, например, для ответа на вопросы. Когда ребёнку задают вопрос — "понимает" его зона Вернике. Она связывается по проводящим путям с зоной Брока, которая "формирует" активный ответ, и ребёнок отвечает. Но если пострадали проводящие пути, то ребёнок не отвечают на вопросы, хотя понимает речь и спонтанно произносит слова. Если повреждены проводящие пути, обеспечивающие нервами речевую мускулатуру, то у ребёнка нарушается дикция.
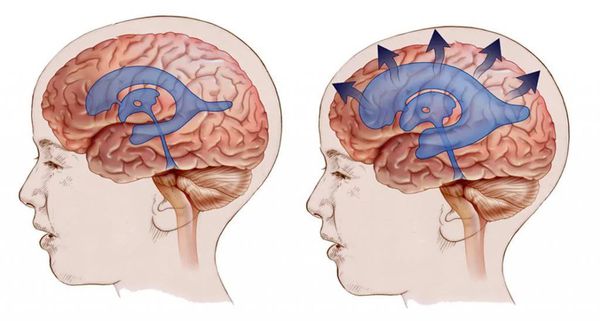
- При внутриутробных аномалиях развития и генетических заболеваниях, например при синдроме Дауна, размеры языка часто не соответствуют нижней челюсти, что затрудняет произнесение звуков. Кроме того, у детей с синдромом Дауна мышцы губ, языка, челюсти расслабленные и вялые, поэтому ими труднее управлять.
- При аномалиях развития мозжечка, таких как гипоплазия полушарий мозжечка (уменьшение его в размерах) или ретроцеребеллярная киста (новообразование в задней черепной ямке за мозжечком), ребёнок произносит слова тихим голосом по слогам. Это вызвано слабой воздушной струёй и происходит потому что киста сдавливает мозжечок и нарушает его работу.
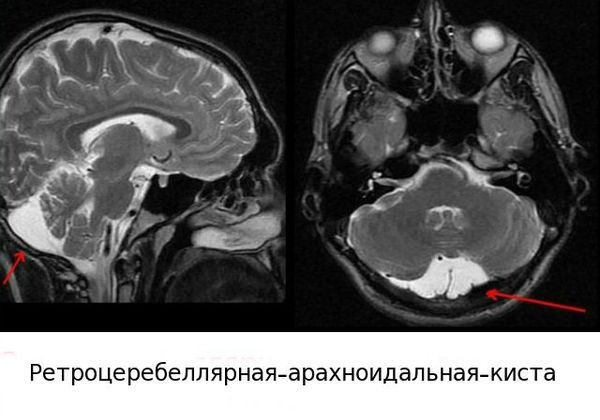
Внешние факторы, сдерживающие речевое развитие [1] [8] :
- Недостаточная речевая среда, например вместо общения дети весь день смотрят мультфильмы;
- Постоянное использование соски в 2-3 года;
- Двуязычность в семье может усилить даже небольшие нарушения речи. Мозгу сложно "разобраться" в разных структурах языков.
Классификация и стадии развития задержки речевого развития
Педагоги и неврологи используют разные классификации. Неврологи выделяют:
1. Нарушения, вызванные органическим повреждением головного мозга:
- алалия — развивается при повреждении зон коры головного мозга до того, как сформировалась речь. Выделяют моторную алалию, при которой ребёнок не говорит, но понимает речь и сенсомоторную — не воспринимает речь и не говорит;
- афазия — ранее ребёнок разговаривал, но перестал из-за поражения корковых зон речи, например после менингита или сотрясения головного мозга.
- дизартрия — произнесение звуков нарушено из-за повреждения нервной системы и связанной с ней речевой мускулатуры;
2. Функциональные нарушения речи, например заикание .
3. Дефекты строения артикуляционного аппарата — заячья губа, расщелина верхнего нёба.
4. Задержка развития речи у недоношенных детей, ослабленных длительной болезнью или недостатком общения.
Педагоги применяют другую классификацию . Она помогает объединить детей в группы со схожим уровнем речевого развития [5] [15] :
- первый уровень общего недоразвития речи (ОНР) — это "безречевые дети", которые не говорят совсем либо произносят отдельные простые слова.
- второй уровень ОНР — в разговоре используют простые фразы.
- третий уровень ОНР — строят предложения, общаются, но в речи много ошибок (путают окончания, рода, числа, падежи, предлоги).
Занятия с логопедом-дефектологом развивают речь от первого уровня ОНР ко второму и третьему. При этом дикция может длительно оставаться нарушенной.
Осложнения задержки речевого развития
Речь — это основа интеллекта. Общаясь со сверстниками и взрослыми, дети познают окружающий мир, расширяют кругозор, учатся формулировать мысли. Если ребёнок не говорит, он всё сильнее отстаёт от сверстников и задержка развития усугубляется. До трёх лет это лишь отставание в темпе развития речи, в три-четыре года — задержка речевого развития, а в пять лет уже задержка психоречевого развития. Без комплексной медико-педагогической реабилитации у ребёнка нарушается память и внимание, появляются трудности в обучении. Такие дети с трудом учатся писать, читают медленно и с ошибками, испытывают проблемы с пониманием и пересказом прочитанного. Это приводит к тому, что ребёнок в дальнейшем может обучаться только в специальной корректирующей школе [1] [5] [8] [14] .
Диагностика задержки речевого развития
Задержку развития речи выявляют детский невролог и логопед-дефектолог [2] [3] [11] [15] .
Невролог уточняет у родителей, как протекали беременность и роды, в каком возрасте ребёнок начал говорить, строит ли он предложения, понимает ли простые и сложные фразы. При подозрении на умственную отсталость или аутизм невролог направляет ребёнка к психиатру. При снижении слуха — к сурдологу. Специалист определяет уровень нарушения и при необходимости подбирает слуховой аппарат.
Невролог может назначить следующие обследования:
- электроэнцефалография (ЭЭГ) — чтобы исследовать деятельность головного мозга;
- ультразвуковая доплерография (УЗДГ) — проверить состояние сосудов головного мозга;
- компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) головного мозга — для выявления аномалий развития, повреждения коры или проводящих путей, гидроцефалию.
Все эти исследования необходимы, чтобы выявить причину нарушения. Для постановки диагноза "задержка речевого развития" достаточно установить отставание от возрастных норм развития речи [1] [2] [7] :
- В год — ребёнок произносит до 10 простых слов: мама, папа, дай, на, ням-ням, бибика или другие подобные слова.
- В два — речь усложняется, словарный запас расширяется до 50 слов и более. Дети соединяют слова между собой во фразы и задают вопросы, например: " Что это? " .
- В три — появляются предложения и много новых слов, ребёнка начинают понимать посторонние люди. Дети знают и называют свой пол, возраст, имена родителей.
- В четыре — ребёнок учится соединять предложения между собой по смыслу в маленький простой рассказ. Появляются вопросы: " Зачем? " и " Почему? " .
- В пять лет — описывает произошедшие события и выговаривает все звуки, кроме "Р".
Если ребёнок отстаёт от возрастной нормы более чем на полгода, то следует обратиться к врачу. Задержку речевого развития важно своевременно отличить от аутизма. При аутизме проблемы с речью осложнены специфическими симптомами: дети погружены в свой внутренний мир, не обращают внимание на сверстников, не смотрят в глаза. Они часто совершают стереотипные действия, механически повторяют слова, боятся перемен и всего нового. Такие дети любят выстраивать игрушки рядами, многократно смотреть один и тот же мультфильм, могут обладать феноменальной зрительной памятью. Они не откликаются на имя, не выполняют просьбы. Очень избирательны в пище: употребляют несколько продуктов, от других отказываются. Могут быть агрессивны, истеричны, гиперактивны.

При подозрении на аутизм лечение начинают немедленно, не дожидаясь 3-5 лет. В раннем детстве мозг пластичен и при своевременной реабилитации аутизм может сгладиться, а ребёнок в развитии догнать сверстников.
Лечение задержки речевого развития
Занятия с логопедом. Логопед проводит с ребёнком специальные уроки по запуску и развитию речи, помогает правильно строить предложения. Такие методики включают артикуляционную гимнастику, упражнения на постановку звуков, игровые техники, например пальчиковый кукольный театр. Если ребёнок понимают фразы, его интеллект сохранен, а речь запаздывает на полгода-год, то логопедических занятий бывает достаточно [1] [8] .
Занятия с логопедом-дефектологом отличаются от обычных логопедических занятий. Например, логопед-дефектолог умеет работать с детьми, которые плохо понимают речь, с грубыми задержками развития. На занятиях ребёнок изучает основные понятия (большое/маленькое, цвет, форма, размер), делает упражнения для улучшения мелкой моторики, заучивает названия предметов для формирования пассивного словарного запаса. После освоения базовых знаний логопед-дефектолог приступает к развитию экспрессивной речи [7] [12] [15] .
Комплексная медико-педагогическая реабилитация при задержке психоречевого развития. Если ребёнок плохо понимает речь, возбудим, у него не выработаны социально-бытовые навыки, то может потребоваться комплексная реабилитация. В таких случаях речь существенно отстаёт от возрастной нормы, грубо нарушена дикция, выражены другие неврологические симптомы [2] . Чтобы развить речь неврологи назначают ноотропные препараты: кортексин , когитум , цераксон . По заявлению производителей, препараты активизируют нейроны, улучшают передачу нервных импульсов и устраняют последствия гипоксии — нехватки кислорода. (Эффективность этих препаратов при задержке речевого развития не доказана в исследованиях, а в новых российских клинических рекомендациях по лечению аутизма группа экспертов уже описала ноотропы, как неэффективный метод лечения расстройства — прим. ред. "ПроБолезни"). Нормализовать работу нервной системы помогут и витамины группы В. Однако важно помнить, что назначает препараты только детский невролог с учётом особенностей ребёнка, так как лекарства способны вызывать перевозбуждение и аллергические реакции [2] [16] .
Микротоковая рефлексотерапия — метод лечения детей с задержками развития речи, разрешённый и рекомендованный Минздравом РФ. Заключается в выборочной активизации речевых зоны головного мозга:
- область Вернике (отвечает за понимание речи);
- область Брока (связана с активным словарным запасом и желанием разговаривать);
Кроме того, развития логическое мышление и сформировать бытовые навыки поможет воздействие на лобные доли. Лечение проводят под контролем электроэнцефалографии (ЭЭГ) [6] [13] [14] .
Логопедический массаж — это воздействие на артикуляционную мускулатуру: мышцы лица, языка, губ, мягкого нёба. Манипуляции проводят стерильными зондами. Цель массажа — нормализовать тонус мышц языка, круговой мышцы рта, улучшить кровоснабжение органов артикуляции. Метод необходим детям с чрезмерным слюнотечением, нарушенной дикцией. Процедуру назначают и неговорящим пациентам, поскольку речь может отсутствовать из-за неумения управлять органами артикуляции [10] [13] .
Прогноз. Профилактика
Если нет грубого органического поражения головного мозга, реабилитация начата до пяти лет и речь удалось развить до школы, то прогноз благоприятный [1] [2] [5] [7] .
При выраженной задержке психоречевого развития, органическом поражении головного мозга, серьёзных расстройствах речевых центров и без своевременного лечения нарушение сохраняется. Это приводит к тому, что ребёнок в дальнейшем испытывает существенные трудности в обучении и при социализации.
Для развития речи важно разговаривать с ребёнком с самого рождения, читать ему книжки вслух, объяснять, что происходит вокруг и показывать мультфильмы на родном языке.
Читайте также:

