Герпес при беременности и дцп
Обновлено: 24.04.2024
Для цитирования: Новикова С.В., Шугинин И.О., Ефанов А.А. К вопросу о диагностике герпетической инфекции у беременных. РМЖ. Мать и дитя. 2015;23(1):40.
Герпетическая инфекция может явиться почвой для бесплодного брака, поскольку вирусы оказывают неблагоприятное воздействие на репродуктивное здоровье как женщин, так и мужчин. Но и при наступившей беременности герпес-вирусы вызывают серьезный риск внутриутробного инфицирования плода и неблагоприятного исхода беременности [1, 4, 5, 7].
Вирус простого герпеса (ВПГ) нередко является причиной развития неврологических, соматических и эндокринных проблем у новорожденных и детей более старшего возраста [3]. Особенно опасна генитальная локализация герпеса, которая у беременных встречается в 7–35% наблюдений [2, 6].
Целью настоящей работы явилось изучение оптимизации диагностики герпетической инфекции у беременных с отягощенным анамнезом (ОАГА) в динамике беременности.
Для выявления маркеров ВПГ были применены вирусологический (быстрый культуральный метод — БКМ), (ПЦР, ПЦР ) и серологические (ИФА) методы. В качестве клинического материала от беременных женщин были изучены кровь, моча и урогенитальные соскобы. О вирусной нагрузке в различных клинических материалах судили по количеству ДНК ВПГ, которую определяли методом . Для каждого образца регистрировали значение порогового цикла Ct (threshold cycle — точка, при которой флюоресценция превышает фоновое значение) и вычисляли медианы. Полученные значения порогового цикла (Ct) сравнивали со значениями стандартных контрольных образцов с известным содержанием ДНК в пробе. Для оценки параметров гуморального ответа исследовали сыворотки крови тИФА на наличие специфических антител к ВПГ (АТ) классов IgM и IgG. Определяли также активность антител, которую выражали в титрах, и авидность , о которой судили по индексу авидности (ИА).
Среди обследованных беременных отмечалась высокая инфицированность: у 43 (58%) из 74 женщин была выявлена та или иная урогенитальная инфекция (УГИ) вирусной и/или бактериальной этиологии. Метод диагностики УГИ — проведение ПЦР с качественной оценкой результата. При подробном изучении анамнеза было обнаружено, что смешанная УГИ была выявлена у 21 (28%) беременной женщины. В структуру инфицирования входил целый спектр возбудителей УГИ: Ureaplasma urealiticum, Micoplasma hominis, Toxoplasma gondii, Gardnerella vaginalis, Chlamidia trahomatis, Candida albicans, Human papillomavirus. У 22 (30%) беременных женщин был обнаружен единственный возбудитель УГИ: Ureaplasma urealiticum — у 15 (20,4%), Micoplasma hominis — у 4 (5,4%). При этом жалоб пациентки не предъявляли, клинических признаков инфекции отмечено не было. Gardnerella vaginalis обнаружена у 3 (4,2%) беременных.
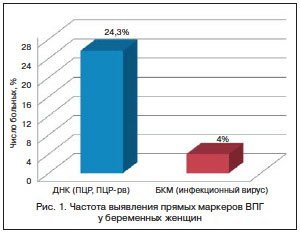
На первом этапе обследования пациенток был проведен сравнительный анализ частоты выявления прямых маркеров ВПГ (инфекционная активность вируса и ДНК ВПГ). Ни у одной из этих женщин во время обследования не было обнаружено клинических проявлений генитального герпеса. Пациентку считали инфицированной, если маркер вируса был обнаружен хотя бы в одном изученном клиническом материале. В течение всего периода обследования у 18 (24,3%) беременных были выявлены маркеры ВПГ. При этом ДНК ВПГ была обнаружена у 15 (20,3%) беременных, инфекционный вирус — у 3 (4%) женщин (рис. 1). Различия в частоте выявления ДНК ВПГ по сравнению с вирусом были статистически значимыми (p<0,05).
Была определена частота выявления ВПГ в разных клинических материалах. Были исследованы 525 биологических материалов от беременных женщин на присутствие прямых маркеров ВПГ: по 175 образцов крови, мочи и урогенитальных соскобов. При анализе всех исследованных образцов суммарно всеми использованными методами (БКМ, ПЦР и ) чаще всего маркеры ВПГ были выявлены в урогенитальных соскобах (27/175, 15,4%) и образцах мочи (20/175, 11,4%), достоверно реже — в крови (4/175, 2,3%, р<0,05).
Наряду с суммарной оценкой был проведен сравнительный анализ частоты выявления маркеров ВПГ в зависимости от метода. Методом ПЦР ДНК ВПГ была обнаружена в 16/525 (3%) образцах, методом — в 30/525 (5,7%) образцах. Статистический анализ показал, что метод ПЦР- rt выявлял вирусную ДНК достоверно чаще, чем классический метод ПЦР (p<0,05). вирус в биологических материалах (БКМ) обнаруживался значительно реже, чем ДНК ВПГ — в 5/525 (1%) пробах. Таким образом, чувствительность обнаружения ВПГ методом превышала чувствительность двух других использованных методов.
Низкую частоту выявления ВПГ методом БКМ в клинических образцах можно объяснить либо отсутствием вируса в данных пробах при наличии вирусной ДНК, либо меньшей чувствительностью метода БКМ по сравнению с ПЦР.
Проведенные исследования показали, что количество ДНК, обнаруженное в моче и урогенитальных соскобах, выше, чем количество ДНК в образцах крови. При статистической обработке значений порогового цикла (Ct) различия оказались статистически достоверными (р<0,05).
Исследование сывороток крови показало, что у 64/74 (86,5%) беременных при первичном обследовании присутствовали антитела. антитела отсутствовали у 10 (13,5%) женщин. У 2 (2,7%) беременных при первичном обследовании помимо были обнаружены антитела класса IgM, которые являются маркерами острой фазы инфекции.
При оценке авидности было установлено, что у всех 64 (86,5%) женщин, у которых были обнаружены к ВПГ, антитела характеризовались высокой авидностью (ИА>50).
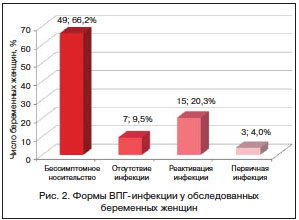
Беременные были обследованы в динамике на трех сроках беременности: во втором и третьем триместре и перед родами. При первичном обследовании во втором триместре беременности у 12 (14,8%) женщин были выявлены маркеры ВПГ методами БКМ и/или ПЦР. У 8 (12,2%) беременных обнаружение маркеров ВПГ сочеталось с выявлением высокоавидных (ИА>50) с высокими титрами (1:320). Из числа обследованных беременных не были обнаружены у двоих, что указывает на первичное инфицирование.
Изменение концентрации или выявление АТ с высокими титрами в сыворотках крови при исследовании в динамике сопровождалось выявлением прямых маркеров ВПГ в течение всего обследования у беременных. У одной беременной так и не были обнаружены, несмотря на выявление маркеров ВПГ в течение всего исследования.
У 2 (3%) женщин были обнаружены прямые маркеры ВПГ при первичном обследовании в сочетании с . У одной из этих женщин беременность закончилась самопроизвольным выкидышем во втором триместре.
В третьем триместре беременности впервые маркеры ВПГ были выявлены у 3 из 74 беременных. Серологическое исследование показало, что у одной женщины антитела к ВПГ отсутствовали. При дальнейшем обследовании этой беременной наблюдалось появление низкоавидных (ИА<50) с низкими титрами 1:20. Это указывало на первичное инфицирование. У пациенток произошла реактивация инфекции, при этом у одной были выявлены высокоавидные с высокими титрами 1:320, у другой титр антител составил 1:20.
Последнее обследование женщин перед родами показало, что у беременных впервые были обнаружены маркеры ВПГ, несмотря на присутствие антител к ВПГ, что свидетельствовало о реактивации герпетической инфекции.
У 4 (5,4%) беременных маркеры ВПГ выявлялись на протяжении всего обследования. При анализе вирусной нагрузки в клинических образцах было установлено, что у беременных вирусная нагрузка увеличивалась в динамике с увеличением срока гестации: от 100 копДНК/мл при первичном обследовании до 10 000 копДНК/мл — на последнем сроке обследования. У двух других изменений вирусной нагрузки зафиксировано не было.
Серологическое обследование 74 беременных в динамике показало, что не всегда реактивация герпетической инфекции сопровождается выявлением высоких титров или повышением титров в динамике. Так, у 3 из 15 (40%) женщин при реактивации ВПГ были выявлены титры с низкими значениями (от 1:20 до 1:80).
Выводы. Частота выявления маркеров герпетической инфекции у беременных зависит от применяемых диагностических методик (вирусологических, , серологических) и исследуемых диагностических сред (кровь, моча, урогенитальные соскобы). Наибольшую диагностическую ценность имеют методы (ПЦР, ) при исследовании материала из таких сред, как моча и урогенитальные соскобы.
Реактивация герпетической инфекции не всегда сопровождается выявлением высоких титров или повышением титров в динамике. Это свидетельствует о низкой способности иммунной системы беременной женщины к выработке достаточного количества антител даже при наличии прямых маркеров ВПГ и доказывает необходимость проведения иммунокорригирующих мероприятий у беременных высокого инфекционного риска.
- Макацария А.Д., Бицадзе В.О., Акиньшина С.В. Синдром системного воспалительного ответа в акушерстве. М.: Мед. информ. агентство. 2006. С. 448.
- Никонов А.П., Асцатурова О.Р. Генитальный герпес и беременность // Гинекология. 2002. Т. 4. № 1. С. 4–6.
- Полетаев А.В., Будыкина Т.С., Морозов С.Г. и др. Инфекция матери как причина патологии плода и новорожденного // Аллергология и иммунология. 2001. Т. 2. № 2. С. 110–116.
- Цинзерлинг А.В., Мельникова В.Ф. Перинатальная инфекция: практическое руководство // Практич. рук-во. СПб.: Эпби СПб, 2002. С. 352.
- Anzivino E., Fioriti D., Mischitelli M. et al. Herpes simplex virus infection in pregnancy and in neonate: status of art of epidemiology, diagnosis, therapy and prevention // Virol. J. 2009. Vol. 6. № 40. P. 1–11.
- Bursrein D.N. Sequally transmitted treatment guidelines // Current Opin. Pediatrics. 2003. Vol. 15. P. 391–397.
- Suligoi B., Cusan M., Santopadre P. et al. HSV-2 specific seroprevalence among various populations in Rome, Italy. The Italian Herpes Management Forum // Sex Transm. Infect. 2000. Vol. 76. P. 213–214.
Вирусные инфекции приобретают особую актуальность в период беременности, так как могут влиять на здоровье не только будущей мамы, но и плода. Герпес среди них занимает одно из главных мест, поскольку это заболевание очень часто встречается у беременных женщин.
Герпетическая инфекция - это большая группа инфекционных заболеваний, вызываемых вирусами герпеса человека. Это одно из наиболее распространенных заболеваний человека. По данным многочисленных исследований, к 18 годам более 90% населения планеты инфицируются одним или несколькими штаммами вирусов герпеса. Среди инфекций, передающихся половым путем, генитальный герпес занимает второе место после трихомониаза.
Особенностью герпеса является его рецидивирующее течение. Находящийся в спящем состоянии вирус пробуждается при снижении иммунитета, а беременность сама по себе обладает свойством ослабления иммунных сил организма, так как организм женщины вынашивает наполовину чужеродный с иммунологической точки зрения плод, что невозможно без снижения интенсивности работы ряда звеньев иммунитета. Именно поэтому обострения герпеса во время беременности происходят довольно часто.
Проявления заболевания
Клинические проявления герпеса зависят от многих факторов - типа вируса, локализации поражения, возраста и иммунного статуса человека. Классическая симптоматика - это появление группы мелких пузырьков, наполненных прозрачной жидкостью. Для герпеса характерно появление пузырьков при очередном рецидиве всегда в одном и том же месте.
При генитальном варианте герпеса высыпания локализуются на половых губах, на коже промежности, внутренней поверхности бедер, лобке или вокруг заднего прохода.
Сыпь сопровождается неприятными ощущениями, зудом, жжением, болью. Затем пузырьки лопаются, на их месте образуются сначала язвочки, затем корочки. Герпетические язвочки характерно болезненны, а образующиеся на их месте корочки исчезают бесследно через 2—3 дня, не оставляя на коже ни пигментации, ни рубцов.
Общая симптоматика заболевания весьма разнообразна: повышение температуры тела, увеличение лимфатических узлов (чаще – паховых), суставная и мышечная боли, упорные мигрени, раздражительность, отсутствие аппетита и т.д.
Типичная клиническая картина проявляется не более чем в трети случаях носительства генитального герпеса. Нередко генитальный герпес протекает бессимптомно или без характерных высыпаний.
Атипичное течение герпеса более коварно: отсутствие пузырьковых высыпаний с лихвой компенсируется многообразием общих проявлений, что часто создает трудности в постановке верного диагноза. Симптомы атипичного герпеса - жжение, трещины промежности, поло¬вых губ или заднего прохода, отек, покраснение слизистых оболочек. В таких случаях часто диагноз ставится неверно либо женщины, уверенные в наличии кандидоза (молочницы) или бактериального вагиноза, безрезультатно занимаются самолечением.
Тяжесть любых проявлений герпетической инфекции определяется состоянием иммунитета.
Разновидности вируса
Наиболее распространенными являются ВПГ 1 и 2 - вирус простого герпеса первого и второго типов. ВПГ 1 чаще всего проявляется в виде пузырьковых высыпаний на губах, возможны поражения глаз, ротовой полости, носа. Классическая локализация ВПГ 2 (генитального герпеса) - слизистая оболочка мочеполового тракта. В некоторых случаях наблюдается следующий феномен перекрестного инфицирования: виновником герпетических высыпаний верхней половины туловища является ВПГ 2 (генитальный) и наоборот - ВПГ 1 вызывает развитие инфекции нижней половины. Как правило, это связано с двумя причинами: нарушением элементарных правил гигиены, когда происходит самозаражение - перенос вируса через кожу и слизистые оболочки, и орально-генитальными контактами.
Заражение герпесом половых путей происходит в основном только через незащищенный половой контакт. В редких случаях возможна передача инфекции через поцелуй, использование общей посуды и белья. Это так называемый горизонтальный путь передачи. При вертикальном пути передачи происходит передача вируса от матери плоду во время беременности (при прохождении ребенка через родовые пути при условии наличия в слизистой вируса герпеса, то есть при родах в момент обострения герпес-вирусной инфекции). При локализации очагов на губах можно заразиться через общую посуду, полотенца и поцелуи. Надо отметить, что риск внутриутробного инфицирования плода при первичном герпесе составляет 50%, при рецидиве – не более 4%, во время родов при наличии высыпаний на шейке матки и наружных половых органов – 90%.
Как действует вирус?
Рассмотрим некоторые особенности взаимодействия вируса с организмом человека.
Обострения герпеса могут быть связаны с двумя факторами:
- уже имеющимся иммунодефицитом, что является пусковым механизмом для рецидива герпетической инфекции;
- влиянием вируса на сам иммунитет. Длительное нахождение герпеса в организме обладает прямым повреждающим действием на клетки иммунной системы. Таким образом, развивается порочный круг: ослабленный иммунитет запускает рецидив герпетической инфекции, а вирус герпеса еще более усугубляет имеющийся иммунодефицит.
Диагностика
Диагностика герпеса при типичной картине не представляет сложности для врача (да и для пациента тоже). Клинические проявления герпетической инфекции весьма яркие: характерные пузырьковые высыпания, рецидивирующее течение говорят сами за себя.
В случаях атипичного герпеса, вирусоносительства и при профилактическом обследовании методы лабораторной диагностики приобретают особое значение.
Основные направления лабораторных методов исследований:
- Определение непосредственно самих вирусных частиц. Для этого используются методы электронной микроскопии с использованием специальных методов окрашивания мазков, ИФА (иммуноферментный ана¬лиз) и ПЦР. Последний метод (полимеразная цепная реакция) широко распространен и дает достаточно точные результаты - он доступен, высокочувствителен, специфичен. Как правило, материал для анализа ПЦР берут путем соскоба (мазка) с шейки матки, влагалища, уретры, также исследуют соскоб со дна ранки или содержимое пузырька. При подозрении на скрытое течение инфекции исследуют еще мочу и слюну.
- Исследование крови на антитела к вирусу простого герпеса, при котором выявляется иммуноглобулины классов М и G. Если заражение человека произошло впервые (первичное инфицирование) или в момент диагностики соответствует острой фазе заболевания (рецидив), то в крови обнаруживают ранние антитела класса М.
Определение поздних иммуноглобулинов класса G свидетельствует о том, что встреча организма с вирусом уже произошла много ранее.
Особое внимание уделяется лабораторной диагностике в случае впервые выявленных симптомов герпеса при беременности. Такая ситуация может отвечать как первичному эпизоду, так и первому рецидиву (т.е. ранее организм уже встречался с вирусом, но проявлений не давал).
Если в крови есть IgG (поздние иммуноглобулины), значит, герпес рецидивирующий и угрозы для плода или эмбриона практически нет. Если в крови нет Ig, а есть IgМ, то необходимо проявить крайнюю степень настороженности, поскольку это является лабораторным подтверждением первичного эпизода.
Генитальный герпес и беременность
Особую же актуальность в период беременности приобретает именно генитальный герпес.
Очевидно, что при возникновении проблемы герпеса у будущей мамы появляется масса волнений. К счастью, в большинстве случаев эти тревоги безосновательны.
Когда же действительно есть повод для волнений? Наибольшую опасность представляет ситуация, когда заражение герпесом происходит у женщины во время беременности - первичный эпизод генитального герпеса. Такая ситуация характеризуется выраженными проявлениями, т.к. в организме матери нет защищающих от герпеса антител. Для плода риск особенно высок при заражении генитальным герпесом в первом и третьих триместрах. Инфицирование плода в первом триместре беременности приводит к возникновению гидроцефалии (накоплению жидкости в головном мозге), пороков сердца, аномалий развития желудочно-кишечного тракта и др. Такие случаи чрезвычайно редки, так как при первичном эпизоде герпеса, как правило, происходит самопроизвольное прерывание беременности до срока 10 недель.
Лечение герпеса во время беременности
При доказанном первичном инфицировании на ранних сроках беременности обсуждается вопрос о ее прерывании.
Лечение рецидивов герпеса во время беременности и вне ее не имеет принципиальных различий. В любом случае преследуются одинаковые цели: снижение выраженности симптомов (боль, зуд, лихорадка и т.д.), сокращение сроков заживления ран, предотвращение новых обострений. Следует помнить, что чем скорее начато лечение, тем больший эффект оно будет иметь. Если лечение начато в продромальный период (когда появляются начальные признаки заболевания – покалывание или легкий зуд на месте будущих пузырьков, озноб, недомогание), то это достоверно поможет снизить выраженность проявлений герпеса.
Особенностью лечения герпетической инфекции является точное соблюдение назначенной дозы и режима приема препаратов. Если пропущена очередная доза противовирусного препарата, то вирус герпеса может успеть в этот период размножиться, что приведет к неэффективности лечения.
Единственными препаратами, обладающими доказанной эффективностью в лечении герпетической инфекции, являются специфические виростатики – аналоги нуклеозидов (АЦИКЛОВИР, ВАЛАЦИКЛОВИР, ПЕНЦИКЛОВИР, ФАМЦИКЛОВИР).
Лечение герпетической инфекции при беременности подразумевает использование разрешенных противовирусных препаратов (ацикловир ЗОВИРАКС и валацикловир ВАЛТРЕКС) в виде мазей, кремов и таблеток.
Одновременно с противовирусными препаратами в комплексном лечении используют иммуномодуляторы (ВИФЕРОН), витамины, физиотерапевтические методы, местные антисептики для более быстрого заживления ранок.
Безусловно, целесообразность и курс лечения определяются в каждом индивидуальном случае. Ситуация сочетание беременности и герпеса должна находится под бдительным контролем врача и самолечение в этих случаях просто недопустимо.
Герпес новорожденных
В каких же случаях коварный вирус все-таки достигает своей цели и вызывает заболевание у новорожденных? В подавляющем большинстве случаев (90%) заражение происходит контактным путем при прохождении через родовые пути. Внутриутробное заражение новорожденного отмечается только в 5% случаев герпеса новорожденных. Причем важным условием является наличие у мамы именно первичного эпизода гениального герпеса, в случаях бессимптомного носительства или рецидивирующего герпеса инфицирование плода в родах случается не чаще, чем в 4% случаев.
Симптомы и признаки герпеса у младенцев появляются уже на 2-й неделе после рождения. Для герпеса новорожденного характерно наличие пузырьков на коже, слизистых оболочках (полости рта, половых органов) и конъюнктиве глаз. Чем более недоношенными рождаются дети, тем более сложнее протекает инфекция; в таких случаях часто встречается поражение головного мозга (герпетический энцефалит).
Профилактика
Специфических методов профилактики герпеса, к сожалению, не существует. Профилактика инфекции на этапе планирования, при беременности и после родов носит исключительно предупредительный характер. Применяются следующие меры:
В последние десять лет отмечается увеличение частоты врожденных инфекций, причём преимущественно вирусной этиологии. Высокая младенческая смертность, а также детская инвалидизация в результате инфекционной патологии являются серьёзной демографической проблемой. Заражение плода и инфекционный процесс может начаться во внутриутробном периоде, во время родов, либо постнатально. Это так называемые перинатальные или внутриутробные инфекции (ВУИ). Наиболее распространённые ВУИ обозначаются синдромом TORCH.
Аббревиатура TORCH используется для обозначения круга заболеваний, включающих токсоплазмоз (Toxoplasmosis), сифилис (Other), краснуху (Rubella), цитомегавирусную инфекцию (Cytomegalovirus) и герпетическую инфекцию (Herpes simplex virus).
Во многих странах эта аббревиатура изменена на STARCH, включив инфекцию, вызванную вирусом иммунодефицита человека (AIDS). Опасность синдрома TORCH и других вирусных инфекций заключается в том, что они вызывают 80% врожденных пороков развития у детей. Среди них ведущее место занимают поражение ЦНС, врожденный порок сердца и почек. Установлено, что инфицирование плода в I триместре беременности приводит к развитию у него микро-, гидроцефалии, пороков сердца, желудочно-кишечного тракта, мочеполовой системы, скелета, катаракты, глухоты.
Инфицирование во II и III триместрах вызывает у плода гепатоспленомегалию, анемию, желтуху, гипотрофию, пневмонию, менингоэцефалит, сепсис.
В Медицинском центре C0RTEX в 2008 — 2013 годах и первой половине 2014 года прошли обследование и лечение 1009 детей, с выставленным диагнозом ДЦП, олигофрении, с задержками в психоречевой и двигательной сферах не уточненного генеза. Возраст детей колебался от 9 месяцев до 20 лет. Всем детям были поведены: КЭЭГ, ВП, МРТ, ( по показаниям выполнена ПЭТ) головного мозга, УЗИ внутренних органов, клинические анализы крови и мочи по общепринятым методикам, исследование на инфекции TORCH- комплекса методами полимеразной цепной реакции и иммуноферментного анализа с определением иммуноглобулинов G и M.
У всех детей был отягощен пре- и перинатальный анамнез: угроза прерывания беременности была отмечена у 69% матерей, причем у половины из них в 1-м и 2-м семестрах, сильный токсикоз −41%, иммуноконфликт −23%, хроническая внутриутробная гипоксия плода −73%, у 31% матерей выявлено обострение генитального герпеса, 15% матерей лечились от бесплодия, более 30% матерей перенесли ОРВИ и 5% токсоплазмоз во время беременности. Признаки фетоплацентарной недостаточности наблюдались у 65% матерей, а обострение хронического уреоплазмоза, хламидиоза, микоплазмоза наблюдались у 40% матерей.
Наиболее часто у обследованных больных (более45%) верифицирована хронически-персистирующая цитомегаловирусная и герпетическая инфекция с явлениями вялотекущего лейкоэнцефалита, у −21% — нейроинфекция, обусловленная листериозом, уреаплазмозом, хламидиозом. В 18% случаев дети перенесли внутриутробно токсоплазмоз, кандидоз, микоплазмоз, осложненные уросепсисом, пневмонией с отеком легких, желудочным и кишечным кровотечением, а также менингитом и менингоэнцефалитом. У 6 % пациентов выявлены поствакцинальные поражения головного мозга. У 5% диагностирован острый менингоэнцефалит и у 3% острый радикулоганглионеврит, обусловленный ассоциацией герпетических вирусов (ВПГ, Варицелла —Зостер, Эпштейн-Барра).
У трети детей диагностирована внутриутробная пневмония, гипотрофия, у 40% — неонатальная желтуха, гепато-спленомегалия, тимомегалия и субклиническая дисфункция щитовидной железы, пороки сердца и соединительной ткани обнаружены у 10% пациентов, у 6% пороки развития мочеполовой системы, у 30% патология органов зрения (глаукома, микрофтальмия, колобома, атрофия зрительных нервов) и др. .
По данным нейровизуализации у 56% обследованных больных обнаружены субкортикальные кисты и кисты в парехиме мозга, у 42% — субатрофия коры больших полушарий, вентрикуломегалия — 46%, очаги глиоза и перивентрикулярной лейкомааляции — 52%, истончение мозолистого тела — 27%, врожденные аномалии мозга −11%, внутрижелудочковые кровоизлияния 65% и окклюзии ликворовыводящих путей — 2%.
Но, что же происходит на самом деле?
К сожалению, не все медицинские учреждения соблюдают эти правила и требования, что отражается на точности результатов.
Другой вариант. Если у ребёнка изначально было тяжёлое состояние при рождении, а затем он плохо развивается и выявляются пороки развития других органов, то выставляется диагноз; последствие перенесенной ВУИ, а детей предлагают сдать в специальный интернат, как бесперспективных.
Таким образом хронические ВУИ не только поддерживает выраженность имеющихся неврологических и психических дефектов у ребёнка, но и в дальнейшем утяжеляет их степень, или в случае их отсутствия вызывает их развитие.
Обращаем внимание родителей на следующее.
Если у Вашего ребёнка имеется даже незначительная задержка в развитии, или нет эффекта от проведённого лечения при уже выставленном диагнозе: детский церебральный паралич, задержка психо-речевого или моторного развития, умственная отсталость, эпилепсия, аутизм и т.д. — необходимо срочно принять все меры к обследованию ребенка в нашем центре, с целью уточнения диагноза и причины его возникновения, а также проведения своевременного патогенетического лечения.
Медицинский центр CORTEX в настоящее время проводит эффективное лечение таких пациентов в рамках новой медицинской технологии лечения детского церебрального паралича, разработанной под руководством академика Василенко Ф.И.

Впервые разработана концептуально новая медицинская технология патогенетического лечения детского церебрального паралича и задержек в психическом, речевом и моторном развитии детей, которую можно считать основой эффективного комплексного лечения этого заболевания.
В составе комплексного лечения проводится диагностика, основное патогенетическое лечение и реабилитационные процедуры.
Помимо инструментального обследования головного и спинного мозга, совместно с лабораторной службой Хеликс проводится высокоточное вирусологическое исследование крови на TORCH — синдром (в соответствии с правилами GCP и GLP) с оценкой клеточного, гуморального иммунитета для исключения аутоиммунного демиелинизирующего процесса с % определением деструкции белого вещества мозга , и прогнозирования клинического исхода перинатальной гипоксии что позволяет уточнить природу заболевания. Это нейроиммунологическое исследование (технология и набор специальных тестов) разработано совместно с государственным медицинским университетом им. И.И. Мечникова. Очень важно качественно провести исследование крови по данной методике. Выбрана лабораторная служба Хеликс.
Поэтому специалисты МЦ CORTEX , основываясь на высокоточном исследовании крови, назначают эффективное лечение выявленной внутриутробной инфекции, что способствует повышению эффективности лечения ДЦП, умственной отсталости, ЗПРР, аутизма и других заболеваний.
Санталова Г.В., Гасилина Е.С., Валеева Г.Р., Шарыпова М.А., Ефимова И.Л., Плахотникова С.В., Сошникова Л.Н.
В последнее время вследствие высокой инфицированности населения вирусными инфекциями растет интерес к их возбудителям, в частности к вирусам семейства Herpes, под влиянием которых часто происходят внутриутробное инфицирование плода и повреждение плаценты. При хронических и рецидивирующих инфекциях частота внутриутробного инфицирования невелика, однако фетоплацентарная недостаточность и потери плода встречаются примерно с той же частотой, что и при острых формах. Исследования последних лет позволяют говорить о значимости внутриутробной инфекции в патогенезе патологических состояний, формирующихся в последующие годы жизни. Крайне важной остается проблема ранней диагностики внутриутробной инфекции и исхода её развития. В связи с этим не вызывает сомнения необходимость разработки комплексного подхода к решению вопроса о прогнозировании инфекции у новорожденного путем своевременной диагностики и проведения соответствующих лечебно–профилактических мероприятий с целью предупреждения формирования тяжелой соматической патологии и инвалидизации у детей.
Целью исследования явилось изучение состояния новорожденных детей, родившихся от герпес-инфицированных матерей.
Обследовано 216 новорожденных. Проведен анализ состояния здоровья детей; оценивалось состояние фетоплацентарной системы беременных. Новорожденные дети были распределены на 3 группы: в 1-ю вошли 73 ребенка от матерей с фетоплацентарной недостаточностью (ФПН) и латентным течением герпетической инфекции; 2-ю составили 68 детей от матерей с латентной герпетической инфекцией без признаков ФПН, 3-ю – 75 новорожденных от матерей, не имевших в анамнезе герпеса и с отрицательными результатами обследования на герпетическую инфекцию (ГИ).
У матерей с герпетической инфекцией недоношенными родились 28 (13,0%) детей, у неинфицированных – 8 (3,7%). Гестационный возраст во всех группах колебался от 29 до 42 недель; масса тела при рождении – от 1850 до 4300 граммов. Среди родившихся выявлено значительное число детей с синдромом внутриутробной задержки развития плода (ВЗРП): 44 (20,4%) – из I группы (чаще встречались дети с ВЗРП II и III степеней) и 10 (4,6%) – из III (преобладали дети с ВЗРП I степени). У большинства новорожденных были диагностированы перинатальное поражение ЦНС, синдром пролонгированной желтухи, синдром дыхательных расстройств, гипотрофия, анемия, дисбиоз кишечника, аномалии и пороки развития. У детей I и II групп эти изменения встречались чаще. Следует отметить, что такая патология, как кисты сосудистых сплетений головного мозга, кальцинаты вещества головного мозга, герпетическая экзема, врожденный хориоретинит, герпетический гепатит, нефрит, встречалась только у детей с подтвержденной на 2-8 день жизни герпетической инфекцией. Из I группы таких случаев было 44 (20,4%), из II – 9 (4,2%).
Таким образом, оценивая состояние здоровья новорожденных детей, родившихся от герпес-инфицированных матерей, важно учитывать состояние фетоплацентарного комплекса.
Для цитирования: Михайлова О.И., Карапетян Т.Э. Прегравидарная подготовка и профилактика рецидивов у женщин с герпетической инфекцией. РМЖ. Мать и дитя. 2014;22(19):1402.
Анализ медицинской литературы последних лет показывает неослабевающий интерес акушеров-гинекологов к проблеме вирусной инфекции вообще и герпетической инфекции в частности. По данным различных авторов, вирус простого герпеса (ВПГ) является одной из основных причин осложненного течения беременности, внутриутробной и перинатальной инфекции [2, 8, 13]. Несмотря на неоднозначное мнение различных исследователей относительно роли этого вируса в частоте перинатальных осложнений, бесспорным является тот факт, что в современных условиях ВПГ представляет весьма многогранную медико-социальную проблему [1, 3, 6].
По-прежнему у практикующих врачей часто возникают определенные сложности при ведении беременности и родов у женщин с герпетической инфекцией [4, 12]. Одним из решающих этапов в комплексе профилактических мероприятий у данного контингента пациенток является их адекватная прегравидарная подготовка с правильным подбором всех современных методов медикаментозной коррекции.
Возбудителем герпетических заболеваний половых органов является ВПГ – облигатный внутриклеточный паразит, принадлежащий к подсемейству α-вирусов в семействе герпес-вирусов. Идентифицировано два серотипа данного вируса: первый тип (ВПГ-1) поражает преимущественно кожу и слизистую оболочку губ, глаз, носа и др.; второй тип (ВПГ-2) является возбудителем генитального герпеса. Развитие последнего возможно также и при возникновении смешанной инфекции ВПГ первого и второго типов [2, 3, 23].
Единственным резервуаром ВПГ являются зараженные им люди, которые распространяют его среди населения. Генитальный герпес относится к заболеваниям, в 99,9% случаев передаваемых половым путем. Это так называемый горизонтальный путь передачи инфекции от носителей вируса к здоровым людям. Вертикальный путь передачи возможен в случае трансплацентарного инфицирования плода [3, 9].
По данным литературы, частота встречаемости генитального герпеса варьирует от 7 до 40%. Причиной большинства случаев генитального и, соответственно, неонатального герпеса является ВПГ-2 (70–80%), однако в 20–30% случаев эта инфекция может быть вызвана ВПГ-1 [2, 19].
Попав в организм человека, ВПГ сохраняется в нем на протяжении всей жизни, периодически вызывая рецидивы заболевания различной степени тяжести. Прослеживается определенная тенденция к фиксированности очагов высыпания, что объясняется поражением только нескольких ганглиев, которые иннервируют ограниченную зону кожи и слизистых. Первичное заражение сопровождается репликацией (размножением) вируса в месте инвазии с последующим его перемещением либо по нервному стволу, либо гематогенным путем. При гематогенном пути распространения инфекции вирусемия является обязательным этапом как первичного, так и рецидивирующего генитального герпеса. Установлено, что ВПГ оседает в виде элементарных телец в строме эритроцитов, он также обнаруживается в лейкоцитах, тромбоцитах и лимфоцитах [2, 7, 11]. Вирус герпеса может находиться и в лимфатической системе, в свободном состоянии или связанном с лимфоцитами, при определенных условиях размножается в Т- и В-лимфоцитах. При персистенции инфекции данный вирус может длительно находиться в коже, слизистых и половых секретах.
К особенностям герпетической инфекции следует относить:
• высокий уровень инфицированности населения;
• пожизненную персистенцию возбудителя в организме человека;
• системность процесса, а также полиморфизм клинических проявлений;
• трудности лабораторной диагностики атипичных и стертых форм заболевания;
• торпидность к имеющимся методам терапии (ни один из противогерпетических препаратов не приводит к полной элиминации вируса из организма, а только подавляет его репликацию).
При определении формы генитального герпеса выделяют первичную инфекцию или первичный эпизод инфекции и рецидивирующее ее течение. Первично инфицированными считаются пациентки с серонегативными результатами, которые ранее не сталкивались с ВПГ и не имеют к нему антител. Инкубационный период колеблется в широких пределах и составляет в среднем 3–9 дней, в течение которых экспрессия вируса минимальна. В 50–80% случаев появлению типичных повреждений предшествуют локальные продромальные симптомы в виде парестезии, зуда или боли, локального лимфаденита, невралгии в ягодичной, паховой, бедренной областях, дизурии, а также нарушения общего состояния пациенток. В последующем вирусное повреждение эпителия проявляется в виде везикул на эритематозном фоне с дальнейшим характерным разрешением. Как правило, первичный эпизод заболевания характеризуется обширными высыпаниями, тяжелой общей симптоматикой и длительной экспрессией вируса [1, 3].
Существует несколько подходов к диагностике герпетической инфекции. Алгоритмы обследования основаны на клинических симптомах и лабораторных тестах. Наиболее распространенным в клинической практике является метод быстрой диагностики герпетической инфекции – полимеразная цепная реакция [2, 21]. Также для постановки диагноза герпетической инфекции часто используется иммуноферментный анализ.
Анализ литературных данных показал, что беременность, как правило, не влияет на частоту возникновения и тяжесть герпетической инфекции. В то же время имеется и противоположное мнение, указывающее на изменение клиники генитального герпеса на фоне физиологического иммунодефицита, имеющего место при беременности [1, 6].
Следует отметить, что пути проникновения вируса к эмбриону и плоду могут быть различными. Первый путь – трансплацентарный, возникает при наличии вирусемии у беременной, когда вирус из межворсинчатого пространства плаценты проникает в сосудистую систему плода с дальнейшей диссеминацией в его органах [3, 9, 13].
Резко увеличивает потенциальную опасность трансплацентарной передачи ВПГ плоду первичное инфицирование женщины во время беременности. Риск увеличивается и при активации латентной герпетической инфекции, однако он значительно ниже, чем при первой встрече организма с вирусом. Возможность трансплацентарной передачи инфекции значительно возрастает на фоне снижения иммунологической реактивности организма и при всех сопутствующих состояниях, увеличивающих проницаемость плаценты. Однако, по мнению ряда авторов [1, 13], вирусы могут проникать в организм плода даже через неповрежденную плаценту.
При восходящем инфицировании основными факторами, повышающими риск заражения плода, являются патологические изменения шейки матки, снижение защитных свойств цервикальной слизи, а также акушерские вмешательства и манипуляции, возможность проникновения вируса в околоплодные воды через плодные оболочки [3].
Бесспорно, как отечественными [1, 6], так и зарубежными авторами [9, 13] лидирующее место (до 90% случаев) отводится контактному механизму заражения плода, возникающему при прохождении ребенка через инфицированные родовые пути матери. При этом передача инфекции возможна как при наличии очагов повреждения в области шейки матки и вульвы, так и при бессимптомном выделении вируса.
В I триместре гестации риск инфицирования плода ВПГ резко возрастает при наличии первичного эпизода инфекции или стадии обострения хронической рецидивирующей формы заболевания, что может явиться причиной возникновения пороков развития плода, неразвивающейся беременности, спонтанных абортов и др. [2, 23]. Эмбриональные ткани с их высоким уровнем метаболизма и энергетики являются идеальной средой для репликации вирусов. При этом вирусная нуклеиновая кислота может включаться в состав клеточного генома, передающего генетическую информацию в аппарат, воспроизводящий клеточный белок, что в конечном итоге приводит к гибели зародыша или нарушению процессов органогенеза и возникновению пороков развития [3].
По данным литературы, при инфицировании беременной после 20 нед. гестации возрастает частота поздних самопроизвольных выкидышей, преждевременных родов, внутриутробного инфицирования плода. В этот период у плода могут развиться воспалительные заболевания головного мозга, глаз, легких, анемия, гепатоспленомегалия и т. д. Генитальная герпетическая инфекция, ввиду частых воспалительных изменений последа, может явиться причиной преждевременного или раннего излития околоплодных вод (с высоким риском восходящего инфицирования плода), нарушений сократительной активности матки с развитием первичной и/или вторичной слабости родовой деятельности, аномалий прикрепления и отделения плаценты с кровотечением в последовом и раннем послеродовом периодах [2, 3, 13].
Внедрение в практику противовирусной терапии привело к значительному снижению заболеваемости и смертности, однако до настоящего времени проблема герпетической инфекции во время беременности и ее влияние на организм ребенка являются одной из наиболее острых проблем в перинатологии [5, 14, 16, 17].
В работах зарубежных авторов было показано, что среди женщин с рецидивирующим генитальным герпесом примерно в 75% случаев следует ожидать по крайней мере один рецидив ВПГ во время беременности и в 14% – клинические проявления на момент родоразрешения [22, 25]. Данные систематического обзора 7 рандомизированных контролируемых испытаний с 1249 участниками выявили, что женщины с первичным эпизодом или рецидивом ВПГ-инфекции, которые получали антивирусную профилактику ацикловиром (400 мг 3 р./сут) или валацикловиром (500 мг 2 р./сут) начиная с 36 нед. беременности, значительно реже имели рецидивы инфекции к моменту родоразрешения (OR=0,28; CI=0,18–0,43), а проведение супрессивной терапии данными препаратами привело к снижению частоты выполнения кесарева сечения в связи с обострением ВПГ-инфекции (OR=0,30; CI=0,20–0,45) [15].
Как известно, во время родоразрешения при рецидивирующей генитальной ВПГ-инфекции происходит заражение плода. В крупном проспективном исследовании (58 362 беременные женщины), проведенном с целью оценки влияния метода родоразрешения на частоту передачи ВПГ-инфекции новорожденным, было показано, что инфицирование новорожденных практически в 6 раз ниже при операции кесарева сечения, чем при самопроизвольных родах (1,2% по сравнению 7,7% соответственно; ОR=0,14; CI=0,02–1,08) [10].
Также в исследованиях было показано, что у беременных с рецидивирующим генитальным герпесом проведение антивирусной профилактики ацикловиром после 36 нед. гестации для снижения риска передачи инфекции новорожденному является более экономически выгодной мерой, чем проведение кесарева сечения в связи с активацией ВПГ-инфекции на момент родоразрешения. Однако в настоящий момент недостаточно исследований, оценивающих экономическую эффективность противовирусной профилактики валацикловиром [18].
С учетом полученных данных, Американский колледж акушеров и гинекологов (AGOG) и общество акушеров и гинекологов Канады (SOGC) рекомендуют женщинам с рецидивирующей генитальной ВПГ-инфекцией проводить супрессивную терапию ацикловиром или валацикловиром после 36 нед. гестации, а также осуществлять родоразрешение путем операции кесарева сечения пациенткам с наличием активных герпетических высыпаний на половых органах и продромальных симптомов инфекции к моменту родов. SOGC предлагает пациенткам с первичной генитальной ВПГ-инфекцией в третьем триместре проводить кесарево сечение вне зависимости от наличия или отсутствия поражения кожных покровов половых органов в связи с высоким риском (до 60%) вертикальной передачи [8, 20].
Осложненное течение гестационного периода у женщин с герпетической инфекцией, тяжесть неонатального герпеса и неблагоприятный прогноз для новорожденного делают весьма актуальной разработку рациональных подходов к диагностике, профилактике и лечению этого заболевания. В профилактике неонатального герпеса большое значение приобретает правильная тактика ведения беременности и родов, однако реальным малоиспользуемым до настоящего времени резервом в решении проблемы рождения здорового ребенка является правильная прегравидарная подготовка пациенток с герпетической инфекцией, которая включает ее лечение с последующей профилактикой рецидивов. При генитальной герпетической инфекции, независимо от уровня поражения репродуктивной системы, показано проведение как базисной (противовирусной) терапии, так и лечение сопутствующих заболеваний.
К базисным видам лечения относится:
• Блокада репродукции ВПГ в режиме эпизодической или супрессивной терапии. Применяют ацикловир по 0,2 г 5 р./сут в течение 5 дней при легком течении инфекции (обострения 1 раз в 6–8 мес.) и по 0,2 г 4 р./сут в непрерывном режиме в течение 3–6 мес. и более – при ее частых рецидивах (обострения 1 раз в 30–90 дней).
• Проведение стимуляции неспецифической резистентности организма в зависимости от показателей иммунного и интерферонового статуса больных (препараты иммуноглобулина, индукторы интерферона, энзимотерапия и др.).
• Местное применение специфических мазей.
В настоящее время наиболее широко используемыми для купирования обострения различных форм герпеса являются препараты из группы ациклических нуклеотидов. Многочисленными наблюдениями показано, что применение ацикловира в дозе 200 мг 5 р./сут или валацикловира – 500 мг 2 р./сут в течение 5 дней значительно уменьшает клинические проявления заболевания, сокращает время рецидива и период вирусовыделения. Были отмечены абсолютная безопасность, хорошая переносимость препаратов и отсутствие значимых побочных эффектов [6, 14, 16].
Как показывает клиническая практика, эффективность ациклических нуклеозидов зависит от биодоступности препарата, чувствительности герпес-вируса к конкретному препарату, адекватности применяемой дозы, продолжительности и кратности лечения, сроков начала лечения. Назначение валацикловира в дозе 500 мг 2 р./сут в течение 5 дней в продромальном периоде или сразу после появления симптомов рецидива заболевания способствует быстрому купированию проявлений вирусной инфекции. Препарат для системного лечения герпетической инфекции Валцикон сочетает в себе эффективность и безопасность ацикловира при отсутствии его недостатков – таких как ограниченная биодоступность, связанная с недостаточно эффективным всасыванием препарата при пероральном применении. Применение Валцикона дает возможность снизить количество приемов лекарства до 2 р./сут в отличие от 5 р./сут – при назначении ацикловира и повысить приверженность пациентов к проводимой терапии.
В ряде случаев среди пациентов, получавших хотя бы короткие курсы валацикловира в момент рецидива, тенденция к нарастанию частоты клинических проявлений ВПГ-инфекции ниже, чем среди пациентов, получавших только местное лечение, что во многом зависит от исходного состояния противовирусной защиты и продолжительности вторичного иммунодефицита у больных с ВПГ-инфекцией. Супрессивную терапию рекомендуют людям с частыми рецидивами. Для пациентов с сохраненным иммунитетом назначают препарат в дозе 500 мг 1 р./сут, с иммунодефицитом – 500 мг 2 р./сут. Прием препаратов ежедневно в течение 12 и более месяцев в 80% случаев предотвращает рецидивы герпеса и обеспечивает психологическое преимущество над лечением, проводимым во время обострений; при такой терапии рецидивы заболевания становятся достаточно редкими, а у некоторых пациентов возможна ремиссия в течение нескольких лет. Анализ рандомизированного исследования [26] подтвердил высокую клиническую эффективность применения валацикловира в профилактике рецидивирующей ВПГ-инфекции. Супрессивная терапия в прегравидарном периоде и перед родоразрешением может снизить частоту рецидивов ВПГ, риск бессимптомного выделения вируса и частоту кесарева сечения вследствие активации герпетической инфекции. Валцикон с фармакоэкономической точки зрения наиболее оптимально подходит для супрессивной терапии. Учитывая наличие большой упаковки (42 капсулы), доступную стоимость и 2–кратное применение в сутки, препарат Валцикон позволяет достичь очень высокой комплаентности лечения.
Таким образом, следует подчеркнуть, что проведение ранней диагностики, профилактики и лечения ВПГ-инфекции у женщин до наступления беременности, прегравидарная подготовка и планирование беременности позволяют снизить частоту осложнений гестационного периода, тяжесть течения (частоту и длительность рецидивов) инфекционного процесса при беременности, предупредить тяжелые формы неонатальной инфекции, уменьшить перинатальную заболеваемость и смертность.
Читайте также:

