Герпес в крови слюне моче ребенка
Обновлено: 25.04.2024
За последние пять лет увеличилось число детей в возрасте до одного года, умерших от генерализованных вирусных инфекций [4]. Велика роль герпес-вирусных инфекций, особенно цитомегаловирусной, в формировании перинатальной патологии и младенческой смертности. Риск развития внутриутробной инфекции зависит от характера взаимоотношений между организмом беременной женщины и микроорганизмом (первичное заражение во время беременности или реактивация ранее приобретенной инфекции).
Проблема врожденной инфекционной патологии является приоритетной для России [5].
Иммуногенез герпес-вирусной инфекции. Длительное нахождение герпес-вируса в организме человека становится возможным благодаря сложной стратегии противоборства и ускользания от иммунной системы хозяина. В достижении этого состояния можно выделить три пути стратегии возбудителя:
Вирус простого герпеса. В инфицированных клетках вирус простого герпеса образует внутриядерные включения и гигантские клетки, оказывает выраженное цитопатическое действие, проявляющееся округлением и образованием многоядерных клеток. Вирус является слабым индуктором интерферона, в связи с чем инактивация вирусной ДНК внутри клеток не наступает и он сохраняется внутри клеток длительное время, периодически вызывая рецидивы заболевания.
ЦМВ. Сущность проблемы ЦМВ-инфекции в том, что последняя относится к так называемым оппортунистическим инфекциям, клинические проявления которых возможно в условиях первичного или вторичного иммунодефицита.
ЦМВ поражает разнообразные клетки, чаще всего лейкоциты (лимфоциты, моноциты), эпителиальные клетки (дыхательных путей, слюнных желез, почек). С клеток крови ЦМВ с большим постоянством переходит на эндотелий, тропизм к которому у него весьма выражен. Поврежденные эндотелиальные клетки постоянно обнаруживаются в токе крови при активной/реактивированной ЦМВ-инфекции. Повреждение эндотелия сосудов имеет собственное патогенетическое значение в формировании органных поражений, так как вызывает ишемию или кровоизлияния в различные ткани [6].
В раннем неонатальном периоде (0–7 дней) у детей с ЦМВ-инфекцией наблюдались симптомы интоксикации, серый колорит кожи, выраженная мышечная гипотония, большая первоначальная потеря массы тела, синдром рвоты или срыгиваний, признаки угнетения ЦНС. В позднем неонатальном периоде (от 7 дней до одного мессяца) анализ клинических проявлений острой ЦМВ-инфекции выявляет поражение многих органов и систем. Так, у всех детей обнаруживаются гипоксически-ишемическая энцефалопатия с трансформацией синдрома угнетения в синдром гипервозбудимости, проявления анемии, патологическая гипербилирубинемия, увеличение печени и селезенки.
ВЭБ относится к подсемейству бета-герпес-вирусов. Вирусный геном заключен в нуклеокапсид, который покрыт гликопротеидным тегументом gp350, являющимся фактором рецепторного взаимодействия [7]. Проникновение вируса в В-лифоциты осуществляется через рецептор этих клеток CD21-рецептор к C3d-компоненту комплемента. ВЭБ-инфекция широко распространена среди людей, причем первичное инфицирование, как правило, происходит в антенатальном или детском возрасте, но манифестация ВЭБ-инфекции в виде отчетливых клинических проявлений инфекционного мононуклеоза в большинстве случаев происходит в школьном возрасте при различного рода иммунопатологических реакциях. Манифестация инфекции в виде инфекционного мононуклеоза может осложняться поражением печени, слизистой оболочки желудка, ткани почек, лимфоидного аппарата.
Особый характер взаимодействия микро- и макроорганизма при хронических персистирующих инфекциях обусловливают трудности лабораторной диагностики. Обнаружение возбудителя не может быть единственным критерием подтверждения диагноза. Необходима комплексная оценка клинических и лабораторных данных для постановки диагноза.
Цель исследования. Определить клинические особенности течения персистирующих герпес-вирусных инфекций у детей и оценить значимость комплекса лабораторных исследований, в том числе показателей общей иммунологической реактивности у больных при персистирующем у них инфекционном процессе.
Материал и методы исследований. Под наблюдением находилось 63 пациента в возрасте от одного месяца до 7 лет, из них детей до одного года было 25, от одного года до трех лет — 22 и старше трех лет — 15 больных. Среди обследованных детей преобладали пациенты первых двух лет жизни — 47 детей (74,6%) и старше двух лет было 15 больных (25,4%).
Результаты. В клинической диагностике персистирующих инфекций у детей следует отводить первостепенное значение неблагополучию акушерского анамнеза матерей больных детей.
Беременность и роды были осложненными у большинства матерей наблюдаемых детей, чаще всего у них отмечались гестозы и угроза выкидыша, рождение недоношенных, в родах гипоксия плода, преждевременная отслойка плаценты, кесарево сечение и др. У 32 женщин из 63 (50,7%) были различные соматические заболевания (хронический пиелонефрит, кольпит, анемия, аутоиммунный тиреоидит и др.). При обследовании беременных женщин было выявлено как моноинфицирование (у 30 из 63–47,6%), так и сочетания инфекций (у 16 из 63–25,4%). Наиболее часто обнаруживались герпес-вирусы и цитомегаловирусы (суммарно у 27 женщин из 63–43%) и реже другие возбудители — хламидии, микоплазмы (у 11 беременных — 17,4%). Высокая частота вышеуказанных осложнений свидетельствует о несомненной роли инфекции как отягощающего фактора в течение гестационного периода и родов.
Заподозрить внутриутробную или персистирующую инфекцию у детей можно было по высокой степени поражения у детей различных органов и систем: ЦНС (71,4%), органов дыхания (88,8%), желудочно-кишечного тракта (95,2%), поражению глаз (31,7%), лимфатического аппарата (15,9%).
В процессе наблюдения за детьми в недалеком прошлом все дети обследовались на состояние микробиоценоза кишечника.
У всех детей обнаруживались нарушения как в основных компонентах биоценоза, так и в составе условно-патогенной флоры. Следует отметить, что у всех пациентов проводилась коррекция микробиоценоза повторными курсами пре- и пробиотиков, однако восстановления микрофлоры до нормобиоценоза не наблюдалось ни у одного пациента. Следовательно, без выявления и адекватного лечения основного заболевания не удается курировать дисбиотические нарушения в организме ребенка.
Закономерен вопрос о правильности выбора комплекса диагностики внутриутробной и персистирующей инфекции у детей. В зависимости от возраста пользуются разными методами диагностики. Важное значение отводится сбору семейного анамнеза. Диагностика внутриутробных инфекций у детей должна опираться на клинические проявления как общего характера, так и на типоспецифические ее признаки, а также основываться на анализе комплекса лабораторных методов обследования [8].
При оценке клинических анализов крови у наблюдаемых детей обращали на себя внимание значительные отклонения в различных показателях гемограммы: выраженная анемизация (у 31,7% пациентов), нейтропения (у 19%), лимфоцитоз (у 27%), лейкопения с лимфоцитопенией (36,5%), ускорение СОЭ (у 27%), что в совокупности свидетельствовало о наличии воспалительного процесса в организме с выраженным снижением иммунореактивности у детей.
При скрининговом серологическом обследовании методом ИФА на внутриутробные инфекции у детей наиболее часто выявлялись положительные титры типоспецифических антител класса IgM и/или IgG к герпес-вирусам. Диагностические титры антител класса IgM и IgG определялись к ЦМВ (у 9 детей), к HV 1-го, 2-го типа (у 9 детей). Антитела к антигенам ВЭБ обнаруживались у 20 детей, из них у 10 детей были антитела класса IgG к раннему антигену ВЭБ и антитела класса IgM к капсидному антигену ВЭБ, что свидетельствовало об активной фазе ВЭБ-инфекции. Остальные 10 пациентов имели антитела класса IgG к нуклеарному (ядерному) антигену ВЭБ, что расценивалось как поздняя стадия инфекции.
У детей при персистирующем течении с реактивацией инфекции, которое чаще возникало после провоцирующих воздействий (ротавирусные диареи, ОРВИ, профилактические прививки) ПЦР-тесты при исследовании биосубстратов: кровь, осадок мочи, секрет из зева давали положительные результаты с последующим нарастанием титра типоспецифических антител по данным ИФА.
Совокупность проведенных исследований позволила выделить у обследованных больных следующие формы инфекций: моноинфекции были у 21 пациента — 31,8% (ЦМВ — у 5 детей, HV 1-го, 2-го типа — у 6 детей и ВЭБ — у 10), у 42 детей из 63 (68,2%) обнаруживались микст-инфекции. У 23 детей была ассоциация ЦМВ с герпес-вирусами (у 9 детей с HV 1-го, 2-го типа, у 3 детей — с HV 6-го типа и у 11 детей — с C. albicans и хламидиями). Микст-формы герпеса 1-го, 2-го типа были выявлены у 9 больных, у них были ассоциации с микоплазмами и хламидиями. Ассоциации ВЭБ были обнаружены у 10 детей (5 больных имели ассоциацию с ЦМВ, пациента — с HV 6-го типа и 2 больных — с Yersinia pseudotuberculosis).
Из 63 больных у 21 (33,3%) с моноинфекцией течение заболевания расценивалось как латентное (с ЦМВ-инфекцией у 5 и HV 1-го, 2-го типа у 6) и как персистирующее (у 10 детей с ВЭБ-инфекцией). У 14 детей из 42 с микст-инфицированием (у 1/3) было персистирующее течение инфекционного процесса (у 3 детей с ЦМВ-инфекцией в ассоциации с HV 6-го типа и у 11 детей с ЦМВ-инфекцией в ассоциации с C. albicans и хламидиями). У 28 детей из 43 (у 2/3) наблюдалось персистирующее течение с реактивацией инфекции (у 9 детей с ЦМВ-инфекцией в ассоциации с HV 1-го, 2-го типа; у 9 детей с HV 1-го, 2-го типа в ассоциации с хламидиями или микоплазмами и у 10 детей с ВЭБ инфекцией в ассоциации с ЦМВ, HV 6-го типа и ВЭБ в ассоциации с Y. pseudotuberculosis).
Коэффициент фагоцитарной защиты у детей с моноинфицированием и микст-формами герпесвирусной инфекции оказался достоверно сниженным по сравнению со средневозрастной нормой для здоровых детей (0,634 ± 0,05 усл. ед. и 0,540 ± 0,03 усл. ед. соответственно при норме 0,946 ± 0,03, Р1–2 и Р2–3 < 0,001 и < 0,001 соответственно). При микст-инфицировании герпес-вирусами КФЗ имел более низкие значения по сравнению с таковым у детей с -моноинфекцией, однако разница недостоверна (Р1–2 > 0,05). Недостаточность защиты клеточно-фагоцитарного звена иммунитета играет важную роль в патогенезе герпес-вирусных инфекций, что должно учитываться в лечении этих заболеваний.
Отклонение величины показателя ИЛМП имело противоположную направленность, она оказывалась достоверно повышенной как при моноинфекции, так и при микст-формах герпес-вирусных инфекций по сравнению с контролем (Р1–3 и Р2–3 < 0,001 и < 0,001 соответственно). Величины показателя ИЛМП у детей с микст-инфицированием была большей по сравнению с таковой при моноинфекции, однако разница недостоверна Р1–2 > 0,05. Увеличение показателя ИЛМП у детей с герпес-вирусной инфекцией еще раз подтверждает лимфотропность вирусных антигенов.
ЛИИ оказался достоверно повышенным у больных с микст-формами герпес-вирусной инфекции по сравнению со средневозрастной нормой в контроле (Р2–3 < 0,001). Средние значения ЛИИ у детей с моноинфекцией достоверно не отличались от норматива (Р1–3 > 0,05), они имели лишь тенденцию к повышению. Однако при оценке индивидуальных показателей ЛИИ у детей с моноинфицированием герпес-вирусами выявились существенные особенности. У 13 детей из 21 (61,9%) ЛИИ был ниже возрастной нормы, что отражало фазу положительной анергии к совершенно определенному антигену. Это свидетельствует, что организм защищен сейчас только от специфических антигенов, однако он остается уязвимым в отношении других патогенов, то есть низкий индекс интоксикации отнюдь не указывает на полное благополучие организма.
Полученные результаты исследований подтверждают выраженность иммунного дисбаланса как в клеточно-фагоцитарном звене иммунитета, так и в гуморальном, а также свидетельствуют о значимости эндогенной интоксикации у больных с микст-формами герпес-вирусной инфекции и уязвимости иммунной защиты у детей и при моноинфицировании.
Клинический пример. Андрей С., 2 года 5 мес., поступил в стационар с жалобами на высокую температуру — 39 °С, однократную рвоту, сниженный аппетит и жидкий стул 5 раз в сутки. Болен в течение двух недель ОРВИ, получил амбулаторно симптоматическое лечение. К концу второй недели ухудшилось состояние, рецидив лихорадки — 39 °C и дисфункция кишечника. Направлен на госпитализацию.
Анамнез жизни. От первой беременности, протекала с угрозой выкидыша, нефропатией, преэклампсией в родах. Во время беременности перенесла ОPВИ с лимфаденитом. Обследование на пренатальные инфекции, обнаруживались антитела класса IgG к антигенам ЦМВ и вирусу герпеса 1-го, 2-го типа. Лечение не проводилось. Роды в срок, масса при рождении 3500 г, длина 51 см. К груди приложен сразу, сосал активно, грудное вскармливание до года, прикормы вводились в 5 и 6 месяцев. Адаптация к пище нормальная. В массе прибавки достаточные, в 2 г. 5 мес — масса 14 кг 810 г, рост 93 см.
Состояние здоровья в течение первого года жизни неблагополучное. Длительно держалась желтуха, в возрасте 3 недель: общий билирубин — 315,1 мкмоль/л, непрямой — 297,3 мкмоль/л, прямой — 17,8 мкмоль/л. Одновременно с желтухой был неустойчивый стул. В 1-месячном возрасте неврологом установлен диагноз перинатального поражения ЦНС, гипоксическо-ишемического генеза, гипертензионный синдром.
К возрасту 6 мес были обнаружены изменения в гемограмме: гемоглобин — 112 г/л, эритроциты — 4,2 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, сегментоядерные нейтрофилы — 12%, лимфоциты — 67%, моноциты — 12%, эозинофилы — 8%, базофилы — 1%, СОЭ — 3 мм/час. В повторных анализах крови во 2-м полугодии продолжала выявляться нейтропения. Консультирован гематологом, установлен диагноз доброкачественной нейтропении детского возраста. В 10 мес в анализе крови выявлена анемия (гемоглобин — 107 г/л, эритроциты — 3,81 × 10 12 /л, цветовой показатель — 0,84, тромбоциты — 280 × 10 9 /л, сегментоядерные нейтрофилы — 11%, лимфоциты — 76%, моноциты — 90%, эозинофилы — 3%, базофилы — 1%). Гематологом назначено лечение Сорбифером дурулесом, курс 1 месяц.
Осмотрен ортопедом: отмечено ограниченное отведение бедер. В один год на УЗИ органов брюшной полости определялся перегиб в области шейки желчного пузыря, холестаз. Осмотр генетика: диагностирована недифференцированная дисплазия соединительной ткани с поражением костно-мышечной системы. В 1 г. 5 мес перенес острый энтероколит неуточненной этиологии, госпитализировался в стационар на 10 дней, получал лечение метронидазолом и Энтеролом. В течение 1,5 лет переносит частые ОРВИ с повышением температуры до 38,8 °С в течение 3–4 дней и катаральными явлениями.
Объективные данные. При последней госпитализации отмечались явления назофарингита в течение 5 дней, лихорадка до 39 °С 2 дня, кожные покровы без сыпи. При осмотре — гиперемия зева и увеличение подчелюстных, передних и заднешейных лимфоузлов, стул учащенный до 3 раз в сутки, с 5 дня лечения — оформленный. ЛОР-врачом диагностирован хронический тонзиллит и аденоидит, в фазе обострения.
Обследование. В мазке из зева — высев гемолитического стрептококка. Посевы на патогенную кишечную флору отрицательные. ИФА на ротавирус — отрицательный. Реакция непрямой гемагглютинации (РНГА) с кишечными диагностикумами — отрицательные.
Гемограмма при поступлении: гемоглобин 104 г/л, эритроциты — 3,7 × 10 12 /л, цветовой показатель — 0,85, лейкоциты — 6,4 × 10 9 /л, палочкоядерные нейтрофилы — 4%, сегментоядерные — 72%, лимфоциты — 18%, моноциты — 4%, эозинофилы — 2%, СОЭ — 4 мм/час.
Гемограмма в динамике: гемоглобин — 109 г/л, эритроциты — 3,4 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, палочкоядерные нейтрофилы — 19%, сегментоядерные — 42%, лимфоциты — 28% (широкоплазменные лимфоциты), моноциты — 8%, плазматические клетки — 1%, эозинофилы — 2%, СОЭ — 13 мм/час. В дальнейшем — красная кровь оставалась без динамики, число лейкоцитов не изменялось, нарастал лимфоцитоз до 43% (широкоплазменные формы), моноцитов до 12%, СОЭ повысилась до 20 мм/час.
Анализ мочи без отклонений от нормы (пятикратно). В биохимическом анализе крови — умеренная гипоальбуминемия, печеночные пробы — в норме. ИФА на специфические антитела к антигенам ЦМВ класса IgM — отрицательный, класса IgG — положительный. Маркеры ДНК-ЦМВ в осадке мочи и в секрете из зева методом ПЦР не найдены. ИФА на специфические антитела к хламидийному антигену (Chlamydia pneumoniae) — положительный в титре 1:80. Маркеры ДНК Ch. pneumoniae в мазке из носоглотки методом ПЦР — положительный. ИФА с микоплазменным антигеном — IgM и IgG — отрицательные, с герпес-вирусами 1-го, 2-го типа — IgM и IgG отрицательные. ИФА на специфические антитела к антигенам ВЭБ: IgM к капсидному антигену — отрицательный, IgG к раннему антигену — положительный и IgG к ядерному антигену (IgGNA) — положительный (> 0,5 ед.). Совокупность данного анализа была индикатором активной фазы мононуклеозной инфекции.
После проведенного обследования ребенку была назначена адекватная комплексная терапия (Cумамед, Ликопид с последующим переходом на Виферон, витамины А, Е, Пиридоксин, пробиотики — курс Примадофилуса). Наблюдение за ним продолжается.
Выводы
- В пользу диагностики персистирующих инфекций у детей свидетельствует отягощенный акушерско-гинекологический и соматический анамнез, а также инфекционный фактор беременных женщин.
- Заподозрить внутриутробное инфицирование у детей раннего возраста можно по высокой степени поражения различных органов и систем: ЦНС, органов дыхания, пищеварения, лимфатического аппарата.
- Диагностика внутриутробных инфекций должна базироваться на клинических проявлениях болезни и основываться на комплексе лабораторных и иммунологических методов исследования с их оценкой в динамике (в 1 мес, 3 мес, 6 мес и в 1 год жизни).
- Правильность выбора комплекса клинических и лабораторных тестов (ИФА в динамике, ПЦР-тесты с различными биосубстратами) приводит к своевременной диагностике внутриутробных инфекций и позволяет выявить моноинфицирование или микст-формы при их длительной персистенции.
- Для суждения о состоянии общей иммунологической реактивности детей с персистирующими герпесвирусными инфекциями может использоваться оценка интегральных показателей (КФЗ и ИЛМП): чем меньше величина КФЗ, тем больше выражен риск прорыва защитного барьера на пути инфекции.
- Наиболее неблагоприятное персистирующее течение имеют микст-формы герпесвирусной инфекции (ЦМВ, герпес, ВЭБ) или их сочетания с внутриклеточными возбудителями.
Литература
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
СПбМАПО, Санкт-Петербург
Простой герпес у детей – болезнь, которая поражает множество тканей и органов ребенка, что сопровождается высыпаниями на коже и слизистых оболочках в виде пузырьков. В большинстве случаев лечение длительное латентное, случаются периодические рецидивы.
Простой герпес у детей, согласно международной классификации, делится на:
- герпетическую болезнь глаз (подразделяется на передний увеит, кератоконъюнктивит, кератит, ирит, иридоциклит, дерматит век, конъюнктивит);
- герпетический энцефалит;
- герпетический гингивостоматит и фаринготонзиллит;
- герпетический менингит;
- герпетический везикулярный дерматит;
- герпетическую экзему;
- диссеминированную герпетическую болезнь;
- герпетические инфекции неуточненные;
- другие формы герпетических инфекций.

Эпидемиология
Инфекции подвержены дети, которые заражаются инфекцией в первые 3 года жизни. Новорожденные не могут заразиться данной болезнью до полугода, т. к. имеют в крови специфические антитела класса lgG. Но бывают очень редкие случаи, когда у матери в крови антитела отсутствуют, а значит – и у ребенка. Тогда при заражении у ребенка возникает генерализированная форма болезни, течение тяжелое. У большинства детей 3-летнего возраста в крови достаточно антител, защищающих организм. Число детей с высоким уровнем антител к ВПГ2 возрастает к 5-7-летнему возрасту.
Инфекцию переносят и распространяют как больные, так и вирусоносители. Пути передачи инфекции: контактный, половой и, предположительно, воздушно-капельный. Заразиться можно, что касается подростков, при поцелуе – через слюну. Также заражение происходит через предметы быта, игрушки и прочие предметы, на которых может оказаться слюна зараженного человека. Ребенок может заразиться в утробе матери или при рождении в родовых путях.
Заболевания встречаются периодически, отдельными случаями по всей стране. Но в зимний период (меньше – в другие сезоны) случаются небольшие эпидемии в детсадах, школах и прочих детских коллективах.
На скорость и масштабы распространения герпеса влияют переохлаждение, плохие санитарно-гигиенические условия, повышенная инсоляция, скученность и др.
Что провоцирует / Причины Герпеса у детей:
Вирус простого герпеса (обозначают аббревиатурой ВПГ) содержит РНК. Диаметр вириона 120-150 нм. Размножение вируса происходит лучше всего в тканях куриного эмбриона. В инфицированных клетках из-за влияния вируса образуются внутриядерные включения и гигантские клетки.
Лучше всего вирус герпеса сохраняется при низкой температуре (- 70 °С). Инактивировать его можно, повышая температуру среды до 50-52 °С на протяжении получаса. Также вирус уничтожается ультрафиолетовыми и рентгеновскими лучами. В высушенном состоянии может сохранять жизнедеятельность около 10 лет.
Вирус простого герпеса делят на ВПГ1 и ВПГ2. Первая группа приводит к поражению кожи лица и слизистой во рту. ВПГ2 поражают гениталии, вызывают менингоэнцефалит. Если ребенок заразился одним типом вируса, может возникнуть также инфекция, вызванная и вторым типом.
Патогенез (что происходит?) во время Герпеса у детей:
Инфекция попадает в организм ребенка через поврежденные слизистые оболочки и травмированную кожу. ВПГ вызывает высыпания в местах поражения. В редких случаях вирус из мест первичной локализации попадает в регионарные лимфатические узлы, еще более редко он проникает в кровоток.
Развитие инфекции далее зависит от состояния систем, отвечающих за иммунитет. Если формы герпеса локализированы, то процесс завершается лишь местными проявлениями. Вирус с кровью заносится в легкие, печень, селезенку или другие органы и поражает их – такое происходит при генерализованных формах герпеса. При этом процессе в крови скоро накапливаются вирус-нейтрализующие антитела. Вирусная ДНК внутри клетки не инактивируется. Вирус нельзя убить до конца, он пребывает в организме всю жизнь, из-за чего время от времени возникают повторения заболевания. Рецидивы происходят, не смотря на то, что в крови присутствуют вируснейтрализующие антитела.
Рецидивы наступают по причине ослабления местного иммунитета или из-за генетически детерминированного дефицита клеточного иммунитета. Если иммунный контроль ослаблен, вирус свободно переходит по клеткам и между ними.
Патоморфология. Патологические изменения зависят от локализации инфекции. Происходит баллотирующая дегенерация эпителия, что проявляется как воспаление в эпидермисе в виде пузырьков. Пузырек лежит на на инфильтрированном и отечном сосочковом слое дермы.
При генерализованных формах заболевания во многих органах и системах организма появляются мелкие очаги коагуляционного некроза. Встречаются изменения в ЦНС. Есть вероятность кровоизлияний в субарахноидальное пространство (полость между паутинной и мягкой мозговыми оболочками).
Обнаруживают картину лептоменингита с и нфильтрацией оболочек и стенок сосудов клеточными лимфогистиоцитарными элементами. Изменения такого же характера могут произойти в легких, печени, костном мозге, селезенке и коре надпочечников.
Симптомы Герпеса у детей:
Клинические проявления
Инкубационный период болезни составляет 6 дней (в среднем), но в разных случаях может длиться 2-14 дней. Локализация патологического процесса позволяет различать такие виды поражений:
- поражение глаз (проявляющееся как блефароконъюнктивит, конъюнктивит, кератит, хориоретинит и пр.);
- поражение слизистых оболочек (проявляющееся как стоматит, тонзиллит, гингивит и т. д.);
- поражение кожи (проявляющееся как герпес носа, герпес губ, век рук, лица и пр.);
- генитальный герпес (поражение вульвы, полового члена, уретры и т. д.);
- герпетическая экзема;
- висцеральные формы (пневмония, гепатит);
- поражение ЦНС (неврит, менингоэнцефалит и пр.).
В диагнозе обычно указывают, насколько распространены поражения (герпес: локализованный, распространенный или генерализованный простой). Течение заболевания: острое, абортивное, рецидивирующее. Абортивная форма указывает на быстрое, преждевременное прекращение болезненного процесса. Рецидивирующее течение указывает на повторение болезни в виде выздоровления и нового возвращения симптомов. После исчезновения клинических проявлений в крови есть антитела, но вирус присутствует в организме, ничем не проявляясь. В случае появления фактора активизации он проявляется и поражает те же или иные органы человека.
Один из самых распространенных симптомов герпеса у детей – поражение слизистых оболочек. Оно проявляется как острый стоматит или гингивостоматит. Такой симптом может быть у детей любого возраста, но в большинстве случаев – у детей от 2 до 3 лет. Инкубационный период длится от одного дня до восьми. Заболевание имеет острое начало с подъемом температуры до 39—40 °С. Ребенка знобит, он начинает проявлять беспокойство (новорожденные и груднички). Появляется общее недомогание. Малыш отказывается от еды, потому что она вызывает болезненные ощущения во рту. Родители могут отметить активное слюнотечение и характерный запах изо рта. У маленьких детей снижается масса тела, появляются в редких случаях расстройства желудка, возможна дегидратация.
При поражении слизистых оболочек рот внутри отечный и красноватый. Слизистая покрыта высыпаниями размером от 2 до 10 мм, которые выглядят, как пузырьки. Сначала они прозрачные, а затем появляется желтоватое содержимое. Они скоро лопаются, после пузырьков остаются эрозии. Регионарные лимфатические узлы увеличены и болезненны (боль при пальпации). Заболевание продолжается от 1 до 2 недель. На 3-5 сутки температура тела приходит в норму. В некоторых случаях возможны рецидивы болезни.
Поражение кожи в большинстве случаев возникает вокруг рта, носа и ушей. За несколько дней до появления высыпаний может появиться жжение, а также зуд, покалывание или небольшие болевые ощущения. Стоит отметить, что жидкость в появившихся позже пузырьках может быть с примесью крови. Когда затягиваются появившиеся на месте пузырьков эрозии, появляется корочка буровато-желтоватого оттенка. Корочки отпадают в скором времени, на их месте кожа может быть красной или слегка пигментированной.
Следующая форма герпеса – герпетическая экзема. Возникает у детей, заболевших экземой, нейродермитом и другими дерматозами, при которых имеются эрозивные поражения (через которые инфекция попадает в организм). Болезнь также называется иначе: осповидные высыпания Капоши, вакциниформный пустулез, герпетиформная экзема и т. д.
Есть вероятность судорог, потеря сознания кратковременная. С первого дня заболевания появляется обильная сыпь, иногда она может проявиться только на 2-3 сутки. Высыпания держатся до 2-3 недель. Случается болезненный регионарный лимфоаденит. Сначала пузырьки прозрачные, затем становятся более мутными и уплотненными. Элементы сыпи на второй день напоминают вакцинальные пустулы. Пузырьки сливаются между собой, лопаются, покрываясь корочкой. В тяжелых случаях сыпь оставляет на коже рубцы. Болезнь может длиться долго, есть вероятность повторных высыпаний на протяжении 2 или 3 недель. На 7-10 день температура тела приходит в норму, общее состояние больного улучшается. После этого начинает очищаться кожа. Если организм ребенка ослаблен, герпетическая экзема имеет тяжелое течение. Патологический процесс затрагивает не только слизистые оболочки и кожу, но и нервную систему, висцеральные органы, глаза, что приводит при несвоевременном лечении и ослабленности организма к летальному исходу.
.Из-за обширности поражения кожных покровов угрозу представляет вторичная бактериальная инфекция.
Поражение глаз (офтальмогерпес) часто развивается из-за заражения вирусом герпеса. Может проявляться как изолированное поражение глаза, но также нередки случаи комбинирования поражения глаза, слизистых оболочек полости рта и кожи. Увеличиваются регионарные лимфатические узлы, развивается фолликулярный, катаральный или везикулезно-язвенный конъюнктивит.
Офтальмогерпес начинается остро, появляется конъюнктивит, язвочки или герметические пузырьки на коже века возле ресниц. Течение поверхностных герпетических кератитов в большинстве случаев доброкачественное. Глубокие дисковидные герпетические кератиты имеют тяжелое течение, что нередко приводит к воспалению переднего отдела сосудистого тракта.
Клинические проявления генитального герпеса различны. Течение в большинстве случаев упорное и рецидивирующее. Генитальный герпес у подростков и детей другого возраста вызывает везикулезные и эрозивно-язвенные высыпания на коже и слизистой оболочке половых органов.
У заболевших женского пола высыпания могут быть локализированы на половых губах (малых и больших), в промежности, реже – на внутренней поверхности бедер. В еще более редких случаях высыпания могут появиться на слизистой оболочке влагалища, клиторе или анусе. У заболевших мужского пола высыпания локализируются на внутреннем листке крайней плоти и коже мошонки. Также возможны случаи появления сыпи на слизистой оболочке уретры, которые переходят в высыпания на мочевом пузыре. Болезнь проявляется лихорадкой, болью, зудом, жжением и пр. на участках, пораженных болезнью. Тяжелее, чем у детей, генитальный герпес протекает у взрослых. После исчезновения симптомов возможно длительное латентное вирусоносительство, что повышает риск заражения окружающих детей и взрослых.
Поражение нервной системы при герпесе. Распространение вируса по кровотоку может привести к инфицированию мозга. Поражение ЦНС может иметь течение, сходное с менингоонцефапитом, энцефалитом, менингитом, менингоэнцефалорадикулита. Самыми распространенными формами герпеса являются энцефалит и менингит, которыми болеют обычно новорожденные и младенцы.
По клиническим проявлениям герпетический энцефалит не отличается от других вирусных энцефалитов. У детей раннего возраста часто возникает первичная генерализованная инфекция, хотя поражение ЦНС возможно одновременно с проявлением высыпаний на губах, глазах и пр. Герпетический энцефалит начинается остро, с очень повышенной температуры. Головная боль сильная, чувствуется озноб, возможны повторяющиеся приступы рвоты. За ребенком нужно наблюдать, тогда можно заметить заторможенность и сонливость, но в некоторых случаях – наоборот – возбужденность. В разгар болезни могут случиться судороги, обмороки, параличи и даже нарушение рефлексов. Течение болезни тяжелое, последствия серьезные. Особо тяжелые случаи кончаются фатальным исходом. В таких случаях вскрытие показывает острый геморрагический некроз в коре головного мозга.
Анализ спинномозговой жидкости показывает лимфоцитарньтй цитоз и повышенный белок.
Висцеральные формы проявляются в виде острого паренхиматозного гепатита, пневмонии, поражения почек и других органов.
Герпетический гепатит распространен в основном среди новорожденных детей, но также встречается и у более старших. Обычно гепатит появляется как следствие генерализации простого герпеса, в результате которого возникает поражение многих органов ребенка. Но возможно также, хоть и редко, изолированное поражение печени больного.
Герпетический гепатит проявляется высокой лихорадкой, выраженными симптомами интоксикации, сонливостью, расстройством дыхания, одышкой, цианозом, увеличением печени, рвотой, увеличением селезенки и т. д. Не исключена и желтуха, как при других формах гепатита.
Герпетическая пневмония и герпетический очаговый нефрит клинически не отличаются от поражений легких и почек другой этиологии. Заболевание имеет течение как у вирусно-бактериальной инфекции. Течение острое или рецидивирующее. В основном – именно рецидивирующее. Болезнь повторяется по причине переохлаждения или перегревания, присоединения/активизации вирусных и бактериальных инфекций. У девочек периодом нового обострения болезни может быть время менструаций. Рецидивы обычно имеют легкое течение.
Осложнения при герпесе возникают в случае присоединения бактериальной инфекции.
Диагностика Герпеса у детей:
Простой герпес определяется врачами по характерным пузырьковым высыпаниям, группирующимся на коже и слизистых оболочках. Лабораторное подтверждение проходит с помощью анализа наличия вируса в пузырьках-высыпаниях, в кожных изъязвлениях, в крови, в спинномозговой жидкости (метод ПЦР). Для диагностики рецидивирующего герпеса определенное значение имеет обнаружение высоких пиров антител IgG или нарастание титра в динамике заболевания.
Прогноз благоприятный при локализированных формах болезни. При генерализированных формах лечение более тяжелое и длительное, не исключены летальные исходы. Особенно тяжелый прогноз при герпетических энцефалитах, менингоэнцефалитах, я также при врожденном герпесе и при заболеваниях новорожденных.
Лечение Герпеса у детей:
Локализированные поражения слизистых и кожи лечат местным способом – мазью ацикловира, 5% линимента циклофероном и другими противовирусными препаратами. Интерферон назначают в форме примочек, мази, полосканий слизистых или ингаляций. Пораженные участки кожи и слизистых оболочек обрабатывают 1—2% спиртовым раствором бриллиантового зеленого, 1—3% спиртовым раствором меч кленового синего. Полость рта обрабатывают 3% раствором перекиси водорода, что дает санирующий эффект при герпетическом стоматите. Чтобы груднички могли питаться без болевых ощущений, применяют обезболивающие средства местно – например, анестезин или лидокаин.
Если температура сильно повышена, больному дают ибупрофен. Тяжелые формы герпеса лечат ацикловиром. Комбинированная терапия предусматривает ацикловир + циклоферон.
При рецидивирующем течении болезни назначают курс виферона, витаминов В, В2, В12, пирогенала. Также назначают экстракт элеутерококка жидкий, настойку женьшеня и др. Также эффективны для лечения специфический противогерпетический иммуноглобулин и противогерпетическая вакцина, особенно в комбинированном применении с циклофероном.
В некоторых случаях назначают индукторы интерферона, например, циклоферон или анаферон детский. Присоединение бактериальной инфекции означает, что к лечению нужно добавить антибактериальную терапию. Противопоказаны для лечения герпеса кортикостероидные гормоны, но их подключают при тяжелых формах герпетического энцефалита и менингоэнцефалита.
При рецидивирующем течении герпеса ацикловир малодейственен, нунжо применять его комплексно, вместе с циклофероном.
Профилактика Герпеса у детей:
Среди профилактических мер выделяют закаливание детей и воспитание навыков гигиены. Инфицированным детям не рекомендованы ультрафиолетовое облучение, физические нагрузки, сильный стресс.
Особенно важно оберегать детей, страдающих экземой и мокнущими формами атонического дерматита. Новорожденные, имевшие контакт с заболевшим герпесом человеком, подлежат изоляции. Если мать заражена герпесом, и высыпания есть у нее на коже и слизистых, при контакте с ребенком она обязана носить хирургическую маску. Пока эрозии после отпадения корочек не заживут, зараженная мать не может прижиматься к коже ребенка и целовать его. Если на груди поражений герпеса нет, кормление разрешено.
Чтобы предупредить внутриутробное заражение малыша, беременных рекомендуется обследовать на ВПГ. Если есть клинические признаки инфицирования, вводят иммуноглобулин (0,2 мл/кг). Если признаки генитального герпеса найдены перед родами, роды должны проходить с помощью кесаревого сечения. Но эта мера не на 100% исключает возможность заражения новорожденного.
Цитомегаловирусная инфекция у детей (ЦМВИ) – типичный представитель оппортунистических инфекционных заболеваний, клинически проявляющихся только на фоне иммунодефицитных состояний.
Цитомегалия — это вирусное заболевание, которое проявляется множеством симптомов, которые возникаюь из-за образования гигантских клеток с типичными внутриядерными и цитоплазматическими включениями в слюнных железах, висцеральных органах и центральной нервной системе.
Цитомегаловирусная инфекция, согласно международной классификации, бывает таких видов:
- цитомегаловирусный панкреатит
- цитомегаловирусный гепатит
- цитомегаловирусная пневмония
- другие цитомегаловирусньте болезни
- неуточненная цитомегаловирусная болезнь.
Также существует врожденная цитомегаловирусная инфекция и цитомегаловирусный мононуклеоз.
Цитомегалия бывает врожденной или приобретенной. При врожденной могут быть поражены многие органы и системы ребенка, такую форму болезни называют генерализированной.
Приобретенная цитомегалия у детей раннего возраст протекает по типу мононуклеозоподобного синдрома. В некоторых случаях вирус преимущественно поражает желудочно-кишечный тракт, легкие, печень. Или же болезнь может принять генерализированную форму. Обе формы (врожденная и приобретенная) могут проходить бессимптомно. Согласно классификации по признаку течения, цитомегалия бывает острой и хронической.
Что провоцирует / Причины Цитомегаловирусной инфекции у детей:
Возбудитель – ДНК-содержащий вирус семейства Herpes-viriae – Cytomegalovirus hominis. Источником цитомегаловирусной инфекции у детей является мать. Механизмы передачи: вертикальный и интранатальный.
Пути передачи – гематогенный (трансплацентарный), восходящий, контактный, аспирационный (при заглатывании инфицированных околоплодных вод). У детей первого года жизни возможно инфицирование через грудное молоко. Дети раннего возраста могут инфицироваться контактно-бытовым, воздушно-капельным, трансфузионным путем.
Эпидемиологические особенности ЦМВИ (широкое распространение цитомегаловируса в человеческой популяции, различные механизмы и пути передачи, преобладание субклинических форм инфекции), а также особенности иммунитета у беременных и плода способствуют повышенному риску внутриутробного инфицирования вирусом цитомегалии.

У больных цитомегаловирусной инфекцией клетки, зараженные вирусом, обнаруживают в осадке мочи, слюне, спинномозговой жидкости и пораженных органах. Вирус сохраняет жизнедеятельность в среде, имеющей комнатную температуру. Он имеет чувствительность к дезинфицирующим средствам и эфиру. Вирус устойчив к антибиотикам.
Патогенез (что происходит?) во время Цитомегаловирусной инфекции у детей:
У новорожденных детей встречается в 0,2-2,5% случаев. Клинические формы врожденной цитомегаловирусной инфекции у детей: бессимптомная, генерализованная. У 80% детей, перенесших генерализованную ЦМВИ, в дальнейшем отмечается неврологическая симптоматика, у 17% детей при бессимптомном течении заболевания отмечается минимальная мозговая дисфункция, задержка развития, неврозоподобные расстройства.
Скорость репликации и инфицирования дочерними вирусами незараженных клеток зависит от функционального состояния иммунной системы. Неспецифические факторы иммунитета – система интерферона, комплемента, естественные киллеры – на первых этапах инфекционного процесса замедляют скорость распространения возбудителя, а в дальнейшем потенцируют активность специфического иммунитета и препятствуют инфицированию непораженных клеток. Однако наиболее действенной защитой от ЦМВИ является создание специфического иммунитета (образование специфических антител и специфических Т-лимфоцитов). Специфическая иммунная защита может формироваться только в том случае, если вирусы расположены и неклеточно. Внутриклеточное расположение вируса защищает его от иммунного воздействия.
Клинические проявления: риск инфицирования плода, тяжесть заболевания новорожденного ребенка и дальнейший прогноз при внутриутробной ЦМВИ зависят от характера течения инфекционного процесса у матери в период беременности. Если женщина, не имеющая иммунитета к вирусу цитомегалии, впервые инфицируется им в период беременности, то это приводит к развитию у нее первичной ЦМВИ. Частота передачи цитомегаловируса при первичной инфекции от серонегативной беременной плоду составляет от 30 до 50%. Следует отметить, что в большинстве случаев отмечается бессимптомное течение инфекции у женщин. При вторичной цитомегаловирусной инфекции риск внутриутробного инфицирования плода значительно ниже (2%).
Симптомы Цитомегаловирусной инфекции у детей:
Клинические проявления внутриутробной ЦМВИ:
- петехиальная сыпь (мелкие кожные кровоизлияния) – 60-80%
- тромбоцитопеническая пурпура – 76%;
- желтуха – 67%;
- гепатоспленомегалия – 60%;
- микроцефалия – 53%;
- гипотрофия – 50%;
- недоношенность – 34%;
- гепатит – 20%;
- энцефалит –15%;
- хориоретинит – 12%.
Клиническая картина приобретенной цитомегалии. Инкубационный период может длиться минимум 15 дней, максимум 3 месяца. Всё это время ребенок является носителем инфекции.
При приобретенной цитомегалии ребенок заражается от матери или медперсоналав роддоме в том случае, если данные взрослые – носители вируса. Если малышу делают переливание плазмы/крови от доноров, и кровь недостаточно проверена, возможно заражение.
Болезнь может проявиться в изолированном поражении слюнных желез, либо инфекция поражает, помимо слюнных желез, еще и висцеральные органы. Приобретенная цитомегалия редко бывает генерализированной. У ребенка постепенно повышается температура. Среди симптомов отмечают такие: боли в горле, увеличение шейных лимфатических узлов, печени и селезенки. Могут быть головные боли, боли в животе, анорексия, ощущение слабости в теле.
Слизиста оболочка ротоглотки чуть красновата, можно наблюдать увеличение небных миндалин.
В других случаях могут проявляться симптомы интерстициальной пневмонии, такие как цианоз, одышка и пр. Не исключены желудочно-кишечные расстройства, проявляющиеся в учащении стула и рвоте. Может наблюдаться также нарушение печеночных функций, например, потемнение мочи, желтуха и т. д., а также изменения в мочи.
Болезнь длится долго. Температура может ежедневно повышаться до уровня 39—40 ˚ С. Ребенок во время подъемов температуры ощущает озноб, что может длиться от 2 до 4 недель, редко – более длительный срок.
Если заражение возникло вследствие переливания крови, через 5-6 недель после процедуры возникает цитомегаловирусный мононуклеозоподобный синдром.
Генерализированная форма приобретенной цитомегаловирусной инфекции отличается тем, что вирус постепенно поражает многие органы и системы в организме ребенка. Лихорадка длительная, проявляется общеинфекционный токсикоз. Вирус поражает легкие, что приводит к интерстициальной пневмонии. Поражение желудочно-кишечного тракта проявляется в повторяющихся приступах рвоты и жидком многократном стуле. Вирус при генерализированной форме поражает сердечно-сосудистую систему. Фиксируются явления паренхиматозного гепатита, энцефалита. Течение генерализированной формы длительное.
Диагностика Цитомегаловирусной инфекции у детей:
Чтобы диагностировать наличие цитомегаловирусной инфекции у детей проводиться лабороторное исследование крови на специфические антитела к цитомегаловирусу – иммуноглобулинов М и G.
Обнаружение иммуноглобулинов М может указывать на первичное заражение цитомегаловирусами либо на реактивацию хронической цитомегаловирусной инфекции. Высокие титры IgМ у беременных могут способствовать инфицированию плода. Повышение IgМ определяется в крови через 4-7 недель после заражения вирусом и наблюдается в течение16-20 недель.
Повышенные иммуноглобулины G развиваются в период снижения активности цитомегаловирусной инфекции. Их наличие в крови указывает на цитомегаловирус в организме, но не показывает активности инфекционного процесса.
С помощью ПЦР-диагностики определяется ДНК цитомегаловируса в клетках крови и слизистых – соскобы из уретры и цервикального канала, мокроты, слюна и т.д. Эффективным способом диагностики является проведение количественной ПЦР, которая показывает активность цитомегаловируса и вызываемого им инфекционного процесса. Диагноз ставится, когда выделение цитомегаловируса в забранном материале пошается.
Зависимо от того, какой орган пострадал от инфекции, пациент проходит осмотр гинеколога, гастроэнтеролога, андролога или других докторов. Дополнительно может назначаться проведение УЗИ органов брюшной полости, гастроскопия, кольпоскопия, МРТ головного мозга и другое.
Лечение Цитомегаловирусной инфекции у детей:
В настоящее время существует два основных направления терапии и профилактики вирусных инфекций. Это виростатические препараты и специфические иммуноглобулины. Эти два вида терапии имеют принципиальные отличия в механизме противовирусного действия.
Ганцикловир назначают внутрь во время еды, а также вводят внутривенно. Биоусвоение из желудочно-кишечного тракта равно 15-20%, тем не менее этого достаточно для оказания эффекта. У препарата высокая активность и он обладает способностью избирательно накапливаться в клетках, инфицированных вирусом, но не в интактных клетках. Его концентрация в инфицированных клетках может в 30-120 раз быть больше, чем в плазме крови. Это важное обстоятельство объясняет большую широту терапевтического действия данного препарата по сравнению с другими и меньшую опасность осложнений. Связывание с белками плазмы крови всего 9-30%, поэтому препарат хорошо проникает в различные ткани и жидкости (включая ликвор). Большая часть препарата (80-90%) в неизмененном виде и в виде метаболита 9-карбоксиметоксиметилгуанина выводится почками. Период полувыведения примерно 3,3 ч, однако при почечной недостаточности он может увеличиваться до 20 ч, поэтому необходимо корректировать дозирование. Так, при скорости клубочковой фильтрации (СКФ) менее 70 мл/мин — дозу препарата снижают в 2 раза; при СКФ менее 50 мл/мин – дозу уменьшают еще на треть; при СКФ менее 25 мл/мин еще на '/2 и при СКФ менее 10 мл/мин – в 3 раза.
Нежелательные эффекты ганцикловира: гематотоксичность (нейтро-, лейко-, тромбоцитопения); энцефалопатические реакции; иммунодепрессия; повреждение репродуктивной функции у мужчин и женщин; мутагенное, тератогенное и канцерогенное действие.
Фоскарнет (фосфоноформат) вводят внутривенно. Период его полувыведения от 2 до 4 ч. Экскретируется в неизмененном виде почками. Фоскарнет может вызывать костномозговую депрессию, иммунодепрессию, нарушения функции печени и почек; он обладает тератогенным, мутагенным и канцерогенным свойством.
При использовании ганцикловира и фоскарнета необходимо каждые 2 дня анализ крови. При выраженной нейтропении (меньше 500/мкл) и тромбоцитопении (менее 25 000/мкл) препараты срочно отменяют.
Ганцикловир и фоскарнет являются цитостатиками, поэтому при лечении ЦМВИ их иногда комбинируют с иммуностимуляторами или с интерфероногенами (например, с циклофероном и др.), а также со стимуляторами кроветворения (например, с филграстимом и др.) и с иммуноглобулинами (цитотект).
Цитотект – иммуноглобулин с повышенным содержанием специфических антител к цитомегаловирусу. Его применяют как средство заместительной терапии.
Индивидуальная непереносимость препарата проявляется головной болью, тошнотой, головокружением, рвотой, диареей, тахикардией, цианозом, одышкой, гипертермией, ознобом, повышенным потоотделением, болью в спине, миалгией. Перечисленные симптомы могут появиться уже через 30 мин после начала инфузии и наблюдаться в течение первых суток. Тяжелая анафилактическая реакция может наблюдаться у больных с отсутствием или выраженным дефицитом IgA, что примерно в 30% случаев связано с наличием у них антител против названного иммуноглобулина. Когда такие больные получают иммуноглобулиновый препарат, у них образуются макромолекулярный комплекс IgA – анти-IgA, приводящий к анафилаксии. Целесообразно у всех больных определять IgA в сыворотке крови перед введением цитотекта.
Профилактика Цитомегаловирусной инфекции у детей:
К методам профилактики принадлежат неспецифические: соблюдение личной гигиены, к специфическим относятся медикаментозный метод препаратами – ганцикловир, ацикловир, фоскарнет.
Чтобы исключить возможность инфицирования цитомегаловирусом пациентов при пересадке органов и тканей необходимо проводить тщательный подбор доноров и контроль донорского материала на наличие цитомегаловирусной инфекции.
Особую опасность цитомегаловирусная инфекция представляет для беременных женщин, так как может спровоцировать выкидыш, мертворождение или вызвать тяжелые врожденные уродства у ребенка. Поэтому цитомегаловирус, наряду с токсоплазмозом, герпесом и краснухой принадлежит к числу инфекций, обследоваться на которые женщины должны еще на этапе планирования беременности.
К каким докторам следует обращаться если у Вас Цитомегаловирусная инфекция у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Цитомегаловирусной инфекции у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Герпесвирусные инфекции - группа инфекционных заболеваний, которые вызываются вирусами из семейства Herpesviridae, могут протекать в виде локализованных, генерализованных, рецидивирующих форм болезни, имеют способность к персистированию (постоянному нахождению вируса) в организме человека.
Герпесвирусные инфекции (ГВИ) относятся к наиболее распространенным вирусным болезням человека. Инфицированность и заболеваемость ими каждый год возрастает. Во всех странах мира 60-90% населения инфицированы тем или иным герпесвирусом.
Этиология
Герпесвирусы в своем составе содержат двунитчатую ДНК, имеют глико-липопротеиновую оболочку. Размеры вирусных частиц от 120 до 220 нм.
На сегодня описано 8 типов герпесвирусов, которые выявлены у человека:
- два типа вируса простого герпеса (HSV-1, HSV-2),
- вирус ветряной оспы и опоясывающего герпеса (VZV или HHV-3),
- вирус Эпштейн-Барр (ЕBV или HHV-4),
- цитомегаловирус (CMV или HHV-5), HHV-6, HHV-7, HHV-8.
На основе биологических свойств вирусов сформированы 3 подсемейства герпесвирусов: (альфа-герпесвирусы, бетта-герпесвирусы и гамма-герпесвирусы). К a-герпесвирусам относятся HSV-1, HSV-2, VZV.
К бета-герпесвирусам относятся CMV, HHV-6, HHV-7. Они, как правило, медленно размножаются в клетках, вызывают увеличение пораженных клеток (цитомегалия), способны к персистенции, преимущественно в слюнных железах и почках, могут вызывать врожденные инфекции. К гамма-герпесвирусам относятся ЕBV и HHV-8.
Вирус простого герпеса 1 и 2 типов
Термин "герпетическая инфекция" (ГИ) обычно употребляется относительно заболеваний, которые вызываются HSV-1 и HSV-2. Источником HSV-инфекции являются больные люди различными формами заболевания, в том числе и латентной, а также вирусоносители.
HSV-1 передается воздушно-капельным и контактным путем. Попавший на кожу во время кашля, чихания вирус, находящийся в капельках слюны, выживает в течение часа. На влажных поверхностях (умывальник, ванна и прочее) он сохраняет жизнеспособность в течение 3-4 часов, что нередко является причиной вспышек заболеваний в детских дошкольных учреждениях. Заражение может осуществляться при поцелуях, а также через предметы обихода, которые инфицированы слюной больного или вирусоносителя. HSV-2 передается половым или вертикальным путем. При последнем инфицирование происходит во время родов (контакт с родовыми путями матери), трансплацентарно или через цервикальный канал в полости матки. В связи с тем, что при генерализации инфекции имеет место вирусемия, возможен также трансфузионный или парентеральный путь передачи HSV-2 инфекции. HSV-2 вызывает, как правило, генитальный и неонатальный герпес.
Наибольшая восприимчивость у детей к ГИ в возрасте от 5 месяцев до 3 лет. В зависимости от механизма заражения различают приобретенную и врожденную форму ГИ. Приобретенная ГИ может быть первичной и вторичной (рецидивирующая), локализованной и генерализованной. Также выделяют латентную форму ГИ.
Ни одна инфекция не имеет такого многообразия клинических проявлений, как герпесвирусная. Она может вызывать поражение глаз, нервной системы, внутренних органов, слизистой оболочки желудочно-кишечного тракта, полости рта, гениталий, может являться причиной онкологических заболеваний, имеет определенное значение в неонатальной патологии и возникновении гипертонии. Распространение вируса в организме происходит гематогенным, лимфогенным, нейрогенным путем.
Частота первичной герпесвирусной инфекции возрастает у детей после 6 месяцев жизни, когда полученные от матери антитела исчезают. Пик заболеваемости приходится на возраст 2—3 года. Нередко ГИ встречается и у новорожденных детей, по данным ряда авторов диагностируется у 8% новорожденных с общесоматической патологией и у 11% недоношенных детей.
По данным ВОЗ, заболевания, обусловленные вирусом простого герпеса (HSV), занимают второе место после гриппа среди причин смертности от вирусных инфекций. Решение проблемы диагностики и лечения герпесвирусной инфекции с проявлениями на слизистой оболочке полости рта — одна из важнейших задач практической медицины.
В последнее десятилетие во всем мире значение герпесвирусных заболеваний как проблемы общественного здравоохранения постоянно растет. Представители семейства герпесвирусов человека поражают до 95% населения мира.
К первичным формам ГИ относятся: инфекция новорожденных (генерализованный герпес, энцефалиты, герпес кожи и слизистых), энцефалиты, гингивостоматиты, герпетиформная экзема Капоши, первичный герпес кожи, глаз, герпетический панариций, кератиты. Первичная ГИ возникает вследствие первичного контакта человека с HSV. Как правило, это происходит в раннем детском возрасте (до 5 лет). У взрослых в возрасте 16-25 лет, которые не имеют противовирусного иммунитета, первичная ГИ чаще может быть обусловлена HSV-2. Латентно переносят заболевание 80-90% первично инфицированных детей, и только в 10-20% случаев наблюдаются клинические проявления болезни.
Вторичными, рецидивирующими формами ГИ является герпес кожи и слизистых оболочек, офтальмогерпес, герпес половых органов.
Эпштейн-Барр-вирусная инфекция
Инфекционное заболевание, которое вызывается вирусом Эпштейн-Барр (ЕBV) и характеризуется системным лимфопролиферативным процессом с доброкачественным или злокачественным течением.
ЕBV выделяется из организма больного или вирусоносителя с орофарингеальным секретом. Передача инфекции происходит воздушно-капельным путем через слюну, часто во время поцелуев матерью своего ребенка, поэтому иногда ЕBV-инфекцию называют "болезнью поцелуев". Дети нередко заражаются ЭБВ через игрушки, загрязненные слюной больного ребенка или вирусоносителя, при пользовании общей посудой, бельем. Возможен гемотрансфузионный путь передачи инфекции, а также половой. Описаны случаи вертикальной передачи ЕBV от матери к плоду, предполагают, что вирус может быть причиной внутриутробных аномалий развития. Контагиозность при ЕBV-инфекции умеренная, что, вероятно, связано с низкой концентрацией вируса в слюне. На активацию инфекции влияют факторы, снижающие общий и местный иммунитет. Возбудитель ЕBV-инфекции имеет тропизм к лимфоидно-ретикулярной системе. Вирус проникает в В-лимфоидные ткани ротоглотки, а затем распространяется по всей лимфатической системе организма. Происходит инфицирование циркулирующих В-лимфоцитов. ДНК-вируса проникает в ядра клеток, при этом белки вируса придают инфицированным В-лимфоцитам способность беспрерывно размножаться, вызывая так называемое "бессмертие" В-лимфоцитов. Этот процесс является характерным признаком всех форм ЕBV-инфекции.
ЕBV может вызывать: инфекционный мононуклеоз, лимфому Беркитта, назофарингеальную карциному, хроническую активную ЕBV-инфекцию, лейомиосаркому, лимфоидную интерстициальную пневмонию, "волосатую" лейкоплакию, неходжкинскую лимфому, врожденную ЕBV-инфекцию.
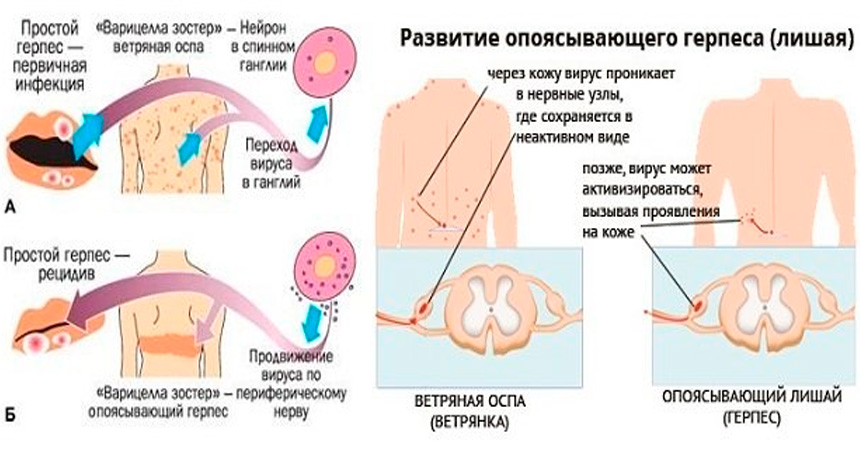
Варицелла-зостер-инфекция
Varicella-zoster вирус вызывает ветряную оспу и опоясывающий герпес. Источником инфекции при ветряной оспе может быть только человек, больной ветряной оспой или опоясывающим герпесом, включая последние 24-48 часов инкубационного периода. Реконвалесценты ветряной оспы остаются заразными на протяжении 3-5 дней после прекращения высыпаний на коже. Через третье лицо заболевание не передается. Возможно внутриутробное заражение ветряной оспой в случае заболевания беременной. Ветряная оспа может встречаться в любом возрасте, но в современных условиях максимальное количество больных приходится на детей в возрасте от 2 до 7 лет. Опоясывающий герпес развивается после первичного инфицирования вирусом Varicella-zoster, после перехода инфекции в латентную форму, при которой вирус локализуется в спинальных, тройничном, сакральном и других нервных ганглиях. Возможна эндогенная реактивация инфекции.
Цитомегаловирусная инфекция
Инфекционное заболевание, которое вызывается цитомегаловирусом (CMV) и характеризуется разнообразными клиническими формами (от бессимптомной до тяжелой генерализованной с поражением многих органов) и течением (острым или хроническим). Факторами передачи CMV могут быть практически все биологические субстраты и выделения человека, в которых содержится вирус: кровь, слюна, моча, ликвор, вагинальный секрет, сперма, амниотическая жидкость, грудное молоко. Потенциальным источником инфекции являются органы и ткани в трансплантологии, а также кровь и ее продукты в трансфузиологии. Пути передачи CMV-инфекции: воздушно-капельный, половой, вертикальный и парентеральный.
Различают врожденную и приобретенную формы CMV-инфекции. Врожденная CMV-инфекция. При антенатальном инфицировании плода заражение происходит преимущественно трансплацентарно. При интранатальном инфицировании CMV поступает в организм при аспирации инфицированных околоплодных вод или секретов родовых путей матери.
У детей более старшего возраста приобретенная CMV-инфекция в 99% случаев протекает в субклинической форме. Наиболее частым проявлением такой формы CMV-инфекции у детей в возрасте старше года является мононуклеозоподобный синдром. Как правило, наблюдается клиника острого респираторного заболевания в виде фарингита, ларингита, бронхита.
Инфекции, вызванные шестым, седьмым и восьмым типами герпесвирусов Герпесвирусы шестого типа (HHV-6) могут явиться причиной эритематозной и розеолезной сыпи (внезапная экзантема), поражений ЦНС и костного мозга у иммуноскомпроментированных детей. Герпесвирусы седьмого типа (HHV-7) вызывают экзантему новорожденных
Для диагностики герпетической инфекции ценным являются цитологический, иммунофлюоресцентный, серологический и ПЦР методы.
Вирусологическое исследование при герпетической инфекции выявляет комплементсвязывающие антитела к ВПГ-1 или -2 в крови матери, пуповинной крови плода и амниотической жидкости.
ПЦР-метод. Материалом для исследования на герпес являются кровь, мазки из глотки, содержимое пузырьков, язв, моча.
Важное значение имеет исследование специфических антител различных подклассов: IgM, IgG1-2, IgG3 и IgG4 к герпес-вирусам. Выявление в сыворотке крови детей специфических иммуноглобулинов М, IgG3, IgG1-2 в титре > 1:20, вирусного антигена и специфических иммунных комплексов с антигеном свидетельствует об остроте инфекционного процесса (активная фаза), а определение только специфических IgG4 расценивается как латентная фаза инфекции или носительство материнских антител.
Лечение
Герпетической инфекции проходит в 3 этапа:
- 1 этап – в активной стадии или при обострении хронического течения заболевания;
- 2 этап – пролонгированное лечение поддерживающими дозами в период ремиссии;
- 3 этап – выявление и санация хронических очагов инфекции, обследование членов семьи для выявления источника инфицирования.
Во всех случаях препараты, их комбинация и длительность подбираются индивидуально с учетом проявлений заболевания, особенности иммунной системы ребенка, возраста, течения заболевания.
Автор материала: врач-педиатр клиники на Родионовской Телицына Е. В.
Читайте также:

