Герпес в перинатальном центре
Обновлено: 18.04.2024
Внутриутробная герпетическая инфекция. Заражение плода вирусом герпеса
Вероятность перинатальной передачи герпетической, наиболее распространенной и практически неконтролируемой инфекции, очень высока. По данным Т. В. Голосовой, И. К. Никитина, известно более 80 представителей вирусов герпеса, из которых 8 типов патогенны для человека.
В паравертебральных сенсорных ганглиях ВПГ и ЦМВ находятся в латентном состоянии в виде L-prep-частиц. Персистенция вирусов связана с иммунокомпетентностью организма. В ситуациях, сопровождающихся иммуносупрессией, вирусы поражают различные ткани и вызывают разнообразные клинические формы заболевания. Одна из таких ситуаций обусловлена беременностью и взаимоотношением мать — плод.
Вероятно, это обусловлено тем, что вирус простого герпеса содержит детерминанты, подобные одному из фрагментов ФНР. Повышение уровня этих аутоантител в крови новорожденных коррелирует с появлением ЭКГ-признаков, свидетельствующих о снижении активности синусового узла и электрической активности миокарда.
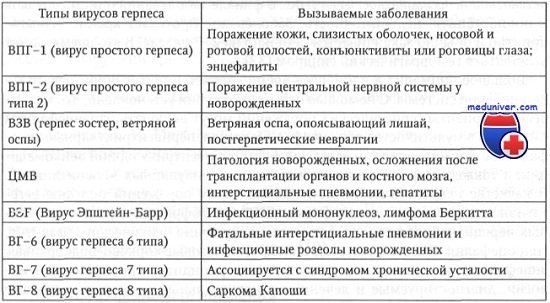
У детей, рожденных женщинами с обострением герпетической инфекции, относительно чаще выявляются нарушения ритма сердца, связанные с угнетением симпатического звена регуляции, а также значительное удлинение интервала QT, что является маркером высокого риска формирования электрической нестабильности миокарда.
По данным Е. М. Малковой с соавторами, у новорожденных (n=62) с обнаруженной ДНК семейства герпесвирусов летальность составила 26,9%, у 7 новорожденных при патолого-анатомическом исследовании обнаружены врожденные пороки развития (гипоплазия легких, ангиоматоз сосудов легкого и генерализованная форма бронхоэктазий).
По результатам анализа у этих детей была выявлена ДНК вируса герпеса человека типа 6, что подтвердило тератогенное действие этого вируса.
Лечение перинатальной герпетической инфекции. К противогерпетическим относят противовирусные (химиопрепараты, интерфероны) и иммунокорригирующие препараты. Рекомендуются для использования в педиатрической практике иммуноглобулин человеческий нормальный, в том числе цитотект внутривенно, иммуноглобулин человеческий нормальный для внутримышечного введения. Однако препараты крови не исключают риск передачи гемотрансмиссивных инфекций. Установлено, что платные и первичные доноры крови являются источниками высокого уровня риска для гемотрансмиссивной передачи ВИЧ-инфекции и гепатитов.
Представляется обоснованным пересмотр показаний к переливанию компонентов и препаратов крови в сторону их сокращения.
Приорететное значение имеет раннее назначение противовирусной терапии. По данным О. Е. Озеровой с соавторами, основной метод диагностики — иммунологический — не всем доступен в связи с трудоемкостью и значительным временем для постановки окончательного диагноза. Поэтому в настоящее время основным диагностическим методом на 1 этапе, помимо клинических методов исследований, является эхография, дающая возможность оценить структуру головного мозга, других органов и установить степень их вовлечения в патологический процесс.
Исходы и результаты лечения внутриутробной ЦМВ-инфекции новорожденных
У детей после ЦМВ инфекции наблюдаются умеренные портальные инфильтраты и фиброз. Вероятно, именно склеротические процессы в аномальных тканях могут оказывать влияние на дальнейшее развитие детей и проявляться в различных формах хронических состояний, в том числе хронического гепатита и атрезии желчевыводящих путей при поражении печени. Достоверного цитомегаловирусного цирроза печени, видимо, не описано. По данным И. М. Каримовой, поражение печени при перинатальной цитомегаловирусной инфекции может протекать в виде хронигеского гепатита, в редких слугаях с переходом в цирроз.
Под наблюдением Н.И. Михайловской находятся дети, госпитализированные в возрасте старше 2 лет по поводу гепатомегалии, а также гепато-спленомегалии. Данные анамнеза, изучение медицинской документации, в том числе выписок из историй болезни родильных домов, отделений патологии новорожденных, в которых дети получали лечение по поводу затянувшейся желтухи, заболеваний бронхолегочной системы, диспептических явлений, заключений специалистов: невропатолога, гастроэнтеролога — позволили заподозрить персистирующую перинатальную герпес-вирусную инфекцию. При лабораторном обследовании диагноз был подтвержден.
В качестве примера Н.И. Михайловская приводит сведения о Р., 4 лет. Клинический диагноз: Персистирующая герпес-вирусная инфекция (перинатальное поражение ЦНС, гепатит, гепато-спленомегалия). МАРС (фальшхорда). Дистония толстого кишечника.
Мальчик был госпитализирован в инфекционное отделение в возрасте 4 лет с клиникой респираторной инфекции. При поступлении выявлена гепато-спленомегалия, печень на 4—5—5 см выступает из подреберья, плотновата, болезненна, селезенка до 2—3—2 см. Ребенок переведен в Центр гепатологии с подозрением на вирусный гепатит. При обследовании острая и хроническая инфекция вирусов гепатитов исключена. Маркеры вирусов гепатитов А, В, С, D не обнаружены, серологические реакции на anti-HIV, RW отрицательны, группа крови и резус-принадлежность ребенка и матери идентичны.
Получал гепатопротекторы, желчегонные препараты, ферменты. Лечение продолжено в домашних условиях. Спустя 2 месяца после выписки госпитализирован повторно с жалобами на периодические боли в животе, снижение аппетита. Собран подробный анамнез, изучена медицинская документация. Ребенок от первой беременности, протекавшей с гестозом, угрозой прерывания, анемией, мама находилась на стационарном лечении. В анамнезе ребенка диагностированы — затянувшаяся конъюгационная желтуха, частые эпизоды респираторной инфекции, наблюдение и лечение у невропатолога по поводу перинатального поражения ЦНС, синдрома повышенной нервно-рефлекторной возбудимости, судорожной готовности на фоне гипертермии.
С двухлетнего возраста получал лечение у гастроэнтеролога по поводу дистонии толстого кишечника с клиникой стойкой задержки стула.
При поступлении в стационар общее состояние расценено как средней тяжести. Бледен. Дефицит веса. Пальмарная эритема. Печень на 5—6—5 см выступает из подреберья, плотна, с фестончатым краем и гладкой поверхностью, чувствительна при пальпации. Селезенка до 1—3—1 см выступает из подреберья. Локальная болезненность в точке желчного пузыря. Со стороны проб печени — умеренная диспротеинемия, повышение активности АЛТ и ACT (1,5 нормы), биохимический синдром холестаза.
Со стороны периферической крови — лейкоциты 6 700 э 13! с 37 л 50. УЗИ — гепатоспленомегалия, небольшое уплотнение структуры печени, резкая гипотония желчного пузыря, киста левой почки, уплотнение ЧЛС и паренхимы обеих почек (направлен под наблюдение нефролога для верификации диагноза). ЭХО КГ — фальшхорда, кардио-патия. Консультирован в отделении плановой абдоминальной хирургии НИИ педиатрии РАМН НЦЗД, исключена врожденная хирургическая патология и врожденный фиброз печени, рекомендовано динамическое наблюдение в институте.
У отца ребенка — часто рецидивирующая герпетическая инфекция, с обильными высыпаниями везикул на коже лица и слизистых. У ребенка при исследовании в Центре молекулярной диагностики ЦНИИЭ МЗ РФ обнаружены anti-CMV IgG в концентрации 33,0 ЕД/мл (максимально допустимые показатели — до 10 МЕ/мл) и антитела к вирусу Herpes anti-HSV 1 и 2 типа. У матери при скрининговом исследовании в Центре молекулярной диагностики ЦНИИЭ МЗ РФ обнаружены маркеры вирусов Herpes 1 и 2 типа —anti-HSV 1 и 11 IgG, и anti-CMV в концентрации 37,0 ЕД/мл. С учетом предстоящей запланированной беременности женщина направлена под наблюдение Областного НИИ акушерства и гинекологии Москвы.
Таким образом, у детей в возрасте старше 2 лет с проявлениями поражения печени необходимо исключать персистирующую перинатальную инфекцию, в частности, герпес-вирусную. При подтверждении диагноза показана рациональная, в том числе противовирусная терапия, соответствующая диагнозу, активности процесса, результатам клинического, лабораторного и ультразвукового исследований.
Пример внутриутробной смешанной ЦМВ и герпес инфекции у новорожденного ребенка
Перинатальная вирусная инфекция смешанной этиологии характеризуется выраженной общеинфекционной симптоматикой, гипотрофией, персистирующим течением с обострениями, периодами лихорадки, диспептических явлений, полиорганной патологией, резистентностью к терапии.
В качестве типичного клинического примера Н.И. Михайловская приводит сведения о ребенке Д.
Девочка Д. (дата рождения 26.06.2004 года, история болезни 1969/2004). Клинический диагноз: Перинатальная персистирующая смешанная инфекция — цитомегаловирусная и вируса герпеса 6 типа, фаза репликации (перинатальное поражение ЦНС, гепатит, гипотрофия, анемия, кардиопатия).
Ребенок от 4 беременности, протекавшей гестозом и угрозой прерывания на протяжении всей беременности. Первая беременность закончилась самопрооизволь-ным выкидышем, вторая — срочными родами, третья — медицинским абортом. Девочка родилась в срок с признаками внутриутробной гипотрофии (вес 2550,0, длина 51 см), перинатальной энцефалопатии, с желтухой. С рождения получала лечение у невропатолога. В возрасте 3 месяцев (27.09) вес — 5 100,0, жалоб на ребенка не было. Сделана первая вакцинация АКДС и полиомиелита. Спустя сутки мама стала обращаться к специалистам по поводу выраженного беспокойства, нарушения сна, отказа ребенка от еды, упорного срыгивания, потери веса.
В возрасте 3,5 месяца госпитализирована в Детскую областную больницу, где выявлено повышение активности печеночных ферментов: АЛТ — 240 ед, ACT— 126 ед. Госпитализирована в Центр гепатологии, где у ребенка и у мамы исключена инфекция вирусов гепатитов А, В, С, D, anti-HIV, RW отрицательны. При исследовании в Центре молекулярной диагностики ЦНИИЭ МЗ РФ у ребенка обнаружены anti-CMV IgG в концентрации 93 ME /мл (при допустимой > 10,0). Анемия: НВ — 92 г/л гипохромия, анизоцитоз. УЗИ — гепатомегалия, стенки сосудов печени подчеркнуты, добавочная долька селезенки. НСГ — четвертый желудочек расширен, углублен, глубина передних рогов — 7 мм, умеренная дилятация боковых желудочков головного мозга.
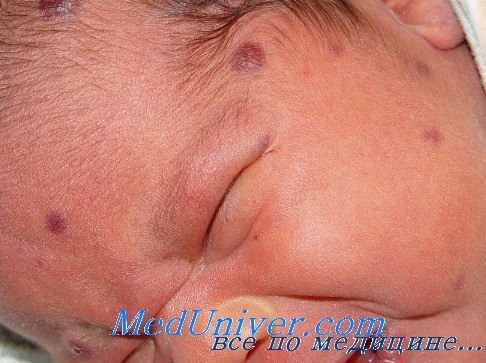
Диагностирована перинатальная цитомегаловирусная инфекция (поражение ЦНС — энцефалопатия с признаками вялотекущего энцефалита, гепатит, анемия). Проведены курсы противовирусной терапии (виферон, ацикловир), ликопида, гепатопротекторов, ак-тиферрина, выполнены назначения невропатолога. При обследовании в возрасте 5,5 месяцев (1.12.04) все функциональные пробы печени в норме. Повторно госпитализирована в возрасте 7 месяцев 8.02.2005 года. Со слов мамы за 3 недели до госпитализации — вакцинация против полиомиелита, после чего внезапное резкое ухудшение состояния, отказ от еды, потеря в весе. При поступлении состояние ребенка средней тяжести за счет интоксикации. Девочка вяла, беспокойна, не интересуется окружающим, крик монотонный, эмоционально не окрашен. Кожа бледна, с сероватым оттенком. Печень на 3—4—3 см выступает из подреберья, плотновата, болезненна, селезенка до 2 см.
Со стороны функциональных проб печени — резкое повышение активности цитолитических ферментов — АЛТ до 9 норм, ACT до 3 норм. Концентрация anti-CMV IgG повысилась до 177!! МЕ/мл. Для уточнения диагноза и тактики лечения девочка госпитализирована в Республиканскую детскую клиническую больницу. При обследовании выявлены маркеры смешанной вирусной внутриутробной инфекции: anti-CMV IgG 168 МЕ/мл, DNA CMV обнаружена в моче и слюне, DNA V. Herpes 6 типа — в крови. Микробиологическое исследование кала: лактозонегативная кишечная палочка (кп) 0, гемолизирующая кп 10* 9, обнаружены золотистый стафилококк, грибы рода Кандида, Клебсиелла, Цитробактер в высоких разведениях.
Допплерография печени и портальной системы — внутрипеченочные желчные протоки с фрагментарно уплотненными стенками. Стенки внутриорганного бассейна равномерно утолщены. УЗИ — Селезенка на верхней границе нормы, подчеркнут рисунок сосудов, почки — ЧЛК с уплотненными стенками. Специалистами РДКБ была назначена терапия: виферон по схеме не менее 6 месяцев, траумель по 1 /2 таблетки 3 раза между едой + хепель по 1 /2 таблетки 3 раза за 30 минут до еды, курсами по 2 месяца с перерывом в 1 месяц, поливалентный бактериофаг 2 курса по 4 дня, по схеме абомин, креон, гомеопатические препараты. Назначения невропатолога включали фенибут. Общее состояние и самочувствие ребенка улучшились, снизилась активности АЛТ и ACT (до 2—3 норм). Однако в возрасте 11 месяцев — вновь беспокойство, нарушение сна, снижение аппетита. За 5 месяцев девочка прибавила в весе лишь 700,0: вес в возрасте 6 месяцев— 7 500,0, в 8 месяцев— 7 300,0, в 9 месяцев — 7 000,0, в 11 месяцев — 8 200,0.
При поступлении в стационар состояние ребенка средней тяжести, явления интоксикации, клинико-лабораторная симптоматика гепатита.
Активность ферментов повысилась до 8 норм, появилась биохимическая симптоматика внутрипеченочного холестаза. Маркеры вирусов гепатитов А, В, С, D отрицательны. В анализах мочи — изостенурия, лейкоциты до 20 в поле зрения. Выписана с улучшением, с тенденцией к нормализации активности ферментов. Однако болезнь приняла хроническое течение, на фоне признаков вторичного иммунодефицитного состояния. Ребенок повторно направлен в РДКБ.
Таким образом, внутриутробная инфекция смешанной вирусной этиологии — цитомегаловирусная и вируса герпеса 6 типа — протекала у ребенка с признаками полиорганной патологии, приняла хроническое течение, осложнилась проявлениями вторичного иммунодефицитного состояния. Фактором, провоцирующим обострение в возрасте трех и шести месяцев, была вакцинация. Детям с признаками перинатальной вирусной инфекции показан медицинский отвод от живых вакцин сроком не менее 2 лет.

Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Введение
В настоящее время отмечается большой рост внутриутробной герпетической инфекции и увеличение числа инфицированных новорожденных. Среди инфекций герпетической этиологии наибольшую распространенность имеет цитомегаловирусная инфекция (ЦМВИ) и герпес-вирусная инфекция, вызываемая вирусами простого герпеса (ВПГ) I и II типов. У новорожденных 80% герпес-вирусной инфекции вызываются ВПГ II типа. Исходом даже бессимптомно протекающей во время беременности инфекции могут быть тяжелые последствия у плода: врожденные уродства, поражение различных органов и систем, наиболее серьезным из которых является повреждение головного мозга.
Клинические проявления в неонатальном периоде отмечаются лишь у 10% анте- или интранатально инфицированных детей, у остальных же внутриутробное инфицирование в периоде новорожденности протекает бессимптомно. Летальность у детей с генерализованной герпес-вирусной и цитомегаловирусной инфекцией при отсутствии химиотерапии составляет 90%; у 50% выживших отмечаются тяжелые психоневрологические исходы 1.
Быстрая и надежная расшифровка этиологии заболевания у новорожденного приобретает особую актуальность в связи с появляющейся в последние годы возможностью проведения этиотропной терапии.
Основным методом диагностики этих заболеваний является иммунологический метод. Но он далеко не всем доступен из-за дороговизны, трудоемкости, значительного времени, необходимого для постановки окончательного диагноза. Кроме того, этот метод не дает возможности установить вовлечение в патологический процесс головного мозга, что крайне важно для выбора лечебных мероприятий. Поэтому в настоящее время основным диагностическим методом на первом этапе помимо клинических методов является эхоэнцефалография, позволяющая оценить степень вовлечения головного мозга и других внутренних органов в инфекционный процесс.
На основании данных эхографии головного мозга и клинической картины заболевания у новорожденных можно начинать проводить лечение детей "по подозрению". В дальнейшем эти дети составят группу для комплексного иммунологического обследования, в результате которого диагноз будет уточнен.
Как свидетельствуют литературные данные, наиболее часто у детей с внутриутробной герпес-цитомегаловирусной инфекцией при эхоэнцефалографии выявляют кисты сосудистых сплетений боковых желудочков и (или) субэпендимальные кисты [4]. Показано, что при изолированных кистах сосудистых сплетений (без анализа причин их возникновения) прогноз психоневрологического развития детей в целом благоприятный [5]. При субэпендимальных кистах инфекционного происхождения прогноз неопределенный : от нормального развития до выраженного церебрального дефицита 6. В связи с этим цель настоящего исследования состояла в оценке психоневрологического статуса детей, имевших кисты сосудистых сплетений и (или) субэпендимальные кисты, с внутриутробной герпес-цитомегаловирусной инфекцией, подтвержденной данными комплексного иммунологического исследования.
Материалы и методы
Из многочисленной группы новорожденных (396 новорожденных с субэпендимальными кистами и 261 с кистами сосудистых сплетений) нами впоследствии (после завершения периода наблюдения) были отобраны 16 детей с подтвержденной иммунологическими методами герпес-цитомегаловирусной инфекцией, которые были подвергнуты динамической эхоэнцефалографии и клиническому обследованию в течение 2-12 мес. Показаниями для проведения иммунологического исследования на первом этапе являлись структурные изменения головного мозга, выявленные при эхографии, косвенно свидетельствующие о наличии внутриутробной инфекции.
Иммунологическая диагностика состояла в выявлении специфического антигена иммуноферментным и иммунофлюоресцентным методами, фрагментов ДНК вируса методом полимеразной цепной реакции, определении специфических антител в биологических средах. Материалом для исследования у детей служили кровь, моча и ликвор, у матерей - кровь. Обследование матерей проводили для повышения достоверности диагноза у их детей.
Всем детям проводили динамическую эхоэнцефалографию с первой недели до 2-9 мес. жизни. Эхографию головного мозга осуществляли с помощью различных ультразвуковых приборов, часть исследований выполнена на аппарате SA-8800 "GAIA" ("Medison", Южная Корея). Всего выполнено 59 эхографических исследований головного мозга.
Результаты и обсуждение
В клинической картине у 3 детей отмечался синдром угнетения функций ЦНС, который выражался в снижении церебральной и двигательной активности, мышечного тонуса и угнетении физиологических рефлексов новорожденных; у этих же детей выявлено вовлечение в патологический процесс органов дыхания с развитием пневмонии. У 2 новорожденных отмечена затянувшаяся желтуха с гепатоспленомегалией, у 2 - отечный синдром. У 4-го ребенка неврологическая симптоматика отсутствовала, у него были выявлены изменения со стороны внутренних органов в виде гепатоспленомегалии и затянувшейся желтухи.
При эхоэнцефалографии у детей I группы выявлено от 1 до 3 изолированных кистозных структур (не сочетающихся с другими структурными изменениями) диаметром от 0,2-0,5 см (рис. 1, 2), расположенных в верхушке или теле сосудистого сплетения левого бокового желудочка. У 3-х из этих детей исходные данные вентрикулометрии соответствовали нормальным значениям. У 1-го ребенка отмечено незначительное (до 0,6 см) расширение межполушарной щели и субарахноидальных пространств по конвекситальной поверхности мозга и умеренное симметричное увеличение ширины лобных рогов (преимущественно) и высоты тел боковых желудочков (до 0,7 см).
Рис. 1. Эхоэнцефалограмма ребенка Р. со смешанной герпес-цитомегаловирусной инфекцией, 7-е сут. жизни. Стрелками обозначена киста в верхушке сосудистого сплетения левого бокового желудочка.


Рис. 2. Эхоэнцефалограмма ребенка Д. с цитомегаловирусной инфекцией, 2-е сут. жизни. Стрелками обозначены кисты в теле сосудистого сплетения левого бокового желудочка.


В конце периода наблюдения, который составлял от 2 до 7 мес., у 2 детей кисты сосудистых сплетений имели прежние размеры и число; у них данные вентрикулометрии, как при первом УЗИ, соответствовали возрастной норме. У одного ребенка киста сосудистых сплетений уменьшилась в размерах с 0,5 до 0,1 см; у него отмечено дальнейшее симметричное расширение боковых желудочков (ширина их лобных рогов и высота тел увеличилась с 0,7 до 0,9 см) и межполушарной щели и субарахноидальных пространств по конвекситальной поверхности мозга от 0,6 до 0,9 см. У одного ребенка этой группы при эхоэнцефалографии, проведенной в 7 мес. жизни, киста сосудистых сплетений не выявлялась, однако у него произошло симметричное увеличение ширины лобных рогов (преимущественно) и высоты тел боковых желудочков до 1 см и расширение субарахноидальных пространств по конвекситальной поверхности мозга до 0,7 см. При катамнестическом наблюдении только у этого ребенка выявлена незначительная задержка психомоторного развития, у 3 других детей I группы признаки церебрального дефицита не отмечены.
Всем детям этой группы проводилась иммунотерапия цитотектом и пентаглобином ("Biotest", Германия); в том числе 2 детям - иммунохимиотерапия (противоцитомегаловирусный иммуноглобулин - цитотект и виролекс). При анализе полученных данных какой-либо связи клинических проявлений заболевания, данных комплексного иммунологического обследования с локализацией кисты сосудистых сплетений, их числом, размерами и динамикой не выявлено.
По данным комплексного иммунологического обследования, у 6 детей была установлена смешанная герпес-цитомегаловирусная, у 3 - цитомегаловирусная и у 3 - герпес-вирусная инфекция. В клинической картине у этой группы больных выявлено полиморфное поражение с преобладанием признаков нарушений функций нервной системы у всех детей: преимущественно синдромом угнетения - у 9, гипервозбудимости - у 3. Вовлечение в патологический процесс органов дыхания отмечено у 5 новорожденных, затянувшаяся желтуха с гипербилирубинемией - у 9, гепатомегалия - у 2, отечный синдром - у 3 детей.
У детей этой группы при первом эхоэнцефалографическом исследовании были выявлены субэпендимально расположенные кистозные структуры на уровне таламо-каудальной вырезки (ТКВ) и (или) кпереди от нее диаметром от 0,3 до 1,1 см. У части новорожденных субэпендимальные кисты были представлены единой полостью с однородным или неоднородным содержимым, у других детей эти структуры напоминали соты, т. е. состояли из множества жидкостных включений, окруженных эхопозитивным ободком (рис. 3). Эти структурные особенности субэпендимальных кист, по-видимому, обусловлены разными стадиями резорбции. У 10 детей субэпендимальные кисты располагались в симметричных участках обоих полушарий, у 2 новорожденных - только в левом полушарии. У 3 детей, помимо субэпендимальных кист, расположенных в таламо-каудальной вырезке и (или) кпереди от нее, дополнительно выявлены субэпендимальные щелевидные кистозные структуры на уровне средних или передних отделов лобных рогов (см. рис. 3).
Рис. 3. Эхоэнцефалограмма ребенка Б. со смешанной герпес-цитомегаловирусной инфекцией, 5-е сут. жизни.

а) Правое полушарие. Стрелками обозначены субэпендимальные кисты, имеющие вид сот, расположенные в таламокаудальной вырезке и кпереди от нее.

б) Левое полушарие. Стрелками обозначены субэпендимальные кисты, имеющие вид сот, расположенные в таламокаудальной вырезке и кпереди от нее.

в) Правое полушарие. Стрелками обозначены субэпендимальные щелевидные кистозные структуры на уровне передних и средних отделов лобных рогов боковых желудочков.

г) Левое полушарие. Стрелками обозначены субэпендимальные щелевидные кистозные структуры на уровне передних и средних отделов лобных рогов боковых желудочков.
У всех новорожденных этой группы исходные данные вентрикулометрии соответствовали нормальным значениям. В конце периода наблюдения, составляющего от 2 до 9 мес., размеры желудочковой системы у 9 детей оставались на нормальных значениях, у 3 детей отмечалось умеренное (до 0,9 см), симметричное увеличение ширины лобных рогов (преимущественно) и высоты тел боковых желудочков. Кроме того, у 1 ребенка выявлено расширение межполушарной щели и субарахноидальных пространств по конвекситальной поверхности мозга до 0,7 см. В течение периода наблюдения субэпендимальные кисты уменьшались в размерах у 11 детей (полностью резорбировались в конце периода наблюдения у 10 из них) и только у 1 ребенка односторонняя субэпендимальная киста увеличилась к 2 мес. жизни с 0,5 до 1 см.
Всем новорожденным II группы, как и детям I группы, проводилась иммунотерапия различными иммуноглобулинами (цитотект, пентаглобин), 3 детям - иммунохимиотерапия (цитотект, виролекс). Положительный терапевтический эффект отмечался у всех детей этой группы.
Эффективность лечения оценивалась по срокам выхода из тяжелого состояния, ликвидации или уменьшению явлений инфекционного токсикоза, нарастанию массы тела, данным динамической эхоэнцефалографии и лабораторным показателям. При катамнестическом наблюдении психоэмоциональное и моторное развитие у 6 детей II группы соответствовало возрастной норме. У других 6 детей этой группы в течение первого полугодия отмечено выраженное в различной степени отставание психомоторного развития (3-е из них имели вентрикуломегалию). К концу первого года жизни признаки церебрального дефицита у них отсутствовали.
Как и в I группе детей, мы не выявили отчетливой связи между числом, локализацией, динамикой субэпендимальных кист и данными комплексного иммунологического обследования, а также клиническими проявлениями заболевания как в раннем неонатальном периоде, так и в конце периода наблюдения.
Как известно, субэпендимальные кисты, возникающие при инфекции, являются результатом поражения субэпендимально расположенного герминативного матрикса инфекционным агентом. В начале процесса в зоне повреждения герминативного матрикса возникает участок некроза, который по мере его резорбции в течение 3-4 нед. трансформируется в кистозную полость [9]. Полная резорбция кисты, как показали наши исследования, происходит к концу 2-4 мес. жизни ребенка (чем больше кистозная полость, тем дольше идет процесс ее резорбции). Так как во всех приводимых нами наблюдениях уже при первом эхографическом исследовании головного мозга были выявлены субэпендимальные кисты, мы можем утверждать, что повреждение герминативного матрикса произошло в период внутриутробного развития.
Из 396 новорожденных с субэпендимальными кистами только один ребенок имел гестационный возраст 30 нед., подавляющее число новорожденных (88,9%) были доношенными. Зная время, необходимое на формирование субэпендимальной кисты в зоне некроза, можно предположить, что в подавляющем большинстве случаев повреждение матрикса произошло в конце II - начале III триместра беременности. При повреждении герминативного матрикса на стадии активной пролиферации его клеток (до 20 нед. гестации), обеспечивающей формирование серого вещества и глии [6], можно ожидать возникновения пороков развития головного мозга, обусловленных нарушением миграции, или внутриутробной гибели плода. Поскольку как первое, так и второе встречаются довольно редко, кроме того, учитывая, что субэпендимальные кисты в основном выявлены у доношенных детей, мы полагаем, что до 20 нед. гестации герминативный матрикс обладает определенной резистентностью к действию инфекционного агента.
Структурные же изменения головного мозга у новорожденных в виде субэпендимальных кист, по-видимому, являются исходом повреждения герминативного матрикса, находящегося в процессе регрессии (после завершения своей основной функции). Опровергнуть или подтвердить это предположение могут данные скринингового ультразвукового исследования головного мозга плода, проведенного в начале II триместра беременности, высококвалифицированным специалистом с использованием трансвагинального датчика.
Схожесть клинической картины заболевания у новорожденных I и II групп, этиологии процесса, установленной иммунологическим методом, а также высокий терапевтический эффект при использовании одних и тех же лекарственных препаратов свидетельствуют о том, что не кисты сосудистых сплетений и субэпендимальные кисты являются определяющими в клинической картине заболевания, а, по-видимому, сходные патоморфологические изменения, возникающие в головном мозге под влиянием инфекции, не обнаруживаемые при эхоэнцефалографии. Кисты сосудистых сплетений и субэпендимальные кисты - лишь маркеры этих патологических процессов. В то же время, выявление при эхографии головного мозга кист сосудистых сплетений и (или) субэпендимальных кист при клинической картине, характерной для внутриутробных вирусных инфекций, дает основание для проведения иммунохимиотерапии еще до получения результатов иммунологического исследования, что ведет к снижению тяжелых церебральных расстройств у детей раннего возраста.
Литература
- Кудашов Н.И., Озерова О.Е., Орловская И.В. Неврологические проявления при герпесвирусной инфекции у новорожденных // Педиатрия . - 1997. - N5. -С.42-45.
- Whitley R.T. Neonatal herpes Simplex infections // J. Med.Virol. - 1993. - V.1.- Suppl.- P.13-21.
- MurguiapdepSierra T., Florido J.,Minox T., Arriola M et al. Neonatal herpetic encephalitis . Current concepts concerning a case.// Rev. Invest. Clin. - 1996. - V.48. - N 1. - P. 35-41.
- Озерова О.Е., Кудашов Н.И., Орловская И.В. Особенности эхоэнцефалограммы у новорожденных с герпетической инфекцией // Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии. - 1993. - N2. - С. 55-70.
- Озерова О.Е., Казьмин А.М., Дайхина Л.В., Кудашов Н.И., Орловская И.В. Клиническое значение кист сосудистых сплетений желудочков головного мозга у новорожденных // Акушерство и гинекология - 1993. - N 1. - вС. 31-33.
- Mito T., Ando Y.,Takeshita K.,Takada K., Takashima S. Ultrasonographical and morphological examination of subependimal cysts lesions in maturely born infants //Neuropediatrics. - 1989. - V.20. - N 4. - P. 211-214.
- Zorzi C., Angonese I. Subependimal pseudocysts in the neonate // Eur. J. Pediatr. - 1989. - V.148. - P. 462-464.
- Yamashita Y., Outani Y., Kawano Y., Horikawa M et al. Clinical analyses and short-term prognoses of neonates with subependimal cysts // Pediatr. Neurol. - 1990. - V.6. - N6. - P. 375378.
- Озерова О.Е., Казьмин А.М., Дайхина Л. В. Субэпендимальные кровоизлияния у новорожденных: эхографическая характеристика и психоневрологические исходы // Акушерство и гинекология. - 1991. - N3. - С. 40-43.

УЗИ сканер HS60
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
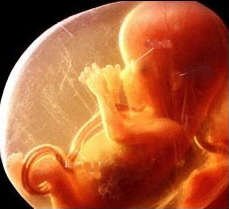
Вирусные инфекции приобретают особую актуальность в период беременности, так как могут влиять на здоровье не только будущей мамы, но и плода. Герпес среди них занимает одно из главных мест, поскольку это заболевание очень часто встречается у беременных женщин.
Герпетическая инфекция - это большая группа инфекционных заболеваний, вызываемых вирусами герпеса человека. Это одно из наиболее распространенных заболеваний человека. По данным многочисленных исследований, к 18 годам более 90% населения планеты инфицируются одним или несколькими штаммами вирусов герпеса. Среди инфекций, передающихся половым путем, генитальный герпес занимает второе место после трихомониаза.
Особенностью герпеса является его рецидивирующее течение. Находящийся в спящем состоянии вирус пробуждается при снижении иммунитета, а беременность сама по себе обладает свойством ослабления иммунных сил организма, так как организм женщины вынашивает наполовину чужеродный с иммунологической точки зрения плод, что невозможно без снижения интенсивности работы ряда звеньев иммунитета. Именно поэтому обострения герпеса во время беременности происходят довольно часто.
Проявления заболевания
Клинические проявления герпеса зависят от многих факторов - типа вируса, локализации поражения, возраста и иммунного статуса человека. Классическая симптоматика - это появление группы мелких пузырьков, наполненных прозрачной жидкостью. Для герпеса характерно появление пузырьков при очередном рецидиве всегда в одном и том же месте.
При генитальном варианте герпеса высыпания локализуются на половых губах, на коже промежности, внутренней поверхности бедер, лобке или вокруг заднего прохода.
Сыпь сопровождается неприятными ощущениями, зудом, жжением, болью. Затем пузырьки лопаются, на их месте образуются сначала язвочки, затем корочки. Герпетические язвочки характерно болезненны, а образующиеся на их месте корочки исчезают бесследно через 2—3 дня, не оставляя на коже ни пигментации, ни рубцов.
Общая симптоматика заболевания весьма разнообразна: повышение температуры тела, увеличение лимфатических узлов (чаще – паховых), суставная и мышечная боли, упорные мигрени, раздражительность, отсутствие аппетита и т.д.
Типичная клиническая картина проявляется не более чем в трети случаях носительства генитального герпеса. Нередко генитальный герпес протекает бессимптомно или без характерных высыпаний.
Атипичное течение герпеса более коварно: отсутствие пузырьковых высыпаний с лихвой компенсируется многообразием общих проявлений, что часто создает трудности в постановке верного диагноза. Симптомы атипичного герпеса - жжение, трещины промежности, поло¬вых губ или заднего прохода, отек, покраснение слизистых оболочек. В таких случаях часто диагноз ставится неверно либо женщины, уверенные в наличии кандидоза (молочницы) или бактериального вагиноза, безрезультатно занимаются самолечением.
Тяжесть любых проявлений герпетической инфекции определяется состоянием иммунитета.
Разновидности вируса
Наиболее распространенными являются ВПГ 1 и 2 - вирус простого герпеса первого и второго типов. ВПГ 1 чаще всего проявляется в виде пузырьковых высыпаний на губах, возможны поражения глаз, ротовой полости, носа. Классическая локализация ВПГ 2 (генитального герпеса) - слизистая оболочка мочеполового тракта. В некоторых случаях наблюдается следующий феномен перекрестного инфицирования: виновником герпетических высыпаний верхней половины туловища является ВПГ 2 (генитальный) и наоборот - ВПГ 1 вызывает развитие инфекции нижней половины. Как правило, это связано с двумя причинами: нарушением элементарных правил гигиены, когда происходит самозаражение - перенос вируса через кожу и слизистые оболочки, и орально-генитальными контактами.
Заражение герпесом половых путей происходит в основном только через незащищенный половой контакт. В редких случаях возможна передача инфекции через поцелуй, использование общей посуды и белья. Это так называемый горизонтальный путь передачи. При вертикальном пути передачи происходит передача вируса от матери плоду во время беременности (при прохождении ребенка через родовые пути при условии наличия в слизистой вируса герпеса, то есть при родах в момент обострения герпес-вирусной инфекции). При локализации очагов на губах можно заразиться через общую посуду, полотенца и поцелуи. Надо отметить, что риск внутриутробного инфицирования плода при первичном герпесе составляет 50%, при рецидиве – не более 4%, во время родов при наличии высыпаний на шейке матки и наружных половых органов – 90%.
Как действует вирус?
Рассмотрим некоторые особенности взаимодействия вируса с организмом человека.
Обострения герпеса могут быть связаны с двумя факторами:
- уже имеющимся иммунодефицитом, что является пусковым механизмом для рецидива герпетической инфекции;
- влиянием вируса на сам иммунитет. Длительное нахождение герпеса в организме обладает прямым повреждающим действием на клетки иммунной системы. Таким образом, развивается порочный круг: ослабленный иммунитет запускает рецидив герпетической инфекции, а вирус герпеса еще более усугубляет имеющийся иммунодефицит.
Диагностика
Диагностика герпеса при типичной картине не представляет сложности для врача (да и для пациента тоже). Клинические проявления герпетической инфекции весьма яркие: характерные пузырьковые высыпания, рецидивирующее течение говорят сами за себя.
В случаях атипичного герпеса, вирусоносительства и при профилактическом обследовании методы лабораторной диагностики приобретают особое значение.
Основные направления лабораторных методов исследований:
- Определение непосредственно самих вирусных частиц. Для этого используются методы электронной микроскопии с использованием специальных методов окрашивания мазков, ИФА (иммуноферментный ана¬лиз) и ПЦР. Последний метод (полимеразная цепная реакция) широко распространен и дает достаточно точные результаты - он доступен, высокочувствителен, специфичен. Как правило, материал для анализа ПЦР берут путем соскоба (мазка) с шейки матки, влагалища, уретры, также исследуют соскоб со дна ранки или содержимое пузырька. При подозрении на скрытое течение инфекции исследуют еще мочу и слюну.
- Исследование крови на антитела к вирусу простого герпеса, при котором выявляется иммуноглобулины классов М и G. Если заражение человека произошло впервые (первичное инфицирование) или в момент диагностики соответствует острой фазе заболевания (рецидив), то в крови обнаруживают ранние антитела класса М.
Определение поздних иммуноглобулинов класса G свидетельствует о том, что встреча организма с вирусом уже произошла много ранее.
Особое внимание уделяется лабораторной диагностике в случае впервые выявленных симптомов герпеса при беременности. Такая ситуация может отвечать как первичному эпизоду, так и первому рецидиву (т.е. ранее организм уже встречался с вирусом, но проявлений не давал).
Если в крови есть IgG (поздние иммуноглобулины), значит, герпес рецидивирующий и угрозы для плода или эмбриона практически нет. Если в крови нет Ig, а есть IgМ, то необходимо проявить крайнюю степень настороженности, поскольку это является лабораторным подтверждением первичного эпизода.
Генитальный герпес и беременность
Особую же актуальность в период беременности приобретает именно генитальный герпес.
Очевидно, что при возникновении проблемы герпеса у будущей мамы появляется масса волнений. К счастью, в большинстве случаев эти тревоги безосновательны.
Когда же действительно есть повод для волнений? Наибольшую опасность представляет ситуация, когда заражение герпесом происходит у женщины во время беременности - первичный эпизод генитального герпеса. Такая ситуация характеризуется выраженными проявлениями, т.к. в организме матери нет защищающих от герпеса антител. Для плода риск особенно высок при заражении генитальным герпесом в первом и третьих триместрах. Инфицирование плода в первом триместре беременности приводит к возникновению гидроцефалии (накоплению жидкости в головном мозге), пороков сердца, аномалий развития желудочно-кишечного тракта и др. Такие случаи чрезвычайно редки, так как при первичном эпизоде герпеса, как правило, происходит самопроизвольное прерывание беременности до срока 10 недель.
Лечение герпеса во время беременности
При доказанном первичном инфицировании на ранних сроках беременности обсуждается вопрос о ее прерывании.
Лечение рецидивов герпеса во время беременности и вне ее не имеет принципиальных различий. В любом случае преследуются одинаковые цели: снижение выраженности симптомов (боль, зуд, лихорадка и т.д.), сокращение сроков заживления ран, предотвращение новых обострений. Следует помнить, что чем скорее начато лечение, тем больший эффект оно будет иметь. Если лечение начато в продромальный период (когда появляются начальные признаки заболевания – покалывание или легкий зуд на месте будущих пузырьков, озноб, недомогание), то это достоверно поможет снизить выраженность проявлений герпеса.
Особенностью лечения герпетической инфекции является точное соблюдение назначенной дозы и режима приема препаратов. Если пропущена очередная доза противовирусного препарата, то вирус герпеса может успеть в этот период размножиться, что приведет к неэффективности лечения.
Единственными препаратами, обладающими доказанной эффективностью в лечении герпетической инфекции, являются специфические виростатики – аналоги нуклеозидов (АЦИКЛОВИР, ВАЛАЦИКЛОВИР, ПЕНЦИКЛОВИР, ФАМЦИКЛОВИР).
Лечение герпетической инфекции при беременности подразумевает использование разрешенных противовирусных препаратов (ацикловир ЗОВИРАКС и валацикловир ВАЛТРЕКС) в виде мазей, кремов и таблеток.
Одновременно с противовирусными препаратами в комплексном лечении используют иммуномодуляторы (ВИФЕРОН), витамины, физиотерапевтические методы, местные антисептики для более быстрого заживления ранок.
Безусловно, целесообразность и курс лечения определяются в каждом индивидуальном случае. Ситуация сочетание беременности и герпеса должна находится под бдительным контролем врача и самолечение в этих случаях просто недопустимо.
Герпес новорожденных
В каких же случаях коварный вирус все-таки достигает своей цели и вызывает заболевание у новорожденных? В подавляющем большинстве случаев (90%) заражение происходит контактным путем при прохождении через родовые пути. Внутриутробное заражение новорожденного отмечается только в 5% случаев герпеса новорожденных. Причем важным условием является наличие у мамы именно первичного эпизода гениального герпеса, в случаях бессимптомного носительства или рецидивирующего герпеса инфицирование плода в родах случается не чаще, чем в 4% случаев.
Симптомы и признаки герпеса у младенцев появляются уже на 2-й неделе после рождения. Для герпеса новорожденного характерно наличие пузырьков на коже, слизистых оболочках (полости рта, половых органов) и конъюнктиве глаз. Чем более недоношенными рождаются дети, тем более сложнее протекает инфекция; в таких случаях часто встречается поражение головного мозга (герпетический энцефалит).
Профилактика
Специфических методов профилактики герпеса, к сожалению, не существует. Профилактика инфекции на этапе планирования, при беременности и после родов носит исключительно предупредительный характер. Применяются следующие меры:
Читайте также:

