Гибель клетки от вируса
Обновлено: 18.04.2024
Вирусология:
Популярные разделы сайта:
Механизмы повреждения клеток вирусами. Гибель клеток от вирусов
Прежде чем рассмотреть вирусный патогенез на уровне целого организма, мы кратко суммируем то, что известно о цитопатическом действии вирусов на клеточном уровне.
Существует значительное разнообразие типов взаимодействия между вирусом и клеткой, причем исход взаимодействия в каждом частном случае определяется главным образом генетическими характеристиками вируса и клетки. Эти взаимодействия можно разбить на три основных типа: а) разрушение клеток, вызываемое цитовидными вирусами, б) персистентная инфекция, вызываемая некоторыми вирусами, не убивающими клеток, в) трансформация, вызываемая онкогенными вирусами.
Взаимодействие клеток с цитоцидными вирусами характеризуется летальными повреждениями клетки, которые вызываются воздействием продуктов вирусного генома на клетку или на ее регуляторные механизмы. Несмотря на то что наши знания в области молекулярной биологии размножения вирусов существенно расширились в течение последнего десятилетия, мы все еще далеки от ясного понимания того, каким образом вирусы убивают клетки, или — на другом уровне — каким образом они вызывают заболевание.
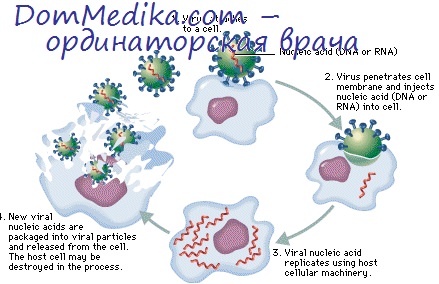
В клетках, зараженных цитоцидным вирусом, происходят резкие биохимические сдвиги. Быстро образующиеся вирусспецифические белки во многих случаях вызывают подавление синтеза клеточных белков и РНК хозяина, что само по себе несовместимо с выживанием клетки. Далее, на поздних стадиях инфекционного цикла в клетке накапливается большое количество вирусных макромолекул; часть из них, в особенности некоторые капсидные белки, могут быть токсичны.
Вирусные белки или вирионы как таковые образуют большие кристаллические (кристаллоподобные) агрегаты или включения, вызывающие отчетливо видимую деформацию клетки. Инфицированные клетки обычно сильно набухают; при этом, естественно, должна изменяться и проницаемость мембран. В результате этого лизосомные ферменты клетки могут выходить в цитоплазму и вызывать аутолитическое переваривание клетки.
Большая часть литературы по этому вопросу посвящена попыткам выяснить, какое событие отвечает непосредственно за видимые цитопатические повреждения. Эти исследования показали, что повреждения клеток могут иметь место и в тех случаях, когда выражение вирусного генома ограничено. Например, вирус может быть инактивирован (скажем, УФ-облучением), или представлять собой условно-летальный мутант, или его размножение может быть подавлено химическими ингибиторами.
В заражённых вирусом клетках возможны патологические проявления разностороннего характера.
Морфология патологических эффектов. Зараженные вирусом клетки. Основные реакции зараженных вирусом клеток.
Характерные проявления взаимодействий между вирусом и чувствительными клетками-видимые поражения заражённых клеток вплоть до их гибели, а также присутствие возбудителей в исследуемом материале.
Альтерация и воспаление зараженных вирусом тканей. При вирусных инфекциях на первый план выступает картина повреждения клеток и воспалительных изменений тканей, при различных инфекциях их соотношение и выраженность варьируют. В противоположность бактериальным инфекциям (где доминируют полиморфноядерные лейкоциты), при вирусных поражениях среди клеточных элементов воспалительных реакций доминируют мононуклеары (лимфо- и моноциты). На этапах, предшествующих разрушению клеток, можно визуально наблюдать их дегенеративные и некротические изменения.
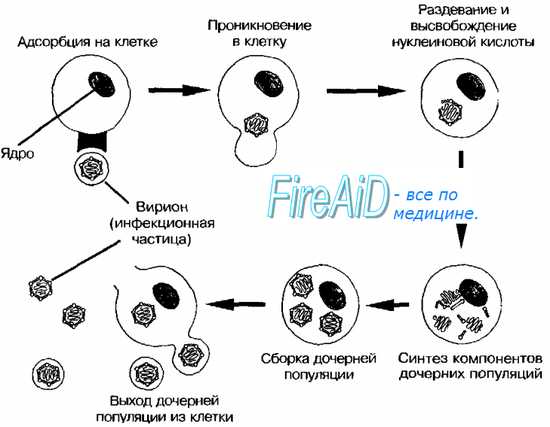
Тельца включений зараженных вирусом клеток. Микроскопия заражённых клеток часто позволяет выявить тельца включений — характерный, но не абсолютный признак вирусных поражений. Тельца значительно крупнее, чем отдельные вирионы, и часто окрашиваются кислыми красителями (например, эозином).
• При заражении клеток ДНК-содержащими вирусами тельца включений располагаются в ядре; исключение — тельца включений поксвирусов (тельца Гварнери).
• При заражении клеток РНК-содержашими вирусами тельца включений располагаются в цитоплазме (например, тельца Бабеша-Нёгри, выявляемые в цитоплазме клеток головного мозга при бешенстве).
Причины гибели зараженных вирусом клеток. Размножаясь в клетке, вирусы индуцируют синтез вирусспецифических белков, в той или иной степени подавляющих метаболизм клетки. Нарушение синтеза макромолекул вызвано нарушением трансляции клеточной мРНК. Среди РНК-геномных вирусов наиболее быстрое и глубокое подавление макромолекулярных синтезов в клетке вызывают пикорнавирусы, среди ДНК-геномных — покс- и герпесвирусы. Действие указанных вирусов реализуется на ранних этапах (до появления морфологических признаков цитопатического эффекта). Ингибирование синтеза РНК и ДНК обычно вторично по отношению к воздействию на белки, контролирующие экспрессию генов и пролиферацию клетки. Значительно реже нарушения вызывают вирусные белки, напрямую ингибирующие синтез нуклеиновых кислот. Среди РНК-геномных вирусов наиболее быстрое и глубокое подавление синтезов нуклеиновых кислот вызывают пикорнавирусы, среди ДНК-геномных — покс- и герпесвирусы.
Во время репродукции вируса в клетке накапливаются вирусные компоненты, оказывающие токсическое и повреждающее действие на клеточные структуры. Например, цитотоксические свойства проявляют капсомеры некоторых аденовирусов, гликопротеины парамиксовирусов. В процессе вирусной инфекции также происходит повреждение мембран лизосом, содержимое которых высвобождается и осуществляет аутолиз клетки. Таким образом, гибель клеток наступает в результате сочетания раннего подавления синтеза клеточных компонентов, накопления токсических вирусных продуктов и повреждения лизосом.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Разрушение эффекторных клеток иммунитета и макрофагов вирусами. Устранение действия цитокинов вирусами.
Многие вирусы размножаются продуктивно или абортивно в клетках лимфоидной или ретикуло—эндотелиальнои системы, которые, тем самым, участвуют в создании персистентной инфекции. Лимфоциты и макрофаги являются искушающими мишенями для любых вирусов, они разносят вирусы по организму, а также играют ключевую роль в иммунном ответе. Исключительным примером разрушения иммунной системы является вирус иммунодефицита человека, размножающийся в СД4 Т-лимфоцитах и клетках моноцит-макрофагального ряда и вызывающий глубокую иммунную депрессию и гибель от вторичных инфекций или от неоплазий.
Геном цирковируса анемии цыплят кодирует небольшой белок (13 кД), получивший название апотин, который сам по себе вызывает гибель Т-лимфоцитов и рассматривается как важный фактор патогенеза при данной инфекции у цыплят.
Подавление МНС-регуляции антигенной экспрессии
Т-клетки СД8 и СД4 различают вирусные пептиды во взаимодействии соответственно с МНС I, МНС II, а в присутствии вируса концентрация молекул МНС на клеточной поверхности уменьшается. Аденовирусы кодируют ранний протеин, который связывается с вновь синтезированным антигеном МНС I, препятствуя его нормальному процессингу и, тем самым, уменьшает его экспрессию на поверхности клеток.
Бетагерпесвирусы в дополнение к снижению регулирующей экспрессии МНС I исключают лизис хозяинных клеток Тц-лимфоцитами, синтез молекулподобных МНС I, которые действуют как ловушки, защищая от лизиса NK-клетки, которые сами лизируют клетки, не экспонирующие нормальные комплексы с МНС I.

Устранение действия цитокинов
Интерфероны играют важную роль как антивирусные агенты и как иммуномодуляторы. Однако некоторые вирусы содержат гены, которые блокируют антивирусное действие эффекторных молекул.
Избегание нейтрализации антителами (маскирование эпитопов и иммунные ловушки)
Все еще непонятно, каким образом филовирусы, аренавирусы и асфаровиру-сы устойчивы к нейтрализации сывороткой инфицированных людей и животных. Одной из особенностей вируса Эбола является использование иммунных ловушек для избежания нейтрализации; вирус образует 2 гликопротеина, один из которых формирует пепломеры на поверхности вириона, другой, а может быть, тот же самый, производится в большом количестве и секретируется из клеток. Этот белок, вероятно, связывает антитела и тем самым защищает вирус.
Индукция не нейтрализующих антител
Для многих персистентных инфекций характерно присутствие вирус-специфических антител в низком титре при высоком титре антител против не нейтрализуемых эпитопов вируса. В последнем случае комплекс вирус-антитела и вирусный антиген могут накапливаться на базальных мембранах почечных клубочков или в других местах, вызывая различную иммунную патологию или неопластические заболевания.
Например, при многих ретровирусных инфекциях, в том числе при Алеутской болезни норок, не нейтрализующие антитела часто, соединяясь с вирионами, блокируют присоединение нейтрализующих антител. Поэтому при создании новых вакцин против инфекционного перитонита кошек, PC- болезни, вирусной диареи КРС, инфекционной анемии лошадей, артрита-энцефалита коз и др. необходимо учитывать экспрессию естественных недоминантных нейтрализующих эпитопов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:

