Гибрид вируса и бактерии
Обновлено: 19.04.2024
Вирус гепатита С – один из наиболее опасных вирусов человека, передающихся через кровь: по данным ВОЗ число носителей этой хронической инфекции в мире составляет не менее 170 млн человек! Поэтому производство лечебных препаратов из плазмы крови требует разработки специальных подходов, обеспечивающих надежный уровень вирусной безопасности. Одним из главных методических затруднений на этом пути служит отсутствие удобной биологической модельной системы, позволяющей количественно оценивать жизнеспособные вирусные частицы.
Вирус гепатита С является потенциальным биологическим контаминантом (загрязняющим агентом) продуктов крови, в том числе препаратов иммуноглобулинов, использующихся для лечения и профилактики опасных вирусных болезней. Одной из главных причин, затрудняющих поиск эффективных вирусинактивирующих реагентов против этого вируса при производстве лечебных средств, является отсутствие удобной модельной биосистемы для размножения возбудителя, которая позволяла бы количественно регистрировать жизнеспособные полноценные вирусные частицы.
Вирусная модель
Известно, что в качестве моделей опасных для человека вирусов в некоторых случаях используют родственные им вирусы животных. Ближайшим родственником возбудителя гепатита С является вирус диареи крупного рогатого скота (ВД КРС). Оба этих вируса относятся к одному семейству Flaviviridae и имеют очень близкое молекулярно-генетическое родство (Buckwold, 2003).
Вирус диареи крупного рогатого скота – представитель семейства Flaviviridae рода Pestivirus; ближайшй родственник вируса гепатита С. В качестве наследственного материала содержит РНК. Вирионы имеют размер 30–50 нм. Характеризуется тропизмом преимущественно к лимфоидной ткани
Вирус диареи крупного рогатого скота причиняет значительный ущерб животноводству. Он является мощным иммуносупрессором, на фоне которого активизируются другие инфекционные агенты; кроме того, вирус отрицательно влияет на репродуктивную систему коров, приводя к абортам, врожденным уродствам плода и гибели новорожденных телят. Искоренение ¬болезни требует огромных экономических вложений.
Но значимость этого инфекционного агента не исчерпывается ветеринарией. Как известно, для культивирования различных вирусов в медицинских целях используют клетки человека и животных, которые выращивают в питательной среде с добавлением в качестве основного ростового компонента эмбриональной сыворотки крови крупного рогатого скота. И эта сыворотка почти в 90—100 % случаев контаминирована нецитопатогенным (т. е. не убивающим клетки) вирусом диареи (Vilcek, 2001). Таким образом, этот вирус, как и вирус гепатита С, может загрязнять биологическую продукцию, выпускаемую для нужд медицины и ветеринарии.
Использование вируса крупного рогатого скота в качестве модели вируса гепатита С при отработке технологии инактивации вирусов в препаратах иммуноглобулинов имеет ряд преимуществ. К ним относятся наличие у него цитопатогенных штаммов, способность размножаться в культурах клеток в высоких концентрациях, экономичность подобных экспериментов, а также возможность проведения экспериментальных исследований на животных.
В результате был определен оптимальный режим инактивации, обеспечивающий необходимое снижение активных инфекционных частиц вируса в двух временных контрольных точках процесса (через 1 ч и через 5 сут.). Оказалось, что для инактивации вируса оптимальным является время инкубации, равное 1—2 сут. Данный режим обеспечил высокую воспроизводимость результатов в опытах с тремя сериями иммуноглобулинов.
Исследователи надеются, что дальнейшее изучение эффективности метода инактивации вирусов при низких значениях pH (в кислой среде) позволит решить одну из актуальных задач производства медицинских и ветеринарных препаратов, связанных с биобезопасностью продукции.
Методы по очистке биопрепаратов от загрязнения вирусом диареи крупного рогатого скота важны не только сами по себе: их можно рассматривать в качестве перспективного подхода для деконтаминации лекарственных препаратов от вируса гепатита С, представляющего непосредственную угрозу для здоровья и жизни человека.
К этому можно добавить, что на сегодняшний день нет исчерпывающей информации о безопасности действия самого вируса диареи крупного рогатого скота на организм человека. Учитывая же тот факт, что этот вирус подвержен сильной мутационной изменчивости, можно предположить, что он также может в принципе оказаться способным преодолевать межвидовые барьеры и заражать человека (Giangaspero, 1997).
Buckwold V.E., Beer B.E., Donis R.O. Bovine viral diarrhea virus as a surrogate model of hepatitis C virus for the evaluation of antiviral agents // Antiviral Res. 2003. V. 60. No. 1. P. 1—15.
Vilcek S. Identification of pestiviruses contaminating cell lines and fetal calf sera // Acta Virol. 2001. V. 45. No. 2. P. 81—86.

Обзор
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.

Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Современное биооружие гораздо серьезнее, чем кажется на первый взгляд. Внешне безвредные организмы и растения могут нести серьезную опасность и вызывать глобальные эпидемии, остановить которые сможет только высокоразвитое и подготовленное государство.
За последние десятилетия биология и медицина совершили огромный рывок вперед. Вмешательство в гены человека и создание химер, гибридов совершенно разных организмов сегодня уже не фантастика. К сожалению, эти достижения можно использовать не только в мирных целях. Биотехнологии могут стать оружием, намного более опасным, чем ядерное, и покончить с человечеством несколькими разными способами.
Так получилось, что экосистемы в различных районах нашей планеты приходили в равновесие тысячи лет. Сотни видов животных, насекомых, растений и т.д. приспособились друг к другу и поддерживают жизнеспособность окружающей среды.
В ноябре 2011 года Министерство сельского хозяйства США объявило об опасности биотерроризма с использованием инвазивных видов. Противник может распространить чужеродные для определенной экосистемы организмы и тем самым нанести значительный экономический ущерб и вред людям. В качестве примера может служить барбарис. Это неприхотливое растение может расти в широтах от Крыма до Санкт-Петербурга. Само по себе оно безвредно и выращивается садоводами. Однако оно может быть промежуточным носителем опасной грибковой болезни - стеблевой ржавчины. Эта болезнь зерновых встречается редко, но приводит к огромным потерям сельскохозяйственной продукции – от 50% до 100%.
Нетрудно догадаться, что зараженный ржавчиной барбарис способен нанести государству больший ущерб, чем санкции и авиабомбы. При соответствующих генных модификациях грибка стеблевой ржавчины семена барбариса могут лишить небольшую бедную страну урожая зерновых и спровоцировать социальный взрыв.

Барбарис – всего лишь один из примеров инвазивных видов, способных лишить страну продовольствия
Один из самых опасных иназивных видов - это бактерии. Важнейшим продуктом сельского хозяйства является мясо, а значит, животные – первая мишень для экономического удара. С помощью переноса определенных фрагментов ДНК, взятых у устойчивых к антибиотикам бактерий, можно, например, превратить бактерию R. Rurninantium в биологическое оружие. Бактерия R. Rurninantium вызывает острое заболевание у животных и в отдельных случаях у людей. Распространенная через клещей генно-модифицированная бактерия может вызвать массовую гибель свиней и коров, а главное – панику среди населения.
Кроме естественных инвазивных видов сегодня существует возможность разработки химер – гибридных организмов, имеющих ДНК двух и более разных существ.
Гибридные бактерии - первый шаг на пути создания сложнейших химер
Здесь дело только за фантазией. Можно представить паразитов, передающих смертельные вирусы человеку, насекомых, саранчу, съедающую основу экономики отсталой страны, например, финики и т.п. Надо понимать, что внимание ученых сегодня сосредоточено в основном на создании гибридов человеческих генов и генов лабораторных животных – для медицинских целей. Впервые о химерах с человеческими генами громко заговорили в 2008 году, когда британские ученые попросили разрешения создать эмбрион-гибрид свиньи и человека, причем генов последнего было 99%. Обычно подобная работа с животными, насекомыми или растениями не афишируется и общественностью не обсуждается, но в научной медицине уже около 10 лет технология гибридизации существует и успешно применяется.
Информацией о новом типе вируса H5N1 обладают около 100 лабораторий и тысячи ученых по всему миру, так что при желании они могут изготовить свой собственный смертоносный штамм, который способен погрузить в хаос многие страны и дестабилизировать мировую экономику.
Вирус H5N1 имеет все необходимые инструменты для убийства человека. Прежде всего он поражает легочную ткань, в результате чего снижается уровень кислорода в крови, и человек постепенно умирает. Но даже если внешние симптомы инфицирования удалось победить, коварный вирус продолжает жить в мозге и уничтожать дофаминовые нейроны, вызывая симптомы болезни Паркинсона.
Таким образом, есть возможность нацелить вирусное оружие на определенные этнические группы. Также существуют технологии создания гибридных вирусов. Так, в марте 2011 года китайские ученые создали более 127 штаммов-гибридов вирусов H1N1 и H5N1 (свиной и птичий грипп), некоторые из них были патогенными.
Начинка вируса птичьего гриппа очень привлекательна с точки зрения создания разрушительного биооружия
В декабре 2012 года ученые из Университета Северной Каролины (США) разработали технологию разборки вирусов на фрагменты и последующей сборки нового вируса с заданными возможностями. Они планируют таким образом использовать вирусы для генной терапии – замены поврежденных участков ДНК исправными.
За основу будущего вируса можно взять различные типы вирусов. Возьмем, к примеру, адено-связанный вирус (AAV). Это небольшой непатогенный вирус, который живет в организмах большинства людей. Из различных форм вируса AAV выделяются определенные факторы, например, способность AAV1 проникать в мышцы или AAV8 - в клетки печени. Затем можно воспользоваться уже проверенной технологией, разработанной командой американских и британских ученых, которые научились программировать адено-связанный вирус на встраивание гена, продуцирующего выработку белка (фактора IX). Этот белок отвечает за свертываемость крови, и если вызвать гиперпродукцию фактора IX в определенной части тела, то там начнут образовываться микротромбы, делающие человека инвалидом или приводящие к смерти.

Несчастное насекомое не подозревает, что любимое лакомство, сладкая кукуруза, изменит его гены и приговорит к смерти
Свертываемость – это лишь один из сотен механизмов, влияющих на жизнедеятельность организма. Скорее всего, врачи даже не поймут, что произошло с человеком, особенно если собранный специалистами вирус будет имитировать симптомы распространенной болезни.
Современные биологическая война и терроризм могут быть совсем не похожи на представления большинства неспециалистов. Наука открывает все больше возможностей для скрытого, тонкого воздействия на организм человека. Трудно организовать распыление вируса или патогенной бактерии над всеми крупными городами страны, но есть и другие технологии, пока находящиеся на острие прогресса. Например, в начале этого года китайские ученые из Нанкинского университета обнаружили, казалось бы, невероятный факт: частички микро-РНК пищи могут ограниченно воздействовать на наши гены, влияя на работу печени и других органов пищеварения. По-видимому, этот природный механизм должен помогать нам лучше усваивать пищу.
Например, в 2007 году компании Monsanto и Devgen научились с помощью искусственных микро-РНК, внедренных в растения, убивать насекомых вредителей. Несчастное насекомое под названием блошка длинноусая ест генетически модифицированную кукурузу. В организм вредителя попадает молекула микро-РНК, которая блокирует ген, ответственный за выработку энергии в организме блошки. В результате максимум через 12 дней вредитель гарантированно гибнет, поскольку безопасная для всех остальных живых существ пища стала для блошки смертельно ядовитой. Растительную микро-РНК можно настроить на убийство или изменение биологических процессов любого насекомого. Теперь, как выяснилось, это возможно и в отношении человека.
Современные биотехнологии имеют огромный разрушительный потенциал. Страшно представить, как целые государства или даже регионы планеты гибнут в эпидемиях, как миллионы граждан неотвратимо к 30-40 годам заболевают болезнью Альцгеймера или неожиданно теряют зрение, слух. Сценариев можно придумать бесчисленное множество. К сожалению, защититься от таких разрушительных атак смогут только страны, обладающие высоким научным потенциалом в области биотехнологий и особенно генной инженерии. Сегодня таких государств совсем немного…

Два новых исследования предоставляют доказательства и раскрывают механизмы этих взаимодействий, что дает новое понимание микробиологического патогенеза для разработки вакцин.
С появлением современных методов в области молекулярной микробиологии становится очевидно, что легкие не являются стерильными даже при отсутствии заболеваний. Существуют доказательства взаимодействия и коэволюции бактериальных сообществ и иммунной системы позвоночных на протяжении всей истории. Последние данные также свидетельствуют о сходном взаимодействии этих колонизирующих микроорганизмов и эволюции по отношению к патогенезу вирусов.
Это особенно актуально в случае взаимодействия между вирусом гриппа и бактерией Streptococcus pneumoniae, так как коинфекция этими двумя микроорганизмами приводит к более резкому прогрессированию заболевания и увеличению смертности, чем заражение только одним из этих патогеном.
Два новых исследования, опубликованных в Nature Microbiology, предоставляют доказательства взаимодействия между Streptococcus pneumoniae и вирусом гриппа. Это важно не только для понимания патогенеза, но и для разработки эффективных вакцин против таких инфекций.
Rowe и соавторы предоставляют косвенные доказательства физического взаимодействия между Streptococcus pneumoniae и вирусом гриппа путем их совместной седиментации и прямые доказательства связывания вируса с бактериями, используя штамм гриппа, экспрессирующий флуоресцентный белок mRuby2.
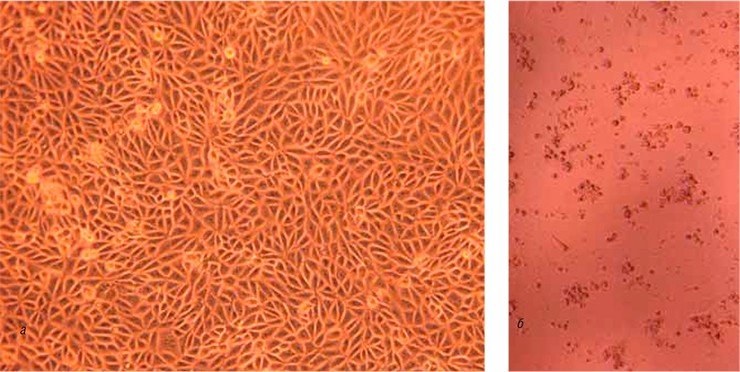
Чтобы изучить влияние прямого связывания вируса и бактерии на респираторную инфекцию, ученые продемонстрировали повышенную адгезию вирусно-бактериального комплекса к культивируемым in vitro линиям эпителиальных клеток человека и мышей, которым интраназально инокулировали только Streptococcus pneumoniae или Streptococcus pneumoniae, прединкубированных с вирусом гриппа (рис. 1, левая панель).
.
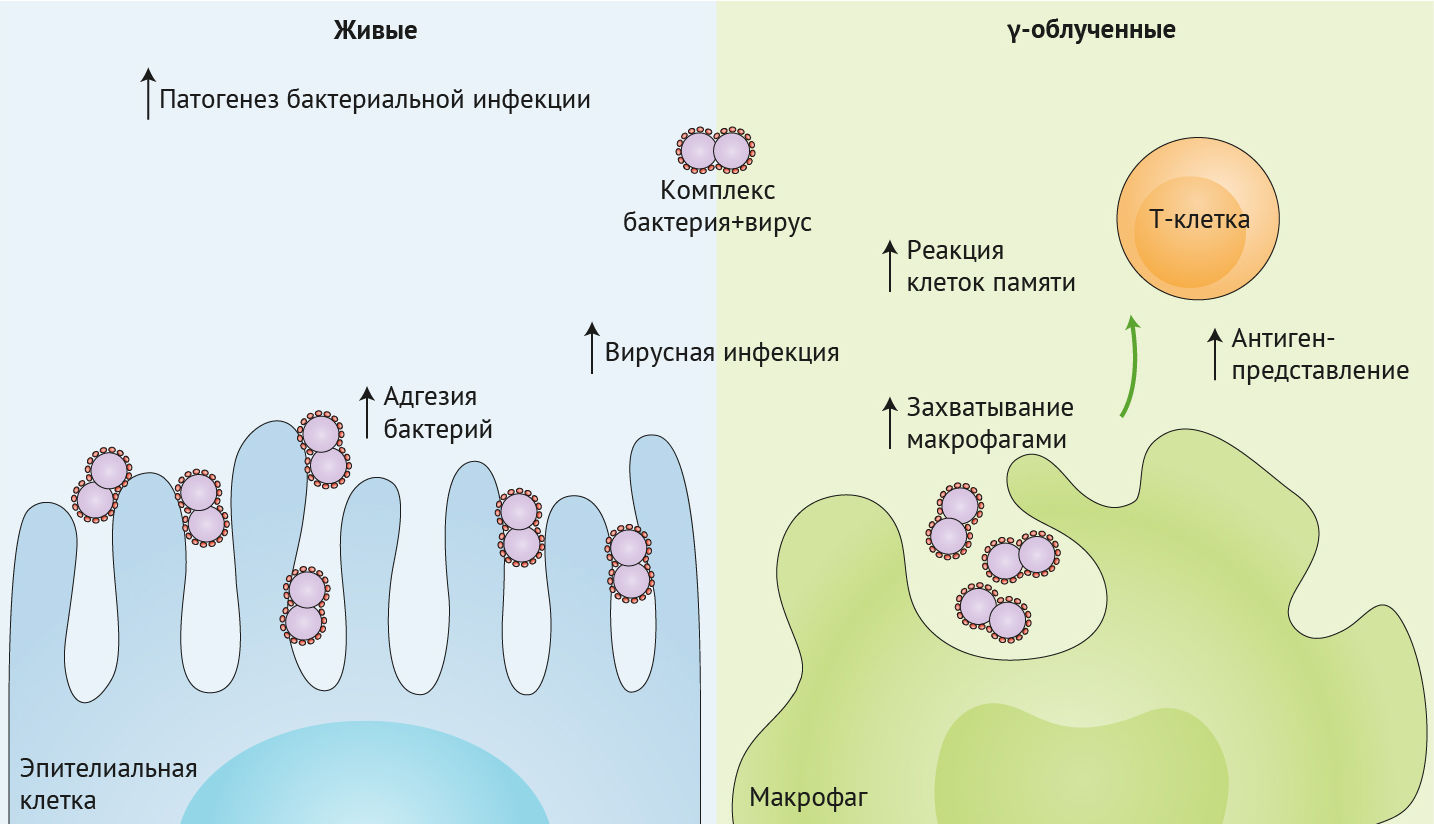
Вирус гриппа напрямую связывается с поверхностью бактерии, что приводит к увеличению адгезии бактерий к дыхательному эпителию, прогрессированию патологического процесса и смертности в мышиной модели. Это связывание вируса с бактерией независимо от жизнеспособности бактерий и использование γ-облученного Streptococcus pneumoniae также приводило к увеличению вирусной инфекции клеток MDCK (левая панель).
Когда и Streptococcus pneumoniae, и вирус гриппа были облучены γ-лучами, непосредственное связывание между этими двумя патогенами все еще было очевидно, что привело к увеличению поглощения макрофагами. Мукозальная вакцинация мышиной модели этим γ-облученным комплексом патогенов способствовала усилению резидентной памяти и действия Т-клеток легких на вирус гриппа, что, возможно, произошло в результате увеличения антиген-презентации макрофагами (правая панель).
Всего через 24 часа отмечен рост Streptococcus pneumoniae в носовых ходах и среднем ухе у мышиных моделей, которым предварительно инокулировали комплекс, включающий Streptococcus pneumoniae и вирус гриппа. В данном случае рост был более интенсивным, чем при инокулировании двух патогенов без предварительной инкубации. Вследствие этого повышенного связывания комплексных патогенов скорость развития инфекции и смертность значительно увеличились.
Интересно, что увеличение смертности не было связано с повышенной бактериемией. Это позволяет предположить, что прогрессирование заболевания может быть результатом цитокиновой бури в дыхательных путях. Но остается вопрос, как бактериально-вирусное взаимодействие приносит пользу вирусу.
David и его коллеги из Австралии решили изучить этот вопрос. Они представляют электронные микрофотографии для подтверждения факта прямого связывания гриппа с гамма-облученным штаммом Streptococcus pneumoniae и демонстрируют, что этот комплекс повышает способность гриппа инфицировать клетки Мадин-Дарби почек собак (MDCK) (рис. 1, левая панель). Ученые не выяснили, было ли это прогрессирование вирусной инфекции вызвано повышенной адгезией бактериально-вирусного комплекса к клеткам MDCK, но продемонстрировали, что комплекс способствует лучшему захвату и интернализации вируса гриппа макрофагами THP-1 (рис. 1, правая панель).
Есть предположение, что взаимодействие вируса гриппа и Streptococcus pneumoniae способствует заражению организма-хозяина обоими организмами, но можно ли использовать это взаимодействие для усиления иммуногенности к этим патогенам? Группа австралийских ученых ранее продемонстрировала, что совместная мукозальная вакцинация с помощью γ-облученного гриппа A/Puerto Rico/8/1934 (PR8) H1N1 (γ-Flu) и γ-Spn обеспечивает значительную защиту от летальной коинфекции и увеличение специфической реакции на Streptococcus pneumoniae. Данная статья посвящена исследованию специфического иммунитета против гриппа, возникающего в результате интраназальной инокуляции γ-Flu-γ-Spn.
Через три недели после вакцинации γ-Flu-γ-Spn David и соавторы провели эксперимент с заражением мышей смертельной дозой вируса гриппа штамма PR8. Неудивительно, что мыши, вакцинированные одним γ-Flu или γ-Flu-γ-Spn, были полностью защищены в течение трех недель после заражения, тогда как мыши, которые были вакцинированы только одним γ-Spn, умерли в течение первой недели. Мыши, вакцинированные только одним γ-гриппом или γ-гриппом-γ-Spn, также были защищены от последствий смертельного заражения недавним пандемическим штаммом H1N1 2009 года.
Важно отметить, что только мыши, вакцинированные γ-Flu-γ-Spn, были полностью защищены от заражения гетероподтипом H3N2, в то время, как среди мышей, вакцинированных одним γ-Flu, смертность составляла 40 %. Авторы исследования продемонстрировали, что эта совместная вакцинация не была связана с различием реакции нейтрализующих антител и циркулирующих Т-клеток. В отличие от этого, вакцинация γ-Flu-γ-Spn значительно усиливала резидентную память CD4+ и CD8+ T-клеток в легких, которые необходимы для противостояния инфекции гриппа (рис. 1, правая панель).
Такие взаимодействия не ограничиваются Streptococcus pneumoniae. Rowe и соавторы также предоставляют доказательства прямого взаимодействия вируса гриппа с другими респираторными микроорганизмами, такими как нетипируемые Haemophilus influenzae (NTHi) и Moraxella catarrhalis. Эти данные могут объяснить тот факт, что пациенты с хронической обструктивной болезнью легких, которые колонизированы NTHi, в три раза чаще испытывают обострение своего заболевания после вирусной инфекции, чем пациенты без NTHi.
В обоих исследованиях есть недостатки. Большинство наблюдений основаны на экспериментах in vitro или на моделях летальных животных, а не на моделях, которые воспроизводят человеческие заболевания. Над отчетом David и соавторов потребуется провести дополнительную работу — продемонстрировать продолжительность защиты, прежде чем транслировать в массы эти наблюдения.
Обе статьи также посвящены взаимодействию между бактериями и вирусом гриппа А, без упоминания о штаммах гриппа В, хотя штаммы В являются распространенной причиной гриппа. Но эффективность применения комбинированной вакцины впечатляющая, эти результаты можно использовать для разработки вакцины против респираторно-синцитиального вируса, который, как уже известно, непосредственно связывается с Streptococcus pneumoniae. Если перекрестная защита от гетеросубтипических штаммов подействует на риновирус, то, возможно, есть надежда создать вакцину от простуды.
Разработка вакцин — важная задача будущего, но пока наблюдения ученых должны заставить нас обратить внимание на респираторные инфекции. Несмотря на то, что заражение одним патогеном все еще может быть уместными во многих случаях, учитывая наличие микробиоты в легких, модели сочетанной инфекции, а не последовательной инфекции, ближе к реальной картине.
Читайте также:

