Гигантские многоядерные клетки при герпесе
Обновлено: 23.04.2024
ЭТИОЛОГИЯ.
Впервые ВПГ выделил Гротер (W.Gruter) в 1912 году. Это ДНК-содержащий вирус, вирион которого состоит из центрально расположенного плотного нуклеотида, белковой капсулы - капсида и наружной оболочки. Наружняя оболочка неправильной формы содержит белки, углеводы, липиды и другие вещества, а в антигенном отношении проявляет сродство с антигенами клетки хозяина. На своей оболочке ВПГ имеет антирецепторы, благодаря чему он присоединяется к тканям экто- и эндодермального происхождения (пан-тропизм). То есть он может поражать кожу, слизистые, центральную и периферическую нервную систему, печень, эндотелий сосудов, клетки крови (Т-лимфоциты, эритроциты, тромбоциты). < ВПГ >, как ДНК-содержащий < вирус >, может интегрировать генетический аппарат клетки хозяина и вызывать злокачественную трансформацию клеток (< ВПГ >-2 и рак шейки матки). При этом не обязательно постоянное присутствие вируса в клетке. Геном < ВПГ >может интегрировать с генами некоторых других < вирусов >, вызывая их активацию. С другой стороны развитие ряда < вирусных >и бактериальных инфекций сопровождается активацией латентного < герпеса >.
ВПГ термолабилен, при нагревании до 50-52 °С он инактивируется через 30 минут. Вирус погибает под воздействием ультрафиолетовых и рентгеновских лучей. ВПГ чувствителен к действию этилового спирта, протеолитических ферментов, фосфатазы, желчи и других органических растворителей. Низкие температуры вирус переносит хорошо и при температуре от -20 °С до -70 °С сохраняется в жизнеспособном состоянии годами или десятилетиями. Устойчив он также к повторному замораживанию и оттаиванию, действию ультразвука и годами может сохраняться в высушенном состоянии.
ЭПИДЕМИОЛОГИЯ.
Источниками инфекции при заболеваниях вызываемых ВПГ являются больные с различными формами болезни, в том числе и латентной, а также вирусо-носители. Вирус передается главным образом контактным путем (прямой контакт), возможна передача возбудителя также контактно-бытовым, воздушно-капельным и вертикальным путями (от матери к плоду). Последнее может осуществляться во время родов (контакт с родовыми путями матери), трансплацентарно или же вирус проникает в полость матки через цервикальный канал (восходящий путь). В связи с тем, что при генерализации процесса имеет место вирусемия возможен трансфузионный и парентеральный пути передачи.
Восприимчивость всеобщая, антитела к ВПГ выявляются у 80-90% взрослых. Наибольшее количество заболеваний регистрируется в холодные месяцы, но эпидемии не бывает, хотя могут наблюдаться небольшие вспышки в дошкольных учреждениях, школах, больницах.
ПАТОГЕНЕЗ.
Независимо от того, каким путем < ВПГ >попадает в организм, начальное размножение < вируса >происходит у входных ворот, далее он проникает в региональные лимфоузлы, затем в кровь и гематогенно заносится во внутренние органы, мозг. В центральную нервную систему он может проникать и по нервным стволам. Первичное заражение, как правило, происходит в раннем детстве и протекает первичный герпес у 80% больных бессимптомно. Уже через несколько дней после заражения в сыворотке крови появляются антитела (у 85% детей до 3 лет они уже имеются). Попав в организм, ВПГ сохраняется в нем в течение всей жизни, находясь в неактивном (латентном) состоянии. Вирусоносительство встречается более чем у 90% людей и является одной из особенностей герпеса. Причем вирус может обнаруживаться только после его реактивации в результате ослабления иммунитета под влиянием разнообразных факторов, поскольку вирус находится в клетках паравертебральных сенсорных ганглиев в непродуктивном состоянии. Дефекты иммунной системы приводят к рецидиву болезни.
Но существует и другая точка зрения, согласно которой репродукция и выделение из ганглия ВПГ происходит постоянно, но в небольшом количестве. Мигрируя центробежно, он из ганглия по аксону периферического нерва достигает эпителиальных клеток, но механизмы защиты устраняют микроочаги инфекции, то есть предупреждают клинические проявления. Определенную роль играют и защитные свойства кожи.
КЛИНИКА.
Заболевания вызываемые ВПГ подразделяют на первичную и вторичную (рецидивирующую) герпетическую инфекцию. По клиническим проявлениям выделяют 4 формы: латентную, локализованную, генерализованную и смешанную.
Первичная герпетическая инфекция возникает при первом контакте человека с ВПГ. Как правило это происходит в раннем детском возрасте (до 5-ти лет).
После короткого (от 2-х до 14-ти дней) инкубационного периода в крови начинают определяться тела к ВПГ и у 80-90% первично инфицированных болезнь протекает в латентной форме. У 10-20% имеют место клинические проявления для которых характерен общеинфекционный синдром с лихорадкой и другими признаками интоксикации. Чаще всего это ОРЗ или афтозный стоматит. Первичный герпес может проявляться поражением кожи и слизистых, в том числе конъюнктивы или роговицы глаза. Особенно тяжело протекает первичная герпетическая инфекция у новорожденных и на фоне выраженного иммунодефицита. Здесь возможна генерализация процесса с поражением внутренних органов и/или головного мозга. Без этиотропной терапии обычно заканчивается смертью.
Вторичная (рецидивирующая) герпетическая инфекция встречается в любом возрасте после первичного герпеса. Так как рецидивы возникают при наличии противовирусных антител, то они протекают со слабовыраженным общеинфекционным синдромом и, как правило, на фоне болезней и/или состояний снижающих иммунитет: другие инфекционные и соматические болезни, переохлаждение, перегрев, ультрафиолетовое излучение, эндокринные изменения (например менструации), эмоциональный стресс и т.п.
Рецидивы простого герпеса могут возникать с различной частотой. Если они проявляются один раз в несколько лет (но не чаще 2-х раз в год), высыпания выражены в умеренной степени и фиксированы на одном и том же месте, то это является неплохим прогностическим признаком. Если же рецидивы возникают чаще (1 раз в квартал и чаще), то можно говорить о дефекте в иммунной системе и необходимости ее коррекции.
Клинические проявления первичного и вторичного герпеса имеют много общего и различаются в основном по количественным, а не по качественным признакам. При первичном герпесе более выражены симптомы общей интоксикации, тяжелее протекают местные поражения и чаще происходит генерализация процесса.
Локализованные формы простого герпеса (син. пузырьковый лишай - herpes simplex) дифференцируют прежде всего по локализации очагов поражения (кожа, слизистые, глаза и т.п.).
ПОРАЖЕНИЕ КОЖИ ПРИ ПРОСТОМ ГЕРПЕСЕ
Наиболее распространенная форма герпетической инфекции. Клиническая картина характеризуется появлением на коже после инкубационного периода (2-12 дней, чаще 3-4 дня) группы пузырьков диаметром 0,1-0,3 см на фоне ограниченного, слегка отечного розового пятна. Часто за 1-2 суток до высыпания больные чувствуют жжение и зуд кожи на месте будущей сыпи. Содержимое пузырьков вначале прозрачное, через несколько дней мутнеет. Расположены пузырьки тесно и нередко сливаются в многокамерный сплошной пузырь. В дальнейшем пузырьки вскрываются, образуя мелкие эрозии. Образующиеся корочки отпадают, эрозии эпителизируются и на 6-8 день заживают, не вызывая рубцовых изменений кожи. Иногда сроки заживления удлиняются до 3-4 недель и более. Высыпание пузырьков сопровождается ощущением зуда, жжения, общего недомогания, боли.
Пузырьковые высыпания имеют фиксированный характер и при первичной инфекции располагаются в месте внедрения вируса, а при вторичной - в зоне иннервации того или иного нерва. Обычная локализация - кожа лица: окружность рта, особенно красная кайма губ (herpes labialis), носа (herpes nasalis), реже кожа щек, век, ушных раковин.
Распространенные герпетические поражения кожи могут возникнуть при массивной инфекции, например у борцов, когда при тесном контакте вирус втирается в кожу. Обычная локализация сыпи в этом случае - руки, туловище, лицо. Нередко повышается температура (до 38 °С) и имеют место другие симптомы общей интоксикации. Элементы сыпи находятся в разных стадиях развития (везикулы, пустулы, корочки).
К редко встречающимся (атипичным) проявлениям поражений кожи при простом герпесе можно отнести:
1. Зостериформную разновидность простого герпеса. Она характеризуется расположением высыпаний по ходу нервных стволов чаще в области нижних конечностей, ягодиц и лица. От опоясывающего лишая эта форма простого герпеса отличается отсутствием болей, иррадиирующих по ходу нерва.
2. Геморрагическую форму с кровянистым содержанием пузырьков.
3. Геморрагически-некротическую, характеризующую образованием некрозов на месте высыпаний.
Язвенно-некротическая форма также относится к атипичным и возникает на фоне тяжелого иммунодефицита любого генеза. У больных на фоне типичных высыпаний образуются язвы, которые постепенно увеличиваясь, достигают 2-5 см в диаметре. Позже они сливаются в обширные язвенные поверхности с неровными краями. Такие поражения сохраняются в течение нескольких месяцев, а обратное развитие происходит медленно (если они сохраняются более 3-х месяцев, то их относят к СПИД-маркерным заболеваниям).
К атипичным формам простого герпеса также относят эритоматозную, папулезную, зудящуюся и отечную. При них везикулы не образуются, а в месте появления рецидива возникают соответственно гиперемия, мелкие папулы, резкая| отечность тканей в области поражения. Частые рецидивы этой формы в одном и том же месте могут быть причиной стойкого элефантиаза (элефантиазоподобный герпес).
ПОРАЖЕНИЕ СЛИЗИСТЫХ ОБОЛОЧЕК ПРИ ПРОСТОМ ГЕРПЕСЕ
Герпетический стоматит может быть проявлением как первичной, так и рецидивирующей герпетической инфекции. Наиболее часто эта форма встречается у детей 1-3 лет. Начинается болезнь остро с повышения температуры и общего недомогания. У детей отмечается плохой аппетит, беспокойство, нарушение сна. Через 1-2 дня на гиперемированных и отечных слизистых оболочках щек, языка, неба, десен, губ возникает множество пузырьков, которые через 2-3 дня лопаются, образуя очень болезненные эрозии, покрытые белым налетом в виде афт. Появляется интенсивное слюноотделение, болезненность и увеличение регионарных лимфатических узлов. Выздоровление наступает через 2-3 недели.
У 40% больных после выздоровления возможно развитие хронического рецидивирующего герпетического стоматита. Протекает он, как правило, без лихорадки и интоксикации.
Если имеет место поражение ВПГ слизистых оболочек верхних отделов дыхательных путей, то возникают острые респираторные заболевания, которые клинически не отличаются от ОРЗ другой этиологии. Их частота составляет 5-7% всех ОРЗ.
Генитальный герпес чаще всего протекает бессимптомно. ВПГ может персистировать у мужчин в мочеполовом тракте, а у женщин в канале шейки матки, влагалище и уретре. Лица с бессимптомным генитальным герпесом являются источниками и резервуарами инфекции.
Клинические проявления генитального герпеса наиболее ярко наблюдаются при первичном инфицировании. После инкубационного периода (около 7 дней) на половых органах возникает отек и гиперемия, затем появляются везикулезные высысыпания на головке и стволе полового члена, на внутренней поверхности крайней плоти, на коже мошонки; у женщин - на больших и малых половых губах, влагалище, промежности. Сыпь, как правило, обильная, пузырьки быстро лопаются, образуя эрозивные или эрозивно-язвенные поверхности. Практически всегда появлению высыпаний предшествует зуд, жжение и болезненность слизистых.
Генитальный герпес может сопровождаться лихорадкой, увеличением лимфатаческих узлов, невралгическими болями, возможно образование обширных эрозий и отека половых органов. При орогенитальных и анагенитальных контактах могут возникнуть герпетические тонзилиты, фарингиты, уретриты и проктиты.
50-75% людей после первичного инфицирования герпес принимает рецидивирующее течение. При рецидиве характер болезни будет определяться выраженностью иммунодефицита. При выраженном иммунодефиците рецидивы герпеса сопровождаются тяжелыми местными изменениями эрозивно-язвенного характера, распространением процесса на близлежащие участки кожи, регионарным паховым лимфаденитом. Иногда язвы сопровождаются некрозом и на их месте остаются рубцы.
В других случаях в период рецидива изменения отличаются от таковых при первичном герпесе отсутствием интоксикационного синдрома и менее обильными высыпаниями. У ряда больных могут иметь место абортивные рецидивы, проявляющиеся незначительной гиперемией, на фоне которой возникают мелкие, быстро вскрывающиеся пузырьки. Нередко все клинические проявления органичиваются только появлением чувства жжения и зуда, а также незначительным отеком и гиперемией кожи и слизистых половых органов.
Часто рецидивирующий генитальный герпес приводит к вовлечению в патологический процесс лимфатических сосудов. При этом у больных возможно развитие лимфостаза, как результат, - слоновость половых органов.
Генитальный герпес представляет собой важную медицинскую и социальную проблему. Рецидивирующий генитальный герпес нередко препятствует созданию семьи, частые рецидивы нарушают нормальную половую жизнь. Следствием длительно существующего генитального герпеса могут быть неврастенические и депрессивные нарушения. У женщин генитальный герпес даже при бессимптомном течении может стать причиной невынашивания беременности, заражения плода и новорожденного, что приводит к умственному недоразвитию, уродствам или летальному исходу. С возбудителем генитального герпеса связано возникновение рака шейки матки.
Офтальмогерпес может быть первичным и вторичным (рецидивирующим).
Первичный герпес развивается у людей, не имеющих противовирусного иммунитета (дети от 6 месяцев до 5 лет или взрослые в возрасте от 16 до 25 лет). Первичная инфекция у детей вызывается ВПГ-1, после 16 лет - ВПГ-2. Клинически довольно часто (до 40%) отмечается сочетание кератоконъюнктивита с поражением кожи век, лица.
Более 90% герпетических поражений глаз приходится на вторичный (рецидивирующий) офтальмогерпес. Так как рецидивы возникают на фоне циркулирующих противовирусных антител, то обычно не наблюдается распространения процесса. Чаще всего эта форма офтальмогерпеса встречается у мужчин в возрасте 20-40 лет.
Поверхностные поражения переднего отдела глаза характеризуются развитием конъюнктивита (фолликулярного, катарального, везикулезно-язвенного), сочетанного поражения конъюнктивы и век - блефаро-конъюнктивита, каналикулита, различных кератитов (точечный, везикулезный, древовидный, географический, краевой). Возможно развитие рецидивирующей эрозии роговицы, а также изолированное поражение склеры в виде диффузного (нередко двухстороннего) эписклерита. При герпетическом конъюнктивите слизистая век, глазного яблока, краев век гиперемирована. Характерны умеренные светобоязнь и слезотечение. Для везикулезного и древовидного кератита характерно развитие умеренно выраженных светобоязни, слезотечения, перикорнеальной инъекции, а затем невралгии (часто значительной) по ходу I и II ветвей тройничного нерва.
Глубокие поражения переднего отдела глаза характеризуются распространением инфильтрации в строму роговицы и протекают в виде стромального кератита (с изъязвлением и без). Большинство из них сочетаются с воспалением переднего отдела сосудистого тракта, то есть являются кератоиридо-циклитами.
Рецидивирующие герпетические поражения внутренних оболочек глаза проявляются в виде изолированного иридоциклита, хориоидита, периваскулита и флеботромбоза сетчатки, неврита зрительного нерва.
Висцеральные формы простого герпеса проявляются вовлечением в патологический процесс нервной системы, легких, печени и других внутренних органов.
Поражение центральной нервной системы протекает чаще всего в виде серозного менингита и острого энцефалита. По характеру клинических проявлений герпетические менингиты и энцефалиты трудно отличить от аналогичных заболеваний, вызываемых другими возбудителями. По данным литературы герпетическую природу имеют около 10% всех энцефалитов, 0,6% асептических менингитов и 20% менингоэнцефалитов.
Поражение периферической нервной системы протекает по типу невритов и полирадикулоневритов.
Герпетические пневмонии возникают в результате активации герпетической инфекции под влиянием различных имму-нодепрессантов. При этом практически всегда имеет место наслоение вторичной бактериальной инфекции.
Герпетический гепатит представляет собой одно из проявлений генерализованной инфекии. С возможностью изолированного поражения печени ВПГ у взрослых согласны не все ученые. Герпетический гепатит характеризуется острым началом, выраженной интоксикацией, коротким преджелтушным периодом, быстрым развитием желтухи и тяжелым течением с развитием острой печеночной энцефалопатии. Исход болезни, как правило, летальный.
Cohen PR, Paravar T, Lee RA. Epidermal multinucleated giant cells are not always a histopathologic clue to a herpes virus infection: multinucleated epithelial giant cells in the epidermis of lesional skin biopsies from patients with acantholytic dermatoses can histologically mimic a herpes virus infection.
Эпидермальные многоядерные гигантские клетки не всегда являются гистопатологическим ключом к герпесвирусной инфекции
Филип Р. Коэн, Таране Паравар, Роберт А. Ли, отдел дерматологии Калифорнийского университета в Сан-Диего, Сан-Диего, Калифорния
Клинический случай
Случай 1
У 24-летней европеоидной женщины появились болезненные язвы в полости рта, которые сохранялись после короткого курса пероральных кортикостероидов (несколько доз метилпреднизолона), который был прекращен через 5 дней.
Ее анамнез был отягощён по сахарному диабету 1 типа и генитальной инфекции, вызванной вирусом простого герпеса. Впоследствии у нее появились заполненные жидкостью пузыри в подмышечной впадине и паховой области, и она эмпирически лечилась пероральным валацикловиром по 1000 мг два раза в день без улучшения.
Осмотр выявил язвы на твердом небе, слизистой оболочке щек и слизистой оболочке десен и половых губ. Пустулы, пузырьки и буллы наблюдались в правой подмышечной впадине (рис. 1) и больших половых губах.
Была выполнена биопсия пораженной кожи из правой подмышечной впадины; также были получены образцы для культурального исследования, прямой иммунофлюоресценции антител и вирусных культур.
Микроскопическое исследование показало эпидермальный некроз и изъязвление с базофильными остатками; единичные бактерии в форме кокков были замечены в корке воспалительного очага.
Были отмечены очаговая ретикулярная дегенерация, внутриэпидермальные нейтрофильные пустулы, образующие супрабазилярное расщепление, и многочисленные многоядерные гигантские клетки кератиноцитов, демонстрирующие ядерную дегенерацию.
В верхней части дермы наблюдался периваскулярный инфильтрат, состоящий из нейтрофилов и эозинофилов (рис. 2).
Патология соответствовала герпетической инфекции. Пациентка была госпитализирована и лечилась от диссеминированной герпесвирусной инфекции внутривенным введением ацикловира в дозе 10 мг на килограмм каждые 8 часов.
В бактериальной культуре высеяли метициллинрезистентный золотистый стафилококк и добавляли в лечение внутривенный ванкомицин.
У нее продолжали развиваться похожие новые высыпания не только во рту, подмышечной впадине и паху, но также на руках и животе; кроме того, более ранние пустулы и пузырьки увеличились и/или вскрывались (рис. 3).
Исследования методом прямой иммунофлюоресценции и вирусных культур были отрицательными как для вируса простого герпеса, так и для вируса ветряной оспы. Повторные биопсии кожи выполнялись для методов рутинного окрашивания и прямой иммунофлуоресценции.
Микроскопическое исследование показало внутриэпидермальный пузырь, содержащий акантолитические кератиноциты, многочисленные эозинофилы и единичные нейтрофилы; соседствующий эпителий показал спонгиоз с эозинофилией. Периваскулярное воспаление, состоящее из эозинофилов и единичных лимфоцитов, присутствовало в верхней части дермы (рис. 4).
Прямая иммунофлуоресценция показала положительное межклеточное окрашивание в эпидермисе на IgG и C3. Впоследствии иммуноферментный анализ (ИФА) показал, что титры IgG в сыворотке крови были повышены как для десмоглеина 1, так и для десмоглеина 3.
Сопоставление клинических результатов, лабораторных исследований и повторных биопсий кожи позволило установить диагноз вульгарной пузырчатки.
Первоначальное лечение включало 60 мг перорального преднизолона в день. Она также получала внутривенно ритуксимаб, 2 дозы по 1000 мг каждая, разделенные на 2 недели, до того, как в течение следующих 6 месяцев она сократила свою ежедневную дозу преднизона. Высыпания на коже разрешились без рецидивов.
У здоровой 40-летней кавказской женщины наблюдалась рецидивирующая зудящая сыпь на груди и животе продолжительностью более одного года. Герпес-вирусную инфекцию в анамнезе отрицает.
Осмотр кожи выявил зудящие эритематозные и покрытые коркой папулы на груди и животе (рис. 5). Была проведена биопсия очага поражения. Эмпирическое местное лечение было начато с 0,1% мази триамцинолона.
Микроскопическое исследование показало супрабазальный эпидермальный акантолиз и образование полостей с нейтрофилами и эозинофилами как в интраэпидермальных пузырьках, так и в дерме.
В полости пузыря также наблюдались многоядерные гигантские клетки (рис. 6). Патологические изменения были интерпретированы как инфекция, вызванная вирусом герпеса.
Клиническое течение и улучшение при топической терапии кортикостероидами не коррелировали с наблюдаемыми патологическими изменениями. Прямая иммунофлуоресценция и исследование вирусных культур не показали заражения вирусом герпеса. Была проведена повторная биопсия кожи нового элемента сыпи в верхней части груди.
Повторная биопсия показала акантоз с очаговым акантолизом и дискератозом; вирусные цитопатические изменения отсутствовали. Лимфоцитарный воспалительный инфильтрат присутствовал в верхней части дермы (рис. 7).
Корреляция клинической картины, лабораторных исследований и патологических изменений позволила установить диагноз транзиторного акантолитического дискератоза (болезнь Гровера).
В эпидермисе можно наблюдать многоядерные гигантские клетки (табл. 1) 9. Происхождение гигантских клеток может быть эпителиальным или гистиоцитарным.
Гистиоцитарные эпидермальные многоядерные гигантские клетки выявляются при гигантоклеточном лихеноидном дерматите [7, 8] и блестящем лишае ладоней [9, 10].
Эпителиальные многоядерные гигантские клетки чаще всего ассоциируются с инфекциями, вызванными вирусом герпеса 1.
Однако они иногда встречаются как при доброкачественных, так и при злокачественных опухолях эпидермального клеточного происхождения, таких как трихоэпителиомы или базальноклеточные карциномы соответственно 5.
Недавно мы наблюдали многоядерные гигантские клетки кератиноцитарного происхождения, которые имитировали клетки, выявляемые при герпесвирусной инфекции, в эпидермисе пациентов с акантолитическими дерматозами: пузырчаткой обыкновенной 13 и транзиторным акантолитическим дерматозом 17.
Герпесвирусные инфекции кожи обычно проявляются в виде эритематозных пузырьков. Микроскопическое исследование биоптата очага поражения часто выявляет многоядерные гигантские клетки в эпидермисе, содержащие серые ядра с выделяющейся нуклеоплазмой на их периферии; также можно отметить акантолитические, иногда некротические кератиноциты во внутриэпидермальных пузырях.
Диагноз герпесвирусной инфекции может быть подтвержден прямым флуоресцентным исследованием или методом вирусных культур [1-3,22-25].
Вирусная инфекция простого герпеса может сосуществовать в сочетании с другими кожными заболеваниями; это, вероятно, представляет собой совпадающее развитие этой вирусной инфекции с ослабленным иммунитетом—в области кожи, которая стала уязвимой из-за предшествующего или сопутствующего кожного заболевания [26].
В дополнение к акантолитическим дерматозам и буллезным заболеваниям (таблица 2) 30 вирус простого герпеса также может активироваться в связи с гематологическими злокачественными новообразованиями [27, 34, 35], воспалительными дерматозами [27, 35] и физиотерапией [27, 35, 36]. Редко герпетическая инфекция была обнаружена при доброкачественных опухолях кожи, таких как себорейные кератомы [37].
У наших пациентов были акантолитические дерматозы, которые первоначально интерпретировались как герпесвирусная инфекция, основанная на выявлении многоядерных эпителиальных гигантских клеток в эпидермисе в биоптатах кожи.
Однако дополнительная оценка (включая прямую флуоресценцию и метод вирусных культур) была отрицательной для вирусной инфекции. Кроме того, одному пациенту не удалось улучшить течение заболевания после перорального или внутривенного назначения противовирусной терапии. Впоследствии повторные биопсии для исследования методом прямой иммунофлуоресценции и/или рутинной гистологии установили правильный диагноз для обоих пациентов.
Выводы
Эпителиальные и гистиоцитарные многоядерные гигантские клетки иногда можно обнаружить в эпидермисе. Хотя кератиноцитарные многоядерные гигантские клетки чаще всего обусловлены инфекцией, вызванной вирусом герпеса, они также могут наблюдаться при доброкачественных или злокачественных опухолях кожи или у пациентов с акантолитическими дерматозами.
Действительно, у наших пациентов были обнаружены везикулярные поражения кожи, в которых обнаруживались эпидермальные многоядерные гигантские клетки в образцах биоптатов и первоначально были интерпретированы как инфекция, вызванная вирусом герпеса. Однако прямые флуоресцентные исследования антител и вирусной культуры не подтвердили диагноз вирусной инфекции.
Впоследствии повторные биопсии пораженной кожи выявили патологические особенности, которые позволили установить правильный диагноз либо вульгарной пузырчатки, либо транзиторного акантолитического дерматоза.
Поэтому, когда подозрение на герпетическую инфекцию основано на обнаружении эпителиальных многоядерных гигантских клеток в эпидермисе, но либо клинической картине, либо основываясь на отсутствии ответа на противовирусную терапию, либо отсутствие подтверждающих лабораторных исследований не позволяют поставить диагноз вирусной инфекции, следует рассмотреть вероятность первичного акантолитического дерматоза и провести дополнительные гистологические исследования пораженной кожи.
Кроме того, поскольку окрашивание гематоксилином и эозином не является золотым стандартом для подтверждения аутоиммунных буллезных дерматозов, при подозрении на первичный буллезный дерматоз следует проводить биопсию кожи для прямой иммунофлуоресценции, поскольку гистопатологические изменения, наблюдаемые на окрашенных гематоксилином и эозином срезах, могут вводить в заблуждение.
Epidermal multinucleated giant cells are not always a histopathologic clue to a herpes virus infection: multinucleated epithelial giant cells in the epidermis of lesional skin biopsies from patients with acantholytic dermatoses can histologically mimic a herpes virus infection
Background: Multinucleated giant cells in the epidermis can either be epithelial or histiocytic. Epithelial multinucleated giant cells are most often associated with herpes virus infections. Purpose: To review the histologic differential diagnosis of conditions with epithelial and histiocytic multinucleated giant cells—since multinucleated giant cells in the epidermis are not always pathognomonic of a cutaneous herpes virus infection—and to summarize dermatoses in which herpes virus infection has been observed to coexist. Methods: Two individuals with acantholytic dermatoses whose initial lesional skin biopsies showed multinucleated epithelial giant cells suggestive of a herpes virus infection are reported. Using the PubMed database, an extensive literature search was performed on multinucleated giant cell (and epidermis, epithelial, and histiocytic) and herpes virus infection. Relevant papers were reviewed to discover the skin conditions with either multinucleated giant cells in the epidermis or coincident cutaneous herpes virus infection. Results: Initial skin biopsies from patients with either pemphigus vulgaris or transient acantholytic dermatosis mimicked herpes virus infection; however, laboratory studies and repeat biopsies established the correct diagnosis of their acantholytic dermatosis. Hence, epidermal multinucleated giant cells are not always a histopathologic clue to a herpes virus infection. Indeed, epithelial multinucleated giant cells in the epidermis can be observed not only in the presence of infection (herpes virus), but also acantholytic dermatoses and tumors (trichoepithelioma and pleomorphic basal cell carcinoma). Histiocytic multinucleated giant cells in the epidermis can be observed in patients with either giant cell lichenoid dermatitis or lichen nitidus of the palms. Conclusions: Epithelial and histiocytic multinucleated giant cell can occur in the epidermis. Keratinocyte-derived multinucleated giant cells are most commonly associated with herpes virus infection; yet, they can also be observed in patients with skin tumors or acantholytic dermatoses. Cutaneous herpes simplex virus infection can coexist in association with other conditions such as acantholytic dermatoses, benign skin tumors, bullous disorders, hematologic malignancies, inflammatory dermatoses, and physical therapies. However, when a herpes virus infection is suspected based upon the discovery of epithelial multinucleated giant cells in the epidermis, but either the clinic presentation or lack of response to viral therapy or absence of confirmatory laboratory studies does not support the diagnosis of a viral infection, the possibility of a primary acantholytic dermatosis should be considered and additional lesional skin biopsies performed. Also, because hematoxylin and eosin staining is not the golden standard for confirmation of autoimmune bullous dermatoses, skin biopsies for direct immunofluorescence should be performed when a primary bullous dermatosis is suspected since the histopathology observed on hematoxylin and eosin stained sections can be misleading.
Вирус герпеса третьего типа varicella zoster (VZV) вызывает два клинически обособленных заболевания - ветряную оспу и опоясывающий герпес (Баринский И.Ф. и др., 1986; Haanpaa M., 2001). Оба заболевания, прежде всего, характеризуются везикулярной сыпью. Первичная инфекция манифестирует в форме ветряной оспы (ветрянки), а реактивация латентного VZV обусловливает появление локализованных высыпаний - опоясывающего лишая (Хахалин Н.Н., 2002). Мысль о связи между ветрянкой оспой и опоясывающим лишаем впервые была высказана в 1888 венским врачом Яношом Бокеем (von Bokay J., 1909).
Эпизод ветряной оспы в детстве способствует формированию специфической клеточной и гуморальной иммунной защиты. Считается, что рецидив инфекции у таких пациентов может развиться только на фоне недостаточности иммунной защиты, вследствие снижения активности специфических натуральных киллеров, Т-киллеров и системы интерферонов (Fleming D.M. et al., 2004). После первичной инфекции излюбленным местом персистенции VZV являются ганглий тройничного нерва и спинномозговые ганглии чувствительных корешков грудного отдела спинного мозга, где VZV находится в латентном состоянии. В течение этого времени вирус не размножается и не проявляет патогенных свойств. По-видимому, время латентного состояния вируса определяется уровнем специфических антител к VZV. Снижение их количества ведет к реактивации вируса, вирусной репликации (размножению), что на клиническом уровне и проявляется в виде опоясывающего лишая (Arvin A., 2005). Данный вывод подтверждается высокой корреляцией между вероятностью возникновения опоясывающего лишая у людей пожилого возраста и возрастным ослаблением активности клеточного звена иммунитета (Gilden et al., 2000)., На это также указывают данные, свидетельствующие о более высокой заболеваемости опоясывающим герпесом среди лиц, инфицированных вирусом иммунодефицита человека (Gilson I.H. et al., 1989), однако точные механизмы, лежащие в основе перехода вируса из латентного состояния в активное неизвестны.
В случае реактивации VZV ганглии чувствительных нервов становятся местами репликации вируса, именно в них обнаруживаются наиболее выраженные дегенеративные повреждения нейронов (Zerboni L. et al., 2005; Reichelt M. et al., 2008). В результате развивается ганглионит, сопровождаемый распространением инфекции вниз по нервным аксонам к коже. Каким образом происходит транспортировка вируса в поврежденных аксонах неизвестно. Инфекция также может распространяться центрально, приводя к воспалению оболочек в области передних и задних рогов спинного мозга (Gray F. et al. 1994). Отдельные патолого-анатомические наблюдения также свидетельствуют о наличии воспалительных изменений и в контралатеральных спинномозговых ганглиях (Miller S. E. et al., 1997), отмечается снижение количества нейронов и наличие воспалительных инфильтратов в ганглиях, периферических нервах, и спинномозговых корешках (Gowrishankar K. et al., 2007). В некоторых случаях отмечается выраженные некротические изменения в спинномозговых ганглиях. Большинство изменений в периферическом нерве протекает по типу Валлериановской дегенерации, имеющей место, как в толстых, так и в тонких волокнах. (Denny-Brown et al., 1944).
Острая VZV инфекция клинически характеризуется стадией продрома и стадией везикулярных высыпаний (Arvin A., 2005).
Сыпь обычно локализуется в одном или нескольких смежных дерматомах и сопровождается развитием острой невропатической боли. У 50% больных сыпь встречается на туловище, у 20% - на голове, у 15% - на руках, и у 15% - на ногах (Arani R.B. et al., 2001).
Клинический диагноз опоясывающего лишая в типичных случаях достаточно прост. Однако иногда требуется проведение лабораторной диагностики с целью идентификации вируса. Наиболее быстрым и высокочувствительным методом является полимеразная цепная реакция.
В остром периоде болезни или после него возможно развитие осложнений, захватывающих различные системы организма. Наиболее серьезными считаются неврологические осложнения. В структуре неврологических расстройств ведущее место занимает поражение периферической нервной системы. При данном заболевании воспалительный процесс затрагивает региональные, чувствительные ганглии с развитием ганглиолитов. Наличие у больных корешковых болей, парастезий, сегментарных нарушений чувствительности отмечается практически у каждого больного (Stankus S. et al., 2000; Thyregod H. G. et al., 2007). Болевой синдром имеет выраженную вегетативную окраску в виде жгучих, приступообразных, резких болей, усиливающихся в ночное время. В головном мозге при опоясывающем герпесе могут быть обнаружены явления отека, выраженная диффузная инфильтрация подпаутинного пространства, геморрагии в белом веществе, базальных ганглиях (Sissoko D. et al., 1998). Следует заметить, что осложнения со стороны головного и спинного мозга в настоящее время встречаются редко. В случаях развития VZV-инфекции в области тройничного нерва часто наблюдаются осложнения со стороны глаз - кератит, ирит, ретинит, офтальмит. Ранее, при отсутствии специфической противогерпетической терапии, к частым осложнениям VZV-инфекции относились пневмонии, энцефалиты или гепатиты, иногда приводившие к летальному исходу.
Вместе с тем, из всех перечисленных осложнений VZV инфекции самым распространенным считается постгерпетическая невралгия (Dworkin R.H., Portenoy R.K., 1996).
Различают острую герпетическую невралгию (в течение 30 дней после начала заболевания) и постгерпетическую невралгию (Choo P. et al.,1997). К ПГН относят упорные боли в областях, затронутых герпесной инфекцией после заживления кожи (Dworkin R. et al. 2003). Наиболее хорошо установленными факторами риска для ПГН являются пожилой возраст, большая распространенность высыпаний на коже и выраженная боль перед везикулярной сыпью (Desmond R.A. et al., 2002; Fleming D.M. et al., 2004). Все эти факторы находятся во взаимосвязи, поэтому пациенты 50 лет и старше в большинстве случаев испытывают тяжелую, нестерпимую боль и значительные кожные высыпания, что гораздо чаще приводит к развитию ПГН. У пациентов со всеми этими факторами риск развития ПГН превышает 50-75 % (Gnann J., Whitley R. 2002; Jung B.F., 2004). Постгерпетическая невралгия может развиться в любом возрасте, однако для нее характерна прямая корреляция частоты встречаемости и длительности ПГН с возрастом. Более 50% всех пациентов с ПГН - старше 60 лет, 75% больных с указанной патологией приходится на возрастную группу старше 75 лет (Nurmikko T.J., 2001). Половина всех пациентов с ПГН старше 60 лет испытывает постоянную боль более 6 месяцев, в то время как в возрастной группе 30-50 лет ПГН более 6 месяцевь наблюдается у 10% больных (Whitley R. et al. 1996). В США ежегодно регистрируется 100-200 тыс. новых случаев ПГН (Nurmikko T.J., 2001). Однако, истинная распространенность ПГН не известна, не только потому, что эпидемиологические данные недостаточны, но также из-за отсутствия конценсусса по определению ПГН. Некоторые авторы относят к ПГН боли, возникающие в любой период герпесной инфекции, другие считают, что ПГН - это боль, сохраняющаяся спустя 3 месяца после заживления кожи. В первом случае определения ПГН ее распространенность составляет 8%, во втором - 4,5% (Choo P. et al. 1997). Постоянную боль в течение 1 мес после сыпи испытывают до 15% пациентов и около 4% пациентов от общего количества перенесших опоясывающий лишай отмечают сохранение боли в течение года (Lancaster T. et al. 1995).
Классическое проспективное исследование, проведенное Hope-Simpson (1975), продемонстрировало, что из 321 пациента с опоясывающим лишаем 10 % имеют выраженную боль спустя 3 месяца после острой герпетической инфекции, а 4 % - и через 12 месяцев. Подобные результаты были получены и в других проспективных исследованиях (Helgason S. et al. 1996; 2000; Scott F.T. et al., 2006), в которых также было показано, что наибольший риск пролонгации болевого синдрома после перенесенного опоясывающего лишая имеют пациенты в возрасте около 60 лет.
Постгерпетическая невралгия занимает третье место по частоте встречаемости среди различных типов невропатической боли и уступает только болям в нижней части спины и диабетической невропатии (Montero H.J. et al., 2005; Breivik H. et al, 2006; Torrance N. et al., 2006).
Локализация болевого синдрома практически всегда соответствует зоне кожных высыпаний. Интенсивность болевого синдрома как правило высокая. Кроме глубоких ноющих и стреляющих болей очень характерны поверхностные жгучие боли и наличие стимулозависимых болей - динамической гипералгезии и аллодинии (Baron R., 2004).
При клиническом осмотре в зоне болей выявляются нарушения поверхностной чувствительности. Качество боли в острый период опоясывающего лишая и при ПГН различно. Вместе с тем, несмотря на разный выбор дескрипторов из МакГилловского болевого вопросника, пациенты с опоясывающим лишаем и ПГН для описания своих болевых ощущений выбирают похожие по смыслу слова, например, горячая и жгучая боль или пронзающая и простреливающая боль (Bennett M., 2001).
Схожие проявления наблюдаются и при описании вызванной боли пациентами с опоясывающим лишаем и ПГН. И те, и другие отмечают наличие схожих типов гипералгезии и аллодинии (Haanpaa M. et al., 2000; Berry J.D., Rowbotham M.C., 2004).
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части больных она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания (Cunningham A.L., Dworkin R.H., 2000). Затяжной, тяжелый характер заболевания с длительным, выраженным болевым синдромом способствует формированию расстройств психики (Dworkin R.H., et al., 1992). У таких пациентов выявляются тревожно-депрессивные расстройства, когнитивные нарушения - снижение активного внимания, памяти, затруднения осмысления происходящего, отмечается некритичность, нетерпеливость, неряшливость, страх боли, неуверенность в завтрашнем дне, отмечается снижение социальной активности (Haythornthwaite J.A. et al., 2003). ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов особенно пожилого возраста (Lydick E. et al., 1995). У пациентов с ПГН отмечается хроническая усталость, снижение массы тела, физической активности, нарушения сна (Morin C.M., Gibson D., Wade J., 1998).
В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Такие боли относят к невропатическим болям, их выделяют в отдельную самостоятельную группу и определяют как боли, возникающие вследствие первичного повреждения соматосенсорной нервной системы (Treede R.D. et al., 2008).
Патофизиологической основой невропатических болевых синдромов являются нарушения генерации и проведения ноцицептивного сигнала в нервных волокнах, а также механизмов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга (Кукушкин М.Л., Хитров Н.К., 2004; Baron R. 2000).
Лечебная тактика при опоясывающем лишае включает два основных направления: противовирусная терапия и купирование невропатической боли, как в острый период заболевания, так и в стадии постгерпетической невралгии. Результаты нескольких рандомизированных контролируемых испытаний свидетельствуют о том, что раннее начало лечения простого герпеса может предотвратить развитие постгерпетической невралгии или способствовать ее скорейшему разрешению (Исаков В.А. и др., 2004; Helgason S. et al., 1996; Jackson J.L. et al., 1997 ; Volmink J. et al., 1996).
Наиболее широкое применение нашли такие специфические противогерпетические препараты, как ацикловир, фамцикловир и валацикловир, которые, являясь нуклеозидными аналогами, блокируют вирусную репликацию (Романцев М.Г., 1996; Beutner K. et al., 1995; Bruxelle J., 1995). Важно, что противовирусное лечение проявляет наивысшую активность, если назначено в течение 72 ч от начала герпетических высыпаний (Johnson R., 2001; Johnson R., Dworkin R.H., 2003). В ряде исследований доказана высокая эффективность ацикловира в уменьшении тяжести, продолжительности острой герпесной инфекции и профилактике ПГН, особенно при его раннем назначении. Оценка эффективности фамцикловира также продемонстрировала уменьшение времени до разрешения сыпи (Dworkin R.H. et al., 1998). В сравнительном исследовании ацикловира и валацикловира показана эквивалентная эффективность в сокращении продолжительности невропатической ПГН (Beutner K. et al. 1995). В другом клиническом испытании установлена терапевтическая эквивалентность фамцикловира и валацикловира для неосложненного герпеса (Tyring S. et al. 2000). Возможно также сочетанное использование противовирусной терапии и глюкокортикостероидов (Whitley R. et al. 1999). Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир+преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, то есть она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН и в этом смысле его действие сравнимо с влиянием плацебо, то есть данная комбинация может быть спокойно использована в старших возрастных группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона (Kost R., Straus S., 1996).
В настоящее время в США делается акцент на профилактику герпетической инфекции. С 1995 г. в США проводится всеобщая вакцинация от ветряной оспы, особенно пожилых лиц, и с 1999 г. отмечается резкое снижение заболеваемости (Hambleton S., Gershon A., 2005; Oxman M.N. et al., 2005).
При постгерпетической невралгии препаратами с доказанной эффективностью (класс А - терапия первой линии) являются: пластины с 5% лидокаином, габапентин, прегабалин, трициклические антидепрессанты, трамадол (Attal et al., 2006).
На сегодняшний день эффективность применения пластин с 5% лидокаином (Версатис, Grunenthal Gmbh) убедительно доказана при лечении ПГН. Так, в нескольких рандомизированных клинических исследованиях установлено, что применение пластин с 5% лидокаином статистически достоверно более значимо облегчает проявления болевого синдрома у пациентов с постгерпетической невралгией по сравнению с плацебо (Rowbotham M.C., 1996; Galer B.S., 1999, 2002). На основании полученных данных FDA одобрило применение данного препарата в качестве стартовой терапии у пациентов с постгерпетической невралгией. (Richard L. et al., 2004)
Версатис - это топический анальгетик, который действует непосредственно там, где болит. Он выпускается в виде мягких пластин размером 10х14 см, которые наклеиваются на неповрежденную кожу без признаков воспаления. Медленно высвобождающийся из пластины лидокаин создает более или менее значительную концентрацию лишь в поверхностных слоях кожи, где проходят тонкие волокна, обеспечивающие болевую и температурную чувствительность (Gammaitoni AR, Davis MW. 2002.). Лидокаин лишь в незначительной степени проникает в более глубокие слои кожи, где проходят кровеносные сосуды, поэтому его попадание в системный кровоток сведено к минимуму. У пациентов, использовавших пластины Версатис, не наблюдалось никаких известных системных эффектов лидокаина (влияние на деятельность ЦНС и сердечно-сосудистой системы). Таким образом, важнейшим преимуществом пластин Версатис служит отсутствие системного действия, что гарантирует безопасность лечения. Практически полное отсутствие системного эффекта позволяет назначать Версатис совместно с любыми другими препаратами для лечения нейропатической боли.
Механизм лечебного эффекта препарата Версатис не ограничивается только действием высвобождающегося из них лидокаина. Важное значение имеет также то, что пластина выполняет роль механического барьера, препятствуя раздражению участка кожи с измененной чувствительностью (аллодиния), а также оказывает не него легкое охлаждающее действие (Galer BS, Gammaitoni AR, Oleka N et al., 2004)
Пластины Версатис рекомендуется прикреплять на 12 ч в течение суток, затем следует 12-часовой перерыв. Обезболивающий эффект часто начинается в течение 30 мин после прикрепления пластины, но может проявляться и позже, нарастает в течение 4 ч и затем поддерживается в течение длительного времени, пока пластина прикреплена к коже. Более того, он может сохраняться и после ее удаления.
Для объективной оценки эффективности каждого из препаратов при лечении ПГН используется показатель NNT (number needed to treat - количество больных, которых нужно пролечить, чтобы получить у одного 50% снижение боли). Чем ниже NNT, тем более эффективен препарат при данной патологии. NNT для пластин с 5% лидокаином при лечении пациентов с ПГН составляет 2,0; для амитриптилина - 2,6; габапентина - 4,4; прегабалина - 4,6 (Wu C.L., Raja S.N., 2008); для трамадола - 3,9 (Kalso E., 2006).
Кроме того, в клинической практике очень важен показатель NNH (number needed to harm - число пациентов, которых необходимо пролечить данным препаратом, чтобы получить развитие 1 случая неблагоприятной побочной реакции, приводящей к отмене препарата). Он показывает, насколько безопасен данный препарат при его использовании. Величина NNH для трамадола, рассчитанная по результатам нескольких клинических исследований, составила 9.0, для ТЦА 14.7, для габапентина 26.1. Рассчитать показатель NNH для пластин с 5% лидокаином не представляется возможным в связи благоприятным профилем безопасности препарата, сравнимым с плацебо.
Таким образом, оценка препарата Версатис с позиций доказательной медицины делает его препаратом выбора при лечении постгерпетической невралгии, что подтверждено в соответствующих рекомендациях.
СПИСОК ЛИТЕРАТУРЫ
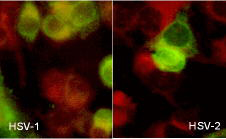
Иммунофлюоресценция - антитела ВПГ-1 и ВПГ-2
Зачем нужна лабораторная диагностика, её роль в постановке диагноза.
Вирус простого герпеса (ВПГ) является одним из немногих вирусов, для выявления этиологической роли которого при инфекционных заболеваниях используются все лабораторные диагностические реакции – от цитологических исследований до молекулярно-биологических методов верификации. Одновременно необходимо проводить обследование на наличие сопутствующих возбудителей (хламидий, микоплазм, уреаплазм, простейших и других бактерий, вирусов).
Что исследуется - биологический материал из очага инфекции
Для постановки диагноза генитального герпеса (ГГ) необходимо исследовать материал, полученный непосредственно из полового тракта, а также биологические жидкости и секреты организма.
содержимое герпетических пузырьков, кровь, слюна, спинномозговая жидкость, биоптаты шейки матки и других органов, цервикальный секрет, уретральные пробы, эякулят, секрет предстательной железы, соскобы и смывы с тканей и органов, моча, слизь, мазки-отпечатки с высыпаний и т.д
Что ищут в процессе исследования
Лабораторная диагностика заболеваний, вызванных ВПГ включает комплекс методологических подходов, цель которых состоит в обнаружении маркеров герпесвирусной инфекции, среди которых:
- геном вируса
- вирусные белки (антигены)
- инфекционные вирусные частицы
- цитопатогенное действие на клетки
- специфический иммунный ответ организма больного (его антитела)
Методы лабораторной диагностики
До недавнего времени лабораторная диагностика герпесвирусных инфекций (ГВИ) производилась только в специализированных вирусологических центрах. Появление новых методов исследования привело к расширению возможностей вирусологической диагностики ГВИ в практическом здравоохранении.
Современные методы лабораторной диагностики ГВИ позволяют: получать результаты анализа в короткие сроки (часы, иногда — минуты), проводить и завершать анализ без выделения культуры вируса, используя только нативный материал; получать надлежащую достоверность анализа, учитывая высокую специфичность и чувствительность методов исследования.
- молекулярно-биологические – детекция вирусного генома методом полимеразной цепной реакции (ПЦР);
- иммуноморфологические – выявление антигена ВПГ с помощью прямой и непрямой иммунофлюоресценции (ПИФ и НИФ);
- серологические – выявление специфических антител к ВПГ (IgA, IgM, IgG) и антигена методом иммуноферментного анализа (ИФА);
- вирусологические – выделение вируса в культуре ткани из клинического материала и его идентификация;
- цитологические.
Молекулярно-биологические методы диагностики
К молекулярно-биологическим методам относится один из самых перспективных современных методов лабораторной диагностики – метод полимеразной цепной реакции (ПЦР). Метод ПЦР, позволяет обнаружить единичные копии вирусной ДНК в клетках, биологических жидкостях (кровь, слюна, материал, взятый из уретры или цервикального канала) и биопсированных тканях.
Иммуноморфологические методы
Обнаружение вирусного антигена в клетках и жидкостях организма (клетках осадка мочи, слюны, лейкоцитах крови, мазков-отпечатков с герпетических высыпаний, шейки матки, биопсийного и аутопсийного материала) осуществляют с помощью метода иммунофлюоресценции, иммунопероксидазного и лантанидного методов.
В прямой монофлюоресценции используют антитела, меченные люминесцирующей сывороткой (изотиоционатом флюоресцеина), что позволяет выявить вирусный антиген по свечению клеток в люминесцентном микроскопе. Во втором случае применяют антитела, меченные пероксидазой. Вирусный антиген выявляют в обычном световом микроскопе по окрашиванию антигенсодержащих клеток хромогеном в темно-коричневый цвет. Разрабатываются также лантанидные методы, основанные на амплификации свечения.
Непосредственное выявление антигена в клиническом образце указывает на активную репликацию вируса и является методом, конкурирующим по надежности с методом выделения вируса в культуре тканей.
Серологические методы
Обнаружение в крови антител к ВПГ-2 не позволяет достоверно судить о наличии у больного ГГ, так как многие используемые коммерческие серологические наборы не способны точно различать антитела к ВПГ-1 и ВПГ-2 из-за высокого (70%) антигенного сродства обоих типов вируса.
Чувствительность большинства известных ИФА тест-систем для выявления ВПГ-инфекции варьируется в пределах 48–98,7% и зависит от исследуемого материала. Наличие перекрестных антигенных связей между штаммами, принадлежащими к ВПГ-1 и ВПГ-2 и другими типами герпесвирусов, требует определенной осторожности при интерпретации результатов лабораторных исследований.
В этой группе существует еще один метод – так называемый Western blot analysis: тестирование с помощью твердофазного иммунологического анализа электрофоретически разделенных белков или полипептидов. Метод высокоточен и позволяет дифференцировать антитела к ВПГ-1 и ВПГ-2.
Окончательные тесты на определение антител к ВПГ-2 должны основываться на детекции ВПГ2-типоспецифического поверхностного антигена – гликопротеина gG1–gG2. Чувствительность и специфичность серологических тестов на его основе при исследовании крови составляют 95–99 и 100% соответственно. В настоящее время типоспецифическая серология используется преимущественно в научно- исследовательских целях и не применяется в широкой клинико-лабораторной практике.
Вирусологическое исследование
Для диагноза заболевания важное значение имеет выделение вируса из пораженных тканей. Выделение вирусов в клеточной культуре включает выявление (индикацию) вируса и последующее его серотипирование. При подозрении на герпетическую инфекцию необходимо проводить многократное вирусологическое исследование материала, отделяемого из мочеполовой системы у пациентов, т.к. отрицательный результат однократного вирусологического исследования не исключает наличие урогенитальной герпетической инфекции. Повторное 2–4-кратное исследование (1 раз в неделю) повышает шанс выделения вируса в 2–3 раза.
Цитологическое исследование
Наиболее доступным, быстрым и дешевым методом исследования является цитологическое исследование инфицированного материала на ВПГ. Материалом для цитологического исследования может служить содержимое везикул, соскоб со дна эрозии, слизистой уретры, стенок влагалища, канала шейки матки.
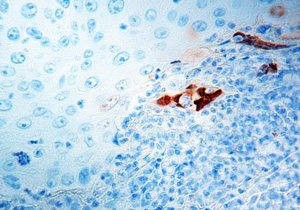
Антитела к ВПГ-2. Подготовленный лабораторный препарат (ткань, зараженная ВПГ-2)
Специальным образом подготовленные образцы исследуют с помощью световой микроскопии. При цитологическом исследовании обнаруживаются многоядерные гигантские клетки с внутриядерными включениями.
Недостатками метода являются низкая чувствительность, сложность дифференциальной диагностики с другими вирусными инфекциями и зависимость от квалификации специалиста, проводящего исследование. Однако этот метод может быть применен как вспомогательное диагностическое средство. Электронная микроскопия в диагностике герпетической инфекции также рекомендована для экспресс-диагностики ВПГ-инфекции.
Выявление противовирусных антител классов M и G
Для подтверждения инфицирования вирусом герпеса определяют уровни специфических иммуноглобулинов Ig, относящихся к различным классам G и M (IgM, IgG), циркулирующих в биологических жидкостях и секретах организма больного (сыворотке крови, ликворе, слюне, слезной жидкости). Выявление специфических противогерпетических антител (IgM, IgG,) чаще всего осуществляют методом иммуноферментного анализа (ИФА). Редко используют классические методы: реакцию нейтрализации, реакцию связывания комплемента вируса герпеса (РСК). Из новых методов следует отметить иммуноблот (western blot) и иммунодот.
Детекция типоспецифических антител позволяет определить наличие и тип герпетической инфекции по наличию М-антител, нарастанию G-антител к одному или двум вирусам. Достоверные результаты получают при исследовании парных сывороток крови больного, взятых в начале заболевания (3-7 день) и через 10-12 дней. В этом случае удается наблюдать динамику нарастания антител. При вирусных инфекциях лишь четырехкратное и большее повышение титра антител во второй сыворотке имеет диагностическое значение.
IgM детектируются через неделю после заражения. Специфические IgG антитела обычно появляются через 2-3 недели после первичного инфицирования.
Выявление специфических иммуноглобулинов IgM в отсутствии IgG или при 4-кратном увеличении титров специфических IgG в парных сыворотках крови, полученных от больного с интервалом 10-12 дней, свидетельствует о первичном заражении.
Выявление специфических иммуноглобулинов IgM на фоне IgG при отсутствии достоверного роста титров IgG в парных сыворотках говорит об обострении хронической герпетической инфекции.
Выявление титров IgG выше средних является показанием к дополнительному обследованию пациента и выявлению выделения вируса герпеса в средах.
Итоговый вывод
Читайте также:

