Гистологический метод при вирусах
Обновлено: 19.04.2024
Злокачественные новообразования — это группа заболеваний, насчитывающая несколько тысяч видов опухолей разных типов и разной степени злокачественности. Они подразделяются на большие группы в зависимости от того из каких тканей они развиваются: если из эпителиальных (барьерных) — то это раки, если из соединительных тканей (мягких тканей и костей) – саркомы, если из лимфоидных (иммунных) – лимфомы/лейкозы. От того насколько правильно верифицирована опухоль (определен ее тип, степень злокачественности и другие характеристики) зависит правильность и эффективность лечения. Важную роль в этом играют гистологические исследования.
О том, как проходят гистологические исследования, какие задачи кроме диагностических они позволяют решать, что влияет на сроки их выполнения рассказывает заведующая патологоанатомическим отделением с прозектурой НМИЦ онкологии им. Н.Н. Петрова, к.м.н. Анна Сергеевна Артемьева.
Что служит материалом для патоморфологических (гистологических) исследований?
Кусочек ткани пациента: кожи, слизистых оболочек, внутренних органов, костей, головного и спинного мозга и т.п., так называемый биоптат.
Процесс получения фрагмента ткани (биоптата) — биопсия – это несколько разных способов забора материала для гистологического исследования.
Биопсию внутренних органов делают под УЗИ-навигацией, либо с помощью хирургического вмешательства.
Операционный материал – это все что удалено во время операции, как правило, орган или его часть, или несколько органов и/или их частей с образованием (опухолью) или без него.
Как обрабатывают эти материалы для проведения гистологического исследования?
Фиксация биоптата может занимать от 6 до 24 часов – в зависимости от его вида и размера.
Операционный материал фиксируется дольше, в несколько этапов. Сначала предварительная фиксация, которая занимает примерно 12 часов. Затем вырезка нужных фрагментов и повторная фиксация еще 24 часа.
Соотношение объема материала к объему формалина должно быть 1:20.
2 Этап. Процессинг — процесс обезвоживания, обезжиривания и пропитки материала парафином. Автомат перемещает кусочек материала из раствора в раствор.
В качестве растворов применяются: абсолютированный изопропиловый спирт (6-8 смен), ксилол (2 смены), расплавленный парафин (2 смены).

Процесс получения парафиновых блоков.
3 Этап. Изготовление парафинового блока. Кусок материала помещается в форму с расплавленным парафином (уже другим нежели во время процессинга – с более высокой температурой плавления) и охлаждается. Выполняется вручную, сложно ускорить.

4 Этап. Изготовление срезов. Толщина образца — кусочка ткани, залитого в парафин – 1-3 мм. Толщина каждого среза 4-5 мкм (0,004-0,005 мм). Выполняет лаборант с использованием специального инструмента – микротома.
Срезы монтируются на стекла и должны высохнуть.
Несмотря на то, что часть материала теряется при выравнивании в микротоме, при должном профессионализме, из одного образца — материала от одной биопсии, операционного материала от одной опухоли, возможно изготовить около 100 стекол (микропрепаратов).
Для чего делаются срезы?
Срезы делаются для рутинной окраски гематоксилинном и эозином, иммуногистохимического исследования и других видов исследований.
Срезы для всех исследований используются одинаковые, различается окраска, могут отличаться стекла, на которые они монтируются, так для ИГХ и FISH нужны специальные адгезивные стекла или заряженные стекла.

Блоки и стекла способны храниться долгие годы и использоваться для проведения дополнительных гистологических исследований, пересмотров, а также в научных целях.

Архив гистологических материалов собирается в НМИЦ онкологии им. Н.Н. Петрова с 1927 года и содержит более 10 млн единиц хранения (микропрепараты — стекла, парафиновые блоки, архивные карточки, влажный архив).
Какие виды гистологических исследований наиболее информативны?
- Гистологическое исследование
- Иммуногистохимия (ИГХ)
- Флуоресцентная гибридизация in situ (FISH), может быть хромофобной (принцип тот же, другой тип метки)
Что позволяют определить разные виды гистологических исследований
Гистологическое исследование – что это такое?
Позволяет верифицировать опухоль – то есть определить из каких клеток она состоит (из какой ткани она развивается), степень ее дифференцировки (зрелости).
Рутинная окраска, выполняющаяся при гистологическом исследовании, позволяет выявить патологический процесс в анализируемом материале (биоптате, операционном материале):
- воспаление,
- специфическое воспаление,
- аномалия развития,
- опухоль.
Также, в большинстве случаев, благодаря рутинной окраске, можно определить степень злокачественности опухоли и, если она достаточно зрелая, то какова ее природа.
Окрашенные срезы под микроскопом
Инвазивный протоковый рак er 100%.
Карцинома сигмовидной кишки.
Крупноклеточная нейроэндокринная опухоль.
МТС крупноклеточной нейроэндокринной опухоли.
Неспецифический рак молочной железы. Участок in situ карциномы внутри протока, криброзного типа.
Низкодифферинцированный рак пищевода.
При гистологическом исследовании биоптата и операционного материала можно оценить распространенность: размер опухоли и прорастание в окружающие ткани, насколько затронуты лимфоузлы и есть ли метастазы в отдаленные органы (если эти все структуры присланы для гистологического исследования). При консультации готовых микропрепаратов – стекол, это, как правило, невозможно, если опухоль больше размеров гистологической кассеты или рассечена предыдущим исследователем и не предоставлены данные макроскопического исследования.
Во время гистологического исследования изучаются все стекла от одного образца – материала, полученного от одного вмешательства — одной операции или одной биопсии, вне зависимости от их количества, это считается одной консультацией.
Сроки выполнения гистологического исследования зависят от количества микропрепаратов и от категории сложности того процесса, который в них обнаруживается, сроки могут удлиняться, особенно при необходимости использования дополнительных методов исследования и анализа дополнительных сведений. На сроки выполнения гистологического исследования влияет полнота предоставленной пациентом клинической информации, в том числе данных уже проведенных исследований.
Иммуногистохимия (ИГХ)
Сложное многоэтапное исследование, выполняется после гистологического исследования на том же материале. Опухолевые срезы окрашиваются антителами, которые способны связываться антигенами (белками), которые несут опухолевые клетки. Разные опухолевые клетки несут разные антигены, к каждому из которых подобно ключа к замку подходит антитело.

Один из этапов ИГХ
ИГХ исследование — это комбинаторика. 100% специфичных и чувствительных к какой-то опухоли маркеров не существует, но есть набор антигенов, которые в определенном типе опухоль должны быть и набор тех, которых там быть не должно, таким образом ИГХ-панель строится так чтобы включать несколько антител, которые должны быть позитивны и несколько, которые должны быть негативны. Для разных опухолей различаются эти наборы позитивных/негативных маркеров.
При проведении прогностической ИГХ – выявлении маркеров чувствительности к терапии определяется набор таких маркеров для конкретных опухолей, например, рака молочной железы: рецепторы стероидных гормонов (эстроген, прогестерон), рецептор эпидермального фактора роста (HER2) и индекс пролиферативной активности Ki67 (скорости деления клеток).
Стекла окрашиваются последовательно — различными антителами красятся наборы маркеров в несколько этапов, процесс окраски стекол одним антителом занимает 48 часов.
Таким образом, каждое антитело наносится на отдельный срез ткани, монтированный на отдельное стекло, как правило с соответствующим внешним контролем, количество реакций (используемых антител) и этапов окраски может существенно варьировать в зависимости от конкретной диагностической ситуации, все зависит от индивидуальных особенностей опухоли. Проводится такое количество окрасок, которое необходимо для того, чтобы выявить наиболее характерный для определенной опухоли набор позитивных и негативных маркеров.
Кому-то для этого будет достаточно 5 антител, а кому-то необходимо сделать 20 окрасок и более. Максимальное количество окрасок, которое нам приходилось делать – 212.
Поэтому точные сроки и стоимость этого исследования невозможно определить заранее. Разные по течению и прогнозу опухоли могут быть очень похожи друг на друга, только минимальные различия в окрашивании, с учетом клинических данных и данных других методов обследования, могут позволить установить верный диагноз.
Есть целый ряд доброкачественных опухолей, симулирующих злокачественные, в том числе высокоагрессивные, а некоторые злокачественные высоко дифференцированные опухоли трудно отличить от воспалительных и реактивных процессов. В таких ситуациях только опыт и квалификация патоморфолога, анализ всего комплекса доступной информации (снимки КТ, МРТ, рентген, протокол операции, и др.) позволяют поставить диагноз.
В грамотной интерпретации результатов ИГХ очень важна роль эксперта, ведь те случаи, с которыми приходится работать, в большинстве своем, сложные. Практически не существует антител, которые могут выступать в качестве 100%-х маркеров той или иной опухоли, врачу всегда приходится взвешивать различные вероятности.
Что определяется с помощью ИГХ?
- Наличие рецепторов гормонов прогестерона и эстрогена при раке молочной железы;
- Экспрессию HER-2/neu в клетках при раке молочной железы, раке желудка;
- Определить ходжкинские и неходжкинские лимфомы — установить точный диагноз лимфомы на сегодняшний день невозможно без применения этого вида исследования.
- Определить первичная это опухоль или метастазы, тканевую принадлежность метастазов.
Иммуногистохимия позволяет оценить потенциальный темп роста опухоли, ответ на химио-, таргетную, гормональную терапию.
Флуоресцентная гибридизация in situ (FISH-тест)
Это метод молекулярно-генетической диагностики в ткани.
FISH проводится в срезе ткани и позволяет привязать генетическую перестройку к конкретной опухолевой клетке.
В этом тесте также используются специальные красители, которые связываются только с определенными участками хромосом. Их называют зондами, которые могут быть помечены флуоресцентным или хромогенным красителем, визуализирующимися при помощи флуоресцентного или светового микроскопа.
Технические операции по подготовке гистологических стекол к этому исследованию занимает 2 рабочих дня.

Анализ препарата с помощью многоголового микроскопа.
Полученные микропрепараты очень чувствительны к внешней среде – они могут выцвести со временем, чтобы избежать потерь информации все FISH-препараты сканируются, создается их цифровая копия, которая доступна для внешнего пересмотра. Специалисты просматривают флуоресцирующий материал в темном поле, в анализе препарата принимают участие как минимум 2 специалиста. При необходимости используется и цифровой анализ.
Что определяется с помощью FISH-теста?
FISH-тест позволят диагностировать некоторые виды опухолей, определяет целесообразность использования некоторых химиотерапевтических препаратов.
- определяется наличие амплификации HER2 в случаях пограничного результата по данным ИГХ, что необходимо для назначения таргетной терапии;
- проводится диагностика, то есть выявление генетических перестроек специфичных для определенного типа опухолей, когда невозможно окончательно установить диагноз при помощи более простых методик, чаще всего это саркомы мягких тканей и опухоли головного мозга;
- генетические отклонения, вызывающие рак того или иного органа;
- при лимфомах эта методика используется в диагностических целях и для выявления факторов неблагоприятного прогноза, то есть показаний для ранней интенсификации лечения.
Проведение гистологического исследования, и в первую очередь FISH-теста — это экспертная работа, которая зависит от квалификации специалиста. Очень многие мутации, которые выявляются в опухолях, не всегда являются метками опухолей, они могут находиться и в доброкачественных образованиях или нормальных тканях.
За год патологоанатомическое отделение НМИЦ онкологии имени Н.Н. Петрова выполняет около 20000 гистологических исследований (пациентов), из них около 5000 консультативных случаев (пересмотров), более 30000 ИГХ исследований, а также участвует в программе внешнего контроля качества ИГХ исследований NordIQ.
Специалисты отделения обладают огромным опытом проведения гистологических исследований и экспертными компетенциями.
Помните! Гистологические исследования – это отправная точка, от того насколько грамотно они выполнены зависит точность поставленного диагноза и эффективность назначенного лечения.
Скорость выполнения гистологических исследований и адекватность гистологического заключения зависят от ряда факторов:
- Качества стекол и блоков;
- Комплектности предоставления стекол (необходимо предоставить все стекла и блоки);
- Предоставление пациентом дополнительной информации, которая поможет верно интерпретировать данные гистологического исследования, ИГХ и FISH-теста, а именно: данные анамнеза заболевания, данные о сопутствующих заболеваниях, в первую очередь инфекционных (ВИЧ, гепатиты); все данные всех проведенных обследований и вмешательств: снимки — рентген, КТ, МРТ, УЗИ, протоколы операций, выписки.
После выполнения гистологического исследования пациент получает гистологическое заключение/протокол исследования гистологического материала.
Расшифровка гистологического исследования: на что обратить внимание?
Гистологическое заключение включает в себя несколько рубрик (полей):
Макроскопическое описание
Заполняется как для биоптатов — не обязательно, так и для операционного материала, для которого имеет крайне важное значение в ряде случаев.
Микроскопическое описание
Результаты иммуногистохимического исследования
В этом поле описано какие антитела использовались в данном случае и каков результат окрашивания: наличие окрашивание или его отсутствие, локализация в клетке при необходимости, а также процент позитивных клеток и интенсивность реакции, когда это имеет значение.
Патологоанатомическое заключение
Содержит нозологическую/классификационную единицу, если ее возможно установить по исследованному материалу, то есть дает ответы на вопросы:
- Это первичная опухоль или метастаз?
- Где локализован первичный опухолевый очаг?
- Каков гистологический тип опухоли (из клеток какого типа она состоит).
Также приводятся все необходимые прогностические данные: степень дифференцировки, параметры, влияющие на стадию, состояние краев резекции, если возможно их оценить и т.п.
Дополнительные замечания и рекомендации
Поле может содержать комментарии, относительно возможного направления дальнейшего обследования, вероятности того или иного диагноза, необходимости ознакомиться с теми или иными клиническими данными и др.
Мы не рекомендуем пациентам самостоятельно заниматься расшифровкой показателей гистологического исследования, используя информацию, полученную на различных Интернет-сайтах и форумах пациентов, так как на интерпретацию данных влияет большое количество факторов, в том числе, возраст пациента, данные других исследований и др.
Расшифровкой исследования может заниматься только специалист – врач онколог по профилю заболевания!

Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.
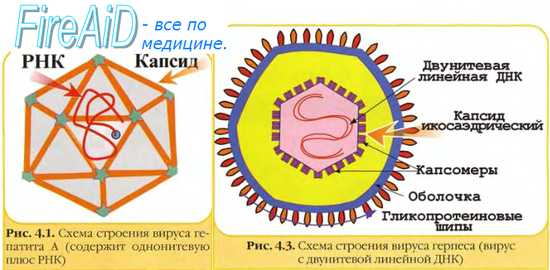
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3~4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Обследования при опухолях с неизвестной первичной локализацией
Здесь представлены лишь общие соображения, касающиеся этой трудной проблемы. Следует подчеркнуть, что для каждого пациента выбирается своя глубина обследования. При этом принимаются во внимание такие факторы, как возраст и физическое состояние больного, его психологическая готовность к процедурам, а также вероятность обнаружить курабельную опухоль.
Принятие врачом решения проводить дальнейшее обследование больного требует рассудительности и опыта. В общем, чем меньшим опытом обладает врач, тем больше он назначает различных процедур обследования. После обнаружения метастазов и исключения курабельных случаев, необходимо убедить больного в том, что дальнейшее обследование с целью выяснения локализации первичной опухоли не требуется (или не принесет ему пользы).
Гистологические исследования при опухолях с неизвестной первичной локализацией
Первый, наиболее важный этап обследования состоит в обсуждении результатов анализа биопсийного материала вместе с опытным врачом-гистологом. У гистолога могут быть предположения относительно локализации первичной опухоли, однако из-за отсутствия клинической информации он не может их подтвердить. Обычно при гистологическом исследовании обнаруживается плохо дифференцированная аденокарцинома или недифференцированная опухоль.
Использование специальных методов окраски может дать дополнительную информацию, как, например, при иммуногистохимическом окрашивании препаратов крупноклеточных лимфом. Эти опухоли часто бывает трудно отличить от анапластической карциномы, однако они обладают высокой чувствительностью к химиотерапевтическим средствам. Прокрашивание гистологических препаратов красителями на муцин позволяет обнаружить его в опухолевых клетках, что свидетельствует об их происхождении из тканей кишки, поджелудочной железы или желудка.
Определить происхождение опухолевых клеток можно с помощью моноклональных антител, специфичных к определенным белкам цитоплазмы или клеточной мембраны. В случаях недифференцированных опухолей чрезвычайно важно не пропустить крупноклеточную лимфому, и для этого обычно проводят гистологический анализ с использованием антител к общему антигену лейкоцитов, и к антигенам эпителиальных клеток, например к цитокератинам.
В таблице ниже представлены наиболее часто используемые реагенты и методы для анализа гистологических препаратов. Для одних реагентов необходимо использовать парафиновые срезы, для других — срезы замороженной ткани. Поэтому при подозрении на рак биопсийные образцы не следует фиксировать в формалине. Существуют антитела к мембранным антигенам клеток эпителия.
С их помощью можно обнаружить эпителиальные опухоли, например рак легкого, или другие плохо дифференцированные аденокарциномы. Антитела к прекератину позволяют ответить на вопрос, является ли опухоль сквамозной. Также существуют антитела к специфическому антигену меланомы. У женщин положительный тест на наличие эстрогеновых и прогестероновых рецепторов в клетках биоптатов, взятых из подмышечного или надключичного лимфатических узлов, может указывать на опухоль молочной железы.
В отдельных случаях полезно электронно-микроскопическое иесследование. Например, с помощью этого метода в клетках злокачественной меланомы можно обнаружить пре-меланосомы, а в клетках плохо дифференцированной сквамозной карциномы — существование межклеточных мостиков. Недифференцированные опухоли герминативного происхождения у больных молодого возраста относятся к числу курабельных раков, однако при обследовании их часто пропускают. В клетках этих опухолей содержится хориогонадотропин (ХГЧ) и а-фетопротеин (АФП), которые можно обнаружить при иммуногистохимическом окрашивании препаратов.

Инструментальные методы исследования при опухолях с неизвестной первичной локализацией
С помощью инструментальных методов определяют степень развития опухоли, а в отдельных случаях и локализацию ее первичного очага.
Рентгеноскопия грудной клетки является важным методом обследования и позволяет обнаружить карциному бронха, или увеличение медиастинальных лимфатических узлов, указывающее на возможность лимфомы.
При компьютерной томографии брюшной полости в 25% случаев удается обнаружить локализацию первичной опухоли. Если метастазы представляют собой аденокарциному, то часто местом ее локализации является поджелудочная железа. Диагносцирование первичной опухоли поджелудочной железы не влияет на выбор метода лечения. Обнаружение метастазов в надпочечниках позволяет предположить, что первичная опухоль локализована в легком.
При небольших размерах легочных метастазов они, вероятно, образуются из опухоли ободочной кишки, предстательной или щитовидной железы.
Для сарком характерны несколько более крупные метастазы. Кальцификация печеночных метастазов позволяет заподозрить опухоль ободочной кишки. Для дифференциальной диагностики карциномы молочной железы необходимо проводить маммографию, поскольку поражение надключичных или подмышечных лимфатических узлов не исключает возможности успешного лечения.

Гематологические и биохимические исследования исследования при опухолях с неизвестной первичной локализацией
Некоторые исследования проводят во всех случаях. К числу их относится анализ содержания щелочной фосфатазы и/или PSA в крови у мужчин старше 40 лет, позволяющий обнаружить карциному простаты. Определение уровня ХГЧ и АФП у больных молодого возраста позволяет обнаружить опухоли герминативного происхождения. Уровень АФП увеличивается также при гепатомах. При подозрении на миелому для выявления белков Бенс-Джонса необходимо провести электрофоретическое исследование плазмы крови и мочи.
При исследовании мазков крови может быть обнаружена лейкоэритробластная анемия, наиболее характерная для рака молочной железы. При карциноме почки и гепатоме отмечаются полицитемия и тромбоцитоз. Развитие гипокалиемии и гиперкальциемии свидетельствует о развитии синдрома Кушинга, который в данном случае, скорее всего, обусловлен мелкоклеточным раком легкого.
Прочие исследования
Для обнаружения эритроцитов необходимо провести анализ свежеполученных образцов мочи. Присутствие эритроцитов может указывать на карциному почки. Также могут оказаться полезными результаты определения сывороточных маркеров, однако диагностического значения они не имеют. При подозрении на карциному органов желудочно-кишечного тракта, исследуют уровень СЕА, а при подозрении на рак яичников — уровень СА-125.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Методы исследования в гистологии. Подготовка препаратов к микроскопии.
Методы исследования в гистологии включают приготовление гистологических препаратов и их изучение с помощью световых или электронных микроскопов. Гистологические препараты представляют собой мазки, отпечатки органов, пленочные препараты, тонкие срезы кусочков органов, окрашенные тем или иным красителем (исследуются также нативные — неокрашенные срезы), помещенные на предметное стекло, заключенные в бальзам и покрытые тонким покровным стеклом.
Для изготовления гистологического препарата необходимо после взятия материала произвести его фиксацию в том или ином фиксаторе (формалине, спирте, а для электронной микроскопии — в глутаровом альдегиде и четырехокиси осмия). Делается это для предотвращения процессов аутолиза и сохранения структуры органа, близкой к прижизненной. Далее следуют этапы обезвоживания кусочка органа в спиртах возрастающей концентрации и в ксилоле с целью уплотнения тканей, что необходимо для изготовления тонких срезов. Для придания кусочку органа еще большей плотности и гомогенности, обеспечивающей высококачественную резку, проводят его заливку в органическую среду — парафин, целлоидин (для световой микроскопии) и органические смолы (эпон, аралдит, дуркупан) — для электронно-микроскопического исследования.
Существуют также физические способы фиксации материала, наиболее распространенным из которых является быстрое замораживание кусочка органа с помощью жидко.го азота и других средств. Для резки замороженного материала используют специальные приборы — криостаты, или замораживающие микротомы.
Толщина срезов, предназначенных для световой микроскопии, не должна превышать 4-5 мкм, для электронной — 50-60 нм (такие ультратонкие срезы изготавливают на специальном приборе ультратоме, используя стеклянные или алмазные ножи и автоматический режим резки).

После получения срезов их помещают на предметные стекла, далее следуют этапы освобождения срезов от заливочной среды (при световой микроскопии) и окраски для придания срезам контрастности. Среди гистологических красителей наиболее часто употребляется сочетание гематоксилина, маркирующего ядро (кислотные молекулы), и эозина, избирательно окрашивающего белковые молекулы (цитоплазматический краситель).
По окончании окрашивания срезы заключают в консервирующие среды (канадский, кедровый бальзамы) и накрываются покровным стеклом.
Основным методом гистологического исследования клеток, тканей и органов является световая микроскопия. В световом микроскопе для освещения объекта используются лучи видимого спектра. Современные световые микроскопы позволяют получать разрешение порядка 0,2 мкм (разрешающая способность микроскопа — это то наименьшее расстояние, при котором две рядом расположенные точки видны как отдельные). Разновидности световой микроскопии — фазово-контрастная, интерференционная, поляризационная, темнопольная и др.
Фазово-контрастная микроскопия — метод изучения клеток в световом микроскопе, снабженном фазово-контрастным устройством. Благодаря смещению фаз световых волн в микроскопе такой конструкции повышается контрастность структур исследуемого объекта, что позволяет изучать живые клетки.
Интерференционная микроскопия. В интерференционном микроскопе падающие на объект световые пучки раздваиваются — один пучок проходит через объект, другой — идет мимо. При последующем воссоединении пучков возникает интерференционное изображение объекта. По сдвигу фаз одного пучка относительно другого можно судить о концентрациях различных веществ в исследуемом объекте.
Поляризационная микроскопия. В микроскопах этого типа световой пучок разлагается на два луча, поляризованных во взаимно перпендикулярных плоскостях. Проходя через структуры ткани со строгой ориентацией молекул, лучи запаздывают друг относительно друга вследствие неодинакового их преломления. Возникающий при этом сдвиг фаз является показателем двойного лучепреломления клеточных структур (таким способом были исследованы, например, миофибриллы).
Злокачественная опухоль образуется из неороговевающих клеток эпителия на участке от мягкого неба до подъязычной кости.
Анатомическое строение
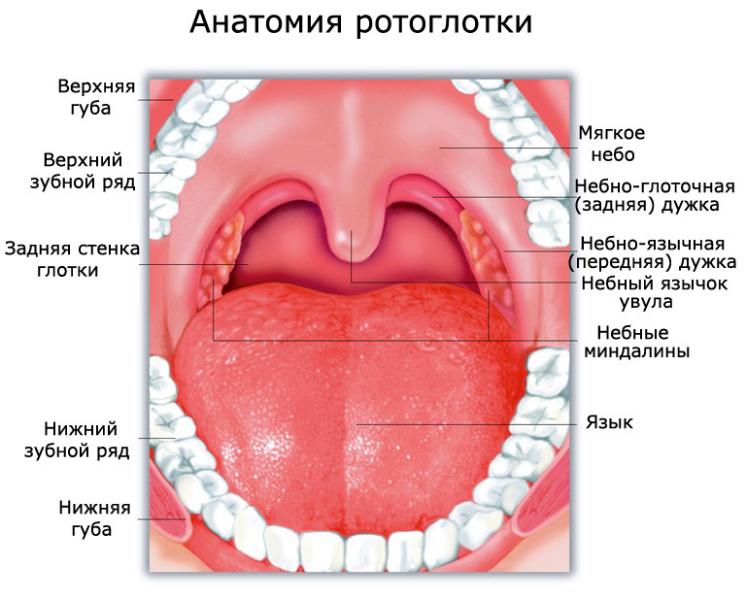
Ротоглотка – это продолжение носоглотки, средний отдел гортани. Она начинается от твердого неба и заканчивается у входа в гортань. Орган соединяется с полостью рта зевом, а отделяется небными дужками, мягким небом и спинкой языка. В этом отделе перекрещиваются пищеварительные и дыхательные пути. В состав ротоглотки входит:
- задняя треть языка (его корень);
- миндалины;
- задние и боковые стенки глотки. Задняя стенка находится на уровне третьего шейного позвонка. Боковые стенки соединяются с евстахиевыми трубами ушей.
Классификация
Опухоль в ротоглотке делится на три вида:
| Доброкачественные новообразования | Неопасные, но причиняют дискомфорт. Устраняются хирургически | Остеохондрома |
| Лейомиома | ||
| Эозинофильная гранулема | ||
| Остроконечная кондилома | ||
| Фиброма | ||
| Одонтогенные опухоли | ||
| Верруциформная ксантома | ||
| Гранулярно-клеточная опухоль | ||
| Пиогенная гранулема | ||
| Рабдомиома | ||
| Нейрофиброма | ||
| Шваннома | ||
| Кератоакантома | ||
| Папиллома | ||
| Липома | ||
| Предраковые состояния | Есть риск малигнизации, но иногда дисплазия самостоятельно регрессирует | Лейкоплакия. На слизистой возникают белесые или серые точки. Они выпячивают над поверхностью или остаются плоскими |
| Эритроплакия. Образуются красные пятна, которые кровоточат при легком прикосновении | ||
| Раковая опухоль, образующаяся из клеток неороговевающего эпителия | Врач индивидуально подбирает схему лечения | Карцинома, прорастающая только из поверхностного слоя эпителия. Диагностируется в 90% случаев, причем 60% связано с выявлением ВПЧ 16 или 18 штамма |
| Полиморфная низкосортная аденокарцинома | ||
| Аденоидная кистозная карцинома | ||
| Мукоэпидермальная карцинома | ||
| Лимфома |
Рисунок 1. Лейкоплакия
Рисунок 2.1. Эритроплакия
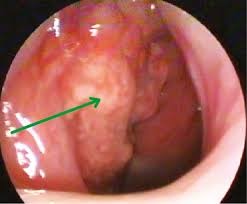
Рисунок 2.2. Эритроплакия
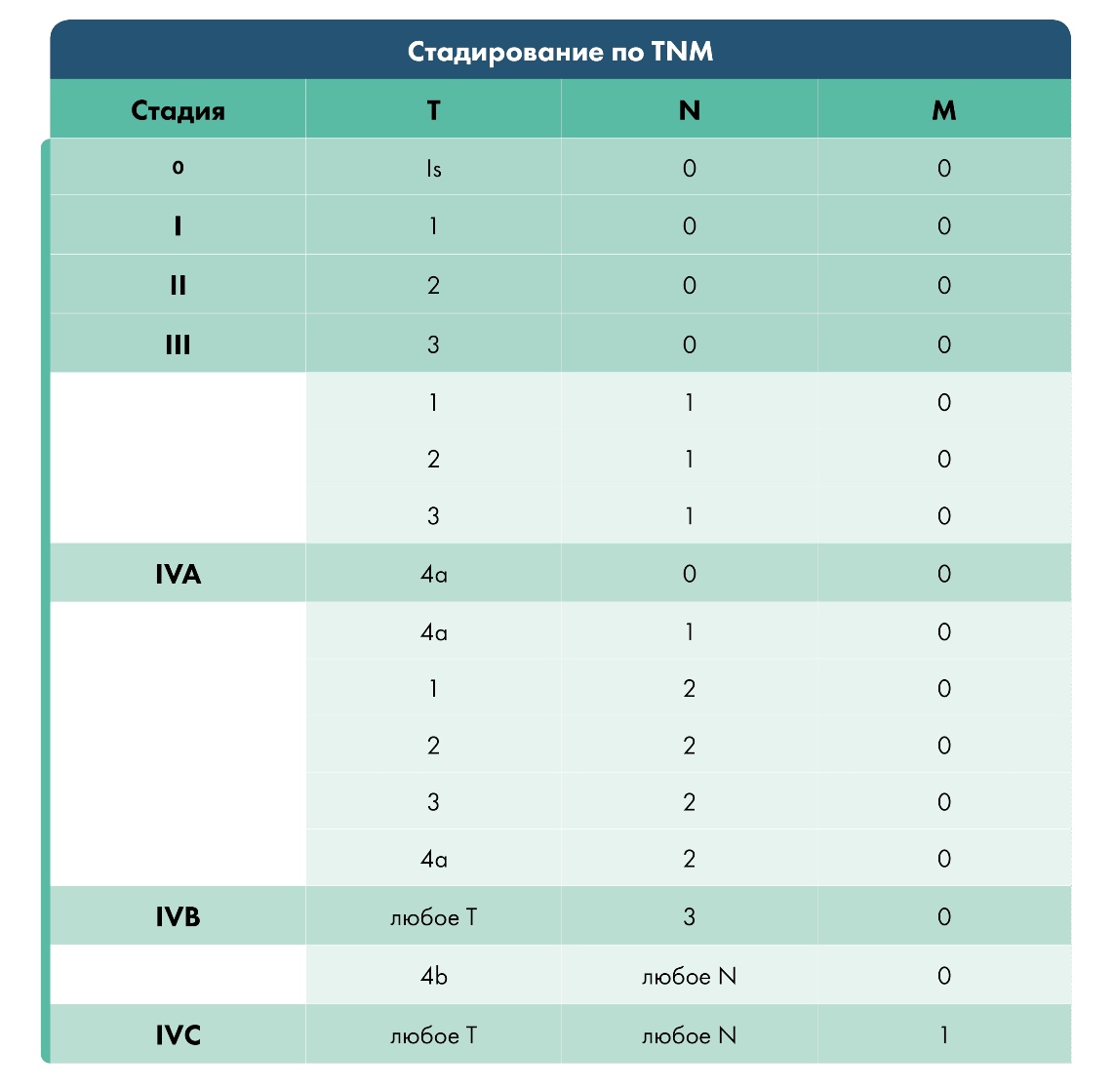
Классификация TNM

Причины возникновения
Заболеваемость раком ротоглотки достигла пика в 2015-2016 году. Диагноз ставился 13% заболевших от общего числа онкологических больных, при этом процент смертности достигал 7,5%. Смертность каждого второго больного обусловлена распространением раковых клеток в полости рта и глотки, а каждого третьего – распространением рака в гортани. На сегодняшний день заболеваемость снизилась и составляет 8,7%, но смертность остается по-прежнему высокой.
Основная причина рака ротоглотки – курение и употребление крепких спиртных напитков. Каждый третий больной является курильщиком со стажем. Токсические вещества в первую очередь проникают в глотку, систематически раздражая слизистую оболочку, разрушая костные структуры.
В группу риска входят:
- больные ВПЧ. Образование папиллом на слизистой рта и глотки может перерасти в онкологию, особенно при вирусе папилломы 16 штамма;
- пожилые люди;
- люди, которые подвергались мощному ультрафиолетовому излучению;
- ослабленный иммунитет. В эту группу относят ВИЧ-инфицированных, а также людей, которые длительное время проходили курс лечения иммуносупрессивными препаратами;
- больные врожденным дискрератозом и анемией Фанкони.
Симптомы
К сожалению, специфических признаков развития злокачественного новообразования в ротоглотке нет. Пациента должны насторожить следующие симптомы:
- длительно непроходящая боль в горле;
- ощущение инородного предмета в горле;
- дискомфорт при глотании пищи или слюны;
- сложность при пережевывании;
- белесые пятна на слизистой с красной каймой;
- онемение корня языка;
- шарик при пальпировании шеи;
- огрубевший или сиплый голос;
- неприятный запах изо рта;
- необоснованная потеря веса.
Коварство заболевания в латентном течении на первой стадии. Болезнь никак себя не проявляет, поэтому человек не обращается за медицинской помощью. Уже на 2-3 стадиях пальпируемый узелок на шее начинает болеть, ощущаться сильнее. Увеличиваются шейные лимфатические узлы. На 4 стадии рака ротоглотки нарушается дыхательный и глотательный процесс, опухоль распространяется на окружающие ткани. Болезнь обостряется кровохарканьем, стремительной потерей веса, истощением и анорексией. Иногда изо рта идет кровь. Если опухоль сдавила жевательные мышцы или нервные сплетения, движения мышц ограничивается.
Метастазы развиваются быстрее, чем сама опухоль.
Диагностика
После осмотра онколога и стоматолога назначается ряд обследований:
- анализ крови на ВПЧ. Исследование проводится методом ПЦР, секвенирования или ферментного анализа. Подтверждение вируса папилломы человека изменяет тактику лечения опухоли;
- эндоскопический осмотр гортани и ротоглотки методом ларинго- и фарингоскопии;
- цитологическое исследование. При ларингоскопии врач берет соскоб со слизистой и отправляет на анализ. Определяется клеточный состав опухоли;
- биопсия. Изъятый участок окрашивается эозином и гематоксилином, а затем наблюдается реакция на препарат;
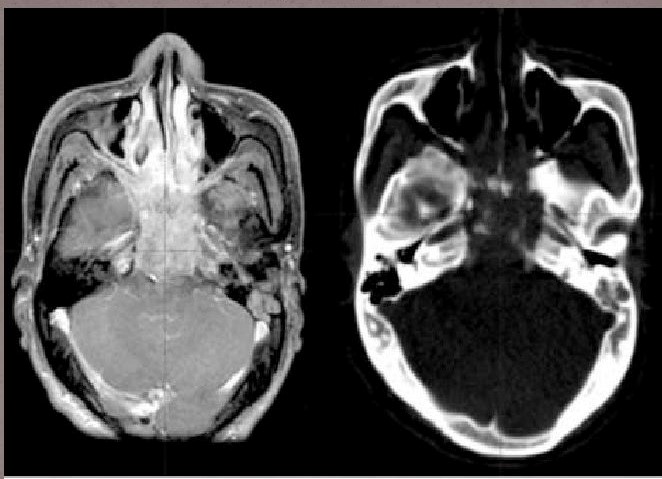
- КТ/МРТ. Томография уточняет локализацию и размер опухоли;
- ПЭТ. Показывает распространенность опухоли на окружающие органы, а также метастазирование в органы грудной клетки.
Лечение
В зависимости от стадии заболевания и состояния больного врач назначает химиотерапию, лучевую терапию, операцию, таргетную терапию, иммунотерапию в комбинации друг с другом или отдельно.
Как правило, при операции врачи стараются сохранить орган, если раковые клетки не метастазировали. Если выявлены метастазы в лимфатических узлах, сосудах или клетки проросли в нервный ствол, проводится химиотерапия совместно с облучением. Таргетная терапия используется при раке ротоглотки, вызванном ВПЧ-ассоциированным плоскоклеточным раком. Исходя из практики, в этом случае результаты благоприятные.
После окончания курса лечения пациенты наблюдаются у онколога и стоматолога. Посещение врачей обязательно каждые 3-6 месяцев в течение первых двух лет. Следующие пять лет осмотр проводится раз в полгода-года. Последующие пять лет пациент посещает врача раз в год или чаще при недомогании. Во время посещения доктор анализирует состояние больного, учитывая результаты фиброскопии, ежегодной рентгенографии органов грудной клетки, УЗИ лимфатических узлов, органов малого таза и органов брюшной полости.
Профилактика
Предотвратить онкологию можно, выполняя ряд рекомендаций специалистов. Прежде всего, важно правильно ухаживать за полостью рта и своевременно посещать стоматолога. Врач дважды в год поддерживает чистоту зубов и следит за состоянием десен и мягких тканей.
Поскольку ВПЧ – весомый фактор в развитии рака ротоглотки, важно снизить риск заражения. Для этого необходимо исключить беспорядочные половые связи и ставить вакцину.
Специалисты рекомендуют отказаться от вредных привычек и полностью бросить курить. Сразу после еды необходимо ополаскивать полость рта, а зубы чистить дважды в день. Рациональное питание – залог здоровья, поэтому ежедневно следует потреблять больше овощей и фруктов, кушать цельнозерновой хлеб, а от переработанного мяса, бобовых и курятины лучше отказаться.
Список литературы:


Авторская публикация:
Керимова С. Н.
Ординатор отделения опухолей головы и шеи
НМИЦ онкологии им Н.Н. Петрова

Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Читайте также:

