Гликопротеины это вирус или
Обновлено: 18.04.2024
Внутри вириона гриппа А находятся восемь сегментов вирусной РНК. Эти молекулы несут всю необходимую информацию для образования новых частиц вируса гриппа. Эти восемь РНК схематично показаны желто-зелеными линиями в верхней части рис. 2. РНК представляют собой цепи из четырех различных нуклеотидов – A, C, G и U. В случае с вирусом гриппа восемь РНК имеют длину порядка 14000 нуклеотидов. Нуклеотиды составляют генетический код, который считывается преобразующим механизмом клетки в триплеты, определяющие аминокислоту.
Необходимо рассмотреть два важных аспекта этих вирусных РНК. Во-первых, вы можете видеть, что концы вирусных РНК помечены как 3′ и 5′. Нуклеиновые кислоты обладают полярностью, так что один конец цепи имеет отличные химические свойства от другого. Эта полярность представлена как 3′ и 5′. Во-вторых, во время копирования, или удвоения, нуклеиновой кислоты ферментами, которые носят название полимераз, появляется нить с комплементарной полярностью. Вирусные РНК гриппа называются (-), или РНК с отрицательной нитью, поскольку они представляют собой отрицательную полярность РНК с трансляцией в белок. Молекулы РНК, являющиеся образцами для синтеза белков, называются (+), или положительной полярностью. После вхождения в клетку отрицательная нить (-) вирусной РНК гриппа должна скопироваться в комплементарные (+) нити, так что они могут служить образцом для белков. Вирусные РНК копируются ферментом (РНК-полимеразой), который привносится в клетку вместе с вирусом.
На рис. 2 желто-зелеными линиями обозначены обнаруженные в вирионе гриппа РНК с отрицательными нитями. Как только вирион входит в клетку, эти восемь РНК копируются в положительную нить мРНК. Наконец, мРНК может служить образцом для синтеза белков. Специфические вирусные белки, производимые каждой вирусной мРНК, показаны в нижней части рис. 2. Видно, что, например, сегмент 4 РНК несет информацию о вирусном белке HA, а сегмент 6 – о вирусном белке NA. Заметьте, что некоторые сегменты РНК несут информацию более чем об одном белке. Вирусы гриппа субтипов А и B имеют восемь сегментов РНК, тогда как субтипа C – только семь.
Вирусы гриппа называются РНК-вирусами с отрицательной нитью из-за полярности РНК, привносимой в вирион. Другие РНК-вирусы, такие как полиовирус, являются РНК-вирусами c положительной нитью, так как их геномная РНК может преобразовываться в белок сразу после вхождения в клетку.
1.3. Субтипы A, B и C вируса гриппа
рисунок). Оболочечные вирионы с шестиугольной структурой на поверхности формируют длинную (500 микрон) напоминающую шнур структуру при отпочковании от клетки (рис. 4). Как и в случае с вирусами гриппа A и B, ядро вируса гриппа C состоит из рибонуклеопротеина, созданного из вирусной РНК и 4 белков. Белок M1 расположен под мембраной, как и в вирионах гриппа A и B. Второстепенный вирусный оболочечный белок CM2 функционирует как ионный канал. Основной оболочечный гликопротеин вируса гриппа C называется HEF (слияние гемагглютинина и эстеразы – hemagglutinin-esterase-fusion), поскольку он обладает функциями и HA, и NA. Поэтому вирион гриппа содержит 7 сегментов РНК, а не 8, как вирусы гриппа субтипов A и B.
Практически все взрослые когда-либо заражались вирусом гриппа C, вызывающим мягкое течение болезни в верхних дыхательных путях. Осложнения с переходом на нижние дыхательные пути – редкость. Против вируса гриппа C не существует вакцины.
Мне достаточно хорошо знакомы вирусы гриппа B и C – я получил степень доктора наук за их изучение. В моей работе говорится, что геном вируса гриппа C состоит из 7 сегментов РНК, и показана рекомбинация среди различных штаммов вируса гриппа C.
Рисунок 4.
Рекомендуемая литература.
- Hatta, M., & Kawaoka, Y. (2003). The NB Protein of Influenza B Virus Is Not Necessary for Virus Replication In Vitro Journal of Virology, 77 (10), 6050-6054 DOI:10.1128/JVI.77.10.6050-6054.2003.
- RacanielloVR, & Palese P (1979). Isolation of influenza C virus recombinants. Journal of Virology, 32 (3), 1006-14 PMID: 513198.
1.4. РНК вируса гриппа: трансляция в белок
Рисунок 6.
Рисунок 7.
Последовательности, взятые нами для образца, принадлежат штамму 1918 H1N1 вируса гриппа. Обратите внимание на аминокислоту PB1-F2, выделенную синим цветом. Эта аминокислота играет важную роль в биологическом функционировании белка, которую мы еще рассмотрим впоследствии.
Эпидемиология герпесвирусов. Строение герпесвирусов.
Герпесвирусы могут передаваться от одного поколения хозяев к другому благодаря персистенции, часто латентной инфекции, при которой вирус периодически реактивируется и выделяется из организма. При некоторых герпесвирусных инфекциях выделение вируса может быть фактически непрерывным. Молекулярное филогенетическое изучение подтверждает, что, за небольшими исключениями, каждый вирус является уникальным, потому что он происходит от своего видового хозяина. Латентность позволяет герпесвирусам быть пожизненными даже в очень небольшой изолированной группе хозяев.
Попытки разработать критерии классификации герпесвирусов внутри семейства пока не увенчались успехом. Существующая классификация основана на их естественном паразитизме.
В зависимости от биологических свойств герпесвирусы делятся на 4 подсемейства, 3 из которых имеют названия альфа-, бета-, гаммагерпесвирусы и одно - без названия, объединяющие герпесподобные вирусы.
Подсемейство альфагерпесвирусы включает герпесвирусы 1 и 3 человека, герпесвирус 1 кур и вирус болезни Марека. Большинство альфагерпесвирусов размножаются быстро (цикл репликации меньше 24 ч) и вызывают латентную инфекцию первоначально в сенсорных ганглиях. Подсемейство бетагерпесвирусы представлено цитомегаловирусами многих видов млекопитающих. Прототипным вирусом является герпесвирус человека 5 — цитомегаловирус человека. Вирусы этого подсемейства размножаются медленно (цикл репликации более 28 ч) и вызывают лизис клеток спустя несколько дней. Они могут оставаться латентными в секреторных железах, лимфоретикулярных тканях, почках и других органах. Подсемейство гаммагерпесвирусы представляет лимфотропные вирусы. Прототипом является герпесвирус человека 4 — вирус Эпштейн-Барр. Гаммагерпесвирусы обладают узким хозяинным спектром и находятся латентно в лимфоцитах (лимфома Беркитта и др.), некоторые представители вызывают инфекцию с разрушением клеток эпителия и фибробластоидных клеток.
Вирионы герпесвирусов имеют диаметр около 120—150 нм и состоят из 4 структурных компонентов: сердцевины (ядра), содержащей линейную двуцепочечную ДНК размером 125—235 тпн, икосаэдрического нуклеокапсида диаметром 100-110 нм, содержащего 162 капсомера; аморфного материала (тегумент), окружающего капсид и оболочки с небольшими гликопротеиновыми выступами (пепломерами) на поверхности.

Тяжелый гингивостоматит вызванный герпесвирусом
ДНК-геном закручен вокруг волокнистого ядра, имеющего вид катушки, которая прикреплена волокнами к внутренней поверхности окружающего капсида. Вирусный геном в соответствующих экспериментальных условиях обладает инфекционностью.
Сердцевина вириона окружена икосаэдрическим капсидом, содержащим 162 частично полых капсомера (12 пентамеров и 150 гексамеров). Капсомеры высотой 12,5 нм и диаметром 9,5 нм имеют внутренний осевой канал диаметром 4 нм, простирающийся внутрь на половину длинной оси капсомера.
Количество гликопротеинов в оболочке герпесвирусов варьирует. В оболочке вируса простого герпеса их не менее 11. Число копий индивидуальных гликопротеинов может превышать 1000 на вирион. Содержание полипептидов в вири-оне точно не известно и различается у разных герпесвирусов. В общем, оно колеблется в пределах 35—45 полипептидов.
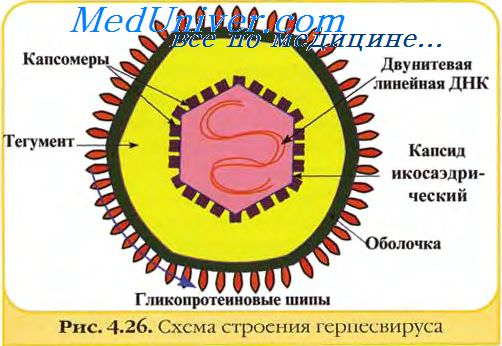
Все герпесвирусы кодируют широкий набор ферментов, связанных с метаболизмом нуклеиновых кислот, синтезом ДНК и процессингом белков. Синтез вирусных ДНК и сборка вирионов происходят в ядре клетки. Капсиды покрываются оболочкой, проходя через мембрану ядра. Образование инфекционного вирусного потомства сопровождается деструкцией зараженных клеток. Вероятно, что некоторые кодируемые вирусом белки играют заметную роль в патогенезе и иммунитете при герпесвирусной инфекции, не являясь необходимыми для репликации вируса в культуре клеток. Считают, что геномы герпесвирусов в латентном состоянии в клетках хозяина существуют в циркулярной эписомальной (экстрахромосомальной) форме.
Репликация герпесвирусов наиболее детально изучена на примере герпесвируса 1 человека (вирус простого герпеса 1). После прикрепления вириона путем связывания пепломерных гликопротеинов оболочки с рецепторами клетки, одним из которых является гепаринсульфатпротеогликан, нуклеокапсид входит в цитоплазму путем слияния оболочки вириона с мембраной клетки путем эндофагоцитоза. Затем ДНК-белковый комплекс освобождается от нуклеокапсида и быстро останавливает синтез макромолекул клетки.
Геном ВПГ-1 (153 тпн) содержит три области инициации-репликации. Он практически кодирует все гены, необходимые для репликации, кроме ДНК-лигазы и топоизомеразы. На первом этапе репликации функционирует ДНК-полимераза а, а затем функционирует вирусная ДНК-полимераза.
Три класса мРНК — а, (3 и 7-транскрибируются последовательно клеточной РНК полимеразой II. Таким образом а (ранние) РНК в последующем функционируют как мРНК и транслируются в а-белки, которые вызывают транскрипцию (3 (ранних) мРНК, трансляция которых приводит к синтезу (3 (ранних) белков и подавляет дальнейшую транскрипцию а мРНК. Затем начинается репликация вирусной ДН К с использованием тех же самых аир протеинов, так же как протеинов клетки. Транскрипционная программа затем возобновляется, и в результате появляются 7 (поздние) мРНК, которые транслируются в 7 протеины. Более 70 белков, кодируемых вирусом, образуются в цикле его репродукции, многие из а и (3 белков являются ферментами и белками, связанными с вирусной ДНК, тогда как 7 белки являются структурными вирионными компонентами. Сложный контроль регуляции экспрессии осуществляется на уровне транскрипции и трансляции. Вирусная ДНК реплицируется в ядре, и вновь синтезированная ДНК упаковывается в преформированные незрелые капсиды. Созревание вирионов связано с вхождением ДНК в нуклеокапсиды и связыванием нуклеокапсидов с измененным внутренним слоем оболочки ядра и последующим обволакиванием вирионов при почковании. Зрелые вирионы накапливаются внутри вакуолей в цитоплазме и освобождаются экзоцитозом или при цитолизе. Вирусспецифические белки обнаружены также в цитоплазматической мембране, где они участвуют в клеточном слиянии и могут в качестве Fc-рецепторов выступать мишенями в иммунном цитолизе. Герпесвирусная инфекция сопровождается образованием внутриядерных телец включений, которые обычно обнаруживают в фиксированных окрашенных препаратах.
Геном вируса кодирует синтез по меньшей мере четырех гликопротеинов (gB, gC, gD, gE). Имеет место посттрансляционное расщепление или другие модификации вирусных белков. Белок gB обладает фузогенной активностью и ответственен за проникновение вируса в клетку; gD — основной протективный антиген.
Белки gC и gE не играют существенной роли в репродукции вируса, но помогают ему ускользнуть от иммунной системы организма. В отсутствие репликации вирус редко вызывает сплавление клеток, а при наличии специфических условий — агглютинацию эритроцитов. Оболочка вириона играет существенную роль в антигенности и инфекционности вируса. Гликопротеины вирусной оболочки ответственны за прикрепление вирусной частицы к клетке, проникновение вируса в клетку, за индукцию нейтрализующих антител и образование иммунитета. Нейтрализующие антитела реагируют с главными вирусными гликопротеинами, находящимися в оболочке вириона. Мембранные антигены, индуцированные в зараженных клетках, содержат по крайней мере три гликопротеина, обнаруженных в структуре вириона. Эти данные послужили основанием для приготовления вакцин из вирусспецифических компонентов. Однократное введение вакцины из субъединиц приводило к активизации гуморальных и клеточных факторов иммунитета у мышей и кроликов, повышало их резистентность к экспериментальному заражению и снижало количество клеток ганглия тройничного нерва, несущих геном вируса.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Морфология вируса иммунодефицита человека. Антигены вируса иммунодефицита человека.
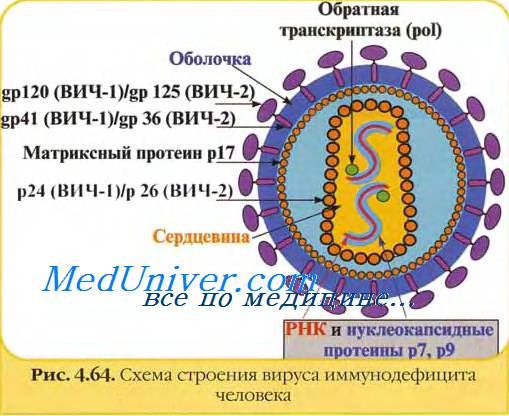
Зрелые вирионы вируса иммунодефицита человека имеют сферическую форму, их размеры не превышают 100-120 им в диаметре. Геном вируса иммунодефицита человека образуют две нити +РНК; их связывают белки рб и р7 (цифра соответствует молекулярному весу в кД).
Капсид вируса иммунодефицита человека образует белок р24. Сердцевина вириона вируса иммунодефицита человека имеет цилиндрическую или конусовидную формы; её формируют белки р18 и р24.
В сердцевине вируса иммунодефицита человека располагаются РНК, внутренние белки (р7 и р9), обратная транскриптаза (димер из белков р66 и p51) и эндонуклсаза (р31). Матричный белок р17 формирует прослойку между сердцевиной вириона и внешней оболочкой.
Суперкапсид вируса иммунодефицита человека образован двойным липидным слоем, который пронизывают гликопротсиновыс шипы. Каждый шип состоит из белков gp41 и gp 120. Гликопротеины gpl20 локализованы в выступающей части шипа и взаимодействуют с молекулами CD4 на мембранах клеток.
Гликопротеины gp41 (белки слияния) вируса иммунодефицита человека располагаются внутри оболочки и обеспечивают её слияние с клеточной мембраной.
Антигенная структура вируса иммунодефицита человека
У вируса иммунодефицита человека главными антигенами выступают группо- и видоспецифичные антигены [сердцевинные (gag-) белки p24; типоспецифичные антигены [оболочечные (env-) белки gp41 и gp120].
В соответствии с их структурой выделяют два типа и более 10 сероваров вируса иммунодефицита человека. Вирус иммунодефицита человека отличается высокой антигенной изменчивостью, и в результате сбоев обратной транскриптазы из организма больного можно выделить серологически различные вирусы.
Главные антигены вируса иммунодефицита человека — поверхностные gp41 и gpl20, a также сердцевинный (ядерный) gp24.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Обзор
здесь и далее рисунки Андрея Занкевича
Автор
Редактор

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Напомним, что РНК (рибонуклеиновая кислота) — это такая молекула, представляющая собой одну цепочку нуклеотидов. В составе каждого нуклеотида присутствует остаток моносахарида рибозы. На сегодняшний день известно множество разных типов РНК, которые выполняют совершенно разные функции: от кодирования клеточных белков (мРНК) до противовирусной защиты (некоторые микроРНК) [1–5]. РНК, входящие в состав многих вирусов, могут иметь ряд оригинальных функций, таких как регуляция времени экспрессии различных вирусных генов путем изменения пространственной организации цепи РНК или привлечение клеточных белковых комплексов.
Но бывает ли такое, что в пределах одной молекулы РНК одна ее часть, кодирующая некоторый белковый продукт, имеет положительную полярность, в то время как другая часть цепи представлена участком отрицательной полярности, кодирующим другой белок? Могла ли такая молекула возникнуть в процессе эволюции живых форм?
Ответ — да! И для того, чтобы разобраться, как функционируют такие молекулы, нам предстоит погрузиться в таинственный мир вирусов.
Давным-давно, в далекой-далекой галактике.
Как известно, все формы жизни обладают определенной наследственностью, которая определяет степень генетической идентичности живых объектов. В качестве молекул, ответственных за поддержание такой наследственной идентичности, выступают нуклеиновые кислоты (ДНК и РНК). Клеточные формы жизни для хранения и передачи информации используют только один тип нуклеиновых кислот — дезоксирибонуклеиновую кислоту (ДНК), в то время как вирусы в качестве основной молекулы наследственности могут использовать либо ДНК, либо РНК.
В случае ДНК-содержащих вирусов реализуется, как правило, Центральная догма молекулярной биологии в классическом виде: попав в клетку, ДНК удваивается в процессе репликации вирусного генома, на матрице ДНК в ходе транскрипции синтезируются мРНК, которые затем прочитываются рибосомой, синтезирующей по ним вирусные белки, то есть осуществляется трансляция. Далее вирусные белки ассоциируются с ДНК-геномом вируса в вирусную частицу (вирион), которая способна заражать новые клетки.
Очевидно, что РНК-содержащие вирусы используют иные стратегии размножения и, следовательно, реализации своего генома. Непривычные для большинства биологов молекулярные механизмы, которые используются такими вирусами, вероятно, унаследованы от далеких предков из того самого РНК-мира.
Размножение РНК-вирусов подразумевает использование разных типов РНК:
- геномная РНК находится внутри вириона, в зависимости от конкретного вируса, она может быть представлена (+)РНК, (–)РНК, (±)РНК, либо двухцепочечной РНК;
- комплементарная геномной РНК антигеномная РНК образуется в процессе репликации вирусов с одноцепочечным РНК-геномом и обладает полярностью, противоположной геномной РНК;
- субгеномная РНК (вирусная мРНК) имеет (+)полярность и является продуктом транскрипции геномной или антигеномной РНК. Как и подобает мРНК, субгеномная РНК участвует в процессе трансляционного синтеза белка.
Немного истории
Первым найденным РНК-вирусом стал бактериофаг f2, инфицирующий бактерию кишечную палочку (Escherichia coli) [7]. Выделенная геномная РНК фага f2 имела свойства мРНК, то есть она распознавалась рибосомой и могла транслироваться. На родственном РНК-бактериофаге Qβ была изучена РНК-зависимая РНК-полимераза (RdRp), которая, как оказалось, может синтезировать цепь РНК на матрице другой цепи РНК, то есть осуществлять репликацию вирусного РНК-генома! В ходе работы с РНК-бактериофагами f2 и его родственником Qβ были получены общие представления о биологии таких РНК-вирусов [8].
После РНК-бактериофагов были найдены (+)РНК-вирусы животных, такие, как вирус полиомиелита [9], [10], представитель группы пикорнавирусов. Подобные вирусы не содержат репликативных белков в составе вирусной частицы (вириона).
Встречаются вирусы, геном которых представлен двухцепочечной РНК. Как и в случае (–)РНК-вирусов, у дцРНК-вирусов во время репликации в клетке первым делом происходит синтез (+)цепи. Вирусные частицы этой группы также включают в свой состав RdRp.
Вирусы с двусмысленным РНК-геномом из семейства Bunyaviridae

Рисунок 1. Схематичное изображение структуры вириона флебовирусов
В семействе Bunyaviridae роды Phlebovirus, Tospovirus и Tenuivirus являются вирусами с двусмысленным РНК-геномом и, в отличие от остальных представителей семейства, имеют чуть более длинный S-сегмент генома (РНК S) (±)полярности. Род Tospovirus имеет вдобавок (+)участок на РНК M, который делает и эту РНК амбисенсной.
Флебовирусы
Вирусы рода Phlebovirus выделяют практически по всему миру и относят к нетаксономической группе арбовирусов, распространяющихся в членистоногих переносчиках и в позвоночных, на которых питаются переносчики. Члены этого рода переносятся кровососущими членистоногими. Инфекции не обходят стороной человека: вирусы сицилийской и неаполитанской москитных лихорадок широко распространены по территории Средиземноморья [15]. Среди симптомов таких инфекций — продолжительная сильная лихорадка, тошнота, рвота, диарея и головные боли. Вирус Тосканы, также переносимый москитами, обладает способностью проникать в нервную ткань и, вдобавок к вышеперечисленным симптомам, вызывает асептический менингит и менингоэнцефалит. Флебовирусы, переносимые клещами, например, вирус Бханджа, вирус тяжелой лихорадки с синдромом тромбоцитопении, или вирус Хартленд, вызывают серьезные вспышки инфекций среди людей [16].
Эти вирусы получили свое имя от латинского названия москитов (Phlebotominae), которые являются их основными переносчиками. Вирионы флебовирусов имеют диаметр 100-125 нанометров. Внутри вириона находятся три вирусных рибонуклеопротеина (вРНП), содержащих геномные сегменты, однако для вируса лихорадки долины Рифт (RVFV) было показано [17], что вирионы также могут содержать ещё три дополнительных вРНП, образованных цепочками антигеномных РНК, комплементарных геномным вирусным РНК. Рецептор-распознающий аппарат вирусов представлен гетеродимерами гликопротеинов Gn и Gc, которые организованным способом распределены по мембране вириона.
Структура генома флебовирусов
Геном флебовирусов как и других представителей семейства Bunyaviridae, включает три молекулы РНК: PHК L, РНК M, РНК S, имеющие на 5′- и 3′- концах уникальные для каждого геномного сегмента комплементарные последовательности. РНК L (–)полярности кодирует белок репликазы L. (–)РНК M кодирует предшественник гликопротеинов G1 и G2. (±)РНК S кодирует белок нуклеокапсида N на (–)полярном участке (ближе к 3′) и неструктурный белок NSs на (+)полярном участке (ближе к 5′) (рис. 2).

Рисунок 2. Схема структуры генома флебовирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
NSs выполняет ряд функций, среди которых подавление индукции интерферона, усиление репликации и транскрипции вирусной РНК и определение круга хозяев [18]. NSs через цепочку белковых факторов способен приводить к инактивации противовирусной протеинкиназы R организма-хозяина [19].
Механизмы транскрипции и репликации РНК флебовирусов
Остановка транскрипции (–)участка РНК S определяется межгенным сигналом терминации. Похожие сигналы терминации находятся в 5′-концевой области РНК M и РНК L. В результате синтезируются кэпированные, но неполиаденилированные (и, следовательно, не такие стабильные, как клеточные мРНК) субгеномные РНК [18]. Также было показано [17], что в инфицированных клетках наблюдается ранняя экспрессия белка NSs, к тому же при детальном анализе состава вирионов обнаружили, что в вирусную частицу может упаковываться как три геномных цепи, так и еще три антигеномных цепи. Считается, что антигеномная РНК S присутствует в вирионе для осуществления ранней транскрипции мРНК, кодирующей NSs, поскольку этот неструктурный белок способен регулировать клеточные процессы, и чем раньше он начнёт работать в зараженной клетке, тем интенсивнее будет протекать вирусная инфекция.
Жизненный цикл флебовирусов
Жизненный цикл состоит из следующих стадий (рис. 3):

Рисунок 3. Схема, демонстрирующая основные этапы цикла флебовируса
Тосповирусы и тенуивирусы
Название рода Tospovirus происходит от сокращения названия вируса пятнистого увядания томатов (tomato spotted wilt virus, ТоSWV), впервые выделенного в 1930 году из зараженных растений томата. Этот вирус имеет очень широкий спектр хозяев и важное хозяйственное значение, борьба с ним ведется, в основном, за счет контроля численности трипсов.
Структура генома тосповирусов и тенуивирусов
Представители родов Тospovirus и Tenuivirus (тенуивирусы близки к тосповирусам, но не имеют липидной оболочки) являются единственными известными РНКвирусами растений с двусмысленным геномом [23]. Геном тосповирусов представлен тремя РНК-сегментами: большим, средним и малым (L, M, S). РНК L кодирует репликазу L. РНК S, подобно таковой у флебовирусов, кодирует белок нуклеокапсида N в (–)области и неструктурный белок NSs в (+)области. Эти области не пересекаются, они разделены межгенным некодирующим участком, содержащим сигналы терминации транскрипции. М-сегмент генома имеет принципиально отличную от РНК М флебовирусов структуру, являясь амбисенсной РНК. РНК М тосповирусов имеет область (–)полярности, в которой находится последовательность, кодирующая мРНК GnGc — предшественника поверхностных гликопротеинов, а также участок (+)полярности в 5′-области, кодирующий белок межклеточного транспорта NSm. Эти последовательности также разделены межгенным участком (рис. 4). Механизмы транскрипции и репликации РНК этих вирусов сходны с таковыми у флебовирусов [18].

Рисунок 4. Схема структуры генома тосповирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
Отдельного внимания заслуживает неструктурный белок, закодированный в S-сегменте генома тосповирусов — NSs. Основной его функцией является супрессия противовирусного сайленсинга РНК, системы малых интерферирующих РНК [5], [24], распознающих вирусные РНК, что приводит к деградации последних [25]. Логично предположить, что синтез такого белка должен происходить как можно раньше, поэтому, возможно, по аналогии с белком NSs флебовирусов, ранняя транскрипция такой последовательности происходит в результате наличия в вирионе, помимо геномной цепи РНК S, еще и соответствующей ей антигеномной.
Вирусы с двусмысленным РНК-геномом из семейства Arenaviridae
Помимо семейства Bunyaviridae, амбисенсные РНК имеют представители семейства Arenaviridae. Аренавирусы являются таксономической группой вирусов позвоночных с сегментированным двусмысленным РНК-геномом. Вирусы, инфицирующие млекопитающих, определены в род Mammarenavirus, а заражающие рептилий — в роды Reptarenavirus и Hartmanivirus [26].
Вирионы аренавирусов, как и рассмотренных выше буньявирусов, плеоморфны, а их диаметр может варьировать от 40 до 200 нанометров в зависимости от вида, однако и частицы одного вида могут заметно различаться по размерам [27]. Границы вириона представлены липопротеидной оболочкой — производной клеточной мембраны, модифицированной равномерно распределёнными гликопротеиновыми комплексами (гетеродимерный гликопротеин GP1/GP2). Гликопротеины синтезируются в виде предшественника, который разрезается примерно пополам клеточной протеиназой на рецептор-распознающую субъединицу GP1 и трансмембранную субъединицу GP2. Последняя ответственна за слияние мембран при проникновении в цитоплазму [28]. В вирионе гликопротеины ассоциированны с лежащими на внутренней стороне мембраны молекулами матриксного белка Z, выстилающего внутреннюю поверхность мембраны, и белка нуклеокапсида N. Белок N способен связываться с РНК, распознавать кэп и ингибировать интерфероновый ответ. Структурный белок Z в клетке выполняет ряд функций (в том числе ингибирование трансляции клеточных мРНК и подавление апоптоза), являясь фактором созревания вирусных частиц (отвечает за инициацию сборки вирионов и за их отпочковывание).
Во время сборки вирусных частиц при формировании внешней оболочки иногда происходит захват субъединиц клеточных рибосом, по всей видимости, не играющих роли в вирусной инфекции (рис. 5).

Рисунок 5. Схематичное изображение структуры вириона аренавирусов
Значительная часть представителей семейства вызывает хронические и, как правило, бессимптомные инфекции у грызунов. При контакте человека с такими вирусами может развиваться острая и тяжелая инфекция, часто — геморрагическая лихорадка (например, в случае инфекции вирусом лихорадки Ласса, LasV). Вирус лимфоцитарного хориоменингита (LCMV), первый выделенный аренавирус, является нейроинвазивным. Попав в организм человека (например, через выделения грызунов), вирионы с током крови преодолевают гематоэнцефалический барьер центральной нервной системы и вызывают воспаления мозговых оболочек [29].
Структура генома аренавирусов

Рисунок 6. Схема структуры генома аренавирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирными линиями обозначены сайты протеолиза белковых продуктов.
РНК L на (–)участке несет последовательность, комплементарную гену репликазы L, и рамку матриксного и регуляторного белка Z на (+)участке в 5′-концевой части геномной РНК.
РНК S кодирует белок нуклеокапсида N в области (–)полярности и содержит рамку считывания GP1GP2 — предшественника поверхностных гликопротеинов GP1/GP2 (также в 5′-концевой части геномного сегмента).
Транскрипция и репликация генома аренавирусов
Переключение на репликацию связано с наличием белка N: когда его накапливается такое количество, что он начинает покрывать строящиеся цепи РНК, это, вероятно, влияет на конформацию репликазы и приводит к проскоку сигналов терминации транскрипции в виде межгенных шпилек. РНК S при репликации накапливается в больших количествах, так как нужно много копий белка нуклеокапсида, а также гликопротеинов (для экспрессии последних необходим предварительный синтез антигеномной РНК).
Заключение
Такая необычная организация двусмысленных геномных сегментов является интересным способом представления двух кодирующих последовательностей в одном геномном сегменте. На примере вирусов с двусмысленными РНК-геномами заметно, насколько изобретательной может быть эволюция вирусных РНК. Поскольку вирусы с двусмысленными РНК-геномами до сих пор удерживают определенную нишу, можно утверждать, что такой способ кодирования обладает некоторыми преимуществами по сравнению с более привычным для родственных вирусов способом, использующим только (–)РНК-сегменты.
Как возникли амбисенсные РНК и почему поддержались отбором, до сих пор остается одной из загадок современной вирусологии.
Благодарности от автора
Я благодарю доктора биологических наук, профессора кафедры вирусологии биологического факультета МГУ им. М.В. Ломоносова Аграновского Алексея Анатольевича за интересные и содержательные лекции по молекулярным процессам РНК-вирусов и вдохновение на написание данной статьи. Также выражаю благодарность художнику Андрею Занкевичу, чьи наглядные и яркие иллюстрации украшают данную статью.
Читайте также:

