Гормональные нарушения при гепатите
Обновлено: 19.04.2024
Миома матки (ММ) относится к истинным доброкачественным опухолям гормонально зависимых органов. Ее распространенность колеблется в широких пределах. По данным литературы, каждая четвертая-пятая женщина в мире больна миомой матки
Миома матки (ММ) относится к истинным доброкачественным опухолям гормонально зависимых органов. Ее распространенность колеблется в широких пределах. По данным литературы, каждая четвертая-пятая женщина в мире больна миомой матки [40, 57]. Несмотря на низкую вероятность малигнизации (1%), до 2/3 пациенток, страдающих миомой матки, подвергаются оперативному лечению, причем 60–96% всех операций являются радикальными и приводят к потере репродуктивной и менструальной функции у женщин. Это впоследствии становится основной причиной развития нарушений в гипоталамо-гипофизарно-яичниковой системе, а также вегетососудистых и психоэмоциональных сдвигов [6, 14].
Фоном для усиленного роста миоматозных узлов в пременопаузальном периоде считаются длительные нейроэндокринные нарушения, патологический климакс, действие факторов, стимулирующих гиперпластические процессы в организме, а также различные метаболические расстройства (ожирение, нарушение липидного и углеводного обменов и т. д.) [6, 14, 17].
Миома матки часто сочетается с различными экстрагенитальными заболеваниями: ожирением (64%), заболеваниями сердечно-сосудистой системы (60%), функциональными нарушениями желудочно-кишечного тракта (40%); гипертонической болезнью (19%), неврозами и неврозоподобными состояниями (11%), эндокринопатиями (4,5%). Избыточный вес женщины в сочетании с низкой физической активностью и частыми стрессами относятся к факторам, способствующим появлению ММ. Кроме того, при оценке риска возникновения миомы матки не исключается генетическая предрасположенность ее развития [58].
В клинической практике важное значение имеет характер опухолевого роста. Опухоли матки разделяются по тканевому составу — миомы, фибромы, ангиомы и аденомиомы — в зависимости от содержания в них соединительной ткани и степени развития сосудистого компонента. Выделяют простые и пролиферирующие опухоли, последние встречаются у каждой четвертой больной с миомой матки.
ММ следует рассматривать как дисрегенераторный пролиферат поврежденного миометрия, а не опухоль [24, 38, 58].
Известно, что в миометрии вокруг тонкостенного сосуда сразу закладываются несколько зачатков роста. Миома матки имеет автономный рост (аутокринный и паракринный), обусловленный взаимодействием ростовых факторов и образованием гормонально чувствительных и ростовых рецепторов [14, 23, 38, 53].
Патогенез ММ до сих пор вызывает много споров. Существующие теории развития заболевания основаны на результатах лабораторных и экспериментальных исследований и объясняют лишь некоторые звенья патогенеза. Одно из центральных мест в патогенезе ММ отводится особенностям гормонального статуса и функционального состояния репродуктивной системы [42].
Современные исследования подтверждают традиционное мнение о ведущей роли эстрогенов в патогенезе ММ [40, 41, 56]. Содержание рецепторов эстрадиола и прогестерона в ткани миомы выше, чем в неизмененном миометрии, и подвержено циклическим изменениям. Длительное лечение агонистами гонадолиберина (гипоталамический рилизинг-фактор) уменьшает объем миоматозных узлов на фоне значительного снижения содержания рецепторов эстрогенов в миометрии и тканях миомы [14, 16, 23, 33, 40, 54].
Ведущая роль в патогенезе миомы матки отводится гиперэстрогенемии. Это было доказано в эксперименте возможностью получения псевдомиомы в результате длительного применения эстрогенных гормонов. После прекращения действия эстрогенов ММ у животных подвергается обратному развитию [19].
Эстрогены в крови женщин циркулируют как в свободном, так и в связанном состоянии в виде соединений с серной и глюкуроновой кислотами. Конъюгация эстрогенов с глюкуроновой кислотой с помощью фермента уридинфосфоглюкуронилтрансферазы происходит в основном в печени. Нарушение процессов конъюгации эстрогенов может привести к увеличению свободных фракций эстрогенов, обладающих более выраженной способностью стимулировать гиперпластические процессы в органах-мишенях — матке [19].
У женщин, страдающих ММ, все ткани (а не только ткани матки) реагируют на колебания уровня половых гормонов изменением концентрации своих рецепторов; эстрадиол индуцирует образование сначала рецепторов, а подъем уровня прогестерона в крови приводит к снижению и эстрогенных и прогестеронных рецепторов [23].
Прогестерон наряду с эстрогенами стимулирует рост миомы матки [54], но оба этих гормона, принимая участие в патогенезе миом, используют разные пути [59]. Доказано, что 4-гидроксилирование эстрадиола в ткани ММ повышено по отношению к окружающему миометрию в пять раз. Уровни активности ароматазы и продуктов транскрипции цитохрома Р450-ароматаз в 2 — 20 раз выше в культуре клеток миомы, чем в нормальной ткани. Это указывает на усиление локального биосинтеза эстрогенов, стимулирующих рост миомы [33]. Высокое содержание рецепторов эстрогенов и прогестерона в миоме реализуется в локальном повышении концентрации эстрадиола, прогестерона и стимулировании роста миомы. При этом прогестерон и эстрогены оказывают синергическое действие [59].
Таким образом, нарушения обмена половых стероидов в миоматозных узлах формируются по принципу положительной обратной связи, основанной на аутокринной стимуляции клеток. Развитие этого патофизиологического механизма обусловлено активным участием так называемых факторов роста, что приводит к росту миоматозных узлов, нарушению васкуляризации и кровотечениям [33, 40, 56, 59].
Основную роль в развитии осложнений предположительно играют фактор роста фибробластов, сосудистый эндотелиальный фактор роста, трансформирующий β-фактор роста, паратиреоидный гормоноподобный протеин и пролактин [17].
Решающим фактором, индуцирующим развитие ММ, является локальная гиперэстрадиолемия, не сбалансированная локальной гиперпрогестеронемией. ММ в условиях естественной ановуляции становится фактором риска ускоренного развития гиперпластических процессов миометрия и эндометрия [6, 23, 29, 30].
Источником синтеза основных липидов желчи, в частности желчных кислот и неизмененного холестерина желчи, является холестерин различных классов липопротеидов, причем холестерин липопротеидов высокой плотности в основном превращается в желчные кислоты, а холестерин липопротеидов низкой плотности экскретируется в желчь в неизмененном виде [17, 36, 46]. Ключевым моментом синтеза желчных кислот считается 7-альфа-гидроксилаза. Существенная роль в регуляции активности данного фермента отводится половым гормонам, кроме того, активность 7-альфа-редуктазы зависит от количества свободного неэстерифицированного холестерина [21, 35, 46].
Метаболические и катаболические реакции, происходящие в печени, уравновешивают различные секреторные процессы, в частности, здесь активируются и взаимопревращаются гормоны [22, 44]. Изменение превращений гормонов влияет на количество активных форм в крови и тканях. Усиление метаболических реакций ведет как к смещению равновесия между свободной и связанной формами гормонов в сторону увеличения концентрации свободной их фракции, так и к подавлению синтеза специфических транспортных белков и автоматическому повышению содержания свободной активной формы гормонов [19].
Катаболизм гормонов — это совокупность разнообразных процессов ферментной деградации исходной структуры секретируемого гормона [25]. Печень является главным продуцентом гормоносвязывающих белков. Более 90% холестерина, используемого при синтезе стероидных гормонов, образуется в печени. Метаболиты стероидных гормонов плохо растворяются в воде и перед экскрецией превращаются в печени в парные соединения (конъюгаты) эфира с серной, глюкуроновой и другими кислотами [21, 47].
Гормональный импринтинг метаболизма стероидов осуществляется на транскрипционном или трансляционном уровнях. Он сводится к организации определения соотношения молекулярных форм микросомального цитохрома Р-450. Нарушение стероидного обмена связано с усилением активности одних и уменьшением других ферментных систем [37, 48].
Взаимосвязь между репродуктивной и гепатобилиарной системами известна давно [2,3,4,5]. С одной стороны, у пациентов с ММ часто выявляются заболевания печени и желчевыводящих путей, способствующие развитию нарушений метаболизма эстрогенов [39, 45], с другой — избыток в крови некоторых половых стероидов неблагоприятно влияет на различные функции печени [44, 55]. M. Maneshi и A. Martorani (1974) описали печеночно-яичниковый синдром, в определенной степени определяющий эту взаимосвязь [49].
Тесные функциональные взаимосвязи печени и женских половых гормонов, часто встречающееся сочетание их поражений и связанная с ним необходимость применения гормональной терапии, влияющей на деятельность печени, объясняют повышенный интерес к изучению функционального состояния печени у больных с миомой матки.
У больных с ММ и нормальным содержанием эстрогенов в крови связей между экскрецией эстрогенов и изменением содержания белковых фракций в плазме крови не отмечено. При повышении содержания эстрогенов в крови больных с ММ наблюдалась прямая корреляционная связь между содержанием прямого билирубина и концентрацией эстрадиола [7, 9, 10, 11, 12].
У большинства больных с ММ нарушения функций печени происходят в отсутствии клинических признаков заболевания гепатобилиарной системы [20].
Таким образом, установлено, что развитие ММ сочетается с функциональными поражениями печени, и не исключается, что рост миомы происходит на их фоне.
Нельзя исключить, что обнаруженные функциональные изменения печени у больных с ММ связаны с нарушением обмена стероидных гормонов. Установлено, что концентрация плазменных липидов увеличивается параллельно повышению уровня эндогенных половых гормонов, в частности эстрогенов, и это в определенной степени доказывает гормональную обусловленность гиперлипидемии при ММ [34, 44, 50]. Под влиянием эстрогенов происходят торможение синтеза холестерина в печени и уменьшение содержания холестерина в надпочечниках, увеличение содержания фосфолипидов [1, 13, 51, 52].
Известно, что транспорт липидов в печень плазмы крови осуществляется рецепторами мембран гепатоцитов и синусоидальных клеток печени. Эстрогены активируют рецепторы гепатоцитов для ХС ЛПНП, в результате чего увеличивается их захват [8, 10, 26, 31, 46]. Следствием этого процесса является увеличение содержания холестерина в печени и пузырной желчи, но не за счет усиления его синтеза, а за счет повышения уровня эстрогенов, приводящего к снижению синтеза желчных кислот в печени в результате ингибирующего влияния эстрогенов на активность 7-альфа-гидроксилазы холестерина [37, 43].
Повышенное содержание половых гормонов (эстрогенов) обусловливает изменение соотношения холестерина и желчных кислот в желчи. Это приводит к увеличению содержания свободного холестерина, выделяемого с желчью, и образованию насыщенной и перенасыщенной холестерином желчи. Наиболее выраженные нарушения липидного обмена отмечались у больных со значительными размерами опухоли при ее быстром росте. У них имелась отчетливая тенденция к нарастанию концентрации в крови общих липидов, липопротеидов, свободного холестерина, отмечено значительное снижение фосфолипидов и эфиров холестерина [2, 3, 4, 18].
При длительном существовании ММ и ее медленном росте показатели содержания общих липидов, липопротеидов и холестерина в сыворотке крови незначительно отличаются от нормальных значений, тогда как качественные нарушения липидного обмена сохранили описанные выше закономерности и укладываются в рамки дислипопротеидемии [2, 4]. Кроме того, значительный дефицит фосфолипидов, особенно при длительно существующих опухолях, является доказанным фактом [2, 3, 18].
Таким образом, имеющиеся в литературе данные о функциональном состоянии печени у больных с ММ противоречивы, так как были получены при анализе небольшого и неоднородного количества клинических наблюдений, кроме того, часто ограничены характеристикой одной из функций печени. Практически не освещен вопрос комплексной диагностики нарушений функционального состояния печени (особенно на ранних стадиях ее поражения) с применением современных радиоизотопных методов исследования, включая исследования ее ретикулоэндотелиальной системы. Тактика лечения больных с ММ не учитывает нарушения функций печени.
Нельзя упускать из вида следующее обстоятельство: основная задача при лечении ММ, особенно гормональном, направлена на избавление пациенток от миомы. В то же время любой из используемых сегодня препаратов оказывает в той или иной степени негативное влияние, а хирургическое лечение не оказывает положительного воздействия на нарушенные функции печени.
Современные методы диагностики позволяют по-новому взглянуть на проблему лечения миомы матки с учетом патогенеза морфологических и функциональных изменений печени у больных с ММ, что, безусловно, положительно скажется на ее результатах.
Независимо от вида терапии (консервативное или хирургическое) нарушения функции печени при ММ следует рассматривать с позиций липидного дистресс-синдрома Савельева [28]. В этой связи наиболее перспективным направлением лечения метаболических нарушений функции печени можно считать длительную липидокоррегирующую терапию вазелин-пектиновой эмульсией ФИШант С (Россия, ПентаМед) с обязательным применением комбинированных растительных гепатотропных препаратов (гепабене, ратиофарм) и восстановлением микробиоценоза толстой кишки пробиотиками (хилак форте, ратиофарм) [28].
По вопросам литературы обращайтесь в редакцию
З. Р. Кантемирова, кандидат медицинских наук
А. М. Торчинов, доктор медицинских наук, профессор
Т. А. Жигулина
В. В. Кадохова
Е. А. Алексеева, кандидат медицинских наук
Е. А. Девятых
В. А. Петухов, доктор медицинских наук, профессор
МГМСУ, РГМУ, 1-я Градская больница, Москва
Что такое гепатит Б? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит В (Б) — острое и хроническое инфекционное заболевание, вызываемое вирусом гепатита В, с гемоконтактным механизмом передачи (через кровь), протекающее в различных клинико-морфологических вариантах, и возможным развитием цирроза печени и гепатоцеллюлярной карциномы. Всего в мире, по самым скромных оценкам, инфицировано более 250 млн человек.
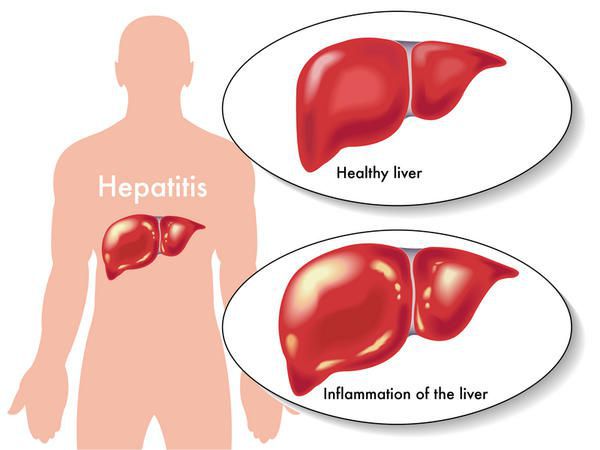
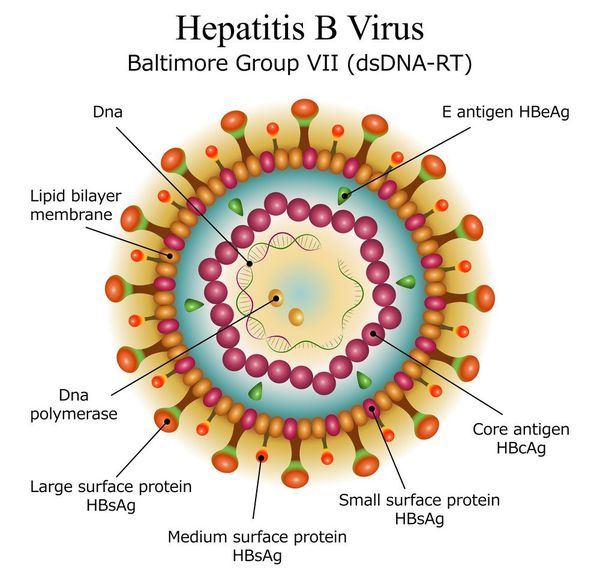
Этиология
вид — вирус гепатита В (частица Дейна)
Развитие вируса гепатита Б происходит в гепатоцитах (железистых клетках печени). Он способен к интеграции в ДНК человека. Имеются 9 генотипов вируса с различными подтипами — генетическая изменчивость позволяет вирусу образовывать мутантные формы и ускользать от действия лекарств.
Имеет ряд собственных антигенов:
- поверхностный HbsAg (австралийский). Появляется за 15-30 дней до развития болезни, свидетельствует об инфицировании (не всегда). Антитела к HbsAg выявляются через 2-5 месяцев от начала заболевания, а сам HbsAg исчезает из крови (при благоприятном течении процесса);
- сердцевинный HbcorAg (ядерный, коровский). Появляется в инкубационном периоде и совместно с ним появляются антитела (HbcorAb). Длительное присутствие HbcorAg в крови свидетельствует о вероятной хронизации процесса (неадекватный иммунный ответ);
- антиген инфекциозности и активного размножения вируса (HbeAg). Появляется совместно с HbsAg и отражает степень инфицированности. Его продолжительная циркуляция в крови является свидетельством развития хронизации процесса, а антитела к нему являются благоприятным прогностическим признаком (не всегда, но по меньшей мере указывают на возможность более благоприятного процесса, срок их циркуляции после выздоровления окончательно не определён, но не более пяти лет после благоприятного разрешения процесса);
- HbxAg — регулятор транскрипции, способствует развитию гепатокарциномы.
Вирус гепатита В чрезвычайно устойчив к действию всевозможных естественных факторов окружающей среды, инактивируется при 60 °C за 10 часов, при 100 °C за 10 минут, при оптимальной температуре сохраняется до 6 месяцев, при автоклавировании погибает за 5 минут, в сухожаровом шкафу — через 2 часа, 2% раствор хлорамина убивает вирус за 2 часа. [1] [3]
Эпидемиология
Источник инфекции — только человек, больной острой или хронической формой инфекции.
Механизм передачи: гемоконтактный и вертикальный (от матери к ребёнку), не исключается трансмиссивный механизм передачи (например, при укусах комаров в результате раздавливания и втирания инфицированного тела комара в поврежденную ткань человека).
Пути передачи: половой, контактно-бытовой, гемотрансфузионный (например, при переливании крови или медицинских манипуляциях). Восприимчивость всеобщая. Заболеваемость — 30-100 человек на 100 тысяч населения (зависит от страны). Летальность от острых форм — до 2%. После перенесённого острого заболевания при условии выздоровления иммунитет стойкий, пожизненный.
Для заражения характерна малая заражающая доза (невидимые следы крови). [1] [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита Б
Инкубационный период гепатита В длится от 42 до 180 дней (следует иметь в виду, что наличие клинической симптоматики характеризует лишь незначительную долю всех случаев заболевания).
Начало постепенное. Характерные синдромы:
- общей инфекционной интоксикации (проявляется как астеноневротический синдром);
- холестатический (нарушение секреции желчи);
- артрита;
- нарушения пигментного обмена (появление желтухи при уровне общего билирубина свыше 40 ммоль/л);
- геморрагический (кровоточивость кровеносных сосудов);
- экзантемы;
- отёчно-асцитический (скопление жидкости в брюшной полости);
- гепатолиенальный (увеличение печени и селезёнки).
При первых признаках гепатита B нужно обратиться к доктору.
Первые признаки гепатита B
Начальный (преджелтушный) период продолжается 7-14 дней. Чаще протекает по многообразному типу с болевыми ощущениями в различных суставах по ночам и утром, уртикарными высыпаниями, астеновегетативными проявлениями (снижение аппетита, апатия, нервозность, слабость, разбитость, повышенная утомляемость). Изредка развивается синдром Джанотти-Крости — симметричная, яркая пятнисто-папулёзная сыпь. Не исключены умеренные диспептические явления (расстройства пищеварения). К концу периода происходит потемнение мочи, обесцвечивание кала.
Желтушный период
Этот период продолжительностью около одного месяца характеризуется возникновением желтушного окрашивания кожи (различных оттенков) на фоне продолжающегося или ухудшающегося общего состояния. Характерна длительность и стойкость симптоматики. Появляется тяжесть и болезненность в правом подреберье, горечь во рту, тошнота, выражённый зуд кожи (практически не снимаемый никакими средствами). На фоне усиления астеноневротического компонента появляются геморрагические проявления, урежение пульса, гипотензия, отёки (отражает степень интоксикации и нарушения функций печени).
Выздоровление
Следующим этапом в развитии болезни является нормализации общего состояния, спадение желтухи и реконвалесценция, которая в зависимости от конкретной ситуации и состояния иммунной системы может закончиться как выздоровлением, так и движением развития заболевания в хроническое течение, характеризующееся маловыраженой неусточивой симптоматикой, преимущественно в виде слабости, периодического дискомфорта в правом подреберье, бурно сигнализирующим лишь на стадии цирроза и полиорганных осложнений.
- гепатиты другой этиологии;
- желтухи другой этиологии (например, гемолитическая болезнь, токсическое поражение, опухоли);
- малярия; ;
- лептоспироз;
- ревматоидный артрит.
Гепатит В у беременных
Острый гепатит характеризуется более тяжёлым течением у беременной, возникновении повышенного риска преждевременных родов, аномалий развития плода на ранних сроках и кровотечений. Вероятность передачи при острой форме зависит от сроков беременности: в первом триместре риск 10% (но более тяжёлые проявления), в третьем триместре — до 75% (чаще бессимптомное течение после родов). У большинства детей при заражении во внутриутробном и постнатальном периодах происходит хронизация инфекции. [1] [3] [6]
Патогенез гепатита Б
С движением кровяной массы вирус попадает в печеночную ткань, где локализуется в гепатоцитах и теряет свою протеиновую сферу в лизосомах. Происходит выход вирусной ДНК с последующим ресинтезом аномальных протеинов LSP, а параллельно образование новых частиц Дейна.
В процессе эволюции вирусчеловеческого взаимодействия возможно развитие двух вариантов:
При репликативном пути происходит следующее: белки LSP совместно с HbcorAg вызывают увеличение продукции гамма-интерферона, что приводит к активации главного комплекса гисотсовместимости (HLA), проистекает преобразование молекул гистосовместимости 1 и 2 классов, в результате чего клетка становиться для организма враждебной в антигенном формате.
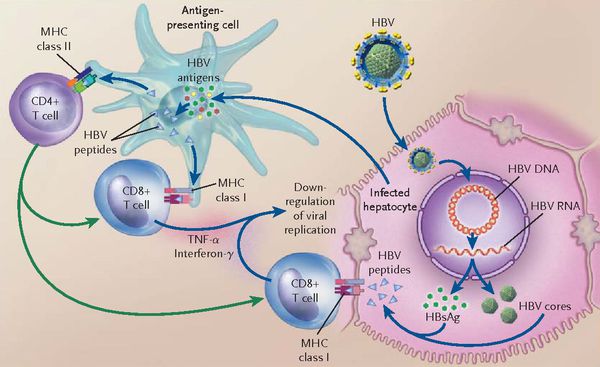
Антигенпрезентирующие макрофаги содействуют изменению В-лимфоцитов в плазматические клетки и экспрессии ими агрессивных белков-антител к посторонним антигенам. В итоге на поверхности печёночных клеток формируются вирусспецифические иммунные комплексы (антиген + антитело + фракция комплемента С3в).
В динамике может реализоваться два сценария:
- в первом варианте запуск каскада комплимента ведёт к появлению в составе иммунных комплексов агрессивной фракции С9 (мембранатакующий комплекс) — наблюдается значительный некроз гепатоцитов без участия лимфоцитов (молниеносная форма гепатита В);
- при альтернативной варианте (наблюдающимся в большинстве случаев) каскад комплемента в силу иммуноиндивидуалистических свойств не активируется — тогда идёт умеренное разрушение Т-киллерами меченых антителами заражённых вирусом гепатоцитов. Образуются ступенчатые некрозы с образованием на месте гибели гепатоцитов соединительной ткани — рубцов (то есть острый гепатит В при плохом иммунном ответе постепенно переходит в хронический).
Непременным атрибутом патогенеза является формирование иммунопатологического процесса. Гибель гепатоцитов, инфицированных вирусом гепатита В, следует за счёт иммунокомпетентных частиц, Т-киллеров и макрофагальных элементов.
Серьёзным значением является нарушение свойств мембраны клеток печени, что сопровождается экскрецией (выделением) лизосомальных ферментов, разрушающих гепатоциты. Сообразно этому, гибель гепатоцитов происходит за счёт иммунокомпетентных клеток, лизосомальных ферментов и противопечёночных гуморальных аутоантител, то есть острая болезнь наступает (и благоприятно заканчивается) только при хорошем иммунитете, а при плохом идёт хронизация.
При тяжёлом цитолитическом синдроме (массивные некрозы гепатоцитов) возникает гипокалиемический алкалоз, острая печёночная недостаточность, печёночная энцефалопатия (ПЭП), церебротоксическое действие, нарушение функции обмена нервной ткани. [2] [3] [6]
Классификация и стадии развития гепатита Б
По цикличности течения:
- острый;
- острый затяжной;
- хронический.
По клиническим проявлениям:
- субклинический (инаппарантный);
- клинически выраженный (желтушный, безжелтушный, холестатический, фульминантный).
По фазам хронического процесса:
Группы риска хронического гепатита B
Хроническим гепатитом чаще страдают дети младше шести лет. При заражении в первый год жизни он развивается в 80–90 % случаев, от года до шести лет — в 30–50 %, у взрослых без сопутствующих заболеваний — менее чем в 5 %. [7]
Осложнения гепатита Б
Чем опасен гепатит Б
Заболевание может привести к острой печёночной недостаточности (синдрому острой печеночной энцефалопатии).
Выделяют четыре стадии болезни:
Диагностика гепатита Б
Многообразие форм, тесная взаимосвязь с иммунной системой человека и зачастую достаточно высокая стоимость исследований часто затрудняют принятие конкретного решения и диагноза в стационарный отрезок времени, поэтому во избежание роковых (для больного) ошибок следует подходить к диагностике с учётом всех получаемых данных в динамическом наблюдении:
- общеклинический анализ крови с лейкоцитарной формулой (лейкопения, лимфо- и моноцитоз, уменьшение СОЭ, тромбоцитопения);
- общий анализ мочи (появление уробилина);
- биохимический анализ крови (гипербилирубинемия в основном за счёт связанной фракции, повышение уровня АЛТ и АСТ, ГГТП, холестерина, щелочной фосфатазы, снижение протромбинового индекса, фибриногена, положительная тимоловая проба);
- маркеры гепатита В: HbsAg, HbeAg, HbcorAg, HbcorAb IgM и суммарные, HbeAb, anti-Hbs, ПЦР в качественном и количественном измерении);
- УЗИ органов брюшной полости, КТ и МРТ диагностика;
- фиброскан (применяется для оценки степени фиброза). [3][4]
Скрининг при хроническом гепатите
Пациентам с хроническим гепатитом В рекомендуется не реже чем раз в полгода проходить обследование: УЗИ органов брюшной полости, клинический анализ крови, АЛТ, АСТ, тест на альфа-фетопротеин. Скрининг позволяет вовремя заметить обострение болезни и начать специфическую терапию.
Лечение гепатита Б
Лечение острых форм гепатита В должно осуществляться в стационаре (учитывая возможность быстрых и тяжёлых форм болезни), хронических — с учётом проявлений.
Диета и режим при гепатите В
В острый период показан постельный режим, печёночная диета (№ 5 по Певзнеру): достаточное количество жидкости, исключение алкоголя, жирной, жареной, острой пищи, всё в мягком и жидком виде.
Медикаментозная терапия
При лёгкой и средней тяжести острого гепатита этиотропная противовирусная терапия (ПВТ) не показана. При тяжёлой степени и риске развития осложнений назначается специфическая противовирусная терапия на весь период лечения и возможно более длительное время.
В лечении хронических форм гепатита показаниями к назначению ПВТ является наличие уровня DNA HBV более 2000 МЕ/мл (при циррозе печении независимо от уровня), умеренное и высокое повышение АЛТ/АСТ и степени фиброза печёночной ткани не менее F2 по шкале METAVIR, высокая вирусная нагрузка у беременных женщин. В каждом конкретном случае показания определяются индивидуально, в зависимости от выраженности процесса, временной тенденции, пола, планирования беременности и другого.
Существует два пути противовирусного лечения:
- терапия пегилированными интерферонами (имеет ряд существенных противопоказаний и серьёзных побочных эффектов — не менее 12 месяцев);
- нуклеозидно-аналоговой терапии NA (используются препараты с высоким порогом резистентности вируса, длительно — не менее пяти лет, удобство применения, хорошая переносимость).
В отдельных случаях может рассматриваться применение комбинированной терапии.
Из средств патогенетической терапии в острый период используются внутривенно вводимые растворы 5% глюкозы, дезинтоксикантов, антиоксидантов и витамины. Показан приём энтеросорбентов, ферментных препаратов, при выраженном холестазе применяются препараты Урсодезоксихолевой кислоты, при тяжёлом течении — глюкокортикостероиды, методы аппаратного плазмофереза.
В хронической стадии заболевания при наличии соответствующей активности процесса и невозможности назначения ПВТ может быть показан приём групп гепатопротекторов и антиоксидантов. [1] [3]
Прогноз. Профилактика
Основное направление профилактики на сегодняшний день — это проведение профилактической вакцинации против гепатита В в младенческом возрасте (в том числе усиленная вакцинация детей, рождённых от матерей с гепатитом В) и далее периодические ревакцинации раз в 10 лет (или индивидуально по результатам обследования). Достоверно показано, что в странах, где была введена вакцинация, резко сократилось количество вновь выявленных случаев острого гепатита В.
Вторая составляющая стратегии профилактики включает обеспечение безопасности крови и её компонентов, использование одноразового или стерилизованного инструментария, ограничение числа половых партнёров и использование барьерной контрацепции. [1] [2]
На сервисе СпросиВрача доступна консультация гинеколог-эндокринолога по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!

Все гормональные препараты влиябт на печень, поэтому если есть гепатит , то он может дать о себе знать. Вам лучше проконсультироваться


Здравствуйте.Ольга.Для многих гормональных препаратов ВГС является противопоказанием к применению.Если не обойтись без гормонального лечения,то под контролем АЛТ и АСТ,и приемом гепатопротекторов.


Здравствуйте, Ольга! Этот вопрос нужно решать с наблюдающим Вас инфекционистом. Прием гормонов является противопоказанием при нарушении функции печени, гепатит с компенсированный не является противопоказанием к гормонотерапии. У меня есть пациентки с гепатитом С принимающие МГТ и КОК более 5 лет и не имеют проблем с активацией процесса. Вам нужно обсудить с инфекционистом какие препараты принимать для облегчения работы печени при приеме гормонов. С Вашим гинекологом я соглашусь, эндометриоз хроническое гормональнозависимое заболевание. Гормональное лечение необходимо до возраста менопаузы. Но в Вашем случае нужно взвешивать все риски и пользу, совместное ведение гинеколога и инфекциониста. Здоровья Вам!

Первым делом консультация инфекциониста в Вашем случае!
Препараты конечно желательны, но последствия от них вероятно всего будут(
Нужно что бы инфекционист оценил всю картину и анализы

Увы, но никто не даст вам 100 % гарантии. Проконсультируйтесь с инфекционистами, возможна на период терапии будет назначена профилактика.
В статье отражены современные представления о роли вируса гепатита С в развитии патологии щитовидной железы. Установлено, что вирус гепатита С, локализуясь в тиреоидной ткани и реплицируясь, оказывает прямое тиреоцитотоксическое действие с формированием аутоиммунных механизмов повреждения этого органа, а также показана роль интерферонотерапии в отношении развития тиреоидной дисфункции у больных гепатитом С.
Current views on the impact of HCV-infection on the state thyroid gland
The article reflects the current understanding of the role of hepatitis C in the development of thyroid cancer. It is established that the hepatitis C virus, localized in the thyroid tissue and replicate, has a direct effect on the formation of tyreocytotoxical action with the formation of autoimmune mechanisms damage of the body, and shows the role of interferontherapy in the development of thyroid dysfunction in patients with hepatitis C.
По данным Всемирной организации здравоохранения (ВОЗ), в мире ежегодно более 50 млн человек заболевают гепатитом В, а умирают — до 2 млн. Более 500 млн человек — носители гепатита С (HCV). Из них от 100 до 200 млн — хронические носители вируса гепатита С. По прогнозам ВОЗ, в ближайшие 10-20 лет на 60% может увеличиться число больных циррозом печени, на 68% — раком, и в два раза возрасти смертность от других печеночных заболеваний. Острый вирусный гепатит С переходит в хроническую форму в 60% случаев, а в 20% случаев — к циррозу. По последним данным, заболеваемость хроническим вирусным гепатитом С в течение последних пяти лет удерживается на высоком уровне: от 47,5 на 100 тысяч населения в 2005 году, до 53,4 — в 2010 году [4].
Особенностью вируса является ее преимущественно скрытое течение. Оставаясь в течение длительного периода нераспознанным, инфицированные ВГС становятся основным источником инфекции, сохраняющей своих возбудителей как биологический вид. Более того, длительная персистенция возбудителя приводит к частой хронизации, которая на протяжении многих лет может не вызывать субъективных нарушений в самочувствии больных, тем самым не давая повода обратиться к врачу и выявить заболевание. Одной из основных характеристик гепатита С является также чрезвычайно высокий риск хронизации — до 80% и выше. Сегодня именно HCV-инфекция является основной причиной формирования всей группы хронических болезней печени — хронического гепатита, цирроза, гепатокарциномы [5]. Манифестируя на стадии хронического гепатита и цирроза печени, с возможными внепеченочными проявлениями HCV-инфекция резко ограничивает терапевтические возможности клинициста.
Механизмом, с которым связано повреждение гепатоцитов, как правило, уже на этапе хронизации HCV-инфекции является специфический или неспецифический иммунный, а в последующем и аутоиммунный ответ организма [6]. Особенности гуморального иммунного ответа при ХГС отражают: высокую частоту (79-80%) выявления анти-GOR-вирусспецифических аутоантител к GOR-эпитопу гепатоцитов хозяина; продукцию криоглобулинов; появление неспецифических антинуклеарных, антигладкомышечных антител (10-20% больных) и печень/почки микросомальных антител I типа; частоту выявления некоторых органоспецифических аутоантител (антитела к тиреоглобулину, микросомам щитовидной железы [7]. Это играет важную роль в формировании аутоиммунных процессов, а так же предрасполагает к поражению других органов и систем с развитием внепеченочных проявлений (кератоконъюнктивит, красный плоский лишай, мембранопролиферативный гломерулонефрит, B-клеточная лимфома, млазмоцитома, MALT-лимфома, смешанная криоглобулинемия, тиреоидит, синдром Шегрена, поздняя кожная порфирия, идиопатическая тромбоцитопеническая пурпура) [8]. Одной из малоизученных проблем является влияние вирусного гепатита С на состояние эндокринной системы, в частности на функциональное состояние щитовидной железы.
Печень играет важную роль в процессах метаболизма, транспорта, хранения и экскреции тиреоидных гормонов. Тиреоидные гормоны в печени йодируются, дезаминируются, декарбоксилируются, соединяются с глюкуроновой и серной кислотами [9]. Уровень гормонов щитовидной железы важен для ее нормального функционирования, в том числе обмена билирубина [10]. Под действием тиреоидных гормонов возрастает количество печеночных мРНК (примерно на 8%). Этот эффект от части опосредуется влиянием Т3 на продукцию других факторов (например, гормона роста) и непосредственно регулируется Т3. Особый интерес среди них привлекает так называемый ген S-14. Он облегчает транскрипцию генов липогенных ферментов [11] Роль печени в метаболизме гормонов щитовидной железы интересна еще и тем, что в гепатоците происходит выработка белков переносчиков гормонов щитовидной железы. В нормальных условиях более 99,95% присутствующего в крови Т4 и более 99,5% Т3 связано с белками плазмы. Роль белков, связывающих тиреоидные гормоны, в организме велика. Они связывают избыточное количество этих гормонов, ограничивая в строгих пределах фракцию свободных гормонов, и тем самым, с одной стороны, предупреждают их потерю через выделительную систему (печень и почки), СА с другой стороны — регулируют скорость доставки тиреоидных гормонов на периферию, где они оказывают основное метаболическое действие. Свободная фракция составляет лишь 0.04% для Т4 и 0,4% для Т3 и именно она обусловливает биологическое действие тиреоидных гормонов на распределение Т4 и Т3 среди различных связывающих белков влияют pH и ионный состав плазмы. В плазме примерно 80% Т4 скомплексировано с тироксин-связывающим глобулином 15% — с тироксин-связывающим преальбумином (ТСПА), а остальная часть — с альбумином сыворотки [12]. Трийодтиронин слабо связывается с преальбумином, а его сродство с ТСГ составляет всего 3% от таковой Т4. Таким образом, хотя щитовидная железа производит в 10 раз больше Т4, чем Т3, особенности связывания этих гормонов белками могут приводить к тому, что концентрация свободного Т3 в плазме оказывается вдвое ниже концентрации свободного Т4. При гипертиреозе отношение к Т3 к Т4 может быть еще выше. Принято считать, что метаболически активной является только та ничтожная доля тиреоидных гормонов, которая не присоединена к белкам и способна к диффузии через клеточную мембрану. В абсолютных цифрах количество свободного Т4 в сыворотке составляет около 2 нг/дл, а Т3 — 0,2 нг/дл. Основным белком, переносящим гормоны щитовидной железы, является тироксин связывающий глобулин, он имеет молекулярную массу 63000 Да и представляет собой гликопротеин, синтезируемый в печени. Период его полураспада составляет 5 дней и скорость разрушения 15 мг/сут. Углеводный компонент представлен сиаловой кислотой и играет существенную роль в комплексировании гормонов. Концентрация тироксин-связывающего глобулина в крови составляет 16-29 мкг/мл или 286-552 нмоль/л [13]. Молекулярная масса ТСПА — 55000 Да. Подобно ТСГ ТСПА обладает гораздо большим сродством к Т4, чем к Т3.
Важно отметить, что тяжелые нетиреоидные заболевания, а также голодание сопровождаются быстрым и значительным падением уровня ТСПА в сыворотке.
Изменения концентрации белков, связывающих тиреоидные гормоны, приводят к изменениям содержания самихТ4 и Т3. Например, при повышении тироксин-связывающего глобулина уровни общего Т4 и общего Т3 в сыворотке возрастают, а при дефиците тироксин-связывающего глобулина — снижаются. Кроме этого, важную роль играет функциональное состояние молекулы ТСГ, то есть наличие тироксин-связывающих участков. Для изучения этого феномена предложен лабораторный тест, обозначенный как Т-захват (Т-up), позволяющий оценить функциональное состояние доступных участков для связывания Т4 на белках крови. Между общим содержанием Т4,Т3 и содержанием свободных Т4, Т3 существует динамическое равновесие. Увеличение концентрации тироксин-связывающего глобулина вначале приводит к кратковременному снижению свободного Т4 и свободного Т3. Затем секреция Т4 и Т3 усиливается. И их общее содержание в сыворотке повышается до тех пор, пока не восстановится нормальный уровень свободного Т4 и свободного Т3. Таким образом, уровни свободных Т4 и Т3 в сыворотке не изменяются, поэтому не изменяется и интенсивность процессов, регулируемых Т4 и Т3 в тканях-мишенях. Повышение содержания ТСГ наблюдается при приеме эстрогенов, беременности, хронически активном гепатите, биллиарном циррозе печени. Снижение тироксин-связывающего глобулина наблюдается при лечении глюкокортикоидами, андрогенами, нефротическом синдроме, тиреотоксикозе и недостаточности белкового питания. Кроме того, существуют врожденные аномалии продукции этого белка, которые могут сказаться на общей концентрации тиреоидных гормонов в сыворотке крови [14].
Нередко патологию щитовидной железы вызывают вирусные инфекции.
Хронические вирусные заболевания печени часто приводят к развитию дисфункции щитовидной железы, в частности повышению уровня ТСГ и Т4 сыворотки крови [17]; снижение уровня Т3 за счет уменьшения его секреции, дейодирования и усвоения гепатоцитами тироксина; повышения уровня реверсивного Т3. Уровень тироксина также может снижаться из-за неполноценной продукции ТСГ или за счет снижения связывания Т4 на периферии [17]. Среди вирусных поражений печени особенно актуально стоит проблема хронических вирусных гепатитов, в частности гепатита С, который многими исследователями рассматривается не как исход или тем более осложнение острого, а как фаза единого инфекционного процесса [18].
Тиреоидная дисфункция у больных гепатитом С проявляется в большинстве случаев гипотиреозом и встречается в 3,5-7% случаев по данным ряда авторов [20]. У гораздо большей части обследуемых (31-42,5%) выявляются диагностические значимые уровни антитериоидных антител (антимикросомальных, антипероксидазных, антител к тиреоглобулину) [21]. Разброс данных обусловлен различиями в типе определяемых антител, возрасте, поле, неоднородными характеристиками контрольной группы. Наиболее часто регистрируются антитела к тиреопероксидазе (Анти-ТПО), по данным различных авторов, от 4,1 до 15% антитела к тиреоглобулину — 4,7%. Одновременно анти-ТПО и АТ к ТГ определяется у 1,8% [22]. Имеются указания на более высокую распространенность антитериоидных антител у женщин с HCV-инфекцией по сравнению с мужчинами, так частота гипофункции щитовидной железы с обнаружением антитериоидных антител среди женщин с вирусным гепатитом С в 4 раза выше чем среди мужчин и составляет 12,7-31% против 5,6-10,5%, соответственно [23]. Механизмы развития вышеуказанных осложнений при гепатите С недостаточно ясны. Существуют различные предположения. По некоторым данным, вирус гепатита С непосредственно поражает такие органы, как слюнные железы, поджелудочная и щитовидная железа [24], а по другим данным, вирус запускает аутоиммунные процессы поражения тканей и органов [25]. Вирус гепатита С, локализуясь в тиреоидной ткани, вероятно, напрямую может вызвать ее поражение [26]. С другой стороны, возможно, аутоиммунные реакции обусловлены такой особенностью вируса, как способность к мимикрии некоторых компонентов тиреоидной ткани. По экспериментальным данным, Т-лимфоциты, инфильтрующие ткани щитовидной железы при хроническом гепатите С, вырабатывают антитела к тиреоидным аутоантигенам [27]. Ряд авторов считает, что поражение щитовидной железы не связано с хроническим вирусным гепатитом С; другие констатируют, что HCV-инфекция активизирует скрытно протекающие заболевания щитовидной железы; а третья группа исследователей показывает, что вирус, реплицируясь в ткани щитовидной железы, оказывает прямое тиреоцитотоксическое действие с формированием аутоиммунных механизмов повреждения этого органа [28].
З.М. Галеева, О.И. Колчеманова
Казанская государственная медицинская академия
Галеева Зарина Мунировна — кандидат медицинских наук, доцент кафедры терапии
Патогенез АГ сложен. Полагают, что это ответ генетически предрасположенного организма на какой-то внешний агент, который является пусковым моментом в развитии аутоиммунных процессов, вызывающих прогрессирующие воспалительно-некротические изменени
 |
Патогенез АГ сложен. Полагают, что это ответ генетически предрасположенного организма на какой-то внешний агент, который является пусковым моментом в развитии аутоиммунных процессов, вызывающих прогрессирующие воспалительно-некротические изменения, приводящие к фиброзу и циррозу печени (ЦП). Генетически детерминированная предрасположенность к этому заболеванию выявлена во многих исследованиях. Доказано, что большая часть больных АГ имеют фенотип по антигенам главного комплекса гистосовместимости HLA-B8, HLA-DR4, DR3 и DR52a. Пусковой агент пока неизвестен, однако есть некоторые данные о роли вирусов гепатита [31, 26], кори [27], Эпштейн-Барр вируса [32], а также интерферона (ИФН) [14] как инициаторов начала АГ.
| Аутоиммунный гепатит (АГ) — хроническое воспалительное заболевание печени невыясненой этиологии, характеризующееся определенными лабораторными, клиническими и гистологическими признаками. Болеют им в основном женщины молодого возраста |
АГ — это прогрессирующее воспаление печени, характеризующееся наличием некрозов в перипортальной, септальной зонах (ступенчатые некрозы) или, более широко, лобулярным гепатитом (ЛГ), гипергаммаглобулинемией и аутоантителами в сыворотке крови [7]. Портальные тракты печени на биоптатах находят расширенными с накоплением в них обширных инфильтратов, имеющих разный клеточный состав: лимфоциты, макрофаги, плазматические клетки. ЛГ — дольковый гепатит, когда некрозы выявляются во второй и третьей зонах ацинусов, а также обнаруживается внутридольковая лимфоидноклеточная инфильтрация, которая выражена значительно больше, чем инфильтрация портальных трактов. ЛГ является частью гистологической картины АГ, если он выявляется одновременно с перипортальным гепатитом. По гистологической картине на АГ может указывать, кроме вышеперечисленного, наличие многоядерных гепатоцитов [2].
Наконец, картина фиброза может присутствовать в той или иной степени даже при умеренной степени активности АГ, а в запущенных случаях, особенно при отсутствии эффективной терапии, формируются мостовидные некрозы и, в конце концов, ЦП.
Хотя гистологическая картина при АГ очень характерна, все-таки она неспецифична. Отличительной чертой АГ является обнаружение в биоптатах преимущественно плазматических клеток, так как выраженная инфильтрация в портальной, перипортальной зоне, вовлечение в процесс долек печени — в равной мере присущи и хроническому вирусному гепатиту (ХВГ).
Одной из основных клинических характеристик АГ является обнаружение аутоантител к клеточным и субклеточным структурам клеток разных органов [22]. Типичным маркером АГ являются антитела к ядрам клеток — ANA. Из других маркеров выявляются антитела к клеткам гладкой мускулатуры (SMA), антитела к микросомам клеток печени и эпителиальных клеток клубочкового аппарата почек (LKM), антитела к растворимому печеночному антигену (SLA), антитела к антигенам (цитокератины 8, 18) мембран гепатоцитов — LMA.
Клинические проявления АГ очень разнообразны [1, 3, 4]. С одной стороны, встречаются бессимптомные формы, когда случайно выявляется повышение АЛТ, АСТ, а с другой — острое начало болезни с тяжелым течением вплоть до развития фульминантного гепатита (ФГ).
Нередко заболевание начинается незаметно с астеновегетативных проявлений, болей в области правого предреберья, незначительной желтухи. Однако у большинства больных АГ начало болезни острое, как при остром вирусном гепатите (ОВГ), и при осмотре пациента врач впервые выявляет признаки хронического гепатита (ХГ) — телеангиоэктазии, пальмарную эритему, увеличение печени и селезенки, а также изменения в анализах крови — гипергаммаглобулинемию, увеличение IgG, снижение содержания общего белка, резкое увеличение СОЭ. Лейкопения и тромбоцитопения наблюдаются у больных на поздних стадиях болезни или при развившихся гиперспленизме и синдроме портальной гипертензии.
Когда АГ впервые проявляется желтухой, как при ОВГ, приходится дифференцировать его от гепатитов А, В, Е и особенно С, при котором антитела в сыворотке крови могут появляться через достаточно продолжительное время после начала болезни. Желтуха у пациентов с АГ может быть разной степени выраженности, часто появляется на поздних стадиях заболевания, бывает непостоянной и усиливается в период обострений. В общем же у большинства больных чаще всего изменяются аминотрансферазы, нежели щелочная фосфотаза (ЩФ) или билирубин.
| Аутоиммунный гепатит был выделен из группы болезней печени и впервые описан как отдельная нозология в начале 50-х годов [33]. В научной литературе существовал под разными названиями. Термин люпоидный гепатит, который часто использовался в нашей стране, ввел в 1956 году Дж. Маккей с соавторами в журнале Lancet, так как при этом заболевании нередко в сыворотке крови больных выявлялись волчаночные клетки. Потом, в последующие годы, люпоидный, или классический, АГ стали называть аутоиммунным активным хроническим гепатитом, но в 1993 году Международная группа по изучению болезней печени предложила термин АГ, а также критерии установления его диагноза [17] |
Для АГ характерно поражение кожи в виде геморрагической сыпи, оставляющей после себя пигментацию. Из других симптомов встречаются волчаночная и узловатая эритемы, очаговая склеродермия, пальмарная эритема и телеангиоэктазии. У всех больных выявляются изменения в эндокринной системе — аменорея, угри, гирсутизм, стрии. Диагностическое значение отдельных симптомов болезни при АГ неодинаково. К наиболее значимым относятся длительная лихорадка и арталгии. В большинстве случаев АГ они присутствуют одновременно, являясь наиболее частыми и постоянно встречающимися жалобами больных [4].
Один из вариантов начала АГ — появление лихорадки с внепеченочными проявлениями, из которых следует назвать аутоиммунный тиреоидит, язвенный колит, гипертиреоидизм, гемолитическая анемия, идеопатическая тромбоцитопения, сахарный диабет, целиакия, полимиозит, фиброзирующий альвеолит, гломерулонефрит и т. д. Желтуха при этом варианте появляется позже [20].
Часто АГ сопровождается бесплодием, однако при возникновении беременности и последующих родах на фоне компенсированного процесса это не влияет на течение АГ и судьбу ребенка даже при постоянном приеме преднизолона (ПР) [30]. Беременность на стадии сформировавшегося ЦП и синдрома портальной гипертензии, которые выявляются у трети больных на момент выявления АГ, нежелательна [3].
В отличие от ХВГ течение АГ у больных непрерывно прогрессирующее, без самопроизвольных ремиссий. Улучшения самочувствия бывают кратковременными, нормализации биохимических процессов не происходит. Прогноз течения АГ хуже у пациентов с острым началом болезни по типу ОВГ, с наличием признаков холестаза, асцитом, повторными эпизодами острой печеночной энцефалопатии (ОПЭ). Как правило, больные, пережившие критический период, имеют лучший прогноз.
Диагноз АГ выставляется на основании соответствия лабораторных и гистологических данных, отсутствия маркеров ВГ, исключения злоупотребления алкоголем и контактов с препаратами крови, гипотоксическими веществами, повышения гамма-глобулинов не менее чем в 1,5 раза выше нормы. Повреждение желчных протоков, отложение меди, гемосидероз, при которых также могут выявляться ЛГ и ступенчатые некрозы, предполагают другую причину ХГ и исключают диагноз АГ. ANA, SMA и LRM-1 должны быть в титрах не менее 1:80 у взрослых и 1:20 у детей (рекомендации Международной группы, 1993).
Дифференциальный диагноз между АГ и другими аутоиммунными заболеваниями, в основном первичным билиарным циррозом (ПБЦ), первичным склерозирующим холангитом (ПСХ), ХВГ основывается на клинических, гистологических и иммунологических параметрах. Однако нередко выявляется так называемый overlap-синдром, когда одновременно у пациентов выявляются признаки АГ и вышеперечисленных хронических заболеваний печени. Далее они будут описываться как варианты АГ [7, 13]. Предполагаемый диагноз АГ в данном случае подразумевает сходство с клиникой АГ (жалобы на слабость, арталгии, миалгии), а биохимический анализ крови отражает преимущественно изменения холестатического порядка, имеет место кожный зуд разной степени выраженности. Пациенты с такими вариантами АГ могут быть обоего пола, любого возраста, но все же чаще это женщины в возрасте до 40 лет и моложе. На гистологии находят перипортальный гепатит с или без ЛГ, часто с поражением желчных протоков, жировой дистрофией гепатоцитов и лимфоидной инфильтацией портальных трактов в виде гранулем [7, 10].
Деление АГ на подтипы практического значения не имеет, однако следует иметь в виду, что подтип 2 АГ может быть связан с гепатитом С либо HCV может индуцировать появление АГ у генетически предрасположенных лиц. Нет данных о различиях гистологической картины при отдельных подтипах АГ
Большинство больных с ПБЦ можно точно отделить от пациентов с АГ с помощью характерных лабораторных и иммунологических данных. Однако при этом варианте наряду с характерными параметрами АГ нередко выявляются гистологические признаки холангита и АМА (антитела к антигенам внутренней поверхности мембраны митохондрий), что очень характерно для ПБЦ. Наиболее важным для подтверждения диагноза ПБЦ является обнаружение АМА подтипа М2 [6]. АМА выявляются у 20-27% больных АГ в разных титрах [19]. Это может отражать диагностические ошибки в определении иммуносерологических маркеров, другие заболевания или одну из стадий ПБЦ. Если у больного повышена щелочная фосфатаза (ЩФ), IgM сыворотки крови и обнаружена АМА — вероятен диагноз ПБЦ. Трех-шестимесячный курс лечения стероидами помогает расшифровать преобладающую патологию — при реакции на лечение можно говорить о превалировании АГ.
Установлено, что у 16% больных АГ выявляется язвенный колит (ЯК), наличие которого характерно для пациентов с ПСХ (от 40 до 60% больных). К тому же при таком сочетании — АГ и признаки ПСХ (наличие ЯК, поражение желчных протоков, слабый ответ на стероиды) — также обнаруживают фенотип HLA-B8, HLADR3, HLA DR4. Поэтому наличие кожного зуда у больных АГ и повышение ЩФ более чем в четыре раза против нормы указывают на необходимость проведения холангиографии (ХГР) и вероятность развития варианта АГ и ПСХ. Поражения желчных протоков несовместимы с диагнозом АГ. Они редки, но когда появляются у больных АГ с сопутствующей патологией кишечника или атипичным повышением ЩФ, можно допустить этот вариант АГ. Окончательный диагноз зависит от результатов ХГР. ХГР выявляет признаки склерозирующего холагнита у 42% больных АГ и ЯК. Но иногда ХГР бывает в норме у 14% больных ПСХ при гистологически подтвержденном диагнозе. Об этом необходимо помнить [24].
АГ считается заболеванием невирусной этиологии, но у 4% больных АГ выявляются антиHCV и еще у 4% — маркеры вируса гепатита В. Больные АГ, имеющие атипичное течение болезни либо плохо отвечающие на терапию стероидами, нередко имеют в сыворотке крови HCV RNA. Любопытно, что 11% больных ХВГ имеют SMA и 28% — ANA. У 62% выявляются аутоантитела к щитовидной железе и ревматоидный фактор. Большая часть этих больных имеют низкие титры SMA и ANA (1:80 и ниже), а пациенты с точным диагнозом АГ — SMA в титрах 1:160 и ANA 1:320. Поэтому больные АГ и с выявляемыми SMA или ANA в титрах ниже 1:320 могут быть отнесены к группе с превалированием вирусного заболевания [11].
Тем не менее пациенты с АГ имеют более выраженную инфильтрацию портальных трактов плазматическими клетками, более выраженные воспалительные изменения в дольках и больше ступенчатых и перисептальных некрозов по сравнению с пациентами ХВГ, особенно ХГС. У больных ХВГ/ХГС наоборот — в портальных трактах преобладает лимфоидноклеточная инфильтрация, чаще выявляется стеатоз и повреждения желчных протоков, особенно при ХГС.
У 13% взрослых больных с признаками АГ не обнаруживаются аутоантитела, а все остальные признаки — иммунологические, биохимические и гистологические, а также возраст и пол соответствуют критериям постановки диагноза АГ. Что важно, эти больные также хорошо реагируют на лечение стероидами [8, 9]. Отмечено, что с течением времени при динамическом наблюдении у некоторых из них появляются соответствующие аутоантитела, характерные для АГ.
Несмотря на разнообразие клинической картины, при АГ основой лечения является назначение преднизолона (ПР). Ответ на данную терапию — один из критериев постановки диагноза АГ. Целесообразность назначения ПР при АГ доказана в многочисленных исследованиях и обусловлена редкими самопроизвольными ремиссиями в течении болезни, высокой смертностью и ухудшением качества жизни [12, 18, 23, 28, 29]. При назначении ПР смертность удается снизить в течение пяти лет с 50 до 20%, а частоту индуцированных ремиссий довести до 80%. У большинства больных ремиссии появляются в течение первых двух лет терапии и почти у всех в последующие четыре года лечения.
Лечение ПР следует назначать всем больным АГ высокой степени активности с фиброзом и циррозом или без. У больных с умеренной степенью активности болезни назначение ПР часто определяется наличием жалоб и симптомов болезни. Больные без симптомов и с умеренной степенью активности процесса по гистологической картине не нуждаются в лечении, но должны тщательно и регулярно наблюдаться для своевременного выявления признаков прогрессирования болезни.
Как правило, начальная доза ПР составляет 20-30 мг/сутки с последующим постепенным снижением ее до поддерживающей — обычно 10 мг/сутки. Из всех схем лечения предпочтителен ежедневный прием однократно утром. Осложнения терапии наблюдаются при дозе более 10 мг/сутки. Нет точных рекомендаций по отмене или снижению дозы иммуносупрессоров, некоторые больные могут долго оставаться в ремиссии после отмены ПР.
Однако было установлено, что у большей части больных в дальнейшем, даже спустя несколько лет после ремиссии, появляются признаки обострения и часто требуется большая доза для ее достижения [15].
Комбинация ПР с азатиоприном (АЗА) может уменьшить побочные эффекты (при этом требуется небольшая доза ПР). Лучше давать 10 мг/сутки ПР с 50 мг/сутки АЗА, чем один ПР, но в большей дозе. Сам АЗА не способен индуцировать ремиссию, но его добавление к ПР поддерживает ее даже в дозе 1 мг/кг/сутки. При неэффективности лечения АЗА назначали 6-меркаптопурин с хорошим эффектом [25]. У 20% больных АГ не удается достигнуть ремиссии — чаще всего у пациентов с признаками ЦП, лиц молодого возраста, при длительном анамнезе болезни до начала терапии ПР и у больных с фенотипом HLA-B8, DR3 [28]. Побочные эффекты при назначении иммунодепрессантов редкие, это в основном диспепсический синдром, сыпи, кушингоидизм, нарушение роста и развития у детей, сахарный диабет и остеопороз у женщин в менопаузе. АЗА может индуцировать миелосупрессию, возникновение катаракты, обладает онкогенным и, возможно, тератогенным эффектами.
Лечение вариантов АГ представляет определенные трудности. Основа терапии, препарат выбора для начала лечения — и здесь ПР. При сочетании АГ и ПБЦ назначают ПР в дозе 20 мг/сутки от трех до шести месяцев, а при отсутствии эффекта — урсодезоксихолевую кислоту (УДХК) или ее коммерческие препараты (урсофальк, урсосан, урсодиол и др.) по 13-15 мг/сутки от трех до шести месяцев.
Тактика лечения больных с вариантом АГ и ПСХ та же, что и при АГ и ПБЦ. Больные АГ и ЯК отвечают на терапию ПР хуже, чем больные с одним АГ (не столь часты ремиссии, чаще и быстрее выявляют прогрессирование к ЦП). Эти пациенты, возможно, должны лечиться УДХК большими дозами (до 15-20 мг/кг/сутки), если признаки холестаза выражены.
При сочетании АГ и ХВГ назначают ПР 20 мг/сутки или 10 мг/сутки ПР и 50 мг/сутки АЗА на три–шесть месяцев, если превалируют признаки АГ. Рекомбинантный ИФН в дозе 3 млн. МЕ/сутки три раза в неделю до 6 месяцев назначают при выявлении признаков ХВГ и маркеров репликации вируса либо неэффективности стероидной терапии [21, 5]. Лечение таких больных представляет собой сложную задачу, так как ПР усиливает вирусную репликацию, а ИФН может усилить иммуноопосредованный печеночно-клеточный некроз, перевести ХВГ в АГ, который до этого мог быть в латентном состоянии, обострить течение болезни с развитием внепеченочных аутоиммунных проявлений, индуцировать выброс антител с неясным клиническим значением. Поэтому лечение состоит в правильном определении преобладания тех или иных клинических синдромов или признаков. В любом случае обострение болезни печени или внезапное появление признаков аутоиммунного заболевания у пациентов с признаками АГ, но с преобладанием вирусного поражения указывает на необходимость прерывания лечения ИФН.
Тактика лечения больных криптогенным ХГ состоит в назначении ПР 10-20 мг/сутки вместе с 50 мг/сутки АЗА до появления ремиссии или максимального эффекта.
Литература
Читайте также:

