Грипп при ревматоидном артрите
Обновлено: 25.04.2024
Человек постоянно контактирует с окружающей средой, а значит и с населяющими ее микроорганизмами, многие из которых являются патогенными, способными вызвать воспалительный процесс. Инфекционный артрит развивается при попадании инфекции в сустав. Предупредить тяжелые осложнения этого заболевания может только своевременное обращение за медицинской помощью.
Общие сведения о заболевании
Инфекционный артрит – это воспаление сустава, вызванное местной или общей инфекцией. Симптомы болезни и ее течение во многом зависят от вызвавшей инфекционный процесс инфекции.
Коды инфекционных артритов по МКБ-10:
- стафилококковый - M00.0;
- пневмококковый - M00.1;
- стрептококковые - M00.2;
- вызванные другими уточненными бактериальными возбудителями - M00.8;
- пиогенный неуточненный - M00.9;
- туберкулезный – М01.1;
- гонококковый - M01.3;
- вирусный – М01.5.
Заболевание очень распространено и может стать причиной стойкого нарушения суставной функции. Четверть пациентов, обращающихся по поводу заболеваний суставов, страдают инфекционными артритами.
Причины инфекционного артрита
Причиной заболевания является инфекция – гнойная инфекция из расположенных рядом очагов (флегмон, абсцессов) или занесенная с током крови при холециститах тонзиллитах, а также общие инфекционные заболевания. При попадании инфекционных возбудителей в сустав иммунная система начинает с ними бороться, вызывая воспалительный процесс, течение которого напрямую связано с особенностями инфекционного возбудителя.
Воспаление может быть:
- неспецифическим – то есть, иметь общие симптомы, характерные для воспалительных процессов; вызываются такие процессы гноеродной патогенной и условно-патогенной микрофлорой – стафилококками, стрептококками, синегнойной и кишечной палочками и др.; вызываемые ими воспалительные процессы носят обычно острый гнойный характер и протекают остро, особенно, у детей;
- специфическим – при таком воспалении развиваются, как общие симптомы, характерные для всех артритов, так и симптомы, свойственные данной инфекции; к таким инфекциям относят туберкулезный, бруцеллезный, гонорейный, вирусный, грибковый, паразитарный воспалительные процессы.
Инфекционные артриты имеют два механизма развития:
- бактериально-метастатический – воспаление начинается из-за присутствия в суставе инфекции;
- токсико-аллергический – воспаление развивается за счет общей интоксикации и неадекватного иммунного ответа на внедрение в организм инфекции;
- смешанный – действуют оба механизма.
Факторы, предрасполагающие к развитию инфекционного артрита: вредные привычки, поднятие тяжестей, наличие лишней массы тела, сахарного диабета. Гнойные поражения суставов особенно часто развиваются у женщин, страдающих ревматоидным артритом.
Симптомы инфекционного атрита
Инфекционный артрит обычно начинается и протекает остро, иногда подостро. Но при некоторых специфических инфекциях он имеет незаметное начало и длительное течение.
Начало болезни и первые симптомы
При остром начале основными симптомами инфекционного артрита являются: выраженная лихорадка, озноб, летучие мышечно-суставные боли в сочетании с резкой болезненностью в пораженном суставе, отеком и гиперемией кожи над ним. Практически всегда остро протекает инфекционный артрит у детей.
Подострое течение имеет не такое заметное начало, температура тела нормальная или субфебрильная. Отек, гиперемия и боль в суставах умеренные.
Самым опасным является скрытое, незаметное течение, характерное для туберкулезного артрита. Характерны неопределенные боли в суставах, похрустывание, снижение двигательной активности. Болезнь протекает на фоне туберкулеза, небольшое повышение температуры также может не привлечь внимания, поэтому туберкулезный артрит редко выявляется на ранних стадиях.
Боли и и отеки характерны для начальной стадии инфекционного токсико-аллергического артрита у детей и взрослых
Явные симптомы
Острый гнойный артрит развиваются очень быстро, состояние ухудшается с каждым днем, беспокоит лихорадка, отечность, гиперемия и боль нарастают. Не исключено, что больному потребуется хирургическая помощь.
При более медленном течении симптомы инфекционного артрита развиваются постепенно, появляется общее недомогание, слабость, суставные боли становятся постоянными, усиливаясь при движении. Постепенно нарушается функция конечностей: появляются трудности в их сгибании или разгибании.
Когда необходимо обращаться за медицинской помощью
К врачу нужно обращаться при появлении следующих симптомов:
- постоянных или регулярно повторяющихся болях в суставах;
- появлении лихорадки, недомогания в сочетании с болями в суставах;
- отека, гиперемии кожи над суставом в сочетании с лихорадкой у пациентов, уже страдающих хроническим артритом – возможно, к имеющемуся хроническому воспалению присоединилась инфекция;
- появление суставных болей при туберкулезе легких, гонорее, бруцеллезе и др. инфекционных заболеваниях.
Опасности
Заболевание часто протекает тяжело, с осложнениями.
Стадии заболевания
Течение болезни связано с ее клинической формой, поэтому стадии развития патологического процесса могут иметь значительные различия. Рассмотрим стадии развития острого гнойного артрита, разработанные НИИ им. Вишневского:
- Начальная – гнойный процесс без деструкции внутрисуставных тканей:
- А. - без поражения околосуставных тканей;
- В. – с развитием гнойных процессов в прилегающих тканях.
- Развернутая – гнойный артрит с деструкцией внутрисуставных тканей:
- А. - без поражения околосуставных тканей;
- В. – с гнойным поражением окружающих мягких тканей.
- Запущенная – с поражением костной и хрящевой ткани:
- А. - без поражения окружающих тканей;
- В. – с гнойным поражением данных тканей;
- С. – с выходом гноя на поверхность тела (свищами).
- Завершающая:
- при отсутствии адекватного лечения – деструкция, неподвижность сустава, инвалидизация;
- при правильном лечении – полное или частичное восстановление функции конечности.
Возможные осложнения
Инфекционный артрит может давать ранние и поздние осложнения. К ранним осложнениям относятся в основном осложнения гнойного артрита:
- нагноение околосуставных тканей;
- генерализация инфекции, сепсис.
Отдаленные последствия – это утрата функции конечности разной степени: от легкой до полной неподвижности.
Классификация
Происхождение и симптомы инфекционного артрита разных клинических форм имеют, как сходство, так и отличие. Рассмотрим наиболее распространенные формы.
Острый гнойный
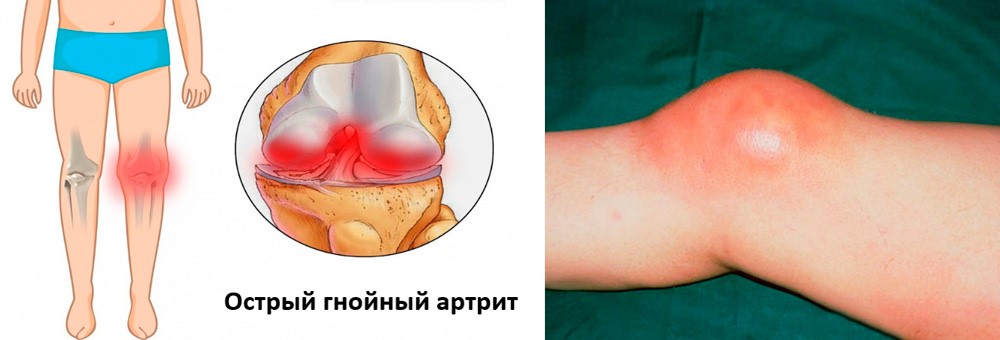
Острый гнойный артрит коленного сустава
Данная форма заболевания развивается при попадании в сустав гноеродной инфекции (синегнойной палочки, стафилококков, стрептококков и др.). Заражение может быть первичным при ранениях и вторичным – при переходе инфекции из окружающих тканей или отдаленных очагов инфекции. К группе риска относятся лица, страдающие ревматоидным артритом, особенно, женщины.
Начинается заболевание остро и протекает тяжело. Появляется лихорадка, головная боль, озноб. Пораженный сустав отекает, кожа над ним краснеет. Боль настолько сильная, что больной не может пошевелить конечностью и старается придать ей положение, вызывающее наименьшую болезненность.
Без оказания своевременной помощи суставные поверхности быстро разрушаются с ограничением подвижности конечности. При назначении адекватного лечения наступает полное выздоровление.
Септический
Развивается на фоне уже существующего сепсиса – генерализованного инфекционного процесса. Инфекция попадает в суставную полость гематогенным путем - с током крови. Заболевание может протекать в виде:
- бактериально-метастатической формы с симптомами острого гнойного артрита – состояние пациента может быть крайне тяжелым; прогноз заболевания зависит от своевременного лечения;
- токсико-аллергической формы – течение не всегда имеет острый характер, часто протекает подостро с множественным поражением суставов мигрирующего (чередующегося) характера; процесс носит негнойный характер и заканчивается выздоровлением на фоне излечения сепсиса.
Туберкулезный
Артрит в данном случае также протекает в виде бактериально-метастатической и токсико-аллергической форм. В первом случае поражаются в основном позвоночник и крупные суставы конечностей, а заболевание носит название костно-суставного туберкулеза. Протекает изначально хронически с нарастающими болями при движении, общим недомоганием. Основные изменения видны на рентгене в виде поражения суставной костной ткани от появления пятна с утратой костью кальция до разрушения кости. При отсутствии лечения приводит к инвалидности.
Токсико-аллергическая форма впервые описанная Понсе в начале 20-го века, протекает очень похоже на ревматоидный артрит с хроническим началом и поражением мелких суставов кисти и стоп. Возможна также их деструкция и инвалидизация. Поражение крупных суставов иногда протекает без последствий и проходит на фоне противотуберкулезной терапии.
Хондропротекторы что это как выбрать, насколько они эффективны
Боль в суставах в состоянии покоя
Гонорейный
Поражение суставов гонококковой инфекцией может иметь бактериально-метастатическую и токсико-аллергическую формы. В обоих случаях поражаются крупные суставы, чаще всего один коленный (голеностопный, лучезапястный). Протекает болезнь остро, с высокой температурой, интоксикацией и сильнейшими суставными болями. Колено отекает, краснеет, до него невозможно дотронуться из-за болей.
При проведении своевременного лечения болезнь имеет благоприятный исход. Если же не лечить, быстро наступает полная неподвижность конечности.
Боррелиозный
Боррелиоз или болезнь Лайма – это инфекция, вызываемая спиралевидными бактериями – спирохетами боррелиями. Передается она клещами и протекает в виде последовательной смены стадий:
- Через 1-2 недели после укуса клеща появляются повышение температуры тела, интоксикация, скованность мышц и появление на теле в месте укуса клеща покраснения - эритемы, окруженной концентрическими кольцами, распространяющейся на большие участки тела. При своевременном назначении антибактериальной терапии заболевание может закончиться на этой стадии.
- Развивается через 1 – 3 месяца после начала заболевания и проявляется в виде поражений нервной системы (менингитов, невритов с острыми болями) и сердца (сердечных блокад, миокардитов и др.).
- Поражение суставов начинается через полгода (иногда через 2 года) после начала заболевания у генетически предрасположенных людей и протекает в виде сильных суставных болей, доброкачественного рецидивирующего воспалительного процесса, протекающего по типу инфекционно-аллергического артрита с асимметричным поражением 1 – 2 суставов (чаще всего коленного) и заканчивающегося через несколько лет выздоровлением у большинства больных. Но у некоторых пациентов заболевание может переходить в хроническую форму с постепенным нарушением функции конечностей.
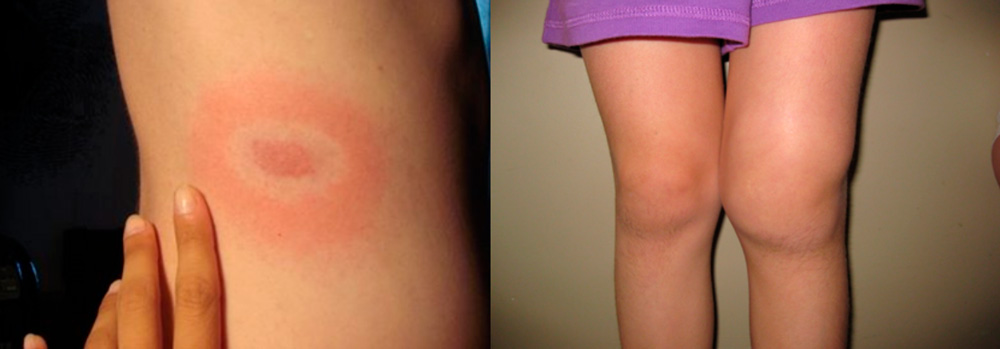
Начальная стадия боррелиоза – мигрирующая эритема и 3 стадия - хронический артрит колена
Вирусный
Развивается на фоне различных вирусных заболеваний:
- Парвовирусная инфекция, вызванная парвовирусом B19 – заболевание протекает с интоксикацией, лихорадкой, кожными проявлениями в виде красных пятен, возвышающихся над кожей папул и точечных подкожных кровоизлияний. Одновременно происходит симметричное поражение суставов. Могут вовлекаться мелкие суставчики кисти, лучезапястные, локтевые, коленные, голеностопные суставы. Симптомы похожи на ревматоидные поражения, но протекают от 3 месяцев до года и имеют благоприятный исход.
- Краснуха – артрит развивается чаще у взрослых женщин на фоне уже имеющихся симптомов краснухи или перед их появлением. У детей такие поражения встречаются редко. Околосуставные ткани отекают, краснеют, появляются сильные боли, нарушающие суставную функцию. Поражение асимметричное с вовлечением мелких суставов кисти, лучезапястных, коленных, локтевых суставов. Артрит продолжается две-три недели, после чего наступает полное выздоровление.
- Вирусные гепатиты В и С – артриты развиваются достаточно часто, но имеют доброкачественное течение и заканчиваются полным выздоровлением. Поражаются мелкие суставы кисти, локтевые, голеностопные и реже другие суставы. Воспаление в суставах обычно начинается до появления желтухи и заканчивается в период ее разгара.
Грибковый
Чаще всего грибковые поражения суставов развиваются при актиномикозе, но встречаются и при другой грибковой инфекции. Патогенные грибки попадают в суставную полость из расположенного рядом костного очага поражения или из отдаленных очагов (кариозные зубы) с током крови. Течение хроническое, с рецидивами и возможным присоединением бактериальной инфекции. Очень часто возникают свищи – ходы, по которым гной из сустава выделяется на поверхность кожи. При отсутствии адекватного лечения приводит к постепенной утрате суставной функции.
Паразитарный
Причиной артрита обычно является эхинококкоз, поражающий костную ткань позвонков, костей таза и длинных костей конечностей. В суставах обычно развивается токсико-аллергический воспалительный процесс. Часто вовлекаются суставы позвоночника, тазобедренные, коленные и локтевые суставы. Течение доброкачественное, но сопровождается сильными суставными болями. Выздоровление наступает при назначении полноценного лечения эхинококкоза.
Инфекционно-аллергический артрит
Инфекционно-аллергический артрит возникает, когда есть аллергия, на фоне которой развивается при неблагоприятных условиях воспалительный процесс в суставах. Заболевание протекает в бурной форме, сопровождается высокой температурой и сильными болевыми признаками. В области поражения наблюдается покраснение, отечность, припухлость. На разных участках кожи – кольцеобразная аллергическая сыпь. Лечением инфекционно-аллергического артрита занимаются ревматолог и аллерголог.
Локализация инфекционного артрита
При инфекционном поражении суставов локализация патологического процесса зависит от особенностей инфекции и ее клинической формы. При острых гнойных артритах – это в основном крупные суставы – коленный, голеностопный, локтевой. Мелкие суставы кисти и стопы поражаются при токсико-аллергической форме туберкулезного и некоторых вирусных артритах.
Асимметричное поражение одного-двух крупных суставов характерно для боррелиоза, чаще всего при этой инфекции в процесс вовлекаются коленные суставы.
В настоящее время одной из глобальных проблем медицины и биологии в целом является нарушение баланса и взаимоотношений в системе микро- и макроорганизмов (по отношению к человеку прежде всего). В основе данных нарушений лежат изменения окружающей среды, во многом вызванные массовым применением препаратов антибактериальной направленности, что в свою очередь вызывает изменения эндоэкологического равновесия в пользу вирусного микроокружения [1].
В частности, в последнее время все чаще указывается на выраженную связь между вирусами и развитием хронических воспалительных процессов, в том числе и аутоиммунных заболеваний соединительной ткани и опорно-двигательного аппарата [4].
Ювенильный ревматоидный артрит (ЮРА) — это хроническое воспалительное заболевание суставов, характеризующееся сложным аутоиммунным патогенезом, неуклонно прогрессирующим течением, возможным вовлечением в процесс внутренних органов и частым развитием инвалидности у детей [4, 5]. Известно, что при ЮРА чаще всего отмечаются сочетанные и генетически обусловленные нарушения в основных звеньях специфического иммунитета (клеточном и гуморальном) [6].
Следует отметить, что супрессивное влияние вирусов и фармакотерапии вызывает нарушения не только в системе иммунитета, но и в системе интерферонов (ИФН), что является дополнительной предпосылкой к персистированию вирусной инфекции при ЮРА.
Таким образом, с одной стороны, в отношении детей, больных ЮРА, имеются все предпосылки для использования противовирусных препаратов, а также препаратов, действующих через систему ИФН, для профилактики и лечения ОРИ. Вместе с тем возможности широкого использования подобных препаратов и прежде всего коммерческих ИФН и индукторов ИФН при аутоиммунных заболеваниях могут быть ограничены. Основным ограничением для применения данных препаратов является риск обострения аутоиммунного процесса [10].
Все выше сказанное определяет актуальность поиска новых возможностей проводить профилактику и лечение ОРИ у детей, больных ЮРА. С этой целью нами в стационаре был использован препарат Анаферон детский (регистрационное удостоверение № 000372/01). Наш выбор определялся наличием у данного препарата следующих свойств и качеств. Анаферон детский обладает противовирусным действием широкого спектра. Препарат действует за счет регуляции системы ИФН, влияя прежде всего на индуцированную вирусом продукцию ИФН (ИФНα и γ) [11, 12]. Являясь индуктором смешанного Th1- и Th2-типа иммунного ответа, Анаферон нормализует (модулирует) баланс Th1/Th2-активностей [11–13]. Основными показаниями к применению Анаферона являются профилактика и лечение гриппа и других ОРИ. Кроме того, препарат рекомендован для лечения вторичных иммунодефицитных состояний различной этиологии, в том числе возникающих в результате частых (рецидивирущих) инфекционных заболеваний (грипп, ОРИ, другие вирусные инфекции).
Анаферон привлек наше внимание еще и потому, что он один из немногих иммунотропных препаратов, которые не противопоказаны больным с системными, аутоиммунными и аллергическими заболеваниями. За последнее время появился ряд публикаций, отражающих успешный опыт применения Анаферона у детей с заболеваниями, оказывающими специфическое отрицательное влияние на иммунную систему (аллергические заболевания, туберкулез и др.). Нами был получен опыт применения Анаферона для профилактики и лечения ОРИ у детей, находящихся на санаторно-курортном лечении [15], а также у детей, инфицированных микобактериями туберкулеза. Из литературы известно, что безопасность и эффективность препарата, применяемого для профилактики и лечения ОРИ, подтверждены также у детей, больных туберкулезом [16], у детей с аллергопатологией (атопический дерматит, аллергический ринит, бронхиальная астма) [17–19] и у детей, родившихся от ВИЧ-инфицированных матерей [20]. Кроме того, мы изучили опыт ревматологов по применению Анаферона у взрослых больных для комбинированной терапии ревматоидного артрита [21, 22].
Всего в исследование было включено 77 детей, соответствующих данным критериям. С помощью рандомизации дети были разделены на 2 группы.
Дети, вошедшие в основную группу (n=50), получали Анаферон по стандартной профилактической схеме (1 табл. в сутки сублингвально) в течение 40 дней. Дети, включенные в группу сравнения (n=27), получали поливитаминные препараты и не получали исследуемый препарат. Согласно протоколу, в случае развившегося ОРИ дети основной группы переводились на лечебную схему приема Анаферона (в первые сутки от начала заболевания — 8 приемов по 1 табл., в последующие — до выздоровления — 3 приема в сутки по 1 табл.) Дети из обеих групп получали для лечения ОРИ необходимую симптоматическую и патогенетическую терапию, однако не получали другие противовирусные и иммуномодулирующие препараты, а также ИФН и их индукторы.
Период наблюдения за больными составил 40 дней.
В качестве основных критериев эффективности мы использовали долю детей, заболевших ОРИ в группе за период наблюдения, а также среднюю продолжительность одного ОРИ в группе и долю случаев развития обострения основного заболевания на фоне ОРИ среди всех случаев ОРИ в группах. Безопасность проводимых профилактических и лечебных курсов оценивали по частоте возникновения нежелательных явлений в группе. Математическую обработку полученных данных проводили с использованием методов вариационной статистики (пакет Statistica 6.1). Определяли средние показатели в группах для параметрических критериев; доли — для непараметрических. Тестировали гипотезу об отличии средних показателей и долей в основной группе и группе сравнения. Средние показатели в группах для независимых переменных сравнивали с использованием двустороннего t-критерия Стьюдента, а в случае отклонения распределения от нормального использовали критерий Манна–Уитни. Сравнение долей осуществляли с использованием теста χ2. Различия считали достоверными при рОсновная группа характеризовалась преобладанием девочек (72%). Средний возраст детей в группе составил 6,6±0,4 лет. В группе сравнения данные показатели были сравнимы и не имели статистически значимых отличий: средний возраст составил 6,4±0,5 лет, а доля девочек — 70,4%. Из сопутствующих заболеваний в обеих группах имели место проявления аллергических реакций — в 6–7% случаев, наличие аденоидных вегетаций и (или) хронического тонзиллита — в 18–20%. В обеих группах преобладала манифестация болезни в возрасте до 6-летнего возраста (4,3±0,8 года в основной группе и 3,9±0,6 года в группе сравнения).
| Параметры | Основная группа (n=50) | Группа сравнения (n=27) | p (t Стьюдента, для долей — х2) |
| Не болели (абс / %) | 42/84% | 9/33% | |
| Заболевшие 1 раз (абс / %)* | 6/12% | 11/41% | =0,005 |
| Заболевшие 2 раза (абс / %) | 2/4% | 6/22% | =0,02 |
| Заболевшие 3 раза (абс / %) | — | 1/4% | — |
| Среднее число ОРИ в группе | 0,2±0,07 | 0,96±0,16 | |
| Средняя продолжительность одного ОРИ, сут | 5,1±0,31 | 7,24±0,33 | |
| Средняя продолжительность повышения температуры тела, сут | 1,7±0,21 | 3,72±0,17 |
* среди численности всей группы.
При обсуждении полученных результатов можно отметить, что проведение курсов неспецифической профилактики ОРИ у детей с ЮРА в эпидемически неблагоприятный период оказывается достаточно эффективным, чтобы предотвратить значительное число ОРИ. При этом полученные данные показали, что поливитаминные препараты, применяемые для этих целей, переносятся хорошо, однако не обладают выраженным профилактическим действием по отношению к вирусным инфекциям и тем более не могут применяться в качестве основного средства для лечения возникших ОРИ. Вместе с тем Анаферон детский оказался способен предотвращать более 70% ОРИ, которые потенциально могут развиться без проведения их неспецифической профилактики у детей, больных ЮРА. Анаферон не только снижал долю детей, у которых развивались ОРИ, но и сокращал их кратность, причем данный показатель статистически значимо был меньше, чем в группе сравнения. Применяемый для лечения развившихся ОРИ Анаферон обеспечивал более быструю нормализацию температуры тела больного ребенка (на 2 дня) и достоверно сокращал общую продолжительность заболевания также на 2 суток. Кроме того, в группе детей, получавших Анаферон, была отмечена тенденция к уменьшению частоты и кратности развития обострений основного заболевания на фоне развившихся ОРИ — в основной группе обострение развивалось при каждом десятом ОРИ, в то время как в группе сравнения практически каждое второе ОРИ завершалось развитием обострения основного заболевания.
Р. М. Балабанова, профессор, доктор медицинских наук, руководитель отдела изучения и коррекции аутоиммунных нарушений ГУ Института ревматологии РАМН
Е. В. Шекшина, кандидат медицинских наук, младший научный сотрудник
Хроническое системное иммуноопосредованное воспалительное заболевание с преимущественным поражением периферических (синовиальных) суставов по типу симметричного эрозивнодеструктивного полиартрита, сопровождающегося пролиферацией синовиоцитов и ангиогенезом (что сближает его с онкологическими заболеваниями), называют РЕВМАТОИДНЫМ АРТРИТОМ (РА).
Распространенность РА среди взрослого населения различных климато-географичеcких зон – в среднем 0,6–1,3%. Ежегодная заболеваемость за последние годы сохраняется на высоком уровне – 0,02%. Для РА характерен половой диморфизм: женщины болеют в 3–4 раза чаще, чем мужчины. Во время беременности нередко развивается ремиссия. У женщин пик заболеваемости РА приходится на 35–55 лет, у мужчин – на 40–60 лет.
Этиология и патогенез заболевания
До настоящего времени причина возникновения РА не уточнена. В его развитии равнозначна роль как генетических, так и внешнесредовых факторов, среди которых предполагается участие инфекции, иммунизации, питания, переливания крови, курения, УФО-облучения и др.
О генетической предрасположенности к заболеванию свидетельствует его высокая агрегация в семьях больных РА. Заболеваемость им в раннем возрастезначительно чаще встречается в семьях, где были родственники с РА. Роль генетической предрасположенности к этому заболеванию подтверждена и его более высокой частотой среди монозиготных близнецов (12–32%) по сравнению с дизиготными (3,5–9%).
Из эндогенных факторов в развитии РА определенную роль играют половые гормоны, что подтверждается большой частотой заболевания среди женщин, а также положительным влиянием беременности на течение РА и его обострением после родоразрешения или ее прерывания. У женщин, больных РА, выявлен дефицит андрогенов – тестостерона и дегидроэпиандростерона, у мужчин также низок уровень тестостерона.
Участие половых гормонов в развитии РА подтверждает влияние экзогенных эстрогенов (оральных контрацептивов), снижающих риск развития РА.
Среди внешнесредовых факторов возникновения этого заболевания в первую очередь предполагается роль инфекции. Классических эпидемиологических доказательств инфекционной этиологии РА нет, но это не исключает ее участия в генетически предрасположенном организме, о чем свидетельствуют результаты исследований на животных.
Специфический (инфекционный) триггер РА не установлен, но есть много претендентов: микоплазма, парвовирус В19, цитомегаловирус (ЦМВ), вирус простого герпеса 6-го типа, Эпстайна – Барр вирус (ЭБВ). Один из механизмов развития так называемых аутоиммунных заболеваний, к которым относится и РА, – “молекулярная мимикрия”. Микробы и вирусы могут содержать белковые структуры (аминокислотные последовательности), сходные с белками хозяина. Иммунный ответ на патоген с целью его элиминации может “изменить направление”, в результате чего возникает перекрестная реакция с собственными антигенами, структурно схожими с чужеродными.
В сыворотке больных РА содержатся в повышенных титрах антитела к латентному или репликативному антигену ЭБВ. Тлимфоциты периферической крови больных РА не способны контролировать ЭБВ-позитивные В-лимфобластоподобные линии, и это объясняет частоту ЭБВ-инфицированных периферических В-лимфоцитов при РА в сравнении с контролем. Длительная экспозиция одного или нескольких вирусов, что нередко имеет место при РА, может играть триггерную роль в инициации иммунного воспаления, так как антигены вируса не только перекрестно реагируют с антигенами хозяина, но и выполняют адъювантный эффект.
Патогенез
ЭФ РА(?) > Трансформация IgG в АутоАГ > IgM,A,G-ревматоидные факторы + АутоАГ = ЦИК > синовиальная ткань > повышение активности медиаторов воспаления, проницаемости микрососудов, хемотаксис лейкоцитов, фагоцитоз ЦИК > повреждение лизосом лейкоцитов и макрофагов > высвобождение лизосомальных ферментов > повреждение клеточных структур > образование новых АутоАГ > цепная реакция
Неизвестный этиологический фактор ревматоидного артрита вызывает первичную иммунную реакцию в виде образования антител в виде IgG. По неизвестной причине они трансформируются и превращаются в аутоантигены, которые в условиях иммунодефицита по Тсупрессорам инициируют выработку В-лимфоцитами антител групп Ig M, A, G (ревматоидные факторы). Они образуют с аутоантигеном циркулирующие иммунные комплексы (ЦИК), оседающие главным образом в синовиальной оболочке суставов и вызывающие повышение активности медиаторов воспаления, нарушение микроциркуляции, активацию хемотаксиса лейкоцитов.
В процессе фагоцитоза повреждаются лизосомы нейтрофилов и макрофагов, высвобождаются лизосомальные ферменты, повреждающие клеточные структуры. Образуются новые аутоантигены, новые аутоантитела, и патологический процесс приобретает характер цепной реакции. На какое-то время она может затихать, но затем вновь возобновляется под влиянием специфических и неспецифических факторов.
Исход воспалительного процесса характеризуется редукцией, а затем и прекращением миграции клеток в воспаленную ткань с последующим повышением апоптоза клеток и восстановлением тканей. Постоянная активация моноцитов и макрофагов приводит к неспособности их блокировать эти процессы, что способствует переходу острого воспаления в хроническое.
Важную роль в патогенезе РА играют простагландины.
Другой механизм, участвующий в воспалении и деструкции хряща, – усиление новообразования сосудов. Этот ангиогенез в синовии связывают с действием провоспалительных цитокинов, который приводит к усилению проникновения воспалительных клеток в ткани сустава, что обеспечивает поступление питательных веществ, необходимых для нормального функционирования воспалительных и пролиферирующих клеток. Важная роль отводится нейтрофилам, увеличение количества которых в синовиальной жидкости приводит к гиперпродукции хемоаттрактантов. Дегрануляция нейтрофилов сопровождается высвобождением протеиназ, реактивных форм кислорода, продуктов метаболизма арахидоновой кислоты.
Процессы, происходящие в синовии при РА, напоминают локальное злокачественное новообразование. Масса вновь образованных клеток и соединительной ткани во много раз превышает массу нормальной синовиальной оболочки. Образующийся при РА паннус обладает способностью к инвазии и деструкции хряща, субхондральной кости и связочного аппарата. Синовиоциты больных РА обладают фенотипическими свойствами трансформированных опухолевых клеток. В синовиальной жидкости и тканях обнаружено увеличение уровня факторов роста – тромбоцитарного и фибробластного. Сходство ревматоидного синовита и локализованного злокачественного новообразования проявляется и на молекулярном уровне. Ряд цитокинов обладает способностью вызвать длительно сохраняющиеся фенотипические изменения клеток.
Патологический процесс при РА в первую очередь развивается в суставах и околосуставных тканях и имеет свои особенности в зависимости от стадии заболевания.
Синовит выявляется рано, даже в клинически неизмененном суставе. Нарушения в синовиальной мембране обусловлены иммунологическими процессами. В начальных стадиях процесса строма скудно инфильтрирована лимфоцитами, плазматическими клетками, лаброцитами (тучными клетками) и макрофагами. Т-лимфоциты имеют морфологические и иммунологические характеристики антигензависимых клеток. В-лимфоциты как предшественники плазматических клеток и сами плазматические клетки синтезируют иммуноглобулины in situ.
На ранней стадии имеет место пролиферация кроющих синовиоцитов типа В, имеющих морфологическое сходство с фибробластами. Клетки формируют несколько слоев с очаговым “частоколом”. Встречаются капилляриты и продуктивные васкулиты. На этой стадии выявляется преобладание экссудативных и альтернативных процессов в синовиальной мембране – отек, полнокровие и очаги фибриноидных изменений.
Для развернутой стадии характерна картина хронического пролиферативного процесса. При этом отмечаются выраженная гиперплазия и гипертрофия ворсинок. Становится более очевидной пролиферация кроющих синовиоцитов с формированием нескольких слоев и наличием гигантских клеток.
В морфогенезе ревматоидного синовита важное место занимает поражение сосудов микроциркуляторного русла – васкулиты и ангиоматоз. В стенках сосудов выявляются отложения иммуноглобулинов. На этой стадии в синовиальной мембране могут формироваться ревматоидные узелки, а в случае присоединения амилоидоза – амилоидные массы.
Особенность позднего периода – выраженный ангиоматоз, сочетающийся с продуктивными васкулитами и тромбозами. Волнообразное течение болезни находит отражение и в морфологии синовиальной мембраны.
Под ней в перихондральной ее части формируется синовиальный паннус – сосудистая и фиброзная ткань. В процессе развития он врастает в хрящ, разрушая его.
Специфический морфологический признак при РА – ревматоидный узелок. Его можно увидеть в различных органах и тканях, но наиболее частая локализация – кожа и синовиальная мембрана. Узелок представлен очагом фибриноидного некроза, окруженного палисадообразно расположенными макрофагами, лимфоцитами и плазматическими клетками. Нередко в нем видны гигантские многоядерные клетки. С помощью моноклональных антител удалось подтвердить участие иммунопатологических реакций в развитии ревматоидных узелков.
Особое место в прогрессировании ревматоидного процесса занимают васкулиты, которые выявляютсяво всех органах, но не имеют специфических морфологических признаков. Исследование сосудов кожи у больных РА с признаками кожного васкулита показало, что изменения микроциркуляторного русла носят генерализованный характер.
При этом заболевании обнаруживают продуктивные, деструктивные и деструктивно-продуктивные васкулиты. Сосуды поражены генерализованно и полиморфно – от умеренной пролиферации эндотелия и инфильтрации наружной оболочки до некроза средней оболочки стенки сосуда. Преобладают поражения сосудов мелкого калибра – кожи, скелетной мускулатуры, внутренних органов. Наиболее типичны продуктивные васкулиты и тромбоваскулиты, реже встречается панваскулит типа узелкового полиартериита с очаговым или тотальным некрозом средней оболочки.
Изменения в сосудах крупного и среднего калибра могут быть обусловлены поражением vasa vasorum и развивающейся в связи с этим ишемией сосудистой стенки. Иногда наблюдается картина аортита с последующим склерозом и расширением устья аорты.
Поражение серозных оболочек проявляется чаще всего сухим плевритом с незначительным фибринозным выпотом, что ведет к образованию спаек. В легочной ткани процесс развивается по типу хронической межуточной пневмонии, очагового или диффузного пневмосклероза с образованием ревматоидных узелков.
Поражение почек обусловлено гломерулонефритом (мембранозным или мембранозно-пролиферативным), нефроангиосклерозом, хроническим интерстициальным нефритом, ангиитом. Часто нефропатия обусловлена отложением амилоидных масс. В латентной стадии амилоид обнаруживают периваскулярно в ткани пирамид и некоторых артериолах клубочков, в нефротической стадии в большинстве клубочков, стенках сосудов, пирамидах отложения амилоида массивные.
В желудочно-кишечном тракте выявляют признаки гастрита, энтерита, колита, которые достаточно часто обусловлены иммунокомплексным процессом, что подтверждается обнаружением в подслизистой основе иммуноглобулинов, фибрина. Наиболее тяжелые изменения желудочно-кишечного тракта связаны с отложением амилоидных масс в слизистой оболочке, стенке сосудов с развитием лимфоидно-плазмоцитарной инфильтрации, атрофией слизистой оболочки и подслизистой основы.
В биоптатах печени отмечают изменения в портальной соединительной ткани с продуктивными васкулитами, лимфоидно-гистиоцитарной или плазмоцитарной инфильтрацией, склеротические изменения, а также дистрофию, некроз гепатоцитов. При амилоидном поражении отложения амилоида наблюдают в ретикулярной строме долек печени по ходу внутридольковых капилляров, в стенке сосудов. Амилоид нередко замещает большую часть паренхимы.
В селезенке выявляют гиперплазию и плазматизацию лимфоидной ткани, пролиферацию эндотелия синусов, отложения белковых преципитатов.
При РА поражаются различные отделы нервной системы и ее элементы (сосуды, соединительная ткань, нервные волокна). Периферическая система в основном поражена за счет vasa nervorum. В соединительной ткани нервной системы выявляют фибриноидные изменения, лимфоидные и плазмоклеточные инфильтраты, а также отложения амилоида, микронекрозы.
Клиническая картина РА
Суставной синдром – ведущий в клинической картине РА. Начало заболевания чаще всего подострое (55–70%), как правило, спровоцированное перенесенной острой инфекцией или обострением хронической, охлаждением, травмой, стрессовой ситуацией.
Развитию артрита за несколько недель или месяцев предшествует продромальный период, признаки которого – усталость, похудание, периодически возникающая боль в суставах (часто на изменение атмосферного давления), снижение аппетита, повышенная потливость, субфебрильная температура, небольшая анемия, увеличение СОЭ.
По данным В. А. Насоновой и М. Г. Астапенко (1989), в продромальном периоде у 32% больных развивается утренняя скованность, особенно в суставах конечностей, которая при активном движении проходит. Среди причин возникновения этого симптома – нарушение нормального ритма выработки гормонов надпочечниками со смещением на более поздний период суток, а также аккумуляция цитокинов в отечной жидкости воспаленных суставов во время сна.
В начальном периоде РА у 1/3 больных отмечают артралгии, усиливающиеся при движении, у 2/3 – симметричный артрит мелких суставов кистей и стоп. Боль и скованность наибольшие в утренние часы, постепенно убывающие к вечеру. Интенсивность и длительность этих проявлений коррелирует с прогрессивностью болезни, сохраняясь при выраженной активности до обеда, а у отдельных больных проходит только к вечеру.
У 8–15% страдающих РА заболевание начинается остро в течение нескольких дней. При этом пациент может указать время и движение, спровоцировавшее боль. Артралгии могут сопровождаться такой же резкой болью в мышцах, длительной утренней скованностью, лихорадкой, что приводит больного к обездвиженности.
В 15–20% случаев РА начинается незаметно с медленным прогрессированием артрита без повышения температуры тела, ограничения движений.
Поражение суставов в ранней стадии РА может быть нестойким и самопроизвольно исчезать на несколько месяцев и даже лет. Стойкий полиартрит с прогрессированием воспалительного процесса отмечен у 70% больных. Первыми, как правило, при РА вовлекаются вторые-третьи пястно-фаланговые, проксимальные межфаланговые и суставы запястья, реже – плюсне-фаланговые. Затем по частоте поражения следуют коленные, локтевые, голеностопные. Позднее вовлечение крупных суставов некоторые авторы объясняют более высоким соотношением поверхности синовиальной мембраны к суставному хрящу. По нашим данным, у 87% заболевших все началось с поражения мелких суставов кистей, у 9,7% – крупных (коленные, плечевые). Стойкий прогрессирующий полиартрит имел место у 43%, у 57% больных он носил волнообразное течение с периодами ремиссии. У 20,4% пациентов развился ишемический некроз головок бедренных костей.
Некоторые суставы в дебюте болезни остаются интактными (“суставы исключения”) – дистальные межфаланговые, первый пястнофаланговый сустав большого пальца кисти, проксимальный межфаланговый мизинца.
Ранняя фаза РА характеризуется преобладанием экссудативных явлений симметрично пораженных суставов кистей с наличием выпота, определяемого по симптому флюктуации, воспалительному отеку периартикулярных тканей, резкой болезненности при пальпации, положительному симптому сжатиякисти.
Над мелкими суставами может быть слегка гиперемирована кожа, а над крупными – повышенная температура. Вследствие воспаления суставных тканей и рефлекторного спазма мышц резко ограничивается движение в пораженных суставах, что ведет к развитию мышечной атрофии. Артрит сопровождается воспалительным поражением влагалищ сухожилий, чаще разгибателей, реже – сгибателей кисти и стопы.
У 15–20% заболевших в первый год болезни может произойти спонтанное затухание симптомов артрита и развиться ремиссия болезни. Но у большей части больных процесс принимает прогрессирующий характер с переходом в экссудативно-пролиферативную фазу.
Наряду с общими симптомами (слабость, астения, похудание, ухудшение сна, аппетита, субфебрильная температура) прогрессирует суставной синдром. Преобладание пролиферативных процессов в суставных тканях приводит к их утолщению, стойкой плотной или пружинящей припухлости периартикулярных тканей, что вызывает изменение конфигурации суставов, в первую очередь мелких – кистей и стоп, запястья, лучезапястных, коленных, локтевых. Плечевые, тазобедренные суставы поражаются при РА редко, еще реже вовлекаются суставы позвоночника.
Классификация РА
Первая была предложена А. И. Нестеровым в 1961 году, после чего неоднократно уточнялась в связи с появлением новых данных о клинике и вариантах течения РА. Последний был одобрен на I Всероссийском конгрессе ревматологов в 2003 году.
Выделено 2 клинико-иммунологических варианта: серопозитивный и серонегативный РА. Полиартрит как основное проявление этого заболевания включает в себя оба варианта. Внесуставные проявления в основном отнесены к серопозитивному варианту и представлены лишь там, где ревматоидная принадлежность не вызывает сомнений. Сюда же отнесена особая форма РА – синдром Фелти. Серонегативный вариант РА имеет свои клинико-лабораторные особенности, к нему отнесен и синдром Стилла взрослых.
Характеризуя активность заболевания, выделяют 4 степени: 0 – ремиссия, 1 – низкая, 2 – средняя, 3 – высокая. Определение активности базируется на наиболее лабильных клинических и лабораторных признаках:
- выраженность боли по визуальной аналоговой шкале (ВАШ), где ее отсутствие приравнивается к нулевой отметке, а максимальное значение – к 10 см
- длительность утренней скованности в минутах
- показатели СОЭ и СРБ
Определение СРБ в нашей стране не стандартизировано, поэтому мы взяли за исходное значение норму, а далее – ее 2–3- и более кратное превышение.
Зарубежными ревматологами предложено для оценки активности РА применять DAS (счет активности болезни).
По МКБ Х принята такая классификация РА: Воспалительные полиартропатии

Здравствуйте.
Вакцинация противопоказана.
Стимуляция иммунной системы может вызвать декомпенсацию аутоиммунного заболевания.
Рисковать не нужно.
Алексей, был репортаж о вакцине из центра Чумакова, там говорилось, что начинают исследования на добровольцах с онкологией и аутоиммунными заболеваниями, возможно все не так плохо будет?

Пока нет убедительных данных о безопасности вакцины, для таких пациентов, в рандомизированных клинических исследованиях, (а их нет) я бы не рисковал.

Здравствуйте. Вакцинация в данном случае противопоказана.
Для людей старше 65 лет пока нет доказанной безопасности вакцины.

Здравствуйте, конечно, прививку при наличии ревматоидного артрита делать нельзя. можно рассматривать вакцинацию только в период ремиссии, при наличии отрицательных показателей СРБ,РФ, СОЭ,при отсутствии осложнений и тем более наличия патогенетической терапии. А у женщины какие были неприятные последствия ранее проводимой вакцинации?
Мария, вот как раз у меня ремиссия ревматоидного артрита, анализы вроде нормальные. А женщина уже не помнит про ту вакцинацию ничего, кроме неприятных ощущений , кажись от повышенной температуры

Здравствуйте. Аутоимунные заболевания являются противопоказанием для вакцинации Спутником V.
Если у женщины 70 лет нет противопоказаний, то привиться надо. Это ее защитит от серьёзных осложнений . Для принятия решения о вакцинации нужны дополнительные данные: на какую вакцину было повышение температуры? Какие сопутствующие заболевания?
На сервисе СпросиВрача доступна бесплатная консультация педиатра онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно. Задайте свой вопрос и получите ответ сразу же!


Маргуба,
Нет, мы сдавали кровь, мочу и экг делали через месяц после выздоровления. Больше нас ничего не беспокоило


Маргуба,
Так я только за это! Но врач посмотрела на наши свежие анализы и сказала все хорошо. никакого лечения. А у нас биохимия крови показывает АСЛО 337,3.
Мне просто сейчас не совсем понятно, с чего начинать??

Сделать узи суставов нижних конечностей для исключения ра. Необходимо взять мазок из зёва на стрептококк и сдать кровь на иммуноглобулины m g к цмв и вэб , и конечно консультация лор врача
Ксения,
Так у неё суставы то и не болели. У неё жалобы на икры! Нажимаешь на икры- она морщиться. А колени и суставы - вообще не реагирует, никаких болей там нет

сдать мазок из зева и носа с конс лор и ревматолога
сдать оам. УЗИ почек.
УЗИ суставов сейчас не надо
боли в мышцах=миалгия-может быть как ревматической, так и неревматической -на фоне ОРВИ, гриппа.

Здравствуйте икры могут болеть из за воспаления нервов или патологии сосудов
Нужно сделать УЗИ сосудов

Анастасия,
Так нас вообще выписывать хотят, говорят все в норме.
Так что о стационаре речи вообще не велось

Анастасия,
А у нас с карточке обращение к педиатру в пятницу с температурой и диагноз грипп, второй врач, который на дом приходил и поставил этот диагноз - на вчерашний день записи не было никакой. Наш участковый врач болеет- и мы сейчас беспризорные. Вот я и интересуюсь, с чего мне начинать в понедельник? Лечения никакого не назначено.

Здравствуйте! Какие жалобы на сегодняшний день? Повышение АСЛО говорит о том, что была "встреча" организма со стрептоккоком и сформировались антитела. Это иммунная память. Если вы перенесли скарлатину, оно и понятно что АСЛО будет выше нормы.
Аида,
Скарлатина у нас была 2 года назад, АСЛО повышенный сейчас.
Стрептококковая бактерия сама не пройдёт - нужны антибиотики.
Диагноз нам подтвердили, реактивный артрит на фоне гриппа. Противовирусные уже не надо пить, само пройдёт- сказал мне врач вчера. жалоб нет, осталась недосказанность. Я поняла уже, что надо сдать анализ оам, кровь на антитела, сделать экг и узи сердца.

Первичная асло для постановки диагноза не годится, нужен повторный анализ на асло. Может свидетельствовать о носительстве стафилококкка ( мазок из зева на чувствительность и флору).
Реактивный артрит включает цистит, увеит ( о данных симптомах не говорили).
Ревматизм включает поражение сердца почек. Вот пока надо проверить их ( эхо-кг+ оам, УЗИ почек).
Екатерина,
Спасибо большое за ответ!
У нас вообще кроме температуры и болей в икроножных мышцах не было ничего. Ни насморка, ни кашля. Меня тоже очень смутило, что по одному анализу нам подтверждают диагноз и в понедельник выписывают дочку в школу. Ну допустим, что это осложнение после гриппа, как врач сказал - а грипп то когда был? За неделю и грипп и осложнение и выздоровление.

Спасибо зс ответ. Вам обязательно нужно повторить АСЛО! Если титр растет, значит нужно искать очаг и лечить. Необходимо сдать мазок из зева и носа с определением чувствительности к аб, сделать ЭКГ и ЭхоКГ, оам и узи почек.
Читайте также:

