Холестатический гепатит от уреаплазмы
Обновлено: 18.04.2024
Ключевые слова
Раскрытие информации о конфликте интересов:
Авторы заявляют об отсутствии конфликта интересов.
Информация о статье:
Депонировано (дата): 26.09.2020
Все авторы прочитали и одобрили окончательную рукопись статьи.
Информация о рецензировании:
"Качественная Клиническая Практика" благодарит анонимного рецензента (рецензентов) за их вклад в рецензирование этой работы.
Комментарий редакции:
В случае возникновения разночтений в тексте или расхождений в форматировании между pdf-версией статьи и её html-версией приоритет отдаётся pdf-версии.
Для цитирования:
For citation:
Введение
Существует несколько классификаций лекарственно-индуцированных поражений печени, протекающих с холестазом (ЛИППХ).
По МКБ-10 данный тип нарушений кодируется как [2]:
К.71 — токсическое поражение печени.
- лекарственная идиосинкразическая (непредсказуемая) болезнь печени;
- токсическая (предсказуемая) болезнь печени.
При необходимости идентифицировать токсическое вещество используют дополнительный код внешних причин (класс ХХ).
- алкогольная болезнь печени (К.70);
- синдром Бадда—Киари (I82.0);
Существует также патогенетическая классификация ЛПП, которая предусматривает 2 варианта повреждения органа [2]:
- прямое повреждающее действие (тип А): дозозависимый эффект — при достижении определённой дозы, препараты оказывают непосредственное повреждающее действие на печень; механизм — непосредственное повреждение клеточных структур; эффект воспроизводим и предсказуем; латентный период короткий; гистологические изменения — некроз гепатоци-тов и/или жировая дистрофия печени;
- непрямое повреждающее (идиосинкразическое) действие (тип В): токсический эффект не зависит от дозы; токсический эффект идиосинкразический — индивидуален, невоспроизводим и непредсказуем, зависит от генетических особенностей пациента; латентный период от нескольких дней до нескольких месяцев; механизм — образование гепатотоксических метаболитов в реакциях I или II фазы, или индивидуальная гиперчувствительность — идиосинкразия.
Согласно третьей классификация — по типам поражения печени (клинико-лабораторные варианты ЛПП) различают [2][3]:
- гепатоцеллюлярный вариант — характеризуется повышением активности аланинами-нотрансферазы (АЛТ) более чем в 2 раза в сравнении с верхней границей нормы (ВГН) или соотношением АЛТ/ЩФ ≥5;
- холестатический вариант — типично повышение активности ЩФ > 2ВГН или соотношение АЛТ/ЩФ ≤2 при хроническом течении;
- смешанный вариант — свойственно повышение активности АЛТ > 2ВГН и соотношение 2 > АЛТ/ЩФ и > 5 при хроническом течении.
Токсическое поражение печени с холестазом, вызванное приёмом ЛС, по своей сути является нежелательной реакций (НР), и, следовательно, к ней применима соответствующая классификация НР, которые подразделяют на 4 типа — А, В, С и D [4][5]:
- тип А — предсказуемые нежелательные реакции, которые обусловлены непосредственно фармакологическим действием ЛС или в результате межлекарственных взаимодействий;
- тип В — непредсказуемые не зависящие от дозы нежелательные реакции (например реакции идиосинкразии или анафилаксии);
- тип С — реакции, связанные с длительной терапией (такие эффекты, как толерантность, зависимость, синдром отмены, кумуляция);
- тип D — отсроченные эффекты ЛС.
По аналогии с рекомендациями Российского научного медицинского общества терапевтов (РНМОТ) и Научного общества гастроэнтерологов России (НОГР) [2], Российская гастроэнтерологическая ассоциация (РГА) [4] в своих клинических рекомендациях подразделяет лекарственно-индуцированные поражения печени на собственно гепатотоксические (категория А) и идиосинкразические реакции (категория В). В этих рекомендациях [4][6][7] выделены несколько фенотипов ЛПП:
1. Холестатический вариант:
- острый внутрипечёночный холестаз без/с воспалительной инфильтрацией;
- хронический внутрипечёночный холестаз без/с воспалительной инфильтрацией;
- с развитием билиарного склероза;
- с исчезновением желчных протоков;
2. Смешанный гепатоцеллюлярный и холестати-ческий вариант.
Существует также и классификация ЛИППХ, основанная на клинической и гистологической картине поражения печени, протекающего с холестазом [8]:
В данной статье мы хотели бы остановиться именно на лекарственно-индуцированном поражении печени, сопровождающимся холестазом (ЛИППХ), как относительно редкой и потенциально не распознаваемой патологии.
Цель работы — анализ и систематизация данных о ЛС, которые могут потенциально приводить к развитию ЛИППХ, о патофизиологических механизмах его развития, способах диагностики, лечения и профилактики. Вопросы поражения печени фитотерапевтическими препаратами, продуктами питания и биологически активными добавками в данном обзоре не рассматривались.
Распространённость
Точные данные о распространённости ЛИППХ в общей популяции отсутствуют. В нескольких крупных ретроспективных исследованиях [10][11][12][13] было показано, что среди случаев ЛПП холестаз наблюдается у 20—40 % пациентов, смешанный вариант — у 12—20 %, а гепатоцеллюлярный — у 48—58 % пациентов [10][11][12][13][14]. По данным Sgro C и соавт. [15] распространённость ЛПП в общей популяции жителей Франции составляет 13,9 случаев на 100 000 населения в год, среди которых холестатический или смешанный вариант повреждения наблюдается в 33 % случаев [15]. В аналогичном исследовании, проведённом в Исландии [16], было показано, что распространённость ЛПП составляет 19 случаев на 100 000 населения в год, среди которых 32 % случаев — холестатический вариант повреждения, а 26 % — смешанный [16]. Как правило, пациенты с холестатическим/смешан-ным вариантом ЛПП были старше тех, у которых наблюдалось только гепатоцеллюлярное повреждение (60 лет против 46 лет, р=0,004), что согласуется с результатами других исследований [10][11][12][13][14][15][16].
Прогноз
В работе Zimmerman H и соавт. [11] было показано, что лекарственно-индуцированная желтуха ассоциирована с тяжёлым поражением печени и плохим прогнозом (смертность до 10 %) [11]. Это явление получило название закон Хая (Hy’s law) и позднее было валидировано в серии крупных исследований [10][12][13], где количество случаев летальных исходов/ необходимости трансплантации печени составило 9—12 % [10][12][13]. Первоначально предполагалось, что это правило работает только для печёночно-клеточной желтухи, а негативный прогноз считали обусловленным сопутствующей патологией [17], однако в исследованиях [10][12][13] было показано, что ЛИП-ПХ ассоциируется с частотой летальных исходов на уровне 5—14 % [10][12][13] (для сравнения частота летальных исходов при печёночно-клеточном и смешанном типе ЛПП составляет 7—13 % [10][12][13] и 2 % [10][12][13], соответственно), то есть прогноз у пациентов с лекарственно-индуцированным холе-статическим типом повреждения не лучше, чем при гепатоцеллюлярном [10][12][13].
Патофизиологические механизмы
Основные механизмы развития лекарственно-индуцированного холестаза включают в себя [1]:
1) идиосинкразию и/или развитие реакции гиперчувствительности;
2) избирательное взаимодействие с системами транспорта компонентов желчи на микрострук-турном уровне;
3) селективное нарушение захвата и переноса компонентов желчи через мембрану синусоидов;
4) повреждение желчных протоков.
Молекулы главного комплекса гистосовместимости имеют низкую аффинность к ЛС, равно как и к эпитопам, образованным комплексами белок+ЛС. Аналогично и Т-клетки в норме склонны демонстрировать толерантность к эпитопам белок+ЛС, что связанно с их клональной анергией в этом отношении. Вероятно, этими факторами можно объяснить сравнительно низкую встречаемость иммуноаллергиче-ских реакций в целом и иммуноаллергического хо-лестатического поражения печени, в частности [1].
Второй механизм лекарственно-индуцированного холестаза является одним из наиболее важных и состоит во взаимодействии ЛС с транспортными системами экскреции желчи. Многие препараты, оказывающие холестатический эффект, служат субстратами транспортных белков, расположенных на базолатеральной и каналикулярной мембранах гепатоцитов, которые по своему строению в большинстве случаев принадлежат к суперсемейству аденозинтрифосфат-связывающих кассетных транспортёров [22]. Структурно-функциональные особенности последних находят отражение в индивидуальной предрасположенности пациентов к развитию лекарственно-индуцированных нарушений секреции желчи. Вариации в строении и функционировании кассетных транспортёров по аналогии с генетическим полиморфизмом цитохрома Р450, ведущим к изменениям метаболизма ЛС, находятся в центре внимания фармакогеномики как стремительно развивающейся научной области [23]. К примеру, известно, что мутации в гене MDR3, кодирующим экспортирующую помпу для фосфолипидов в печени, способствует возникновению внутрипечёночно-го холестаза при беременности в силу повышения содержания в крови метаболитов прогестерона [24]. Сходным образом, недавно была описана мутация в структуре ещё одного транспортного белка печени — помпы, выводящей соли желчных кислот (англ., bile salt export pump, BSEP), и, вероятно, её наличие служит причиной развития внутрипечёночного холес-таза у подростков, принимающих определённые нестероидные противовоспалительные препараты.
У людей скорость-лимитирующим этапом в образовании желчи является транспорт солей желчных кислот через плазматические мембраны, расположенные на канальцевой поверхности гепатоцитов, реализующийся за счёт работы BSEP [27]. В ходе исследований мембранных везикул изолятов клеток, экспрессирующих в большом количестве BSEP, было показано, что такие ЛС как циклоспорин А, рифа-мицин SV, глибенкламид и антагонист эндотелина бозентан вызывают cis-ингибирование BSEP-опосредованного транспорта таурохолтатов, чем потенциально можно объяснить холестатический эффект указанных препаратов [1]. Интересно отметить, что сахароснижающий препарат из группы тиазолидин-дионов — троглитазон, изъятый с рынка в марте 2000 г. в связи со своим гепатотоксическим эффектом, в экспериментальных работах полностью подавлял активность BSEP [28].
Третий механизм лекарственно-индуцированного холестаза сводится к нарушению рядом ЛС захвата в синусоидах веществ, в норме секретируемых с желчью, прежде всего билирубина и применяемого в диагностических целях бромосульфофталеина. К таким препаратам относится рифампицин и рифа-мицин SV [1], которые метаболизируются в печени и элиминируются с желчью. Рифампицин увеличивает содержание солей желчных кислот в сыворотке крови у 72 % пациентов после приёма первой дозы [29], что указывает на его роль в захвате данных соединений в синусоидах печени. Вероятно, холестатические эффекты рифампицина и рифамицина SV реализуются через влияние на белковые транспортёры органических анионов (англ., organic anion transporting polypeptides, OATP) [1]. Так известно, что рифампи-цин в концентрации 10 мкмоль/л ингибирует транспорт бромосульфофталеина через ОАТР8 на 50 %, в то время как активность OATP-А, OATP-В и OATP-С подавляется им лишь порядка 15 %. В отличие от этого рифамицин SV в концентрации 10 мкмоль/л угнетает все типы OATP в печени человека более чем на 50 % [30].
В экспериментальных работах продемонстрировано, что введение грызунам бактериальных липополисахаридов сопровождалось снижением экспрессии гена, кодирующего белок второго типа множественной лекарственной резистентности (англ., multidrug resistance protein 2, MRP2) — белок формирующий канальцевый транспортёр органических анионов в печени, а также вело к возникновению холестаза, который в реальной практике нередко сопутствует сепсису и токсическому поражению печени [35]. Как установлено, провоспа-лительный цитокин интерлейкин-1 в ингибирует ретиноид-опосредованную активацию промотерных участков генов MRP2 и натрий-зависимый по-липептидный котранспортёр таурохолата (англ., Na+-taurocholate cotransporting polypeptide, NTCP) посредством снижения в ядре клетки содержания рецепторов ретиноевой кислоты ( англ ., retinoic acid receptor, RAR) и Х-рецептора ретиноидов ( англ ., retinoid X receptor, RXR) [36]. В дополнение к этому, интерлейкин-1в снижает уровень ядерного фактора-а гепатоцитов, который критически важен для активации транскрипции гена NTCP у грызунов и MRP2 и OATP-C — у человека [1]. В свете представленных данных, можно предполагать, что любой ксенобиотик, вызывающий гепатит, вероятно, влияет и на экспрессию генов белковых транспортёров печени, участвующих в обмене желчи, через изменение содержания важнейших транскрипционных ядерных факторов, на которое в свою очередь оказывают влияние провоспалительные цитокины.
Факторы риска
Факторами риска развития ЛИППХ являются: возраст старше 65 лет, генетическая предрасположенность (для некоторых ЛС), приём алкоголя, сопутствующие заболевания, прежде всего заболевания печени (включая стеатогепатит), ВИЧ-инфекция, повторный курс лечения препаратами, которые потенциально могут вызывать данное осложнение (например, антибиотиками), особенности химического строения молекулы ЛС, высокая липофильность ЛС, билиарная экскреция, приём потенциально гепато-токсичных препаратов в высоких дозах, печёночный метаболизм ЛС (табл. 1) [31][37]
Факторы риска развития ЛИППХ [1][37][38][39][40][41][42][43][44][45][46][47][48][49][50][51][52][53][54][55]
Что такое уреаплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ковалык Владимира Павловича, уролога со стажем в 27 лет.
Над статьей доктора Ковалык Владимира Павловича работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Уреаплазмоз — группа воспалительных и дисбиотических заболеваний, ассоциированных с уреаплазмами (Ureaplasma species). С 1995 г. различают два вида уреаплазм: Ureaplasma urealyticum и Ureaplasma parvum. Геном U.urealyticum значительно больше U.parvum. В настоящее время невозможно утверждать, что какой-либо из видов является явным патогеном или наоборот — сапрофитом.
Уреаплазмы — условно-патогенные микроорганизмы, которые часто обнаруживаются на слизистых оболочках мочеполовых органов, верхних дыхательных путей и в рото-носоглотке.
В 2021 году профессиональные российские сообщества перестали разрабатывать официальные клинические рекомендации по ведению больных с Ureaplasma spp. и Mycoplasma hominis. Согласно позиции Международного союза по борьбе с инфекциями, передаваемыми половым путём, активное выявление этих микроорганизмов и лечение приносит больше вреда, чем пользы, так как из-за него устойчивость к антибиотикам развивается у действительно опасных инфекций. Поэтому антибиотики при выявлении этих бактерий нужно применять только при наличии симптомов.
Впервые уреаплазмы были выделены в США от темнокожего больного негонококковым уретритом в 1954 г. [1]
Первое попадание уреаплазм в мужскую уретру, как правило, вызывает уретрит — воспаление мочеиспускательного канала. Имеются данные о том, что у женщин уреаплазмы ассоциированы с острыми воспалительными заболеваниями органов малого таза (ВЗОМТ), а также с бактериальным вагинозом. Доказана роль уреаплазм в возникновении бронхолегочных заболеваний у новорожденных (бронхит, пневмония) и послеродового хорионамнионита. [2]
Роль уреаплазм в патологии человека до конца не установлена. Продолжается изучение патогенетической связи этих микроорганизмов с широким спектром заболеваний из разных сфер:
- заболевания мочеполовых органов у мужчин: бесплодие, простатит, везикулит, эпидидимоорхит; [3]
- урогенитальная патология у женщин: ВЗОМТ, бесплодие, воспаление бульбовагинальной железы;
- патология новорождённых. Существуют данные о том, что наличие уреаплазм приводит к низкому весу новорождённого и снижению балла по шкале Апгар;
- патология рожениц: преждевременные роды, преждевременный разрыв околоплодного пузыря, привычный выкидыш, замершая беременность и т. д.; , цистит. Уреаплазмы выявляли в удалённых из почек конкрементах в биоптатах мочевого пузыря, а эксперименты по инфицированию мышей приводили к появлению у них уратных камней в почках.
Уреаплазмы зачастую входят в состав нормальной микрофлоры уретры и влагалища. Частота выявления уреаплазм составляет в среднем 40% в мочеполовых органах у женщин и 5-15% у мужчин. При этом U.parvum обнаруживается значительно чаще, чем U.urealyticum (38% против 9%). [4]
Как передаётся уреаплазма
Уреаплазмы распространяются посредством сексуальных контактов. Чем больше сексуальных партнёров в течение жизни, тем чаще колонизация уреаплазмами влагалища или уретры. Уреаплазмы передаются новорождённым при прохождении через родовой канал. При этом происходит колонизация слизистой вульвы и влагалища у девочек и носоглотки у обоих полов. Частота выявления уреаплазм у новорожденных может достигать 30% и выше, снижаясь до нескольких процентов к первому году жизни. [5]
В последующем рост частоты колонизации уреаплазмами начинается с момента начала половой жизни (в 14-18 лет).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы уреаплазмоза
Симптоматика различается в зависимости от возникшего заболевания.
Уреаплазмоз у мужчин
У мужчин может возникать уретрит, который проявляется скудными выделениями и жжением в мочеиспускательном канале, учащенным мочеиспусканием. Без лечения уретрит склонен к саморазрешению: симптомы затихают, пациент успокаивается. Перенесённый уретрит увеличивает вероятность возникновения в будущем воспаления предстательной железы — простатита. Кроме того, осложнениями уретрита могут быть эпидидимоорхит — воспаление яичка и его придатка, везикулит — семенного пузырька и, редко, куперит — бульбоуретральной железы.
Уреаплозмоз у женщин
У женщин под влиянием уреаплазм может развиваться сальпингоофорит, эндометрит и вагиноз.
Острый сальпингоофорит, эндометрит могут проявляться тянущими болями внизу живота, лихорадкой, слабостью и выделениями из вагины. Воспалительные заболевания тазовых органов у женщин — закономерное следствие бактериального вагиноза, наблюдаемого при выявлении уреаплазм. Симптомы заболевания могут быстро усугубляться, нередко требуется госпитализация в гинекологический стационар.
Помимо воспалительных заболеваний уреаплазмы, помимо многих других микроорганизмов, ассоциированы с бактериальным вагинозом.
Бактериальный вагиноз, как правило, сопровождается выделениями с неприятным запахом, который к тому же усиливается во время близости.
Заболевание предрасполагает к акушерско-гинекологическим осложнениям: преждевременным родам, рождению с низким весом.
Автор статьи разделяет взгляды мировых экспертов в области урогенитальной патологии (Jenny Marazzo, Jorma Paavonen, Sharon Hillier, Gilbert Donders) на отсутствие связи уреаплазм с возникновением цервицита и вагинита. [6] [7] [8]
Здесь необходимо заметить, что российский гайдлайн призывает проводить лечение цервицита и вагинита, базируясь на этиологической роли уреаплазм при этих заболеваниях, что, конечно же, является ошибкой. [17]
Уреаплазмоз у детей
У девочек в большинстве случаев уреаплазмы не вызывают каких-либо заболеваний, наблюдается здоровое носительство. Изредка развивается воспаление вульвыи/или влагалища. У новорождённых девочек и мальчиков повышен риск развития бронхолёгочной дисплазии.
Патогенез уреаплазмоза
Уреаплазмы — условно-патогенные микроорганизмы, т. е. их болезнетворные свойства реализуются только при особых условиях: высокая концентрация на слизистой, иммуносупрессия и другие.
Уреаплазмы прикрепляются к поверхности слизистой оболочки с помощью цитоадгезиновых протеинов. Кроме уретрального эпителия уреаплазмы способны прикрепляться к эритроцитам и сперматозоидам.
Одним из основных факторов патогенности являются ферменты фосфолипаза А и С, под влиянием которых в организме вырабатывается простагландин — фактор, запускающий сокращения непроизвольных мышц, следовательно, возможны преждевременные роды. Воспалительная реакция сопровождается выработкой провоспалительных цитокинов — IL 6, 8, 10.
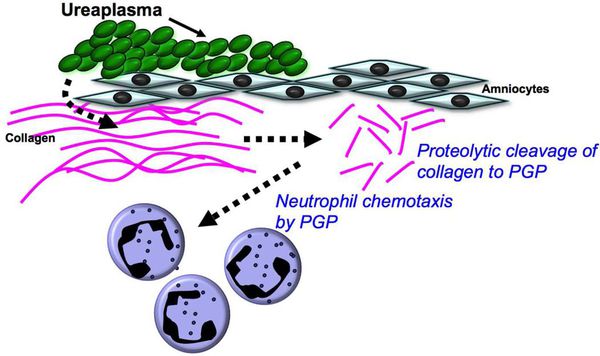
Уреаплазмы обладают IgA-протеазной активностью, разрушая местный защитный фактор слизистой оболочки иммуноглобулин А. [9]
Воспалительный процесс в мочеиспускательном канале развивается при большой концентрации уреаплазм. Так показано, что 10 3 КОЕ/мл и выше ассоциировано с выявлением 12 и более лейкоцитов на мл в уретральном содержимом. [10]
Особые факторы патогенеза реализуются при возникновении бактериального вагиноза. При этом ослабевают факторы местного иммунитета слизистой, благодаря чему такие пациентки более подвержены инфицированию инфекциями, передаваемыми половым путём (в т. ч. ВИЧ). Кислотность вагинального содержимого (рН в норме 3,5-4,5) снижается до нейтральной среды (рН 6,5-7 и выше). Таким образом, ослабевает естественный защитный барьер против болезнетворных микроорганизмов.
Классификация и стадии развития уреаплазмоза
По длительности протекания различают острый и хронический уретрит. Острый уретрит — до 2 месяцев, хронический — более 2 месяцев. В последнем случае различают рецидивирующий и персистирующий уретрит.
Хроническим рецидивирующим уретритом считается заболевание, при котором лейкоциты в уретре к концу лечения пришли в норму, а через 3 месяца — вновь наблюдался их подъём свыше 5 в поле зрения (при увеличении х1000). Хронический персистирующий уретрит — когда повышенное содержание лейкоцитов наблюдалось к концу лечения и через 3 месяца. [11]
ВЗОМТ подразумевает вовлечение в процесс маточных труб, яичника и их связок. Воспаление придатков может быть одно- и двухсторонним, острым или хроническим. Основные симптомы: боль внизу живота, в пояснице, выделения из половых органов, температура 38˚С и выше. [12]
Осложнения уреаплазмоза
У мужчин осложнениями уретрита являются баланопостит — воспаление головки и крайней плоти полового члена. Также возможны простатит, реже — эпидидимоорхит и шеечный цистит. При этом уреаплазмы не рассматриваются в качестве самостоятельного агента, вызывающего воспаление предстательной железы. Вероятно, эта цепь осложнений возникает посредством заднего уретрита и реализуется с помощью уретропростатического рефлюкса, т. е. заброса содержимого задней уретры в ацинусы простаты и семявыносящие протоки. [13]
У женщин ВЗОМТ может осложняться тубоовариальным абсцессом, изредка возникают перитонит и сепсис. В отдалённые сроки возможны серьёзные осложнения, имеющие социальные последствия: хроническая тазовая боль, внематочная беременность и бесплодие.
Маловероятно, что только лишь наличие уреаплазм в биоценозе влагалища приведёт к таким осложнениям. Свой патогенный потенциал эти микроорганизмы реализуют совместно с другими микроорганизмами, приводящими к дисбиотическим изменениям — бактериальному вагинозу. [14]
Диагностика уреаплазмоза
Показанием для назначения исследований для выявления уреаплазм являются клинические и/или лабораторные признаки воспалительного процесса: уретрит, ВЗОМТ. Не следует проводить рутинные исследования всем пациентам, в т.ч. без признаков какого-либо заболевания.
Для выявления уреаплазм используются только прямые методы выявления: бактериологический и молекулярно-генетический. Определение антител: IgG, IgA, IgM неинформативно. Материалом для исследования могут служить отделяемое мочеполовых органов, моча, вагинальный секрет и др.
Прямая иммунофлюоресценция (ПИФ) и иммунофлюоресцентный анализ (ИФА) менее информативны при уреаплазмозе, чем молекулярно-генетические и бактериологические исследования. Их применяют только при отсутствии последних.
Бактериальный вагиноз верифицируют с помощью критериев Амсела:
При наличии любых 3-х из 4-х критериев диагноз является установленным. Тем не менее, ввиду трудоёмкости выполнения, невозможности измерения рН оценка критериев Амсела затруднена.
Лечение уреаплазмоза
Лечение уреаплазмоза показано только в тех случаях, когда в результате обследования выявлена очевидная связь уреаплазм с воспалительным процессом. В случае здорового носительства уреаплазм лечение не показано. Порочной является практика назначения терапии всем лицам, у которых выявлены уреаплазмы.
Лечение показано донорам спермы и при бесплодии, когда других его причин не выявлено.
Недавние бактериологические исследования показали высокую активность в отношении уреаплазм Доксициклина, Джозамицина и ряда других антимикробных препаратов.
Схема лечения уреаплазмоза
Согласно клиническим рекомендациям Российского общества дерматовенерологов при неосложнённом заболевании — уретрит — проводят 10-дневные курсы лечения уреаплазмоза:
- Доксициклин моногидрат 100 мг по 1 таб. 2 раза в день;
- или Джозамицин 500 мг по 1 таб. 3 раза в день.
При персистенции воспалительного процесса курс лечения уреаплазмоза может быть продлён до 14 дней. [17]
При выявлении бактериального вагиноза назначают вагинальные препараты:
- Метронидазол вагинальный гель0,75% на ночь 5 г в течение 5 дней;
- или Клиндамицин крем 2% на ночь в течение 7 дней. [18]
Особенности лечения уреаплазмоза при беременности
При беременности по назначению врача можно применять препараты из группы макролидов и азалидов (Джозамицин, Азитромицин).
Прогноз. Профилактика
Ограничение числа сексуальных партнёров, применение барьерных методов контрацепции уменьшают колонизацию уреаплазм. В тех случаях, когда уже имеется носительство уреаплазм, необходимо профилактическое обследование и консультация у профильных специалистов перед:
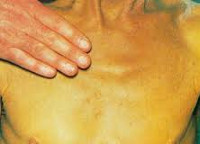
Холестатический гепатит – это заболевание, в развитии которого ключевое значение имеет затруднение тока желчи, а также накопление составляющих ее компонентов в печени. Клинически болезнь проявляется зудом, дискомфортом в зоне правого подреберья, интенсивной желтухой, диспепсией, увеличением печени и появлением ксантелазм на коже. В диагностике основное значение имеют общеклиническое и биохимическое исследования крови с определением печеночных проб, УЗИ печени и желчного пузыря, сонография поджелудочной железы, МРТ органов брюшной полости. Терапия направлена на улучшение оттока желчи и нормализацию функции органа.
МКБ-10
Общие сведения
Холестатический гепатит представляет собой достаточно редкую патологию, в основе патогенеза которой лежит внутрипеченочный холестаз с ухудшением экскреторной функции клеток и повреждением протоков. Частота выявления заболевания не превышает 10% среди всех гепатитов с хроническим течением. Холестатический гепатит преимущественно встречается у людей пожилого возраста.
Несмотря на свою относительно низкую распространенность, заболевание плохо поддается лечению в связи с тем, что не всегда возможно четко установить его причину. Изучением этиологии и патогенеза, а также разработкой новых методов терапии холестатического гепатита занимается клиническая гастроэнтерология.

Причины
Данная патология может быть обусловлена внутрипеченочным или внепеченочным застоем желчи. В первом случае нарушение оттока желчи возможно как на уровне клеток печени, так и на уровне внутрипеченочных протоков. Причинами внутрипеченочного холестаза с последующим развитием гепатита может выступать:
- переход острого вирусного гепатита В, С или других типов в хроническую форму;
- поражение печени вирусами Эбштейна-Барра, герпеса, цитомегаловирусом, микоплазменная инфекция;
- прием различных препаратов, таких как аминазин, некоторые диуретики, антибиотики, анаболические стероиды, контрацептивы;
- воздействие токсинов, алкоголя, ядов;
- эндокринные заболевания.
Внепеченочный холестаз является следствием обструкции крупных протоков. В этом случае его возможными причинами служат:
- закупорка камнем общего желчного протока;
- хронический калькулезный холецистит;
- хронический панкреатит;
- рак головки поджелудочной железы и опухоли других органов гепатобилиарной системы.
На фоне холестаза в печени происходит деструкция гепатоцитов с последующим нарушением функции органа. В некоторых случаях установить причину развития заболевания не удается, что трактуется как идиопатический холестатический гепатит.
Симптомы холестатического гепатита
Симптоматика холестатического гепатита похожа на проявления других хронических заболеваний печени. Отличительными особенностями являются более выраженная желтуха и кожный зуд, который часто выступает первым проявлением болезни. Зуд в данном случае обусловлен попаданием в кровь желчных кислот вследствие застоя желчи в печени. Также у больных холестатической формой гепатита часто возникают ксантомы, которые имеют вид желтых пятен.
Цвет кала, как правило, становится более светлым, а моча темнеет. Пальпаторно определяется увеличение размеров и повышение плотности печени без спленомегалии. В период обострения возможно повышение температуры и неяркие симптомы интоксикации. Тяжесть клинической картины зависит от выраженности холестаза.
Диагностика
В диагностике заболевания важную роль играют лабораторные и инструментальные методы исследования. Из лабораторных методик основным для постановки диагноза холестаза считают биохимический анализ крови.
- Печеночные пробы. При биохимическом исследовании отмечается увеличение уровня билирубина за счет прямой фракции, повышение уровня трансаминаз, щелочной фосфатазы (более чем в 5 раз), гамма-глутаминтрансферазы и холестерина. Также можно определить повышенное количество в крови фосфолипидов, В-липопротеидов и желчных кислот.
- Серологическая и ПЦР-диагностика. Для подтверждения вирусной этиологии заболевания проводится исследование специфических маркеров методами ИФА и ПЦР. Характерным серологическим маркером внутрипеченочного холестаза является определение антимитохондриальных антител.
Из инструментальных методов используется эхографическая, рентгеновская, магнитно-резонансная, инвазивная диагностика:
- УЗИ печени и желчного пузыря. При ультразвуковом исследовании выявляются признаки хронического гепатита. УЗИ желчных путей, желчного пузыря и поджелудочной железы позволяет подтвердить или исключить внепеченочный холестаз.
- Рентгенография. При наличии сложностей в диагностике холестаза проводится ретроградная холангиопанкреатография, чрескожная чреспеченочная холангиография или холецистография, которые позволяют обнаружить камни в желчных путях в тех случаях, когда они не видны на УЗИ.
- МРТ. Современными неинвазивными методами выявления причин холестатического гепатита являются МР-панкреатохолангиография и МРТ гепатобилиарной зоны.
- Биопсия с гистологией. Для изучения морфологических изменений может проводиться пункционная биопсия печени, хотя она и не играет решающей роли в диагностике холестаза.
Лечение холестатического гепатита
Лечение хронического гепатита с холестатическим синдромом должно быть основано на устранении причины, которая привела к холестазу. Если причиной заболевания является воздействие токсических факторов или медикаментозных препаратов, то необходимо прекратить их поступление в организм. Всем больным рекомендуется придерживаться диеты №5, которая предусматривает исключение острой, жирной и жареной пищи. Обязательно минимизировать употребление алкоголя, который негативно влияет на клетки печени. Также рекомендовано полноценное питание с достаточным содержанием белка.
Медикаментозная терапия
На любой стадии заболевания желателен прием жирорастворимых витаминов А, Е, а также В12. Для улучшения функции гепатоцитов могут назначаться гепатопротекторы, эссенциальные фосфолипиды и липоевая кислота. При наличии внутрипеченочного холестаза с высокой активностью воспалительного процесса показано назначение небольших доз преднизолона для уменьшения выраженности патологических изменений.
Если больного беспокоит сильный зуд, необходимо применение препаратов для нейтрализации желчных кислот, таких как холестирамин или лигнин. Самым эффективным средством для лечения внутрипеченочного холестаза считается урсодезоксихолевая кислота, которая улучшает отток желчи. Препарат рекомендован всем больным с холестатическим гепатитом.
Хирургическое лечение
Если гепатит вызван внепеченочным холестазом, необходимо устранить его причину. Для этого используются различные оперативные методы:
- лапароскопическая или открытая холецистэктомия;
- резекция головки поджелудочной железы;
- экстракция конкрементов желчных протоков при РПХГ;
- эндоскопическая баллонная дилатация сфинктера Одди и др.
Прогноз и профилактика
При правильном лечении и устранении причины холестаза прогноз при холестатическом гепатите в целом благоприятный. Профилактика заболевания сводится к прекращению поступления в организм алкоголя и других гепатотоксических веществ, а также своевременному лечению патологии печени.
Что такое гепатит Б? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит В (Б) — острое и хроническое инфекционное заболевание, вызываемое вирусом гепатита В, с гемоконтактным механизмом передачи (через кровь), протекающее в различных клинико-морфологических вариантах, и возможным развитием цирроза печени и гепатоцеллюлярной карциномы. Всего в мире, по самым скромных оценкам, инфицировано более 250 млн человек.
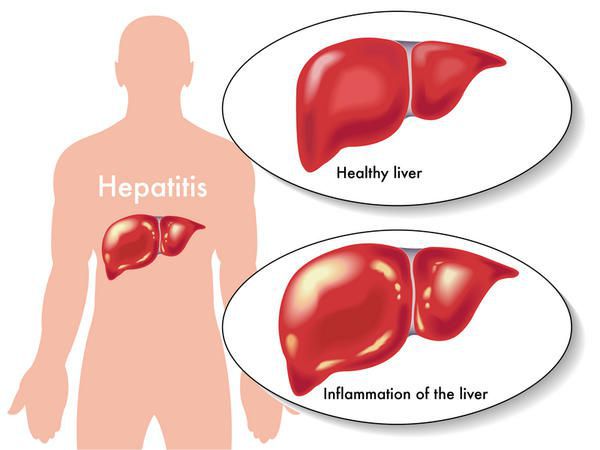
Этиология
вид — вирус гепатита В (частица Дейна)
Развитие вируса гепатита Б происходит в гепатоцитах (железистых клетках печени). Он способен к интеграции в ДНК человека. Имеются 9 генотипов вируса с различными подтипами — генетическая изменчивость позволяет вирусу образовывать мутантные формы и ускользать от действия лекарств.
Имеет ряд собственных антигенов:
- поверхностный HbsAg (австралийский). Появляется за 15-30 дней до развития болезни, свидетельствует об инфицировании (не всегда). Антитела к HbsAg выявляются через 2-5 месяцев от начала заболевания, а сам HbsAg исчезает из крови (при благоприятном течении процесса);
- сердцевинный HbcorAg (ядерный, коровский). Появляется в инкубационном периоде и совместно с ним появляются антитела (HbcorAb). Длительное присутствие HbcorAg в крови свидетельствует о вероятной хронизации процесса (неадекватный иммунный ответ);
- антиген инфекциозности и активного размножения вируса (HbeAg). Появляется совместно с HbsAg и отражает степень инфицированности. Его продолжительная циркуляция в крови является свидетельством развития хронизации процесса, а антитела к нему являются благоприятным прогностическим признаком (не всегда, но по меньшей мере указывают на возможность более благоприятного процесса, срок их циркуляции после выздоровления окончательно не определён, но не более пяти лет после благоприятного разрешения процесса);
- HbxAg — регулятор транскрипции, способствует развитию гепатокарциномы.
Вирус гепатита В чрезвычайно устойчив к действию всевозможных естественных факторов окружающей среды, инактивируется при 60 °C за 10 часов, при 100 °C за 10 минут, при оптимальной температуре сохраняется до 6 месяцев, при автоклавировании погибает за 5 минут, в сухожаровом шкафу — через 2 часа, 2% раствор хлорамина убивает вирус за 2 часа. [1] [3]
Эпидемиология
Источник инфекции — только человек, больной острой или хронической формой инфекции.
Механизм передачи: гемоконтактный и вертикальный (от матери к ребёнку), не исключается трансмиссивный механизм передачи (например, при укусах комаров в результате раздавливания и втирания инфицированного тела комара в поврежденную ткань человека).
Пути передачи: половой, контактно-бытовой, гемотрансфузионный (например, при переливании крови или медицинских манипуляциях). Восприимчивость всеобщая. Заболеваемость — 30-100 человек на 100 тысяч населения (зависит от страны). Летальность от острых форм — до 2%. После перенесённого острого заболевания при условии выздоровления иммунитет стойкий, пожизненный.
Для заражения характерна малая заражающая доза (невидимые следы крови). [1] [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита Б
Инкубационный период гепатита В длится от 42 до 180 дней (следует иметь в виду, что наличие клинической симптоматики характеризует лишь незначительную долю всех случаев заболевания).
Начало постепенное. Характерные синдромы:
- общей инфекционной интоксикации (проявляется как астеноневротический синдром);
- холестатический (нарушение секреции желчи);
- артрита;
- нарушения пигментного обмена (появление желтухи при уровне общего билирубина свыше 40 ммоль/л);
- геморрагический (кровоточивость кровеносных сосудов);
- экзантемы;
- отёчно-асцитический (скопление жидкости в брюшной полости);
- гепатолиенальный (увеличение печени и селезёнки).
При первых признаках гепатита B нужно обратиться к доктору.
Первые признаки гепатита B
Начальный (преджелтушный) период продолжается 7-14 дней. Чаще протекает по многообразному типу с болевыми ощущениями в различных суставах по ночам и утром, уртикарными высыпаниями, астеновегетативными проявлениями (снижение аппетита, апатия, нервозность, слабость, разбитость, повышенная утомляемость). Изредка развивается синдром Джанотти-Крости — симметричная, яркая пятнисто-папулёзная сыпь. Не исключены умеренные диспептические явления (расстройства пищеварения). К концу периода происходит потемнение мочи, обесцвечивание кала.
Желтушный период
Этот период продолжительностью около одного месяца характеризуется возникновением желтушного окрашивания кожи (различных оттенков) на фоне продолжающегося или ухудшающегося общего состояния. Характерна длительность и стойкость симптоматики. Появляется тяжесть и болезненность в правом подреберье, горечь во рту, тошнота, выражённый зуд кожи (практически не снимаемый никакими средствами). На фоне усиления астеноневротического компонента появляются геморрагические проявления, урежение пульса, гипотензия, отёки (отражает степень интоксикации и нарушения функций печени).
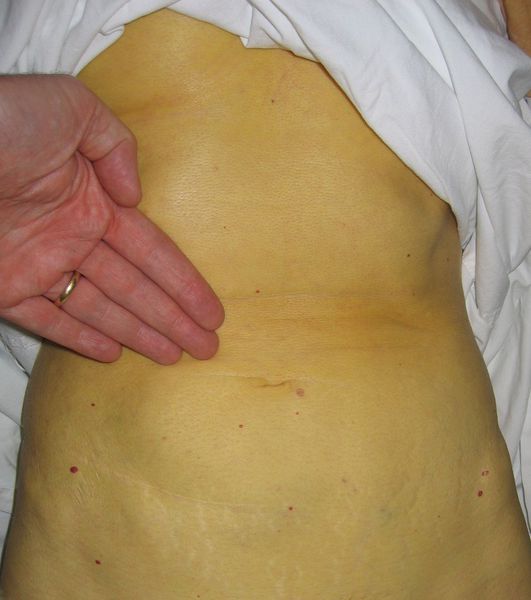
Выздоровление
Следующим этапом в развитии болезни является нормализации общего состояния, спадение желтухи и реконвалесценция, которая в зависимости от конкретной ситуации и состояния иммунной системы может закончиться как выздоровлением, так и движением развития заболевания в хроническое течение, характеризующееся маловыраженой неусточивой симптоматикой, преимущественно в виде слабости, периодического дискомфорта в правом подреберье, бурно сигнализирующим лишь на стадии цирроза и полиорганных осложнений.
- гепатиты другой этиологии;
- желтухи другой этиологии (например, гемолитическая болезнь, токсическое поражение, опухоли);
- малярия; ;
- лептоспироз;
- ревматоидный артрит.
Гепатит В у беременных
Острый гепатит характеризуется более тяжёлым течением у беременной, возникновении повышенного риска преждевременных родов, аномалий развития плода на ранних сроках и кровотечений. Вероятность передачи при острой форме зависит от сроков беременности: в первом триместре риск 10% (но более тяжёлые проявления), в третьем триместре — до 75% (чаще бессимптомное течение после родов). У большинства детей при заражении во внутриутробном и постнатальном периодах происходит хронизация инфекции. [1] [3] [6]
Патогенез гепатита Б
С движением кровяной массы вирус попадает в печеночную ткань, где локализуется в гепатоцитах и теряет свою протеиновую сферу в лизосомах. Происходит выход вирусной ДНК с последующим ресинтезом аномальных протеинов LSP, а параллельно образование новых частиц Дейна.
В процессе эволюции вирусчеловеческого взаимодействия возможно развитие двух вариантов:
При репликативном пути происходит следующее: белки LSP совместно с HbcorAg вызывают увеличение продукции гамма-интерферона, что приводит к активации главного комплекса гисотсовместимости (HLA), проистекает преобразование молекул гистосовместимости 1 и 2 классов, в результате чего клетка становиться для организма враждебной в антигенном формате.
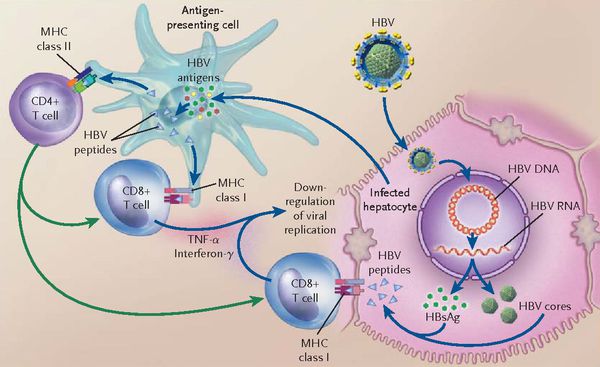
Антигенпрезентирующие макрофаги содействуют изменению В-лимфоцитов в плазматические клетки и экспрессии ими агрессивных белков-антител к посторонним антигенам. В итоге на поверхности печёночных клеток формируются вирусспецифические иммунные комплексы (антиген + антитело + фракция комплемента С3в).
В динамике может реализоваться два сценария:
- в первом варианте запуск каскада комплимента ведёт к появлению в составе иммунных комплексов агрессивной фракции С9 (мембранатакующий комплекс) — наблюдается значительный некроз гепатоцитов без участия лимфоцитов (молниеносная форма гепатита В);
- при альтернативной варианте (наблюдающимся в большинстве случаев) каскад комплемента в силу иммуноиндивидуалистических свойств не активируется — тогда идёт умеренное разрушение Т-киллерами меченых антителами заражённых вирусом гепатоцитов. Образуются ступенчатые некрозы с образованием на месте гибели гепатоцитов соединительной ткани — рубцов (то есть острый гепатит В при плохом иммунном ответе постепенно переходит в хронический).
Непременным атрибутом патогенеза является формирование иммунопатологического процесса. Гибель гепатоцитов, инфицированных вирусом гепатита В, следует за счёт иммунокомпетентных частиц, Т-киллеров и макрофагальных элементов.
Серьёзным значением является нарушение свойств мембраны клеток печени, что сопровождается экскрецией (выделением) лизосомальных ферментов, разрушающих гепатоциты. Сообразно этому, гибель гепатоцитов происходит за счёт иммунокомпетентных клеток, лизосомальных ферментов и противопечёночных гуморальных аутоантител, то есть острая болезнь наступает (и благоприятно заканчивается) только при хорошем иммунитете, а при плохом идёт хронизация.
При тяжёлом цитолитическом синдроме (массивные некрозы гепатоцитов) возникает гипокалиемический алкалоз, острая печёночная недостаточность, печёночная энцефалопатия (ПЭП), церебротоксическое действие, нарушение функции обмена нервной ткани. [2] [3] [6]
Классификация и стадии развития гепатита Б
По цикличности течения:
- острый;
- острый затяжной;
- хронический.
По клиническим проявлениям:
- субклинический (инаппарантный);
- клинически выраженный (желтушный, безжелтушный, холестатический, фульминантный).
По фазам хронического процесса:
Группы риска хронического гепатита B
Хроническим гепатитом чаще страдают дети младше шести лет. При заражении в первый год жизни он развивается в 80–90 % случаев, от года до шести лет — в 30–50 %, у взрослых без сопутствующих заболеваний — менее чем в 5 %. [7]
Осложнения гепатита Б
Чем опасен гепатит Б
Заболевание может привести к острой печёночной недостаточности (синдрому острой печеночной энцефалопатии).
Выделяют четыре стадии болезни:
Диагностика гепатита Б
Многообразие форм, тесная взаимосвязь с иммунной системой человека и зачастую достаточно высокая стоимость исследований часто затрудняют принятие конкретного решения и диагноза в стационарный отрезок времени, поэтому во избежание роковых (для больного) ошибок следует подходить к диагностике с учётом всех получаемых данных в динамическом наблюдении:
- общеклинический анализ крови с лейкоцитарной формулой (лейкопения, лимфо- и моноцитоз, уменьшение СОЭ, тромбоцитопения);
- общий анализ мочи (появление уробилина);
- биохимический анализ крови (гипербилирубинемия в основном за счёт связанной фракции, повышение уровня АЛТ и АСТ, ГГТП, холестерина, щелочной фосфатазы, снижение протромбинового индекса, фибриногена, положительная тимоловая проба);
- маркеры гепатита В: HbsAg, HbeAg, HbcorAg, HbcorAb IgM и суммарные, HbeAb, anti-Hbs, ПЦР в качественном и количественном измерении);
- УЗИ органов брюшной полости, КТ и МРТ диагностика;
- фиброскан (применяется для оценки степени фиброза). [3][4]
Скрининг при хроническом гепатите
Пациентам с хроническим гепатитом В рекомендуется не реже чем раз в полгода проходить обследование: УЗИ органов брюшной полости, клинический анализ крови, АЛТ, АСТ, тест на альфа-фетопротеин. Скрининг позволяет вовремя заметить обострение болезни и начать специфическую терапию.
Лечение гепатита Б
Лечение острых форм гепатита В должно осуществляться в стационаре (учитывая возможность быстрых и тяжёлых форм болезни), хронических — с учётом проявлений.
Диета и режим при гепатите В
В острый период показан постельный режим, печёночная диета (№ 5 по Певзнеру): достаточное количество жидкости, исключение алкоголя, жирной, жареной, острой пищи, всё в мягком и жидком виде.
Медикаментозная терапия
При лёгкой и средней тяжести острого гепатита этиотропная противовирусная терапия (ПВТ) не показана. При тяжёлой степени и риске развития осложнений назначается специфическая противовирусная терапия на весь период лечения и возможно более длительное время.
В лечении хронических форм гепатита показаниями к назначению ПВТ является наличие уровня DNA HBV более 2000 МЕ/мл (при циррозе печении независимо от уровня), умеренное и высокое повышение АЛТ/АСТ и степени фиброза печёночной ткани не менее F2 по шкале METAVIR, высокая вирусная нагрузка у беременных женщин. В каждом конкретном случае показания определяются индивидуально, в зависимости от выраженности процесса, временной тенденции, пола, планирования беременности и другого.
Существует два пути противовирусного лечения:
- терапия пегилированными интерферонами (имеет ряд существенных противопоказаний и серьёзных побочных эффектов — не менее 12 месяцев);
- нуклеозидно-аналоговой терапии NA (используются препараты с высоким порогом резистентности вируса, длительно — не менее пяти лет, удобство применения, хорошая переносимость).
В отдельных случаях может рассматриваться применение комбинированной терапии.
Из средств патогенетической терапии в острый период используются внутривенно вводимые растворы 5% глюкозы, дезинтоксикантов, антиоксидантов и витамины. Показан приём энтеросорбентов, ферментных препаратов, при выраженном холестазе применяются препараты Урсодезоксихолевой кислоты, при тяжёлом течении — глюкокортикостероиды, методы аппаратного плазмофереза.
В хронической стадии заболевания при наличии соответствующей активности процесса и невозможности назначения ПВТ может быть показан приём групп гепатопротекторов и антиоксидантов. [1] [3]
Прогноз. Профилактика
Основное направление профилактики на сегодняшний день — это проведение профилактической вакцинации против гепатита В в младенческом возрасте (в том числе усиленная вакцинация детей, рождённых от матерей с гепатитом В) и далее периодические ревакцинации раз в 10 лет (или индивидуально по результатам обследования). Достоверно показано, что в странах, где была введена вакцинация, резко сократилось количество вновь выявленных случаев острого гепатита В.
Вторая составляющая стратегии профилактики включает обеспечение безопасности крови и её компонентов, использование одноразового или стерилизованного инструментария, ограничение числа половых партнёров и использование барьерной контрацепции. [1] [2]
Уреаплазменную инфекцию лишь условно можно отнести к инфекциям, передаваемым половым путем. Дело в том, что возбудителем при этом является Ureaplasma urealyticum из семейства микоплазм, которые действительно могут обитать в половых путях и передават
Уреаплазменную инфекцию лишь условно можно отнести к инфекциям, передаваемым половым путем. Дело в том, что возбудителем при этом является Ureaplasma urealyticum из семейства микоплазм, которые действительно могут обитать в половых путях и передаваться при половых контактах. Однако роль уреаплазм, как и других микоплазм, за исключением M. genitalium, в возникновении воспалительной реакции достаточно неоднозначна, вследствие чего этот возбудитель большинство авторов, особенно за рубежом, относят к условно-патогенным. И в МКБ-10, международно признанном списке болезней, такого заболевания, как уреаплазмоз или уреаплазменная инфекция, не приведено. Между тем ряд исследователей приводят достаточно убедительные доказательства, свидетельствующие в пользу патогенности этой инфекции. Не так давно в Москве даже была защищена докторская диссертация, автор которой отстаивал именно эту точку зрения.
В 1954 г. Шепард впервые обнаружил U. urealyticum в выделениях, полученных от больного уретритом, и назвал их Т-микоплазмами (от английского слова tiny - крошечный). По своим размерам уреаплазмы являются одними из самых мелких представителей бактериальной флоры, выявляемой у человека, а по виду своей жизнедеятельности относятся к внутриклеточным паразитам.
Известны два биовара уреаплазм - Parvo и Т960, которые разделены на 14 сероваров. Последние достижения молекулярной биологии в исследовании ДНК и рибосомальной РНК уреаплазм позволили некоторым авторам (F. Kong et al., 2000) отказаться от классической классификации и разделить все уреаплазмы на два вида - Ureaplasma urealyticum (бывший биовар Т960) и Ureaplasma parvum (бывший биовар Parvo).
Как уже говорилось выше, вопрос о роли уреаплазм в этиологии и патогенезе заболеваний урогенитального тракта до сих пор не решен. Слишком уж широко они распространены, и слишком часто эти микроорганизмы выявляются у лиц, не имеющих клинической симптоматики. Авторы, относящие уреаплазмы к облигатным патогенам, считают, что они вызывают уретриты, цервициты, простатиты, послеродовые эндометриты, пиелонефриты, бесплодие, различную патологию беременности (хориоамниониты) и плода (легочную патологию). Другие исследователи полагают, что уреаплазмы являются частью условно-патогенной флоры урогенитального тракта и способны вызывать инфекционно-воспалительные заболевания мочеполовых органов только при определенных условиях (в частности, при недостаточности иммунитета) или при соответствующих микробных ассоциациях.
Показатели инфицированности урогенитального тракта уреаплазмами среди сексуально активного населения варьируют от 10 до 80%. Уреаплазмы, как правило, обнаруживают у людей, ведущих активную половую жизнь, а наиболее часто эти микроорганизмы выявляются у лиц, имеющих три и более половых партнеров. По данным F. Kong et al., у 81-87% больных выявляется Ureaplasma parvum и у 13-19% - Ureaplasma urealyticum. Клиническая картина воспалительного процесса, при котором обнаруживаются уреаплазмы, не имеет патогномоничных симптомов.
Авторы некоторых работ утверждают, что именно уреаплазмы зачастую являются причиной неблагоприятных исходов беременности, усугубляют риск преждевременных родов и летального исхода при рождении детей с очень низкой массой тела.
Вопрос о влиянии уреаплазм на репродуктивную функцию человека остается открытым. Между тем женское бесплодие может быть связано с воспалительными процессами в области половых органов, индуцированными уреаплазмами, приводящими к нарушению прохождения яйцеклетки в полость матки. Мужское бесплодие может быть обусловлено, во-первых, воспалительными процессами, а во-вторых - влиянием уреаплазм на сперматогенез. Адсорбция уреаплазм на поверхности сперматозоидов способна изменять их подвижность, морфологию и хромосомный аппарат.
Как и для большинства представителей условно-патогенной флоры, для уреаплазм выделяют ряд факторов, способствующих развитию инфекционно-воспалительных процессов. Наиболее важными из них являются иммунные нарушения, изменения гормонального статуса, массивность колонизации, ассоциации с другими бактериями. Все эти аспекты следует учитывать при выборе тактики ведения таких больных.
Методы диагностики
- Культуральное исследование на селективных средах. Такое исследование позволяет в течение 3 дней выделить культуру возбудителя и отделить уреаплазмы от других микоплазм. Материалами для исследования служат соскобы из урогенитального тракта и моча пациента. Метод позволяет определить чувствительность выделенных возбудителей к различным антибиотикам, что очень важно с учетом нередкой сегодня антибиотикорезистентности. Специфичность метода составляет 100%. Этот метод используется для одновременного выявления Mycoplasma hominis и Ureaplasma urealyticum.
- Обнаружение ДНК возбудителей методом ПЦР. Исследование позволяет в течение суток выявить возбудителя в соскобе из урогенитального тракта и определить его видовую принадлежность.
- Серологические тесты. Позволяют определять присутствие антигенов и специфических антител к ним в крови. Могут быть полезны при рецидивирующем течении болезни, при развитии осложнений и бесплодии.
Как и проблема патогенности уреаплазм, вопрос о необходимости элиминации этих возбудителей из урогенитального тракта также остается открытым. Чаще всего авторы предлагают принимать меры по элиминации этих микроорганизмов при наличии у человека инфекционно-воспалительного процесса в месте их обнаружения (уретрите, простатите, цервиците, вагините), а также при бесплодии, невынашивании беременности, воспалительных заболеваниях органов малого таза, хориоамнионите, послеродовых лихорадочных состояниях при наличии уреаплазм в мочеполовом тракте.
Этиотропное лечение уреаплазменной инфекции основывается на применении антибактериальных препаратов различных групп. Активность препаратов в отношении любой инфекции определяется по минимальной подавляющей концентрации (МПК) в исследованиях in vitro. Показатели МПК, как правило, коррелируют с результатами клинического излечения. Казалось бы, оптимальными препаратами должны являться антибиотики с наименьшей МПК, но при этом нельзя сбрасывать со счетов важность таких параметров, как биодоступность, способность к созданию высоких внутритканевых и внутриклеточных концентраций, переносимость и комплаентность лечения.
Уреаплазмы устойчивы к β-лактамным антибиотикам (пенициллинам и цефалоспоринам), из-за того что у них отсутствует клеточная стенка, и сульфаниламидам, так как эти микроорганизмы не синтезируют кислоту. При лечении уреаплазменной инфекции могут быть эффективны те антибактериальные агенты, которые воздействуют на синтез белка и ДНК, т. е. обладающие бактериостатическим действием. Это препараты тетрациклинового ряда, макролиды, фторхинолоны, аминогликозиды, левомицетин и некоторые другие (см. табл. 1).
Как видно из таблицы, доксициклин и кларитромицин отличаются наилучшими показателями МПК, кроме того, они высокоактивны в отношении уреаплазм. Другие препараты обладают избирательной активностью и их выбор определяется в зависимости от результатов микробиологических исследований.
Тетрациклины
Согласно методическим рекомендациям 1998 г. и Федеральному руководству по использованию лекарственных средств, при уреаплазменной инфекции рекомендуется назначение доксициклина (юнидокс солютаб, вибрамицин, медомицин). Препарат назначают по 100 мг 2 раза в день в течение 7-14 дней. Обычно при первом приеме антибиотика дозу удваивают. По рекомендациям Американского центра по контролю и профилактике заболеваний (CDC), доксициклин, наравне с эритромицином и офлоксацином, является препаратом выбора при лечении негонококковых уретритов (НГУ). Менее удобен для пациента курс тетрациклина, который применяют по 500 мг 4 раза в день в течение 7-10 дней.
Доксициклин используют в виде двух солей, в зависимости от того, применяют антибиотик в капсулах или в виде порошка. В капсулах используют доксициклина гидрохлорид или хиклат. Порошок для приготовления других пероральных форм представляет собой моногидрат доксициклина. Использование соли моногидрата вместо гидрохлорида исключает возникновение эзофагитов. Наиболее удобной в применении является лекарственная форма солютаб.
Благодаря своим особым фармакокинетическим свойствам, доксициклин переносится гораздо лучше, чем тетрациклин.
Хорошие результаты были получены при назначении доксициклина женщинам, инфицированным различными микоплазмами (в том числе уреаплазмами) и страдающим бесплодием или привычным невынашиванием беременности. После санации от микоплазм в ряде случаев наступала беременность, которая заканчивалась нормальными родами в срок и без осложнений.
Необходимо, однако, отметить, что от 2 до 33% штаммов уреаплазм могут быть устойчивы к тетрациклину. К другим существенным недостаткам препаратов тетрациклинового ряда можно отнести противопоказания к их назначению беременным и детям до 8 лет, высокую частоту побочных реакций со стороны желудочно-кишечного тракта, а также фотосенсибилизацию кожи во время их применения.
Макролиды, линкозамины, стрептограмины
Из препаратов группы макролидов, азалидов, линкозаминов и стрептограминов наиболее предпочтительны кларитромицин, джозамицин, азитромицин, мидекамицин и эритромицин.
Как уже упоминалось выше, наилучшие показатели МПК из всех макролидных антибиотиков имеет кларитромицин, обладающий всеми преимуществами современных антибиотиков, относящихся к этому классу: хорошей переносимостью, небольшой частотой побочных реакций и высоким комплайенсом.
Кларитромицин (клабакс, клацид) назначают по 250 мг 2 раза в сутки, а в пролонгированной форме СР по 500 мг 1 раз в сутки, в течение 7-14 дней.
Джозамицин (вильпрафен) по 500 мг 3 раза в сутки в течение 7-14 дней.
Азитромицин (азитрал, сумамед, хемомицин) назначают по 250 мг 1 раз в сутки в течение 6 дней или по 1 г однократно.
Мидекамицин (макроен)- по 400 мг 3 раза в сутки в течение 7-14 дней.
Эритромицин (эритромицин, эрифлюид) по 500 мг 4 раза в сутки 7-14 дней.
Рокситромицин (роксид, рокситромицин, рулид) по 150 мг 2 раза в сутки 7-14 дней.
Во время беременности нежелательно назначать азитромицин, рокситромицин, кларитромицин и мидекамицин. Для лечения беременных женщин с уреаплазменной инфекцией рекомендовано применять эритромицин внутрь по 500 мг каждые 6 ч в течение 7-10 дней. Показано, что после такого лечения уменьшаются угроза прерывания беременности, частота самопроизвольных абортов и явления многоводия.
Для лечения беременных рекомендован также джозамицин. Он обладает высокой эффективностью, не вызывая побочных реакций со стороны печени, не влияет на метаболизм других препаратов. При этом действие джозамицина на естественную бактериальную флору невелико.
При рождении детей, внутриутробно инфицированных уреаплазмами, также проводят терапию эритромицином. Предпочтительно внутривенное, капельное назначение препарата из расчета 20-40 мг на 1 кг массы тела.
Фторхинолоны
Все виды микоплазм высоко чувствительны к новым фторхинолонам, особенно офлоксацину. Его лидирующее положение в этой группе обусловлено широким антибактериальным спектром воздействия, высокой бактерицидной активностью, хорошими фармакокинетическими характеристиками (быстротой всасывания, высокими концентрациями препарата в тканях, клетках, биологических жидкостях), низкой токсичностью.
Офлоксацин (заноцин, офло, тарицин) назначают по 200 мг 2 раза в сутки в течение 7-10 дней, пефлоксацин - по 600 мг 1 раз в сутки в течение 7-10 дней, моксифлоксацин (авелокс) по 400 мг 1 раз в сутки в течение 10 дней.
Следует отметить, что исследования антибиотикочувствительности уреаплазм показывают частую их резистентность в клинической практике к офлоксацину и другим фторхинолонам.
Как и в случае с тетрациклинами, препараты этой группы нежелательно применять у беременных, они также вызывают фотосенсибилизацию.
Уреаплазмы среднечувствительны к аминогликозидам и левомицетину. Из аминогликозидов наиболее эффективен гентамицин, который назначают парентерально по 40 мг каждые 8 ч в течение 5 дней. Стрептомицин и канамицин при уреаплазменной инфекции практически неэффективны.
В последние годы как в нашей стране, так и за рубежом участились случаи выявления микоплазм, генетически резистентных к тетрациклину (до 40%), эритромицину, спирамицину (до 30%) и ципрофлоксацину.
Для выбора схемы адекватной терапии в конкретных случаях рекомендуется лабораторное определение чувствительности выделенных культур уреаплазм к различным антибиотикам. Однако многие авторы отмечают способность уреаплазм быстро приобретать устойчивость к антибактериальным препаратам при их пассировании in vitro. Следовательно, необходимо тестирование свежевыделенных от больных штаммов. Другая сложность состоит в том, что чувствительность к антибиотикам in vitro не обязательно коррелирует с положительным эффектом in vivo. Это может быть связано с фармакокинетикой препаратов. Анализ исследований, посвященных лечению уреаплазменной инфекции, показывает чрезвычайно большой разброс показателей эффективности различных антибиотиков - от 40 до 100%. В независимых исследованиях критерий эффективности того или иного антибиотика при уреаплазменной инфекции редко превышает 80%.
В ряде случаев этиотропная терапия может являться частью комбинированной терапии, в частности иммунотропной. В работе Hadson MMT et al. (1998) сообщается о важности иммунологического статуса больного при уреаплазменной инфекции. Так как антибиотики, активные в отношении уреаплазм, обладают бактериостатическим, а не бактерицидным действием, определяющую роль играет иммунный ответ больного. Использование иммунотропной терапии может быть особенно актуальным при неэффективности хотя бы одного курса противомикробного лечения.
Наши собственные исследования показали, что при выборе иммунотропной терапии особенно высокую эффективность демонстрировал препарат иммуномакс.
Этот препарат относится к группе иммуномодуляторов и показан для коррекции ослабленного иммунитета, лечения и профилактики вирусных и бактериальных инфекций.
Суммируя вышеизложенное, можно констатировать, что при лечении больных уреаплазменной инфекцией из всех антибиотиков следует отдавать предпочтение доксициклину из группы тетрациклинов, кларитромицину из группы макролидов, джозамицину - при беременности.
Наиболее удачной комбинацией при резистентных к стандартной этиотропной терапии случаях уреаплазменной инфекции, а также при рецидивирующем течении этой инфекции является применение антибиотиков в сочетании с иммунотропным лечением, что позволяет добиться элиминации возбудителя и избежать рецидивов инфекции.
М. А. Гомберг, доктор медицинских наук
А. М. Соловьев, кандидат медицинских наук
ЦИКВИ, МГМСУ, Москва
Читайте также:

