Иммуногенность новой гриппозной вакцины
Обновлено: 19.04.2024
Для цитирования: Маркова Т.П., Ярилина Л.Г., Ким М.Н. Вакцинопрофилактика гриппа. Новая отечественная вакцина Ультрикс®. РМЖ. 2014;25:1862.
Злободневность проблемы респираторных инфекций, в т. ч. гриппа, не вызывает сомнений. Проблема осложняется многообразием инфекционных агентов, вызывающих респираторные инфекции (около 200 вирусов, Chlamydia и Mycoplasma pneumoniaе, бактериальные возбудители (Streptococcus pneumoniaе, Hаemоphilus influenzaе и др.)), а также мутациями вируса гриппа. Сравнительная характеристика вирусов гриппа представлена в таблице 1.
Специфическая вакцинопрофилактика гриппа проводится достаточно эффективно. В таблице 2 перечислены наиболее часто используемые вакцины.
Вакцины обладают сходной иммуногенностью, их состав изменяется каждый год, согласно прогнозу ВОЗ. Отечественная вакцина гриппол является тривалентной полимер-субъединичной вакциной, в ее состав входит полиоксидоний, высокомолекулярный адъювант, связанный с антигенами вируса гриппа А (H1N1, H3N2) и В – нейраминидазой и гемагглютинином. Полиоксидоний усиливает формирование протективного иммунитета, несмотря на сниженное содержание в вакцине антигенов вирусов гриппа. Для инактивации вируса используется ультрафиолет, что повышает безопасность вакцины. Гриппол разрешен для применения с 6 мес., включен в национальный календарь прививок, является низкореактогенной и высокоочищенной вакциной, его безопасность контролируется на уровне Государственного института стандартизации и контроля при Роспотребнадзоре РФ. Многочисленные исследования показывают, что после вакцинации заболеваемость гриппом снижается в 3–4 раза по сравнению с контрольной группой, а за счет полиоксидония повышается резистентность к другим респираторным инфекциям. За создание вакцины коллектив авторов был удостоен Государственной премии РФ в 2002 г. [5, 6].
В группах риска (дети, люди старше 50 лет, пациенты с сопутствующими заболеваниями, иммунодефицитами, аллергическими заболеваниями, при которых наблюдаются более тяжелое течение инфекций, развитие осложнений и смертельные исходы), по рекомендациям ВОЗ вакцинация проводится субъединичными вакцинами. У пожилых людей высок риск серьезных осложнений, включая вторичную бактериальную пневмонию, обострения сопутствующих хронических заболеваний, приводящие к госпитализации и повышенной смертности. Инактивированные противогриппозные вакцины применяют более 50 лет, они безопасны, проверены на миллионах людей [7, 8]. Вакцинация уменьшает число смертельных исходов, развитие и тяжесть осложнений [9–11, 13–15]. У детей с аллергическими заболеваниями показана эффективность вакцины инфлювак [12]. Для профилактики эпидемий необходимо вакцинировать наибольшее количество населения. С учетом большого количества вирусов, способных вызывать ОРЗ, заболеваемость гриппом после вакцинации должна быть подтверждена серологически.
В рандомизированном контролируемом исследовании (Нидерланды) после вакцинации 1838 человек старше 60 лет случаи гриппа, подтвержденные серологически, составили 58% ОРЗ [7]. По результатам метаанализа показано, что вакцинация против гриппа пожилых людей в различных странах позволяет уменьшить количество случаев госпитализации в среднем на 33%, в т. ч. связанные с пневмонией и гриппом, – на 27–38%, общую смертность – на 50% [11, 13].
Несмотря на успехи профилактики, объем вакцинации остается ограниченным [24, 25]. В США в 1997 г. вакцинированных в возрасте до 65 лет было менее 30%, сейчас, по данным ВОЗ, количество вакцинированных увеличивается. Не всегда наблюдается полное соответствие структуры вакцины циркулирующим штаммам, соответственно, защитный эффект вакцины составляет 70–90% [25], в в группах риска, у лиц преклонного возраста, пациентов с иммунодефицитом эффективность снижается до 30–40% [26, 27].
Меры по предотвращению пандемии необходимо принимать заранее, т. к. в случае ее развития существенно возрастет расход лекарственных препаратов, увеличится потребность в первичных консультациях, число обращений к врачу, случаев госпитализации, осложнений. По прогнозам ВОЗ, при пандемии за короткий срок число посещений в поликлиниках достигнет 233 млн, поступлений в больницу – 5,2 млн, смертей – 7,4 млн человек [28].
Предполагают, что наиболее выраженные проявления пандемии будут отмечаться в слаборазвитых странах вследствие недостаточно организованной работы системы здравоохранения. С другой стороны, будет наблюдаться недостаток вакцины, сотрудников, что повлечет за собой нарушения работы учреждений здравоохранения, общественного транспорта, правоохранительных органов. Без развития пандемии в США ежегодно от гриппа умирает от 10 тыс. до 40 тыс. человек, при этом в последние 60 лет не было отмечено снижения показателей смертности от гриппозной пневмонии [29].
До конца 1970-х гг. в России вакцинацию против гриппа проводили живой ослабленной вакциной. Проведение вакцинации в группе риска живой ослабленной вакциной невозможно, что связано с реактогенностью и возможностью развития гриппа у ослабленного контингента пациентов. В последние годы в практическое здравоохранение активно внедряются вакцины IV поколения, виросомальные вакцины, в которые введены мембранные антигены вируса гриппа, что позволяет повысить их иммуногенность и приводит к активации клеточного иммунитета, повышает титр и увеличивает длительность циркуляции протективных антител [17].
Новая отечественная инактивированная расщепленная вакцина Ультрикс® получена с помощью обработки вирусов гриппа детергентом β-октилгликозидом и в своем составе содержит высокоактивные псевдовирусные частицы в виде виросом, поверхностные и внутренние антигены вирусов гриппа А (H1N1 – 15 мкг, H3N2 – 15 мкг) и В (15 мкг). Введение вакцины не приводит к повышению уровня иммуноглобулина (Ig) E, что указывает на ее безопасность при аллергических заболеваниях [19]. В клинических испытаниях показана безопасность вакцины у детей старше 6 лет, взрослых 18–60 лет и старше 60 лет. Иммуногенность вакцины по уровню сероконверсии антител к вирусу гриппа А (H1N1) – 94%, А (H3N2) – 86%, В – 90%. Состав антигенов вакцины меняется согласно рекомендациям ВОЗ. Через 6 мес. после вакцинации сохранялся защитный титр антител к вирусу гриппа А (H1N1) у 81,3%, А (H3N2) – у 61,5%, В – у 47,3% вакцинированных, при этом не наблюдалось достоверного снижения титра антител. При вакцинации детей не было отмечено выраженной реактогенности, иммуногенность вакцины по уровню сероконверсии антител составляла к вирусу гриппа А (H1N1) 70%, А (H3N2) – 50%, В – 70%. После вакцинации не отмечалось выраженных общих и местных реакций [3].
Эффективность вакцинации оценивали в клиническом исследовании в октябре – ноябре 2013 г. у 5743 жителей 7 регионов РФ, 325 человек из них были старше 60 лет. Местную реакцию наблюдали в единичных случаях, при этом не потребовалось терапевтического вмешательства [3].
И. Фельдблюм и соавт. проведено открытое проспективное рандомизированное исследование с включением 1008 взрослых от 18 до 63 лет, 504 человека из них были вакцинированы вакциной Ультрикс®, 504 человека не были вакцинированы (контрольная группа). В течение 6 мес. осуществляли проспективное наблюдение за группой. Иммуногенность вакцины оценивали по уровню сероконверсии (доля лиц, у которых титр противовирусных антител возрос в 4 раза) и серопротекции (доля лиц, у которых титр антител был больше 1:40). Наблюдение в поствакцинальном периоде выявило слабые местные реакции у 0,8% вакцинированных, слабые общие – у 2,8%, комбинированные – у 0,4% вакцинированных. Наблюдение в течение 6 мес. не выявило значимых изменений биохимических показателей крови и мочи (показатели билирубина, креатинина, мочевины, ферменты печени, в моче не определяли повышения уровня белка и лейкоцитов). Общий IgE на начало исследования составлял 50,14 МЕ/мл, через 180 дней после вакцинации оставался в пределах нормы – 88,3 МЕ/мл (разница достоверна). Повышение уровня IgE может быть связано с усилением экологической и антропогенной нагрузки в условиях крупного города (г. Пермь), преобладанием T-хелперов 2-го типа иммунного ответа. Иммуногенность вакцины по уровню сероконверсии антител к вирусу гриппа А (H1N1) составила 66,7%, А (H3N2) – 53,5%, В – 46,5%. Фактор сероконверсии к вирусу гриппа А (H1N1) был равен 5,18, А (H3N2) – 3,94, В – 3,55. Серопротекция наблюдалась к вирусу гриппа А (H1N1) у 98%, А (H3N2) – у 76,8%, В – у 70,7% привитых. После вакцинации у привитых диагностирован 31 случай, в контрольной группе – 32 случая ОРВИ. Показатель заболеваемости у привитых составил 61,5 на 1 тыс. человек, в контрольной группе – 85,3 на 1 тыс. человек (разница достоверна). В группе привитых диагноз гриппа не был подтвержден, в контрольной группе подтвержден у 5 человек (длительность заболевания – 7,6 дня (среднетяжелая форма). Таким образом, коэффициент защищенности составил 100% [22].
Иммуногенность у детей 12–18 лет вакцины Ультрикс® 45 мкг была по уровню сероконверсии антител к вирусу гриппа А (H1N1) 70%, А (H3N2) – 50%, В – 70%. Фактор сероконверсии составил к вирусу гриппа А (H1N1) 6,5, А (H3N2) – 2,7, В – 4. Серопротекция наблюдалась к вирусу гриппа А (H1N1) у 90%, А (H3N2) – у 80%, В – у 85% привитых. Показатели сопоставимы с результатами вакцинации ваксигрипом 45 мкг [29].
Таким образом, исследования показали хорошую безопасность, иммуногенность и низкую реактогенность новой отечественной гриппозной виросомальной вакцины Ультрикс® у детей старше 6 лет и взрослых, включая лиц старше 60 лет.

Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с ним. Почему? Грипп является чемпионом среди вирусов по способности к генетической изменчивости, которая позволяет ему уходить от иммунного надзора. Вирус с изменившимися поверхностными белками уже не распознается специфическими противогриппозными антителами к штаммам-предшественникам.
Наиболее эффективным, безопасным и экономически оправданным средством профилактики гриппа является вакцинация. Чтобы вакцина защищала от гриппа, должно быть четкое соответствие вакцинных штаммов эпидемическим. В отличие от большинства других вакцинных препаратов, существует необходимость ежегодного обновления штаммового состава противогриппозных вакцин и, следовательно, необходимость ежегодной иммунизации. Проблема гриппа давно вышла за пределы одной страны. Центрами по гриппу ВОЗ, организованными по всему миру, проводится регулярный мониторинг и сбор информации по сезонным циркулирующим штаммам вируса гриппа и вспышкам заболеваемости. На основании анализа присланного материала эксперты делают прогнозы относительно разновидностей гриппа, которые будут циркулировать в следующем эпидсезоне, а также предлагают вирусы-кандидаты в вакцинные штаммы для производителей.
С учетом того, что дифференциальная диагностика гриппа от других ОРВИ затруднена, показатели иммуногенности вакцин принято оценивать по уровню специфических антител к гемагглютинину (ГА). Защитный эффект ГА-специфических антител неоднократно был продемонстрирован как у животных, так и у людей. Антитела нейтрализуют вирус гриппа, предотвращая его связывание с рецепторами, при этом уровень антител к гемагглютинину напрямую коррелирует с уровнем защищенности. При оценке потенциальной эффективности вакцины титр антител не менее чем 1:40 считают защитным. Антитела к другому изменчивому поверхностному белку вируса гриппа — нейраминидазе — не могут предотвратить инфекцию, однако играют важную роль в защите от тяжелых форм гриппа, препятствуя выходу вирусных частиц из инфицированных клеток и дальнейшему распространению вируса в организме. Гемагглютинин и нейраминидаза названы протективными белками, а вакцины, содержащие только эти очищенные белки, — субъединичными.
Снижение антигенной нагрузки в вакцинирующей дозе обеспечивает максимальный профиль безопасности препарата. Антигены с адъювантом образуют комплекс, который стимулирует гуморальное и клеточное звенья иммунитета. Это приводит к образованию специфических к протективным белкам антител, отвечающих за защиту от гриппа, и повышает общую резистентность организма к инфекции.
Клинические исследования безопасности и иммуногенности Гриппол ® Нео проводились с участием добровольцев в высокоспециализированных исследовательских центрах по изучению вакцинных препаратов и поствакцинальных реакций.
Изучение частоты местных и общих реакций, а также соматической и инфекционной заболеваемости во всех группах наблюдения, проведенное в рамках данного исследования, показало, что препараты хорошо переносятся и обладают низкой реактогенностью. Целью данной публикации является анализ результатов иммуногенности вакцины Гриппол ® Нео в сравнении с коммерческим препаратом — вакциной Гриппол ® .
Материалы и методы
Вакцины
Дизайн исследования
Исследования проведены в соответствии с утвержденными протоколами и согласно разрешению МЗ РФ на клинических базах ФГУ НИИ ДИ Росздрава и ГОУ ВПО СПбГМУ им. ак. И. П. Павлова в соответствии с требованиями Надлежащей клинической практики (GCP).
Дизайн исследования: рандомизированное, двойное слепое, контролируемое сравнительное в параллельных группах. Вакцинация добровольцев проведена после подписания информированного согласия.
Участники были отобраны в соответствии с критериями включения/исключения, определенными протоколом клинического испытания. Всего было вакцинировано 300 здоровых добровольцев в возрасте 18–55 лет (средний возраст — 24,5 ± 0,5 года). Перед прививкой все добровольцы были осмотрены врачом, было проведено измерение температуры тела, артериального давления, женщинам — тест на беременность.
Методом случайного выборочного распределения было сформировано три группы по 100 человек. Вакцинацию проводили однократно в дельтовидную мышцу в объеме 0,5 мл.
Постановка реакции и учет результатов
Иммуногенность оценивали в соответствии с требованиями Европейского комитета к противогриппозным вакцинам (СPMP/BWP/214/96), согласно которым должен выполняться по крайней мере один из трех критериев:
сероконверсия (процент лиц с четырехкратным приростом титра антител после вакцинации) — не менее 40%;
серопротекция (процент лиц с защитным титром антител до и через 21–28 дней после вакцинации) не менее 70%;
Статистика
Результаты исследований статистически обработаны с использованием t-критерия Стьюдента. Вариационный анализ полученных результатов проводили с применением пакета прикладных программ Statistica 6.0.
Результаты и обсуждение
Серологическое обследование с целью оценки иммунологической эффективности вакцинации проводили, сравнивая уровень антител в парных сыворотках, взятых до прививки и на 21-й день после вакцинации. Во всех экспериментальных группах в сыворотках привитых регистрировали статистически достоверное нарастание титров антител. По всем анализируемым критериям не наблюдалось статистически достоверной разницы в иммунном ответе на серии вакцины Гриппол® Нео с различными дозировками антигенов. В таблицах приведены данные, относящиеся к серии, содержащей по 5 мкг гемагглютинина каждого штамма.
Подсчеты числа лиц с серопротекциями (защитными титрами антител (≥ 1:40)) показали, что в каждой группе уровень этих антител соответствует критерию CPMP (табл. 1).
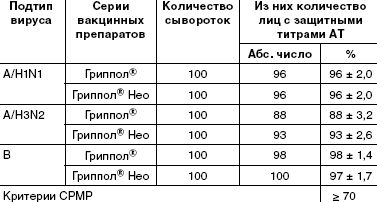
Наиболее иммуногенными оказались компоненты вакцин H1N1 и B. У привитых вакциной Гриппол ® Нео по 5 мкг уровень серопротекций составил 96% и 97% соответственно, у привитых вакциной Гриппол ® — 96% и 98%. Число людей с защитным титром антител (сероконверсий) против штамма A/H3N2 было несколько ниже — 93% для Гриппола® Нео и 88% для Гриппола ® . Достоверных различий по данному показателю между исследуемыми вакцинами и препаратом сравнения вакциной Гриппол ® (p > 0,05) не выявлено. Кратность нарастания антител и доля лиц с 4-кратным и более приростом титра антител являются важными характеристиками иммунного ответа на вакцинацию, особенно у людей, ранее не встречавшихся с данными разновидностями вируса гриппа. В табл. 2 показаны результаты вакцинации серонегативных добровольцев — людей с низким (< 1:20) исходным уровнем антител. Из результатов следует, что для всех подтипов вируса гриппа наблюдалось увеличение титров антител, значительно превышающее критерии CPMP.
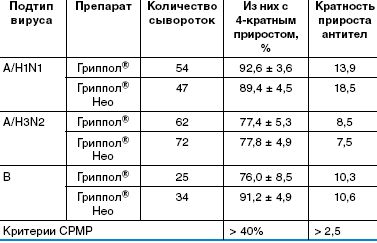
Для вакцин Гриппол ® Нео и Гриппол ® число сероконверсий к подтипу А/H1N1 составило 89,4% и 92,6%; для подтипа А/H3N2 — 77,8% и 77,4%; для типа В — 91,2% и 76,0% соответственно. Кратность прироста титра антител у серонегативных лиц составила от 7,5 до 18,5 для Гриппола ® Нео и от 8,5 до 13,9 — для препарата сравнения.
Известно, что человеческая популяция неоднородна по наличию антител к различным штаммам и подтипам вируса гриппа вследствие гриппозных эпидемий и предыдущих вакцинаций. Среди вакцинированных добровольцев выявлены как серонегативные, так и серопозитивные участники (исходно имевшие защитный титр). Представлялось интересным оценить эффективность иммунизации в общей популяции людей (табл. 3).
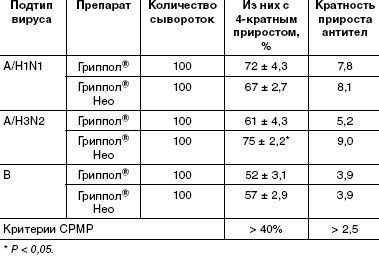
Уровень сероконверсий в целом по группам привитых для штаммов типа А составил 67–75% для вакцины Гриппол ® Нео и 61–72% для вакцины сравнения. Уровень сероконверсий для штамма В составил 57% для вакцины Гриппол ® Нео и 52% для Гриппола ® . Отметим, что в препарате сравнения содержание антигена типа В вдвое выше (11 мкг), чем в тестируемой вакцине — Гриппол ® Нео (5 мкг), однако статистически достоверных различий по иммуногенности к этому компоненту не выявлено.
Выводы и заключение
Проведены государственные клинические испытания вакцины Гриппол® Нео с уменьшенной антигенной нагрузкой, которые показали, что она обладает всеми качествами вакцинного препарата нового поколения: безвредностью, высокой иммуногенной активностью при введении.
Уровень серопротекций для вакцины Гриппол® Нео составил 93–98%; уровень сероконверсий (четырехкратный и более прирост антител) у серонегативных лиц — от 78% до 91%, кратность нарастания титра антител — от 7,5 до 18,5. Таким образом, препарат соответствует всем трем международным критериям иммуногенности, предъявляемым к инактивированным гриппозным вакцинам.
Ключевые слова: вакцина, грипп, Гриппол ® Нео, клеточная культура
Актуальная тема
Как свидетельствуют эпидемиологические исследования, хронической обструктивной болезнью легких (ХОБЛ) в странах Евросоюза и Северной Америки страдают от 4% до 10% взрослого населения [1]. В структуре общей смертности сре
Под стекло
Клинические исследования
Россия входит в пятерку стран с наибольшей заболеваемостью сахарным диабетом [1]. До 47% госпитализаций больных с сахарным диабетом связано с поражением стоп. Результаты лечения гнойно-деструктивных осложнений диабетической стопы остаются неудовлетворител
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с
В структуре инфекционной заболеваемости детей ведущее место занимают респираторные инфекции [1–3]. Известно, что всеобщей закономерностью является повышенная восприимчивость к ним детей раннего и дошкольного возраста [6–8].
Страничка педиатра
Из практики
Цервицит — это тотальное воспаление шейки матки, включающее воспаление слизистой оболочки влагалищной части шейки матки (экзоцервицит) и слизистой оболочки канала шейки матки (эндоцервицит).
Сегодня уже стало очевидно, что бронхиальная астма (БА) — глобальная проблема: в Европе около 30 млн человек страдают этим хроническим заболеванием, в США ежегодно более 2 млн попадают в реанимационные отделения, а
Педиатрия
Эндокринология
Россия входит в пятерку стран с наибольшей заболеваемостью сахарным диабетом [1]. До 47% госпитализаций больных с сахарным диабетом связано с поражением стоп. Результаты лечения гнойно-деструктивных осложнений диабетической стопы остаются неудовлетворител
Гинекология
Цервицит — это тотальное воспаление шейки матки, включающее воспаление слизистой оболочки влагалищной части шейки матки (экзоцервицит) и слизистой оболочки канала шейки матки (эндоцервицит).
Дерматовенерология
Рубцы это результат замещения поврежденных собственных тканей на грубую соединительную в результате оперативных вмешательств и различных травмирующих факторов (механических, температурных, химических, ионизирующего излучения, глубокого
Аллергический контактный дерматит является классической формой реакции гиперчувствительности замедленного типа, опосредованной сенсибилизированными лимфоцитами. По данным ряда авторов, этой патологией страдает от 1% до 2% населения различны
Атопический дерматит (АД) — наследственное, иммунонейроаллергическое, хроническое рецидивирующее воспалительное заболевание кожи, обусловленное атопией, проявляющееся интенсивным зудом, симпатергической реакцией кожи (белым дермографизмом)
Бронхопульмонология
В структуре инфекционной заболеваемости детей ведущее место занимают респираторные инфекции [1–3]. Известно, что всеобщей закономерностью является повышенная восприимчивость к ним детей раннего и дошкольного возраста [6–8].
Сегодня уже стало очевидно, что бронхиальная астма (БА) — глобальная проблема: в Европе около 30 млн человек страдают этим хроническим заболеванием, в США ежегодно более 2 млн попадают в реанимационные отделения, а
Как свидетельствуют эпидемиологические исследования, хронической обструктивной болезнью легких (ХОБЛ) в странах Евросоюза и Северной Америки страдают от 4% до 10% взрослого населения [1]. В структуре общей смертности сре
Инфекции
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с
Иммунопрофилактика в современном мире — основа борьбы с инфекционной патологией. С ее помощью в мире ликвидирована оспа, заканчивается ликвидация полиомиелита, в ряде регионов, в т. ч. в России, практически элимини
Грипп и острые респираторные вирусные инфекции (ОРВИ) являются самыми массовыми заболеваниями человека. В России их доля в общей структуре инфекционной заболеваемости превышает 90%; с ними связан целый ряд медицинских и социа
Вклинике инфекционных болезней демиелинизирующие заболевания нервной системы являются одной из актуальных проблем, вследствие преобладания тяжелых форм, высоких показателей инвалидизации и летальности
С 2005 года в России и Москве впервые через 25 лет снова достигнут и сохраняется спорадический уровень заболеваемости дифтерией (показатель < 0,1 на 100 000 населения) — период, когда внимание к&
Вакцинопрофилактика
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с
Иммунопрофилактика в современном мире — основа борьбы с инфекционной патологией. С ее помощью в мире ликвидирована оспа, заканчивается ликвидация полиомиелита, в ряде регионов, в т. ч. в России, практически элимини
Грипп и острые респираторные вирусные инфекции (ОРВИ) являются самыми массовыми заболеваниями человека. В России их доля в общей структуре инфекционной заболеваемости превышает 90%; с ними связан целый ряд медицинских и социа
Вклинике инфекционных болезней демиелинизирующие заболевания нервной системы являются одной из актуальных проблем, вследствие преобладания тяжелых форм, высоких показателей инвалидизации и летальности
С 2005 года в России и Москве впервые через 25 лет снова достигнут и сохраняется спорадический уровень заболеваемости дифтерией (показатель < 0,1 на 100 000 населения) — период, когда внимание к&
Архив номеров
Актуальные проблемы
Специализации
- Premium
- Аллергология
- Бронхопульмонология
- Вакцинопрофилактика
- Гастроэнтерология
- Гепатология
- Гинекология
- Дерматовенерология
- Иммунология
- Инфекции
- Кардиология
- ЛОР-патология
- Медтехника
- Неотложная помощь
- Нутрициология
- Онкология
- Педиатрия
- Психоневрология
- Ревматология
- Сезонная аллергия
- Терапия
- Уронефрология
- Фармакология
- Эндокринология
- ИТ в здравоохранении
Календарь событий:

Обзор
Автор
Редакторы



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Мутации и вариации
Известно три разновидности вируса гриппа, опасных для человека:
- тип А (Alphainfluenzavirus) — наиболее подвержен мутациям и является постоянной головной болью Всемирной организации здравоохранения (ВОЗ);
- тип В (Betainfluenzavirus) — более стабилен, но все же может видоизменяться;
- тип С (Gammainfluenzavirus) — наиболее стабилен, поэтому к нему вырабатывается длительный иммунитет. Эпидемичных вспышек не дает, чаще всего приводит к нетяжелому заболеванию у детей.
Если бы все типы вируса гриппа были похожи на тип С, больших проблем с ними не было. Однако тип А постоянно мутирует, поэтому довольно часто появляются его новые вариации (штаммы), с которыми наша иммунная система еще не знакома [2]. Из-за этой изменчивости классификация вирусов гриппа достаточно сложная: внутри каждого типа существуют подтипы (в случае с типом В — линии), в которые объединяют штаммы вируса. Причем, штаммы подтипов могут быть как родственными (то есть эволюционно недалеко ушедшими друг от друга), так и непохожими.
Кому опасен грипп?
Причем в случае с беременными женщинами риск касается не только будущей мамы, но и ее ребенка: грипп во время беременности более чем в 7 раз повышает риск госпитализации, а также может привести к преждевременным родам (около 30% случаев), мертворождению и малому весу при рождении [2], [6]. Поэтому во многих странах мира (США, Великобритания, Австралия, Италия) беременным рекомендована вакцинация против гриппа. Делают это по двум причинам:

Рисунок 1. Строение вируса гриппа (типы А и В)
Когда лучше сделать прививку?
Вакцинация против гриппа — это ежегодная прививка , которая защищает от трех или четырех наиболее распространенных в данной местности штаммов вируса. Это значит, что каждый год на основании рекомендаций ВОЗ и региональной ситуации национальные комитеты по контролю над гриппом составляют рекомендации антигенного состава будущей вакцины [15], [16]. Однако чаще всего эти рекомендации совпадают с рекомендациями ВОЗ, которые публикуются отдельно для северного и южного полушарий.
Большинству людей прививают одну дозу вакцины, однако детям от шести месяцев до двух лет (и до девяти лет в случае их первой вакцинации [17]) рекомендованы две дозы с минимальным интервалом в один месяц. Исследования показывают, что в этом случае эффективность вакцинации увеличивается [18], [2].
Состав противогриппозных вакцин все время меняется: например, в сезоне 2019–2020 были заменены оба штамма вируса типа А, и в итоге в четырехкомпонентную вакцину вошли:
- A/Brisbane/02/2018 (H1N1);
- A/Kansas/14/2017 (H3N2);
- B/Colorado/06/2017 (линия B/Victoria/2/87);
- B/Phuket/3073/2013 (линия B/Yamagata/16/88).
В трехкомпонентную вакцину, соответственно, рекомендовано включить первые три штамма вируса [16]. Однако бывает и так, что каждый год в составе вакцин повторяется название одного из штаммов. Значит ли это, что постоянно прививают одно и то же? Нет, даже в этом случае штаммы могут существенно различаться, в том числе и по генам, не входящим в классификацию.
Как долго длится иммунитет после вакцинации и имеет ли он пролонгированный эффект на будущий год? К сожалению, эффективность прививок против гриппа недолговечна. Она зависит от времени, прошедшего с момента прививки и штамма вируса: в среднем, считается, что защита снижается примерно на 7% в месяц для H3N2 и штаммов линии В и на 6–11% — для H1N1 [17]. Конечно, скорость и степень снижения могут различаться, но эффективной защиты, скорее всего, хватает на год [11].
Как выбирают штаммы и почему четыре лучше трех?
В течение всего года специалисты NICs анализируют циркулирующие штаммы вирусов на основании лабораторных анализов пациентов с респираторными заболеваниями, выделяют из общей массы пробы с вирусом гриппа и выбирают подходящих кандидатов для дальнейшего изучения в одном из пяти центров ВОЗ (WHO CCs) [19]. Отбор идет по принципу типичности вируса для данного региона и новизне, которую определяют по его реакции с антителами из набора ВОЗ. Дальнейшая работа осуществляется уже в центрах ВОЗ, где штаммы культивируют, анализируют, сравнивают между собой, составляют карты антигенности, строят математические модели и в итоге на основании всех этих данных выбирают претендентов в состав вакцины [19]. Как происходит этот процесс и сколько времени занимает каждая стадия, показано на рисунке 2.

Рисунок 2. Процесс отбора штаммов для противогриппозной вакцины
И наконец, дважды в год проходят Сезонные совещания ВОЗ, посвященные составам противогриппозных вакцин (Seasonal influenza vaccine composition meeting), на которых объявляют рекомендации для будущего сезона: в феврале — для северного полушария, в сентябре — для южного. Как только составы обнародованы, и производители получают вакцинные штаммы, запускается процесс производства, на который уходит около полугода (видео 1). Однако ошибки в планировании могут задержать весь цикл, что скажется на количестве произведенной вакцины или на сроках ее поставки.
Видео 1. Производство противогриппозных вакцин
Почему все-таки четырехкомпонентная вакцина лучше трехкомпонентной, если циркулирующих штаммов гораздо больше? Все дело в линии В, вирусы которой обычно циркулируют вместе, но в разных пропорциях [3], поэтому в случае с вакцинами, состоящими из трех компонентов, штамм линии В всегда является компромиссным вариантом. Экспертам ВОЗ приходится выбирать большее из двух зол, но так как невозможно точно предсказать ситуацию, которая будет наблюдаться через восемь месяцев, периодически случаются ошибки, сказывающиеся на эффективности вакцины. Например, в сезоне 2017–2018 она оказалась ниже ожидаемой, так как ВОЗ прогадала со штаммом вируса типа В, предположив, что доминировать будет линия Victoria, а оказалось — Yamagata [20]. Кроме того, уже не первый год наблюдается низкая эффективность вакцины в отношении штамма H3N2. Точная причина неизвестна, но существует несколько предположений:
- Адаптация штамма во время производства может приводить к некоторым изменениям (антигенному несоответствию), и иммунитет развивается уже к новому штамму, который отличается от циркулирующего.
- Циркулирующие штаммы подтипа H3N2 меняются быстрее, чем другие — им хватает полугода (то есть времени, прошедшего с момента объявления рекомендаций ВОЗ), чтобы измениться и стать менее похожим на вакцинный штамм.
- Стандартной дозы, содержащейся в вакцине, может быть недостаточно для эффективной защиты [18], [21].
Какой должна быть идеальная вакцина?
Вакцины против гриппа бывают живыми (интраназальные вакцины, применяются редко) и инактивированными. Современные инактивированные делятся на нескольких категорий:

Рисунок 3. Виды антигенов инактивированных вакцин. а — Инактивированный вирусный вирион в цельновирионной вакцине. б — Расщепленный инактивированный вирион в сплит-вакцине. в — Частички антигена в субъединичной вакцине.
Все вышеперечисленные вакцины являются вакцинами против сезонного гриппа .
В отдельную группу выделяют препандемические и пандемические вакцины. Их производят в случае возникновения угрозы пандемии. Препандемические (зоонозные) состоят из штамма зарождающегося вируса животного происхождения, который, по мнению экспертов, обладает пандемическим потенциалом, пандемические — из штамма, вызвавшего пандемию (такие вакцины появляются на волне заболеваемости) [15].
Однако выбрать штаммы для состава — лишь полдела. Главное, чтобы вакцина была эффективной. Для этого существуют определенные критерии.
Во-вторых, существуют требования к титрам антител после вакцинации (в том числе и для вакцин с адъювантами), которые указаны в таблице 1.
| Показатель | Люди от 18 до 60 лет | Люди старше 60 лет |
|---|---|---|
| 1. Кратность нарастания среднего геометрического титра антител после вакцинации (GMT increase) | 2,5 раза | 2 раза |
| 2. Уровень сероконверсии * (процент привитых с нарастанием титра антител минимум в четыре раза по сравнению с исходым) | 40% | 30% |
| 3. Уровень серопротекции (число лиц с защитным титром) ** | 70% | 60% |
| * — В тестах, измеряющих ингибирование гемагглютинина (HI), сероконверсия соответствует отрицательной сыворотке до вакцинации (HI < 1:10) и сыворотке крови после вакцинации HI ≥ 1:40. ** — Серопротекция соответствует проценту привитых с сывороткой HI ≥ 1:40. | ||
Для сезонных вакцин необязательно соблюдение всех трех условий; соответствие всем требованиям необходимо только для пандемических [24]. Мало того, сейчас титр HI ≥ 1:40 уже не считается надежным фактором для определения эффективности защиты (50–70% против клинических симптомов гриппа), так как уровни защиты могут варьировать в зависимости от индивидуальных характеристик, групп населения, возрастных групп и даже от типа вакцины [25].
В-третьих, есть отдельные требования к вакцинам, содержащим адъюванты:
- Совместимость адъюванта с антигенными компонентами вакцины.
- Доказательство последовательной связи адъюванта с вакцинными антигенами во время производства и в течение срока годности.
- Данные о влиянии адъюванта на эффективность вакцины.
- Биохимическая чистота адъюванта [23].
Если все это суммировать, то идеальная вакцина должна быть безопасной (низкореактогенной ), содержать 15 мкг гемагглютинина на дозу, вызывать определенные уровни титров антител у привитых в зависимости от их возраста (при этом количество эффективно привитых должно быть не менее 70% среди взрослого населения до 60 лет). Если же вакцина содержит адъювант, он должен быть безопасным, связанным с антигенами и вызывать иммунный ответ в соответствии со строгими стандартами.
Что касается безопасности, то благодаря широкому использованию сплит- и субъединичных вакцин, прививки против гриппа демонстрируют низкую реактогенность. В основном наблюдаются местные реакции (у 10–64 привитых из 100) и повышение температуры (чаще всего у детей: 12 из 100 привитых) [26].
Вакцинация против гриппа и аллергия на куриный белок
В противопоказаниях к вакцинам против гриппа указано, что их нельзя прививать людям, у которых есть аллергические реакции на любой из компонентов, в том числе и на белок куриного яйца [27]. Однако в международной практике людей с аллергией на куриный белок совершенно спокойно прививают как против гриппа, так и против кори, краснухи и паротита, хотя вирусы для этих вакцин выращивают с использованием куриных эмбрионов. Вакцинации аллергиков дали зеленый свет после серии исследований [28–30], в которых изучали реактогенность у людей с аллергическими реакциями на куриный белок: в итоге эти вакцины признали безопасными, и теперь прививают даже людям с анафилактической реакцией на куриный белок (единственное, таких пациентов нельзя прививать в аптеках или школах, как это делают в некоторых странах — только в медицинских центрах, где есть противошоковые медикаменты).
Во время производства вакцины клеточную культуру подвергают сериям центрифугирований и ультрафильтраций, которые позволяют отделить вирусные частицы от остальных белков. Конечно, эта технология не идеальна, но даже если в препарат вдруг что-то и попадает, то лишь следовые количества овальбумина — основного белка куриного яйца: ≤ 1 мкг на 0,5 мл дозы инактивированной и 0,24 мкг на 0,2 мл дозы живой вакцины [31]. Поэтому основным противопоказанием для вакцинации против гриппа являются только тяжелые реакции на введение этих вакцин в прошлом (реакция на предыдущую дозу и аллергия на куриный белок не всегда связаны между собой: человек мог отреагировать на другой компонент, например, на неомицин) [27], [31].
Чем же прививаться?
Это вопрос, который волнует многих. В России прививают следующими вакцинами:
В какие противогриппозные вакцины добавляют адъюванты?
Муки выбора
Но, честно говоря, таких исследований единицы, поэтому выводы приходится делать по косвенным данным — официальной статистике заболеваемости гриппом в зависимости от количества привитых в нашей стране (рис. 4).

Рисунок 4. Заболеваемость гриппом и количество привитых против гриппа в России за 1996–2018 годы
Автор благодарит врача-биофизика Кирилла Скрипкина за помощь в подготовке материала.
Читайте также:

