Иммуномодулятор от герпеса вич
Обновлено: 25.04.2024
Так как элиминация любого инфекционного возбудителя является результатом синергического взаимодействия между защитными силами макроорганизма и антимикробными агентами, то лечение антибиотиками, противовирусными и противогрибковыми средствами будет малоэфф
Так как элиминация любого инфекционного возбудителя является результатом синергического взаимодействия между защитными силами макроорганизма и антимикробными агентами, то лечение антибиотиками, противовирусными и противогрибковыми средствами будет малоэффективным у лиц с исходно пониженной функциональной активностью иммунной системы. Поэтому оправдан поиск препаратов, стимулирующих иммунологическую реактивность и тем самым повышающих эффективность антимикробной терапии. Речь идет об иммуномодуляторах — лекарственных препаратах с иммунотропным действием, усиливающих эффективную иммунную защиту [9, 10, 13].
При вялотекущих, рецидивирующих, плохо поддающихся химиотерапии, имеющих тенденцию к хронизации заболеваниях целесообразно включение в комплексную терапию иммуномодулятора. Отечественный препарат последнего поколения — полиоксидоний — является иммуномодулятором первого выбора.
В условиях целостного организма полиоксидоний оказывает сложное и многогранное действие на иммунную систему. Так как развитие любого иммунного ответа начинается с клеток моноцитарно-макрофагальной системы, а цитокины, продуцируемые моноцитами/макрофагами, обладают плейотропным эффектом, то усиление под влиянием полиоксидония их функциональной активности ведет к активации и клеточного, и гуморального иммунитета. Так, в частности, при введении полиоксидония совместно с низкими дозами антигена происходит усиление синтеза антител к этому антигену в 5-10 раз по сравнению с контролем. Важно отметить, что такое усиление можно наблюдать у животных с генетически детерминированной слабой отвечаемостью на данный антиген [6]. Таким образом, полиоксидоний обладает способностью приводить в движение все факторы, защищающие организм от инфекционных агентов, причем защищающие естественным путем, так, как это происходит при развитии иммунного ответа в организме. А интенсивность иммунного ответа в большей степени зависит от исходного функционального состояния иммунной системы человека [6].
Рассмотрим, какова же клиническая и иммунологическая эффективность полиоксидония при трех основных формах иммунодефицитов.
Первичные иммунодефициты — это врожденные нарушения иммунной системы, связанные с наличием дефектов на генном уровне. Применение иммуномодуляторов при этих заболеваниях на первый взгляд кажется бесперспективным. Естественно, вылечить с помощью любого, даже самого хорошего иммуномодулятора первичный иммунодефицит невозможно, но применение этих препаратов в комплексном лечении таких состояний является обоснованным. Это связано с тем, что, согласно концепции иммунологических мобилей [4], иммунная система работает по типу весов. Наличие груза, даже очень небольшого, на одной из чашечек весов приводит в движение всю систему. Концепция иммунологических мобилей обосновывает применение иммуномодуляторов при первичных иммунодефицитах. Мы полагали, что активация, например, фагоцитарной системы у больных с дефектами в биосинтезе антител может в какой-то степени компенсировать этот недостаток и привести хотя бы к временному улучшению клинического состояния больного.
В отделении иммунопатологии нашего института полиоксидоний применялся в комплексном лечении первичного иммунодефицита — общей вариабельной иммунологической недостаточности (ОВИН) у взрослых. Это заболевание характеризуется снижением всех классов иммуноглобулинов — IgG, IgA, IgM и клинически чаще всего проявляется в виде хронических рецидивирующих заболеваний бронхолегочного аппарата. Как правило, при длительном течении ОВИН и выраженных очагах инфекции у этой категории больных формируется комбинированный клеточно-гуморальный дефект иммунитета; у многих пациентов отмечается тенденция к лейкопении, нейтропении и лимфопении.
У больных с ОВИН лечение полиоксидонием проводили по индивидуальной схеме: начинали с 12 мг, в/в, № 3 через день, а потом переводили на поддерживающую терапию по 6 мг в/м до 10 инъекций. В некоторых случаях полиоксидоний применяли в течение трех месяцев. У больных ОВИН в результате терапии полиоксидонием формула крови нормализовывалась, сокращались сроки лечения обострений, удлинялась ремиссия и в целом существенно улучшалось качество жизни.
К приобретенным иммунодефицитам относится ВИЧ-инфекция. Длительное время клинические иммунологи подвергали сомнению целесообразность применения иммуномодуляторов у больных с этой инфекцией, так как опасались активации под их влиянием Т-клеточного иммунитета и усиления размножения вируса. Однако в настоящее время накапливается положительный опыт применения иммуномодуляторов при ВИЧ-инфекции, и в частности полиоксидония. В НИИ клинической иммунологии Ростова-на-Дону применяли полиоксидоний совместно с антибиотиками (без противовирусной терапии) у больных в стадии пре-СПИДа с двусторонней очаговой пневмонией. У всех пациентов получен хороший клинический эффект, подтвержденный данными иммунологического и биохимического исследований. При применении антибиотиков и полиоксидония, по данным рентгенологического исследования, удалось на пять дней раньше ликвидировать очаги пневмонии в легких и вывести больных в состояние стойкой ремиссии по сравнению с теми, кто получал только антибиотики. У пациентов повысился уровень CD4+ T-клеток и вырос до единицы иммунорегуляторный индекс. Кроме того, улучшилась функциональная активность печени: снизился уровень билирубина и трансаминаз. Удивительным представляется факт существенного снижения вирусной нагрузки: с lg10 7 до lg10 6 . Мы полагаем, что снижение уровня ВИЧ связано со способностью полиоксидония повышать функциональную активность макрофагов и NK-клеток, осуществляющих элиминацию из организма инфицированных клеток. Мы также считаем, что включение полиоксидония в комплексную терапию больных СПИД, страдающих оппортунистическими инфекциями, является оправданным и целесообразным, так как резервные возможности организма человека очень велики и их повышение с помощью иммуномодулятора в ряде случаев может дать хороший клинический результат, пусть даже и кратковременный.
Вторичные иммунодефициты (ВИД) — это нарушения иммунной системы, развивающиеся в позднем постнатальном периоде или у взрослых и не являющиеся результатом генетических дефектов. Условно мы выделяем две формы ВИД: индуцированную и спонтанную [11]. Индуцированная форма возникает в результате конкретных причин, вызвавших ее появление: рентгеновское излучение, цитостатическая терапия, применение кортикостероидов, травмы и хирургические вмешательства. В этот перечень также входят нарушения иммунитета, развивающиеся вторично по отношению к основному заболеванию (диабет, заболевание печени, почек, злокачественные новообразования). Спонтанная форма вторичного иммунодефицита характеризуется отсутствием явной причины (хотя, без сомнения, она имеется), вызвавшей нарушение иммунной реактивности. Клинически она проявляется в виде хронических, часто рецидивирующих инфекционно-воспалительных процессов бронхолегочного аппарата, придаточных пазух носа, урогенитального и желудочно-кишечного тракта, глаз, кожи, мягких тканей, вызванных оппортунистическими (условно-патогенными) микроорганизмами. Поэтому хронические, часто рецидивирующие, вялотекущие, трудно поддающиеся лечению традиционными средствами воспалительные процессы любой локализации у взрослых рассматриваются как клинические проявления ВИД.
Наиболее ярким примером индуцированных ВИД являются хирургические инфекции. Доказана высокая клиническая эффективность полиоксидония, применяющегося как для их профилактики, так и при лечении [2]. В первом случае применение препарата перед операцией может существенно снизить развитие гнойно-септических осложнений, особенно при операциях на толстом кишечнике, когда велик риск их развития. При предоперационном применении полиоксидония почти в три раза удалось снизить частоту ампутации стопы вследствие язвенно-некротических поражений у больных сахарным диабетом [1]. Включение полиоксидония в комплексную терапию развившихся хирургических инфекций способствует более быстрому очищению раны от гнойно-некротических масс, ускоряет ее эпителизацию и заживление. Все это ведет к существенному снижению количества потребляемых антибиотиков и сокращению числа койко-дней. В силу наличия детоксицирующих и антиоксидантных свойств полиоксидоний особенно эффективен при токсико-септических состояниях; в этих случаях его целесообразно назначать капельно, внутривенно ежедневно в течение первых двух-трех дней и далее через сутки.
Как отмечалось выше, хроническое, рецидивирующее течение инфекционно-воспалительного процесса любой локализации может считаться проявлением ВИД. В этих случаях при назначении антимикробных препаратов целесообразным представляется также назначение иммуномодулятора. В нашем институте имеется положительный опыт применения полиоксидония в комплексном лечении хронического рецидивирующего фурункулеза [3] и хронического рецидивирующего герпеса.
У больных в стадии обострения фурункулеза в результате приема полиоксидония наблюдалось уменьшение признаков интоксикации, уменьшение инфильтрации фурункулов, более быстрая их регрессия. Наблюдение в течение двух лет выявило стойкую ремиссию заболевания у 44,6 % больных. Исходно у больных с хроническим рецидивирующим фурункулезом наблюдалось снижение функциональной активности фагоцитарных клеток, в частности снижение бактерицидных свойств нейтрофилов. Как правило, после применения полиоксидония у таких больных происходило восстановление их функциональной активности. Также имело место восстановление иммунорегуляторного индекса при его исходном нарушении.
При применении полиоксидония совместно с противовирусными препаратами у больных с рецидивирующим герпесом в стадии обострения острая фаза местного воспаления купировалась уже на вторые сутки, тогда как в контрольной группе везикулезные элементы сохранялись до пятого дня от начала лечения. Значительно быстрее достигалась и полная реэпитализация очагов поражения. У 95% больных, получавших полиоксидоний, длительность ремиссии составила в среднем три года. У этих больных наблюдалось повышение функциональной активности естественных киллеров и усиливался синтез α-интерферона, то есть полиоксидоний стимулировал развитие противовирусной защиты.
Литература
1. Гришина Т. Ю., Станулис А. И., Жданов А. В., Хаев А. В. Лечение гнойно-септических осложнений у больных диабетом // Аллергия, астма и клиническая иммунология. 2000. № 1. С. 47-48.
2. Карсонова М. И., Пинегин Б. В., Хаитов Р. М. Иммунопрофилактика и иммунотерапия хирургических инфекций // Практикующий врач. 1998. № 12. С. 9-12.
3. Латышева Т. В., Сетдикова Н. Х. Эффективность полиоксидония при некоторых формах первичных иммунодефицитов (ОВИН) и вторичных иммунодефицитных состояниях // Аллергия, астма и клиническая иммунология. 2000. № 1. С. 41-43.
4. Лусс Л. В. Полиоксидоний в общеклинической практике // Аллергия, астма и клиническая иммунология. 2000. № 1. С. 21-41.
5. Петров Р. В. Я или не Я. Иммунологические мобили. М.: Молодая гвардия, 1987.
6. Петров Р. В., Хаитов Р. М., Некрасов А. В. и др. Полиоксидоний - иммуномодулятор последнего поколения: итоги трехлетнего клинического применения // Аллергия, астма и клиническая иммунология. 1999. № 3. С. 3-6.
7. Пинегин Б. В. Полиоксидоний — новое поколение иммуномодуляторов с известной структурой и механизмом действия // Аллергия, астма и клиническая иммунология. 2000. № 1. С. 27-28.
8. Полосин А. В. Иммуномодулятор полиоксидоний — перспектива в лечении хронических урогенитальных инфекций//Аллергия, астма и клиническая иммунология. 2000. № 1. С. 45-46.
9. Хаитов Р. М., Пинегин Б. В. Иммуномодуляторы и некоторые аспекты их клинического применения // Клиническая медицина. 1996. № 8. С. 7-12.
10. Хаитов Р. М., Пинегин Б. В., Андронова Т. М. Отечественные иммунотропные лекарственные средства последнего поколения и стратегия их применения // Лечащий Врач. 1998. № 4. С. 46-51.
11. Хаитов Р. М., Пинегин Б. В. Вторичные иммунодефициты: клиника, диагностика, лечение // Иммунология. 1999. № 1. С. 14-17.
12. Хаитов Р. М., Пинегин Б. В. Современные представления о защите организма от инфекции // Иммунология. 2000. № 1. С. 61-64.
13. Хаитов Р. М., Пинегин Б. В. Основные принципы иммуномодулирующей терапии // Аллергия, астма и клиническая иммунология. 2000. № 1. С. 9-16.
14. Хоменко А. Г. Туберкулез вчера, сегодня, завтра//Проблемы туберкулеза. 1997. № 5. 9-11.
Иммунитет – это многоуровневая система безопасности нашего здоровья, которая срабатывает при атаках патогенных агентов как снаружи, так и изнутри организма. Как следствие – ослабленная иммунная система приводит к развитию различных заболеваний. Способны ли иммуномодуляторы бороться с болезнями и что необходимо учитывать при лечении этими препаратами?
Природой наш организм запрограммирован на самовосстановление. Но человечество существует в достаточно агрессивном мире, где микроорганизмы постоянно ищут питательную среду для своего размножения и выживания. Бактерии, грибки и вирусы осаждают нас со всех сторон, вторгаясь с пищей, водой и воздухом. И главная роль иммунной системы в организме состоит в том, чтобы защитить его от вредоносных микроорганизмов и не допустить развития заболевания. Другими словами, иммунитет обеспечивает гомеостаз – постоянство внутренней среды организма на клеточном и молекулярном уровне.
Крепкая иммунная система работает без остановки, участвуя во всех физиологических и патологических процессах. Взаимодействуя со всеми системами, иммунитет дает возможность организму существовать как единое целое.
Различают два вида иммунитета:
- врожденный (наследственный);
- приобретенный.
Узнайте больше о каждом виде иммунитета
Врожденный иммунитет у человека и животных передается от одного поколения к другому. Он бывает абсолютным и относительным. Среди примеров абсолютного иммунитета – невосприимчивость человека к болезням животных и наоборот. Относительный врожденный иммунитет проявляется в том, что заражение возможно лишь при определенных условиях, чаще всего в условиях научной лаборатории.
Приобретенный иммунитет подразделяется на искусственный и естественный, а также активный и пассивный. Например, активный искусственный иммунитет возникает при проведении прививок вакцинами и анатоксинами, а активный естественный иммунитет создается без медицинского вмешательства, после перенесенного заболевания или скрытой инфекции. Пассивный естественный иммунитет создается при передаче антител от организма матери ребенку при его внутриутробном развитии.
Любой, даже малейший сбой в работе иммунной системы может привести к заражению и развитию различных вирусных заболеваний, которые вызывает вирус герпеса человека (Human Herpes Virus, ВГЧ). Герпес 1-го типа (орофациальный), 2-го (генитальный), 6-го типа (розеола детская, синдром хронический усталости), ветряная оспа, опоясывающий лишай, цитомегалия, инфекционный мононуклеоз (вирус Эпштейна-Барр) – все эти названия заболеваний наверняка вам хорошо знакомы и периодически встречаются в СМИ.
Во многих странах рост заболеваемости герпесом значительно превышает частоту других инфекций. А это значит, что лечение этого недуга требует особого внимания как со стороны врачей, так и со стороны пациентов. Не все знают, но этот вирус способен приводить к развитию очень тяжелых осложнений, угрожающих жизни человека.
Что выбрать для лечения – противовирусные препараты, иммуномодуляторы или иммуностимуляторы?
При сегодняшнем разнообразии лекарственных препаратов непросто разобраться в их большом количестве и подобрать для борьбы с герпесом то лекарство, которое гарантированно поможет избавиться от заболевания и не вызовет развития осложнений. Если болезнь – это следствие ослабления работы иммунной системы, то для многих очевидно – для борьбы с заболеванием необходимо принимать препараты, которые у всех на слуху и призваны корригировать работу иммунитета: противовирусные препараты прямого действия, иммуномодуляторы или иммуностимуляторы. Что же лучше выбрать для лечения герпеса? Давайте разбираться.
Противовирусные препараты
На сегодняшний день ни один из существующих противовирусных препаратов не способен навсегда удалить вирус герпеса из организма. Но можно укрепить иммунитет, чтобы увеличить промежуток между рецидивами заболеваниями или даже вовсе обойтись без них. Здесь на помощь приходят противовирусные иммуномодулирующие препараты.
Иммуномодуляторы
Иммуномодуляторы – это группа фармакологических препаратов, активизирующих иммунологическую защиту организма на клеточном или гуморальном уровне. Гуморальная регуляция – один из эволюционно ранних механизмов регуляции процессов жизнедеятельности в организме, осуществляемый через жидкие среды организма (кровь, лимфу, тканевую жидкость, слюну). Иммуномодулирующие препараты корректируют показатели иммунитета и повышают неспецифическую резистентность организма, в том числе активизируя выработку интерферона – естественного защитного белка организма. Причем эффект иммуномодуляторов зависит от исходного состояния иммунитета больного: они снижают повышенные и повышают сниженные показатели иммунитета, т.е. действуют максимально благоприятно для человеческого организма.
Иммуностимуляторы
Очевидно, что для борьбы с герпесом лучше применять препараты, которые, во-первых, могли бы блокировать размножение вируса как внутри клетки, так и при приближении к ней, а во-вторых, которые могли бы мягко скорректировать работу иммунной системы, помогая выздороветь при острой форме заболевания. Также они должны купировать рецидив инфекции и увеличивать межрецидивные промежутки при ее хронической форме. Таких препаратов мало, но они есть.
Какие препараты-иммуномодуляторы можно принимать при генитальном герпесе?
Заболевание характеризуется появлением в области половых органов пузырьков, эрозий и язвочек. Все это сопровождается жжением, отечностью, общей интоксикацией организма и без своевременного лечения может приводить к развитию серьезных осложнений. Генитальный герпес входит в группу заболеваний, передаваемым половым путем (ЗППП), и в настоящее время отличается широкой распространенностью.
Бороться с этим заболеванием можно при помощи противовирусных препаратов. Один из таких препаратов – ВИФЕРОН, который помимо прямого противовирусного действия, обладает также выраженными иммуномодулирующими свойствами. В его составе содержится интерферон альфа-2b, который блокирует размножение вирусов, а также корректирует показатели собственного иммунитета организма. Препарат выпускается в форме свечей, мази и геля.
Для лечения герпесвирусных инфекций у детей применяются свечи в дозировке 150 000 МЕ один раз в двенадцать часов, для взрослых – 1 000 000 МЕ, для беременных женщин – 500 000 МЕ. Гель в виде полоски не более 0,5 см наносят на предварительно подсушенную пораженную поверхность 3-5 раз в день в течение 5-6 дней. Мазь наносят на пораженную поверхность 3-4 раза в день в течение 5-7 дней.
Какими иммуномодулирующими средствами лечат герпес на губах?
Для лечения герпеса может применяться препарат ВИФЕРОН, который способствует блокировке размножения вируса и корректирует защитные функции организма.
Применение препарата ВИФЕРОН Суппозитории для лечения герпесвирусных инфекций 1 :

- останавливает образование сыпи на второй день терапии;
- сокращает количество высыпаний на третий день терапии;
- увеличивает межрецидивный промежуток в 2 раза.
Иммуномодуляторы при опоясывающем герпесе
Опоясывающий герпес является вторичной инфекцией эндогенного происхождения у лиц, ранее перенесших ветряную оспу в клинической или латентной форме. Опоясывающий герпес и ветряная оспа имеют общую этиологию (причины и условия возникновения болезней) и патогенез (механизм зарождения и развития болезни и ее проявлений).
Препарат ВИФЕРОН Свечи (суппозитории) подавляет активность вирусов и повышает эффективность собственного иммунного ответа организма на патогенные микроорганизмы. А ВИФЕРОН Гель и ВИФЕРОН Мазь при нанесении на кожу образуют тончайший защитный слой, что позволяет бороться с вирусами, а также укрепляет местный иммунитет. Лечение препаратом ВИФЕРОН всех форм выпуска проводят по такой же схеме, как при генитальном герпесе.
Иммунокорректоры при герпесе 6 типа
Герпесвирус 6 типа является инфекцией, не менее распространенной, чем известные многим штаммы 1 и 2 типов. Вирус герпеса человека 6 типа поражает как детей, так и взрослых, а проявляется он по-разному. Если у ребенка при заражении развивается розеола, то для взрослых активизация вируса может означать развитие рассеянного склероза и синдрома хронической усталости.
Для комплексной терапии герпеса 6 типа может применяться противовирусный препарат ВИФЕРОН в виде свечей, геля и мази. Лечение проводят по такой же схеме, как при генитальном герпесе.
Важно знать
Препарат ВИФЕРОН Свечи может применяться без возрастных ограничений, его назначают детям, а также беременным женщинам со второго триместра. ВИФЕРОН Гель также применяется для лечения взрослых, в том числе беременных и кормящих женщин, и детей всех возрастов, в том числе новорожденных. А ВИФЕРОН Мазь назначают взрослым, в том числе беременным и кормящим женщинам, и детям старше года.
Справочно-информационный материал
Автор статьи
Врач общей практики
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем.
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем. Генитальный герпес вызывают два серотипа вируса простого герпеса: ВПГ-1 и ВПГ-2; причем наиболее часто — ВПГ-2. Согласно данным сероэпидемиологических исследований, инфицирование ВПГ-1 выявляется у 20—40%, а ВПГ-2 — у 50—70% больных генитальным герпесом [2]. Заболевание передается преимущественно при сексуальных контактах от больного генитальным герпесом. Нередко генитальным герпесом заражаются от лиц, не имеющих симптомов заболевания на момент полового контакта или не знающих о том, что они инфицированы [5]. Эта особенность ВПГ, связанная с бессимптомным вирусоносительством, является сложной задачей, от решения которой зависит не только трудоспособность и здоровье, но и личная судьба миллионов потенциальных больных. Имеются сведения о том, что от 60 до 80% новорожденных, у которых развивается неонатальный герпес, рождаются от матерей с бессимптомным носительством [6].
ВПГ-инфекция также может быть причиной нарушения репродуктивной функции, невынашивания беременности, преждевременных родов и патологии плода. Возможно участие ВПГ в развитии онкологических заболеваний гениталий, иммунодефицитных состояний, что позволяет считать герпесвирусные инфекции важной медико-социальной проблемой практического здравоохранения [2].
Лечение хронических, часто рецидивирующих форм ВПГ-инфекции, до настоящего времени представляет определенные трудности, которые объясняются особенностями взаимодействия вируса с макроорганизмом. Жизнедеятельность вирусов герпеса основывается на следующих биологических особенностях:
- все вирусы герпеса являются внутриклеточными паразитами;
- герпесвирусы пожизненно персистируют в аксоноганглиальных структурах центральной и периферической нервной системы;
- в течение жизни человек многократно реинфицируется новыми штаммами вирусов герпеса, при этом возможно одновременное сосуществование нескольких видов и штаммов вирусов [12];
- при нарушении динамического равновесия между иммунным гомеостазом и вирусами последние переходят в активную форму [9].
Согласно данным проведенных исследований только 20% инфицированных ВПГ имеют диагностированный генитальный герпес, 60% — нераспознанный симптоматический генитальный герпес (атипичную форму) и 20% — бессимптомный герпес. В настоящее время только 27% пациентов с диагнозом генитальный герпес получают противовирусную терапию, из них треть — местное лечение [2]. По данным некоторых авторов, около 95% пациентов с клиническими проявлениями генитального герпеса вообще никак не лечатся [11].
Все разнообразие методов терапии и профилактики герпесвирусных инфекций в конечном счете сводится к трем главным подходам:
- химиотерапия;
- иммунотерапия;
- комбинация этих двух методов.
Каждый врач в своей практической работе так или иначе сталкивается с необходимостью решения этой сложной задачи, требующей тонкого индивидуального подхода к каждому пациенту, страдающему ВПГ.
Различают два способа применения противовирусных химиопрепаратов: эпизодическое назначение (при обострениях герпесвирусной инфекции по мере необходимости) и супрессивная или превентивная терапия. В первом случае препарат назначается коротким курсом (5—10 дней), во втором — ежедневный прием препарата в течение нескольких месяцев, а то и лет призван помочь не столько купировать рецидив, сколько предотвратить развитие рецидивов как таковых.
Однако за последние 10 лет увеличилось число исследований, в ходе которых было показано, что изоляты вируса простого герпеса, полученные от пациенток с продолжающимися рецидивами генитального герпеса на фоне длительной супрессивной терапии (более 4 месяцев), обладают резистентностью по отношению к ацикловиру [10].
К тому же ни ацикловир, ни другие противовирусные агенты — фамцикловир, валацикловир — не предотвращают перехода вируса в латентное состояние, возникновения рецидивов после их отмены либо передачи инфекции, а также, к сожалению, не влияют на естественное течение этой инфекции, то есть не гарантируют полного излечения. Поэтому на протяжении последних двух десятилетий ученые изыскивают методы непосредственного воздействия на иммунную систему больных генитальным герпесом с целью стимуляции специфических и неспецифических ее факторов, тем самым способствуя блокаде репродукции вируса [1].
Главной мишенью применения иммуномодулирующих препаратов служат вторичные иммунодефициты, которые проявляются частыми, рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными процессами разной локализации [7]. Именно к таким процессам, требующим иммунокоррекции, и относится хроническая рецидивирующая герпесвирусная инфекция (ХРГВИ), в частности ее генитальная форма. Иммуномодуляторы назначают в комплексной терапии одновременно с противовирусными средствами.
Полиоксидоний — отечественный иммуномодулятор с широким спектром фармакологического действия, не имеющий аналогов в мире [3]. Опыт применения полиоксидония начиная с 1996 года показал его высокую клиническую эффективность в комплексном лечении многих вторичных иммунодефицитных состояний, проявляющихся хроническими, рецидивирующими, вялотекущими инфекционно-воспалительными процессами различной локализации, в том числе в ходе терапии вирусных инфекций [4].
У нас также имеется определенный позитивный опыт применения полиоксидония у пациентов, резистентных к ацикловиру [9].
Мы проводили исследование открытым методом у 50 пациентов с ХРГВИ. В исследование включались пациенты (возрастной интервал от 18 до 65 лет) мужского и женского пола с достоверным диагнозом ХРГВИ. К исследованию не допускались пациенты с гиперчувствительностью к полиоксидонию и беременные женщины. Все пациенты, включенные в исследование, находились в периоде продрома или обострения не более 48 часов от момента появления высыпаний. Обязательным условием для женщин детородного возраста было соблюдение полноценной контрацепции.
На предварительном этапе были сформированы две равнозначные группы пациентов по 25 человек. Пациенты, вошедшие в изучаемые группы, отбирались методом произвольной выборки. Все пациенты предъявляли жалобы на пузырьковые или эрозивные высыпания в области гениталий, зуд, жжение. До лечения всем пациентам проводилась ПЦР-диагностика ВПГ-2 (мазок) — положительный результат получен в 98,3 %.
Возрастной состав пациентов, страдающих генитальной формой герпесвирусной инфекции, в обеих группах был приблизительно одинаковым (43,6 года в первой группе и 38,9 — во второй), в то время как в первой группе средний возраст женщин и мужчин был несколько выше по сравнению со второй группой.
Дозировка и схемы введения. Всем пациентам производилась в/м инъекция препарата утром, под контролем врача. 1-я схема: терапия проводилась в течение 45 дней: пациенты получали по 6 мг полиоксидония в день в/м в течение 5 дней и по 6 мг в/м через день в течение 10 дней. Поддерживающая терапия — по 6 мг в/м 2 раза в неделю в течение месяца. 2-я схема: 6 мг полиоксидония в/м через день в течение 10 дней (всего 5 инъекций на курс).
Обследование проводилось до приема препарата и на 12—14-й день от начала приема препарата, а также на 3—6-й день после окончания приема препарата. Обследование включало общее клиническое, иммунологическое исследования крови, исследование мочи (общее), объективное исследование. Накануне приема препарата собирался подробный анамнез пациента. В состав исследуемых включались совершеннолетние пациенты мужского и женского пола с достоверным диагнозом ХРГВИ.
Объем сопутствующей терапии: все пациенты получали стандартную сопутствующую терапию (ацикловир по 0,2 г 5 раз в день в течение 5 дней и антиоксиданты).
Критериями оценки эффективности являлись следующие параметры: первичные критерии — время достижения полного выздоровления (полная реэпитализация); вторичные критерии — длительность ремиссии и частота рецидивов в ближайшем и отдаленном периоде после терапии полиоксидонием. С целью оценки местных симптомов проводился наружный осмотр места поражения. Оценивалось состояние кожных покровов и слизистых: наличие пузырьков, язвочек, корочек, гиперемии; выяснялись жалобы пациента (зуд, жжение, общее состояние, температура, миалгия).
На фоне лечения полиоксидонием по первой схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,44 до 3,5 дня, в то время как на фоне стандартной терапии (ацикловир и антиоксиданты) те же показатели изменились с 6,44 до 5,16 дня соответственно. После курса терапии в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем составляла 4 дня. В процессе лечения препаратом свежие высыпания ни у одного пациента не появились. 76% (19 человек) отметили уменьшение тяжести течения рецидива; остальные — 24% (6 человек) — не отметили разницы по сравнению с периодом до получения препарата. На фоне лечения полиоксидонием по второй схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,72 до 4,24 дня вместо 6,72 — 5,04 дня соответственно. После лечения полиоксидонием в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем также составляли 4 дня. 64 % (16 человек) отметили уменьшение тяжести течения рецидива; остальные — 36% (9 человек) — не отметили никаких изменений по сравнению с периодом до получения препарата.
Частота рецидивов у пациентов, получавших полиоксидоний по первой схеме в течение 6 месяцев после лечения, уменьшилась в среднем с 6,5 до 3 раз по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 27 до 75 дней. Максимальная длительность ремиссии увеличилась в среднем с 45 до 180 дней (у отдельных пациентов максимальная ремиссия достигала 190–220 дней, что связано с неравномерностью возникновения рецидивов в исследуемом временном интервале). У 84% пациентов (21 человек) отмечалось ослабление клиники течения рецидива; у 16% (4 человека) после лечения клиника не изменилась. Ухудшения течения заболевания отмечено не было. Частота рецидивов у пациентов, получавших полиоксидоний по второй схеме, в течение 6 месяцев после лечения уменьшилась в среднем с 6 до 3,6 раза по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 33 до 62 дней. Показатель максимальной длительности ремиссии в обеих группах вырос в среднем примерно одинаково — с 45 до 180 дней. У 72% пациентов (18 человек) отмечалось ослабление клиники течения рецидива; у 28% (7 человек) после лечения клиника не изменилась. Как и в первой группе, ухудшений течения заболевания отмечено не было.
Максимальная длительность ремиссии за период наблюдения (2 года) составила 1,9 года в первой группе (у 9 пациентов — 36 %) и 1,1 года во второй группе (у 4 пациентов — 16 %).
До лечения полиоксидонием в обеих группах частота встречаемости и выраженность местных и общих клинических проявлений ХРГВИ была выше по сравнению с теми же показателями на фоне лечения полиоксидонием.
Парентеральное (в/м) введение полиоксидония в соответствии со схемами (см. выше) не вызывало аллергических реакций, не оказывало гепатонефротоксического действия и токсического действия на кроветворные органы; пациенты отмечали хорошую переносимость препарата.
По данным общеклинических и лабораторных методов исследования, побочных эффектов и осложнений при приеме полиоксидония не было.
Использование полиоксидония в комплексной терапии пациентов с генитальной формой хронической рецидивирующей герпесвирусной инфекции является эффективным способом уменьшения клинических проявлений в фазе обострения, сокращения длительности рецидивов и заметного уменьшения их частоты в отдаленном периоде.
Раннее назначение полиоксидония способствует более быстрой реэпителизации и более стойкой ремиссии.
Использование инъекционной формы полиоксидония не вызывает аллергических реакций, а также других побочных эффектов и осложнений.
При соблюдении указанного режима дозирования препарат не обладает нефро- и гепатотоксическим действием.
А. Е. Шульженко, кандидат медицинских наук ГНЦ — Институт иммунологии МЗ РФ, Москва
Набиев Т.А., Давидян М.И.
НИИ Дерматологии и Венерологии МЗ РУз,
Республиканский Центр СПИД МЗ РУз, г.Ташкент
Введение
Синдром приобретенного иммунодефицита (СПИД) имеет характер системной патологии, одним из элементов которой являются оппортунистические инфекции [10, 13].
Наиболее часто при ВИЧ-инфекции наблюдаются поражения вызванные вирусами герпеса человека (ВГЧ) различных типов (ВПГ-1 и ВПГ-2типов, ВЗВ, ВЭБ, ЦМВ и др.), проявления которых вносят свой вклад в увеличение разнообразия клинико-лабораторных признаков у этих пациентов [6].
Состояние иммунной системы предопределяет развитие и дальнейшее течение вирусных инфекций. Герпесвирусные инфекции у ВИЧ отрицательных пациентов представляют собой серьезную медико-социальную проблему в практическом здравоохранении [5], а при наличии ВИЧ-индуцированного иммунодефицита они приобретают склонность к агрессивному течению, усугубляя течение самой ВИЧ – инфекции и часто являются одними из факторов, способствующих увеличению частоты летальных исходов у ВИЧ-инфицированных больных.
По данным научной литературы достаточно хорошо изучена взаимосвязь между вирусными инфекциями и иммунодефицитами. Показана способность вирусов, инфицировать иммунокомпетентные клетки с последующим развитием иммунопатологических реакций [2]. Данные нарушения не только препятствуют элиминации возбудителя и полной санации организма, но и создают условия для латентного или манифестного течения инфекционного процесса.
На современном этапе в терапии герпесвирусных инфекций ведущее место отводится химиотерапии ациклическими нуклеозидами (ацикловир, зовиракс, ганцикловир, валтрекс, фамвир и др) [3, 8, 15].
Однако применение данных препаратов при хронических, рецидивирующих формах заболевания, особенно у ВИЧ позитивных пациентов, не позволяет сформироваться полноценному иммунному ответу, что нередко проявляется сохранением частоты и тяжести рецидивов, а также приводит к развитию резистентных штаммов к применяемым противовирусным препаратам. На ряду с этим ни ацикловир, ни другие противовирусные химиопрепараты как фамцикловир, валациклавир и др. не предотвращают, ни перехода вируса в латентное состояние, ни возникновения рецидивов после их отмены, а также не дают возможности полной санации организма [11].
Материалы и методы.
Под наблюдением находились 34 ВИЧ – инфицированных пациентов, со сроками заболевания от 1года до 8 лет (от срока установления ВИЧ-инфекции). Из них 24 мужчин, 10 женщин. Возраст больных колебался от 23 лет до 51года. Больные были на различных стадиях ВИЧ-инфекции (по классификации ВОЗ, рекомендованной для использования в практике приказом МЗ РУз № 420 от 23.09.2003г). В том числе 3 больных на І клинической стадии, 24 на ІІ, 6 на ІІІ и 1 больной на ІV клинической стадии заболевания. Все больные имели активные клинические проявления, вызванные различными типами герпесвирусов. Проявления орофациального герпеса наблюдались у 9 пациентов (в виде поражения красной каймы губ, кожи щек, герпетического стоматита и поражения слизистой зева), генитального герпеса у 12 больных (с локализацией элементов поражения на коже и слизистой половых органов и перианальной области). Опоясывающий лишай (Герпес Зостер) с различной локализацией очагов и формами поражений наблюдался у 9 пациентов, в 2 случаях пациенты имели генерализованную форму простого пузырькового лишая. По одному случаю отмечались волосатая лейкоплакия языка и эпидемическая форма диссиминированной саркомы Капоши (СК). В группе больных с орофациальными и генитальными поражениями наблюдались довольно частые рецидивы герпеса, в среднем от 4–6 до 10–12 раз в год. Среди 9 пациентов с опоясывающим лишаем у 2 наблюдались повторные случаи данного заболевания. У 2 пациентов с генерализованной формой простого пузырькового лишая отмечались 3х кратные рецидивы заболевания. Все больные, у которых за период ВИЧ инфицирования наблюдались рецидивы или другие формы герпетических поражений, неоднократно получали препараты ацикловира, антибиотико-, витаминотерапию.
Клиническую эффективность определяли по времени регресса высыпаний, эпителизации эрозивно-язвенных очагов, исчезновению субъективных ощущений и сокращению числа последующих рецидивов заболевания, а так же по результатам общих клинических и иммунологических исследований.
Результаты и обсуждение.
Таблица 1.
клинической
оценки
Традиционная /
Виферон терапия
Эпителизация
эрозивно-
язвенных очагов,
в днях
клинической
оценки
Генерализованная форма простого пузырькового
лишая
Традиционная /
Виферон терапия
Эпителизация
эрозивно-
язвенных очагов,
в днях
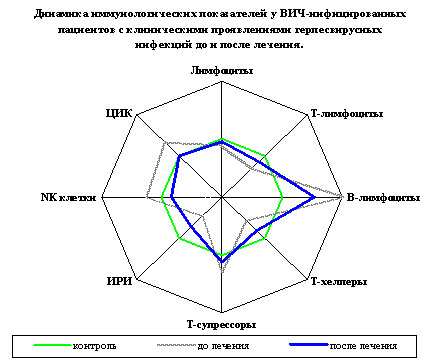
Изучение иммунологических показателей в группе ВИЧ- инфицированных пациентов с клиническими проявлениями различных типов герпесвирусов до назначения терапии выявило значительную динамику нарушений, которые выражались в снижении относительного показателя CD3+ и CD4+ лимфоцитов (42,3 ± 6,12% и 21,0 ± 4,12% соответственно при значениях контрольной группы 60,4 ± 2,17% и 36,0 ± 1,94%). При изучении относительного содержания CD19+, CD8+ и CD16+ лимфоцитов наблюдались изменения в сторону повышения данных показателей по отношению к контролю (31,0 ± 3,22% при норме 15,2 ± 1,74%, 24,3 ± 3,72% при 18,5 ± 1,22% и 15,5 ± 3,38% при 12,3 ± 1,33% соответственно). У больных исследуемой группы выявлено выраженное снижение иммуно-регуляторного индекса (ИРИ) (0,9 ± 0,29 при показателях в группе контроля 1,95 ± 0,11). Так же наблюдалось более чем 3-х кратное увеличение содержания ЦИК (42,4 ± 4,76 при средних нормативных значениях 12,8 ± 0,81).
После проведенной комплексной терапии появилась положительная динамика в изучаемых показателях, которая выражалась в существенном увеличении относительного количества CD4+ лимфоцитов (до 29,4 ± 2,51%), увеличении ИРИ (до 1,42±0,19) и снижении содержания ЦИК (до 32,4 ± 2,89). Наряду с данными изменениями отмечались положительные сдвиги в сторону контрольных величин в показателях гуморального звена: CD19+ лимфоцитов (23,2 ± 1,64%), CD8+ лимфоцитов (20,8 ± 1,34%). После завершения лечения у данной группы пациентов наблюдалась нормализация уровня CD16+ клеток. (Рис.1).

Рис 1.
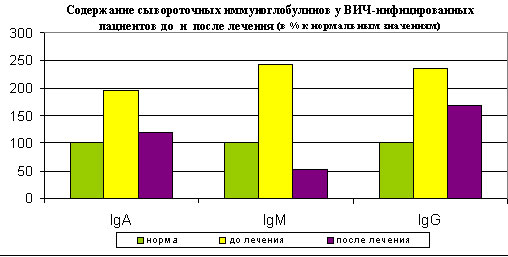
Изучение концентрации сывороточных иммуноглобулинов различных классов выявило значительный размах индивидуальных значений, что сказалось на достоверности данных. В связи с чем, было проведено изучение исходя из количества больных с повышенными значениями изучаемых показателей до и после лечения. Так, до лечения количество больных со значительным увеличением концентрации сывороточных IgA (6,9 ± 1,65) было таким же, как с нормальными значениями (0,98 ± 0,39). После лечения их соотношение изменилось. При чем не только количественно с 17 (50%) до 12 (35%) больных с повышенным содержанием IgA, но и качественно с тенденцией к снижению изучаемого показателя до 4,7 ± 2,59. Аналогичная картина наблюдалась и при изучении концентрации сывороточного IgG. До лечения повышенная концентрация (29,1 ± 5,94) выявлена у 27 больных (79%). После лечения снизилось и число больных с повышением уровня (19 больных, 56%) и сам показатель (23,5 ± 5,11) имел тенденцию к снижению. До лечения уровень сывороточных IgМ был повышен в среднем до 4,0 ± 1,9 у 25 больных (73,5%). После лечения у всех больных (34 человек) показатель снизился и составил в среднем 0,69 ± 0,29. (Рис.2).
ЛИТЕРАТУРА
1. М.В. Башлыкова, С.А.Масюкова, И.М. Каримова. Совершенствование методов диагностики и лечения герпетической и цитомегаловирусной инфекций. // Вестник дерматологии и венерологии.- 2001.- №5.-С.12 -14.
2. Букринская А.Г., Жданов В.М. Молекулярные основы патологии вирусов. М. 1991.-С.12-52.
3.Владимирова Е.В. Эффективность фамцикловира в лечении рецидивирующего генитального герпеса (клинико-лабораторное исследование): Автореф. дис… канд.мед.наук. М. 1998.- 17с.
5. Масюкова С. А., Владимирова Е. В. Фамиикловир в лечении герпетических инфскинй. //Росс. мед. журн.-2001.-№9.-С.11.
6. М.Н. Папуашвили, Н.И. Ильина, В.Б. Пинегин, М.Ю. Щелканов, А.Н. Юдин, С.А.Вичканова. Изучение эффективности гипромина в терапии герпетической инфекции у ВИЧ-инфицированных пациентов. //Иммунология .-2001.-№ 4.-С. 21-23.
7. С. И. Роговская, Н. С. Логинова, Л. З. Файзуллин, Г. Т. Сухих. Препараты интерферона и интерферроногены в лечении заболеваний половых органов, вызванных папиллома вирусной инфекцией. //Заболевания передаваемые половым путем. -1998. -№5. -С. 27-30.
8. Романцова М.Г, Голубева С.Ю. Герпетическая инфекция: вопросы патогенеза, методические подходы к терапии. М., 1997.- С.4—8.
9. А. Г. Филатенков, И.И. Богатырева, В. А. Самсонова, В. Б. Кириллов. Особенности клиники и лечения урогенитальных поражений папилломавирусом человека у женщин на фоне других заболеваний, передаваемых половым путем. //Вестн. дерматологии и венерологии. –1997. -№3. -С. 73-75.
10. Хаитов Р. М., Игнатьева Г. А. СПИД. – М.1992. -352с.
11. А.Е. Шульженко. Клиническая эффективность и безопасность применения полиоксидония в лечении хронической рецидивирующей инфекции вызванной вирусами простого герпеса. // Иммунология.-2002.-№6.-С.349-351.
12. Associazione di interleuchina-2 ed interferone-alpha nel trattamento delta condilomatosidella cervice uterine. //Minerva Ginecol. -1996. -Vol.48, №3. -P. 111-113.
13. CDC. Revised Classification System for HIV Infection and Expanded Surveillance Case Definition for AIDS Among Adolescents and Adults // MMWR. – 1993. – Vol. 41. – P. 1-19.
14. A Kreuter, I Schugt, R Schlottmann, H Rasokat, P Altmeyer, NH Brockmeyer. Treatment of Condylomata acuminata with pegylated interferon Alfa-2? in HIV-infected patients. JEADV 11 th Congress, Prague.- 2002. – P-334. р.35-16.
15. Reed E.G., Bowden R.A., Dandliker P.S. et al. Treatment of cytomegalovirus pneumonie with ganciclovir and intravenous cytomegalovirus immunoglobulin in patients with bone marrow transplants. Ann Intern Med 1988; Vol.109.-P.783-788.
16. I Schugt, A Kreuter, R Schlottmann, H Rasokat, P Altmeyer, NH Brockmeyer. Treatment of HIV- infection with pegylated Interferon Alfa-2? (Peglntron). JEADV 11 th Congress, Prague.- 2002. – P-334. p.35-17.
РЕЗЮМЕ
Читайте также:
- Чума черная смерть что это
- Антитела против вируса вич
- Кар на вирус хабархои нав таджикистан
- Сколько времени делается анализ крови на антитела к ветрянке
- Восстановление скрытых данных после вируса

