Иммунопатогенез при гепатите в
Обновлено: 24.04.2024
Приведенные данные убедительно доказывают то, что лямблиоз действительно угнетает иммунную систему организма, что отражается на активности основного его маркера – лизоцима. В 1-й группе пациентов, для которых характерен длительно протекающих лямблиоз и хронический вирусный гепатит В, только в 5,0 ± 2,8 % случаев наблюдается более 70 % активность лизоцима, и почти в таких же случаях она находится в пределах 61–70 % – 8,0 ± 3,5 %. Активность лизоцима на уровне 41–50 % отмечалась в 40,0 ± 6,3 % случаев. Показатели содержания специфического иммуноглобулина sIgA в ротовой жидкости свидетельствуют о нарушении в местной иммунной системе организма. Самая неблагоприятная ситуация с показателями содержания sIgA наблюдается в 1-й группе пациентов. В отличие от других групп, в этой группе очень мало случаев с нормальным содержанием sIgA. Отягчающее влияние вирусного гепатита В на иммунную функцию организма начинает проявляться при поэтапном развертывании клинической картины заболевания.

1. Бурканова JI.B. Функциональное состояние желчевыводящих путей при инфекционном гепатите в сочетании с лямблиозом и без него // Вирусный гепатит. – 2009. – № 4. – С. 1–7.
2. Быстрова Т.Н., Блохин К.В., Макарова Т.Г Динамика клинического течения гепатита А в зависимости от интенсивности эпидемического процесса // Идеи Пастера в борьбе с инфекциями: материалы конференции. – СПб., 2007. – С. 76.
3. Крамарь Л.В., Резников В.Е., Крамарь О.Г. Распространенность лямблиоза среди жителей Волгограда // Медицинская паразитология и паразитарные болезни. – 2008. – № 4. – С. 38–39.
4. Крыга Л.И., Платошина О.В. Богданов Х.У. Эпидемиологическая характеристика очагов хронических гепатитов В и С. // Идеи Пастера в борьбе с инфекциями: материалы конференции. – СПб., 2007. – С. 78.
5. Alter H.J., Holland P.V., Purcele R.H. Viral hepatitis. Light at the end of the tunnel // JAMA. – 2009. – Vol. 299, № 3. – P. 293–294.
6. Boyd William P., Bachman Barbara A. Gastrointestinal infections in the compromised host // Med. Clin. N. Amer. – 2010. – Vol. 66, № 3. – P. 743–753.
7. Вurness B.W., Beach M.J., Roberts J.M. Giardiasis surveillance United States // Morbidity& Mortality Weekly Report. – 2007. – Vol. 49, № 7. – P. l13.
8. Ganem D. Persistent infection of humans with hepatitis В virus: Mechanism and consequences // Rev. Infect. Dis. – 2008. – Vol. 4. – Р. 1026–1047.
Одно из ведущих мест в современной медицинской науке и практике занимает изучение этиологии, патогенеза и обоснование методов лечения вирусного гепатита В (ВГВ). При этом большинство работ ориентированы на изучение причин и механизмов развития этой патологии у лиц, не отягощенных паразитарными заболеваниями. Значительно меньше изучены особенности течения ВГВ на фоне кишечных паразитозов, в том числе такого распространенного, как лямблиоз [1, 2, 3]. В то же время, по данным ВОЗ, заболеваниями, сопровождающимися нарушениями метаболизма, к каковым относится лямблиоз, страдают многие миллионы людей и прогнозируется значительное увеличение данной патологии в ближайшие 10 лет.
Несмотря на небольшое число исследований по влиянию кишечных паразитозов на развитие и течение ВГВ, получены убедительные факты о многокомпонентноым воздействии этого заболевания на функциональное состояние печени. Как известно, лямблиоз возникает чаще и протекает менее благоприятно у лиц с изначальными дефектами иммунной защиты. В то же время лямблиоз относится к заболеваниям, сопровождающимся нарушениями иммунореактивности, и к факторам риска развития и неблагоприятного течения ВГВ [4, 5, 6, 7. 8]. Поэтому изучение спектра воздействия ВГВ на иммунные функции организма приобретает актуальное значение, так как без устранения последствий подобного воздействия лечение ВГB практически обречено на неудачу.
Целью исследования явилось изучение спектра влияния вирусного гепатита В на иммунные функции организма
Материалы и методы исследования
В соответствии с решаемыми задачами были отобраны три группы наблюдения: 1-я группа наблюдения – 59 пациентов, с развернутой, длительно протекающей клинической формой лямблиоза и с наличием хронического вирусного гепатита В, 2-я группа наблюдения ‒ 48 пациентов без лямблиоза и наличием ранних, начальных стадий , и контрольная группа наблюдения – 45 пациентов, не имеющих ВГВ и лямблиоза, практически здоровое население. Для характеристики состояния местного иммунитета организма обследуемых пациентов использовали методы по определению лизоцима секреторного иммуноглобулина sIgA, которые наиболее информативны в иммунологическом отношении. В основу количественного определения иммуноглобулинов положено измерение кольца преципитации, образующегося после внесения исследуемого субстрата в лунки, вырезанные в слое агара, в котором предварительно диспертирована моноспецифическая сыворотка. В стандартных условиях опыта диаметр кольца преципитации прямо пропорционален концентрации исследуемого иммуноглобулина sIgA. Концентрацию иммуноглобулина определяли по калибровочному графику с точностью до 0,003 г/л. В норме уровень sIgA в ротовой жидкости находится в пределах 50–60 г/л. Статистический анализ данных осуществлялся с помощью программы электронных таблиц Microsoft Excel, которые были сформированы в соответствии с запросами проводимого исследования.
Результаты исследования и их обсуждение
Лизоцим – фермент класса гидролаз, разрушающий оболочки бактериальных клеток, является первым и надежным антимикробным барьером организма. Присутствием его в ротовой жидкости и нейтрализацией агрессивных патогенных микроорганизмов во многом обусловлено процветание человечества. Снижение уровня активности лизоцима (обычно это бывает при менее 70 %) является серьезным сигналом сбоя иммунологической функции организма. Приведенные нами исследования по определению активности лизоцима в ротовой жидкости разных групп пациентов дали следующие результаты (табл. 1).
Данные по активности лизоцима в ротовой жидкости в разных группах обследованных пациентов
Введение
Вирусный гепатит В (HBV) – это самая распространённая хроническая вирусная инфекция в мире. По приблизительным подсчётам, около 2 миллиардов человек инфицированы и более чем 350 миллионов являются хроническими носителями вируса. В 2010 году, по данным миссии, изучающей мировую заболеваемость, HBV инфекция вошла в топ приоритетов здоровья в мире и оказалась в десятке болезней-лидеров по количеству летальных исходов (786000 смертей за год). Эти данные позволили ВОЗ включить вирусные гепатиты в основные приоритеты общественного здравоохранения. Безопасная и эффективная профилактика обеспечивается вакцинацией и эффективными противовирусными препаратами, доступными для предупреждения и лечения HBV инфекции, но удельный вес болезни так и останется высоким без согласованных усилий правительств, учреждений здравоохранения, а также без повышения общественной осведомленности и доступности медицинской помощи.
Эпидемиология

Подсчитано, что приблизительно у 30% населения земного шара обнаруживаются серологические маркеры текущей, либо уже перенесённой инфекции. Рак печени, возникший на фоне HBV, в 2010 году составил около половины причин общей смертности, с 1990 по 2010 смертность, ассоциированная с раком печени, в мире составила 62%, а с циррозом – 29%. HBV-инфекция передаётся посредством контакта с инфицированной кровью либо семенной жидкостью. Существует три основных пути передачи. В высокоэндемичных областях HBV передаётся главным образом перинатально, от инфицированной матери к новорождённому. В областях низкоэндемичных преобладает передача половым путем. Риск заражения высок у людей с большим количеством сексуальных партнеров, у мужчин, занимающихся сексом с другими мужчинами, и у людей, в анамнезе которых уже имеются другие инфекции, передающиеся половым путем. Третий источник инфицирования – небезопасные инъекции, переливание крови или диализ. Хотя скрининг продуктов крови существенно уменьшил развитие трансфузионно-ассоциированной HBV-инфекции, в развивающихся странах эта угроза по-прежнему высока. Другие возможные источники HBV включают нозокомиальную инфекцию, через загрязненные медицинские, хирургические или стоматологические инструменты; уколы иглой и донорство органов от HBsAg+ или HBV-ДНК+ доноров. Случаи HBV в семье, интимные не сексуальные контакты и жизнь в стесненных условиях также могут быть факторами риска развития болезни. Исход острой HBV-инфекции зависит от возраста. Приблизительно у 95% новорожденных, 20-30% детей (возрастом 1-5 лет) и менее 5% взрослых развивается хроническая инфекция. Реализация всемирной детской вакцинации против гепатита В выражается резким падением распространённости во многих частях света. (рисунок 1) Однако вакцинация охватывает от 90% в западной Пенсильвании (Америка), до 56% в юго-восточной Азии. Так же широко варьируется и мировая распространённость HBV. 5% инфицированных индивидов проживают в высокоэндемичных местах (распространенность HBV >8%), включающих Китай, юго-восточную Азию, большую часть Африки, большую часть тихоокеанских островов, часть Среднего Востока и бассейн реки Амазонки. В данных областях большинство случаев инфицирования происходит в младенчестве или в детстве. В некоторых высокоэндемичных странах, к примеру, как Китай, на данный момент общая распространенность HBV составляет 7-8%, и ожидается, что в ближайшем будущем он перейдет в промежуточную категорию. Рисунок 1: Географическое распределение основных генотипов вирусного гепатита В и частоты случаев хронического гепатита В в мире. Адаптация данных американских Центров по контролю и профилактике заболеваний инфекции. Приблизительно 43% HBV-инфицированных живут в регионах с промежуточным уровнем распространенности, к которым относятся: центральная, южная и юго-западная Азия, восточная и северная Европа, Россия, центральная и южная Америка. В этих областях происходит смешение существующих путей передачи инфекции новорождённым, детям и взрослым. Остальные 12% инфицированных индивидов живут в местах низкоэндемичных (распространенность <2%), к которым относятся: Северная Америка, восточная Европа, Австралия и Япония. Здесь большинство случаев инфицирования происходит в подростковом и взрослом возрасте посредством сексуальных и парентеральных контактов. Иммиграция оказывает выраженный эффект на распространённость в странах с высоким доходом. В 2012 году мета-анализ показал, что распространённость HBV-инфекции составила 7·2% у иммигрантов и беженцев, учитывая, что состояние иммунитета обследованных до этого составило 39·7%. По оценкам в США до 95% вновь диагностированных случаев хронической HBV-инфекции принадлежит иммигрантам.
Профилактика
- Все новорожденные *
- Все дети и подростки, не вакцинированые при рождении
- взрослые высокого риска
- Мужчины, имеющие половые контакты с мужчинами
- Люди с множественными сексуальными партнерами
- Потребители инъекционных наркотиков
- Пациенты на гемодиализе
- Пациенты ведомственных учреждений
- Медицинские работники и работники общественной безопасности
- Супруги, сексуальные партнеры, члены семьи которых являются носителями вируса гепатита B
Диагностика

Рисунок 2: HBV маркеры в ходе естественного течения острой HBV-инфекции (А) и перехода острой в хроническую инфекцию (В). У части хронических больных может произойти сероконверсия от HBeAg к антиHBe не смотря на персистенцию вирусной ДНК. HBV=вирус гепатита В Таблица 1. Клиническая интерпретация серологических маркеров вирусного гепатита В.
| Клиническая интерпретация | |
| HBsAg | "Визитная карточка" инфекцииПоложителен в ранней стадии острой инфекцииСтойко положителен при хронической инфекции |
| Анти-HBs | Выздоровление от острой инфекции или поствакцинальный иммунитет |
| HBeAg | Фаза иммунной толерантности или иммунного клиренсаОбычно имеет связь с высокой вирусной нагрузкой |
| Анти-HBeAg | Фаза невысокой репликации, если уровень вирусной ДНК низкийОтличный от других вариант HBV-инфекции, если уровень вирусной ДНК высокий |
| IgM анти-HBc | Острая инфекция;Единственный положительный серологический маркер в серологическом окне между исчезновением HBsAg и появления анти-HBsМожет быть положительным при тяжелом обострением хронической инфекции |
| IgG анти-HBc | Экспозиция инфекцииПрисутствует в связи с HBsAg при хронической инфекцииПрисутствует в связи с анти-HBs после выздоровления от острой инфекции Изолированное присутствие может означать скрыто протекающую инфекцию |
Иммунопатогенез
Вирус гепатита В не цитопатический, и повреждение печени и вирусная нагрузка – иммуноопосредованны. Клинический исход инфекции зависит от сложного взаимодействия между репликацией HBV и иммунным ответом организма. Вирус гепатита В является слабым индуктором врождённого иммунного ответа. Разрешение острой инфекции в основном происходит посредством приобретённого иммунитета. Люди, серологически восстановившиеся от острой HBV-инфекции, имеют сильные Т-клеточные реакции на некоторые эпитопы в различных участках вирусного генома. Напротив, подобные Т-клеточные реакции у пациентов с хронической формой вирусного гепатита В слабые. Восстановление имунной функции отмечается у пациентов, перенесших спонтанную HBeAg сероконверсию, и у пациентов с вирусологическими ответами на противовирусную терапию. Предполагается, что последовательное применение антивирусной, а затем иммунной терапии может повысить уровень клиренса вируса. Иммунный ответ на HBV может иметь негативные последствия. Чрезмерно агрессивная реакция иммунной системы считается причиной молниеносной формы гепатита В и обострений хронических заболеваний с резкими подъёмами концентрации аланинаминотрансферазы, которая служит связующим звеном иммунных реакций. Хотя некоторые подобные вспышки сопровождаются падениями концентрации ДНК-HBV и последующей сероконверсией HBeAg к anti-HBe (представляющей успешный иммунный клиренс инфицированных гепатоцитов), другие могут сопровождаться преходящим падением концентрации вирусной ДНК, представляя неэффективный иммунный клиренс. Периодические подъемы аланинаминотрансферазы повышают риск развития цирроза и гепатоцеллюлярной карциномы. Кроме печеночных проявлений, опосредованных клеточными иммунными реакциями, в результате дисбаланса гуморальных реакций, генерирующих циркуляцию иммунных комплексов, могут развиваться и внепечёночные проявления, главным образом это гломерулонефрит и васкулиты, в том числе и узелковый полиартериит.
Вирусология
Вирус гепатита В принадлежит семейству Hepadnaviridae. Это частично двуцепочечный ДНК-вирус, имеющий приблизительно 3200 пар оснований. Шаблоном для транскрипции вируса является ковалентно замкнутая кольцевая ДНК, которая располагается внутри ядра гепатоцитов как мини-хромосома. Поддержание ковалентно замкнутой кольцевой ДНК имеет большое значение для сохранения вируса. Репликация HBV включает в себя обратную транскрипцию прегеномной РНК, которая является промежуточным звеном на пути к вирусной ДНК. Обратная транскриптаза подвержена образованию дефектов, что увеличивает частоту мутаций. Рецептором для вступления вируса гепатита В в гепатоциты является полипептид таурохолата натрия. Наиболее распространённые мутации HBV включают единичные изменения нуклеотида в позиции 1896 в предшествующей ядру области, которая создает стоп-кодон и двойное изменение нуклеотида в позициях 1762 и 1764, расположенных в базальной промоторной области ядра, снижающих транскрипцию предъядерной мРНК. Эти мутации упраздняют или подавляют продукцию HBeAg, не влияя на способность вируса реплицироваться и вызывать хроническую HBV-инфекцию. Предъядерные мутации и мутации базальной промоторной области ядра могут возникать в отдельности или вместе. Географическое распространение этих HBeAg-отрицательных мутантов связано с распространённостью ассоциаций HBV генотипов. Вирус может быть классифицирован по меньшей мере на 10 генотипов, которые обозначаются от А до J. Генотип А часто встречается в Северной Америке, на севере Европы и Африки, генотипы В и С часты в Азии, а генотип D в основном обнаруживается в странах Средиземноморья, Ближнего Востока и Индии. (рисунок 1). HBV-генотипы могут влиять на прогрессирование заболевания и продукцию интерферонов.
Обычное течение
- Возраст старше 50 лет
- Мужской пол
- Наличие цирроза
- Гепатоцеллюлярная карцинома в семейном анамнезе
- африканская или азиатская раса
- Ожирение
- Сахарный диабет
- Высокий уровень репликации вируса гепатита B
- Генотип (С > В)
- Отличная от других базальная промоторная область ядра
- сопутствующее инфицирование вирусом гепатита С или гепатита D
- Алкоголь
- афлатоксин
Ведение больного
Общее:
Острая HBV-инфекция самоограничивается в более чем 95% случаев иммунокомпетентных взрослых. Поэтому течение является благоприятным, и до сих пор противовирусная терапия показана только для пациентов в случаях длительной или тяжёлой острой болезни. Ведение хронической формы должно включать оценку статуса репликации HBV, скрининг на ко-инфекции: ВИЧ, вирус гепатита С и вирус гепатита D, а также оценку степени тяжести заболевания печени. Клиническая оценка, анализ крови, анализ ферментов печени и гистология печени используются для установления степени тяжести заболевания. Были разработаны дополнительные неинвазивные методы (анализы крови и измерение плотности печени), которые всё больше и больше могут заменить гистологическое исследование печени. Хотя результаты являются многообещающими, эти методы нуждаются в дополнительной оценке до того, как они смогут быть применены в клинической практике. Неинвазивная оценка особенно полезна у пациентов с нормальной концентрацией аланинаминотрансферазы с целью исключения клинически выраженного фиброза, так как компромисс между риском и выгодой у этих больных не в пользу биопсии печени. Тем не менее биопсия печени важна для больных с незначительно повышенной или колеблющейся концентрацией аланинаминотрансферазы для того, чтобы установить, показана ли противовирусная терапия. Пациентов следует консультировать о мерах предотвращения передачи и необходимости изменений образа жизни, таких как ограничение потребления алкоголя, для снижения риска повреждения печени. Пациенты также должны быть осведомлены о возможных исходах болезни, вариантах лечения, и важности долгосрочного мониторинга. Пациенты старше 40 лет с циррозом печени или с семейной историей гепатоцеллюлярной карциномы должны подвергнуться УЗИ и тестированию на α-фетопротеин. Этот надзор за гепатоцеллюлярной карциномой должен быть продолжен при антивирусной терапии, поскольку риск сохраняется даже у пациентов с вирусологическим откликом. Основными целями противовирусной терапии являются длительное подавление репликации HBV и воспаления печени, что предотвращает прогрессирование цирроза и гепатоцеллюлярной карциномы. Ответ на лечение оценивается на основе биохимических (нормализации АЛТ), вирусологических (подавление HBV ДНК до неопределяемой чувствительными ПЦР концентрации), серологических (потеря HBeAg или HBsAg и сероконверсии в анти-HBe или анти-HBs ) и гистологических (снижение воспаления на биопсии печени без признаков прогрессирования фиброза) мер. Семь противовирусных агентов одобрены для лечения хронической инфекции HBV: две формы интерферона альфа (обычный и PEG-илированный), и пять нуклеозидов (T) IDE аналогов (ламивудин, адефовир, энтекавир, тельбивудин и тенофовир).
Интерферон:
Интерферон обладает противовирусной и иммуномодулирующей активностью и применяется как препарат для подкожных инъекций. Он имеет много побочных эффектов, в том числе грипп-подобные симптомы: усталость, супрессия костного мозга, депрессия и обострение или разоблачение аутоиммунных болезней. Интерферон противопоказан пациентам с печёночной недостаточностью и должен использоваться с осторожностью у пациентов с компенсированным циррозом печени. Годичный курс пегилированного интерферона с добавлением (или без) ламивудина у HBeAg-позитивных пациентов результировался сероконверсией у 29-32% больных и потерей HBsAg у 3-7% пациентов через 24 недели после завершения лечения. В дальнейшем сероконверсия была стойкой у 80% пациентов, а потеря HBsAg произошла у 58% пациентов, инфицированных генотипом А и у 11% инфицированных другими генотипами и имевших сероконверсии. У HBeAg негативных пациентов годичный курс пегилированного интерферона с добавлением (или без) ламивудина результировался устойчивой реакцией, которая была определена как нормализация концентрации аланинаминотрансферазы и подавление HBV ДНК ниже 10 000 МЕ / мл у 25% пациентов и потеря HBsAg у 9% пациентов через 3 года после завершения лечения. Предположительный ответ у HBeAg-положительных больных включает предшествующую терапии высокую концентрацию аланинаминотрансферазы, высокую концентрацию HBV ДНК и генотип вируса А. В 2013 результаты исследования показали, что падение концентрации HBsAg на фоне лечения является сильным показателем ответа на интерферон, но в соответствии с генотипом вируса имеются различные правила прекращения терапии. Для HBeAg-отрицательных пациентов не существует показателей, предшествующих терапии и предсказывающих ответ, но снижение концентрации HBeAg в течение первых 12-24 недель лечения прогнозирует устойчивый ответ. Полиморфные интерфероны lambda3 / IL28B в некоторых исследованиях также описываются как предсказывающие реакцию.
Аналоги нуклеоз(т)идов:
Кому показано лечение?
Хроническая HBV-инфекция является динамическим процессом, отражающим взаимодействие между репликацией HBV и иммунным ответом хозяина. Согласно данным литературы, при хроническом гепатите B именно количественный состав и функции врожденных иммунных клеток оказывают выраженное влияние на вирус. Глубокое понимание иммунопатогенетических механизмов, вызванных отдельными антигенными компонентами HBV, которые вызывают как хронический гепатит B, так и его неблагоприятные исходы, послужит основой для применения прогностически значимых методов иммунодиагностики, а также эффективного лечения и профилактики заболевания.
Хроническая HBV-инфекция остается глобальной проблемой общественного здравоохранения в связи со значительной заболеваемостью и смертностью. На сегодняшний день 350–400 млн человек в мире хронически инфицированы вирусом гепатита B (HBV). Распространенность HBV-инфекции в разных странах колеблется от 0,1 до 20%. По оценкам ВОЗ, ежегодно около 1 млн человек умирают от последствий, связанных с гепатитом В (ГВ), таких как цирроз печени (ЦП) и гепатоцеллюлярная карцинома (ГЦК) [1, 2]. Около 10–30% пациентов с хронической HBV-инфекцией имеют повышенный риск развития прогрессивного заболевания печени в сочетании с фиброзом и ЦП [3, 4]. Один из каждых 4 пациентов с ЦП, вызванным HBV-инфекцией, страдает от декомпенсации функции печени в течение 5 лет, а у 5–10% пациентов развивается ГЦК. При отсутствии терапии почти 15% пациентов с ЦП погибают в течение 5 лет [5, 6].
Несмотря на накопленный опыт и знания, в изучении HBV-инфекции все еще остается много вопросов, которые требуют дальнейших исследований. На современном этапе раскрыты многие данные о молекулярных путях, перекрестных взаимодействиях между вирусными частицами и клетками хозяина, роли вирусных белков в инициировании иммунных реакций и регуляции клеточных популяций на разных стадиях вирусной инфекции. Показано, что хронические воспалительные и фиброзные изменения в печени при HBV-инфекции, а также онкогенез в случае ХГВ стимулируются сложными взаимодействиями между вирусом и иммунной системой хозяина [7, 8] и зависят, согласно анализу, проведенному И.П. Балмасовой и соавт. [9], от количественного состава и функциональной состоятельности врожденных иммунных клеток.
В 2017 г. EASL представила обновленные рекомендации [3], в которых предлагается классифицировать хроническую HBV-инфекцию на 5 фаз с учетом наличия HBeAg, уровней HBV ДНК, значения аланинаминотрансферазы (AЛT) и наличия воспаления печени:
- I – HBeAg-позитивная хроническая инфекция;
- II – НВeАg-позитивный хронический гепатит;
- III – HBeAg-негативная хроническая инфекция;
- IV – HBeAg-негативный хронический гепатит;
- V – HBsAg-негативная фаза
Тем не менее однократное определение маркеров репликации HBV, а также маркеров активности заболевания не позволяет немедленно классифицировать фазу заболевания. Так как фазы хронической HBV-инфекции не обязательно последовательны, необходим регулярный мониторинг сывороточных уровней AЛТ, HBeAg и ДНК HBV.
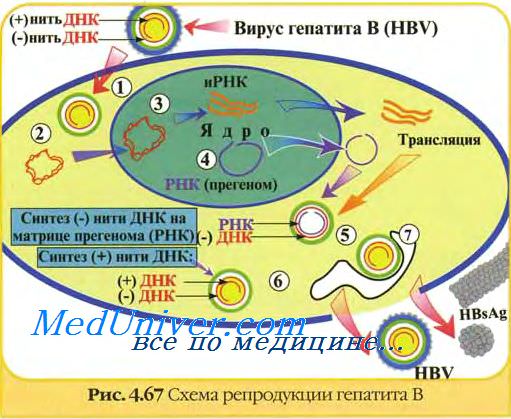
Циркулирующий вирион состоит из оболочки и нуклеокапсида, который содержит релаксированную двухцепочечную ДНК (dslDNA) [10]. Выделение dslDNA из нуклеокапсида под воздействием клеточных ферментов происходит в цитоплазме. После проникновения в гепатоцит оболочка теряется, а нуклеокапсид транспортируется в ядро. Попав в ядро, вирусная dslDNA связывается с хроматином и образует циклическую структуру – ковалентно замкнутую кольцевую ДНК (cccDNA), Таким образом, основными этапами биосинтеза cccDNA являются декапсидация нуклеокапсида, содержащего релаксированную (рыхлую) линейную ДНК – dslDNA; транспортировка dslDNA в ядро и ее превращение в ковалентно-замкнутую кольцевидную ДНК – cccDNA. В свою очередь, cccDNA посредством транскрипции способствует образованию прегеномной РНК и еще 3 матричных РНК (мРНК). Прегеномная РНК выходит из ядра, попадает в эндоплазматический ретикулум (ER) и служит в качестве матрицы для синтеза основного белка и фермента вируса – обратной транскриптазы [11].
Считается, что cccDNA HBV ответственна за латентную инфекцию HBV [13]. В новой номенклатуре она определяется как HBsAg-отрицательная фаза (скрытая HBV-инфекция) и характеризуется отсутствием в сыворотке HBsAg, наличием антител к HBcAg (анти-HBc) с возможным наличием или отсутствием антител к HBsAg (анти-HBs), нормальными значениями АЛТ. Обычно (но не всегда) в сыворотке не обнаруживается ДНК HBV. При этом ДНК HBV (cccDNA) могжет быть обнаружена в печени [14].
Как упоминалось выше, ДНК HBV обладает способностью интегрироваться и находиться в генетическом материале гепатоцитов как мини-хромосомы, которые могут сохраняться от нескольких месяцев до нескольких лет. Процесс интеграции и репликации HBV происходит одновременно. В этом случае интегрированная ДНК может служить независимой матрицей для синтеза мРНК, что объясняет наличие HBsAg у инфицированных пациентов в отсутствие определяемой репликации ДНК HBV. В ходе деления гепатоцитов ДНК HBV асимметрично распределяется ме.
Патогенез гепатита В. Диагностика гепатита В. Лечение гепатита В.
Вирус гепатита В гематогенно заносится в печень и размножается в гепатоцитах. Во второй половине инкубационного периода (40-180 сут) вирус выделяют из крови, спермы, мочи, фекалий и секрета носоглотки.
В патогенезе гепатита В важную роль играют аутоиммунные гуморальные и клеточные реакции, что подтверждает связь между началом клинических*проявлений и появлением специфических AT. Патологический процесс начинается после распознавания вирусиндуцированных Аг на мембранах гепатоцитов иммунокомпетентными клетками.
Осложнения хронической формы гепатита В обусловлены хроническим воспалением и некротическими процессами в паренхиме печени; основные осложнения — цирроз и первичная карцинома печени. Цирроз обычно отмечают у страдающих острым хроническим гепатитом; ежегодно регистрируют более 10 000 летальных исходов, обусловленных вирусным гепатитом В.
Карцинома печени при гепатите В. Показана чёткая связь между злокачественной трансформацией гепатоцитов и перенесённым вирусным гепатитом В. В развитии опухолевого процесса принимают участие определённые кофакторы, многие из которых остаются неизвестными.
Принципы микробиологической диагностики гепатита В
AT к HBeAg. Важный диагностический маркер инфицирования, особенно при отрицательных результатах выявления HBsAg.
• IgM к HBcAg. Один из наиболее ранних сывороточных маркёров вирусного гепатита В. При хроническом гепатите маркируют репликацию вируса и активность процесса в печени. Их исчезновение является показателем либо санации организма от возбудителя, либо развития интегративной фазы инфекции.
• IgG к HBcAg. Сохраняются многие годы. Свидетельствуют об имеющейся или ранее перенесённой инфекции.
AT к HBeAg. Серологический маркёр интеграции вируса. В комплексе с IgG HBeAg и HBsAg свидетельствуют о полном завершении инфекционного процесса.
AT к HBsAg. Протективные AT; также образуются после вакцинации. Применительно к хроническому вирусному гепатиту, могут свидетельствовать о завершении вирусной инфекции.
AT к preS1- и preS2-фрагментам HBsAg. Свидетельствуют о развитии протективного иммунитета при завершении инфекционного процесса. AT к Pre-S выявляют одновременно с AT к HBcAg, a AT к Pre-S2.
Лечение гепатита В
Средства специфической терапии гепатита В отсутствуют, лечение в основном симптоматическое. Определённые перспективы имеет применение ингибиторов ДНК-полимеразы (например, ламивудина), а-ИФН и его индукторов. Несмотря на то что на терапию ИФН реагируют менее 50% пациентов, показаны достоверное исчезновение всех маркёров инфекции (ДНК вируса гепатита В, HBsAg и HBeAg) и увеличение титров AT к HBsAg
Читайте также:

