Инактивированные вакцины от инфекционных болезней
Обновлено: 23.04.2024
Какие компоненты могут содержаться в современных вакцинах?
Существуют различные классификации препаратов для активной иммунизации:
Живые с искусственно ослабленным возбудителем
Убитые (инактивированные)
Этот случай отличается от первого лишь тем, что инфекционный агент уже не живой, содержит убитые целые микроорганизмы (бактерии и вирусы) или их части.
Примеры инактивированных вакцин: против коклюша (цельноклеточная), против полиомиелита (ИПВ) и др.
Эти препараты содержат обезвреженные (инактивированные) токсины бактерий, обладающие иммуногенностью и лишенные токсигенности. Для организма они уже не являются ядом, но всё ещё способны вызывать иммунный ответ.
На основе анатоксинов делают вакцины, например, от дифтерии, столбняка, коклюша (вакцина с бесклеточным коклюшным компонентом).
Прим.: Интересен факт, что при естественном заражении столбняком, иммунитет к нему не формируется. Потому как содержание токсина в крови не достаточно для формирования иммунной памяти, а бо́льшая концентрация приводит к летальному исходу. В данном случае инактивированный токсин – это единственная возможность получить иммунитет и не бояться данной инфекции.
Искусственные антигены
Материалом для создания искусственных антигенов служат рекомбинантные белки или их фрагменты, синтезированные в лабораториях путем применения методов генной инженерии. В данном случае разработчик вакцины выступает инженером той конструкции, которую будут вводить пациенту.
Примеры таких вакцин: против вируса гепатита В, против вируса папилломы человека (ВПЧ).
Сравним вакцины с собаками?
Для ещё большей наглядности предлагаем вам еще одну занимательную аналогию.
Дикий вирус – это волк:
Ослабленный вирус – это домашняя собака:
Инактивированный вирус – это мертвый волк:
Искусственный антиген – это лапа от плюшевой игрушки собачки:
Подведем итоги и вернемся к вопросу сочетаемости вакцин
Все вакцины можно разделить на 2 больших блока: живые и инактивированные (неживые).
Живые включают в себя живые, но ослабленные микроорганизмы (бактерии и вирусы). Неживые содержат убитые целые микроорганизмы или их искусственно созданные части.
НЕЖИВЫЕ ВАКЦИНЫ от следующих инфекций:
- Вирусный Гепатит В (Регевак, Вакцина рекомбинантная дрожжевая, Комбиотех)
- Вирусный Гепатит А (Хаврикс, Аваксим, Альгавак)
- Полиомиелит ИПВ (Полимилекс, Полиорикс, Имовакс Полио, в составе комплексных вакцин)
- Грипп (инфлювак, ваксигрип, ультрикс, грипполы, совигрипп).
- Клещевой энцефалит (Энцевир, ФСМЕ-иммун, Клещ-Э-Вак, Энцепур)
- Вирус Папилломы Человека (Гардасил, Церварикс)
- Коклюш, дифтерия, столбняк (в составе комплексных вакцин: АКДС, Бубо-Кокк, Бубо-М, Пентаксим, Тетраксим, Инфанриксы, Адасель)
- Гемофильная инфекция тип b (Акт-хиб, Хиберикс, в составе комплексных вакцин)
- Пневмококк (Превенар 13, Синфлорикс, Пневмо 23, Пневмовакс 23)
- Менингококк (Менактра, Менвео, Менцевакс и другие)
и ЖИВЫЕ ВАКЦИНЫ:
- Вакцина от туберкулеза (БЦЖ, БЦЖ-М)
- Коревая вакцина (моновакцина без фирменного наименования)
- Краснушная вакцина (моновакцина без фирменного наименования)
- Паротитная вакцина (моновакцина без фирменного наименования)
- Корь+Паротит (дивакцина без фирменного наименования)
- Вакцина от кори, краснухи, паротита (Приорикс, MMR-II)
- Оральная Полиомиелитная Вакцина (Бивак полио)
- Вакцина оральная от Ротавируса (Ротатек)
- Вакцина от Ветряной оспа (Варилрикс)
Сочетаемость вакцин
Можно ли проводить вакцинацию препаратами из этих двух списков в один день? Да, можно, причем в любых сочетаниях!
Мнение CDC (Федеральное агентство министерства здравоохранения США):
В России строгое ограничение есть только для БЦЖ, ее делают отдельно, но не из-за того, что она как-то взаимодействует с другими вакцинами, а потому, что есть риск, что по невнимательности медсестра введет ее не внутрикожно, как положено, а подкожно или внутримышечно, перепутав шприц с БЦЖ с другой вакциной. Это приведет к холодному абсцессу (осложнению). И этот риск минимизируют тем, что БЦЖ всегда делают отдельно от других вакцин (по крайней мере в России).
«Вакцину Энцепур можно вводить одновременно со всеми препаратами из национального календаря профилактических прививок в один день, в разные участки тела. Применение вакцины Энцепур совместно с другими прививками не влияет на их иммуногенность (способность выработки иммунитета).
Почти всегда такой запрет связан с тем, что просто не были проведены исследования совместного применения вакцин в той конкретной стране, где в инструкции есть такое указание.
Плохая новость в том, что если медик, который проводит вакцинацию, внимательно читает инструкцию, то для него это основание вам отказать в одномоментном введении вакцин. Если вы планируете сделать прививки от нескольких инфекций в один день, лучше заранее изучите инструкции на предмет такой неприятности.
У людей с ВИЧ и аспленией CDC и IAC не рекомендуют делать в один день Менактру и Превенар13, так как это приводит к снижению иммунного ответа на некоторые антигены пневмококковой вакцины.
Для здоровых людей единого мнения на этот счёт нет, но по возможности желательно разносить эти вакцины на разные приемы.
ИНТЕРВАЛЫ МЕЖДУ ПРИВИВКАМИ, с точки зрения здравого смысла, если НЕ СДЕЛАЛИ В ОДИН ДЕНЬ, то:
Обе вакцины НЕживые = любой интервал
Одна вакцина живая, вторая нет = любой интервал
Обе вакцины живые = Ждать месяц
Исключение:
Если прививаемому показана и 13-валентная и 23-валентная вакцины от пневмококковой инфекции, то они не должны вводиться одновременно, и 13-валентная вакцина должна вводиться первой.
In patients recommended to receive both PCV13 and PPSV23, the 2 vaccines should not be administered simultaneously. PCV13 should be administered first.
Если 23-валентная вакцина была введена первой, то 13-валентная не должна вводиться ранее, чем через 8 недель у лиц в возрасте 6-18 лет, и не ранее, чем через год у лиц 19 лет и старше .
If PPSV23 has been administered first, PCV13 should be administered no earlier than 8 weeks later in children 6-18 years, and one year later in adults 19 years and older.
Однако, с учетом действующего законодательства в России, месяц придется ждать между любыми вакцинами, если они не были сделаны в один день.
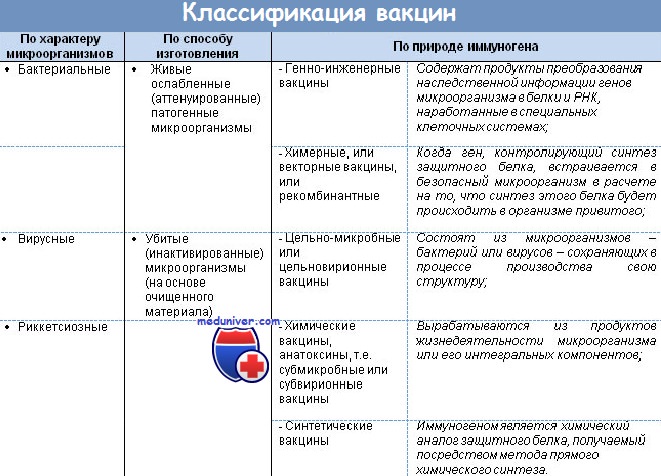
Инактивированные вакцины. Корпускулярные ( цельновирионные ) вакцины. Компонентные ( субъединичные ) вакцины.
В настоящее время также применяют вакцины, изготовленные из убитых микробных тел либо метаболитов, а также из отдельных Аг, полученных биосинтетическим или химическим путём. Вакцины, содержащие убитые микроорганизмы и их структурные компоненты, относят к группе корпускулярных вакцинных препаратов.
Неживые вакцины обычно проявляют меньшую (по сравнению с живыми вакцинами) иммуногенность, что диктует необходимость многократной иммунизации. В то же время неживые вакцины лишены балластных веществ, что значительно уменьшает частоту побочных эффектов, часто развивающихся после иммунизации живыми вакцинами.
Корпускулярные (цельновирионные) вакцины
Для их приготовления вирулентные микроорганизмы убивают либо термической обработкой, либо воздействием химических агентов (например, формалина или ацетона). Подобные вакцины содержат полный набор Аг. Спектр возбудителей, используемых для приготовления неживых вакцин, разнообразен; наибольшее распространение получили бактериальные (например, противочумная) и вирусные (например, антирабическая) вакцины.
Компонентные ( субъединичные ) вакцины
Компонентные (субъединичные) вакцины — разновидность корпускулярных неживых вакцин; они состоят из отдельных (главных, или мажорных) антигенных компонентов, способных обеспечить развитие невосприимчивости. В качестве Аг применяют иммуногенные компоненты возбудителя. Для их выделения используют различные физико-химические методы, поэтому препараты, получаемые из них, также известны как химические вакцины. В настоящее время разработаны субъединичные вакцины против пневмококков (на основе полисахаридов капсул), брюшного тифа (О-, Н- и Vi-Ar), сибирской язвы (полисахариды и полипептиды капсул), гриппа (вирусные нейраминидазы и гемагглютинин). Для придания более высокой иммуногенности компонентные вакцины нередко сочетают с адъювантами (например, сорбируют на гидр оксиде алюминия).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вакцины. Виды антигенов вакцин. Классификация вакцин. Виды вакцин. Живые вакцины. Ослабленные ( аттенуированные ) вакцины. Дивергентные вакцины.
Вакцины — иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю. Вакцинация признана ВОЗ идеальным методом профилактики инфекционных заболеваний человека. Высокая эффективность, простота, возможность широкого охвата вакцинируемых лиц с целью массового предупреждения заболевания вывели активную иммунопрофилактику в большинстве стран мира в разряд государственных приоритетов. Комплекс мероприятий по вакцинации включает отбор лиц, подлежащих вакцинации, выбор вакцинного препарата и определение схемы его использования, а также (при необходимости) контроль эффективности, купирование возможных патологических реакций и осложнений. В качестве Аг в вакцинных препаратах выступают:
• цельные микробные тела (живые или убитые);
• отдельные Аг микроорганизмов (наиболее часто протективные Аг);
• токсины микроорганизмов;
• искусственно созданные Аг микроорганизмов;
• Аг, полученные методами генной инженерии.
Большинство вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
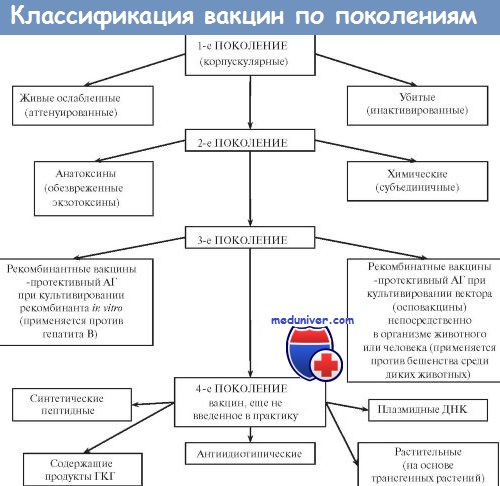
Живые вакцины
Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов.
Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство живых вакцин— полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. Подобные явления более типичны для противовирусных вакцин (например, живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича).
Ослабленные ( аттенуированные ) вакцины
Ослабленные (аттенуированные) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин — противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций.
Дивергентные вакцины
В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вакцины от инфекционного ринотрахеита. Методика вакцинации от ринотрахеита.
В качестве живой вакцины предложен дефектный по тимидинкиназе (ТК-) мутант. Интраназальное и внутримышечное введение вакцины телятам не вызывало развития у них признаков болезни, но способствовало образованию нейтрализующих антител и устойчивости к последующему интраназальному заражению вирулентным штаммом вируса, снижало его репродукцию в слизистой носа. Вакцинный (ТК-) штамм способен персистировать в организме привитых телят не менее 3 мес. и передаваться телятам при контакте без перехода в ТК+ генотип.
Персистенция и экскреция аттенуированного штамма вируса обнаружена также при применении других живых вакцин. Особенно часто и длительно вакцинный штамм вируса выделяется с семенной жидкостью привитых быков. Введение живой вакцины во время астрального периода может сопровождаться поражением яичников, а вакцинация в ранний период стельности — к прерыванию беременности.
При интраназальном введении вакцинный вирус быстро проникает в клетки верхних дыхательных путей и глоточного кольца. Размножаясь в указанных клетках, вирус может выделяться во внешнюю среду в течение двух недель. После парентерального введения вакцинный вирус из секретов выделяется не всегда и с трудом.
Преимущество интраназальной вакцинации состоит в том, что при этом усиливается синтез IgA и локальное образование интерферона. Считается, что сухая вакцина для парентерального или интраназального применения должна содержать соответственно 105 и 104 ТЦД50/мл. Наряду с живыми вакцинами применяют инактивированные, обладающие рядом преимуществ, хотя их изготовление связано с дополнительными затратами. Инактивированные вакцины так же, как и живые, применяют двукратно с 2—3-недельным интервалом. Они могут существовать в виде моно- и комбинированных препаратов. Эффективность инактивированных вакцин против ИРТ зависит от ряда факторов, и прежде всего от концентрации протективных адъювантов.
Различные способы инактивации вируса оказывали неодинаковое влияние на антигенные детерминанты — мишени вируснейтрализующих антител. По степени разрушения антигенных детерминант инактиваторы располагались следующим образом: ультрафиолетовое облучение, нагревание (56°С), пропиолактон и формальдегид. Согласно этим данным последнему должно отдаваться предпочтение при изготовлении инактивированной вакцины. С целью повышения иммуногенности вакцины вирусные антигены концентрировали полиэтиленгликолем.
Инактивированная формолвакцина с масляным адъювантом из вируса ИРТ с исходным титром 10 8 ТЦД50/мл после двукратного введения в дозе 2 мл с 4-недельным интервалом индуцировала у телят выраженный иммунитет независимо от предшествующего иммунного фона. У телят, перенесших спонтанную инфекцию с низким титром сывороточных и отсутствием секреторных антител, после вакцинации формировались гуморальные (1:128 - 1:256) и секреторные (1:2—1:8) антитела. Наблюдалась корреляция между уровнем сывороточных антител и устойчивостью телят к заражению. Иммуносупрессия дексаметазоном показала, что вакцинация серонегативных телят не предупреждала от инфицирования и последующей латенции вируса.
Инактивированные вакцины против ринотрахеита и ПГ-3 оказались эффективными при испытании в производственных условиях. Вакцинальный иммунитет у телят развивался, несмотря на высокий уровень колостральных антител. Иммуногенность субъединичной и инактивированной вакцин с масляным адъювантом оказалась сходной. Титр гуморальных антител у крупного рогатого скота после однократного и двукратного применения субъединичной вакцины был выше, чем при вакцинации инактивированной вакциной. Секреторные антитела формировались лишь после двукратной вакцинации и были равнозначными у животных, привитых обоими препаратами. Через 14 дней после второй прививки телята были устойчивы к интраназальному заражению вирулентным штаммом вируса ИРТ. Интенсивность размножения и продолжительность экскреции вирулентного штамма у животных, вакцинированных обеими вакцинами, были сходными. Иммунизированные телята выделяли меньше вируса и менее продолжительное время, чем непривитые.
Считают, что двукратное введение инактивированной вакцины сообщает привитым животным иммунитет продолжительностью 2 года. Имеется хороший опыт сочетанного применения живой и инактивированной вакцины ИРТ и ФРГ. Живую вакцину вводили двукратно с интервалом в 6 недель сразу после установления диагноза. Спустя 7 мес. двукратно с тем же интервалом вводили инактивированную вакцину. В результате такой вакцинопрофилактики новые случаи заболевания не регистрировали. Спустя четыре года после прекращения вакцинации животные оказались серонегативными, за исключением некоторых телят, имевших материнские антитела перед вакцинацией. Авторы оценивают предложенную схему применения живой и инактивированной вакцины как эффективную для оздоровления поголовья. Комбинированная инактивированная вакцина, включающая высокоактивные антигены вирусов ИРТ, вирусной диареи и парагриппа-3, оказалась эффективным средством профилактики массовых патологических состояний, в том числе связанных с транспортировкой скота.
Испытание иммуногенности маркированной делеционной (gE) вакцины против ГВ-1 КРС на телятах показало, что внутримышечная или назальная иммунизация полностью не защищают от латентного инфицирования вирулентным штаммом гомологичности вируса. Инактивированная маркированная вакцина против ИРТ из негативного по гликопротеину Е штамма позволяла дифференцировать вакцинированных и инфицированных животных. Иммуногенность вакцины зависела от концентрации вирусного антигена.
Таким образом, существующие средства вакцинопрофилактики защищают крупный рогатый скот от инфекционного ринотрахеита, но не от заражения полевым вирусом, установления его латенции и последующей реактивации, реэкскреции. Однако живые вакцины при интраназально-внутримышечном применении обусловливают хороший локальный иммунитет и защиту животных от клинического проявления инфекции. Инактивированные высокоантигенные вакцины после повторного введения также индуцируют локальный иммунитет и предотвращают распространение вируса. Перспективным является разработка высокоэффективных рекомбинантных субъединичных вакцин, основанных главным образом на иммуногенности одного из главных гликопротеинов оболочки вириона, особенно гликопротеина Д. Этот гликопротеин может быть экспрессирован в бакуловирусной системе или включен в геном векторного вируса и использован в качестве живой вакцины.
Многие европейские страны для искоренения болезни используют интегрированную программу, включающую иммунизацию маркированными вакцинами, выявление и убой всех животных, имеющих антитела на полевой вирус.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Используя один и тот же плазмидный или вирусный вектор, можно создавать вакцины против различных инфекционных заболеваний, меняя только последовательность, кодирующую необходимые белки-антигены. При этом отпадает необходимость работать с опасными вирусами и бактериями, становится ненужной сложная и дорогостоящая процедура очистки белков. Препараты ДНК-вакцин не требуют специальных условий хранения и доставки, они стабильны длительное время при комнатной температуре.
Уже разработаны и испытываются ДНК-вакцины против инфекций, вызываемых вирусами гепатитов B и C, гриппа, лимфоцитарного хориоменингита, бешенства, иммунодефицита человека (ВИЧ), японского энцефалита, а также возбудителями сальмонеллеза, туберкулеза и некоторых паразитарных заболеваний (лейшманиоз, малярия). Эти инфекции крайне опасны для человечества, а попытки создать против них надежные вакцинные препараты классическими методами оказались безуспешными.
ДНК-вакцинация — одно из самых перспективных направлений в борьбе с раком. В опухоль можно вводить разные гены: те, что кодируют раковые антигены, гены цитокинов и иммуномодуляторов.
Проведя компьютерный (in silico) анализ генома, исследователь получает не только список кодируемых белков, но и некоторые их характеристики, например, принадлежность к определенным группам, возможная локализация внутри бактериальной клетки, связь с мембраной, антигенные свойства.
Третий подход основан на протеомной технологии. Ее методы дают возможность детализировать количественную и качественную характеристики белков в компонентах клетки. Существуют компьютерные программы, которые по аминокислотной последовательности могут предсказать не только трехмерную структуру изучаемого белка, но и его свойства и функции.
Используя эти три метода, можно отобрать набор белков и соответствующие им гены, которые представляют интерес для создания вакцины. Как правило, в эту группу входит около 20-30% всех генов бактериального генома. Для дальнейшей проверки нужно синтезировать и очистить отобранный антиген в количествах, необходимых для иммунизации животных. Очистку белка проводят с помощью полностью автоматизированных приборов. Используя современные технологии, лаборатория, состоящая из трех исследователей, может в течение месяца выделить и очистить более 100 белков.
Важно не только создать вакцину, но и найти наилучший способ ее доставки в организм. Сейчас появились так называемые мукозальные вакцины, которые вводятся через слизистые оболочки рта или носа либо через кожу. Преимущество таких препаратов в том, что вакцина поступает через входные ворота инфекции и тем самым стимулирует местный иммунитет в тех органах, которые первыми подвергаются атаке микроорганизмов.
Терапевтические вакцины
Существующие терапевтические вакцины для лечения хронических воспалительных заболеваний, вызванных бактериями или вирусами, получают классическими методами. Такие вакцины способствуют развитию иммунитета к входящим в их состав микроорганизмам и активизируют врожденный иммунитет.

Одна из важнейших целей разработчиков терапевтических вакцин — ВИЧ-инфекция. Уже проведена серия доклинических и клинических испытаний нескольких препаратов. Их способность вызывать развитие клеточного иммунитета у здоровых людей не вызывает сомнений. Однако убедительных данных о том, что вакцины подавляют размножение вируса у больных, пока нет.
Схема изготовления дендритной вакцины такова: из крови больного выделяют клетки, которые дают начало дендритным клеткам, и размножают их в лабораторных условиях. Одновременно из опухоли пациента выделяют белки-антигены. Дендритные клетки некоторое время выдерживают вместе с опухолевыми антигенами, чтобы они запомнили образ врага, а затем вводят больному. Такая стимуляция иммунной системы заставляет организм активно бороться с опухолью.
У мышей дендритные вакцины помогают предупредить повторное развитие карциномы после удаления опухоли. Это позволяет надеяться, что они будут эффективны для продления безрецидивного периода онкологических больных после хирургического вмешательства.
Читайте также:

