Индикация вирусов из воды
Обновлено: 24.04.2024
Лабораторные исследованияпри проведении идентификации вирусов и диагностике вирусных инфекций включают следующие этапы: выделение, культивирование, индикация (выявление) и идентификация вирусов.
2.3.1 Культивирование вирусов
Вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы. Окончательное решение проблемы культивирования вирусов оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Использование куриных эмбрионов. Куриные эмбрионы – практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание).
Для заражения обычно используют куриные эмбрионы 7–12-дневного возраста. Перед заражением определяют жизнеспособность эмбриона путем овоскопирования (просматривают в проходящем свете). Живые эмбрионы при овоскопировании проявляют двигательную активность, хорошо виден сосудистый рисунок. Простым карандашом очерчивают границы воздушной камеры.
Куриные эмбрионы заражают вируссодержащим материалом в асептических условиях стерильными инструментами, предварительно обработав скорлупу над воздушным пространством йодом и спиртом. Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость, либо в желточный мешок (рисунок 29). Выбор метода заражения зависит от биологических свойств вируса.
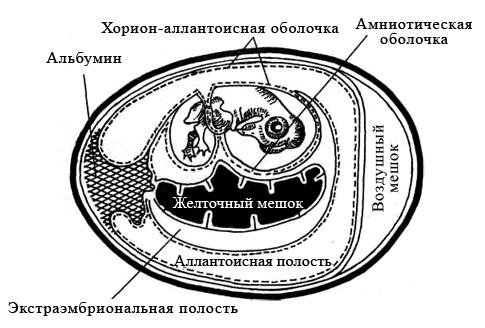
Рисунок 29 – Схематическое изображение развивающегося куриного эмбриона
Культура клеток. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться.
Для получения культур клеток необходимо было решить четыре главных задачи:
– получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
– создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
– обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
– определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Для выделения изолированных (разобщенных), но жизнеспособных клеток из разрушенных тканей, стали использовать обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и другие), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток стали обрабатывать антибиотиками.
В 1949 г. Дж. Эндерс, Т. Веллер и Ф. Роббинс показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток (клеточные линии характеризуются бессмертием и гетероплоидным кариотипом) получают из опухолевых тканей (HeLa получена из карциномы шейки матки, НЕр-2 – из карциномы гортани; Детройт-6 – из метастаза рака легкого в костный мозг; RН – из опухоли почки человека) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток.

Полуперевиваемые (диплоидные) культуры клеток – клетки одного генотипа, способные in vitro выдерживать 50–100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
2.3.2 Выделение вирусов
Выделение вирусов в культурах клеток. При выделении вирусов из различных инфекционных материалов (кровь, моча, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающих наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,1–0,2 мл взвеси исследуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 30-60 мин контакта вируса с монослоем клеток удаляют избыток материала, в культуру вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Выделение вирусов на лабораторных животных. При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Таким образом, для выделения чистых культур вирусов в лабораторных условиях в настоящее время используются следующие живые объекты (биологические модели): 1) культура клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
2.3.3 Индикация вирусов
Индикация вирусов в культурах клеток. Индикатором наличия вируса в зараженных культурах клеток может служить:
1) развитие специфической дегенерации клеток – цитопатическое действие вируса (ЦПД), имеющее три основных типа: крупно- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток (гроздевидная дегенерация клеток).
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы.
Цитопатические эффектыоценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью:
2) обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
3) положительная реакция гемагглютинации (РГА) или гемадсорбции (РГАдс). Некоторые вирусы, в частности, вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей);
4) феномен бляшкообразования. Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов. Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при 37 °С. Через 48–96 ч выявляются пятна – бляшки. Они имеют диаметр 1–3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса;
5) цветная реакция Солка. О росте вирусов в клетках можно судить с помощью индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый;
6) реакция интерференции (используется при отсутствии ЦПД, гемагглютинации и гемадсорбции): исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительна). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции.
Индикация вирусов на лабораторных животных. Индикация вируса основана на обнаружении у животных признаков инфекционного заболевания, регистрации их гибели, изучении характера патоморфологических и патогистологических изменений в тканях и органах, выявлении положительной реакции гемагглютинации.
2.3.4 Методы идентификации вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1–2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
5) нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Вопросы для самоконтроля
1 Назовите основные принципы классификации вирусов.
2 Приведите русские и латинские названия основных семейств вирусов человека и животных.
3 Назовите типовых представителей основных семейств вирусов и заболевания, вызываемые ими.
4 Каковы особенности морфологии и ультраструктуры вирусов человека и животных (основных семейств)?
5 Назовите РНК-геномные и ДНК-геномные фитовирусы.
6 Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
7 Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
8 Как происходит заражение куриных эмбрионов в лабораторных условиях?
9 Какие методы получения культуры клеток вы знаете?
10 Как проводят идентификацию вирусов в курином эмбрионе и на лабораторных животных?
11 Какие существуют методы индикации вирусов на культуре клеток?
12 В чем заключается назначение и сущность реакций нейтрализации вирусов?
До последнего времени при текущем санитарном надзоре за эпидемическим благополучием питьевой воды, воды открытых водоемов и сточных вод о возможном присутствии в них кишечных вирусов судили по косвенному показателю — наличию кишечной палочки. Однако, если последняя не без основания считается достаточно надежным санитарным показателем для группы патогенных кишечных бактерий, то в отношении энтеровирусов и этиологического агента эпидемического гепатита ее санитарно-показательное значение ставится под сомнение из-за более низкой устойчивости ее к воздействию неблагоприятных факторов окружающей среды по сравнению с большинством кишечных вирусов. Это подтверждают данные как ряда зарубежных авторов, так и исследования, проведенные отечественными специалистами в ряде городов страны (Е. Л. Ловцевич, 1963; Л. В. Григорьева, 1968; Г. А. Багдасарьян, Е. Л. Ловцевич, 1972; Clarke е. а., 1964; Чанг, 1969, и др.). Таким образом, эпидемическую безопасность воды в отношении возбудителей кишечных вирусных инфекций необходимо обосновывать результатами непосредственного исследования на присутствие вирусов.
Следует отметить, что до настоящего времени отсутствуют унифицированные методы обнаружения кишечных вирусов в воде. В связи с тем что наибольшие концентрации вирусов кишечной группы содержатся в сточных водах, первые методические исследования по обнаружению энтеровирусов относились именно к этому объекту окружающей среды.
Первые попытки обнаружения энтеровирусов в воде проводились с использованием обезьян, которым внутрибрюшинно вводили большие объемы исследуемой воды (до 200 мл), предварительно обработанной эфиром. Естественно, что такие исследования были единичными и лишь в отдельных случаях удавалось таким образом выделить вирус полиомиелита из внешней среды (Paul, Trask, 1939; Melnick, 1946).
Большая заслуга в деле разработки методов индикации вирусов кишечной группы в воде принадлежит Kelly. Ею начиная с 1952 г. систематически проводились санитарно-вирусологические исследования сточных вод (1953, 1957).
На протяжении 1940—1960 гг. происходило постепенное усложнение методов индикации энтеровирусов в воде, что способствовало увеличению количества положительных находок вирусов вначале в сточной воде, а затем и в более чистых водах. В указанный период усовершенствование методов индикации в основном развивалось по линии включения таких этапов, как первичное концентрирование энтеровирусов в пробе и использование для их выделения не только восприимчивых животных (обезьяны, новорожденные мыши), но и чувствительных первичных и перевиваемых клеточных линий.
развитии санитарно-вирусологических исследований и, в частности, в разработке чувствительных методов индикации в воде большую роль сыграли два фактора: 1) развитие методики однослойных тканевых культур, позволившее неизмеримо расширить объем проводимых исследований и отказаться от дорогостоящих лабораторных животных, и 2) разработка тампонного метода отбора проб (Moore, 1948),
В последующие годы арсенал методов, применяемых для выделения кишечных вирусов из сточных вод, а впоследствии — из воды открытых водоемов, был значительно расширен. В связи с этим если первым исследователям удавалось лишь в единичных случаях выделять вирус полиомиелита во время эпидемических вспышек, то с усовершенствованием методов выделения и концентрирования вирусов в пробах, кроме вируса полиомиелита, удавалось изолировать и вирусы группы ECHO, а также Коксаки А и В, причем их удавалось выделять довольно систематически из сточных вод и изредка из воды открытых водоемов и во внеэпидемический период.
В санитарно-вирусологических исследованиях в настоящее время применяются такие методы концентрирования вирусов, как адсорбция на марлевых тампонах и на ионообменных смолах с последующей элю- Цией, ультрацентрифугирование, ультрафильтрация, диализ и др.
Для определения вирусов кишечной группы в сточных водах наиболее широко используется отбор проб тампонпым методом по Моору с последующей обра- боткой по Риордану (Riordan, 1962). Тампоны помещают в ток сточных вод летом на 3 сут, в зимний период - на 7 сут. Место отбора пробы зависит от целей
исследования: при изучении спектра кишечных вирусов в сточных водах тампон помещают в ток сточных вод, поступающих на очистные сооружения; при изучении эффективности очистки сточных вод от кишечных вирусов на отдельных этапах очистных сооружений или на всей станции в целом отбор проб производится также после соответствующих этапов очистки и па выходе очищенной сточной воды с очистных сооружений. Обработка отжима из тампона по методу Риордана заключается в элюции энтеровирусов с образующейся на тампоне биологической пленки путем изменения pH среды на щелочную с последующим повторным центрифугированием при 2500 об/мин и обработкой эфиром и антибиотиками.
Нами разработана модификация этого метода, заключающаяся в использовании при выделении из обработанных проб вирусов метода бляшек под полужидким агаровым покрытием. Это позволило не только получить данные о наличии вирусов в сточных водах, но и разделять их в смеси в пробах сточных вод, а главное — дало возможность судить об их концентрации в пробе (по количеству БОЕ в 1 мл).
С использованием указанного метода было проведено изучение распространения энтеровирусов в сточных водах, показавшее достаточную его эффективность: процент выделения кишечных вирусов из просточной воды на очистных сооружениях Москвы и Московской области составлял 85,3. Сопоставление полученных данных о циркуляции энтеровирусов в сточных водах с результатами одновременного вирусологического обследования (методом фекальных проб) нескольких детских коллективов показало преимущества метода обследования сточных вод перед индивидуальным обследованием населения. Этот метод позволяет следить за циркуляцией кишечных вирусов в больших коллективах, районах города или отдельных населенных пунктах и осуществлять длительные санитарно-вирусологические наблюдения.
Наиболее совершенным методом концентрирования вирусов вообще и энтеровирусов в частности в настоящее время является ультрацентрифугирование.
Gravell и Chin (1961) провели санитарно-вирусологическое исследование сточных вод с целью выделения вирусов с использованием различных методов концентрации вирусосодержащего материала. Сравнение полученных результатов показало преимущество метода, ультрацеитрифугирования. При помощи этого метода энтеровирусы были выделены из 94% проб сточных вод, а при использовании ионообменных смол - в 55% проб.
Высокая чувствительность метода ультрацентри- фугирования была также подтверждена Lamb с соавт.
(1964) : кишечные вирусы были ими выделены из 80% проб сточных зод и из 38% проб речной воды, отобранных ниже очистных сооружений. К сожалению, метод ультрацентрифугирования из-за своей технической сложности доступен лишь крупным научно-исследовательским и практическим учреждениям и поэтому сравнительно редко используется в практике для концентрирования энтеровирусов.
Для выделения энтеровирусов из воды открытых водоемов нами были разработаны два метода индикации: метод вращающегося тампона и сорбция на пене (Г. А. Багдасарьян, В. Ф. Жевержеева, 1967).
Принцип метода вращающегося тампона заключается в концентрировании энтеровирусов из большого объема первичной пробы воды (3—5 л) при помощи тампона в лабораторных условиях. Длительность контакта тампона с пробой воды при постоянном перемешивании составляет 30—40 мин. В течение этого времени происходит адсорбция энтеровирусов на тампоне, чему способствует предварительное нанесение на него сывороточных белков. Последующая обработка тампона производится по методу Риордана в нашей модификации, которая способствует более полному выделению энтеровирусов и обеспечивает активное освобождение пробы воды от сопутствующей бактериальной микрофлоры. Повышение титра вируса полиомиелита при использовании метода вращающегося тампона составляло 1,0—1,4 1 g. Метод вращающегося тампона был апробирован в естественных условиях при санитарно-вирусологическом обследовании воды реки Москвы и ее верхнего бассейна и оказался весьма эффективным: процент выделения кишечных вирусов из проб речной воды составлял 34,1.
Перспективным для выделения вирусов из воды открытых водоемов является также концентрирование их в пробе воды с помощью разработанного нами метода пенной флотации. Принцип метода заключается в сорбции вирусов пеной, которая образуется при добавлении в пробу воды пенообразователя (нативная бычья сыворотка) и продувании через нее воздуха.
Процесс отделения пены из исследуемой пробы длится 2—3 мин. Объем жидкости, образующейся после распада пены (в которой происходит концентрирование вирусов), составляет 4—6% объема исследуемой пробы воды. Повышение титра вируса полиомиелита при использовании метода пенной флотации составляет 1,5—2 lg. Этот метод был апробирован в естественных условиях при санитарно-вирусологическом изучении воды открытых водоемов и оказался весьма эффективным. Он также был использован за рубежом для концентрирования вируса ящура в биологических средах (Morrow, 1969) и также получил положительную оценку.
В ряде работ последних лет широко используются для концентрирования кишечных вирусов такие методы, как повторное замораживание и оттаивание, уль- трафильтрация, адсорбция на полиэлектролитах (Fo- liguet, 1973; Rubcnstein е. а., 1973; Belfor с. а., 1974). Sobsey и соавт. (1973) рекомендуют проводить концентрирование энтеровирусов из больших объемов воды с. использованием стекловолокна и нитроцеллюлозных фильтров; с помощью этого метода удается выделить до 77% от общего числа внесенных вирусных частиц. Немалый интерес представляет работа Buras (1973), которому удалось без всякого концентрирования выделить кишечные вирусы из сточной воды.
Для концентрирования энтеровирусов из слабоза- грязненных вод в последние годы довольно широко применяются ионообменные смолы. Последние представляют собой неорганические или органические высокомолекулярные вещества, содержащие активные группы с легкообменивающимися ионами. Широкое применение в лабораторной практике в последние годы нашли синтетические высокомолекулярные иониты.
Известно, что многие вирусы, в том числе вирус полиомиелита и другие энтеровирусы, являются отрицательно заряженными частицами. На этом их свойстве основано использование для адсорбции этих вирусов сильноосновных анионитов.
Заслуга в широком внедрении в санитарно-вирусологическую практику ионообменных смол принадлежит Kelly. По ее данным, наиболее эффективным для адсорбции энтеровирусов является анионит Do- wex-1. Адсорбцию энтеровирусов первоначально проводили в статических условиях. В дальнейшем этот метод был модифицирован рядом исследователей: пробу воды фильтровали через колонку, наполненную ионообменной смолой, чем достигалась более полная адсорбция энтеровирусов на смоле и исключалась необходимость в повторном центрифугировании осадка.
Этот метод был успешно применен в исследованиях Coin с соавт. (1964), Nestor (1964), Francovа
(1965) для выделения вирусов из поверхностных и сточных вод. Отбор проб производили при помощи марлевых тампонов. Отжим из тампона фильтровали и пропускали через колонку е ионитом Dowex-1. Вирусы со смолы элюировали 10% раствором двузамещенного фосфата калия.
В последнее время для концентрирования энтеровирусов успешно используются и отечественные марки ионообменных смол. По данным Е. Л. Ловцевич
(1966) , значительная концентрация энтеровирусов в пробах воды достигается при применении ионообменной смолы АВ-17. Автор рекомендует пропускать через колонку с анионитом не отжим из тампона, а исследуемую пробу воды в объеме 3—5 л, что позволяет проводить санитарно-вирусологические исследования при одноразовом отборе воды. Л. В. Григорьева
(1968) для концентрирования вирусов в пробах сточной воды и почвы рекомендует использовать анионит ЭДЭ-10П. Исследования, проведенные В. Ф. Локтевой (1970), показали эффективность отечественной ионообменной смолы АВ-117 для индикации вирусов кишечной группы. Для концентрирования вирусов могут быть использованы и естественные сорбенты (В. ГГ. Широбоков, 1974, и др.).
Концентрирование вирусов может производиться также методом ультрафильтрации. Принцип этого ме-
тода заключается в концентрировании энтеровирусов из больших объемов воды (1—3 л) на фильтры с малым размером пор. Предварительно воду фильтруют через стеклянный или крупнопористый мембранный фильтр для удаления взвешенных частиц и частичнобактериальной микрофлоры. Для ультрафильтрации могут быть использованы специальные промышленные фильтры миллипор или лантановые фильтры, которые приготавливаются непосредственно перед их использованием (Ю. В. Первиков и др., 1973; Wallis, Melnick, 1967; Berg e. a„ 1968; Chang e. a„ 1968, и др.). Вирусы, осевшие на фильтре миллипор, отмывают небольшим объемом щелочного буфера. Лантановые фильтры растворяют в небольшом объеме слабокислой среды. При использовании ультрафильтрации достигается концентрирование вирусов порядка 1-2 lg.
Недостатками метода ультрафильтрации являются следующие: 1) неполная элюция вирусов с фильтров миллипор в результате частичной адсорбции их в теле фильтра; 2) крайняя непрочность лантановых фильтров; 3) быстрое засорение фильтров, несмотря па предварительную очистку воды от взвешенных частиц.
При исследовании водопроводной воды концентрирование вирусов рационально проводить из большого объема пробы. Coulon и Netter (1967) в обзорной статье приводят модификацию тампонного метода, разработанную Coin применительно к индикации кишечных вирусов в питьевой воде. Авторы пропускали струю воды из водопроводного крана через длинный марлевый тампон (1 м), помещенный в поливиниловый цилиндр. Скорость тока воды составляла примерно 0,5 л/мин, экспозиция — 24 ч (общий объем воды, пропущенной через тампон, составлял, таким образом, около 700 л). Отечественными авторами (А. М. Ошерович, Г. С. Часовникова, 1968) для выделения энтеровирусов из водопроводной воды был использован метод концентрирования на ионообменных смолах: воду из водопроводного крана пропускали в течение 6—12 ч через колонку с сильноосновным анионитом AB-17.
Приведенные данные свидетельствуют о большом разнообразии методических приемов, используемых в последние годы отечественными и зарубежными авто-
рами для выделения кишечных вирусов из воды. На основании^результатов лабораторных и натурных исследований нами разработаны принципы выбора методических приемов для индикации кишечных вирусов в водах различной степени загрязнения (сточные воды, вода открытых водоемов, питьевая вода) и разработана схема санитарно-вирусологических исследований воды.
Исходя из предложенных методических подходов рекомендуется применение следующих методов выделения кишечных вирусов из воды в зависимости от степени ее загрязнения:
— для индикации кишечных вирусов в воде открытых водоемов могут быть рекомендованы метод концентрирования на марлевом тампоне, метод вращающегося тампона, методы сорбции на ионообменных смолах и пенной флотации;
для выделения вирусов из питьевой воды перспективным является использование тампопного метода и метода сорбции на ионообменных смолах в модификациях, которые дают возможность концентрировать вирусы из большого объема пробы (10—15 л).
Разработанные методы индикации и принципы санитарно-вирусологических исследований воды нашли свое отражение в методических указаниях по обнаружению кишечных и респираторных вирусов в объектах внешней среды, изданных Министерством здравоохранения РСФСР в 1969 г., а также в инструктивных указаниях по обнаружению в воде возбудителей кишечных инфекций бактериальной и вирусной природы Министерством здравоохранения СССР в 1974 г.
Концентрация населения в больших городах, развитие промышленности и рост промышленных объектов приводят к нарастанию биологического загрязнения окружающей среды, сточных вод, открытых водоемов, почвы, а также в несколько меньшей степени подземных водоисточников и атмосферного Воздуха. Тем самым создаются условия для выживаемости и циркуляции вирусов в объектах окружающей среды. Поскольку сохранение жизнеспособности вируса в воде, почве, воздухе, пищевых продуктах является одним из основных факторов, способствующих распространению инфекций в восприимчивых коллективах, возникла необходимость изучения патогенных для человека вирусов в объектах внешней среды. Этим занимается санитарная вирусология.
Предметом санитарной вирусологии является изучение поведения различных патогенных для человека вирусов в объектах окружающей среды (вода, почва, воздух, пищевые продукты и др.), разработка методов их индикации и эффективных мероприятий по санации объектов окружающей среды.
Задачей санитарно-вирусологической службы является систематическое санитарно-вирусологическое обследование сточных вод на городских очистных сооружениях, воды открытых водоемов, используемой для питьевого и хозяйственного водоснабжения, питьевой воды источников централизованного водоснабжения, почвы земледельческих полей орошения, воздуха больничных и поликлинических учреждений, продуктов питания и т. д. Эти исследования позволяют контролировать циркуляцию патогенных для человека вирусов в окружающей среде.
Индикация вирусов в окружающей среде состоит из нескольких этапов: 1) концентрация вирусных агентов из окружающей среды; 2) транспортировка проб в лабораторию; 3) выделение вирусов в культурах клеток, на лабораторных животных или куриных эмбрионах; 4) идентификация выделенных агентов. Транспортировка, выделение вирусов и их идентификация осуществляются с помощью общепринятых вирусологических методов, и специфической для санитарной вирусологии проблемой является лишь концентрация вирусов из окружающей среды, потребовавшая разработки специальных методических приемов.
САНИТАРНАЯ ВИРУСОЛОГИЯ ВОДЫ
Основной причиной наличия в воде патогенных для человека вирусов является загрязнение ее фекалиями человека.
В фекалиях человека обнаруживаются более 100 различных вирусов, некоторые из них, принадлежащие к семейству пикорнавирусов, аденовирусов и реовирусов, обладают термостабильностью и долгое время могут сохранять жизнеспособность, многие из них устойчивы к обычным дезинфектантам, включая хлорирование, и могут быть обнаружены в сточных водах на далеком расстоянии от источника контаминации.
В воде при контаминации ее человеческими фекалиями обнаруживаются те же вирусы, что в фекалиях (табл. 20).
Наибольшее выделение кишечных вирусов происходит летом и осенью в связи с увеличением количества кишечных заболеваний. Однако вспышки гастроэнтеритов, вызванных ротавирусами, встречаются обычно зимой и ранней весной. Массивное выделение энтеровирусов из кишечника больных людей и здоровых вирусоносителей вызывает значительное обсеменение вирусами сточных вод, а устойчивость их к неблагоприятным факторам внешней среды обусловливает длительное выживание в воде. Таким образом, сточные воды являются основным резервуаром энтеровирусов во внешней среде.
Присутствие энтеровирусов в воде централизованного водопровода представляет эпидемическую опасность в отношении полиомиелита и других энтеровирусных инфекций, гастроэнтеритов, гепатита А и может привести как к спорадическим случаям, так и вспышке этих инфекций.

Длительность сохранения вирусов в воде. Вирусы обнаруживаются в концентрации 1 млн. на 1 г. Время переживания некоторых вирусов в воде достигает нескольких месяцев.
Длительность сохранения в воде вирусов значительно повышается при понижении температуры. Так, вирус полиомиелита выживает в речной и водопроводной воде при температуре 4° С 90 дней, а при температуре 37 и 20° С соответственно 10 и около 40 дней. Чем выше исходная концентрация вируса, тем более длительное время он обнаруживается в воде. Сроки выживания колеблются для разных вирусов. Наиболее длительно в воде выживают вирусы Коксаки группы А, менее длительно — вирусы полиомиелита, наиболее короткие сроки выжива емости — для вирусов Коксаки группы В (30—50 дней)> Вирусы ECHO 7 более длительно выживают в воде, чем вирусы полиомиелита. Аденовирусы более устойчивы, чем вирусы полиомиелита и ECHO. Аденовирусы некоторых серотипов сохраняли свою активность в воде при температуре 4° С в течение 2 лет и более. К неблагоприятным факторам внешней среды наиболее устойчив из группы энтеровирусов вирус гепатита" А. Вирус способен к длительному выживанию в воде в течение нескольких недель и даже месяцев. Известны водные вспышки гепатитаА,например, распространение инфекции через сырую колодезную воду. Выживаемость вирусов более продолжительна в загрязненных водах. В морской воде сроки выживаемости более короткие в связи с повышенным содержанием солей и наличием йода, обладающего вирулицид-ным действием. Возможное вирулицидное действие оказывают находящиеся в морской воде микроорганизмы и растворенные химические вещества.
Из всех микроорганизмов в экспериментальных условиях наиболее длительной выживаемостью в воде различной степени загрязненности обладает фаг кишечной палочки (более 10 мес). Он является возможным кандидатом в санитарно-показательные микроорганизмы.
Методы концентрации кишечных вирусов, находящихся в воде. Исследованию подлежит вода централизованного водоснабжения, колодцев, открытых водоемов, плавательных бассейнов, сточные жидкости. Исследование сточных вод проводят с целью изучения циркуляции вирусов среди населения данной местности, степени инфицирования воды, эффективности работы очистных сооружений и т. п. Исследование воды поверхностных и подземных водоемов проводят при выборе источника для централизованного водоснабжения, для оценки санитарного состояния мест отдыха, по эпидемиологическим показаниям. Исследования питьевой воды проводят только по эпидемиологическим показаниям.
Методы концентрации вирусов из воды можно условно разделить на 4 группы.
I. Физические методы (ультрацентрифугирование, ультрафильтрация, пенная флотация и др.).
II. Физико-химические методы (преципитация этиловым спиртом, сульфатом аммония, сульфатом алюминия, двухвалентными катионами, преципитация в изо-электрической точке вирусного белка, концентрация полиэтиленгликолем).
III. Адсорбционные методы (адсорбция на марлевом тампоне, природных минеральных сорбентах — бентоните и других ионообменных смолах).
IV. Биологические методы (адсорбция на дрожжевых клетках и других микроорганизмах).
Наиболее надежным методом концентрации вирусов является метод ультрацентрифугирования, однако этот метод не всегда доступен для вирусологических лабораторий. Чаще применяют методы ультрафильтрации, методы концентрации вирусов с помощью полиэтиленгли-коля и адсорбционные методы — адсорбцию на марлевом тампоне и ионообменных смолах. Эти методы отличаются простотой, скоростью и достаточной эффективностью.
Для выделения вируса заражают культуру клеток или лабораторных животных (мышей-сосунков). Питьевая вода, безопасная в отношении вирусных инфекций, должна содержать менее одной вирусной частицы в 1 л. Однако эти требования не распространяются на вирус гепатита А и ротавирусы, которые могут быть обнаружены только с помощью малодоступных для вирусологических лабораторий методов.
Для выявления (индикации) вирусов применяются следующие методы.
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла.
Частичная дегенерация культур клеток может протекать по следующим типам:
- гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
- очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
- симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).


А б
Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса) х 200
Индикация вирусов с помощью реакции гемадсорбции (РГад).
Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 4 0 , 20 0 или 37 0 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе.
Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям.
Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому - Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
Индикация вирусов с помощью прямой РИФ – выявлениевирусных антигенов, находящихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ) применяется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).

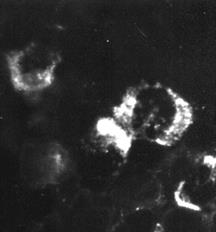
Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х 900
Индикация вирусов по образованию бляшек - очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большинства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Индикация вирусов в куриных эмбрионах.
Зараженные РКЭ инкубируют в термостате при 35- 37 0 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри. При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки - беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов - поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
Гемагглютинационный титр (максимальное разведение вирусосодержащей жидкости, вызывающее агглютинацию эритроцитов - одна гемагглютинирующая единица вируса,1 ГЕ) соответствует концентрации вируса. Агглютинацию эритроцитов могут вызывать также некоторые бактерии (стафилококки, эшерихии, сальмонеллы, шигеллы, холерный вибрион Эль-Тор), что необходимо учитывать при трактовке результатов РГА при исследовании вирус-содержащего материала, загрязненного бактериальной микрофлорой.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке.Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 24-72 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.
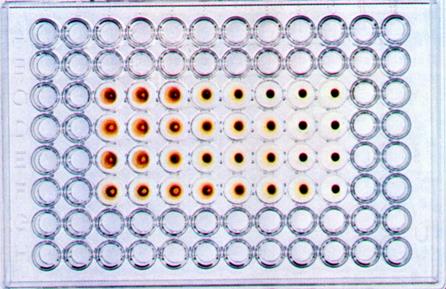
Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животных находится в зависимости от вируса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
Идентификация вирусов проводится с помощью следующих методов .
Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
Изучение антигенных свойств вирусов в серологических реакциях с противовирусными сыворотками является основным методом идентификации вирусов. Для этого используют ряд иммунологических реакций.
Реакция нейтрализации основана на способности антител нейтрализовать инфекционную активность вирусов в культурах ткани, РКЭ, чувствительных лабораторных животных. Из вирус-содержащего материала готовят десятикратные разведения и добавляют к ним специфическую сыворотку в разведении в соответствии с титром, указанным на этикетке ампулы. Смеси вирус-сыворотка инкубируют 30 — 60 мин при 37 °С для обеспечения связывания антигенов с антителами, после чего смесью заражают культуру ткани, куриные эмбрионы или лабораторных животных. Контролем является чувствительная биосистема, зараженная вирусом без сыворотки.
Реакция считается положительной в случае нейтрализации ЦПД в культуре клеток, а также при отсутствии патологических изменений в куриных эмбрионах или в организме животных. По результатам РН высчитывается индекс нейтрализации (ИН - отношение титра вируса в контроле к титру вируса в опыте). При ИН менее 10 реакция расценивается как отрицательная, от 11 до 49 — сомнительная, от 50 и выше — положительная.
РН может быть поставлена в наиболее чувствительном варианте - подавления вирусного бляшкообразования под действием вирусспецифической антисыворотки. Для этого к вирус-содержащему материалу добавляют соответствующую искомому вирусу антисыворотку и после инкубации в термостате при 37 0 С течение 30-60 мин смесь вносят в культуру чувствительных клеток. Бляшкообразование выявляют в слое агара или бентонита. Идентичность вируса антителам сыворотки проявляется подавлением бляшкообразования.
Другим вариантом РН является цветная проба. Положительный результат пробы в случае соответствия вируса противовирусным антителам проявляется блокадой репродукции вируса, клетка при этом остается жизнеспособной, вырабатывая кислые продукты метаболизма, под влиянием которых цвет индикатора (фенолового красного) меняется с красного на желтый. Для постановки пробы в пробирки вносят по 0,25 мл рабочего разведения вируса и соответствующую антисыворотку.
Смесь выдерживают при комнатной температуре 30-60 мин, добавляют в каждую пробирку по 0,25 мл клеточной суспензии и закрывают их резиновыми пробками. Пробирки инкубируют в термостате при 37 0 С 6-8 дней, результаты реакции учитывают по изменению цвета индикатора (красный цвет индикатора соответствует щелочному характеру рН - 7,4 указывая на репродукцию вируса и подавление метаболизма клеток; желтый цвет свидетельствует о кислом рН - ниже 7,2 в результате нейтрализации вируса антителами и активном метаболизме клеток с выработкой кислых продуктов обмена).
Перед постановкой РТГА сыворотки обрабатывают периодатом калия, каолином, бентонитом, ацетоном или другими веществами для удаления неспецифических ингибиторов гемагглютинации. После этого к двукратным разведениям сыворотки добавляют равное количество вируссодержащей жидкости с активностью 4 ГЕ, смесь инкубируют 30-60 мин при оптимальной для данного вируса температуре (4 0 , 20 0 , 37 0 С), а затем добавляют равный объем 0,5-1,0% взвеси эритроцитов. Смесь снова инкубируют 30-45 мин и производят учет результатов реакции. Титром сыворотки считают ее наибольшее разведение, которое вызывает торможение гемагглютинации.
Реакция торможения гемадсорбции (РТГадс) основана на нейтрализации эффекта адсорбции эритроцитов на поверхности клеток, инфицированных вирусами, способными вызывать гемадсорбцию. Для постановки реакции по 0,2 мл специфической сыворотки, разведенной 1:5, вносят в пробирки, инкубируют 30-60 мин в термостате при оптимальной для данного вируса температуре, затем добавляют по 0,2 мл 0,5% взвеси эритроцитов. Контрольные пробы содержат неиммунную сыворотку и эритроциты. Пробирки снова инкубируют 20-30 мин, после чего производят учет реакции. Идентификация вируса основывается на признаке отсутствия адсорбции эритроцитов на клетках в присутствии иммунной сыворотки при наличии гемадсорбции в контрольных пробирках.
Для антигенной идентификации вирусов в клетках культур тканей используются также РПГ, РСК, РИФ, РОПГА ИФА, РИА со специфическими иммунными противовирусными сыворотками или моноклональными AT.
- выявление вирусной НК методами генодиагностики с помощью метода молекулярной гибридизации и ПЦР;
- электронно-микроскопическое изучение вирусов (см. выше).
Определение колиформных бактерий. Общие колиформные бактерии — это Гр- аспорогенные палочки, не обладающие оксидазной активностью и сбраживающие лактозу с образованием кислоты и газа. Их обнаружение свидетельствует о свежем фекальном загрязнении воды.
Общие колиформные бактерии должны отсутствовать в 100 мл. воды.
№ 167 Микрофлора почвы. Факторы, влияющие на количественный и видовой составы микробов почвы.
Состав микрофлоры почвы зависит от ее типа и состояния, состава растительности, температуры, влажности. В почве живут азотфиксирующие бактерии, способные усваивать молекулярный азот (Azotobacter,, Mycobacterium.). Почва является местом обитания спорообразуюших палочек родов Bacillus и Closlridium. Патогенные спорообразующие палочки (возбудители сибирской язвы, ботулизма, столбняка, газовой гангрены) способны длительно сохраняться, а некоторые даже размножаться в почве (Clostridium botulinum).
Кишечные бактерии (сем. Enterobacteriaceae) — кишечная палочка, возбудители брюшного тифа, сальмонеллезов, дизентерии — могут попадать в почву с фекалиями. Обнаружение их в значительных количествах является показателем загрязнения почвы фекалиями человека и животных.
В почве находятся грибы, они участвуют в почвообразовании. Токсинообразующие грибы, попадая в продукты питания – вызывают интоксикацию.
Состав микрофлоры почвы зависит от ее типа и состояния, состава растительности, температуры, влажности. Большинство почвенных микроорганизмов способны развиваться при нейтральном рН, высокой относительной влажности, температуре от 25 до 40С.
№ 168 Почва как фактор передачи инфекционных болезней.
Почва является местом обитания спорообразуюших палочек родов Bacillus и Closlridium. Патогенные спорообразующие палочки (возбудители сибирской язвы, ботулизма, столбняка, газовой гангрены) способны длительно сохраняться, а некоторые даже размножаться в почве (Clostridium botulinum).
Кишечные бактерии (сем. Enterobacteriaceae) — кишечная палочка, возбудители брюшного тифа, сальмонеллезов, дизентерии — могут попадать в почву с фекалиями. Обнаружение их в значительных количествах является показателем загрязнения почвы фекалиями человека и животных.
№ 169 Санитарно-микробиологическое исследование почвы. Микробное число, коли-титр, перфрингенс-титр почвы.
Общее микробное число определяют глубинным посевом (на плотной среде) Перфрингенс-титр почвы - минимальное количество почвы, в котором еще определяются Clostridium perfringens.При фекальном загрязнении почвы клостридии обнаруживают в титре 0,01 г. Определяют перфрингенс-титр глубинным посевом.
Оценка фекального заражения проводится по индексу БГКП – коли-титр(количество БГКП в 1 г почвы).
На свежее фекальное загрязнение указывают: обнаружение энтерококков, большое количество БГКП при отсутствии нитрифицирующих бактерий, относительно высокое содержание вегетативных форм клостридий.
Титр БГКП и перфрингенс-титр для сильно загрязненных почв – 0,009; для чистых почв – коли-титр 1,0; перфрингенс-титр – 0,01.
№ 170 Санитарно-бактериологическое исследование предметов окружающей среды, исследование смывов с рук, инвентаря, оборудования.
Пробы отбирают методом смыва стерильным ватным тампоном, помещенным в пробирки с пептонной водой. Перед взятием пробы тампоны увлажняют. Для проведения смывов с рук увлажненным ватным тампоном протирают руки обследуемого. Перед исследованием смывную жидкость с тампоном или салфеткой встряхивают в течение 10 мин для десорбции микроорганизмов и далее смывную жидкость используют для посевов.
Методика исследования.Определение БГКП.
Определение Staphylococcus aureus. 1 мл смывной жидкости засевают в пробирку солевого бульона, инкубируют. При наличии роста высевают на желточно – солевой агар для получения изолированных колоний.
Требования к микробиологической чистоте: присутствие БГКП, синегнойной палочки, протеев, стафилококка в смывах не допускается.
№ 171 Контроль перевязочного и хирургического материала на стерильность.
Контроль стерильности материала и режима стерилизации в автоклавах проводится прямым и непрямым (косвенным) способами. Прямой способ — бактериологический; посев с перевязочного материала и белья или использование бактериологических тестов. Для бактериологических тестов используют пробирки с известной спороносной непатогенной культурой микроорганизмов, которые погибают при определенной температуре. Материалом обязательно засевают две среды — тиогликолевую (для роста бактерий) и среду Сабуро (для роста грибов). Отсутствие роста микробов свидетельствует о стерильности материала.

Непрямые способы контроля - используют вещества с определенной точкой плавления. Закладывают в биксы при стерилизации.
№172 Значение условно-патогенных микробов в этиологии пищевых токсикоинфекций.
По эпидемическим показаниям продукты исследуют на наличие патогенных и условно- патогенных микроорганизмов – возбудителей пищевых отравлений.
Обнаружение санитарно – показательных бактерий в продуктах питания – кишечной палочки, БГКП, энтерококка, золотистого стафилококка, клостридий.
Обнаружение сальмонелл – при исследовании продуктов из мяса.
Отсутствие характерной молочнокислой микрофлоры на молочных продуктах и наличие посторонней микрофлоры (плесневые грибы, дрожжи) – неудовлетворительное качество.
Консервированные продукты питания не должны содержать кишечную палочку, протей и патогенные микробы. При исследовании предусмотрено: обнаружение аэробных, анаэробных микроорганизмов, ботулинических экзотоксинов.
№ 173 Санитарно-микробиологическое исследование при пищевых токсикоинфекциях и бактериальных токсикозах.
1.Общее микробное число (обсеменение). Определяют факультативные анаэробные макроорганизмы, выросшие в виде колоний на плотной питательной среде после инкубации при 37С в теч. 24 ч.
2. Обнаружение санитарно-показательных бактерийв продуктах питания — кишечной палочки, БГКП, энтерококка, золотистого стафилококка, бактерий группы протея, клостридий.
3. Обнаружение сальмонелл - при исследовании продуктов из мяса.
По эпидемиологическим показаниям продукты исследуют на наличие патогенных и условно-патогенных микроорганизмов — возбудителей пищевых отравлений микробной этиологии.
В кисломолочных продуктах исследуют молочнокислую микрофлору бактериоскопическим изучением мазков из них, окрашенных метиленовым синим. Отсутствие характерной молочнокислой микрофлоры и наличие посторонней микрофлоры (плесневые грибы, дрожжи и др.) указывают на неудовлетворительное качество.
Консервированные продукты питания не должны содержать кишечную палочку, протей и патогенные микробы. При исследовании таких пищевых продуктов, как консервы овощные, рыбные, мясные, предусмотрено: обнаружение аэробных микроорганизмов; обнаружение анаэробных микроорганизмов; определение ботулинических экзотоксинов.
№ 174 Санитарно-микробиологическое исследование пищевых продуктов.
1.Общее микробное число (обсеменение). Определяют факультативные анаэробные макроорганизмы, выросшие в виде колоний на плотной питательной среде после инкубации при 37С в теч. 24 ч.
2. Обнаружение санитарно-показательных бактерийв продуктах питания — кишечной палочки, БГКП, энтерококка, золотистого стафилококка, бактерий группы протея, клостридий.
3. Обнаружение сальмонелл - при исследовании продуктов из мяса.
По эпидемиологическим показаниям продукты исследуют на наличие патогенных и условно-патогенных микроорганизмов — возбудителей пищевых отравлений микробной этиологии.
В кисломолочных продуктах исследуют молочнокислую микрофлору бактериоскопическим изучением мазков из них, окрашенных метиленовым синим. Отсутствие характерной молочнокислой микрофлоры и наличие посторонней микрофлоры (плесневые грибы, дрожжи и др.) указывают на неудовлетворительное качество.
Консервированные продукты питания не должны содержать кишечную палочку, протей и патогенные микробы. При исследовании таких пищевых продуктов, как консервы овощные, рыбные, мясные, предусмотрено: обнаружение аэробных микроорганизмов; обнаружение анаэробных микроорганизмов; определение ботулинических экзотоксинов.
№ 175 Санитарно-бактериологическое исследование молока и молочных продуктов.
О состоянии молока и молочных продуктов судят по микробному числу и коли-титру. Для определения микробного числа молоко разводят стерильным изотоническим раствором хлорида натрия и по 1 мл каждого разведения выливают на дно стерильных чашек Петри, которые заливают расплавленным и остуженным агаром. Посевы инкубируют при 37 С в течение суток, после чего подсчитывают количество выросших колоний. Для определения коли-титра молоко засевают в 6 пробирок со средой Кесслера. Посевы инкубируют при 43С в течение суток, после чего из забродивших проб делают посевы на среду Эндо. Из выросших колоний красного цвета готовят мазки, окрашивают по Граму, микроскопируют и делают посев на среду Козера, а также в пептонную воду с 1% глюкозы. При оценке результатов учитываются бактерии, вызывающие брожение глюкозы с образованием кислоты и газа, но не дающие роста на нитратной среде Козера.
Аналогично для молочных продуктов.
Для обнаружения в молоке патогенных бактерий делают посевы на соответствующие элективные и дифференциально диагностические среды с последующим выделением чистых куль тур и их идентификацией.
№ 176 Санитарно-бактериологическое исследование мяса и мясных продуктов.
При микроскопическом исследовании мяса определяют количество бактерий в мазках-отпечатках, которые готовят из кусочков мяса. Мазки окрашивают по Граму и микроскопируют. Мясо считается свежим, если в поле зрения обнаружено не более 10 бактериальных клеток.
Бактериологическое исследование мясных продуктов: определяют микробное число, а также устанавливают присутствие БГКП, сальмонелл, бактерий рода Proteus, стафилококков и клостридий.
Для определения общего количества микроорганизмов в 1 г продукта делают посев 0,1 и 0,01 г продукта на питательный агар, инкубируют 48ч и подсчитывают число колоний.
Для определения БГКП в 1 г продукта производят посев 5 мл взвеси на элективно - дифференциальную среду для БГКП и содержит питательный. При росте лактозоположительных БГКП синий цвет меняется на темно-зеленый или ярко-желтый.
№ 177 Вирусы, циркулирующие в сточной воде, методы индикации.
В водах обнаруживаются различные бактерии: палочковидные (псевдомонады, аэромонады), кокковидные (микрококки) и извитые. Загрязнение воды органическими веществами сопровождается увеличением анаэробных и аэробных бактерий, а также грибов. Вместе с сточными водами попадают представители нормальной микрофлоры человека и животных (кишечная палочка, цитробактер, энтеробактер, энтерококки, клостридии) и возбудители кишечных инфекций (брюшного тифа, паратифов, дизентерии, холеры, лептоспироза, энтеровирусных инфекций). Некоторые возбудители могут даже размножаться в воде (холерный вибрион, легионеллы).
Индикация: на основе цитопатического действия (ЦПД) вирусов, образования бляшек, реакции гемагглютинации, гемадсорбции.
№ 178 Роль воздушной среды в распространении вирусных заболеваний, методы отбора воздуха и индикации вирусов.
Санитарно – микробиологические показатели воздуха определяют седиментационным или аспирационным методами.
Аспирационный метод отбора проб — принудительное осаждение микробных частиц из воздуха. Для этого используют пробоотборник аэрозоля бактериологического. Принцип его действия основан на электризации частиц исследуемого воздуха и последующем их осаждении на электроде противоположного знака, роль которого играет металлический поддон с питательной средой. После инкубирования питательной среды подсчитывают количество выросших колоний и выражают обсемененность воздуха на определенный объем исследованного воздуха.
Седиментационный метод — осаждение микробов на поверхность плотной питательной среды под действием силы тяжести (гравитации). Открытую чашку Петри с питательной средой ставят на горизонтальную поверхность и оставляют на определенное время. Затем чашку закрывают и инкубируют в термостате. С помощью этого метода можно ориентировочно определить микробную обсемененность воздуха.
1. Общее количество микроорганизмовв 1 м воздуха (обсемененность воздуха) — количество колоний микроорганизмов, выросших при посеве воздуха на питательном агаре в чашке Петри в течение 24 ч при 37С.
2. Индекс санитарно-показательных микробов—количество золотистого стафилококка и гемолитических стрептококков в 1 м 3 воздуха. Эти бактерии являются представителями микрофлоры верхних дыхательных путей и имеют общий путь выделения с патогенными микроорганизмами, передающимися воздушно-капельным путем. Появление в воздухе спорообразующих бактерий — показатель загрязненности воздуха микроорганизмами почвы, а появление грамотрицательных бактерий — показатель возможного антисанитарного состояния.
Читайте также:

