Инфицированный материал в лабораториях
Обновлено: 22.04.2024
Государственное бюджетное учреждение здравоохранения
Тюменской области "Областная клиническая больница №1"
Нам доверяют самое ценное!
Правила взятия, доставки биологических материалов для основных микробиологических исследований в лаборатории клинической микробиологии
Правила взятия, доставки биологических материалов для основных микробиологических исследований в лаборатории клинической микробиологии
- производят в стерильные пробоотборники (пробирки, контейнеры, флаконы и др. посуду) до начала антибактериальной терапии;
- доставляют с соблюдением сроков доставки (без транспортных сред) не позднее 2 часов с момента взятия, без переохлаждения.
ИССЛЕДОВАНИЕ КРОВИ.
Взятие материала производит процедурная медицинская сестра в кабинете или палате с соблюдением асептики во время подъема температуры тела (37,2-380С) во флаконы с питательной средой.
Подготовка флаконов: визуально убедиться в целостности флакона и пробки, защитного колпачка; в прозрачности бульона, проверить цвет сенсора (сенсор должен быть голубовато-зеленый или серый, но не желтый; при наличии желтой окраски флакон не используется).
Удалить защитный колпачок, продезинфицировать пробку 70%-ым раствором спирта или раствором йода, дать высохнуть перед контактом с иглой.
Подготовка кожи: обработать место венепункции 70% раствором спирта в течение не менее 30 секунд. Затем нанести на кожу вокруг места венепункции 1-2% раствор йода концентрическими кругами (диаметр зоны обработки – около 3-5 см). Продолжительность обработки – не менее 30 секунд. Если используется раствор спирта, время обработки – не менее 60 секунд. Дать коже высохнуть перед венепункцией. Не пальпировать вену после обработки. При необходимости пальпации использовать стерильные перчатки.
Произвести венепункцию, используя шприц, набрать необходимое количество крови.
Внести во флаконы необходимое количество крови в соответствии с инструкцией (для флаконов SA, SN, FA, FN рекомендуется вносить до 10 мл); PF (педиатрические аэробные) - от 0,5 до 4 мл крови.
При использовании шприца на 20 мл рекомендуется сначала внести кровь в анаэробный флакон, затем – в аэробный.
Не проталкивать кровь во флакон принудительно при помощи поршня – жидкость легко поступает во флакон, поскольку в нем отрицательное давление воздуха (вакуум). В вечерние и ночные часы, в воскресенье флаконы с кровью помещать в термостат на 350С или хранить при комнатной температуре до утра. В направлениях дополнительно указывать температуру тела в момент взятия крови.
ИССЛЕДОВАНИЕ СОСУДИСТЫХ КАТЕТЕРОВ.
Взятие материала производит врач.
Область кожи вокруг катетера обрабатывают тампоном с 70% спиртом. В условиях асептики извлекают катетер и стерильными ножницами отрезают 5 см дистального конца катетера в стерильную пробирку или флакон.
При невозможности доставить в течение 2 часов рекомендуется хранить при +40С до 24 часов.
ИССЛЕДОВАНИЕ МОЧИ.
Взятие материала производит пациент. У лежачих пациентов – медицинская сестра.
Собирается моча после туалета наружных половых органов утренняя (накопительная) средняя порция мочи в количестве 3-5 мл. Катетеризация не рекомендуется.
При наличии постоянного катетера необходимо: пережать трубку ниже уровня отверстия уретры на 1-3 см, продезинфицировать трубку спиртовым тампоном и с помощью шприца с иглой взять до 5 мл мочи в стерильный пробоотборник (контейнер), снять зажим с катетера.
Доставлять не позднее 2 часов с момента взятия.
При уретрите, цистите – доставляют первую порцию мочи.
ИССЛЕДОВАНИЕ МОКРОТЫ.
Взятие материала производит пациент под контролем медицинской сестры.
Перед взятием почистить зубы, прополоскать рот свежей кипяченой водой. Утреннюю (накопительную) мокроту без слюны в количестве 1-5 мл собрать в прозрачный контейнер. Доставлять не позднее 2 часов с момента забора.
ИССЛЕДОВАНИЕ ПРОМЫВНЫХ ВОД БРОНХОВ.
Взятие материала производит врач.
В стерильную пробирку - в количестве до 3-5 мл. Доставлять в течение 2 часов с момента взятия.
ИССЛЕДОВАНИЕ ОТДЕЛЯЕМОГО НОСА.
1. При ЛОР заболеваниях. Взятие материала производит врач.
Достовернее пунктат из пазух носа в шприце или стерильной пробирке (менее информативно) - стерильным ватным тампоном из средних (по показаниям – глубоких) отделов, предварительно освободив нос от слизи.
2. На носительство золотистого стафилококка. Взятие материала производит обученный медицинский персонал. Из передних отделов слизистой полости носа одним тампоном из обоих носовых ходов, не касаясь кожи носа. Доставлять в течение 2 часов с момента взятия.
ИССЛЕДОВАНИЕ ОТДЕЛЯЕМОГО ЗЕВА.
Взятие материала производит врач или обученный медицинский персонал.
Натощак или через 2 часа после приема пищи, жидкости. Необходимо хорошее освещение, корень языка придавить шпателем. Не касаться слизистой рта, языка!
1. На микрофлору, на носительство золотистого стафилококка - ватным тампоном обтереть слизистую правой миндалины, дужки, язычка, левой миндалины, задней стенки глотки. Доставлять не позднее 2 часов с момента взятия.
2. На возбудителей дифтерии – из зева: при наличии налетов на границе здоровой и пораженной ткани. При отсутствии налетов – как на микрофлору. Одновременно - из носа: отделяемое слизистой носа тампоном из обоих носовых ходов.
При подозрении на дифтерию (по цито) - 2 или 3 тампона из зева для прямой бактериоскопии, постановки опыта на токсигенность, посева. По показаниям - из мест редкой локализации: отделяемое глаз, уха, ран, другое. Доставлять не позднее 2 часов с момента взятия. В вечерние и ночные часы, воскресенье материал опускать в теплую среду обогащения или транспортную среду с активированным углем, хранить в термостате +350С или комнатной температуре до утра.
3. На менингококк – взятие с посевом у постели больного или в лаборатории производит медицинский лабораторный техник с задней стенки носоглотки ватным тампоном, изогнутым под углом 45о в нижней части его длины о пробирку. Доставка немедленно в теплом контейнере!
4. На коклюш – взятие с посевом у постели больного или в лаборатории производит медицинский лабораторный техник изогнутым ватным тампоном под углом 45о (тампон вниз) с задней стенки глотки Доставка немедленно в теплом контейнере!
5. На микоз (грибы) - ватным тампоном с пораженных участков слизистой. Доставлять не позднее 2 часов с момента взятия.
ИССЛЕДОВАНИЕ ЛИКВОРА.
Взятие материала производит врач.
С соблюдением асептики брать последние порции ликвора в количестве 1-3 мл в стерильную пробирку (края пробирки обжечь до взятия и после над спиртовкой). Доставлять немедленно в теплом пенале. Вне часов работы лаборатории - помещать в термостат на 35°С до утра.
ИССЛЕДОВАНИЕ ОТДЕЛЯЕМОГО РАН.
Взятие материала производит врач, перевязочная медицинская сестра.
РАНЫ ПОВЕРХНОСТНЫЕ: во время перевязки кожу вокруг раны предварительно обработать раствором антисептика; некротические массы, детрит, гной удалить стерильной салфеткой. Взятие материала производить последовательно двумя ватными тампонами круговыми вращательными движениями от центра к периферии. Один тампон - для бактериоскопии, второй - для посева. По Cito! - 3 тампона: для бактериоскопии, посева и постановки чувствительности к антибиотикам.
ИССЛЕДОВАНИЕ ОТДЕЛЯЕМОГО ГЛАЗ.
Взятие материала производит врач.
За 5-6 часов до взятия отменить все процедуры и манипуляции. Раздельно из каждого глаза ватным тампоном со слизистой конъюнктивы от наружного к внутреннему краю, не касаясь кожи. Доставлять не позднее 2 часов с момента взятия.
ИССЛЕДОВАНИЕ ОТДЕЛЯЕМОГО УШЕЙ.
Взятие материала производит врач.
При поражении наружного уха обработать кожу 70° спиртом с последующим промыванием физиологическим раствором натрия хлорида. Затем отделяемое из очага взять ватным тампоном.
Доставлять не позднее 2 часов с момента взятия.
При поражении среднего, внутреннего уха доставляют пунктаты и материал, полученный во время оперативных вмешательств, собранный в стерильную посуду.
Вне часов работы лаборатории материал берется в среду обогащения или коммерческие накопительные среды (Амиеса, тиогликолиевая и др.) и хранится в термостате при 35' С или комнатной температуре в течение 24-48 часов (см. раневое отделяемое).
ИССЛЕДОВАНИЕ ЖЕЛЧИ.
Взятие материала производит процедурная медицинская сестра.
При зондировании после взятия желчи в клиническую лабораторию порции в стерильные пробирки в количестве 3-5 мл (чаще исследуется порция В, реже - порция С), либо во время операции с помощью шприца, соблюдая правила асептики. Доставлять в течение 2 часов.
ИССЛЕДОВАНИЕ ГРУДНОГО МОЛОКА.
Взятие материала производит пациентка под контролем медицинской сестры.
С соблюдением правил асептики, после туалета молочных желез, предварительно сцедив первые капли в салфетку. Доставлять в стерильных пробоотборниках (контейнерах) в количестве 1-3 мл в течение 0,5-1 часа.
ИССЛЕДОВАНИЕ ОТДЕЛЯЕМОГО ПОЛОВЫХ ОРГАНОВ.
Взятие материала производит врач.
1. НА НЕСПЕЦИФИЧЕСКИЕ ВОЗБУДИТЕЛИ:
Вульва - до манульного исследования, после введения зеркала и подъемника брать ватным тампоном с патологически измененных участков.
2. НА МИКОПЛАЗМОЗ, УРЕАПЛАЗМОЗ - посев материала (соскоб из уретры, заднего свода влагалища, канала шейки матки) в пробирки осуществляют ложкой Фолькмана или тампоном однократного применения. Пробирки доставляют в лабораторию не позднее 2 часов с момента взятия.
- у мужчин отделяемое слизистой берут петлей или ложкой Фолькмана из глубины уретры, предварительно очистив отверстие тампоном, смоченным изотоническим раствором хлорида натрия. При малом количестве выделений до взятия материала производят массаж уретры в дистальном направлении. При заболевании предстательной железы исследуют ее сок.
- у женщин из шейки матки материал берут после введения во влагалище зеркала Куско. Шейку вытирают, удаляют наружную слизисто – гнойную пробку (вагинальный конец) и из отверстия шейки матки корнцангом или вагинальным пинцетом берут вязкую слизь.
- у мужчин отделяемое слизистой оболочки берут петлей или ложкой Фолькмана из глубины уретры, предварительно очистив отверстие тампоном, смоченным изотоническим раствором хлорида натрия. При малом количестве выделений до взятия материала производят массаж уретры в дистальном направлении. При заболевании предстательной железы исследуют ее сок.
- у женщин из шейки матки материал берут после введения во влагалище зеркала Куско. Шейку вытирают, удаляют наружную слизисто-гнойную пробку (вагинальный конец) и из отверстия шейки матки корнцангом или вагинальным пинцетом берут вязкую слизь (для беременных женщин взятие из экзоцервикса), не допуская загрязнение исследуемого материала микрофлорой влагалища.
ИССЛЕДОВАНИЕ ИСПРАЖНЕНИЙ.
Взятие материала производит медицинская сестра.
1. На патогенные энтеробактерий (шигеллы, сальмонеллы, эшерихий) - из судна без следов дезинфицирующих растворов брать слизь, зелень, фекалий в стерильную посуду или в пробирку с транспортными средами (глицериновый консервант, Кэри-Блейра или другие коммерческие накопительные среды) в объеме не более 1/3 от среды.
Нативный фекалий (без транспортной среды) - доставлять в течение 2 часов с момента взятия.
Вне часов работы лаборатории хранить в холодильнике +40С в глицериновом консерванте до 16-24 часов, среде Кэри-Блейра и других коммерческих средах – до 48 часов.
2. На дисбактериоз, грибы, патогенный стафилококк, УПМ (условно-патогенную микрофлору), иерсинии – из судна с соблюдением асептики 1-2 г нативного фекалия в стерильные контейнеры с лопаточкой. Доставлять не позднее 2 часов с момента взятия.
3. На возбудителей холеры – 0,5-1,5 г нативный фекалий (доставлять не позднее 2 часов с момента взятия), при невозможности доставить в требуемые сроки - в холерный консервант (хранить в термостате 350С до 6 часов).
4. На выявление антигенов лямблий; хеликобактера; рота-, нора- и аденовирусов, токсинов клостридий иммунохроматогенным методом (экспресс-метод) - нативный фекалий 0,5-1,5 г в чистой стеклянной посуде.
Каждая проба сопровождается документом - направлением, где указывают: фамилию, имя, отчество пациента; год рождения; отделение, в котором он находится; номер истории болезни (амбулаторной карты); диагноз; материал, посылаемый на исследование, и задачи исследования; дату и время взятия материала; антибактериальные (иммунные) препараты, если проба берется на фоне антибиотико- и/или иммунотерапии; фамилию, имя, отчество лечащего врача (консультанта), направляющего пробу на исследование.
Часы работы лаборатории клинической микробиологии: с 8.00 до 15.30 часов, в субботу - с 8.00 до 14.00 часов, выходной - воскресенье.
Амбулаторные пациенты исследуемый материал доставляют самостоятельно на 9 этаж административного корпуса больницы.
Из отделений материал доставляется в оперативный отдел.
2.2. Контроль за уровнем квалификации персонала вирусологических лабораторий по этим вопросам является одним из главных в деятельности режимных комиссий учреждений здравоохранения, Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, научно-исследовательских институтов, персонала вирусологических лабораторий, работающих или сохраняющих материалы инфицированные или потенциально инфицированные диким полиовирусом .
2.3. При организации работы необходимо определить перечень вопросов тестового контроля в соответствии с занимаемой должностью и характером работы ( врачи, средний, младший медицинский персонал ).
2.4. По итогам тестового контроля знаний необходимо провести соответствующие организационные и практические мероприятия, направленные на повышение уровня квалификации персонала.
3.2. Основным направлением деятельности является дифференцированный контроль уровня квалификации персонала по вопросам: требования к помещениям и оборудованию лабораторий, осуществляющих работы с материалами, инфицированными или потенциально инфицированными диким полиовирусом, требования к проведению работ в лаборатории, требования к порядку использования средств индивидуальной защиты , требования к обеззараживанию материала и уборке помещений, требования к мероприятиям при локализации и ликвидации последствий аварий , требований к порядку учета, хранения, передачи и транспортировки материалов.
знаний персонала вирусологических лабораторий ( врачей –вирусологов, средних ,младших медицинских работников ) по вопросам безопасности работы с материалами, инфицированными или потенциально инфицированнымио диким полиовирусом ( контейнмент )
Б- безопасное лабораторное хранение инфицированного диким полиовирусом материалов (образцы фекалий, секционные материалы,сточные воды)
В- безопасное лабораторное хранение инфицированного диким полиовирусом материалов (образцы фекалий, отделяемое верхних дыхательных путей, секционные материалы), хранившихся без охлаждения три и более месяцев, инактивированные прогреванием при 500С обработанные дезинфектантами, инактивирующими полиовирус
2. Какой уровень биологической безопасности ( по зарубежной классификации ) необходим при обращении с материалами инфицированными или потенциально инфицированными диким полиовирусом:
2.2. Контроль за уровнем квалификации персонала вирусологических лабораторий по этим вопросам является одним из главных в деятельности режимных комиссий учреждений здравоохранения, Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, научно-исследовательских институтов, персонала вирусологических лабораторий, работающих или сохраняющих материалы инфицированные или потенциально инфицированные диким полиовирусом .
2.3. При организации работы необходимо определить перечень вопросов тестового контроля в соответствии с занимаемой должностью и характером работы ( врачи, средний, младший медицинский персонал ).
2.4. По итогам тестового контроля знаний необходимо провести соответствующие организационные и практические мероприятия, направленные на повышение уровня квалификации персонала.
3.2. Основным направлением деятельности является дифференцированный контроль уровня квалификации персонала по вопросам: требования к помещениям и оборудованию лабораторий, осуществляющих работы с материалами, инфицированными или потенциально инфицированными диким полиовирусом, требования к проведению работ в лаборатории, требования к порядку использования средств индивидуальной защиты , требования к обеззараживанию материала и уборке помещений, требования к мероприятиям при локализации и ликвидации последствий аварий , требований к порядку учета, хранения, передачи и транспортировки материалов.
знаний персонала вирусологических лабораторий ( врачей –вирусологов, средних ,младших медицинских работников ) по вопросам безопасности работы с материалами, инфицированными или потенциально инфицированнымио диким полиовирусом ( контейнмент )
Б- безопасное лабораторное хранение инфицированного диким полиовирусом материалов (образцы фекалий, секционные материалы,сточные воды)
В- безопасное лабораторное хранение инфицированного диким полиовирусом материалов (образцы фекалий, отделяемое верхних дыхательных путей, секционные материалы), хранившихся без охлаждения три и более месяцев, инактивированные прогреванием при 500С обработанные дезинфектантами, инактивирующими полиовирус
2. Какой уровень биологической безопасности ( по зарубежной классификации ) необходим при обращении с материалами инфицированными или потенциально инфицированными диким полиовирусом:
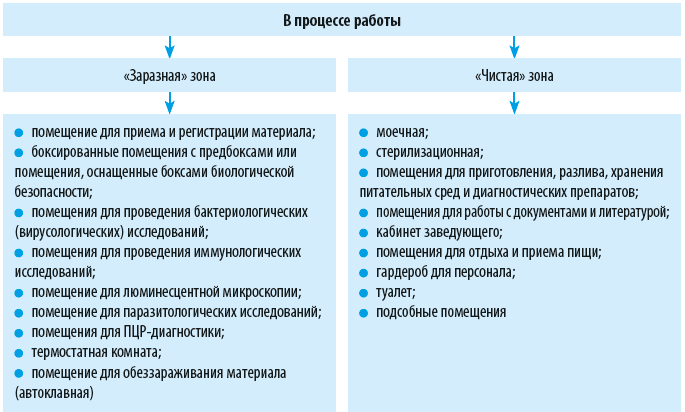
Диагностические лаборатории медицинских организаций, как правило, осуществляют работы с патогенными биологическими агентами (ПБА) III–IV групп патогенности. Чтобы обеспечить в лаборатории требования биологической безопасности, необходимо предусмотреть поточность технологических процессов, зонирование производственных помещений, своевременное проведение дезинфекционных мероприятий. Расскажем о том, как это сделать.
Зонирование лаборатории
Обратите внимание!
Выносить за пределы лаборатории оборудование, лабораторную или хозяйственную посуду, реактивы, инструменты и прочие объекты можно только после их дезинфекции и с разрешения руководителя лаборатории.
Требования к отделке помещений лаборатории
Поверхности пола, стен, потолка, мебели, оборудования и прочих объектов в помещениях лаборатории должны быть гладкими, устойчивыми к влажной уборке с применением моющих и дезинфицирующих средств. Для пола необходимо предусмотреть гидроизоляцию и антискользящее покрытие.
Если лаборатория располагается на первом этаже или в цоколе, то окна обязательно оснащают металлическими решетками, не нарушающими правил пожарной безопасности. Для защиты рабочих столов от попадания прямого солнечного света используют светозащитную пленку или жалюзи из материалов, устойчивых к воздействию дезсредств.
Доставка и прием биологического материала
На дно контейнера для транспортировки укладывают адсорбирующий материал (марлевую салфетку, ткань, вату).
Обратите внимание!
Не допускается доставка материала в хозяйственных сумках, чемоданах, портфелях и других предметах личного пользования.
Чтобы исключить контакт бланков-направлений с биологическим материалом, их вкладывают в отдельный полиэтиленовый пакет.
Важно!
Персонал лаборатории должен осуществлять прием и разбор биологического материала с использованием средств индивидуальной защиты: масок и резиновых перчаток.
Работа с патогенными биологическими агентами
Важно!
Запрещается пипетировать ртом и переливать жидкий инфекционный материал через край пробирки, покидать рабочее место во время манипуляций с ПБА, удалять необеззараженные сгустки крови из пробирок вытряхиванием, сливать жидкие отходы в канализацию без предварительного обеззараживания.
- центрифугирование ПБА и другие манипуляции, вследствие которых образуются аэрозоли;
- приготовление суспензий;
- работа с лиофилизированными ПБА;
- работа по ведению коллекционных штаммов;
- работа по идентификации и изучению выделенных штаммов микроорганизмов.
- серологические исследования и ПЦР-исследованияпо детекции в клиническом материале возбудителей парентеральных вирусных гепатитов В и С, ВИЧ-инфекции и других микроорганизмов II группы патогенности.
Во время работ двери боксов и предбоксов должны быть закрыты. До момента окончания работ выход из боксов не допускается.
Перед началом работ с использованием боксов биологической безопасности включают вентиляцию, проверяют исправность оборудования, наличие аварийного запаса дезинфицирующих средств. Манипуляции с ПБА должны выполняться ближе к задней стенке бокса на поддонах с салфетками, смоченными дезинфицирующим раствором.
После окончания работ с ПБА переднюю панель бокса биологической безопасности опускают, внутри бокса включают бактерицидные лампы.
Обратите внимание!
Боксы биологической безопасности должны проверяться на защитную эффективность:
после монтажа и подготовки к использованию;
после перемещения или ремонта;
не реже одного раза в год при наличии фильтров предварительной очистки воздуха от крупнодисперсных частиц;
не реже 2 раз в год при отсутствии фильтров предварительной очистки воздуха от крупнодисперсных частиц.
При проверке боксов должны контролироваться параметры эффективности работы фильтров очистки воздуха и скорость воздушного потока в рабочем проеме бокса.
Дезинфекционные мероприятия в лаборатории
При организации дезинфекционных мероприятий в лабораториях применяют физические и химические методы дезинфекции.
Для обеззараживания лабораторной посуды, защитной одежды персонала, бактериологических посевов, а также жидких отходов можно применять паровые стерилизаторы.
В воздушных стерилизаторах допускается обеззараживать лабораторную посуду из стекла, металлов или силикона, не загрязненную органическими веществами.
Обратите внимание!
Параметры паровой и воздушной стерилизации контролируют с помощью максимальных термометров, которые размещаются в контрольных точках. Количество контрольных точек зависит от объема камеры стерилизатора. Параметры паровой стерилизации дополнительно контролируются при помощи мановакуумметров.
Химический контроль термической стерилизации осуществляют при каждом цикле работы с использованием специальных тест-индикаторов, необходимое количество и точки расположения которых зависят от вида аппаратуры и объема стерилизационной камеры.
Контроль стерилизации с помощью бактериологических методов (биотестов) должен осуществляться не реже 2 раз в год, а также после ввода в эксплуатацию и ремонта аппаратуры. Биотесты, содержащие некоторое количество жизнеспособных микроорганизмов, обладающих высокой резистентностью, помещают в контрольные точки стерилизационной камеры. При качественно проведенном процессе стерилизации микроорганизмы погибают. Вид применяемых биотестов зависит от типа стерилизационного оборудования.
Химическими методами проводят обеззараживание различных поверхностей, медицинской мебели, оборудования, жидких отходов, спецодежды и других объектов.
К сведению
При выборе химических дезинфектантов предпочтение следует отдавать средствам с широким спектром антимикробной активности.
Объекты, загрязненные кровью, необходимо дезинфицировать растворами, обладающими активностью в отношении возбудителей парентеральных инфекций.
Рабочие растворы дезсредств готовят в специально отведенных помещениях или в вытяжном шкафу. Контейнеры (емкости) с растворами маркируют, указывая название дезсредства и его назначение, концентрацию раствора, дату приготовления и дату конечной реализации.
Дезсредства, применяемые для проведения текущих и генеральных уборок, должны обладать моющими свойствами. Текущую уборку проводят 2 раза в день. Обрабатывают полы, мебель, оборудование, подоконники, двери.
Генеральные уборки проводят не реже 1 раза в месяц, в боксированных помещениях — не реже 1 раза в неделю.
После влажной уборки включают бактерицидные облучатели. Их следует эксплуатировать в соответствии с действующими методическими документами и инструкциями по применению конкретного оборудования.
Обратите внимание!
Если в течение дня нужно экстренно обработать небольшие по площади или труднодоступные поверхности, следует использовать готовые к применению формы дезсредств, которые имеют небольшое время экспозиции и выпускаются в виде спреев или дезинфицирующих салфеток.
Медицинские изделия и посуду дезинфицируют способом полного погружения в рабочий раствор дезинфицирующего средства. Разъемные изделия обеззараживают в разобранном виде, каналы и полости изделий заполняют дезинфицирующим раствором.
Особенности обращения с отходами лабораторий
Лабораторную посуду с культурами микроорганизмов, как правило, обеззараживают в паровых стерилизаторах.
Важно!
Пробирки со сгустками крови обеззараживают с использованием дезинфицирующих растворов или с применением физических методов дезинфекции. Вытряхивать необеззараженные сгустки крови из пробирок запрещено.
При погружении в дезинфицирующий раствор пробирок со сгустками крови необходимо соблюдать осторожность. Пробирку берут анатомическим пинцетом так, чтобы одна его бранша вошла немного внутрь, и погружают ее в наклонном положении до полного заполнения раствором. При правильном погружении воздушные пузыри не образуются, пробирка опускается на дно.
Техника безопасности и ликвидация аварийных ситуаций
Помещения лаборатории должны быть оборудованы пожарной сигнализацией и обеспечены средствами пожаротушения в соответствии с требованиями пожарной безопасности.
Сотрудники диагностических лабораторий должны быть обеспечены спецодеждой соответствующего размера: медицинскими халатами и костюмами, шапочками, медицинской обувью и средствами индивидуальной защиты, в том числе перчатками и масками, респираторами.
Для работы в боксированных помещениях используют отдельный халат, доходящий до нижней трети голени, и тапочки.
Рабочая одежда и обувь должны быть индивидуальными, храниться отдельно от личной одежды. Смена рабочей одежды проводится по мере загрязнения, но не реже 1 раза в неделю. Стирать спецодежду следует централизованно. Перед сдачей в стирку защитную одежду обеззараживают.
Важно!
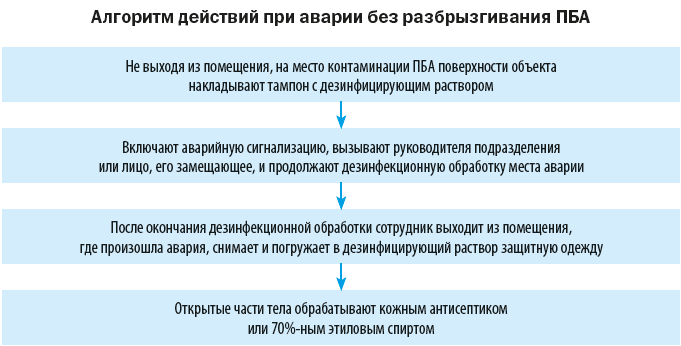
На случай аварийных ситуаций, при которых создается угроза выделения ПБА в воздух рабочей зоны или есть риск заражения персонала, в лаборатории должен быть план ликвидации аварии и запас дезинфицирующих средств.
Объем мероприятий по ликвидации аварии зависит от характера выполняемой работы, вида и свойств ПБА, масштабов аварии.
Кроме того, в специально отведенном месте хранят аварийную аптечку, гидропульт, комплекты рабочей одежды для переодевания пострадавших и защитной одежды для сотрудников, ликвидирующих последствия аварии. Ответственным за комплектование аптечки и аварийной укладки является заведующий лабораторией.
Состав аварийной аптечки:
1. Спирт этиловый 70%-ный — 2 флакона по 100 мл.
2. Спиртовой раствор йода 5%-ный — 1 флакон.
3. Раствор борной кислоты 1%-ный — 1 флакон.
4. Нашатырный спирт — 1 флакон.
5. Бинт марлевый медицинский стерильный (5 м × 10 см) — 2 шт.
6. Лейкопластырь бактерицидный (не менее 1,9 см × 7,2 см) — 3 шт.
7. Салфетка марлевая медицинская стерильная (не менее 16 см × 14 см, № 10) — 1 уп.
8. Ножницы с закругленными браншами.
При аварии во время работы на центрифуге крышку медленно открывают только спустя 30–40 минут, чтобы сформировавшийся аэрозоль успел осесть. Центрифужные стаканы и разбитое стекло помещают в дезинфицирующий раствор, поверхность крышки, внутренние части центрифуги, ее наружную поверхность дезинфицируют (после отключения ее от электросети).
О каждом случае аварийной ситуации руководитель лаборатории обязан сообщить комиссии по контролю соблюдения требований биологической безопасности, а также руководителю медорганизации.
Не реже 1 раза в год в лаборатории должны проводиться тренировочные учения по ликвидации аварий.
Допуск персонала к работе с ПБА
Допуск персонала к работе с ПБА III–IV групп патогенности, а также допуск инженерно-технического персонала к обслуживанию лабораторного оборудования должен осуществляться на основании приказа главного врача. Приказ издается не реже одного раза в два года, корректируется по мере необходимости.
В лабораториях медорганизаций работу с ПБА могут выполнять специалисты не моложе 18 лет с высшим и средним медицинским или биологическим образованием, прошедшие необходимую профессиональную подготовку.
Лица, имеющие медицинские противопоказания к вакцинации, лечению специфическими препаратами, использованию средств индивидуальной защиты, к работам с ПБА не допускаются.
Не реже 1 раза в год медицинский персонал, работающий с ПБА, должен проходить инструктаж по соблюдению требований биологической безопасности. Инженерно-технический персонал, дезинфекторы и санитарки лаборатории также должны проходить вводные и периодические инструктажи по биологической безопасности.
При приеме на работу сотрудников лаборатории направляют на предварительный медицинский осмотр для выявления противопоказаний с учетом специфики трудовой деятельности[1].
Все сотрудники, которые привлекаются к работам с ПБА, должны быть привиты в соответствии с календарем профилактических прививок и календарем прививок по эпидемическим показаниям.
К работе с паровыми стерилизаторами (автоклавами) могут быть допущены лица, обученные, аттестованные и имеющие удостоверение на право обслуживания сосудов, работающих под давлением.
Организация работы комиссии по биологической безопасности
Для контроля за соблюдением мер биологической безопасности при работе с ПБА в медорганизации создается специальная комиссия. В ее состав, как правило, включают заведующего лабораторией, врача-эпидемиолога или его помощника, инженера по охране труда и других заинтересованных специалистов.
Задачи комиссии по биологической безопасности:
- организация и проведение постоянного контроля за соблюдением регламентированного порядка обеспечения биологической безопасности лаборатории;
- разработка комплекса мер по совершенствованию биологической безопасности;
- организация и проведение мероприятий, направленных на предупреждение аварийных ситуаций при работе с ПБА и ликвидацию их последствий;
- контроль за подготовленностью сотрудников к работе с ПБА и организация наблюдения за состоянием их здоровья.
Заседания комиссии проводятся не реже 2 раз в год. Решения комиссии доводятся до сведения руководителя медорганизации.
Читайте также: