Ингибирование вирусной рнк это
Обновлено: 24.04.2024
Ингибиторы ДНК-полимераз ДНК-содержащих вирусов. Видарабин. Идоксуридин. Трифторидин ( вироптик ). Ацикловир. Фамцинловир. Ганцикловир. Фоскарнет.
Ингибиторы ДНК-полимераз ДНК-содержащих вирусов представлены препаратами, фосфорилируемыми как клеточными киназами, так и вирусными тимидинкиназами. Видарабин — аналог пурина с четвертичной структурой, аналогичной дезоксиаденозину. Антивирусный эффект этого ЛС связан с подавлением ДНК-полимеразы интермедиатом видара-бина аденинарабинозид-5'-трифосфатом.
Видарабин — эффективное средство лечения герпетических энцефалитов, существенно снижающее смертность больных. Галогенизированные производные. Для проявления антивирусного эффекта необходимо их метаболизирование до фосфорилированных нуклеотидов, подавляющих вирусные ДНК-полимеразы.
Идоксуридин (5'-йодо-2'-дезоксиуридин, 5'-йододезоксиуридин, IUD) — первый и наиболее эффективный противовирусный препарат данной группы; фосфорилируется как клеточной, так и вирусспецифической тимидинкиназой, то есть его активная форма образуется как в заражённых, так и в интактных клетках. Применяют местно для лечения герпетических кератитов. Побочные эффекты препарата (подавление лейкопоэза) при системном применении ограничили возможность его широкого использования.
Трифторидин (вироптик). Степень селективного воздействия препарата на ДНК-содержащие вирусы (герпеса, оспы, аденовирусы) выше, чем идоксуридина, что обусловлено более высокой (в 15-20 раз) скоростью его фосфорилирования вирусспецифической тимидинкиназой.
Ацикловир — ациклический нуклеозидный аналог гуанозина с высокой избирательностью к инфицированным вирусами клеткам. В клетках происходит последовательное превращение ацикловира в моно-, ди- и трифосфат. Первый этап индуцирует вирусспецифическая тимидинкиназа, экспрессируемая в клетках вскоре после заражения; за реализацию остальных этапов фосфорилирования ответственны клеточные киназы. Образующийся ациклогуанозинтрифосфат ингибирует ДНК-полимеразу вирусов, тормозя образование полноценной молекулы нуклеиновой кислоты, так как из-за отсутствия гидроксильной группы к ациклогуанозинтрифосфату не могут присоединяться последующие нуклеотиды. Таким образом, препарат не влияет на синтез ДНК в незаражённых клетках, так как в них он не превращается в активную форму. Препарат эффективен при лечении инфекций, вызванных ВПГ. При инфекциях, вызванных другими герпесвирусами (например, ЦМВ или вирусом Эпстайна-Барр), этот препарат назначать нецелесообразно, так как названные возбудители лишены вирусспецифической тимидинкиназы.
Фамцинловир. Механизм действия фамцикловира аналогичен таковому ацикловира. Фармакокинетика препарата позволяет применять его с большими интервалами, и он вызывает меньше побочных эффектов.
Ганцикловир — производное ацикловира; активируется под действием киназ млекопитающих и вирусных фосфотрансфераз с образованием трифосфата, ингибирующего преимущественно ДНК-полимеразу ЦМВ.
Фоскарнет. Помимо подавления активности обратной транскриптазы, препарат ингибирует активность всех ДНК-полимераз герпесвирусов и вируса гепатита В. Механизм действия обусловлен связыванием полифосфатных групп ДНК-полимеразы, что препятствует поступлению пирофосфатов из дезоксирибонуклеозидтрифосфата и блокирует элонгацию молекулы ДНК. Аналогичный механизм заложен в ингибирование обратной транскриптазы, но препарат взаимодействует с ферментом через группировки, отличные от участвующих в связывании пирофосфатов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лекарства для лечения вирусных инфекций
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.
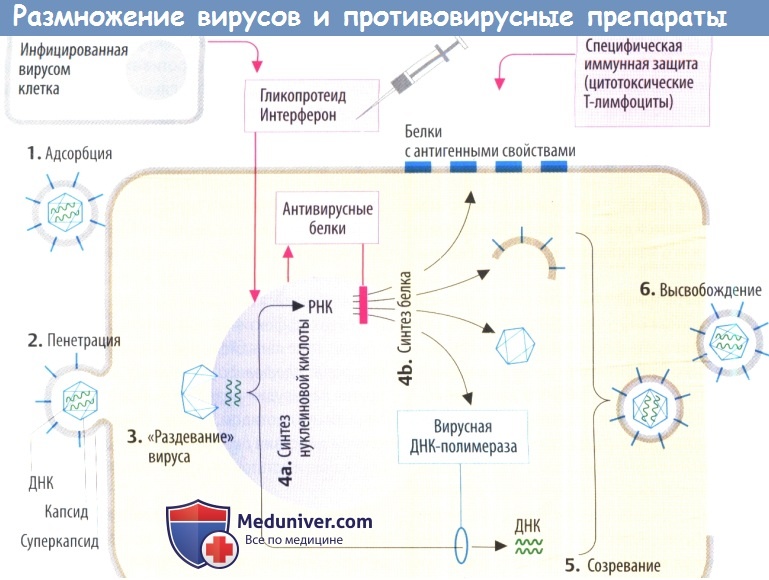
II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.
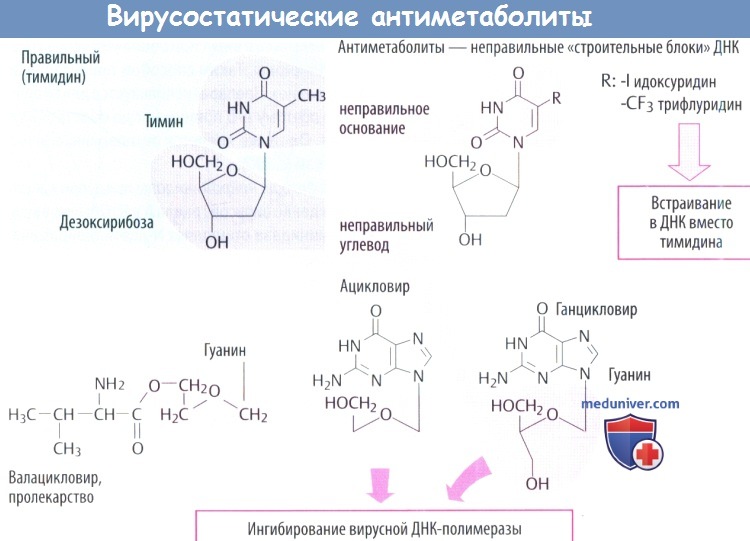
в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
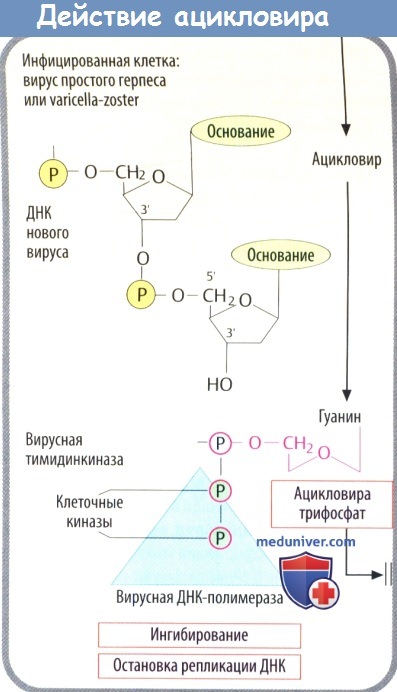
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З'-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.
г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).
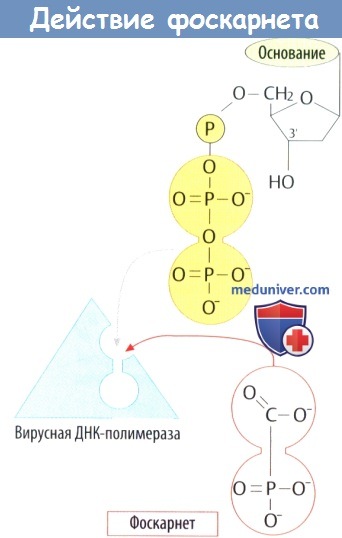
е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
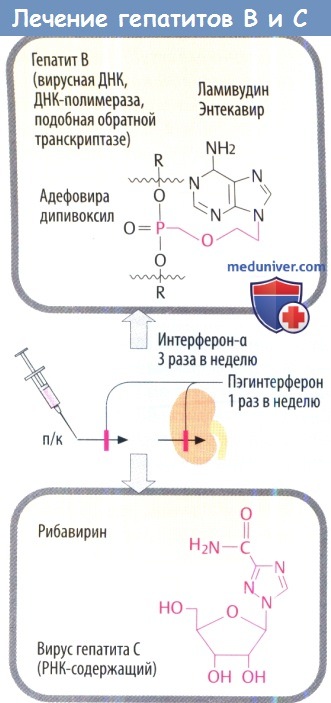
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.
Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
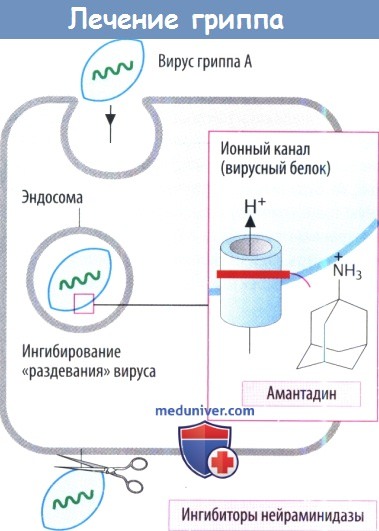
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Установлено, что комбинация интерферона с антиоксидантом обладает более высокой противовирусной активностью по сравнению с монопрепаратом интерферона в отношении пандемического штамма вируса гриппа и вируса простого герпеса 1-го типа. Наиболее эффективна
Combination of interferon and antioxidants was proved to have higher antiviral activity comparing to mono-medication of interferon in respect to pandemic strain of flu and simple 1st type herpes virus. The "interferon + taurin + benzocaine" combination is the most effective.
.jpg)
Несмотря на успехи в разработке новых вакцин и противовирусных препаратов, грипп продолжает оставаться трудноконтролируемой инфекцией. Благодаря особенностям репродукции и организации генома, вирус гриппа способен к изменчивости двух типов — генному дрейфу (постепенной смене антигенных свойств) и генному шифту (появлению в человеческой популяции вируса с принципиально новыми антигенными характеристиками). Высокая скорость изменчивости позволяет вирусу, с одной стороны, ускользать от иммунного ответа хозяина, а с другой — в течение нескольких вирусных поколений вырабатывать устойчивость к противовирусным препаратам.
Новые вирусы гриппа птиц H5N1 и свиней H1N1, инфицирующие людей в последние годы, являются опасными патогенами человека. Большинство человеческих изолятов вируса устойчивы к действию современных противогриппозных препаратов — амантадина и римантадина [1], а некоторые и осельтамивира [2, 3], а также способны эффективно подавлять интерфероновый ответ организма [4]. Помимо этого, поверхностные антигены этих вирусов являются новыми для иммунной системы человека, вследствие чего к ним отсутствует коллективный иммунитет. Перечисленные свойства делают неэффективными такие способы защиты человека, как химиотерапия, специфический иммунный ответ и система интерферона.
На сегодняшний день лишь две вирусные мишени используются для направленного действия химиопрепаратов. Это, во-первых, белок М2 вируса гриппа, играющий роль ионного канала в вирусной мембране, который блокируют препараты адамантанового ряда — римантадин и амантадин [5]. Во-вторых, мишенью для лекарственного вмешательства является вирусная нейраминидаза — фермент, необходимый для почкования вирусных частиц и проявления инфекционных свойств вируса, против которой эффективны нейраминидазные ингибиторы занамивир (5-(ацетиламино)-4-[(аминоиминометил)-амино]-2,6-ангидро-3,4,5-тридезокси-D-глицеро-D-галакто-нон-2-еноновая кислота), осельтамивир [6] и перамивир ((1S,2S,3S,4R)-3-[(1S)-1-ацетамидо-2-этил-бутил]-4-(диаминометилиденамино)-2-гидрокси-циклопентан-1-карбоновая кислота) [7].
Обе группы соединений имеют свои недостатки. В отношении группы производных адамантана можно отметить сравнительно высокую токсичность, узкий спектр действия и быстрое формирование устойчивости к ним вируса. Для ингибиторов нейраминидазы также характерно формирование резистентности и высокая стоимость синтеза, что делает эти препараты менее доступными для широкого использования.
В настоящее время существуют специфические противовирусные препараты для лечения инфекций, вызываемых вирусом простого герпеса, вирусом Varicella zoster, и цитомегаловирусной инфекции. Препаратами выбора для терапии герпеса являются аналоги нуклеозидов — ацикловир, ганцикловир, валацикловир, пенцикловир и фамцикловир. Среди препаратов, рекомендуемых в настоящее время для лечения герпетической инфекции, аналоги нуклеозидов являются единственными, обладающими доказанной эффективностью.
Несмотря на наличие на рынке набора перечисленных препаратов, вирусы герпеса способны вырабатывать к ним устойчивость, что существенно снижает эффективность противовирусной химиотерапии, а в тяжелых случаях и ставит под угрозу жизнь пациента. Поэтому по-прежнему актуальными являются поиск и разработка эффективных и дешевых противогерпетических препаратов возможно более широкого спектра действия.
Проблема иммунотерапии представляет интерес для врачей практически всех специальностей в связи с широким спектром противовирусной активности иммуномодулирующих препаратов из-за неуклонного роста инфекционно-воспалительных заболеваний на фоне низкой эффективности проводимой базовой терапии, злокачественных новообразований, аутоиммунных и аллергических заболеваний, системных заболеваний, вирусных инфекций, обусловливающих высокий уровень заболеваемости, смертности и инвалидности.
При терапии как гриппозной, так и герпетической инфекций в настоящее время широко применяются препараты интерферонов в инъекционной и местной формах. При составлении лекарственной формы в конечную комбинацию добавляются антиоксиданты, препятствующие окислительному разрушению молекул интерферона и способствующие сохранности биологической активности лекарственного продукта. В то же время ряд исследований [1, 2] указывает на наличие противовирусной активности и у самих антиоксидантов. Однако результаты контролируемых клинических испытаний подобных комбинаций не выявили достоверных различий в их эффективности по сравнению с монопрепаратом интерферона [3, 8–11]. Целью настоящего исследования было экспериментальное изучение противовирусной активности рекомбинантного человеческого интерферона альфа-2b (далее ИФН альфа-2b) в комбинации с антиоксидантами в культуре клеток в отношении вируса гриппа и вируса простого герпеса человека.
Материалы и методы
Препараты. В работе использовали препараты: ИФН альфа-2b, аскорбиновая кислота, Унитиол, бензокаин, альфа-токоферола ацетат, таурин. Из полученных препаратов готовили комбинации, соблюдая следующие соотношения:
- ИФН альфа-2b + аскорбиновая кислота (в соотношении 10 000 МЕ: 0,16 мг);
- ИФН альфа-2b + аскорбиновая кислота + альфа-токоферола ацетат (в соотношении 10 000 МЕ:0,16 мг:1,1 мг);
- ИФН альфа-2b + таурин (в соотношении 10 000 МЕ:0,2 мг);
- ИФН альфа-2b + таурин + бензокаин (в соотношении 10 000 МЕ:0,2 мг:1,1 мг);
- ИФН альфа-2b + Унитиол (в соотношении 10 000 МЕ:0,2 мг);
- контроль — ИФН альфа-2b.
Соотношения препаратов были основаны на содержании антиоксидантов в конечных лекарственных формах интерферона.
Оценка токсичности препаратов. Для контроля токсичности полученных препаратов и их комбинаций соединения вносили в лунки отдельных планшетов и инкубировали 2 суток при 37 °C. По истечении этого срока клетки промывали 2 раза по 5 минут фосфатно-солевым буфером и количество живых клеток оценивали при помощи микротетразолиевого теста (МТТ). С этой целью в лунки планшетов добавляли по 100 мкл раствора (5 мг/мл) 3-(4,5-диметилтиазолил-2) 2,5-дифенилтетразолия бромида (ICN Biochemicals Inc., Aurora, Ohio) на физиологическом растворе. Клетки инкубировали при 37 °С в атмосфере 5% СО2 в течение 2 часов и промывали 5 минут фосфатно-солевым буфером. Осадок растворяли в 100 мкл на лунку ДМСО (диметилсульфоксид), после чего оптическую плотность в лунках планшетов измеряли на многофункциональном ридере Victor 1420 (Perkin Elmer, Finland) при длине волны 535 нм. Концентрацию считали токсической, если оптическая плотность соответствующих лунок была в два и более раз меньше, чем в контроле клеток без вируса и препаратов. Минимальную использованную концентрацию, приводящую к такому эффекту, считали минимальной токсической дозой (MTD).
Титрование вируса гриппа. Тестируемые препараты вносили в лунки 96-луночных планшетов с монослоем клеток MDCK и инкубировали в течение 1 часа. Из исходной вируссодержащей жидкости готовили серию десятикратных разведений на среде МЕМ. Клетки заражали серийными десятикратными разведениями материала от 10 0 до 10 -6 и инкубировали в термостате при 36 °C в атмосфере 5% CO2 в течение 48 часов. По окончании срока инкубации культуральную жидкость переносили в лунки планшета для иммунологических реакций, после чего добавляли равный объем 1% куриных эритроцитов в физиологическом растворе и инкубировали 1 час при комнатной температуре.
Уровень репродукции вируса в лунках панели оценивали по реакции гемагглютинации (РГА) эритроцитов. За титр вируса принимали величину, противоположную десятичному логарифму наибольшего разведения вируса, способного вызвать положительную РГА, и выражали в логарифмах 50% экспериментальной инфекционной дозы вируса (lgEID50). О вирусингибирующем действии препаратов судили по снижению титра вируса в присутствии препарата по сравнению с соответствующими контрольными лунками без препаратов.
Обработка данных. Обработку результатов (расчет 50% эффективных доз) проводили при помощи программы линейной регрессии пакета Microsoft Excel. На основании полученных данных для каждого препарата и для интерферона в каждой комбинации препаратов рассчитывали 50% ингибирующую концентрацию (IC50), т. е. концентрацию соединения, снижающую вирусную продукцию вдвое, а также индекс селективности, представляющий собой отношение MTD к IC50.
Результаты исследования и их обсуждение
Результаты тестирования противовирусной активности испытуемых препаратов против вирусов гриппа и герпеса суммированы в табл. 1–4.
С учетом уровня токсичности были рассчитаны индексы селективности, показывающие, во сколько раз уровень цитотоксичности превосходит уровень противовирусной активности для каждой комбинации. По этому показателю оптимальной комбинацией, превосходящей все остальные, оказалась комбинация интерферона с таурином, превосходящая интерферон в виде монопрепарата примерно в полтора раза в случае вируса гриппа и в шесть раз — в случае вируса герпеса.
Для выяснения вопроса о наличии противовирусной активности у самих препаратов антиоксидантов в отдельной группе опытов были изучены вирусингибирующие свойства антиоксидантов. Результаты экспериментов суммированы в табл. 5.
Как следует из представленных результатов, по уровню токсичности антиоксиданты в виде монопрепаратов существенно не отличались от антиоксидантов в составе комбинаций с интерфероном. В то же время два из них — таурин и Унитиол — обладали прямой противовирусной активностью, которая была более выраженной у таурина. Уровень ее был несколько ниже, чем в комбинации с интерфероном, что позволяет предполагать синергидное действие этих препаратов при сочетанном применении.
Выводы
С учетом полученных результатов представляется целесообразным проведение экспериментов по изучению противовирусной активности и цитопротективного действия рассмотренных в настоящей работе комбинаций на животных моделях вирусных инфекций — летальной гриппозной пневмонии и летального герпетического энцефалита. В таких условиях могут быть реализованы как прямые противовирусные эффекты препаратов, как показано в настоящем исследовании, так и опосредованные эффекты, требующие для своего проявления взаимодействия клеточных субпопуляций и наличия иных, не прямых вирусных факторов патогенности, которые есть при инфекции в целостном организме и отсутствуют в гомогенной клеточной культуре.
Литература
- Васильев А. Н. Оценка влияния антиоксидантов на специфическую противовирусную активность интерферона альфа-2b человеческого рекомбинантного в отношении вируса простого герпеса в культуре клеток // Антибиотики и химиотерапия. 2010, № 7, с. 20–25.
- Васильев А. Н., Дерябин П. Г., Галегов Г. А. Противовирусная активность антиоксидантов и их комбинаций с интерфероном альфа-2b человеческим рекомбинантным в отношении вируса гриппа птиц A/H5N1 // Цитокины и воспаление. 2011, т. 10, № 2, с. 32–36.
- Зайцев А. А., Алпенидзе Д. Н., Салафет О. В., Синопальников А. И. Терапевтическая эффективность препаратов интерферона в лечении острого бронхита // Фарматека. 2011, № 5, с. 80–85.
- Горелов А. В., Грачева Н. М., Феклисова Л. В., Погорелова О. О. Результаты сравнительного исследования эффективности и безопасности препаратов интерферона-альфа в суппозиториях у детей, больных острыми респираторными вирусными инфекциями // Инфекционные болезни. 2009, № 3, с. 40–47.
- Scholtissek C., Quack G., Klenk H. D., Webster R. G. How to overcome resistance of influenza A viruses against adamantane derivatives // Antiviral Res. 1998; 37: 83–95.
- Woodhead M., Lavanchy D., Johnston S., Colman P., Fleming D. Neuraminidase inhibitors: progress in the management of influenza // Int J Clin Pract. 2000, Nov; 54 (9): 604–610.
- Mancuso C. E., Gabay M. P., Steinke L. M., Vanosdol S. J. Peramivir: an intravenous neuraminidase inhibitor for the treatment of 2009 H1N1 influenza // Ann Pharmacother. 2010, Jul-Aug; 44 (7–8): 1240–1249.
- Зайцев А. А., Клочков О. И., Горелов А. В. Острые респираторные вирусные инфекции: перспективы противовирусной терапии // Вестник семейной медицины. 2009, № 5, с. 4–11.
- Горелов А. В., Феклисова Л. В., Грачева Н. М., Каннер Е. В., Погорелова О. О., Целипанова Е. Е., Ше Ю. Ф., Черняева Е. В. Иммунотропная терапия острых респираторных вирусных инфекций в педиатрической практике — опыт клинического применения препаратов интерферона альфа // Consilium Medicum. Педиатрия. 2010, № 1, с. 72–80.
- Горелов А. В., Феклисова Л. В., Плоскирева А. А., Мескина Е. Р., Литвинчук О. А., Черняева Е. В. Комплексная терапия вирусной диареи у детей — первые результаты открытого сравнительного рандомизированного клинического исследования препаратов интерферона // Педиатрическая фармакология. 2011, т. 8, № 4, с. 106–114.
- Горелов А. В., Феклисова Л. В., Грачева Н. М., Алпенидзе Д. Н., Линькова Ю. Н., Салафет О. В., Черняева Е. В. Экзогенная интерферонизация как аспект этиопатогенетической терапии острых респираторных вирусных инфекций // Фарматека. 2011, № 15, с. 77–85.
А. А. Штро
А. В. Слита, кандидат биологических наук
Л. А. Карпинская
А. В. Галочкина
В. В. Зарубаев, кандидат биологических наук
ФГБУ НИИ гриппа Минздравсоцразвития России, Санкт-Петербург
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, но специальные лекарства могут блокировать его на различных этапах.
В случае с ВИЧ это выглядит так.

На первом этапе (цифра 1 на схеме) вирус проникает в клетку.
На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
(На этом видео можно увидеть как протекает этот и другие этапы репликации вируса в клетке)
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме).
На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин).
Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы.
Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы (ингибиторы протеазы), включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Читайте также:

