Изготовление вакцины коронавируса
Обновлено: 26.04.2024
Вторая волна коронавируса набирает силу как в России, так и во многих других странах. К счастью, большая часть людей болеет бессимптомно или легко. Однако так везет не всем: вирус, получивший научное название SARS-CoV-2, способен не только провоцировать иммунную систему заболевшего убивать или серьезно повреждать его организм в острой фазе заболевания, но также может вызывать долго длящиеся осложнения — так называемый долгий ковид.
Не исключено, что долгий ковид может быть вызван аутоиммунными реакциями, спровоцированными вирусом, и/или связан с тем, что вирус способен не только выживать, но и активно воспроизводиться в кишечном тракте у некоторых уже выздоровевших пациентов, выписанных из больницы с отрицательными тестами ПЦР [4].
Еще одна крайне неприятная характеристика вируса — его высокая заражающая способность, начинающая проявляться за два дня до возникновения симптомов у тех, кто уже заразился [5]. Таким образом, коронавирус может распространяться невидимо и незаметно, как угарный газ. Те люди, которые еще не знают, что заразились, уже способны заражать других при коммуникациях на близком расстоянии.
Нет сомнений, что для борьбы с эпидемией, вызванной таким непредсказуемым и опасным вирусом, нужна вакцина. Поэтому в настоящее время ее разработка и успешное внедрение становятся особенно актуальной и важной задачей. По технологии производства все вакцины можно разделить на следующие категории: 1) основанные на убитом вирусе; 2) основанные на аттенуированном вирусе; 3) векторные; 4) белковые субъединичные; 5) пептидные и 6) генетические. К последним можно отнести вакцины, основанные на ДНК или РНК, которые кодируют вирусный белок-антиген [6].
В первой части статьи речь пойдет только о двух категориях вакцин, а именно генетических и векторных. Начнем с генетических. Недавно бизнес-объединение двух компаний — BioNTech и Pfizer — объявило о том, что по предварительным результатам анализа провакцинированных людей вакцина эффективно предотвращает заболевание в 90% случаев [7].
Пожалуй, одно из достоинств вакцин, которые разрабатывают компании, перечисленные выше, — то, что они не содержат последовательностей векторного вируса. (О векторных вакцинах и их сравнительных достоинствах по отношению к другим вакцинам речь пойдет ниже.) Соответственно, при применении генетических, а не векторных вакцин в организме вакцинируемого не образуется белков-антигенов, кодируемых векторными вирусами. На эти белки-антигены векторного вируса может вырабатываться иммунитет параллельно с выработкой защитной иммунной реакции на антиген вируса SARS-CoV-2.
Такой иммунитет, если он уже предсуществует, ограничивает эффективность первичного вакцинирования векторными вакцинами. Также иммунитет на векторные антигены, выработанный после вакцинирования именно векторными вакцинами, может свести на нет эффективность вторичного вакцинирования, которое, возможно, будет необходимо в случае кратковременности иммунитета, выработанного на вирусный антиген. Не исключено, что иммунитет от вакцины ослабнет — и через год или два после первой вакцинации потребуется вторая.
В то же время недостатком мРНКовых вакцин является необходимость их хранения в глубокой заморозке — −80°C и ниже, а также обязательность их транспортировки в сухом льду. Хотя если верить недавним пресс-релизам компании CureVac [11], эта проблема может быть решена. Так, сообщается, что вакцина производства CureVac может храниться около суток при комнатной температуре и долгое время — в обычном холодильнике.
У векторных вакцин есть некоторые достоинства по сравнению с вакцинами на основе мРНК. В лиофилизированной (высушенной) форме они не требуют постоянного хранения в глубокой заморозке (−80°C). Кроме того, теоретически за счет дополнительного присутствия векторных последовательностей они могут вызывать более длительный иммунитет по сравнению с мРНК вакцинами. Хотя пока что более длительный иммунитет векторных вакцин по сравнению с генетическими — это только предположение, которое требует экспериментального подтверждения.
При необходимости вторичного применения вакцины для поддержания активного иммунитета будет, вероятно, более эффективна вакцина, сделанная на основе другой векторной последовательности. В этом случае удастся избежать мешающей роли иммунитета на сам вектор от первой вакцинации. То есть для создателей вакцин оптимально иметь набор векторных последовательностей, которые происходят из разных апатогенных вирусов человека или животных вирусов, не способных заражать человека. О наборе таких вирусов, используемых современными исследователями в качестве векторов, будет рассказано во второй части статьи.
Вакцины на аденовирусной основе разрабатываются и находятся в последней фазе клинических испытаний не только в России. Речь идет о компании Johnson and Johnson, объединении University of Oxford / AstraZeneca и нескольких китайских фармацевтических компаниях [14, 15].
В то же время Россия совместно с объединением University of Oxford / AstraZeneca собирается производить векторную вакцину в Новосибирске; основу этого вектора составляет аденовирус шимпанзе. О сотрудничестве и о планах совместного производства недавно сообщил посол России в Лондоне [17]. Не совсем понятно, почему возможности масштабирования производства в Новосибирске существуют для производства импортной аденовирусной вакцины, но отсутствуют для собственной. Какая-то нестыковка!
Предварительные испытания вакцины в Китае, проведенные на нескольких сотнях добровольцев, показали, что она провоцирует высокий уровень нейтрализующих антител у большинства провакцинированных и при этом не вызывает слишком серьезных побочных эффектов. Редкими нежелательными эффектами бывали высокая температура и боль в месте укола [20].
Насколько быстро вирус может изменить свое обличье так, что вакцина ослабнет или перестанет работать? Этот вопрос чрезвычайно волнует создателей вакцин, и его активно изучают. Недавно международный коллектив из более чем 60 авторов опубликовал препринт, затрагивающий эту тему. В работе идет речь о новой мутации, вызывающей аминокислотную замену N439K. Аминокислота расположена в рецептор-связывающем мотиве рецептор-связывающего домена шиповидного белка коронавируса. Согласно авторам препринта, вирус с этой заменой имеет тенденцию к распространению и преобладанию над другими вариантами. Авторы сообщают, что вариант вируса с аминокислотной заменой N439K возник независимо дважды, в обоих случаях образуя множественные потомственные варианты из более чем 500 геномных последовательностей. По состоянию на октябрь 2020 года мутация обнаруживается в 12 странах, и вариант вируса с этой заменой является уже вторым по частоте встречаемости.
Самое неприятное в этой мутации то, что 15% моноклональных антител из коллекции исследователей и поликлональные антитела из сывороток выздоровевших людей связываются с новым вариантом вируса хуже, чем с исходным вариантом. Связывающая способность некоторых моноклональных антител падает больше чем в два раза. Естественно, падает и способность ряда антител нейтрализовать вирус.
Кроме перечисленных выше вакцинных разработок, конечно же, есть много других — как в России, так и в мире. Об их достоинствах, недостатках, препятствиях к широкомасштабному применению, а также о перспективах совершенствования я расскажу в следующей части статьи.
P.S. Пока верстался номер, пришла новость о том, что компания Модерна (Moderna, Inc.) объявила о промежуточных результатах своих клинических исследований. Согласно пресс-релизу компании, эффективность мРНК вакцины, которую она разрабатывает против COVID-19, составляет более 94%.
Всего в клиническом испытании Модерны было задействовано более 30 000 участников, которые были разделены поровну между контрольной и опытной группами. В группе плацебо заболело 90 участников, а в группе вакцинированных всего 5. Был также проведен анализ 11 особенно тяжелых случаев заболевания. Все тяжело заболевшие оказались в группе плацебо. Побочные эффекты вакцинации включали боль в месте инъекции (2,7%), усталость (9,7%), боль в мышцах (8,9%), боль в суставах (5,2%). Вакцину Модерны можно хранить при −20°C, что ее выгодно отличает от мРНК-вакцины Пфайзера, которая требует хранения при температуре −80°C [22].

Об эксперте: Павел Волчков — кандидат биологических наук, вирусолог, генетик, заведующий Лабораторией геномной инженерии Московского физико-технического института (МФТИ).
Существует много разных подходов к созданию вакцины от COVID-19. Она может быть вирусной, инактивированной, векторной, на основе нуклеиновых кислот. Какая из них окажется самой эффективной — пока никто точно не знает. Если вы разработчик, то можете выбрать любую и принять участие в большой мировой гонке по созданию долгожданной прививки. А можете, как ученые из МФТИ, сознательно отказаться от возможных бенефитов и неспешно заняться разработкой экспериментальной вакцины нового типа.
Павел Волчков:
Аденовирусы — ДНК-вирусы. Относятся к группе острых респираторных вирусных инфекций (ОРВИ) и характеризуются поражением слизистых оболочек верхних дыхательных путей, конъюнктив, лимфоидной ткани. Большинство аденовирусных инфекций представляют собой легкую форму инфицирования. Существует семь видов аденовирусов человека (от А до G) и 57 серотипов. Подразделение на серотипы связано с различными способами заражения.
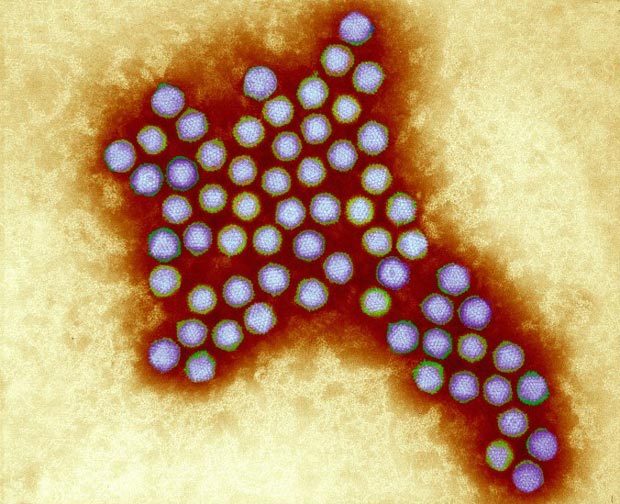
В качестве векторов для вакцин, аденовирусы применяются довольно давно. Эти вирусы хорошо изучены. Согласно данным сайта
Антигены — это любые вещества, содержащиеся в микроорганизмах и других клетках (или выделяемые ими), которые несут в себе признаки генетически чужеродной информации, и которые потенциально могут быть распознаны иммунной системой организма.
Павел Волчков:
Вакцина МФТИ: в чем инновация?
Поскольку у аденовирусных векторов есть существенные недостатки, ученые из МФТИ выбрали другие вирусы в качестве вектора — аденоассоциированные вирусы. Что любопытно, раньше никто в мире не использовал их в таком качестве.
Аденоассоциированные вирусы — мелкие ДНК-содержащие вирусы. Размер частиц 22-24 нм. Размножаются только в присутствии аденовирусов. Способны инфицировать клетки человека и некоторых других приматов. Аденоассоциированный вирус, по-видимому, не вызывает заболеваний у человека, поэтому провоцирует слабый иммунный ответ.
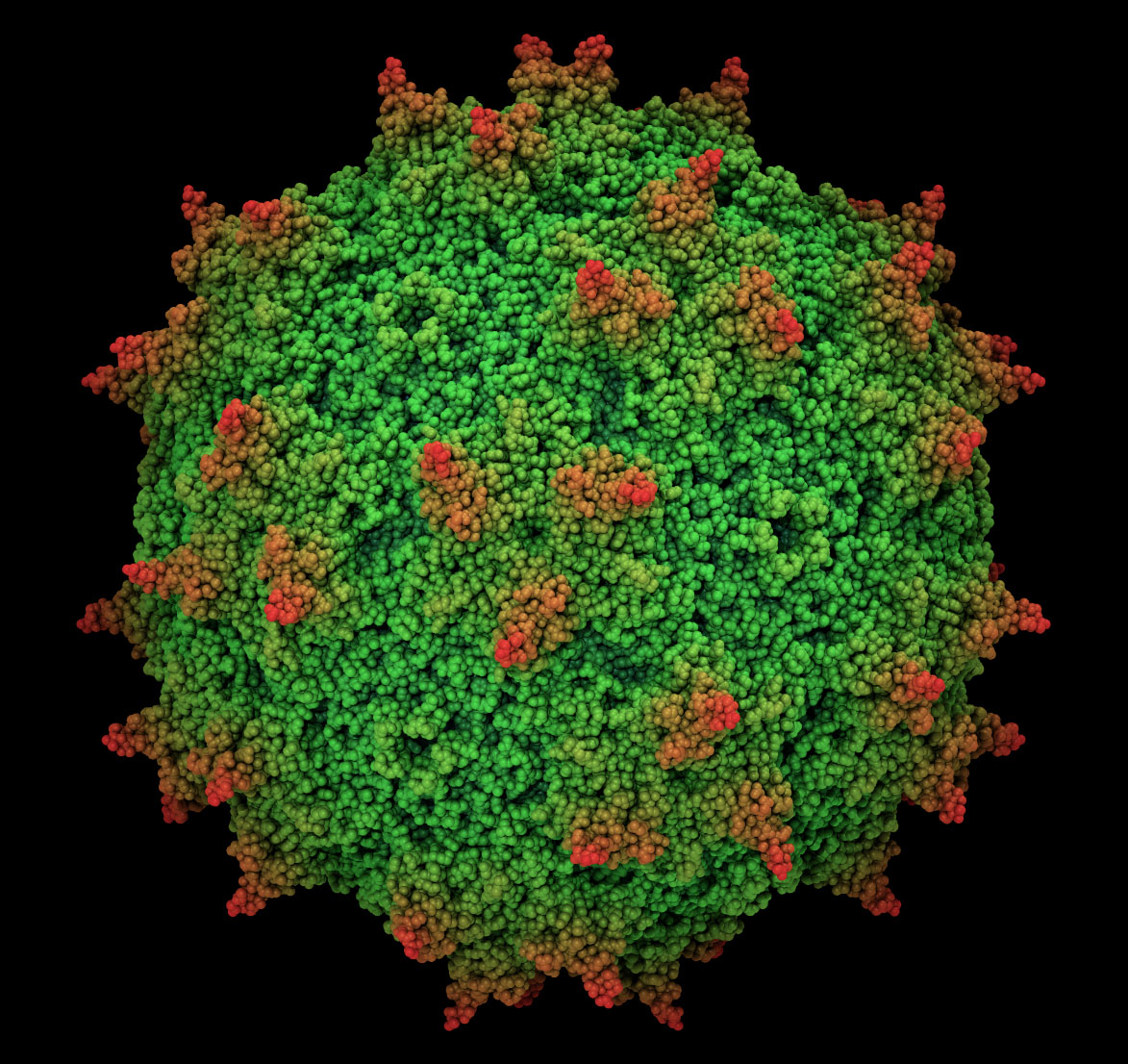
По аденоассоциированным вирусам также накоплена внушительная клиническая база. На сайте
«Мы с самого начала понимали, что сможем не только разработать вакцину, но и масштабировать ее производство. То есть произвести столько доз, сколько потребуется или столько, сколько захотим. В мире существует огромное количество аутсорсинговых компаний, которые по GMP сделают вам любое количество доз препарата.
Good Manufacturing Practice (GMP) — правила, которые устанавливают требования к организации производства и контроля качества лекарственных средств для медицинского и ветеринарного применения.
Вакцина МФТИ будет эффективна против разных штаммов SARS-CoV-2
Изначально ученые хотели разработать вакцину, которая бы вырабатывала иммунитет практически ко всем поверхностным белкам вируса SARS-CoV-2. А не только к S-белку, как это делают большинство разработчиков вакцин по всему миру (включая НИИ им. Гамалеи). Но в итоге разработчики остановились на конечном числе компонентов. Ими стали S-белок, Е-белок и М-белок.
Павел Волчков:
Если текущая разработка покажет свою эффективность и безопасность, ученые планируют пойти еще дальше и разработать вакцину, которая будет содержать не только различные компоненты SARS-CoV-2, но еще и вируса гриппа или других сезонных респираторных вирусов. То есть объединить в одной вакцине генетический материал от самых разных сезонных патогенов. По мнению ученых из МФТИ, такие ассемблированные, поливалентные вакцины могли бы готовить людей каждый сезон к новому остро-респираторному вирусному нашествию.
Павел Волчков:
Массовая вакцинация от COVID-19 может не понадобиться?
Павел Волчков уверен, что сама по себе гонка по созданию вакцин от короновируса уже не имеет смысла. Он уверен, что к тому моменту, когда российские вакцины будут испытаны и наработаны для массовой вакцинации населения, потребность в них может отпасть. Ученый считает, что уже к осени мы все, так или иначе, переболеем COVID-19 и получим естественный иммунитет.
Исследование показало, что лишь у небольшой части шведов в крови присутствовали антитела, но примерно треть граждан имела ту самую клеточную память. Это говорит о том, что существенная часть популяции шведов в той или иной форме переболела COVID-19 или имела непродолжительный контакт с вирусом. В последнем случае большой продукции антител не происходит, но благодаря Т-лимфоцитам формируется иммунологическая память к COVID-19.
Павел Волчков:
Не менее 35 лабораторий по всему миру пытаются создать вакцину от коронавируса. За прошедшую неделю несколько из них объявило о планах начать клинические испытания. Кто создает вакцину и сколько им еще нужно времени — в обзоре РБК

Как создаются вакцины
В мире не менее 35 лабораторий и институтов занимаются разработкой вакцины от коронавируса. За прошедшую неделю несколько компаний объявило о планах начать клинические испытания первой фазы уже имеющихся у них прототипов. При этом большинство мировых экспертов и Всемирная организация здравоохранения (ВОЗ) сходятся на том, что для разработки вакцины потребуется до полутора лет.
Для создания вакцины нужно определить компоненты, из которых она будет состоять. Существует несколько подходов к их подбору. Можно использовать безопасные штаммы живых бактерий или вирусов (аттенуированные), убитые (инактивированные) штаммы или производить вакцину без непосредственного возбудителя (рекомбинантные). После определения компонентов, куда кроме антигенов возбудителя могут входить дополнительные вещества, которые усилят иммунный ответ организма, разработчики получают так называемый кандидатный вакцинный препарат.
Далее следует этап его исследования, подразделяемый на доклинические и клинические исследования. Первые проходят in vitro и in vivo, то есть вне живого организма и на животных. Среди требований к доклиническим исследованиям есть условие, что как минимум одно животное не должно быть грызуном. Сами лабораторные животные при этом должны быть чувствительны к возбудителю. На данном этапе должна быть продемонстрирована безопасность вакцины, а также необходимо проверить иммунный ответ: организм животного должен вырабатывать антитела к вакцине. Кроме того, важно проверить ее протективность, то есть удостовериться, что вакцинация обеспечивает защиту и к возбудителю у животного сформировался иммунитет.
На каком этапе работы по вакцине от COVID-19
В США первой компанией, начавшей клинические испытания, стала Moderna. Она приступила к тестам 16 марта при исследовательском центре Kaiser Permanente Washington Health Research Institute. В рамках исследования две дозы препарата с интервалом в месяц введут 45 добровольцам в возрасте от 18 до 55 лет. Прототип получил название mRNA-1273. Особенность подхода Moderna заключается в том, что в вакцине нет возбудителя — только кусочек его генетического кода. Разработкой вакцины в США занимаются также Arcturus Therapeutics, Johnson & Johnson и Inovio Pharmaceuticals in the US.
BioNTech планирует начать клинические испытания уже в апреле этого года. Компании помогают в разработке китайская Fosun Pharma и американская Pfizer.
В Китае в ближайшее время также должны начаться клинические испытания. Прототип вакцины, названный Ad5-nCoV, разработала Академия военно-медицинских наук Китая совместно с гонконгской компанией CanSino Biologics. 16 марта они получили разрешение от властей КНР на проведение тестов на людях. Исследователи собираются ввести вакцину 108 здоровым гражданам от 18 до 60 лет в трех разных дозировках, свидетельствует запись в национальном реестре клинических испытаний. Тесты будут проводиться в лаборатории в Ухане.
В Великобритании первые клинические испытания вакцины под названием ChAdOx1 начнутся в следующем месяце — прототип разрабатывает группа ученых из Оксфордского университета. В марте должны начаться доклинические тесты на животных, они пройдут в лаборатории Портон-Даун под Солсбери.
18 марта о начале испытаний сообщила и Всемирная организация здравоохранения.
В свою очередь, США, как стало известно из публикации немецкого издания Welt am Sonntag, пытались за $1 млрд перекупить вирусологов CureVac и перевезти на свою территорию штаб-квартиру компании из немецкого Тюбингена. Предложение о продаже главе CureVac Даниэлю Маникелле было сделано на встрече американского президента Дональда Трампа с топ-менеджерами фармацевтических компаний 2 марта в Белом доме. 11 марта Маникелла неожиданно и без объяснения причин покинул CureVac, а вместо него председателем правления компании стал создатель компании Ингмар Хёрр, который отошел от управления в 2018 году.
Планы администрации США вызвали негативную реакцию руководства ФРГ. Министр экономики страны Петер Альтмайер и глава МВД Хорст Зеехофер подтвердили, что американцы пытались купить CureVac. Больше всего немцев возмутил тот факт, что исследователям предлагалось сделать свои наработки доступными только для американцев. Власти Германии не позволят, чтобы другие страны присваивали себе исключительные права на наработки немецких вирусологов по вакцине от коронавируса, заявил глава МИД ФРГ Хайко Маас.
Чего добились российские ученые


№ 1. Международные этапы разработки вакцины
Согласно международным стандартам, все вакцины должны пройти следующие этапы разработки:
- доклиническое тестирование — в этот период препарат тестируют на животных;
- фаза № 1 — исследования проводятся на первых добровольцах (обычно их немного), чтобы убедиться, что вакцина стимулирует иммунную систему;
- фаза № 2 — испытания проводятся на сотнях людей, в том числе на детях и пожилых людях;
- фаза № 3 — количество добровольцев исчисляется тысячами, половине вводят плацебо, чтобы проверить разницу при заражении привитых и непривитых людей;
- утверждение — регулирующие органы проверяют результаты испытаний.
После получения лицензии на вакцину исследователи продолжают наблюдать за людьми, которые ее получили, чтобы убедиться, что прививка безопасна и эффективна.

№ 2. Российские этапы разработки вакцин

№ 3. Типы вакцин
По данным ВОЗ, сейчас в разработке находятся несколько типов потенциальных вакцин.

№ 4. Кто лидирует в гонке исследований
На данный момент есть три лидера. Первыми итоги подвели специалисты из совместного проекта американской компании Pfizer и немецкой BioNTech (совместно с китайской Fosun Pharma). Согласно данным производителей, во время испытаний продукт показал более чем 90-процентную эффективность.
В ближайшие дни закончатся последние исследования вакцины китайской компании Cansino Biological, а также вакцины англо-шведской AstraZeneca.
№ 5. Что известно о лидерах гонки
Коэффициенты эффективности вакцин, превышающие 90%, — это пока предварительные данные. Цифра может измениться. Однако уже сейчас понятно, что препараты преодолеют необходимый для регистрации порог в 50% и смогут получить лицензию (или — как в случае с российской вакциной — уже ее получили).
Последующие итоги исследований будут обнародованы в конце этого или начале следующего года. Это означает, что после решения всех бюрократических вопросов, массовые вакцинации по всему миру начнутся в 2021 году. В России этот процесс, по словам президента Владимира Путина, может начаться раньше.

№ 6. Как работают РНК-вакцины
РНК-вакцины, к которым относятся разработки Pfizer/BioNTech и американской Moderna, работают следующим образом: ученые вводят в человеческие клетки фрагменты РНК — это макромолекулы, которые наравне с ДНК и белками играют решающую роль в кодировании, прочтении и регулировки генов. У некоторых вирусов РНК служит носителем генетической информации. Она провоцирует клетку производить большое количество белков вируса. В ответ организм начинает вырабатывать антитела и Т-лимфоциты, главная задача которых выявлять и обезвреживать инфицированные клетки.
№ 7. Как быстро вакцина Pfizer/BioNTech поступит в продажу и кто сможет ей воспользоваться
Производство вакцины началось еще до объявления результатов исследований. До конца этого года компания планирует произвести 50 млн доз вакцины, а в 2021 году — 1,3 млрд.
Количество людей, которые смогут воспользоваться препаратом, будет в два раза меньше, так как вводить его нужно будет два раза с разницей в 21 день. Заказы на вакцину уже оформили Великобритания (30 млн человек), Евросоюз (200 млн) и США (100 млн).

№ 8. Как финансируются разработки вакцин
В апреле 2020 года Еврокомиссия запустила глобальный сбор средств на разработку вакцины Global Response. В марафоне приняли участие Франция, Германия, Япония, Канада, Саудовская Аравия, Великобритания, Израиль, Греция. В результате удалось собрать €15,9 млрд. Суть проекта: общими усилиями создать прививки для всех.
США хоть и внесли в эту сумму $545 млн, параллельно запустили свою кампанию Warp Speed, куда направлено $2 млрд с целью быстрее разработать вакцину и предоставить ее прежде всего жителям Соединенных Штатов. Россия, КНР и Индия общий сбор денег проигнорировали и занимаются разработками самостоятельно.

№ 9. Сколько вакцин разрабатывается в России

№ 10. Как работают российские векторные вакцины

№ 12. Как долго продлится эффект от вакцины
Точные данные о том, сколько длится действие вакцины, можно будет получить по окончании исследований. Однако уже есть свидетельства, что антитела будут сохраняться в организме не дольше 5 месяцев. Первыми об этом заявили врачи из медицинского центра Mount Sinai в США. А по мнению британских специалистов, быстрее всего антитела теряют пациенты, которые бессимптомно перенесли болезнь, и пожилые люди.
К счастью, иммунитет могут поддерживать не только антитела, но и Т-клетки.
№ 13 Что такое Т-клетки и как они помогают организму бороться с вирусами
Т-лимфоциты — это иммунные клетки. Их главная задача — найти и обезвредить зараженные клетки организма. Они остаются в крови в течение многих лет и защищают здоровых людей, чем пользуются создатели вакцин. Специфические Т-клетки COVID-19 ученые обнаружили в образцах крови, которые были в их распоряжении еще до начала пандемии. Это означает, что люди уже сталкивались с родственными коронавирусами до 2020 года.
Другое дело, что при тяжелом течении болезни Т-клетки исчезают из организма. Отчего так происходит, ученым предстоит выяснить. А вот почему пожилые люди хуже реагируют на коронавирус, ясно уже сейчас: с возрастом организм вырабатывает все меньше Т-лейкоцитов.
№ 14. Условия хранения вакцин
Cоздатели вакцины Moderna предлагают схожие условия хранения: полгода при температуре -20°C.
Препарат Pfizer/Biotech на основе ДНК — гораздо более хрупкий. Максимальные сроки его хранения — 10 дней при температуре -70°C. Что может осложнить условия его перевозки. В связи с этим компания разработала специальные контейнеры вместимостью от 1 тыс. до 5 тыс. вакцин и пообещала установить максимальный срок транспортировки в три дня.

№ 15. Какие категории населения первыми получат вакцину
Каждая страна решает этот вопрос по-своему. Представитель ВОЗ Сумья Сваминатан во время онлайн-конференции сообщила, что в первую очередь препарат получат врачи, те, кто напрямую контактирует с вирусом, и пожилые люди. Молодым и здоровым, скорее всего, придется ждать 2022 года.

Новость
Есть шанс, что вакцина от коронавируса будет доступна уже в начале 2021 года
Автор
Редакторы
Итак, давайте поговорим о разработке вакцин, ведь для реализации таких планов все должно сработать идеально. Вот ссылка на хороший обзор вакцин против коронавируса, опубликованный в Nature Reviews Drug Discovery [1]. На сайте ВОЗ размещен официальный список вакцин, а BioCentury постоянно обновляет в открытом доступе сводки о вакцинах и других методах лечения, которые находятся в клинических или доклинических исследованиях. Только что они опубликовали превосходный обзор о вакцинах, который я рекомендую прочитать после моего поста.
Обзор в Nature Reviews Drug Discovery упоминает 115 (!) программ вакцинации, из которых по 37 нет никакой дополнительной информации, а 78, безусловно, реальны. Из этих 78 пять уже вошли в клинические исследования, и число их будет быстро расти. Это вакцина mRNA1273 от компании Moderna, которая, как следует из названия, является мРНК-вакциной, и INO4800 от компании Inovio, представляющая собой ДНК-плазмиду. Также есть две клеточные вакцины из Шэньчжэньского геноиммунного медицинского института: LV-SMENP-DC, вакцина из дендритных клеток, модифицированных лентивирусными векторами для экспрессии вирусных белков, и вакцина из искусственных антигенпрезентирующих клеток (aАРС). И, наконец, есть более традиционная рекомбинантная белковая вакцина Ad5-nCoV от компании CanSino.
Давайте рассмотрим, что всё это значит. Как видно из приведенного перечня, подходы к созданию вакцины весьма разнообразны, и это еще не весь спектр. Если обратиться к доклиническим кандидатам, мы увидим также вирусоподобные частицы, вирусные векторы (как реплицирующиеся, так и не реплицирующиеся), живые аттенуированные вирусы, инактивированные вирусы и многое другое. Мы видим, что существует множество способов вызвать иммунный ответ. Каковы же различия между ними?
Типы вакцин
Следующий класс — вакцины на основе инактивированных вирусов. В этом случае вирусы, даже если вы считаете их живыми существами (я — нет), мертвы. Раньше вирусный препарат для этого нагревали, теперь же это чаще всего делается при помощи дезинфицирующих средств, вызывающих денатурацию вируса, таких как формалин или бета-пропиолактон. Эти вещества изменяют белки вируса так, что вирус уже не может заражать клетки, но не настолько сильно, чтобы они не вызывали иммунный ответ. Это сродни искусству; такую инактивацию необходимо провести и испытать несколько раз, чтобы получить воспроизводимый иммунный ответ и воспроизводимый способ производства неактивного вируса. Как вы понимаете, введение такого инактивированного вируса часто не столь эффективно, как описанный выше подход с живыми ослабленными вирусами, которые заставляют клетки человека самостоятельно производить вирусные белки. Приходится прибегать к старой доброй схеме повторной вакцинации (праймирование и дальнейшее бустирование). К этому типу относятся, например, вакцины против гепатита А и сезонного гриппа.
Еще один распространенный вид вакцины — субъединичная — это отдельный белок, фрагмент белка или субъединицы патогена (при некоторых бактериальных заболеваниях это может быть также токсин, вырабатываемый бактерией). Идея заключается в том, чтобы выбрать белок, который вызывает сильный иммунный ответ. Таким образом, существует множество потенциальных кандидатов на эту роль, и проработка каждого — самостоятельный процесс. Плюсом такого подхода является то, что выбранный белок можно производить рекомбинантно в больших количествах. Конечно, вместо белка можно взять гликопротеин или даже кусочек полисахарида из наружной оболочки патогена, поскольку они могут быть весьма характерными для конкретной бактерии. Самое сложное здесь — получить достаточный иммунный ответ, ведь такие фрагменты могут быть не столь эффективны для запуска выработки антител, как полноценный патоген. Поэтому, как правило, для успешной работы таких вакцин необходимы адъюванты (о них — ниже). Вакцины такого типа применяются против опоясывающего лишая, гепатита В, вируса папилломы человека, менингококка, сезонного гриппа и многих других патогенов.
Аналогично дела обстоят и с мРНК-вакцинами [7]. Концептуально они похожи на ДНК-вакцины, однако вы сразу перескакиваете к этапу мРНК. Я немного писал об этом в посте про CureVac — иммуногенность такого рода препаратов была отмечена как неожиданный побочный эффект в экспериментах, где животным вводили мРНК, и исследователям пришло в голову использовать это свойство для создания вакцин. Как и в случае ДНК-вакцин, на мРНК-вакцину можно получить два вида иммунного ответа: клетки врожденного иммунитета могут распознать последовательность чужеродных нуклеиновых кислот, плавающих вокруг, как признак инфекции, а клетки адаптивного иммунитета выработать к полученным после трансляции мРНК белкам антитела. Одна из задач при таком подходе — ослабить врожденный иммунный ответ и усилить адаптивный, обеспечивающий длительную защиту, которую мы хотим получить при вакцинации. На днях появилась информация о выздоравливающем от COVID-19 молодом пациенте, который в ходе болезни, по-видимому, не выработал антитела против вируса. Это пример подобного рода проблемы: сильный врожденный иммунный ответ может победить вирус, но не дать пациенту выработать долговременный иммунитет против него.
мРНК-вакцины имеют несколько потенциальных преимуществ перед ДНК-вакцинами, а, возможно, и перед всеми описанными типами вакцин. мРНК — это самая простая конструкция из тех, которую можно себе представить, так что при ее использовании нет проблем с иммунным ответом на вектор, который часто препятствует повторному введению других вакцин. Кроме того, мРНК не может интегрироваться в геном клетки организма. На протяжении многих лет большой проблемой с мРНК-вакцинами была стабильность мРНК: ей нужно не деградировать после введения, а эффективно проникать в клетки и транслироваться в белок. На данный момент многие из этих вопросов практически решены путем внесения изменений в саму последовательность РНК и в формуляцию (рецептуру) раствора, в виде которого она находится перед введением. Правда, ДНК-вакцины существуют дольше мРНК-вакцин, но, как уже говорилось, всё еще не дошли до применения у человека. Превзойдут ли их мРНК-вакцины или нас ждет разочарование? В условиях пандемии коронавируса мы выясним это быстрее, чем планировали.
Адъюванты
Есть еще одна ключевая методика вакцинации, которая применима ко всем вышеописанным методам, — использование адъювантов [8]. Очевидно, что основная вещь, которую мы хотим получить при вакцинации, — это устойчивый длительный иммунный ответ, и оказалось, что различные добавки могут способствовать его появлению, играя на равновесии между врожденным и адаптивным иммунными ответами, упомянутыми выше. Идея состоит в том, чтобы получить оптимальный переход от врожденных механизмов иммунитета к адаптивным, а именно к выработке антител. Для быстрого ознакомления с принципами работы иммунной системы можно прочитать этот пост, хотя, конечно, существует много материалов по этому вопросу . Ключевой процесс в данном случае — взаимодействие антигенпрезентирующих клеток и хелперных Т-клеток.
Изучение адъювантов началось с того, что в 20-х годах прошлого века французский ветеринар Гастон Рамон заметил, что при инъекциях лошадям и дальнейшем заборе от них плазмы крови выход антител был выше у животных с развившейся сильной воспалительной реакцией в месте инъекции. Он начал экспериментировать с добавками, вызывающими местную реакцию, включая такое вещество, как тапиока (крахмал из клубней маниока). В то же время британский иммунолог Александр Гленни разрабатывал вакцины против дифтерии и заметил, что те, которые содержали соли алюминия, были гораздо более эффективными. Никто не знал подробностей этих процессов, но и почти столетие спустя соли алюминия всё еще чрезвычайно распространены в производстве вакцин. Чуть больше мы узнали в 90-х годах XX века, когда впервые за многие десятилетия появились новые адъюванты. Так, вакцина GSK против опоясывающего лишая содержит липопротеины, выделенные из бактерий сальмонелл, а также терпеновые гликозиды из чилийского мыльного дерева — такое сочетание оказалось наиболее мощным. Я могу вам сказать, что реакция на них в месте инъекции, особенно после второго введения, выглядит впечатляюще! Опыт GSK в этой области — это то, что они привносят в сотрудничество с Sanofi, упомянутое в начале статьи.
Разработка вакцин против COVID-19: эффективность
Теперь вернемся к общей картине разработки вакцины против коронавируса. Основной вопрос в том, какой из возможных методов наиболее эффективен и безопасен. Это мы узнаем только после тестирования каждого из вариантов на людях. На множестве людей. С терапиями, нацеленными на иммунную систему, нет другого способа это узнать из-за сложности иммунного ответа человека и его широкой вариации в человеческой популяции. Чтобы ускорить процесс, потребуется огромное количество усилий, и некоторые из шагов должны быть выполнены в таком масштабе, который никогда прежде не предпринимался. Еще один момент, который нельзя игнорировать: если мы хотим, чтобы это было сделано так быстро, как хотелось бы, то должны быть предприняты попытки сокращения пути разработки и тестирования.
В связи с этим, одна из причин такого быстрого старта вакцины Moderna заключается не только в том, что разработка мРНК-вакцины может быть по своей природе более быстрой, но и в том, что шаг тестирования ее на животных был полностью пропущен. Отчасти это сделали из-за того, что до сих пор неясно, какая модель животного была бы наиболее информативной. В более раннем посте мы говорили о том, что вирусы SARS и nCoV-19 действительно показывают различия в лабораторных тестах, и мы можем ожидать, что эти различия распространятся и на животные модели. Один из подходов в тестировании на животных заключается в том, чтобы разводить линию лабораторных животных (например, мышей или хомяков) с человеческой формой белка ACE2, который, по-видимому, имеет решающее значение для проникновения вируса. Это может быть полезно, однако будет ли такая животная модель создана действительно вовремя, чтобы помочь при разработке вакцин? Я думаю, некоторые другие кандидатные вакцины пойдут тем же путем, что и Moderna, и полностью пропустят стадию тестирования эффективности на животных. Поверьте мне, это (и не только это) существенно сократит путь тестирования.
К счастью, тестирование эффективности вакцины может быть довольно простым, и оно включает в себя многие вопросы, возникающие и при тестировании антител, такие как:
- Развивается ли у вакцинированного пациента антительный иммунный ответ?
- Насколько много антител образуется?
- Правильного ли они типа, чтобы нейтрализовать вирус?
- Как долго продолжается этот иммунный ответ?
Ответы на первые три вопроса требуют проведения огромной работы прямо сейчас, но я не сомневаюсь, что они будут найдены. Необходимо понять, по каким конечным точкам мы будем измерять эффективность, чтобы быть уверенными, что они удовлетворят регулирующие органы.
Существует обзор 2016 года о процессе разработки стандартной новой профилактической вакцины [10]. Взгляните на длинную, детальную, перекрывающуюся и взаимосвязанную систему клинических испытаний , которые такие вакцины проходили в прошлом, и подумайте, что мы не сможем сделать всё это, если хотим получить вакцину в сроки, указанные в начале поста. В идеале, хотелось бы изучить вопросы эффективности в исследованиях второй фазы у разных групп (возраст, пол, сопутствующее состояние здоровья и набор принимаемых лекарств) с различными графиками дозирования, и тщательно подобрать эти параметры для запуска третьей фазы испытаний. Запустив множество одновременных испытаний вместо последовательных, мы сможем охватить какую-то часть этих проблем, но отнюдь не все. Сейчас разрабатывают по меньшей мере 78 таких препаратов; с каждым шагом их будет все меньше (до поздних стадий доберутся единицы), но организовать подобные исследования будет все еще очень непросто.
Некоторые же вещи не могут быть ускорены никакими способами, известными человечеству. Вопрос о длительности иммунитета является важным как для людей, естественно инфицированных SARS-CoV-2, так и для тех, кто получит вакцину. К сожалению, нет другого способа ответить на этот вопрос, кроме времени, которого в эти дни так не хватает. Существует множество примеров вакцин, защита после которых не держалась так долго, как ожидалось. Я предполагаю, что для начала мы можем получить вакцину первого раунда, защита которой будет длиться не так долго, как хотелось бы, но обеспечит достаточный иммунитет и, соответственно, время для сбора дополнительных данных об оптимизированной версии вакцины.
Разработка вакцин против COVID-19: безопасность
Все вышеописанное подводит нас ко второму вопросу, возникающему для любой новой терапии: безопасность и ее баланс с эффективностью. Это особенно сложный вопрос для любой терапии, нацеленной на иммунный ответ, поскольку сильная иммунная реакция может стоить пациенту жизни. Так, описан синдром Гийена—Барре: организм реагирует на антиген, появляющийся при вирусной инфекции или вакцинации, принимая миелиновые оболочки вокруг нервов также за враждебные белки и начиная их разрушать. При этом большинство людей выздоравливают, однако некоторые умирают. По приблизительным оценкам, даже вакцина против сезонного гриппа может убить примерно 1 на 10 миллионов человек, хотя понятно, что в случае отсутствия вакцинации умрет гораздо больше людей. Эпидемия свиного гриппа 1976 года показывает, что может произойти, если баланс будет рассчитан неправильно. Данной проблемы нельзя избежать полностью: огромные индивидуальные особенности иммунной системы каждого человека означают, что подобные серьезные события никогда не могут быть исключены, если вакцинировать много людей.
Разработка вакцин нацелена на то, чтобы ввести их миллионам, даже миллиардам людей, которые в настоящее время не больны, чтобы защитить их от болезней, не причиняя при этом больше вреда, чем сама болезнь. Я не сомневаюсь, что вовлеченные компании и регулирующие органы будут делать все возможное для решения вопросов безопасности, но вакцина, получающая EUA в начале следующего года, хм.
Разработка вакцин против COVID-19: логистика
Я думаю, что масштабирование и производство вполне могут стать ахиллесовой пятой для срыва упомянутых ранее сроков обеспечения готовности вакцин, поэтому будут предприняты огромные усилия, чтобы сразу начать работу над этими проблемами. Вот почему, например, Билл Гейтс уже заранее заявил о готовности финансировать фабрики для производства до семи типов вакцин. Производство вакцин с живым, аттенуированным вирусом, рекомбинантным белком и нуклеиновыми кислотами обеспечивается совершенно разными методиками и формуляциями и, поскольку мы не знаем, какой вариант в итоге будет выбран, готовность к реализации производства любого из них может оказаться единственным способом решения этой проблемы. Компания Pfizer и другие уже заявили, что будут работать над налаживанием производства еще до того, как появятся данные об эффективности, что, разумеется, не является обычной практикой. Я думаю, что мы так или иначе получим эффективную вакцину против коронавируса, хотя она, конечно, не будет охарактеризована так тщательно, как обычно. Думаю также, что мы уже согласны пойти на компромисс в вопросах безопасности. Однако масштабирование производства вакцины может стать еще более серьезной проблемой, и по мере развития событий мы будем следить за неприятными сюрпризами в этом процессе.
То, чему мы сейчас свидетели — это беспрецедентный вызов, и, будем надеяться, мы никогда больше не увидим ничего подобного.
Читайте также:

