Как быстро мутирует вирус гриппа
Обновлено: 24.04.2024
Георгий Александрович Базыкин — кандидат биологических наук, заведующий сектором молекулярной эволюции в Институте проблем передачи информации им. А. А. Харкевича РАН, ведущий научный сотрудник лаборатории эволюционной геномики факультета биоинженерии и биоинформатики МГУ им. М. В. Ломоносова. Занимается изучением различных вопросов биологической эволюции с использованием методов геномики и биоинформатики.
Юрий Эдуардович Стефанов — кандидат биологических наук, научный сотрудник Института молекулярной биологии РАН им. В. А. Энгельгарта и научный консультант студии научного дизайна Visual Science. Область научных интересов — эволюция мобильных генетических элементов, трехмерное компьютерное моделирование вирусных частиц.
В общественном сознании закрепилось довольно легкомысленное отношение к гриппу. Действительно, зачастую его симптомы не тяжелее простудных, да и беспокоит он нас не дольше недели, причем проходит обычно без всякого лечения. Однако история взаимодействий человека и вируса гриппа требует более серьезного подхода к этому патогену. Достаточно вспомнить, что одни из самых страшных пандемий прошлого века были вызваны этим вирусом * . Да и обычный сезонный грипп далеко не безвреден: по оценкам Всемирной организации здравоохранения, ежегодно от него и связанных с ним осложнений умирают сотни тысяч человек (в первую очередь, пожилые люди, младенцы и страдающие хроническими заболеваниями), а в годы тяжелых пандемий — миллионы. По числу унесенных жизней среди инфекционных заболеваний грипп уступает, пожалуй, только ВИЧ. Основная проблема профилактики и лечения гриппа связана с тем, что вирус очень быстро меняется, и каждый год мы имеем дело с его новыми формами, поведение которых далеко не всегда можно предсказать. Очередным шагом на пути к пониманию изменчивости вируса гриппа стал компьютерный анализ последовательностей аминокислот в белках вируса и нуклеотидов в его геноме.
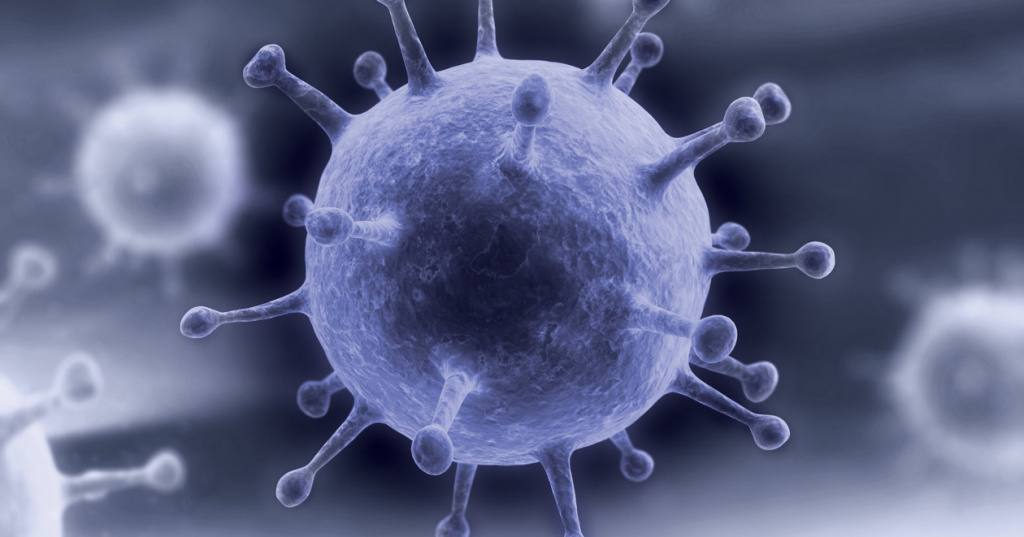
Первая в мире полная достоверная модель вируса гриппа A/H1N1 с атомным разрешением, созданная в рамках проекта Viral Park компании Visual Science при участии Национального центра биотехнологии в Мадриде. Цель проекта — построение научно достоверных 3D-моделей распространенных вирусов человека с максимальной детализацией. Специалисты Visual Science собирают воедино данные огромного количества работ по молекулярной биологии, вирусологии и кристаллографии вирусов, мнения экспертов ведущих научных центров мира и результаты молекулярного моделирования, полученные научным отделом компании. Модель в значительной степени построена на основе данных, опубликованных исследовательскими коллективами под руководством: Хуана Ортина (Испанский национальный центр биотехнологий, Мадрид, Испания), Такеши Нода (Университет Токио, Япония), Роба Ригро (Отдел взаимодействий вируса и клетки, Гренобль, Франция) и Питера Розенталя (Национальный институт медицинских исследований, Лондон, Великобритания). Точное строение генома вируса гриппа удалось смоделировать благодаря сотрудничеству с Хайме Мартин-Бенито (Испанский национальный центр биотехнологий, Мадрид, Испания), группа которого добилась уникальных результатов в описании упаковки вирусного генетического материала. Создатели модели: Иван Константинов (руководитель проекта), Юрий Стефанов (научный консультант), Анастасия Бакулина (ведущий молекулярный моделлер), Дмитрий Щербинин (молекулярный моделлер), Александр Ковалевский (3D-моделлер)
Сегментированный геном
Общая длина генома вируса гриппа составляет приблизительно 13 500 нуклеотидов [2]. Три самых крупных (примерно по 2300 нуклеотидов) его сегмента (PA, PB1 и PB2) кодируют вирусную полимеразу — белок, копирующий РНК и состоящий из трех крупных субъединиц. Четвертый по длине (около 1750 нуклеотидов) сегмент (HA) отвечает за синтез гемагглютинина. Этот белок заякорен в липидной оболочке вируса и отвечает за его проникновение в клетку, связываясь с рецептором на поверхности клеточной мембраны [3]. В зависимости от того, какой именно вариант гемагглютинина несет вирус, связывание может быть более или менее крепким. После этого клетка поглощает вирус, помещая его в мембранный пузырек внутри цитоплазмы. Большинство макромолекулярных комплексов, поглощаемых таким образом, перевариваются клеткой. Однако вирус избегает этой участи: его мембрана сливается с мембраной пузырька, в результате чего ее содержимое оказывается в цитоплазме. В этом процессе гемагглютинин также играет важную роль. Затем геном вируса проникает в ядро, где с него может начать считываться информация.
Сегмент размером около 1550 нуклеотидов (NP) кодирует нуклеопротеин — белок, необходимый вирусу для упаковки РНК. Множество копий такого белка распределяется по каждому из геномных сегментов, связываясь с молекулой нуклеиновой кислоты. В результате фрагменты генома образуют нуклеопротеидные тяжи, сложенные пополам и закрученные в спираль, к каждому из которых прикрепляется своя копия полимеразного комплекса [4].
Сегмент M1/M2 длиной 1000 нуклеотидов, в соответствии со своим названием, кодирует сразу два белка — М1 и М2. Из молекул первого из них образован слой (матрикс), подстилающий вирусную липидную оболочку. Обычно М1 играет ключевую роль в формировании вирусных частиц, поскольку он взаимодействует одновременно с поверхностными белками вируса и внутренними компонентами вирусной частицы. Задача матриксного белка — собрать все составляющие воедино [6]. Белок М2 выполняет роль ионного канала. Он расположен в липидной оболочке вируса и способствует его распаковке в цитоплазме клетки [7].
Последний, самый короткий (из 865 нуклеотидов) сегмент РНК вируса гриппа отвечает за синтез двух белков, которые не попадают в зрелую вирусную частицу. Эти белки называются NS1 и NEP. Первый необходим вирусу, в частности, для того, чтобы блокировать считывание информации с клеточных молекул РНК [8]. Благодаря ему клетке приходится синтезировать преимущественно вирусные белки, оставляя свои собственные нужды. Второй белок, NEP, обеспечивает транспорт новообразованных геномных комплексов вируса из ядра к клеточной мембране, где происходит сборка вирионов [9].
Новые штаммы и поиск реассортаций
Классификация штаммов вируса гриппа основана прежде всего на том, какие именно варианты гемагглютинина и нейраминидазы входят в его состав. Широко известные комбинации букв H и N в сочетании с порядковыми номерами (например, H3N2) как раз и обозначают подтип вируса: гемагглютинин 3, нейраминидаза 2. Таких подтипов десятки, однако человека заражают лишь немногие — обычно те, у которых не слишком большие номера N и H. Наиболее давние хозяева вируса гриппа — птицы, от которых новые штаммы время от времени передаются домашнему скоту и, прямо или опосредованно, людям [10]. Чем более долгий период коэволюции провели вместе патоген и хозяин, тем менее болезненным становится их совместное существование. Птичьи штаммы вируса зачастую оказываются очень опасными после передачи новым хозяевам [11].
Известно, что именно реассортации сегментов РНК привели к возникновению штаммов, которые вызвали пандемии азиатского и гонконгского гриппа в 1957 и 1968 гг., унесшие около 2,5 млн жизней [12]. Возможно, что и испанский грипп начала прошлого века, число жертв которого шло на десятки миллионов, тоже появился в результате такой эволюционной схемы [13].
Подобное исследование можно провести с использованием геномов вируса гриппа, опубликованных в свободном доступе. Избрав в качестве объекта штаммы H3N2, можно составить выборку из 1376 сегментированных геномов, а затем сравнить между собой филогенетические деревья для этих вирусов, построенные в отдельности по каждому из геномных сегментов [15].
В результате такого сравнения оказалось, что число реассортаций примерно сопоставимо для разных сегментов: в ходе эволюции гриппа в популяции человека каждая пара сегментов в недавнем прошлом реассортировала около 50 раз.
Последствия реассортаций
После того как ветви, в которых произошли реассортации, были обнаружены, стало возможным оценить их влияние на накопление в сегментах вирусного генома точечных замен. Для этого можно сравнить время, прошедшее между каждой такой заменой и ближайшей предшествующей ей реассортацией, с тем, которое бы ожидалось из компьютерной модели, если бы реассортации не влияли на замены. Проведенный анализ показал, что по крайней мере в пяти из восьми сегментов генома мутации ускоренно накапливаются после реассортации. Наиболее ярко эффект проявился для нейраминидазы и белка PB1. Ускорение аминокислотных замен после реассортаций вирусных геномов указывает на то, что в такие периоды эволюции вируса гриппа прежде всего происходит адаптация белков к новому генетическому окружению. Из-за того, что вирусные белки взаимодействуют между собой, молекулы из разошедшихся штаммов вынуждены какое-то время изменяться, приспосабливаясь друг к другу.
Интересно, что у нейраминидаз наблюдалось 30 замен, расстояние от которых до ветви, несущей реассортацию, меньше того эволюционного расстояния, на котором мы бы ожидали встретить одну случайную синонимичную замену в гене данного белка. Такой результат свидетельствует о том, что все эти 30 мутаций произошли и закрепились необычайно быстро, и что необходимость быстрой адаптации возникла именно благодаря тому, что соответствующий сегмент генома попал в новое генетическое окружение.
Реассортация — это резкое эволюционное изменение, которое поначалу может снижать общую приспособленность вируса к условиям окружающей среды и к организму-хозяину. Однако иногда оказывается, что из-за такой перетасовки белков из разных штаммов новая форма патогена оказывается более приспособленной, чем штаммы-предшественники, получая возможность эффективнее распространиться [18]. Похоже, что за коррекцию первичного вредного эффекта от реассортации как раз и отвечают быстро закрепляющиеся адаптивные мутации.
Предсказания, полученные только статистическими методами, — путем анализа последовательностей белков и кодирующих их генов, — конечно, не могут иметь стопроцентную точность. Действительно ли взаимодействуют две определенные аминокислоты, можно проверить экспериментально. Однако каждый белок вируса состоит из сотен аминокислот, так что возможны десятки тысяч разных взаимодействий. Постановка такого числа экспериментов практически неосуществимы. Биоинформатический анализ позволяет расставлять приоритеты: выбирать и анализировать только те аминокислоты, которые участвуют во взаимодействиях, экономя время и силы экспериментаторов. Кроме того, такой подход позволяет понять, насколько взаимодействия, приводящие к вредности реассортаций, распространены на уровне всего генома.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 13-04-02098) и Министерства образования и науки Российской Федерации (проект 11.G34.31.0008).
Литература
1. Steinhauer D. A., Domingo E., Holland J. J. Lack of evidence for proofreading mechanisms associated with an RNA virus polymerase // Gene. 1992. V. 22. № 2. P. 281–288.
2. Teng Q., Hu T., Li X. et al. Complete genome sequence of an H3N2 avian influenza virus isolated from a live poultry market in Eastern China // J. Virol. 2012. V. 86. № 21. P. 11944. DOI: 10.1128/JVI.02082-12.
3. Carr C. M., Kim P. S. A spring-loaded mechanism for the conformational change of influenza hemagglutinin // Cell. 1993. V. 73. № 4. P. 823–832.
4. Arranz R., Coloma R., Chichуn F. J. et al. The structure of native influenza virion ribonucleoproteins // Science. 2012. V. 338. № 6114. P. 1634–1637. DOI: 10.1126/science.1228172.
5. Kamali A., Holodniy M. Influenza treatment and prophylaxis with neuraminidase inhibitors: a review // Infection and Drug Resistance. 2013. № 6. P. 187–198. DOI: 10.2147/IDR.S36601.
6. Nayak D. P., Hui E. K., Barman S. Assembly and budding of influenza virus // Virus Res. 2004. V. 106. № 2. P. 147–165.
7. Lear J. D. Proton conduction through the M2 protein of the influenza A virus; a quantitative, mechanistic analysis of experimental data // FEBS Lett. 2003. V. 552. № 1. P. 17–22.
8. Hale B. G., Randall R. E., Ortнn J. et al. The multifunctional NS1 protein of influenza A viruses // J. Gen. Virol. 2008. V. 89. № 10. P. 2359–2376. DOI: 10.1099/vir.0.2008/004606-0.
9. Robb N. C, Smith M., Vreede F. T. et al. NS2/NEP protein regulates transcription and replication of the influenza virus RNA genome // J. Gen. Virol. 2009. V. 90. № 6. P. 1398–1407. DOI: 10.1099/vir.0.009639-0.
10. El Zowalaty M. E., Bustin S. A., Husseiny M. I. et al. Avian influenza: virology, diagnosis and surveillance // Future Microbiol. 2013. V. 8. № 9. P. 1209–1227. DOI: 10.2217/fmb.13.81.
11. Kaplan B. S., Webby R. J. The avian and mammalian host range of highly pathogenic avian H5N1 influenza // Virus Res. 2013. V. 178. № 1. P. 3–11. DOI: 10.1016/j.virusres.2013.09.004.
12. Kilbourne E. D. Influenza pandemics of the 20th century // Emerg. Infect. Dis. 2006. V. 12. № 1. P. 9–14.
13. Suzuki Y. A phylogenetic approach to detecting reassortments in viruses with segmented genomes // Gene. 2010. V. 464. № 1–2. P. 11–16. DOI: 10.1016/j.gene.2010.05.002.
14. Nagarajan N., Kingsford C. GiRaF: robust, computational identification of influenza reassortments via graph mining // Nucleic Acids Research. 2011. V. 39. № 6. e34. DOI: 10.1093/nar/gkq1232.
15. Neverov A. D., Lezhnina K. V., Kondrashov A. S., Bazykin G. A. Intrasubtype Reassortments Cause Adaptive Amino Acid Replacements in H3N2 Influenza Genes // PLoS Genet. 2014. V. 10. № 1. e1004037. DOI: 10.1371/journal.pgen.1004037
16. Wolf Y. I., Viboud C., Holmes E. C. et al. Long intervals of stasis punctuated by bursts of positive selection in the seasonal evolution of influenza A virus // Biol. Direct. 2006. V. 1. P. 34.
17. Kryazhimskiy S., Dushoff J., Bazykin G. A. et al. Prevalence of epistasis in the evolution of influenza A surface proteins // PLoS Genet. 2011. V. 7. № 2. e1001301. DOI: 10.1371/journal.pgen.1001301.
18. Li K. S., Guan Y., Wang J. et al. Genesis of a highly pathogenic and potentially pandemic H5N1 influenza virus in eastern Asia // Nature. 2004. V. 430. № 6996. P. 209–213.
19. Ferguson N. M., Fraser C., Donnelly C. A. et al. Public health. Public health risk from the avian H5N1 influenza epidemic // Science. 2004. V. 304. № 5673. P. 968–969.
20. Yong E. Influenza: Five questions on H5N1 // Nature. 2012. V. 486. № 7404. P. 456–458. DOI: 10.1038/486456a.
21. Herfst S., Schrauwen E. J., Linster M. et al. Airborne transmission of influenza A/H5N1 virus between ferrets // Science. 2012. V. 336. № 6088. P. 1534–1541. DOI: 10.1126/science.1213362.
22. Imai M., Watanabe T., Hatta M. et al. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets // Nature. 2012. V. 486. № 7403. P. 420–428. DOI: 10.1038/nature10831.
23. Russell C. A., Fonville J. M., Brown A. E. et al. The potential for respiratory droplet-transmissible A/H5N1 influenza virus to evolve in a mammalian host // Science. 2012. V. 336. № 6088. P. 1541–1547. DOI: 10.1126/science.1222526.
Многие считают, что грипп – это почти синоним тяжелой простуды. Часто при гриппе пациенты даже не посещают врача, переносят болезнь на ногах и никак не лечатся. Но эта вирусная инфекция далеко не так безобидна, как может показаться. Грипп утяжеляет течение хронических заболеваний легочной и сердечно-сосудистой системы.
Распространен грипп практически повсеместно и может поразить любого из нас. Примерно 60% детей и 40% взрослых, обратившихся в поликлинику с симптомами ОРЗ, болеют именно гриппом.
Особенности вирусных инфекций
Вирусы являются возбудителями множества заболеваний, причем поражают они не только человека, но и животных, растения, а некоторые – даже микробов. К вирусным инфекциям относятся такие смертельно опасные болезни, как бешенство, натуральная оспа, полиомиелит.
Вирусные частицы представляют собой неклеточную форму жизни. Их главная и, по сути, единственная цель – проникнуть в клетку живого организма и заставить ее работать на себя. Поэтому вирусы очень малы и довольно примитивно устроены. Оружием вирусной частицы является ее оболочка, которая состоит из двух компонентов: гемагглютининов и нейраминидаз. Гемагглютинины позволяют вирусу прикрепиться к клетке, а нейраминидазы, в свою очередь, нарушают структуру клеточной стенки. Через образовавшуюся брешь вирус и попадает в здоровую клетку.
Формирование иммунитета
Когда наступает выздоровление, иммунная система вырабатывает специальные белки - антитела, которые защищают организм от вторжения вируса – пожизненно или на определенное время. Даже если возбудитель проникнет в организм, то болезнь не разовьется снова, ведь антитела узнают вирусную частицу по структуре ее оболочки и защитят клетки от поражения.
Что такое мутация вирусов
Итак, именно белковая оболочка вируса – это субстрат для образования специфических антител. Стоит структуре вирусных белков хоть немного поменяться – и выработанная защита организма уже не будет эффективна. Следовательно, даже в результате небольших изменений оболочки возбудителя болезнь может наступить снова.
Почему мутирует вирус гриппа, версия № 1
Исследуя возбудитель гриппа, ученые заметили, что при заражении клеток вирусом в итоге образуются не только его точные копии, но и частицы с измененной белковой структурой. Как известно, синтез белка происходит на основании последовательности фрагментов нуклеиновой кислоты вируса. Почему изменяются нуклеиновые кислоты? Откуда появляются в них новые фрагменты?
Результаты эксперимента буквально загнали исследователей в тупик. Они не могли ответить на эти вопросы, пока не исследовали вирусные инфекции представителей животного мира. Дело в том, что животные и птицы, например, киты и утки тоже подвержены воздействию вируса, похожего на возбудитель гриппа.
Это открытие привело ученых к предположению о том, что мутация вируса гриппа является результатом взаимодействия живых организмов и обмена вирусными частицами с разной структурой между собой.
Данная гипотеза имеет право на жизнь и поддерживается многими биологами. Но в то же время на ряд вопросов ученым еще только предстоит найти ответы. Например, как новые варианты вирусов, которые образуются в организме животного, могут быть заразны для людей? Ведь чаще всего возбудители болезней птиц и млекопитающих не способны вызвать заболевание у человека (очевидное исключение из этого правила – бешенство).
Кроме того, выведенные в лабораторных условиях гибриды человеческого и животного вирусов гриппа нежизнеспособны или крайне неактивны. Этот факт тоже ставит под сомнение правильность вышеизложенной догадки.
Версия № 2
Существует вид мутационной изменчивости вирусов, который носит название антигенного дрейфа. Изучая кровь пожилых людей, исследователи обнаружили в ней антитела к вирусам, уже не циркулирующим в природе, а также к тем частицам, которые выявлены еще не были.
Это явление объясняется постепенным накоплением небольших мутаций в структуре вируса за счет ошибок в процессе копирования генома. Когда точечных ошибок становится много, организм возбудитель воспринимается организмом как совершенно новый.
Как мутация вируса гриппа влияет на нашу жизнь
Существует немало вирусных заболеваний, переболев которыми, человек получает стойкий иммунитет. Многие из них смертельно опасны. Поэтому разработаны вакцины, формирующие устойчивую защиту организма. К ним относится, например, прививка против полиомиелита.
С гриппом ситуация гораздо сложнее. Новую вакцину приходится разрабатывать каждый год. Соответственно, прививаться тоже рекомендуется ежегодно. Ведь иммунитет выработается только к тому штамму вируса, который циркулирует на данный момент. Вакцина применяется обычно осенью. А уже к весне вирус может мутировать до неузнаваемости.
Именно поэтому человек в течение жизни может болеть гриппом много раз.
Почему же вирус гриппа настолько подвержен мутациям? Наверное, истина где-то посередине двух точек зрения. Науке предстоит совершить еще немало открытий до того, как одна из теорий станет единственно верной и экспериментально доказанной. Возможно, именно тогда человечество сможет разработать и применить такие меры профилактики и борьбы с вирусом, которые позволят навсегда забыть о том, что такое грипп.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.

Грипп – наиболее опасное инфекционное заболевание, передающееся воздушным путем. Для него характерна сезонность и быстрая распространенность. Поражает преимущественно дыхательные пути, способствует появлению интоксикации, лихорадки и часто вызывает осложнения.
Что это такое
Грипп А относится к респираторно-вирусным инфекциям с преимущественным поражением дыхательной системы. Имеет короткий инкубационный период, быстрое распространение и высокий риск возникновения осложнений.
В процессе заболевания происходит размножение возбудителя на слизистой поверхности эпителиальной ткани глотки, трахеи, носовой полости. В зависимости от локализации вируса, развиваются характерные симптомы в виде сильного кашля, болей в горле, заложенности носа и других признаков.
Отмечается высокая температура тела на фоне скопления продуктов распада пораженных клеток и тканей, остатки которых попадают в кровяное русло. Также возрастает проницаемость сосудов из-за повреждения эндотелия. Поэтому возможно развитие небольшого кровоизлияния в дыхательные органы, и в том числе головной мозг.
Возбудитель гриппа оказывает общее негативное воздействие на иммунную и кровеносную системы. Это может стать причиной вторичных патологий вирусного или инфекционного характера, которые значительно усугубляют течение болезни и приводят к появлению осложнений.
Пути передачи и причины
Причина гриппа – поражение организма вирусными штаммами А типа.
Основными источниками инфекционного процесса выступают люди, больные или носители, также животные и птицы.
Заражение осуществляется воздушным путем, период от проникновения вируса в организм до появления первых признаков составляет не более 2 дней. Поэтому заболевание характеризуется высокой степенью заразности.
Способствующими факторами вирусной инфекции выступает снижение иммунной системы, близкий контакт с больными людьми и наличие сопутствующих патологий.
В группу риска развития гриппа А, входят:
Женщины в период вынашивания ребенка.
Маленькие дети дошкольного возраста.
Лица, подверженные частому стрессу, имеющие новообразования, дефицит витаминов, придерживающиеся строгой диеты.
Вирус гриппа А
Вирус гриппа А относится к группе ортомиксовирусов. Он опасен, обладает высокой степенью мутации. Это единственный тип, способный вызывать пандемию и быстрое распространение в обществе.
Наибольшую активность проявляет в осенний и весенний сезон. В качестве потенциальных хозяев возбудителя могут выступать различные животные, птицы, люди. Благодаря этому, вирус быстро приспосабливается и изменяет генетическую информацию за короткий промежуток времени.
За счет наличия в их структуре 2 белков: гемагглютинина и нейраминидазы, врачам удается дифференцировать патологию от других инфекционно-вирусных заболеваний.
Как правило, главной причиной возникновения гриппа А у людей считается не сам возбудитель, а его подтипы H1N1 и H3N2.
Симптомы заболевания
Первые симптомы патологии возникают через 2 дня после заражения, редко по истечению 4 суток.
На начальных стадиях болезнь сопровождается сильной лихорадкой до 39 С, слабостью, недомоганием, незначительным насморком с сохранением носового дыхания и першением горла.
По мере деятельности возбудителя в организме, отмечаются следующие явные признаки:
Озноб, чередующийся с жаром.
Болезненные ощущения в горле.
Кашель, чаще сухого характера.
Выраженный насморк, возможна заложенность носа.
Ломота и боль во всем теле.
Как правило, восстановление температуры наступает через неделю без медицинского вмешательства. При отсутствии осложнений, кашель проходит спустя 7-10 дней.
Если вирусная инфекция протекает в особо тяжелой форме и сопровождается бледностью кожных покровов, развитием цианоза, длительной повышенной температурой тела, болями в грудной области и нарушением деятельности сердечно-сосудистой системы, необходимо вызвать скорую помощь.
Методы лечения
Лечебные мероприятия наступают после подтверждения диагноза на основе клинических данных и осмотра пациента.
Люди, вошедшие в группу риска и имеющие тяжелую форму патологии, должны проходить терапию в стационаре. В остальных случаях, необходимые лечебные процедуры можно осуществить в домашних условиях.
Методы борьбы с гриппом заключаются в следующем:
Ограничение контакта больного человека со здоровыми.
Главной задачей при инфекции является купирование симптомов и причины. Поэтому основными группами лекарственных средств при гриппе А считаются противовирусные, противовоспалительные, жаропонижающие, сосудосуживающие препараты. Дополнительно назначают антигистаминные, противокашлевые средства, гормоны и витамины.
Курс и длительность приема определяет врач на основе состояния больного.
Для большей эффективности лечения важно соблюдать дистанцию с другими людьми, пользоваться индивидуальными вещами, соблюдать постельный режим и необходимое питание. Рацион предпочтительно обогатить клетчаткой, фруктами, овощами и белковыми продуктами. В сутки рекомендуется пить не менее 1, 5 л жидкости.
Осложнения
Грипп может повлечь развитие осложнений. Чаще им подвержены дети и люди со слабым иммунитетом. Они связаны с поражением нервной системы и появлением вторичного инфицирования.
Основными осложнениями выступают воспалительные патологии дыхательных путей, менингит, энцефалит, судорожные припадки, психоз.

Обзор
Такие маски в принудительном порядке носили в 1918—1919-х годах, во время крупнейшей пандемии гриппа, по современным подсчетам унесшей до 50 млн. человеческих жизней
Автор
Редакторы

Грипп
Среди наиболее трагических событий первой половины XX века — наряду с двумя мировыми войнами — выделяется пандемия гриппа 1918 года, ставшая не менее смертоносной, чем крупнейшие конфликты между людьми: в течение 18 месяцев около 50 млн. людей погибли от вирусной инфекции.
Гонки с гриппом
Ежегодно гриппом переболевает 5–15% всей мировой популяции. Наибольшему риску подвергаются дети до двух лет, пожилые люди от 65, а также больные астмой, диабетом или хроническими заболеваниями сердца вне зависимости от возраста. В то же время от болезни не застрахован никто — как показала пандемия 2009-го, когда больше всего пострадали как раз молодые люди с превосходной иммунной системой [4].
Гриппозный зоопарк
Это эстафета, которую ученые и органы здравоохранения уже так долго и с переменным успехом стараются прервать.

Ловец вирусов

— Что является самым главным в экологии вируса гриппа?
— Что еще мы узнали после встречи с птичьим гриппом?
— Болеют ли дикие птицы — природные носители вируса — гриппом?
— Как грипп передается между дикими птицами?
— Это неизвестно. Один из способов это выяснить — исследование природных очагов гриппа. Яркий пример, который наблюдаем мы с коллегами — залив Делавэр на востоке США. Птицы побережья во время сезонной миграции на север в мае останавливаются там, чтобы покормиться яйцами мечехвостов. По-видимому, в этом месте собирается критическая масса птиц, многие из которых еще не являются носителями гриппа, — что и становится определяющим фактором, позволяющим инфекции быстро распространяться. Есть и другие подобные места — в Австралии, Канаде, в других регионах. Потенциально подходит любое место массового скопления и кормления этой водной братии.
— Сколько разновидностей вируса гриппа циркулирует в природе?
— Над чем вы сейчас работаете?
Это исследование, в высшей степени ориентированное на практику. Используя наши диагностические методы, можно будет оперативно объявлять о появлении новых штаммов вируса и проводить грамотные кампании по вакцинации.

Рисунок 3. Во время пандемии поцелуи возможны только с защитой
— До сих пор птичий вирус гриппа H5N1 был не слишком активен, заражая людей. Какова вероятность, что в будущем эта его способность значительно возрастет?
— Вероятность пандемии вируса H5N1 значительно меньше, чем любого из H1, H2 или H3, потому что H5 далеко не так заразен для людей. Но если назвать вирус, который нам хотелось бы видеть пандемичным меньше всего, это будет как раз H5 из-за высокой смертности, причиной которой он становится. Одна из отличительных черт высокопатогенного вируса — молекулярные особенности строения гемагглютинина, позволяющие развиться системной инфекции, а не инфекции только дыхательных путей, как обычно [2]. Такая опасная способность числится только за вирусами H5 и H7.
У H5N1 было десять лет, чтобы переменить хозяина, а значит, это не одна-две и не три-четыре замены, которые должны произойти в нем, чтобы стать патогеном человека, а значительно больше. Есть примеры, когда для перемены хозяина вирусу требуется не одно десятилетие, несмотря на плотный контакт между видами, однако сейчас понятно хотя бы, что H5N1 не может передаться людям легко. Впрочем, совсем исключить эту вероятность нельзя, и если что-то и мешает нам спать спокойно по ночам, — то это вирус H5.
— Что, на ваш взгляд, наиболее удивительно в вирусе гриппа?
— Не устаю удивляться, как мало мы про него знаем, несмотря на то, что так давно и так активно изучаем. Это же сравнительно простые вирусы, — но до сих пор так и не понятно, что позволяет им периодически преодолевать межвидовые барьеры.
Читайте также:

