Как лечить гепатит без интерферона
Обновлено: 19.04.2024
Справка: что такое гепатит С
Вирусные гепатиты — это инфекционные заболевания, поражающие печень. Существуют разные вирусные гепатиты (их обозначают латинскими буквами). Симптомы заболеваний могут быть схожими (а чаще всего их вообще нет), но их возбудители по-разному распространяются и влияют на организм человека. Например, гепатит А — это кратковременная инфекция, а В и С могут протекать десятилетиями, незаметно повреждая печень. С распространением гепатитов А и В успешно борются с помощью прививок, а вот против гепатита С вакцины не существует.
Заражение вирусом гепатита С обычно происходит через контакт с кровью инфицированного человека:
- через шприц у лиц, употребляющих инъекционные наркотики (по статистике это наиболее распространенный способ заражения);
- при незащищенном сексе (риск выше при более травматичных формах, например, анальном сексе);
- через нестерильные медицинские инструменты (например, при экстренных вмешательствах в ограниченных условиях, при стоматологических процедурах и др.);
- через предметы личного пользования (например, бритву);
- при нарушении условий переливания крови (встречается редко, так как компоненты и доноры крови проходят тщательный отбор и обследование);
- от инфицированной матери новорожденному.
Основной способ диагностики гепатита С — анализ крови. Поэтому сложно назвать реальное количество людей, которые являются носителями этого вируса. В 2021 году некоторые эксперты говорили о том, что в России гепатитом С могут быть заражены около 5,7 млн человек.
— Как гепатит С лечили раньше?
— Сначала для терапии использовали рибавирин — неспецифический противовирусный препарат, у которого есть немало побочных эффектов. Потом его стали использовать в комбинации с препаратами интерферона, задача которого — усилить иммунный противовирусный ответ в организме. Но и у интерферона есть побочные явления и нередко — противопоказания к применению. Существуют заболевания, при которых применение интерферона невозможно или дает очень высокие риски осложнений. Зачастую приходилось выбирать, кому из больных проводить терапию по этой схеме, а кому отказывать. Эффективность тоже была заведомо невысокой, можно даже сказать, мы играли в лотерею. Переносимость интерферона, сопутствующие заболевания, риск нежелательных явлений, изменение показателей крови, стадия цирроза печени и в целом состояние печени на момент лечения — от всего этого зависело, можно ли было назначать лечение. Плюс мы выявляли у пациентов определенные генетические показатели, при которых его применение заведомо могло быть малоэффективным.
— Таких пациентов совсем не лечили?
— Гепатопротекторы бесполезны при гепатите?
— Итак, старая схема давала высокие риски, побочные эффекты и низкую эффективность. Что удалось изменить в новых рекомендациях?
— Принципиальный момент, который, наверное, будет самым важным для всех нас — и для пациентов, и для врачей, — возможность назначать терапию на любой стадии хронического гепатита С. Не запущенные стадии, как было раньше, когда у пациента уже возникали фиброз и цирроз печени. Сейчас у нас единственное показание к лечению, как и во всем мире, что мне очень приятно, — это сам факт выявления вируса гепатита С в крови. Поэтому врачам теперь не нужно решать, кому назначать противовирусную терапию, а кому — нет.
— Терапию теперь можно проводить сразу после того, как вирус обнаружили в крови?
— По современным российским рекомендациям это нужно сделать не позднее трех месяцев после обнаружения вируса в крови — возможно начать терапию сразу, иногда понаблюдать 6–12 недель. Это можно делать, потому что в определенных случаях организм побеждает вирус сам. Процент таких больных действительно есть, хотя он намного ниже, например, чем в случаях с гепатитом В (он реже становится хроническим).
— Мы убрали это слово, сейчас такого подхода нет. Конечно, приоритет все равно дается пациентам с циррозом печени или с другими рисками (например, с раком печени и вирусным гепатитом или поражением других органов). Пациенты после после пересадки печени получают лечение незамедлительно, так как инфицирование нового органа наступает неизбежно.
— Схема лечения тоже изменилась?
— Это еще один принципиальный момент, над которым мы целенаправленно работали. Из рекомендаций исчезли препараты интерферона. Это влечет за собой целый ряд позитивных изменений. Как я уже говорил, интерферон многими пациентами переносится тяжело, возникают побочные эффекты, и результаты невысоки, особенно при циррозе печени.
Теперь мы перешли полностью на таблеточные схемы, их эффективность приближается к 100%. Это позволяет бюджетным медицинским учреждениям больше не тратить деньги на закупку интерферона, а закупать только таблеточные формы лекарств и использовать безинтерфероновые высокоэффективные схемы. При этом нужно сказать, что большая часть тех препаратов, которые есть в мире и, в частности, в западных странах, присутствуют и в России.
— Новые схемы лечения эффективнее прежних?
— Они перекрывают все существующие в России типы вирусов гепатита С. Это так называемая пангенотипная схема: когда одна таблетка, одна комбинация препаратов, может вылечить все типы вирусов. К примеру, в России встречаются в основном три типа вируса гепатита С (1а, 1b, 3), и их раньше по разным причинам не всегда удавалось лечить эффективно, особенно на стадии цирроза. Сейчас эта проблема уже не имеет значения. Во всем мире принята следующая концепция упрощенного подхода к лечению: выявляют вирус, но не определяют ни его количество, ни его разновидность, для того чтобы выбрать конкретный препарат. Вместо этого назначают лекарства, которые одинаково эффективны при разных вариантах инфекции.
Проведен анализ существующих схем комбинированной противовирусной терапии хронического гепатита С. Комбинирование агентов с прямым противовирусным действием значительно снижает риск резистентности, увеличивая вероятность эрадикации вируса. Проведена оценк
This article contains analysis of current combination treatment regimens for chronic hepatitis C. Combination of agents with direct antiviral effect considerably reduces risk of resistance, increasing probability of virus eradication. A critical estimation of interferon-free modes of antiviral therapy of chronic hepatitis C according to the analysis of clinical studies. Interferon-free variants of treatment have certain advantages over modes of interferon-? based treatment.
Значимость проблемы хронического гепатита С (ХГС) определяется не только самим заболеванием, но и ростом риска формирования отдаленных неблагоприятных последствий в исходе заболевания, что влечет за собой огромные человеческие, социальные и экономические затраты. Около 170 млн человек инфицированы вирусом гепатита С (ВГС), в 10 раз больше, чем ВИЧ; более 350 тысяч человек умирают ежегодно от болезней, связанных с гепатитом C [1, 2]. Показано, что хроническая форма инфекции вызывает формирование цирроза (ЦП) до 20% случаев, а гепатоцеллюлярной карциномы у 1–5% пациентов [2, 3].
ХГС является одной из наиболее серьезных проблем здравоохранения РФ в связи с широким распространением, потенциальной угрозой жизни, а также отсутствием государственных программ противовирусного лечения. Общее число больных ХГС в Российской Федерации оценивается на сегодняшний день в 2,5–3,2 млн, из которых более половины инфицировано 1-м генотипом вируса [4, 5]. В настоящее время установить индивидуальный для пациента риск развития прогрессирующего заболевания печени невозможно, поэтому все больные ХГС (при компенсированной ее функции), ранее не получавшие лечения, вне зависимости от исходной биохимической активности, должны рассматриваться как кандидаты для проведения противовирусной терапии (ПВТ). Причинная связь между заболеванием печени и инфекцией ВГС должна быть доказана. Перед началом ПВТ необходимо оценить тяжесть поражения печени (стадию заболевания) и базовые вирусологические параметры (уровень вирусной нагрузки, генотип ВГС, а также субтип 1-го генотипа ВГС). Особого внимания требует стадия заболевания, поскольку жизненный прогноз и вероятность ответа на ПВТ у пациента с циррозом существенно отличаются от таковых у пациентов без ЦП [1, 5, 6].
Долгое время золотым стандартом терапии ХГС считалась комбинированная двойная терапия пегилированными интерферонами с рибавирином, которая наименее эффективна у больных с 1-м генотипом и продвинутым фиброзом печени [1, 5–7]. Появление за рубежом, а затем и в России препаратов прямого противовирусного действия (ПППД) привело к революционным изменениям в терапии больных ХГС и расширило показания к лечению пациентов, ранее не имевших шансов [8, 9]. Включение ПППД в схемы тройной терапии ХГС, вызванного вирусом 1-го генотипа, значительно повысило эффективность (до 69–85%), но не улучшило безопасность и качество жизни пациентов во время терапии [9–11]. Появившиеся в 2012 г. данные об эффективности ПППД дали начало новой безинтерфероновой эры лечения ХГС, а с 2014 г. по результатам клинических исследований началась регистрация безинтерфероновых режимов противовирусной терапии во всем мире. В настоящем обзоре представлены данные об основных классах ПППД, а также наиболее актуальные режимы безинтерфероновой ПВТ для лечения больных с ХГС без ЦП.
Препараты прямого противовирусного действия — это вещества, которые специфическим образом нарушают репликацию вируса за счет прямого взаимодействия с вирусными протеинами или нуклеиновыми кислотами [8, 9, 12]. За основу их классификации взяты белки-мишени, с которыми непосредственно взаимодействуют препараты (табл. 1). Выделяют классы ингибиторов протеазы NS3/4A, ингибиторов NS5A, ингибиторов полимеразы NS5B и другие (табл. 1).
Ингибиторы полимеразы NS5B (табл. 1), связываясь с РНК-зависимой РНК-полимеразой, нарушают жизненный цикл вируса [14, 19]. Данный класс препаратов делится на две группы: нуклеоз(т)идные и ненуклеозидные ингибиторы полимеразы NS5B. Мишенью нуклеоз(т)идных аналогов является высококонсервативный для всех генотипов ВГС каталитический сайт фермента; они прекращают синтез РНК, характеризуются мощной противовирусной активностью в отношении всех генотипов (1–6), высоким барьером резистентности, низким потенциалом межлекарственных взаимодействий [15]. Софосбувир — это уридиновый нуклеозидный аналог, единственный из этой группы ПППД, для которого завершены клинические исследования (КИ) третьей фазы, и в настоящее время он одобрен для применения в США, европейских и других странах, а с марта 2016 г. и в РФ [14, 16, 21]. В КИ софосбувиром было пролечено в общей сложности около 3 тысяч пациентов, в том числе с ЦП и ожидающих трансплантации печени. При клиренсе креатинина более 30 мл/мин, а также при тяжелом поражении печени (тяжелый фиброз и цирроз) коррекции дозы софосбувира не требуется. Прием пищи не оказывает существенного влияния на фармакокинетику [16, 21]. Софосбувир, как препарат с высоким барьером резистентности, может применяться в качестве основного препарата в комбинациях ингибиторов протеазы с NS3/4A, ингибиторами NS5A, рибавирином. Ненуклеозидные аналоги (ННА), мишенью для которых является один из четырех аллостерических сайтов полимеразы NS5B, ингибируют начальную стадию синтеза РНК, обладают узкой направленностью (в основном действуют на 1b генотип), меньшей противовирусной активностью и низким барьером резистентности. В связи с чем дальнейшая разработка некоторых препаратов данной группы (делеобувир (BI), филибувир, тегобувир) была остановлена [12, 15].
Ингибиторы NS5A блокируют репликацию вируса, вирусную сборку и высвобождение из клетки. Двойной механизм действия обеспечивает быстрое снижение вирусной нагрузки непосредственно после начала приема препаратов [17–19]. Ингибиторы первого поколения (табл. 1) эффективны в отношении 1-го и 4-го генотипов, некоторые активны и в отношении 2-го и/или 3-го генотипов, характеризуются низким барьером резистентности, особенно в отношении 1а и 3-го генотипов. Даклатасвир, первый в своем классе, обладает высокой противовирусной активностью, может применяться в составе интерферон-содержащих и безинтерфероновых режимов [19–21].
Эффективность безинтерфероновой ПВТ зависит от высокой противовирусной активности комбинации ПППД и их барьера резистентности. Препараты прямого действия всех классов имеют выраженную противовирусную активность и обеспечивают выраженное снижение вирусной нагрузки в первые три дня приема препарата и ее дальнейшее постепенное снижение во вторую фазу. В то же время их профиль резистентности существенно отличается. Высокий барьер резистентности является отличительной чертой всех представителей класса нуклеоз(т)идных ингибиторов NS5B. Ингибиторы NS3/4А, ингибиторы NS5A второго поколения характеризуются уже значительно более высоким барьером резистентности [21]. В процессе исследований возникло понимание необходимости применения комбинаций ПППД для преодоления вирусной резистентности, которая может стать значимой проблемой в связи с особенностями репликации возбудителя. Сочетая препараты ПППД разных классов, можно предотвратить развитие лекарственной устойчивости [21].
С 2015 г. доступные безинтерфероновые режимы терапии более предпочтительны за счет эффективного вирусологического ответа, простоты применения и хорошей переносимости [1, 5, 21]. Показания к терапии зависят от генотипа/субтипа ВГС, тяжести заболевания печени и/или результатов предшествующей терапии (табл. 2).
Полный анализ результатов лечения 513 больных ХГС с 1-м генотипом и компенсированным ЦП, прошедших лечение комбинированным препаратом с рибавирином и без него, выявил, что средняя частота УВО 12 недель составила 95% (305/322) после 12 недель лечения и 90% после 24 недель терапии (188/191). Отмечено, что ни продолжительность лечения, ни включение рибавирина в схему терапии не оказали действия на частоту достижения УВО у пациентов без предшествующей терапии в анамнезе. В группе с предшествующей интерферонотерапией частота УВО12 была достигнута в 90% случаев после 12 недель лечения без рибавирина и в 96% случаев с рибавирином. После 24 недель терапии УВО был в 98% случаев лечения без рибавирина и в 100% случаев с рибавирином этой комбинации. Результаты исследования показали равную эффективность схем с рибавирином и без него при длительности лечения 8 и 12 недель у больных без ЦП. Исключение из схемы лечения рибавирина снижало частоту НЛЯ [26–28].
Таким образом, в настоящее время для лечения ХГС в мире и в России начали успешно применяться безинтерфероновые режимы с высокой эффективностью, минимальным влиянием на качество жизни и существенным повышением безопасности и переносимости. Частота достижения УВО при назначении комбинаций препаратов прямого противовирусного действия практически не зависит от негативных факторов пациента и вируса, которые определяли эффективность терапии пегелированным интерфероном и рибавирином. Это позволило полностью исключить интерфероны из схемы и достигнуть значительного повышения эффективности лечения. При этом сократилась продолжительность терапии, повысилось удобство, исчезли правила отмены, отпала необходимость оценки большинства предикторов эффективности, появилась возможность назначать лечение пациентам, не ответившим на ПВТ, с ЦП и без него, с сопутствующей патологией [27]. Удачный опыт использования безинтерфероновых режимов вселяет оптимизм и позволяет с надеждой смотреть на перспективу более широкого применения комбинаций препаратов прямого противовирусного действия в терапии больных хроническим гепатитом С.
Литература
Ж. Б. Понежева, доктор медицинских наук
И. В. Семенова 1 , доктор медицинских наук
ФБУН ЦНИИ эпидемиологии Роспотребнадзора РФ, Москва
Что такое гепатит Б? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит В (Б) — острое и хроническое инфекционное заболевание, вызываемое вирусом гепатита В, с гемоконтактным механизмом передачи (через кровь), протекающее в различных клинико-морфологических вариантах, и возможным развитием цирроза печени и гепатоцеллюлярной карциномы. Всего в мире, по самым скромных оценкам, инфицировано более 250 млн человек.
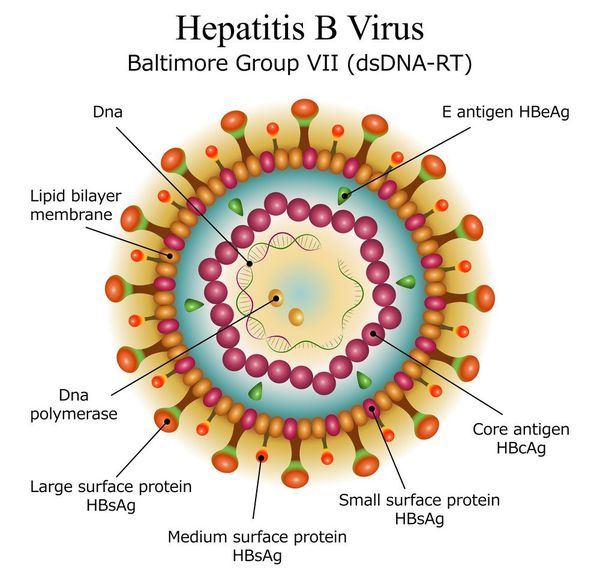
Этиология
вид — вирус гепатита В (частица Дейна)
Развитие вируса гепатита Б происходит в гепатоцитах (железистых клетках печени). Он способен к интеграции в ДНК человека. Имеются 9 генотипов вируса с различными подтипами — генетическая изменчивость позволяет вирусу образовывать мутантные формы и ускользать от действия лекарств.
Имеет ряд собственных антигенов:
- поверхностный HbsAg (австралийский). Появляется за 15-30 дней до развития болезни, свидетельствует об инфицировании (не всегда). Антитела к HbsAg выявляются через 2-5 месяцев от начала заболевания, а сам HbsAg исчезает из крови (при благоприятном течении процесса);
- сердцевинный HbcorAg (ядерный, коровский). Появляется в инкубационном периоде и совместно с ним появляются антитела (HbcorAb). Длительное присутствие HbcorAg в крови свидетельствует о вероятной хронизации процесса (неадекватный иммунный ответ);
- антиген инфекциозности и активного размножения вируса (HbeAg). Появляется совместно с HbsAg и отражает степень инфицированности. Его продолжительная циркуляция в крови является свидетельством развития хронизации процесса, а антитела к нему являются благоприятным прогностическим признаком (не всегда, но по меньшей мере указывают на возможность более благоприятного процесса, срок их циркуляции после выздоровления окончательно не определён, но не более пяти лет после благоприятного разрешения процесса);
- HbxAg — регулятор транскрипции, способствует развитию гепатокарциномы.
Вирус гепатита В чрезвычайно устойчив к действию всевозможных естественных факторов окружающей среды, инактивируется при 60 °C за 10 часов, при 100 °C за 10 минут, при оптимальной температуре сохраняется до 6 месяцев, при автоклавировании погибает за 5 минут, в сухожаровом шкафу — через 2 часа, 2% раствор хлорамина убивает вирус за 2 часа. [1] [3]
Эпидемиология
Источник инфекции — только человек, больной острой или хронической формой инфекции.
Механизм передачи: гемоконтактный и вертикальный (от матери к ребёнку), не исключается трансмиссивный механизм передачи (например, при укусах комаров в результате раздавливания и втирания инфицированного тела комара в поврежденную ткань человека).
Пути передачи: половой, контактно-бытовой, гемотрансфузионный (например, при переливании крови или медицинских манипуляциях). Восприимчивость всеобщая. Заболеваемость — 30-100 человек на 100 тысяч населения (зависит от страны). Летальность от острых форм — до 2%. После перенесённого острого заболевания при условии выздоровления иммунитет стойкий, пожизненный.
Для заражения характерна малая заражающая доза (невидимые следы крови). [1] [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита Б
Инкубационный период гепатита В длится от 42 до 180 дней (следует иметь в виду, что наличие клинической симптоматики характеризует лишь незначительную долю всех случаев заболевания).
Начало постепенное. Характерные синдромы:
- общей инфекционной интоксикации (проявляется как астеноневротический синдром);
- холестатический (нарушение секреции желчи);
- артрита;
- нарушения пигментного обмена (появление желтухи при уровне общего билирубина свыше 40 ммоль/л);
- геморрагический (кровоточивость кровеносных сосудов);
- экзантемы;
- отёчно-асцитический (скопление жидкости в брюшной полости);
- гепатолиенальный (увеличение печени и селезёнки).
При первых признаках гепатита B нужно обратиться к доктору.
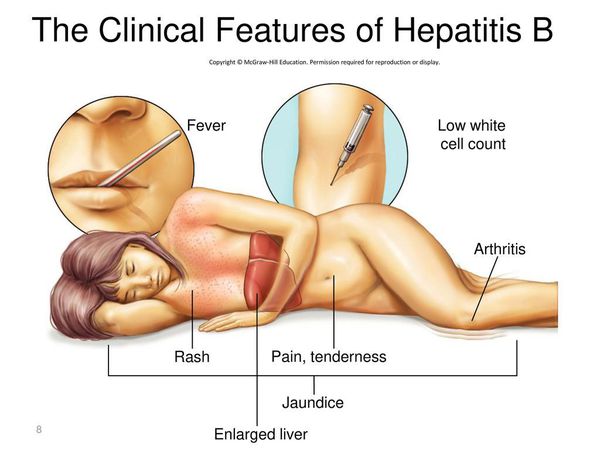
Первые признаки гепатита B
Начальный (преджелтушный) период продолжается 7-14 дней. Чаще протекает по многообразному типу с болевыми ощущениями в различных суставах по ночам и утром, уртикарными высыпаниями, астеновегетативными проявлениями (снижение аппетита, апатия, нервозность, слабость, разбитость, повышенная утомляемость). Изредка развивается синдром Джанотти-Крости — симметричная, яркая пятнисто-папулёзная сыпь. Не исключены умеренные диспептические явления (расстройства пищеварения). К концу периода происходит потемнение мочи, обесцвечивание кала.
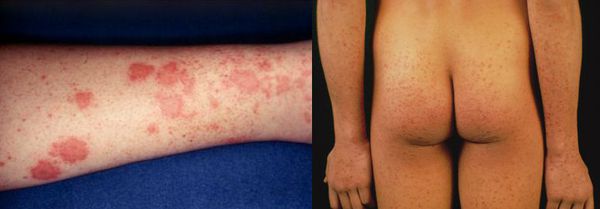
Желтушный период
Этот период продолжительностью около одного месяца характеризуется возникновением желтушного окрашивания кожи (различных оттенков) на фоне продолжающегося или ухудшающегося общего состояния. Характерна длительность и стойкость симптоматики. Появляется тяжесть и болезненность в правом подреберье, горечь во рту, тошнота, выражённый зуд кожи (практически не снимаемый никакими средствами). На фоне усиления астеноневротического компонента появляются геморрагические проявления, урежение пульса, гипотензия, отёки (отражает степень интоксикации и нарушения функций печени).
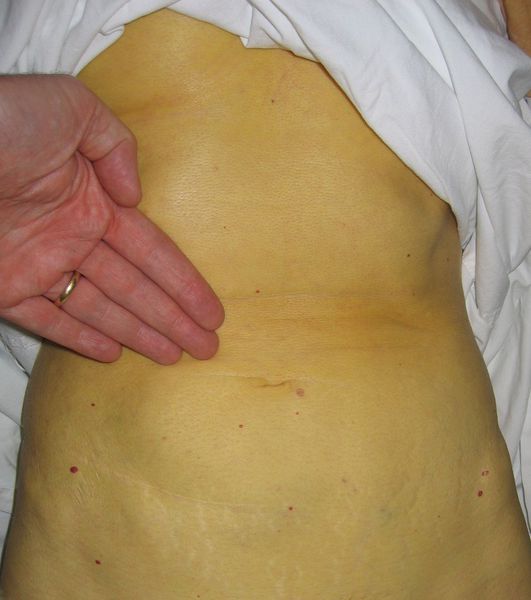
Выздоровление
Следующим этапом в развитии болезни является нормализации общего состояния, спадение желтухи и реконвалесценция, которая в зависимости от конкретной ситуации и состояния иммунной системы может закончиться как выздоровлением, так и движением развития заболевания в хроническое течение, характеризующееся маловыраженой неусточивой симптоматикой, преимущественно в виде слабости, периодического дискомфорта в правом подреберье, бурно сигнализирующим лишь на стадии цирроза и полиорганных осложнений.
- гепатиты другой этиологии;
- желтухи другой этиологии (например, гемолитическая болезнь, токсическое поражение, опухоли);
- малярия; ;
- лептоспироз;
- ревматоидный артрит.
Гепатит В у беременных
Острый гепатит характеризуется более тяжёлым течением у беременной, возникновении повышенного риска преждевременных родов, аномалий развития плода на ранних сроках и кровотечений. Вероятность передачи при острой форме зависит от сроков беременности: в первом триместре риск 10% (но более тяжёлые проявления), в третьем триместре — до 75% (чаще бессимптомное течение после родов). У большинства детей при заражении во внутриутробном и постнатальном периодах происходит хронизация инфекции. [1] [3] [6]
Патогенез гепатита Б
С движением кровяной массы вирус попадает в печеночную ткань, где локализуется в гепатоцитах и теряет свою протеиновую сферу в лизосомах. Происходит выход вирусной ДНК с последующим ресинтезом аномальных протеинов LSP, а параллельно образование новых частиц Дейна.
В процессе эволюции вирусчеловеческого взаимодействия возможно развитие двух вариантов:
При репликативном пути происходит следующее: белки LSP совместно с HbcorAg вызывают увеличение продукции гамма-интерферона, что приводит к активации главного комплекса гисотсовместимости (HLA), проистекает преобразование молекул гистосовместимости 1 и 2 классов, в результате чего клетка становиться для организма враждебной в антигенном формате.
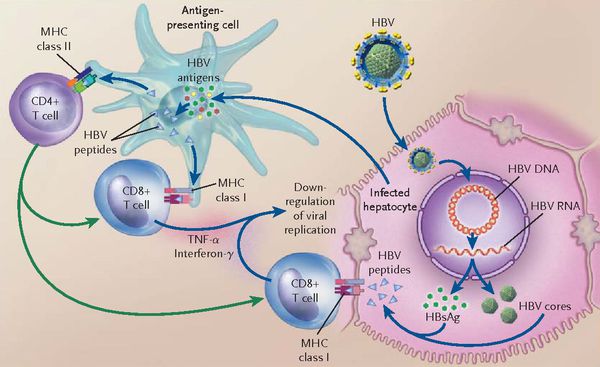
Антигенпрезентирующие макрофаги содействуют изменению В-лимфоцитов в плазматические клетки и экспрессии ими агрессивных белков-антител к посторонним антигенам. В итоге на поверхности печёночных клеток формируются вирусспецифические иммунные комплексы (антиген + антитело + фракция комплемента С3в).
В динамике может реализоваться два сценария:
- в первом варианте запуск каскада комплимента ведёт к появлению в составе иммунных комплексов агрессивной фракции С9 (мембранатакующий комплекс) — наблюдается значительный некроз гепатоцитов без участия лимфоцитов (молниеносная форма гепатита В);
- при альтернативной варианте (наблюдающимся в большинстве случаев) каскад комплемента в силу иммуноиндивидуалистических свойств не активируется — тогда идёт умеренное разрушение Т-киллерами меченых антителами заражённых вирусом гепатоцитов. Образуются ступенчатые некрозы с образованием на месте гибели гепатоцитов соединительной ткани — рубцов (то есть острый гепатит В при плохом иммунном ответе постепенно переходит в хронический).
Непременным атрибутом патогенеза является формирование иммунопатологического процесса. Гибель гепатоцитов, инфицированных вирусом гепатита В, следует за счёт иммунокомпетентных частиц, Т-киллеров и макрофагальных элементов.
Серьёзным значением является нарушение свойств мембраны клеток печени, что сопровождается экскрецией (выделением) лизосомальных ферментов, разрушающих гепатоциты. Сообразно этому, гибель гепатоцитов происходит за счёт иммунокомпетентных клеток, лизосомальных ферментов и противопечёночных гуморальных аутоантител, то есть острая болезнь наступает (и благоприятно заканчивается) только при хорошем иммунитете, а при плохом идёт хронизация.
При тяжёлом цитолитическом синдроме (массивные некрозы гепатоцитов) возникает гипокалиемический алкалоз, острая печёночная недостаточность, печёночная энцефалопатия (ПЭП), церебротоксическое действие, нарушение функции обмена нервной ткани. [2] [3] [6]
Классификация и стадии развития гепатита Б
По цикличности течения:
- острый;
- острый затяжной;
- хронический.
По клиническим проявлениям:
- субклинический (инаппарантный);
- клинически выраженный (желтушный, безжелтушный, холестатический, фульминантный).
По фазам хронического процесса:
Группы риска хронического гепатита B
Хроническим гепатитом чаще страдают дети младше шести лет. При заражении в первый год жизни он развивается в 80–90 % случаев, от года до шести лет — в 30–50 %, у взрослых без сопутствующих заболеваний — менее чем в 5 %. [7]
Осложнения гепатита Б
Чем опасен гепатит Б
Заболевание может привести к острой печёночной недостаточности (синдрому острой печеночной энцефалопатии).
Выделяют четыре стадии болезни:
Диагностика гепатита Б
Многообразие форм, тесная взаимосвязь с иммунной системой человека и зачастую достаточно высокая стоимость исследований часто затрудняют принятие конкретного решения и диагноза в стационарный отрезок времени, поэтому во избежание роковых (для больного) ошибок следует подходить к диагностике с учётом всех получаемых данных в динамическом наблюдении:
- общеклинический анализ крови с лейкоцитарной формулой (лейкопения, лимфо- и моноцитоз, уменьшение СОЭ, тромбоцитопения);
- общий анализ мочи (появление уробилина);
- биохимический анализ крови (гипербилирубинемия в основном за счёт связанной фракции, повышение уровня АЛТ и АСТ, ГГТП, холестерина, щелочной фосфатазы, снижение протромбинового индекса, фибриногена, положительная тимоловая проба);
- маркеры гепатита В: HbsAg, HbeAg, HbcorAg, HbcorAb IgM и суммарные, HbeAb, anti-Hbs, ПЦР в качественном и количественном измерении);
- УЗИ органов брюшной полости, КТ и МРТ диагностика;
- фиброскан (применяется для оценки степени фиброза). [3][4]
Скрининг при хроническом гепатите
Пациентам с хроническим гепатитом В рекомендуется не реже чем раз в полгода проходить обследование: УЗИ органов брюшной полости, клинический анализ крови, АЛТ, АСТ, тест на альфа-фетопротеин. Скрининг позволяет вовремя заметить обострение болезни и начать специфическую терапию.
Лечение гепатита Б
Лечение острых форм гепатита В должно осуществляться в стационаре (учитывая возможность быстрых и тяжёлых форм болезни), хронических — с учётом проявлений.
Диета и режим при гепатите В
В острый период показан постельный режим, печёночная диета (№ 5 по Певзнеру): достаточное количество жидкости, исключение алкоголя, жирной, жареной, острой пищи, всё в мягком и жидком виде.
Медикаментозная терапия
При лёгкой и средней тяжести острого гепатита этиотропная противовирусная терапия (ПВТ) не показана. При тяжёлой степени и риске развития осложнений назначается специфическая противовирусная терапия на весь период лечения и возможно более длительное время.
В лечении хронических форм гепатита показаниями к назначению ПВТ является наличие уровня DNA HBV более 2000 МЕ/мл (при циррозе печении независимо от уровня), умеренное и высокое повышение АЛТ/АСТ и степени фиброза печёночной ткани не менее F2 по шкале METAVIR, высокая вирусная нагрузка у беременных женщин. В каждом конкретном случае показания определяются индивидуально, в зависимости от выраженности процесса, временной тенденции, пола, планирования беременности и другого.
Существует два пути противовирусного лечения:
- терапия пегилированными интерферонами (имеет ряд существенных противопоказаний и серьёзных побочных эффектов — не менее 12 месяцев);
- нуклеозидно-аналоговой терапии NA (используются препараты с высоким порогом резистентности вируса, длительно — не менее пяти лет, удобство применения, хорошая переносимость).
В отдельных случаях может рассматриваться применение комбинированной терапии.
Из средств патогенетической терапии в острый период используются внутривенно вводимые растворы 5% глюкозы, дезинтоксикантов, антиоксидантов и витамины. Показан приём энтеросорбентов, ферментных препаратов, при выраженном холестазе применяются препараты Урсодезоксихолевой кислоты, при тяжёлом течении — глюкокортикостероиды, методы аппаратного плазмофереза.
В хронической стадии заболевания при наличии соответствующей активности процесса и невозможности назначения ПВТ может быть показан приём групп гепатопротекторов и антиоксидантов. [1] [3]
Прогноз. Профилактика
Основное направление профилактики на сегодняшний день — это проведение профилактической вакцинации против гепатита В в младенческом возрасте (в том числе усиленная вакцинация детей, рождённых от матерей с гепатитом В) и далее периодические ревакцинации раз в 10 лет (или индивидуально по результатам обследования). Достоверно показано, что в странах, где была введена вакцинация, резко сократилось количество вновь выявленных случаев острого гепатита В.
Вторая составляющая стратегии профилактики включает обеспечение безопасности крови и её компонентов, использование одноразового или стерилизованного инструментария, ограничение числа половых партнёров и использование барьерной контрацепции. [1] [2]
Появление новых препаратов прямого противовирусного действия – это возможность полной победы над гепатитом С. В клинических испытаниях и по данным клинической практики эффективность лечения этими препаратами составляет от 80 до 99%, а нежелательные явления – минимальные.
Препараты прямого противовирусного действия для лечения хронического вирусного гепатита С
Для назначения курса лечения необходимо обследование, а во время лечения контроль эффективности и безопасности лечения в соответствии с рекомендациями Европейской ассоциации по изучению печени.
По механизму действия все препараты представляют собой ингибиторы различных протеаз вируса: NS3, NS4, NS5A, NS5B. Разные сочетания препаратов позволяют получить выздоровление, с вероятностью в ряде случаев до 100%. Среди препаратов есть пангенотипические, то есть эффективные для всех генотипов, и препараты, действующие только на определенные генотипы вируса (1а, 1в, 2а/b, 3а/в).
СОФОСБУВИР – ингибитор NS5В – следует принимать в дозе 400 мг (1таблетка) один раз в сутки. Применяется только в комбинации с другими препаратами ППВД или с рибавирином и интерфероном.
Софосбувир выводится в основном (60%) почками с мочой, поэтому назначение его требует осторожности у пациентов с заболеваниями почек.
Софосбувир вступает в межлекарственные взаимодействия с многими препаратами, поэтому следует внимательно относиться сопутствующим заболеваниям и корректировать прием препаратов, назначенных для лечения этих заболеваний.

ЛЕДИПАСВИР – ингибитор NS5B - доступен в комбинации с софосбувиром(400 мг софосбувира и 90 мг ледипасвира). Доза для приема – 1 таблетка в день независимо от приема пищи.
Так как ледипасвир взаимодействует с другими лекарственными препаратами, следует соблюдать меры предосторожности с частым контролем функции почек. Кроме того, важно учитывать прием пациентами статинов и препаратов в схеме антиретровирусной терапии (ВИЧ).
ДАКЛАТАСВИР – ингибитор NS5А – применяется 1 таблетка 60 мг в день в комбинации с другими препаратами ППВД, в том числе с софосбувиром, или рибавирином с интерфероном. Многочисленные лекарственные взаимодействия даклатасвира требуют внимательного отношения при его назначении и соответствующего контроля при его применении.
ВИКЕЙРА ПАК – комплексный препарат, включающий 4 действующих вещества (ритонавир, усиливающий действие паритапревира, омбитасвир и дасабувир). Рекомендуемая доза 1 раз в суткиво время еды 2 таблетки ритонавира/паритапревира/омнитасвира, а также дасабувир 2 раза в сутки. При назначении следует учитывать многочисленные лекарственные взаимодействия, а также класс цирроза.
ВЕЛПАТАСВИР – ингибитор NS5А, 1 раз в день 100 мг. Эффективен для всех генотипов вируса. Препарат применяется в комбинации с софосбувиром и воксилапревиром – ВОСЕВИ. Показана его эффективность при перелечивании пациентов с неудачной терапией и формированием мутаций.
МАВИРЕТ – комбинация глекапревира с прибрентасвиром у пациентов с любым генотипом, рекомендован также для перелечивания, так как мутации не влияют на результат лечения.
СИМЕПРЕВИР – ингибитор NS3/4А - следует принимать одну капсулу 150 мг в сутки. Пациентам, принимающим симепривир, нужно с осторожностью лечиться другими препаратами, в частности антиретровирусными.
АСУНАПРЕВИР – ингибитор NS3/4A протеазы, применяется 100 мг 2 раза в день. Препарат назначается в комбинации с даклатасвиром, а также в схемах с рибавирином и интерфероном.
НАРЛАПРЕВИР – ингибитор NS3 протеазы (отечественный препарат), 200 мг 1 таблетка в день, применяется в комбинации с рибавирином и интерфероном, с обязательным включением в схему лечения ритонавира. Есть ряд ограничений при единовременном применении с другими лекарственными препаратам. Противопоказанием является цирроз печени класса В и С.
Схемы лечения препаратами прямого противовирусного действия хронического вирусного гепатита
Выбор наиболее эффективной схемы для пациента проводится врачом гепатологом обязательно с учетом степени поражения печени (есть ограничения при высоком классе цирроза), генотипа вируса и сопутствующих хронических заболеваний, так как большинство препаратов имеет выраженные межлекарственные взаимодействия. Иногда необходимо учитывать опыт предыдущего неудачного лечения препаратами интерферона, так как это повышает вероятность исходных мутаций устойчивости к препаратам у вируса, снижающую возможность выздоровления.
Длительность терапии зависит от степени поражения печени и наличия компенсированного или декомпенсированного цирроза. Стандартный курс – 12 недель, при циррозе может быть увеличен до 24 недель.
Возможно назначение дополнительно к схеме лечения рибавирина у пациентов с циррозом и с отрицательными прогностическими факторами ответа на лечение.
Для лечения пациентов с генотипом 1 (1а и 1в) существует 4 рекомендованные схемы препаратов прямого противовирусного действия:
Софосбувир+Ледипасвир
Софосбувир+Симепревир
Софосбувир+Даклатасвир
Софосбувир+Велпатасвир
Викейра Пак ( генотип 1в – 12 недель, генотип 1а – 24 недели).
Даклатосвир + Аунапревир – 24 недели
Для лечения пациентов с генотипом 2 и 3 существует две безинтерфероновые схемы, которые могут применяться также и при других генотипах – пангенотипические схемы.
Софосбувир+даклатасвир
Софосбувир +велпатасвир
Новые все более эффективные и безопасные препараты прямого противовирусного действия вводятся в клиническую практику постоянно. Информация о них регулярно появляется на нашем сайте.
Лечение новыми препаратами. Мнение специалиста
Кажущаяся простота и доступность лечения новыми препаратами, к сожалению, приводит к самолечению.
Лечение назначают продавцы препаратов по телефону и скайпу, без учета сопутствующих заболеваний, что может проявиться в побочных действиях, иногда смертельно опасных.
Неправильно подобранные схемы лечения и отсутствие правильного контроля безопасности во время лечения – основная причина неудач, связанных с генетическими изменениями вируса и формированием устойчивости вируса к препаратам
Такой вопрос задают себе более 160 миллионов человек в мире, инфицированных этим опасным вирусом.
Длительное воздействие вируса на печень может вызвать перерождение печеной ткани с формированием фиброза, который трансформируется в цирроз и рак печени.
Такой трагический исход заболевания чаще всего связан с тем, что пациент или поздно обращается к врачу, так как не знал о том, что инфицирован, или ему своевременно не была назначена противовирусная терапия.
Кто может заболеть вирусным гепатитом С?
Мы можем получить вирус достаточно часто при проведении манипуляций, связанных с кровью, в том числе при посещении стоматолога, хирургических операциях, переливании крови. Так же часто мы рискуем получить вирус гепатита С, когда делаем маникюр в салонах, татуировки, другие процедуры с инструментами, имеющими контакт с кровью и не прошедшими соответствующую санитарно-эпидемическую обработку. Это значит, каждый из нас может оказаться в группе риска.
Именно поэтому для всех нас последние достижения современной медицинской науки в области лечения вирусного гепатита С жизненно важны.
Как сейчас лечат вирусный гепатит С? Можно ли выздороветь?
История терапии вирусного гепатита С начинается примерно 15 лет назад с появлением противовирусных препаратов – интреферона и рибавирина, которые стали стандартом лечения и при правильном и своевременно назначенном лечении позволяли получить полное выздоровление. В настоящее время вирусный гепатита С официально признан излечимым заболеванием.
Однако, далеко не во всех случаях удается получить этот желаемый результат. Успех зависит от целого ряда обстоятельств: от возраста и пола пациента, генотипа вируса, длительности заболевания, степени поражения печени на момент начала терапии, генетических особенностей пациента в отношении ответа на противовирусные препараты. Ожидаемое выздоровление было возможно с максимальной вероятностью 40-60 %.
При продвинутом фиброзе и циррозе печени целью лечения было лишь остановить прогресс поражения печени, снизить риск развития осложнений – асцита, печеной недостаточности, кровотечений из расширенных вен желудка и пищевода, продлить жизнь и бороться за ее качество.
Трудности и опасности лечения
Эти недостатки противовирусной терапии часто приводили к тому, что пациенты отказывались от терапии из-за страха не получить результат, потратить деньги на лечение и прервать лечение из-за побочных действий препаратов. Те же причины вызывали нежелание врачей назначать терапию, так как на врача ложилась большая ответственность за результат и переносимость лечения.
Новые современные препараты – новые возможности терапии
Ситуация резко изменилась за последние два года. Фармацевтическая наука стремительно отреагировала на достижения в области изучения вируса гепатита С. Появилась новая информация не только о строении вируса, но и о деталях его функционирования в клетке печени и механизмах репликации (размножения). Это позволило разработать противовирусные препараты прямого действия на вирус с эффективностью лечения близкой к 100 %.
Первые препараты прямого противовирусного действия в России
Включение этих препаратов в комплекс лечения существенно повышает его эффективность, и рекомендуется пациентам, не получившим ответ на предыдущей терапии, с рецидивом после успешной терапии, а также пациентам с компенсированным циррозом печени.
Однако, практика применения телапревира и боцепревира в мире показала, что включение в комплекс лечения этих препаратов значительно ухудшает качество жизни пациента на момент лечения из-за добавления к побочным действиям интерфернона и рибавирина серьезных осложнений, вызванных этими препаратами. Значительные изменения клинического анализа крови (снижение лейкоцитов и тромбоцитов до угрожающего уровня) заставляет врача применять дополнительные препараты с целью их коррекции, что увеличивает и без того высокую стоимость лечения. Кроме того, серьезные кожные проявления при терапии нередко вызывали необходимость прекращения лечения.
Включение препарата симепревир в качестве третьего компонента комплексного лечения интерфероном и рибавирином показало его существенные преимущества. При увеличении эффективности лечения почти до 80 % у всех категорий пациентов никаких дополнительных побочных действий не наблюдается. Кроме того значительное удобство этого препарата связано с тем, что вместо нескольких дополнительных таблеток телаприевира и боцепревира в случае симепревира достаточно одной таблетки в день.
В настоящее время выпуск препаратов телапревир и боцепревир прекращен.
Препараты нового поколения – путь к полной победе над гепатитом С
Препараты нового поколения специфичны для различных генотипов вируса, кроме того, их применение зависит от истории противовирусной терапии пациента (были ли в прошлом попытки лечения и каковы их результаты), степени поражения печени (наличие цирроза), сопутствующих заболеваний.
В зависимости от этих показателей Европейской ассоциацией по изучению печени рекомендованы несколько различных комбинаций противовирусных препаратов прямого действия.
Эти препараты могут сочетаться с препаратами интерферона и рибавирина, а также только с рибавирином или без интерферона и рибавирина.
Подобрать схему лечения должен врач
В мире прошли регистрацию и рекомендованы к клиническому применению следующие препараты прямого действия (данные Европейской ассоциации по изучению печени май 2015 года):
Софосбувир – применяется для лечения всех генотипов вируса гепатита С, но в разных комбинациях с препаратами интерферона, рибавирина или без этих препаратов. Комбинация безинтерфероновой терапии может включать следующие препараты прямого противовирусного действия: симепревир, ледипасвир и даклатасвир. Результат лечения колеблется от 94 % до 100 %.
Викейра Пак - комбинация Viekira Pak содержит три новых антивирусных препарата – омбитасвир, паритапревир, усиленный ритонавиром (в одной таблетке), а также дасабувир. Результат лечения - от 94 % до 99,5 %.
Даклинза с асунапревиром (комплекс) – рекомендован к применению без интерферона и рибавирина.
Схема лечения и длительность терапии определяется врачом-гепатологом индивидуально в зависимости от генотипа вируса, вирусной нагрузки, наличия цирроза, сопутствующей инфекции (ВИЧ), предыдущего опыта лечения противовирусными препаратами.
Несмотря на кажущуюся простоту лечения (таблетки с минимальными побочными действиями) необходимо обязательное наблюдение врача-гепатолога, который правильно подберет необходимый именно вам курс противовирусной терапии и будет контролировать процесс лечения.
Читайте также:

