Как связан гепатит и лейкоз
Обновлено: 16.04.2024
Лейкемия и простуда - как не перепутать две болезни? Симптомы рака крови
Лейкемию или рак крови часто в простонародье называют белокровием. При этом онкологическом заболевании происходит нарушение процесса образования клеток крови в костном мозге, что приводит к бесконтрольному росту и мутации лейкоцитов, которые подавляют развитие здоровых кровяных телец.
Лейкемия не знает возрастных ограничений и может поразить людей любого возраста. Болезнь может быстро прогрессировать и привести к летальному исходу в течение 6 месяцев, если носит острый характер. Чаще симптомы лейкемии нарастают постепенно, поэтому больной и его врач не замечают, как начинается заболевание. В этом случае болезнь носит хронический характер и на начальной стадии ее симптомы схожи с проявлениями простуды.
Повышенную температуру, быструю утомляемость и постоянный озноб человек поначалу списывает на обычную простуду, никаких подозрений на онкологию на этом этапе у него не возникают. Лечение инфекции он проводит самостоятельно в домашних условиях или под наблюдением врача, который назначает ему принимать противопростудные средства. Примечательно, что недомогание при лейкемии может действительно пройти после приема лекарств, но уже очень скоро дальнейшее деление патологических клеток крови приводит к ухудшению состояния и повторному проявлению симптомов простуды.
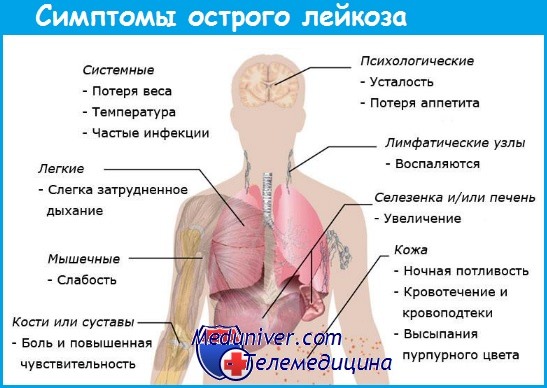
Человек, у которого рак крови, начинает часто болеть. Дело в том, что белые клетки крови - лейкоциты являются главными борцами со всеми инфекциями, а при лейкемии их функции ослабевают и иммунитет становится слабым. Соответственно, организм человека оказывается более уязвимым к любой болячке. Конечно, это не главный отличительный симптом лейкемии от простуды, но если вы часто простужаетесь обязательно надо пройти обследование, чтобы исключить развитие злокачественной болезни.
Для диагностики лейкемии необходимо сдать анализ крови, по результатам которого можно обнаружить заболевание еще до проявления характерных симптомов. Низкий гемоглобин, увеличение количества лейкоцитов и уменьшение количества тромбоцитов требуют более тщательного обследования. Если повторные анализы также указывают на патологическое изменение состава крови, то врач направляет пациента на биопсию костного мозга, чтобы поставить точный диагноз.
Как правило, опытные врачи выявляют хроническую лейкемию уже во время обычного осмотра. Первым делом врач должен проверить, не является ли кожа пациента аномально бледной. Этот симптом при лейкемии неизбежен и является результатом анемии - дефицита красных кровяных телец. Больной чувствуют постоянную усталость и отсутствие сил. Он целые сутки может спать, а проснувшись сказать, что не выспался.
Следующим распространенным симптомом лейкемии является увеличение лимфоузлов, селезенки и печени. Пораженные раком лейкоциты скапливаются в лимфоузлах и развиваются в них дальше, поэтому при лейкемии узлы могут увеличиваться многократно в диаметре, а механическое нажатие на них вызывает боль различной степени интенсивности, что должно насторожить человека. Увеличение лимфоузлов может привести к сдавливанию трахеи и крупных сосудов. Из-за этого нарушается дыхание, появляются кашель и одышка.
Увеличение печени при лейкемии не является критичным. Больших размеров при этом виде онкологии печень не достигает, чего нельзя сказать о селезенке, которая начинает активно расти уже на начальных этапах развития болезни и постепенно становится большой и плотной. Боли и дискомфорта при этом человек может не ощущать, что затрудняет диагностику лейкемии, особенно у пациентов с избыточной массой тела.
Рак крови способствует нарушению процессов выработки тромбоцитов, уменьшение количества которых приводит к плохой свертываемости крови. Поэтому человек больной раком крови часто сталкивается с кровотечениями и синяками. Любое легкое столкновение тела с твердым предметом может привести к появлению синяка, при этом сам человек может и не вспомнить, где и когда он получил этот синяк. Кроме того, при лейкемии на теле появляются мелкие пятнышки синего цвета, похожие на звёздочки.
Больному лейкемией опасны даже неглубокие порезы, царапины, носовые кровотечения и кровотечение десен, так как все они могут привести к серьезным потерям крови. У женщин на фоне заболевания наблюдаются нарушение цикла, обильные менструации и спонтанные маточные кровотечения.
Раньше считалось, что лейкемия - неизлечимая болезнь. Сегодня медицина шагнула далеко вперёд. При своевременной диагностике и начале лечения рак крови можно победить в 90% случаев. Легче всего вылечить лейкемию у детей. Главное вовремя обратиться к врачу, так как чем раньше начать лечение лейкемии, тем больше шансов на полное выздоровление.
М. Г. Ипатова 1, 2 к.м.н., Ю. Г. Мухина 1 д.м.н. профессор, П. В. Шумилов 1 д.м.н., профессор
1 Российский национальный исследовательский медицинский университет им. Н. И. Пирогова
МЗ РФ, Москва
2 Детская Городская Клиническая Больница № 13 им. Н. Ф. Филатова, Москва
Ключевые слова: печень, синдром цитолиза, аланинаминотрансфераза, аспартатамино-трансфераза, гепатопротективные препараты
В статье изложены биохимические лабораторные показатели и их клиническое значение при заболеваниях печени, протекающих с синдромом цитолиза. Отдельное внимание уделено механизмам действия гепатопротективных препаратов, применяемых при цитолитическом синдроме.

Рис. 1. Роль печени в обмене веществ.
Сокращения: ЛПВП - липопротеиды высокой плотности; ЛПОНП - липопротеиды очень низкой плотности; РЭС ретикуло-эндотелиальная система; НАД - никотинамидадениндинуклеотид; ФАД - флавинадениндинуклеотид.
Печень представляет собой центральный орган химического гомеостаза организма, где создается единый обменный и энергетический пул для метаболизма почти всех классов веществ [1]. К основным функциям печени относятся: метаболическая, депонирующая, барьерная, экскреторная, гомеостатическая и детоксицирующая [2]. Печень может обезвреживать как чужеродные экзогенные вещества, обладающие токсическими свойствами, так и синтезированные эндогенно.
Таблица 2. Причины повышения уровня аминотрансфераз
Печеночные причины
Внепеченочные причины
•Вирусные гепатиты (В, С, ЦМВ и др.)
•Хронические инфекции и паразитарные
заболевания (эхинококкоз, токсоплазмоз и др.)
•Неалкогольный стеатогепатит
•Аутоиммунные заболевания печени
•Злоупотребление алкоголем
•Прием лекарственных препаратов
(статины, некоторые антибиотики, противогрибковые препараты, нестероидные
противовоспалительные препараты,
глюкокортикостероиды, другие)
•Метаболические заболевания печени
(галактоземия, фруктоземия, гликогенозы,
дефицит альфа1-антитрипсина,
аминоацидопатии, нарушение цикла мочевины, нарушение окисления жирных кислот, митохондриальная гепатопатия, некоторые лизосомные заболевания (болезнь
Гоше, болезнь Ниманна-Пика, дефицит кислой липазы и др.), муковисцидоз, синдром Швахмана-Даймонда, гемохроматоз, болезнь Вильсона и др.)
•врожденные и приобретенные дефекты
сосудов системы воротной вены (болезнь
Бадда-Киари и др.)
•Цирроз печени
•Опухоли печени
•Патология сердца (острый инфаркт
миокарда, миокардит)
•Повышенная физическая нагрузка
•Наследственные нарушения мышечного
метаболизма
•Приобретенные мышечные заболевания
•Травма и некроз мышц
•Целиакия
•Гипертиреоз
•Тяжелые ожоги
•Гемолиз эритроцитов
•Нарушение кислотно-щелочного равновесия
•Сепсис
Находясь между портальным и большим кругами кровообращения, печень выполняет функцию большого биофильтра. Через воротную вену в нее поступает более 70% крови, остальная кровь попадает через печеночную артерию. Большая часть веществ, всасывающихся в пищеварительном тракте (кроме липидов, транспорт которых в основном осуществляется через лимфатическую систему), поступает по воротной вене в печень [2]. Таким образом, печень функционирует как первичный регулятор содержания в крови веществ, поступающих в организм с пищей (рис 1).
Большое разнообразие функций гепатоцитов приводит к тому, что при патологических состояниях печени нарушаются биохимические константы, отражающие изменения многих видов обмена. Поэтому стандартный биохимический анализ крови включает определение различных параметров, отражающих состояние белкового, углеводного, липидного и минерального обмена, а также активность некоторых ключевых ферментов.
Концентрация ферментов в клетках значительно выше, чем в плазме крови; в норме только очень незначительная часть определяется в крови. Наиболее частыми причинами повышения уровня ферментов в сыворотке крови являются: прямое поражение клеточных мембран, в частности вирусами и химическими соединениями, гипоксия и ишемия тканей. Иногда активность ферментов увеличивается в результате их повышенного синтеза в тканях. Определение активности тех или других ферментов в сыворотке крови позволяет судить о характере и глубине поражения различных компонентов гепатоцитов [3, 4].
Ферменты в зависимости от их локализации можно разделить на несколько групп:
1) универсально распространенные ферменты, активность которых обнаруживается не только в печени, но и в других органах – амино-трансферазы, фруктозо-1-6-дифосфатальдолаза;
2) печеночноспецифические (органоспе-цифические) ферменты; их активность исключительно или наиболее высоко выявляется в печени. К ним относятся холинэстераза, орнитин-карбамилтрансфераза, сорбитдегидрогеназа и др.;
3) клеточноспецифические ферменты печени относят преимущественно к гепатоцитам,
купферовским клеткам или желчным канальцам (5-нуклеотидаза, аденозинтрифосфатаза);
4) органеллоспецифические ферменты, являются маркерами определенных органелл
гепатоцита: митохондриальные (глутаматде-гидрогеназа, сукцинатдегидрогеназа, цитохромоксидаза), лизосомальные (кислая фос фатаза, дезоксирибонуклеаза, рибонуклеаза), микросомальные (глюкозо-6-фосфатаза).
Специфичность ферментов и их диагностическое значение представлено в таблице 1 [5].
Отдельное место занимает макроэнзиме-мия – редкое и крайне сложное для дифференциальной диагностики состояние, при котором происходит комплексирование молекул того или иного энзима с иммуноглобулинами или небелковыми веществами. Описаны клинические наблюдения макро-КФК-емии, макро-ЛДГ-емии, макро-АСТ-емии, макро-ГГТ-емии, макроамилаземии. Макро-энзимемии сложны для диагностики и дифференциальной диагностики и ведут к проведению инвазивных методов обследования и необоснованному лечению.
В основе выявления макроэнзимемии лежит выявление отличий молекулы макрофермента от молекулы обычного энзима. Некоторые из этих методов являются прямыми, т. е. такими, которые позволяют непосредственно определить присутствие в крови ферментного комплекса, имеющего гораздо более высокий молекулярный вес, чем молекула нормального фермента. В основу прямого метода положено разделение белков сыворотки по молекулярному весу. Другие же методы являются непрямыми, так как выявление макроэнзима в крови проводится не путем выявления самого ферментного комплекса, а основываются на выявлении какого-либо из свойств макроэнзима. Прямые тесты имеют большее диагностическое значение и влекут за собой меньше технических и диагностических ошибок.
В некоторых ситуациях повышение ферментов является физиологическим: уровень щелочной фосфатазы повышен у подростков в период вытяжения (период ускорения роста), у здоровых женщин во время третьего триместра беременности (за счет плаценты). Однако очень высокую активность щелочной фосфатазы наблюдают у женщин с преэк-лампсией, что связно с нарушением кровообращения плаценты [7].
Большое значение в диагностике заболеваний печени имеют анамнестические данные и клиническая картина заболевания. Из анамнеза следует попытаться узнать о факторах риска заболеваний печени, обращая особое внимание на семейный анамнез, прием лекарств, витаминов, растительных добавок, наркотиков, алкоголя, трансфузии препаратов крови, патологические результаты печеночных проб в прошлом и симптоматику заболеваний печени. Клиническое обследование позволяет диагностировать до 50–60% патологических состояний. Более детальная дифференциальная диагностика основана на иммунохимических методах. Они позволяют детализировать характер вирусной, а также паразитарной инфекции, определить локализацию неопластического процесса, определить этиологию аутоиммунного заболевания, уточнить вид нарушения наследственных заболеваний обмена веществ.
При патологии печени в биохимическом анализе крови выделяют 4 синдрома:
• Синдром печеночно-клеточной недостаточности
• Мезенхиально-воспалительный синдром.
В данной статье мы подробно разберем по
казатели, характерные для синдрома цитолиза.
Синдром цитолиза – это синдром, обусловленный нарушением проницаемости клеточных мембран, распадом мембранных структур или некрозом гепатоцитов с выходом в плазму ферментов (АЛТ, АСТ, ЛДГ, альдолазы и др.).
АМИНОТРАНСФЕРАЗЫ: аспартатаминотрансфераза и аланинаминотрансфераза
Референтные значения: у новорожденных детей до 1 мес. – менее 80 Ед/л; от 2 мес. до 12 мес. – менее 70 Ед/л., с 1 года до 14 лет – менее 45 Ед/л, у женщин – менее 35 Ед/л, у мужчин – менее 50 Ед/л.
В клинической практике широко применяется одновременное определение уровня двух трансаминаз – аспартатаминотрансферазы (AСT) и аланинаминотрансферазы (АЛТ) в сыворотке крови.
Ферменты АЛТ и АСТ содержатся практически во всех клетках человеческого организма. Однако самый высокий уровень фермента АЛТ содержится в печени, поэтому уровень данного энзима служит специфическим маркером поражения печени. В свою очередь, АСТ помимо печени (в порядке снижения концентрации) содержится в сердечной и скелетных мышцах, почках, поджелудочной железе, легких, лейкоцитах и эритроцитах [6, 7, 8].
В печени АЛТ присутствует только в цитоплазме гепатоцитов, а АСТ – в цитоплазме и в митохондриях. Более 80% печеночной АСТ представлено именно митохондриальной фракцией [6, 7, 8].
В норме постоянство концентрации транс-аминаз в плазме крови отражает равновесие между их высвобождением вследствие физиологического апоптоза состарившихся гепатоци-тов и элиминацией. Соотношение синтеза АСТ/ АЛТ в печени равно 2,5/1. Однако при нормальном обновлении гепатоцитов уровни АСТ и АЛТ в плазме крови практически одинаковы (30–40 Ед/л) из-за более короткого периода полувыведения АСТ (18 ч против 36 ч у АЛТ).
При заболеваниях печени в первую очередь и наиболее значительно повышается активность АЛТ по сравнению с АСТ. Например, при остром гепатите, независимо от его этиологии, активность аминотрансфераз повышается у всех больных, однако преобладает уровень АЛТ, содержащейся в цитоплазме, вследствие ее быстрого выхода из клетки и поступления в кровяное русло. Таким образом, по уровню АЛТ судят о биохимической активности заболевания печени. Повышение показателя в 1,5–5 раз от верхней границы нормы свидетельствует о низкой активности процесса, в 6–10 раз – об умеренной и более 10 раз – о высокой биохимической активности. Повышение активности трансаминаз более 6 месяцев является биохимическим признаком хронического гепатита [6, 7].
Некоторые лекарственные препараты (например, вальпроевая кислота) метаболизируются в митохондриях гепатоцитов [9], поэтому ранним лабораторным маркером гепатотоксичности может быть лишь изолированное повышение АСТ.
Помимо патологии печени АСТ служит одним из ранних маркеров повреждения сердечной мышцы (повышается у 93–98% больных инфарктом миокарда до 2–20 норм); специфичность его не высока. Уровень ACT в сыворотке крови возрастает через 6–8 часов после начала болевого приступа, пик приходится на 18–24 часа, активность снижается до нормальных значений на 4–5 день. Нарастание активности фермента в динамике может свидетельствовать о расширении очага некроза, вовлечении в патологический процесс других органов и тканей, например, печени [7].
Интенсивные мышечные упражнения с чрезмерной нагрузкой также могут вызвать преходящее увеличение уровня ACT в сыворотке крови. Миопатии, дерматомиозиты и другие заболевания мышечной ткани вызывают повышение трансаминаз, преимущественно за счет АСТ.
Умеренное увеличение активности АСТ (в 2–5 раз от верхней границы нормы) отмечается при острых панкреатитах и гемолитических анемиях.
При латентных формах цирроза печени повышения активности ферментов, как правило, не наблюдают. При активных формах цирроза стойкий незначительный подъем аминотрансфераз выявляют в 74–77% случаев, и, как правило, преобладает активность АСТ над АЛТ в два и более раз.
Снижение активности АЛТ и АСТ имеет место при недостаточности пиридоксина (витамина В6), при почечной недостаточности, беременности.
Ниже приведены печеночные и внепеченочные причины повышения активности аминотрансфераз в сыворотке крови (табл. 2).
Помимо оценки уровня трансаминаз в клинической практике широко применяется коэффициент де Ритиса – отношение АСТ к АЛТ (АСТ/АЛТ). В норме значение этого кэффициента составляет 0,8–1,33. Следует отметить, что расчет коэффициента де Ритиса целесообразен только при выходе АСТ и/или АЛТ за пределы референтных значений.
У новорожденных детей соотношение АСТ/АЛТ обычно превышает 3,0, однако к пятому дню жизни снижается до 2,0 и ниже.
При поражениях печени с разрушением гепатоцитов преимущественно повышается АЛТ, коэффициент де Ритиса снижается до 0,2–0,5. При патологии сердца преобладает уровень АСТ, и коэффициент де Ритиса повышается. Однако для точной дифференциальной диагностики этот коэффициент непригоден, так как нередко при алкогольном поражении печени, неалкогольном стеатогепатите, циррозе печени также преобладает повышение АСТ и коэффициент де Ритиса составляет 2,0–4,0 и более. Значение данного коэффициента выше нормы часто наблюдается при обтурационных желтухах, холециститах, когда абсолютные значения АЛТ и АСТ невелики.
1. При остром вирусном и хроническом гепатитах, особенно на ранних стадиях, активность АЛТ выше, чем АСТ (коэффициент де Ритиса меньше 1,0). Тяжелое поражение паренхимы печени может изменить это соотношение.
2. При алкогольном гепатите и циррозе нередко активность АСТ оказывается выше, чем АЛТ (коэффициент де Ритиса больше 1,0).
3. При остром ИМ активность АСТ выше, чем АЛТ (коэффициент де Ритиса больше 1,5).
ЛАКТАТДЕГИДРОГЕНАЗА
Референтные значения ЛДГ для новорожденных – до 600 Ед/л, у детей с 1 года до 12 лет активность ЛДГ – 115 – 300 Ед/л, для детей старше 12 лет и у взрослых норма ЛДГ – до 230 Ед/л.
Лактатдегидрогеназа (ЛДГ) – гликолитический цинксодержащий фермент, обратимо катализирующий окисление L-лактата в пируват, широко распространен в организме человека. Наибольшая активность ЛДГ обнаружена в почках, сердечной мышце, скелетной мускулатуре и печени. ЛДГ содержится не только в сыворотке, но и в значительном количестве в эритроцитах, поэтому сыворотка для исследования должна быть без следов гемолиза [7].
При электрофорезе или хроматографии удается обнаружить 5 изоферментов ЛДГ, отличающихся по своим физико-химическим свойствам. Наибольшее значение имеют два изофермента – ЛДГ1 и ЛДГ5. Фракция ЛДГ1 более активно катализирует обратную реакцию превращения лактата в пируват. Она в большей степени локализуется в сердечной мышце и некоторых других тканях, в норме функционирующих в аэробных условиях. В связи с этим миокардиальные клетки, обладающие богатой митохондриальной системой, окисляют в цикле трикарбоновых кислот не только пируват, образующийся в результате протекающего в них самих процесса гликолиза, но и лактат, образующийся в других тканях. Фракция ЛДГ5 более эффективно катализирует прямую реакцию восстановления пирувата в лактат. Она локализуется преимущественно в печени, в скелетных мышцах. Последние нередко вынуждены функционировать в анаэробных условиях (при значительной физической нагрузке и быстро наступающем утомлении). Образующийся при этом лактат с кровотоком попадает в печень, в которой он используется для процесса глюконеогенеза (ресинтеза глюкозы), а также в сердце и другие ткани, где происходит его преобразование в пируват и вовлечение в цикл трикарбоновых кислот (цикл Кребса). Любое повреждение клеток тканей, содержащих большое количество ЛДГ (сердце, скелетные мышцы, печень, эритроциты), приводит к повышению активности ЛДГ и ее изо-ферментов в сыворотке крови. Наиболее частыми причинами повышения активности ЛДГ являются:
1. Поражение сердца (острый инфаркт миокарда, миокардит, застойная сердечная недостаточность); в этих случаях обычно преобладает повышение активности ЛДГ1 и/или ЛДГ2.
2. Поражение печени (острые и хронические гепатиты, цирроз печени, опухоли и метастазы печени), когда преимущественно увеличивается изофермент ЛДГ5, ЛДГ2, ЛДГ4.
3. Повреждение скелетных мышц, воспалительные и дегенеративные заболевания
скелетных мышц (преимущественно увеличение изофермента ЛДГ1, ЛДГ2, ЛДГ3).
4. Заболевания крови, сопровождающиеся распадом клеток крови: острый лейкоз, гемолитическая анемия, В12-дефицитная анемия, серповидноклеточная анемия, а также заболевания и патологические состояния, сопровождающиеся разрушением тромбоцитов (массивная гемотрансфузия, эмболия легочной артерии, шок и др.). В этих случаях может преобладать повышение активности ЛДГ2, ЛДГ3.
5. Острый панкреатит.
6. Заболевания легких (пневмония и др.)
7. Инфаркт почки.
8. Опухоли (повышенный уровень ЛДГ наблюдается в 27% случаев опухолей в I стадии и в 55% – метастатических семином).
Следует помнить, что многие заболевания сердца, скелетных мышц, печени и крови могут сопровождаться повышением активности в сыворотке крови общей ЛДГ без отчетливого преобладания какого-либо из ее изоферментов.
Таблица 3. Эффективность гепатопротекторов при синдроме цитолиза (по С. В. Морозову с соавт., 2011 г. и Н. Б. Губергриц, 2012 г.) [10]
Распространенность гепатита В и С у гематологических больных - эпидемиология
Частота распространения маркеров инфицированности вирусом гепатита В среди больных онкологическими гематологическими заболеваниями варьирует в широких пределах — от 3,9 до 97 %. Такая значительная разница может быть связана с местом и временем проведения исследования, спектром выявляемых маркеров и используемыми для этого методами (ИФА, ПЦР), а также размерами выборки и, главное, уровнем тестирования донорской крови в данной стране.
Более широко маркеры вирусного гепатита В выявлялись в первой половине 80-х годов, до введения в большинстве развитых стран тестирования донорской крови на наличие HBsAg высокочувствительными методами. В последующие годы инфицированность гепатитом В в этих странах встречалась редко. По данным S. Dibenedetto и соавт., P. Monteleone и соавт., обследовавших 90 детей с онкогематологическими заболеваниями на наличие HBsAg через 2—3 года после окончания полихимиотерапии и 45 детей на наличие HBsAg, анти-НВс и анти-HBs, эти маркеры не были обнаружены ни у одного ребенка.
Тем не менее в некоторых регионах инфицированность пациентов с онкологическими заболеваниями вирусом гепатита В и в настоящее время остается достаточно высокой. Так, в Турции в 1996 г. было проведено обследование пациентов детских онкологических стационаров. Согласно данным, полученным при использовании иммуноферментного анализа (ИФА), инфицированность этого контингента вирусом гепатита В составила 20 %. В Индии, по сведениям, опубликованным в 1998 г., 43,1 % обследованных больных острым лимфобластным лейкозом (ОЛЛ) оказались инфицированными вирусами гепатитов, из них у 50 % был выявлен гепатит В.
По материалам, представленным в мировой литературе в 1997—1998 гг., частота обнаружения гепатита В у детей с онкологическими гематологическими заболеваниями (ОГЗ) колеблется от 36,8 до 47,4 %. В последние годы этот показатель существенно снизился. Так, по данным 2003 г., в Турции HBsAg обнаружен у 11,6 % детей с онкогематологическими заболеваниями (ОГЗ). В то же время ретроспективный анализ результатов обследования 558 детей, перенесших онкологическое гематологическое заболевание (ОГЗ), в Польше выявил инфицированность вирусом гепатита В, равную 62,2 %, что сведетельствует о том, что проблема эта продолжает оставаться остроактуальной.
В России (Вятка) Н. Н. Кузнецова и соавт. при выборочном тестировании в ИФА сыворотки крови 47 детей с онкогематологическими заболеваниями (ОГЗ) HBsAg обнаружили у 29,8 %. У взрослых пациентов в нашей стране в 1997 г. гепатит В встречался с частотой 7,8—11,2 %.
Пристальное внимание к распространенности вирусных гепатитов у детей обусловлено эффективностью лечения онкогематологических заболеваний, что в последние годы привело к выживанию (длительная ремиссия и выздоровление) 60—75 % ранее обреченных детей. В 1997—1998 гг. частота инфицированности вирусом гепатита С стала предметом особого внимания клиницистов. Цифры достаточно неутешительны: в Польше — 38,7 % в 1997 г. и 54,3 % в 2001 г., в Японии - 31,4 %. Эти данные получены при использовании ПЦР. В России при тестировании только антиHCV в ИФА у взрослых пациентов показатели не превышали 12,2-19,4 %.
Для выяснения истинных размеров инфицированности вирусами гепатитов В и С в нашей стране нами проведено сплошное обследование (скрининг) детей, находившихся в отделении онкогематологии Республиканской детской клинической больницы г. Москвы, куда поступают дети с онкогематологическими заболеваниями со всей России. Наиболее распространенной патологией были ОЛЛ (69,2 %) и В-клеточная лимфома (14,7 %).
Исследовались все известные маркеры инфицированности вирусами гепатитов В и С в ИФА, а также ДНК вируса гепатита В и РНК вируса гепатита С в ПЦР. Полученные данные свидетельствуют об очень высокой инфицированности, составляющей в целом 74,9 % детей: 27,3 % — гепатит В, 34,3 % — гепатит С и 13,3 % — сочетанная (В+С) инфекция, т. е. отмечается преимущественно гепатит С, частота которого с учетом смешанного инфицирования достигает 47,6 %.
В последнее время в литературе широко обсуждаются данные о вероятной этиологической роли инфекции, вызванной вирусом гепатита С, в возникновении неходжкинских лимфом. В частности, С. Mazzaro и соавт., обследовав 199 пациентов с лимфомами и 153 пациента с иными онкологическими заболеваниями в трех клиниках Италии, обнаружили инфицированность вирусом гепатита С у 28 % больных с лимфомами, тогда как при иных злокачественных заболеваниях этот показатель составил 3,1 %. Распространенность этой инфекции особенно высока среди пациентов с низкодифференцированными лимфомами (38,4 % по сравнению с 15,2 % при высокодифференцированных лимфомах).
Предполагают, что в основе этого явления лежит длительная стимуляция вирусом гепатита С определенной популяции В-лимфоцитов. Эта стимуляция способствует накоплению мутации протоонкогенов и фактора, подавляющего опухолевый рост. В работе, посвященной выявлению инфицированности мононуклеаров крови вирусом гепатита С, подчеркивается, что это явление особенно характерно для иммуннокомпрометированных пациентов. Авторы делают вывод, что со временем персистирование инфицированных иммунных клеток может приводить к определенным поломкам нормальных иммунологических механизмов и развитию В-клеточных лимфом, при этом выделение вируса гепатита С у пациентов с неход-жкинскими лимфомами может не сопровождаться поражением печени.
Интересные данные приводят L. Zhang и соавт. по результатам проспективного обследования детей, перенесших онкологическое гематологическое заболевание. Оказалось, что инфицированность этих детей вирусом гепатита С прямо зависела от числа гемотрансфузий: она возрастала с 3,7 % после одной гемотрансфузий до 72,7 % после 10. Клинико-лабораторных проявлений гепатита авторы у детей не наблюдали. Они делают вывод об особой, повышенной чувствительности пациентов с онкологическими гематологическими заболеваниями к вирусу гепатита С.
Таким образом, становятся очевидными острота и масштабность проблемы вирусных гепатитов у пациентов с онкологическими гематологическими заболеваниями (ОГЗ) как в нашей стране, так и во всем мире. Отправной точкой решения этой проблемы является их диагностика.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Течение гепатитов В и С у гематологических больных - критерии оценки
Ряд отечественных авторов также отметили высокую частоту хронизации вирусных гепатитов у пациентов с онкологическими заболеваниями. В то же время S. Dibenedetto и соавт. приводят данные о хроническом течении гепатита С только у 17,2 % детей ОЛЛ и у 25 % пациентов с другими онкозаболеваниями. В работе U. Dutta представлены данные о 51 больном, причем ни у одного не произошло элиминации вируса.
В. Sevinir и соавт. обратили внимание на растущую роль инфицированности вирусами гепатитов В и С в развитии хронического гепатита у пациентов с онкологическими гематологическими заболеваниями и определили сроки его формирования: 13 мес при гепатите В и 5 мес при гепатите С.
Очень важно течение самого онкологического гематологического заболевания в условиях наслоения вирусного гепатита. В ряде случаев присоединение гепатитов В и С заставляет прервать терапию основного заболевания (угроза печеночной недостаточности). Следствием вынужденных перерывов и нарушений протокола лечения является более высокая частота рецидивов (56,5 % против 40,4 %).
S. Dibenedetto и соавт. сообщили о достоверно большем числе вынужденных перерывов поддерживающей терапии в группе инфицированных вирусом гепатита С детей с ОЛЛ по сравнению с неинфицированными.
Фоном, на котором происходит развитие гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями, является широкий спектр поражений печени иного происхождения. Печень пациентов с онкологическими гематологическими заболеваниями подвержена воздействию многих патогенных факторов. В первую очередь следует отметить поражение печени в рамках различных онкологических заболеваний. Наиболее часто при этом выявляется диффузная или фокальная инфильтрация печени опухолевыми клетками, затрагивающая портальные тракты и синусоиды.
Часто гепатотоксическое воздействие оказывают противоопухолевые препараты и антибиотики. Спектр наблюдаемых при этом клинико-морфологических вариантов патологии печени очень широк. В частности, при исследовании метотрексата наряду с поражением печени по типу острого гепатита может развиться печеночный фиброз различной степени выраженности. Для проявлений токсичности 6-меркаптопурина характерны некроз и ожирение гепатоцитов, формирование фиброза портальных трактов, холестатические поражения. Токсические гепатиты с нарушением функции печени могут вызывать также циклофосфан, L-аспарагиназа, декарбазин, идарубицин.

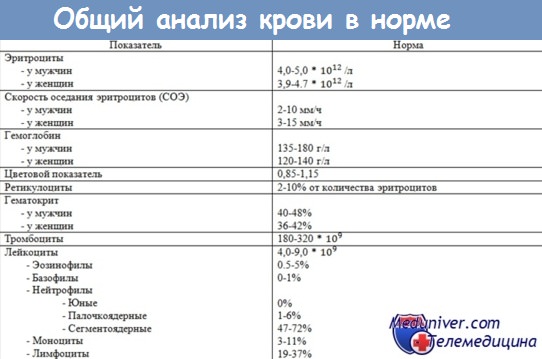
Биохимический анализ крови в норме
Известны случаи развития тяжелых гепатотоксических реакций после однократного введения дактиномицина. В литературе встречаются описания острого гепатита, ассоциированного с приемом антибактериальных препаратов (эритромицин, сульфаниламиды, тетрациклин), используемых среди прочих при лечении онкологических больных. Большие дозы тетрациклина приводят к поражению печени, сходному с острой жировой дистрофией. Использование ципрофлоксацина может обусловить возникновение тяжелого гепатонекроза. Некоторые препараты: эритромицин, амоксициллин/клавуланат, тетрациклин, циклоспорин — вызывают холестатические поражения печени.
Гепатотоксичны также противогрибковые агенты, в частности флуконазол, итраконазол, кетоконазол.
Развитие гепатонекроза возможно при лечении таким широко используемым препаратом, как парацетамол. Сочетание различных препаратов может приводить к потенцированию их гепатотоксичности. Так, воздействие на печень 6-меркаптопурина усиливается при параллельном применении его с доксорубицином. Длительное лечение цитостатическими препаратами может приводить к портальной гипертензии вследствие выраженного фиброза.
Особой формой поражения печени у больных с онкологическими гематологическими заболеваниями является веноокклюзионная болезнь печени, которая встречается главным образом в отделениях ТКМ у пациентов, которым проводят высокодозную ПХТ. Веноокклюзионная болезнь характеризуется гипербилирубинемией, быстрым увеличением и болезненностью печени и задержкой жидкости с развитием асцита.
Морфологически выявляются фиброзная облитерация терминальных печеночных венул, расширение или фиброз центролобулярных синусоидов, некроз гепатоцитов зоны 3, отложение фибрина и фактора VIII в стенках терминальных венул. Данные о распространенности веноокклюзионной болезни очень разноречивы — от 1,2 до 53 %. Ряд авторов утверждают, что риск развития веноокклюзионной болезни возрастает при повышении уровня трансами-наз перед проведением так называемого кондиционирования, которое заключается во введении больному химиопрепаратов в очень высоких дозах и последующей ТКМ.
Веноокклюзионная болезнь чаще развивается у больных, инфицированных вирусом гепатита С, а также у пациентов, длительно получавших антибиотики шикого спектра действия, противогрибковые и противовирусные препараты (амфотерицин В, ацикловир и ванкомицин). В основе патогенеза веноокклюзионной болезни, вероятно, лежат многие факторы: повреждение эндотелия, приводящее к активации факторов свертывания и усилению агрегации тромбоцитов, повышение содержания цитокинов, высокие дозы бусуль-фана, а также снижение содержания глутатиона в гепатоцитах.
У больных с онкологическими гематологическими заболеваниями (ОГЗ) может наблюдаться пострадиационное поражение печени, для которого в острый период характерно повышение уровня щелочной фосфатазы и печеночных трансаминаз, редко — желтуха и асцит. Параллельное применение доксорубицина, дактиномицина и винкристина потенцирует лучевое поражение печени. Одно из отдаленных последствий облучения — фиброз печени.
Редкой патологией печени, которая может развиться в связи с химиотерапией по поводу онкологических заболеваний, является нодулярная регенеративная гиперплазия.
В связи с широким применением цитостатической и гормональной терапии по поводу онкологического гематологического заболевания (ОГЗ), оказывающей выраженное иммуносупрессивное действие, пациенты этой категории крайне подвержены инфекционным заболеваниям. Следовательно, гепатиты у этих больных также могут быть обусловлены широким спектром инфекционных агентов: неспецифическими поражениями в рамках генерализованных инфекций, абсцессами печени, грибковыми заболеваниями (кандидоз, аспергиллез, криптококкоз) и вирусными гепатитами, в том числе обусловленными цитомегаловирусами, вирусами простого и опоясывающего герпеса, аденовирусами.
От гепатитов В и С, развивающихся на подобном фоне, уже априорно можно ожидать необычного течения и своеобразия клинико-лабораторных проявлений, имеющих большое значение для распознавания и лечения этих заболеваний.
Соотношение маркеров репликации гепатитов В и С и активности АЛТ при моно- и микст-инфекции (в процентах к числу обследованных)
| Маркер в ПЦР | Активность АЛТ - нормальная | Активность АЛТ - незначительное повышение (в 1,5—2 раза) |
| РНК ВГС+ | 5,8 | 94,2 |
| ДНК ВГВ+ | 25,0 | 75,0 |
| РНК+, ДНК+ | 58,3 | 41,7 |
По нашим данным, наличие и тяжесть клинических проявлений гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями находятся в прямой зависимости от способа выявления инфицированных. При активном скрининговом обследовании абсолютно приобладают безжелтушная и инаппарантная формы гепатита В (до 100 %). Без активного обследования у этого контингента больных обнаруживаются лишь манифестные формы гепатитов, тяжесть которых превосходит таковую при гепатите В у детей без онкологического гематологического заболевания.
Так, из 29 детей с онкологическими гематологическими заболеваниями при манифестных формах гепатитов В и С у 7 больных наблюдались формы средней тяжести, у 10 — тяжелые и у 2 — злокачественные формы с явлениями острой печеночной энцефалопатии (ОПЭ). У большинства пациентов с онкологическими гематологическими заболеваниями вирусный гепатит приобретает хроническое течение. Об этом в определенной степени свидетельствует тот факт, что из 18 HBsAg-позитивных пациентов, выявленных до начала исследования, у 15 персистенция HBsAg сохранялась более 6 мес.
К особенностям, затрудняющим диагностику вирусных гепатитов на фоне онкологического гематологического заболевания, относится отсутствие корреляции между вирусной репликацией и активностью печеночных ферментов у большинства пациентов независимо от наличия ПХТ. Так, в образцах с нормальной активностью АЛТ от детей в период ПХТ частота обнаружения ДНК составила 44,4 %, а в образцах от детей, которым лечение было отменено, — 42,9 %.
Высокая активность АЛТ обнаружена лишь у 2 % детей с онкологическим гематологическим заболеванием при наличии в крови ДНК вируса гепатита В, средняя — также у 2 %, незначительное повышение — у 32 % детей. У остальных 64 % уровень АЛТ оставался нормальным несмотря на присутствие в крови маркера активной вирусной репликации. В отсутствие онкологического гематологического заболевания наличие ДНК вируса гепатита В в 96,9 % случаев сопровождалось высокой активностью АЛТ.
При гепатите С соотношения аналогичны. У абсолютного большинства активно выявленных при скрининговом обследовании больных гепатит С протекает в безжелтушной и инаппарантной формах. У пациентов, поступающих в гепатитные отделения с манифестными формами, наблюдается широкий спектр клинических форм — от легких типичных до тяжелых холестатических.
Как и при гепатите В, активность трансаминаз у пациентов с гепатитом С и онкологического гематологического заболевания на фоне вирусной репликации повышается незначительно или остается нормальной, в то время как гепатит С без сопутствующего онкологического гематологического заболевания чаще протекает со значительным увеличением активности АЛТ.
Подавление цитолиза максимально выражено при одновременной репликации вирусов гепатитов В и С. Уровень АЛТ не повышается более чем у половины детей с активной микст-инфекцией.
Практический вывод таков: активность АЛТ не может быть использована в качестве привычного и надежного критерия диагностики и контроля за течением гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями.
Оценка собственно клинических (объективных и субъективных) проявлений гепатитов В и С у больных с онкологическими гематологическими заболеваниями также очень сложна, особенно на фоне ПХТ. Слабость, вялость, тошнота, рвота, анорексия и т. д. встречаются почти постоянно как побочные эффекты массивной ПХТ, поэтому они не могут служить признаками гепатитов В и С так же, как увеличение печени и желтуха, которые могут иметь медикаментозное происхождение, быть следствием веноокклюзионной болезни и т. д.
Таким образом, диапазон форм тяжести гепатитов В, С и микст-гепатитов у больных с онкологическими гематологическими заболеваниями достаточно широк. При активном целенаправленном выявлении абсолютно преобладают безжелтушные, субклинические и инаппарантные формы. Немногочисленные манифестные заболевания протекают преимущественно в тяжелой (35 %) и злокачественной (10 %) формах. При вирусных гепатитах у детей с онкологическими гематологическими заболеваниями корреляция между репликацией вируса и активностью печеночных ферментов в большинстве случаев отсутствует, что наряду с невыраженностью клинических признаков существенно затрудняет выявление инфицированных. Главным методом остается генная диагностика с использованием ПЦР.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Тромбоцитопения: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Тромбоциты – клетки крови, имеющие форму пластинки, которые участвуют в процессах свертывания крови. Их основная функция – закрытие раны при кровотечении путем образования тромба, или сгустка крови. Тромбообразование является естественным процессом защиты от массивной кровопотери при любых травмах. Дефицит тромбоцитов в крови называется тромбоцитопенией. Данное состояние достаточно часто протекает бессимптомно, однако может являться опасным для жизни при значительном уменьшении числа тромбоцитов крови.
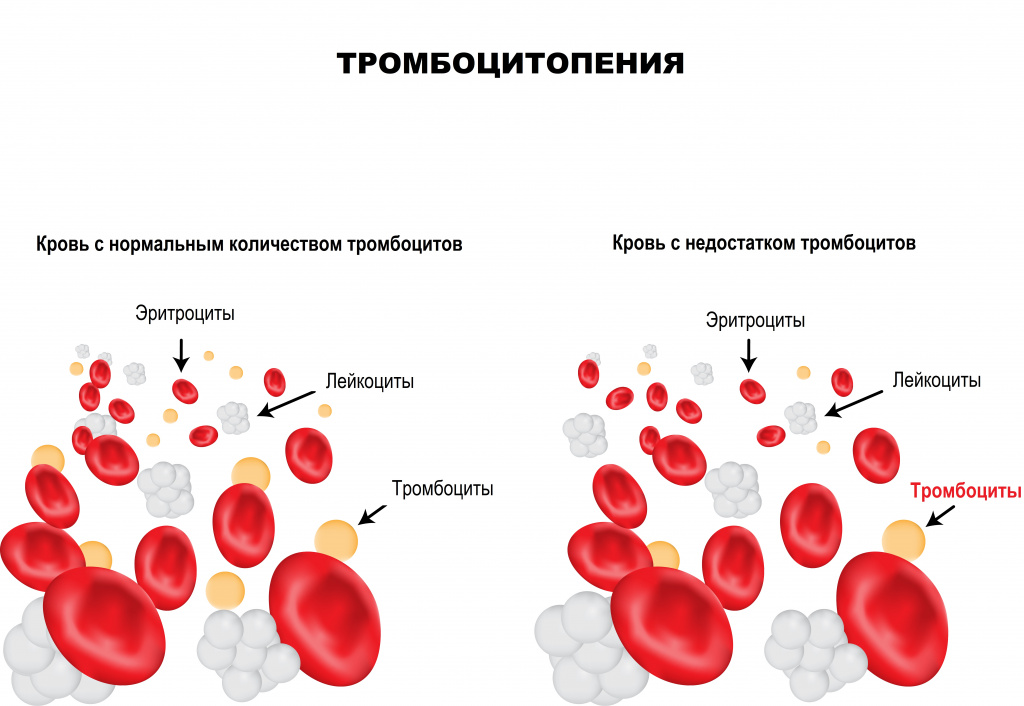
Помимо остановки кровотечения (гемостаза), тромбоциты выполняют ряд важных функций в организме человека: выделение веществ, суживающих сосуды при кровотечении; стимуляция восстановления тканей при любой травме; регулирование процессов местного воспаления и иммунитета.
Эти функции активизируются при любом повреждении эндотелия (внутреннего слоя, покрывающего стенки сосудов). Недостаток тромбоцитов приводит к нарушению системы свертывания крови и, как результат, повышенной кровоточивости, гематомам (синякам) и темно-красной сыпи на коже и слизистых (при надавливании такая сыпь не исчезает).
Продолжительная кровоточивость десен, большой объем кровотечений из маленьких ран и при менструациях – тревожный сигнал, говорящий о возможной проблеме системы свертывания крови.
Разновидности тромбоцитопении
Под тромбоцитопенией понимают уменьшение количества тромбоцитов в периферической крови ниже 150 тыс./мкл. Среди всех тромбоцитопений выделяют следующие состояния:
- Тромбоцитопения разведения – возникает при массивных кровотечениях и восполнении объема циркулирующей крови растворами.
- Тромбоцитопения распределения – часто возникает при избыточной патологической утилизации тромбоцитов в увеличенной селезенке.
- Продуктивная тромбоцитопения – возникает при нарушении функции костного мозга в результате различных заболеваниях или лучевой терапии.
- Тромбоцитопения потребления – возникает при ДВС-синдроме (диссеминированном внутрисосудистом свертывании крови – патологическом состоянии, когда образуются тромбы в кровеносном русле многих органов) или при постоянном аутоиммунном повреждении эндотелия сосудов. Происходит патологическая активация тромбоцитов и их быстрое расходование (потребление) организмом.
- Псевдотромбоцитопения – возникает при нарушении техники проведения анализа с развитием агрегации тромбоцитов.
Одной из частых причин тромбоцитопении является избыточное потребление тромбоцитов в организме, например, при ДВС-синдроме.
Иммунная форма тромбоцитопении считается самой частой иммунной патологией крови. Развивается быстро, с подъемом температуры тела и появлением обильной сыпи на коже нижних конечностей, ягодиц, вокруг крупных суставов, иногда достигая лица. Сыпь представляет собой мелкие кровоизлияния в кожу, часто сопровождается болью в суставах, отеками и нарушением движения в пораженных суставах. Иногда проявляется схваткообразной болью в животе, тошнотой, рвотой и жидким стулом. Описаны случаи появления крови в моче.
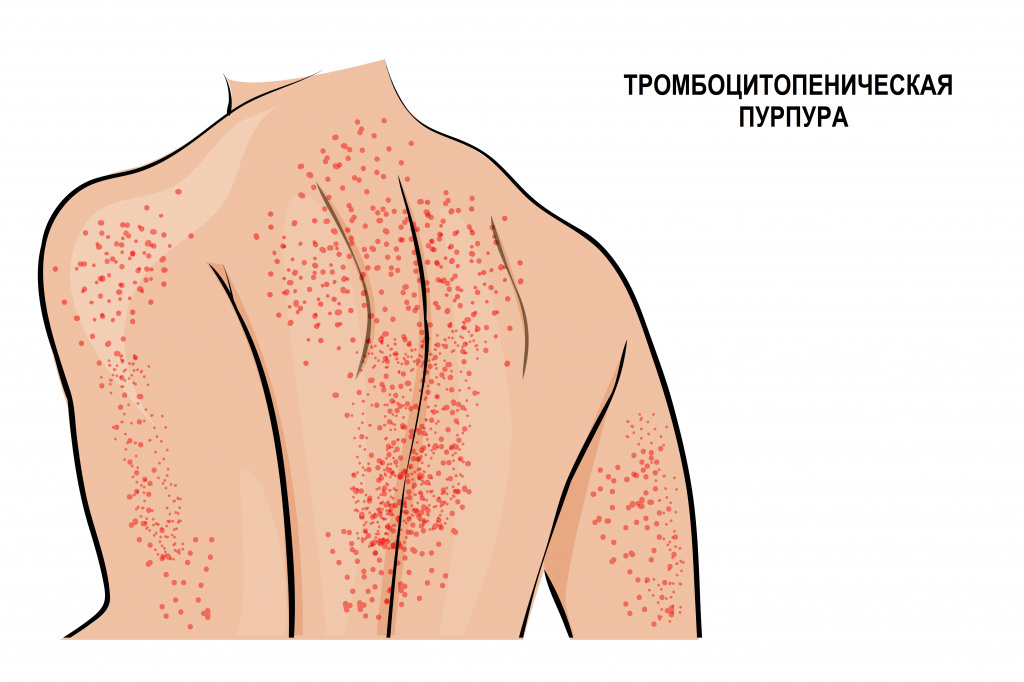
Аутоиммунная тромбоцитопения (идиопатическая тромбоцитопеническая пурпура, болезнь Верльгофа) вызвана уменьшением продолжительности жизни тромбоцитов из-за воздействия антитромбоцитарных аутоантител. Такая тромбоцитопения может протекать волнообразно – с чередованием периодов обострения и ремиссии. Нередко заболевание дает о себе знать на фоне инфекционных заболеваний: гриппа, вируса иммунодефицита человека (ВИЧ), вируса Эпштейна–Барр (ВЭБ), парвовируса В19, цитомегаловирусной инфекции (ЦМВ), вирусных гепатитов В и С.
Среди продуктивных тромбоцитопений особое место занимают апластические анемии, опухолевые процессы в костном мозге, лучевые поражения.
Для всех перечисленных состояний характерно резкое снижение гемопоэтической (кроветворной) функции костного мозга за счет тех или иных структурных изменений.
Апластическая анемия характеризуется уменьшением продукции всех трех ростков кроветворения: эритроцитов, лейкоцитов и тромбоцитов. Каждый росток отвечает за определенные функции в организме, и уменьшение производимых клеток приводит к появлению соответствующих симптомов. Уменьшение тромбоцитов ведет к повышенной кровоточивости, снижение количества эритроцитов говорит о признаках анемии (бледность, утомляемость, ломкость волос, боль за грудиной), а уменьшение лейкоцитов ведет к инфекционным осложнениям в виде рецидивирующих ангин, пневмоний и др. В некоторых случаях костный мозг замещается жировой тканью, что также нарушает образование клеток крови.
При В12- и фолиеводефицитной анемиях происходит нарушение созревания будущих тромбоцитов, они погибают еще до стадии созревания. Заболевание проявляется бледностью кожи, учащенным сердцебиением, одышкой. При выраженном дефиците витамина В12 возможны нарушение чувствительности, парезы и параличи.
Различные виды лейкозов приводят к появлению опухолевых клеток, которые делятся с огромной скоростью и вскоре замещают собой костный мозг. При этом нарушается функция всех трех ростков кроветворения. В костном мозге и крови появляются незрелые клетки, неспособные выполнять свою функцию.
Медикаментозная тромбоцитопения может развиться в результате приема некоторых лекарственных препаратов, например, цитостатиков, которые угнетают образование тромбоцитов в костном мозге.
Заболевания, сопровождающиеся увеличением размера селезенки (спленомегалией), способны привести к повышенному разрушению тромбоцитов, или гиперспленизму (увеличению утилизации тромбоцитов селезенкой). Помимо тромбоцитов также разрушаются эритроциты, что ведет к развитию не только тромбоцитопенического состояния, но и к гемолитической анемии.
К таким заболеваниям относят цирроз печени, в том числе алкогольной этиологии, хроническую сердечную недостаточность, лимфопролиферативные заболевания.
Диагностика и обследования при тромбоцитопении
При выявлении признаков тромбоцитопении врач назначит комплекс лабораторно-инструментальных методов исследования:
-
клинический анализ крови: общий анализ с подсчетом тромбоцитов, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также:

