Как в парить вирус
Обновлено: 19.04.2024

Новость
Хотя основное назначение систем CRISPR/Cas состоит в обеспечении защиты от вирусов клеток бактерий и архей, сами вирусы прокариот могут использовать эти системы для конкурентной борьбы друг с другом
Автор
Редактор
Гипертермофильные археи и их вирусы
Классической функцией систем CRISPR/Cas является защита клеток бактерий и архей от вирусов и других мобильных элементов . Впрочем, описана масса случаев, в которых варианты этой системы присутствуют в составе бактериофагов, плазмид и транспозонов.
Группа исследователей во главе с Мартом Круповичем из Института Пастера (Франция) провела глубокий анализ спейсеров в локусах CRISPR архей рода Saccharolobus (раньше он был известен как Sulfolobus) с помощью высокопроизводительного секвенирования [5]. Для анализа были взяты как образцы, полученные непосредственно из природных местообитаний этих архей, так и образцы культур Saccharolobus, выращенных из этих же образцов. Анализ разнообразия спейсеров гипертермофильных архей принес несколько интересных результатов.
Во-первых, оказалось, что спейсеры архей рода Saccharolobus, взятых из разных мест, различаются и соответствуют именно тем вирусам, с которыми археи сталкиваются в природных условиях. Следовательно, с помощью анализа спейсеров гипертермофильных архей можно установить биогеографию поражающих их вирусов.
В-третьих, выяснилось, что самые многочисленные спейсеры в образцах принадлежат вовсе не археям, а поражающим их вирусам, которые используют эти спейсеры, а также белки Cas археи-хозяина в конкурентной борьбе друг с другом. Но обо всем по порядку.
CRISPR/Cas как механизм конкуренции близкородственных вирусов
Однако откуда происходят отсеквенированные спейсеры — из геномов архей, поражающих их вирусов или других мобильных генетических элементов? Лишь для приблизительно 6% спейсеров удалось установить исходные последовательности (протоспейсеры), из которых они возникли. Спейсеры архей из Беппу соответствуют 53 вирусным геномам, которые были обнаружены в разных частях планеты, однако бóльшая часть спейсеров приходится именно на те вирусы, которые также обитают в Беппу. Действительно, нужнее всего археям спейсеры против тех вирусов, с которыми они постоянно контактируют.
Стоит отметить, что геномы SPV1 и SPV2 очень близки, и в них содержатся фрагменты, ортологичные спейсерам, направленным против другого вируса. Если спейсеры вируса будут идентичны участкам его собственного генома, то вирус может уничтожить сам себя. Чтобы избежать такого исхода, участки, ортологичные спейсерам, несут точечные мутации или делеции, препятствующие их распознаванию crРНК. Примечательно, что, хотя в геномах архей тоже есть спейсеры, нацеленные против SPV1 и SPV2, они менее специфичны и нацелены против обоих вирусов одновременно. А вот спейсеры самих вирусов действуют строго против вируса-конкурента.
Исследователи не остановились на SPV1 и SPV2 и продолжили поиск мини-CRISPR в геномах других вирусов, содержащихся в образцах. Поиск принес свои плоды: по меньшей мере 15 вирусов архей, отличных от SPV1 и SPV2, но близких к ним, имеют собственные мини-CRISPR, причем из 26 спейсеров, суммарно входящих в их состав, 18 нацелены на разные участки геномов SPV1 и SPV2. Мини-CRISPR были выявлены и у некоторых других, неродственных вирусов архей.
Таким образом, ученым удалось выявить еще один механизм, который вирусы, поражающие один и тот же вид, используют в конкурентной борьбе друг с другом. Он же может лежать в основе феномена исключения суперинфекции: клетку заражает только один из вирусов-конкурентов, но не два вируса одновременно. Важно отметить, что вирус SPV1 не относится к числу литических, то есть не вызывает быструю гибель клетки, а довольно долгое время может мирно с ней сосуществовать. Поскольку SPV1, содержащийся внутри клетки, не убивает ее и обеспечивает защиту от SPV2, подобные отношения между SPV1 и клеткой археи можно рассматривать как своеобразный случай взаимовыгодного симбиоза. Более того, необходимость точечных замен и делеций для предотвращения действия вирусных CRISPR против собственного генома служит дополнительным стимулом повышения разнообразия и эволюции вирусов.
Вирусные мини-CRISPR: что дальше?
Будем надеяться, что дальнейшие исследования вирусных CRISPR-систем помогут разрешить эти вопросы.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
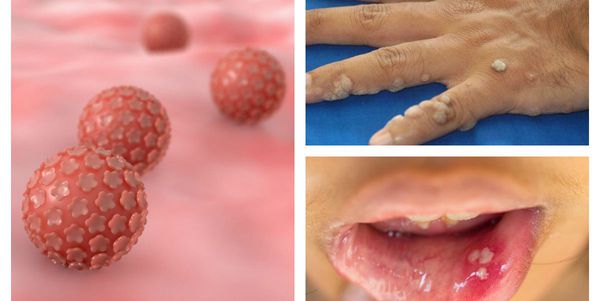
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
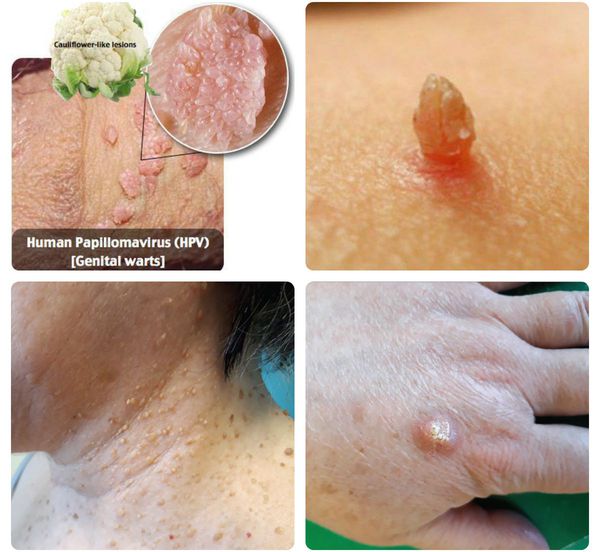
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
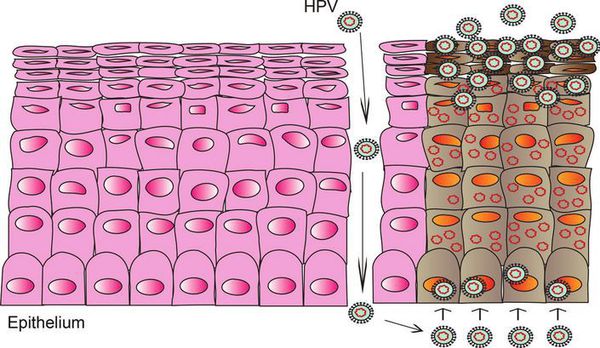
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
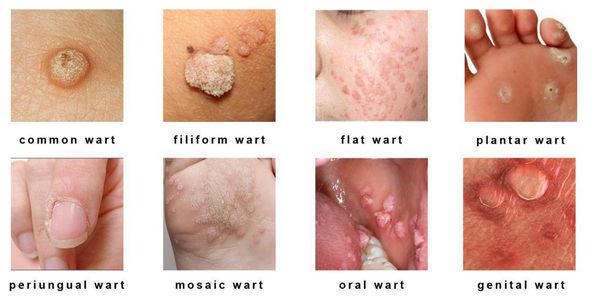
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
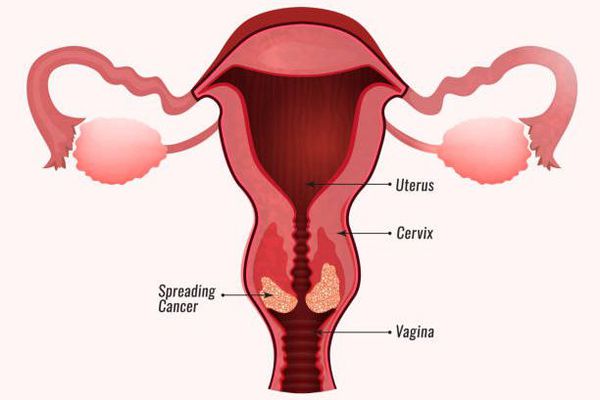
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
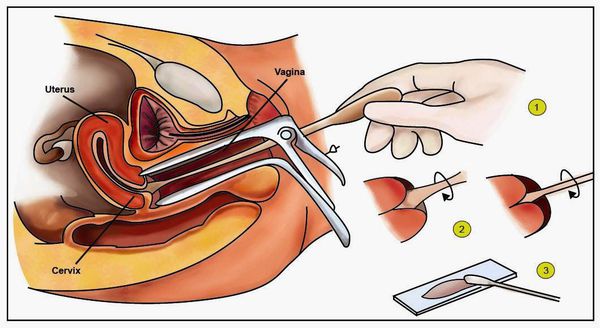
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
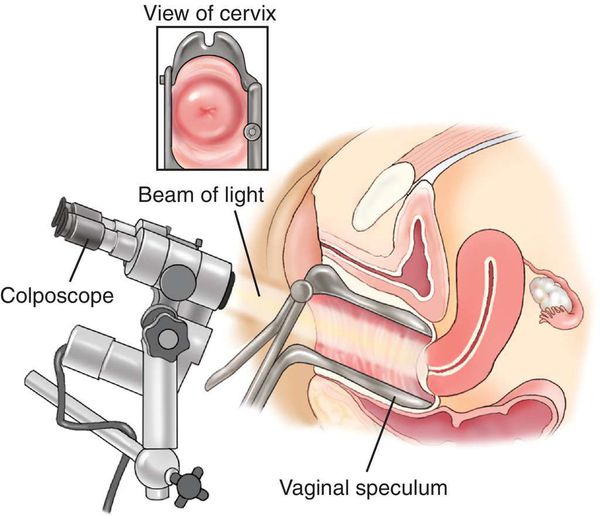
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
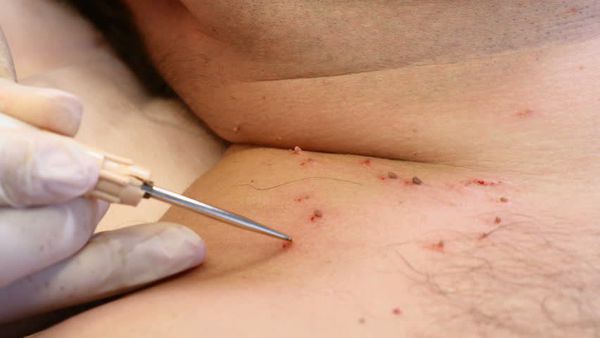
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Ротавирусная инфекция — участившееся инфекционное заболевание, с которым сталкивается большинство родителей. Однако о лечении своего ребенка знает далеко не каждый.

Анастасия, что такое Ротавирус?
Это кишечная инфекция, которая вызывается вирусом семейства Реовирусы. Инфицирование происходит из-за попадания ротавируса на слизистую ротовой полости, вирус проникает дальше в пищеварительный тракт и начинает размножаться в тонком кишечнике, вызывая неблагоприятные последствия.
У ротавируса есть восемь видов, но человек может заразиться лишь тремя из них, при этом болезнь протекает абсолютно одинаково. Чаще всего в нашей стране заражаются ротавирусом вида А.
Ротавирусная инфекция характеризуется сезонностью, вирус активен при высокой влажности и устойчив к низким и высоким температурам. Чаще всего дети болеют в зимне-весенний и осенне-зимний период.
Какие симптомы характерны при заболевании ротавирусной инфекцией?
Характерно острое начало — рвота, жидкий стул, боли в животе, повышение температуры.
Как передается заболевание?
Через грязные руки инфекция попадает в рот, то есть фекально-оральным путем. Воздушно-капельным путем ротавирус не передается.
В каком возрасте дети наиболее подвержены заболеванию?
До пяти лет практически каждый ребенок хотя бы раз в жизни переболевает ротавирусом, в той или иной степени. Данная инфекция поражает все возрастные слои населения.
Как происходит массовое заражение детей в школе?
Дети не соблюдают простых правил личной гигиены — после посещения туалетной комнаты не моют руки. Дальше происходят рукопожатие, игры, съели яблочко, поделились яблоком с другом, откусили шоколадку у друга и так далее. Таким образом распространяется инфекция.
Чем опасен ротавирус?
Главная опасность — это потеря жидкости. Обезвоживание и интоксикация ведут к нарушению функций организма.
В течение какого времени после инфицирования проявляются симптомы заболевания?
Инкубационный период — от нескольких часов до нескольких суток. Чаще всего симптомы проявляются на первые — вторые сутки.
Сколько длится острый период заболевания?
Это индивидуально для каждого случая. Чаще всего — от трех до пяти суток. Первые трое суток — самое тяжелое течение заболевания.
Что делать, если у ребенка высокая температура?
Если температура выше, чем 38,5 °C, то ее нужно сбивать жаропонижающими средствами. При преобладании рвоты — лучше ректальные свечки, при превалировании диарейного синдрома — суспензия через рот. Препаратами выбора могут быть парацетамол и ибупрофен.
Существует ли особая опасность для маленьких детей до года?
Как я уже говорила, мы боимся потери жидкости, соответственно, чем меньше человечек, тем меньший объем жидкости находится в его организме. Если у ребенка будет многократная рвота и обильный жидкий стул, значит ребенок быстрым темпом дойдет до обезвоживания. Поэтому в тяжелых случаях — однозначно стационар.
Можно ли лечить заболевание самостоятельно?
При первых симптомах заболевания необходимо обратиться к доктору, чтобы он посмотрел ребенка, сделал необходимые анализы и назначил правильное лечение. До осмотра у врача нужно начать отпаивать ребенка водой — небольшими порциями. Заниматься самостоятельным лечением ребенка не следует.

Нужно ли кормить ребенка до назначения лечения врачом?
Во время болезни ротавирусной инфекцией дети чаще всего от еды отказываются, так как превалирует рвота. Но если ребенок просит есть, то это должна быть еда не жирная, не содержащая большого количества клетчатки. Прекрасно подходит рисовая каша, которая закрепляет стул и является сорбентом.
В народе принято при заболевании ротавирусом давать детям Регидрон. Нужно ли это делать?
Регидрон — это солевой раствор, он является лекарственным препаратом. Принимать его или нет — решает только врач.
Можно ли осуществлять лечение на дому?
Все зависит от степени тяжести заболевания. Если форма легкая — лечение можно проводить на дому. Если заболевание средне-тяжелое или тяжелое — стационар. В любом случае, это определяет врач.
Что делать, если у ребенка в классе много случаев заболевания?
Необходимо объяснить ребенку, что очень важно соблюдать правила личной гигиены.
Какие меры предосторожности принимать в квартире, если болеет ребенок?
В этом случает также необходимо соблюдать правила гигиены. Если рвотные или каловые массы попадают на поверхность, это место нужно обрабатывать дезинфицирующими средствами. Мыть руки чаще.
Какая должна быть восстановительная терапия после того, как спали основные симптомы заболевания?
Соблюдение элиминационной диеты (от англ. Elimination — исключение, устранение — это диета с исключением некоторых продуктов из рациона) — необходимо на время исключить из рациона жирные продукты и продукты с повышенным содержанием клетчатки, а также продукты, вызывающие послабление кишечника, с постепенным расширением диеты.
Какая существует профилактика этого заболевания?
Профилактика — соблюдение правил личной гигиены и вакцинация. Вакцинация проводится для детей в возрасте до 32 недель, то есть в грудничковом возрасте. Это вакцина Ротатек. Существует еще вторая вакцина — Ротарикс — она делается до 24 недели. Если ребенку сделали прививку в этом возрасте, то вакцина защитит от заболевания, если в более позднем возрасте, то вакцинация уже не будет иметь положительного эффекта. Во время заболевания вакцинация также не принесет результата.
Читайте также:

