Как вирус взаимодействует с клеткой
Обновлено: 19.04.2024

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.

Обзор
У вирусов архей семейства Bicaudaviridae вирионы имеют крайне необычную морфологию: к одному или двум концам заостренного капсида прикрепляются белковые хвосты, длина которых может варьировать.
Автор
Редактор
Вирусы заражают все клеточные формы жизни, и археи — не исключение. Хотя сейчас известно гораздо меньше вирусов архей, чем вирусов бактерий и эукариот, разнообразие устройства их вирионов и используемых молекулярных механизмов поражает воображение: некоторые из них имеют вирионы в форме бутылки, у других генетический материал в вирионе хранится в форме А-ДНК, третьи обзавелись уникальным типом биологических мембран или используют для выхода из зараженной археи ранее неизвестные клеточные структуры. Наша статья посвящена этим пока еще малоизученным, но удивительно самобытным генетическим элементам.
Давно прошли те времена, когда археи считались обитателями исключительно тех мест, где никакая другая клеточная жизнь существовать не может, например, горячих источников. В действительности, архей можно найти везде, даже в желудочно-кишечном тракте человека, однако наиболее многочисленны они на глубоководьях морей и океанов. Так, показано, что археи, окисляющие ионы аммония до нитрата (они относятся к типу Thaumarchaeota) являются одной из самых многочисленных клеточных форм жизни в океанах. Неудивительно, что и вирусы архей также очень многочисленны: метагеномный анализ показал, что в некоторых зонах на долю вирусов архей приходится около 10% самых распространенных там вирусов. Объемы клеток архей, которые погибают из-за вирусов, тоже впечатляют: установлено, что в верхних 50 см океанического донного грунта клетки архей, лизированные вирусами, составляют до трети всей ежегодной биомассы погибших микробов, что соответствует 0,3–0,5 гигатоннам углерода ежегодно [1].
Все известные на данный момент вирусы архей имеют геномы, представленные ДНК: одноцепочечной или двухцепочечной, кольцевой или линейной. Недавно, однако, в горячих источниках Йеллоустонского национального парка, которые населены почти исключительно археей Sulfolobus solfataricus, с помощью метагеномики обнаружили вирусный РНК-геном, отдаленно напоминающий эукариотические РНК-вирусы, поэтому, возможно, существуют и РНК-содержащие вирусы архей.
Пока вирусы архей представлены 17 семействами. Стоит отметить, что вирусы архей, вообще-то, составляют две сильно различающиеся группы. К первой относят вирусы, которые структурно и генетически близки к вирусам бактерий и эукариот, а ко второй — вирусы, уникальные для архей и мало похожие на вирусы других клеточных форм. Практически все специфические для архей вирусы поражают представителей типа Crenarchaeota, а вирусы, близкие к бактериофагам и вирусам эукариот, чаще всего паразитируют на археях типа Euryarchaeota [1].
Строение вирусных частиц
Вирусы, специфичные для архей, нередко имеют вирионы необычной формы (рис. 1а).
Так, представители семейства Ampullaviridae имеют вирионы в виде бутылок из-под шампанского, причем поверх белков капсида они обтянуты липидной оболочкой. А у членов семейства Spiraviridae вирионы в виде спиралей. Столь необычная форма вирионов у вирусов этих двух семейств связана с особым способом упаковки генома при помощи белков капсида [1].

Рисунок 1а. Морфология вирионов вирусов, специфичных для архей. Просвечивающая электронная микроскопия.

Рисунок 1б. Морфология вирионов некоторых вирусов архей и бактерий
Некоторые специфичные для архей вирусы имеют веретеновидные капсиды. Среди них у вирусов семейства Fuselloviridae на одном из заостренных концов капсида находится пучок белковых филаментов, а у членов семейства Bicaudaviridae на одном или двух концах капсида — одиночные придатки в виде хвостов. Не менее удивительна морфология вирионов Guttaviridae: у этих вирусов вирионы тоже похожи на веретено, однако один их конец закруглен и имеет каплевидную форму [1].
У многих специфичных для архей вирусов нитчатые вирионы, которые могут нести специальные придатки, предназначенные для распознавания клеток архей. Иногда, как у вирусов семейства Tristromaviridae, капсид сформирован не одним, а тремя типами белков [1].
Некоторые вирусы, специфичные для архей, имеют сферические вирионы, причем иногда поверх капсида находятся липидная мембрана и еще один слой белков, из-за чего частицы принимают икосаэдрическую форму [1].
Вирионы Pleolipoviridae по строению похожи на везикулы, которые образуют многие археи: голая геномная ДНК находится внутри мембранного пузырька, который пронизан белками двух типов. Такие пузырьки могут содержать как одноцепочечную, так и двухцепочечную ДНК линейной или кольцевой формы [1].

Рисунок 2. Морфология вирионов вирусов архей, родственных бактериофагам и вирусам эукариот. Просвечивающая электронная микроскопия.
Чем можно объяснить столь необычную морфологию вирусов архей? Вирионы некоторых из них удалось не только рассмотреть под электронным микроскопом, но и детально изучить с помощью криоэлектронной микроскопии. Так ученые выяснили, что геномы некоторых вирусов архей в капсидах находятся в А-форме! Это первый известный случай, когда А-форма ДНК присутствует в живых организмах в нормальных условиях. Один из вирусов с геномом в виде А-ДНК, AFV1, имеет очень тонкую липидную оболочку с необычным химическим составом — главным ее компонентом является липид глицеролдибифитанилглицеролтетраэфир (GDGT-0), имеющий необычную U-образную конфигурацию (рис. 3). В мембране, состоящей их таких липидов, их гидрофильные головки обращены наружу, а гидрофобные дуги — внутрь. Наряду с фосфолипидным бислоем и монослоем архей такое строение можно считать третьим из известных типов биологических мембран [1].

Рисунок 3. Химическая структура GDGT-0 (вверху), его схематическое представление (внизу слева; красным цветом показаны гидрофильные головки) и модель (внизу справа) в U-образной конформации подпись
Геномы
Все выделенные на данный момент вирусы архей имеют ДНК-геномы (хотя, как отмечалось выше, в горячих источниках Йеллоустона с помощью метагеномики удалось найти РНК-геном возможного вируса архей). В большинстве случаев геном представлен двухцепочечной молекулой ДНК, и лишь у членов семейств Spiraviridae и Pleolipoviridae геномы состоят из одноцепочечной ДНК. Размеры геномов архейных вирусов варьируют от 5300 пар нуклеотидов (п.н.) у клававируса APBV1 (это один из мельчайших известных геномов ДНК-содержащих вирусов) до 143 800 п.н. у миовируса HGTV-1. Как правило, вирусы, специфичные для архей, имеют меньшие геномы, чем вирусы архей, родственные бактериофагам и вирусам эукариот [2].
Механизмы репликации геномов вирусов архей экспериментально изучены лишь для небольшого числа вирусов. Известно, что ДНК представителей порядка Caudovirales (которые, кстати, имеют самые большие геномы среди архейных вирусов) кодирует часть или даже все компоненты аппарата репликации ДНК: ДНК-полимеразы, белки скользящего зажима (PCNA), праймазы и хеликазы. Имеющие более скромные размеры геномов вирусы архей, как правило, кодируют белки, которые необходимы для привлечения аппарата репликации клетки-хозяина. Стоит, однако, отметить, что в геномах многих вирусов, специфичных для архей, не удалось найти белки, связанные с репликацией ДНК, так что они либо полностью зависимы от аппарата репликации клетки-хозяина, либо используют уникальные, пока еще не изученные механизмы репликации ДНК. Например, удалось показать, что и инициация, и терминация репликации генома липотриксвируса AFV1 связаны с рекомбинационными процессами [1].
Механизмы упаковки генома в капсид у вирусов архей детально не изучены. Тем не менее известно, что члены порядка Caudovirales имеют гомологи терминазы, которая упаковывает геномную ДНК в пустой капсид. Механизм формирования вирионов с использованием терминазы используют также вирусы бактерий и эукариот. Можно предположить, что упаковка генома в капсид у вирусов архей протекает так же, как и у бактериофагов и вирусов эукариот, а вот в плане репликации ДНК вирусы архей или целиком зависят от клетки-хозяина, либо используют уникальные, пока еще не изученные механизмы [1].
Взаимодействие с клеткой-хозяином
Выход зрелых вирионов из клетки архей во многих случаях напоминает отпочковывание от эукариотической клетки-хозяина у вируса гриппа, ВИЧ и вируса Эбола. Когда вирион покидает клетку археи, он забирает с собой фрагмент ее мембраны, который становится дополнительной оболочкой поверх капсида. У некоторых вирусов архей финальные стадии созревания вирионов происходят уже после выхода из клетки, когда капсид претерпевает морфологические перестройки [1].
У некоторых вирусов архей (а именно, представителей семейств Rudiviridae и Turriviridae) все стадии созревания вириона проходят в цитоплазме клетки. Новые вирусные частицы покидают клетку через специальные структуры с семиосевой симметрией на их поверхности, которые получили название вирусассоциированных пирамид (virus-associated pyramids, VAP). VAP образуются на внутренней поверхности мембраны зараженной клетки, проходят сквозь ее поверхностный S-слой и открываются на финальных этапах инфекции, давая возможность вирионам выйти из клетки (рис. 4) [1].

Рисунок 4. Вирусассоциированная пирамида. а и б — Пирамида на поверхности клетки археи Pyrobaculum oguniense в закрытой (а) и открытой (б) конформациях. в и г — Открытая пирамида вируса SIRV2 на поверхности Sulfolobus islandicus. а–в — Визуализация с помощью трансмиссионной электронной микроскопии. г — С помощью электронной криотомографии (CryoET).
Выход некоторых вирусов архей из клетки сопровождается ее лизисом. К их числу относятся вирусы семейства Tristromaviridae, которые, хотя и развиваются целиком в цитоплазме, каким-то образом ухитряются приобрести липидную оболочку. Примечательно, что сифовирус ψM2 кодирует фермент псевдомуреинэндоизопептидазу, который разрушает псевдомуреиновую клеточную стенку археи [1].
Эволюция и родственные связи
Вирусы, специфичные для архей, как правило, заражают только представителей типа Crenarchaeota. Они отличаются от всех других вирусов не только нестандартной морфологией вирионов, но и генетически: около 90% их генов не имеет гомологов в существующих базах данных. В геномах некоторых архейных вирусов не удалось найти ни одного белка, для которого существовал бы функционально охарактеризованный белок-гомолог.
Иногда, если гомологию не удается установить по нуклеотидным или аминокислотным последовательностям, на помощь приходят пространственные структуры. Действительно, для различных белков вирусов архей получили пространственные структуры, но ситуация от этого не стала яснее: оказалось, что во многих из них содержатся совершенно уникальные структурные мотивы. Более того, функции многих генов вирусов архей совершенно непонятны: так, оказалось, что фузелловирус SSV1 может спокойно обойтись без половины своих генов. Можно предположить, что такие неохарактеризованные гены-сироты кодируют белки, участвующие во взаимодействии вируса с клеткой архей, например, противодействующие системам CRISPR-Cas [1].
Впрочем, многие вирусы архей родственны некоторым бактериофагам и вирусам эукариот. Однако вирусы, специфичные для архей, стоят особняком среди всех ДНК-содержащих вирусов. Более того, различные группы вирусов, специфичных для архей, неродственны друг другу и эволюционируют независимо друг от друга. Высказывается предположение, что некоторые группы специфичных для архей вирусов появились на заре эволюции клеточной жизни и были впоследствии утрачены бактериями и эукариотами. Другие группы специфичных архейных вирусов могли появиться в момент обособления домена архей или даже позже, в отдельных группах архей [1].
Любопытно, что некоторые вирусы архей родственны лишенным капсидов мобильным генетическим элементам (например, плазмидам) . Эти вирусы, так же как и мобильные генетические элементы, имеют родственные гены основных белков репликативного аппарата [1], [2].
Несмотря на то, что мы только-только начинаем приподнимать завесу тайны над вирусами архей, многие уже известные особенности их морфологии или генетического аппарата поражают воображение. Несомненно, дальнейшее изучение вирусов архей при помощи метагеномики и других подходов подарит нам множество сюрпризов.
В заражённых вирусом клетках возможны патологические проявления разностороннего характера.
Морфология патологических эффектов. Зараженные вирусом клетки. Основные реакции зараженных вирусом клеток.
Характерные проявления взаимодействий между вирусом и чувствительными клетками-видимые поражения заражённых клеток вплоть до их гибели, а также присутствие возбудителей в исследуемом материале.
Альтерация и воспаление зараженных вирусом тканей. При вирусных инфекциях на первый план выступает картина повреждения клеток и воспалительных изменений тканей, при различных инфекциях их соотношение и выраженность варьируют. В противоположность бактериальным инфекциям (где доминируют полиморфноядерные лейкоциты), при вирусных поражениях среди клеточных элементов воспалительных реакций доминируют мононуклеары (лимфо- и моноциты). На этапах, предшествующих разрушению клеток, можно визуально наблюдать их дегенеративные и некротические изменения.
Тельца включений зараженных вирусом клеток. Микроскопия заражённых клеток часто позволяет выявить тельца включений — характерный, но не абсолютный признак вирусных поражений. Тельца значительно крупнее, чем отдельные вирионы, и часто окрашиваются кислыми красителями (например, эозином).
• При заражении клеток ДНК-содержащими вирусами тельца включений располагаются в ядре; исключение — тельца включений поксвирусов (тельца Гварнери).
• При заражении клеток РНК-содержашими вирусами тельца включений располагаются в цитоплазме (например, тельца Бабеша-Нёгри, выявляемые в цитоплазме клеток головного мозга при бешенстве).
Причины гибели зараженных вирусом клеток. Размножаясь в клетке, вирусы индуцируют синтез вирусспецифических белков, в той или иной степени подавляющих метаболизм клетки. Нарушение синтеза макромолекул вызвано нарушением трансляции клеточной мРНК. Среди РНК-геномных вирусов наиболее быстрое и глубокое подавление макромолекулярных синтезов в клетке вызывают пикорнавирусы, среди ДНК-геномных — покс- и герпесвирусы. Действие указанных вирусов реализуется на ранних этапах (до появления морфологических признаков цитопатического эффекта). Ингибирование синтеза РНК и ДНК обычно вторично по отношению к воздействию на белки, контролирующие экспрессию генов и пролиферацию клетки. Значительно реже нарушения вызывают вирусные белки, напрямую ингибирующие синтез нуклеиновых кислот. Среди РНК-геномных вирусов наиболее быстрое и глубокое подавление синтезов нуклеиновых кислот вызывают пикорнавирусы, среди ДНК-геномных — покс- и герпесвирусы.
Во время репродукции вируса в клетке накапливаются вирусные компоненты, оказывающие токсическое и повреждающее действие на клеточные структуры. Например, цитотоксические свойства проявляют капсомеры некоторых аденовирусов, гликопротеины парамиксовирусов. В процессе вирусной инфекции также происходит повреждение мембран лизосом, содержимое которых высвобождается и осуществляет аутолиз клетки. Таким образом, гибель клеток наступает в результате сочетания раннего подавления синтеза клеточных компонентов, накопления токсических вирусных продуктов и повреждения лизосом.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Типы инфицирования клеток вирусами. Репродуктивный цикл вирусов. Основные этапы репродукции вирусов. Адсорбция вириона к клетке.
По характеру взаимодействия генома вируса с геномом клетки выделяют автономное (геном вируса не интегрирован в геном клетки) и интеграционное (геном вируса интегрирован в геном клетки) инфицирование. Особую форму составляют латентное и персистирующее инфицирование.
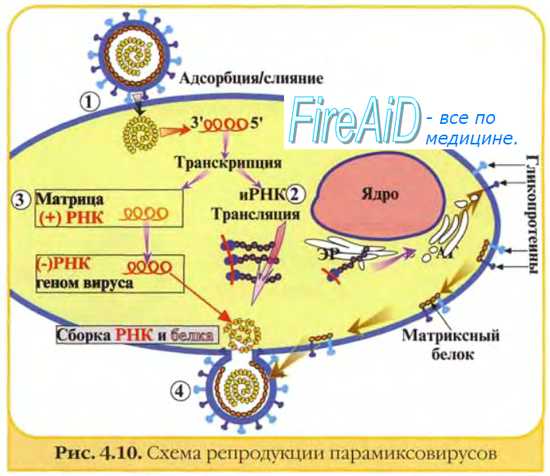
Персистирующее инфицирование клеток вирусам. Некоторые РНК-вирусы могут вызывать персистиру-ющие инфекции, проявляющиеся образованием дочерних популяций возбудителя после завершения острой фазы болезни. При этом происходит постепенное выделение вирусных частиц, но инфицированная клетка не лизируется. Нередко дочерние популяции вирионов дефектны (часто наблюдают у лиц с иммунодефицитами). Иногда такие хронические поражения протекают без клинических проявлений. В частности, вирус гепатита В способен вызывать персистирующее поражение гепатоцитов с развитием хронического гепатита; в дальнейшем возможна малигнизация клеток.
Репродуктивный цикл вирусов
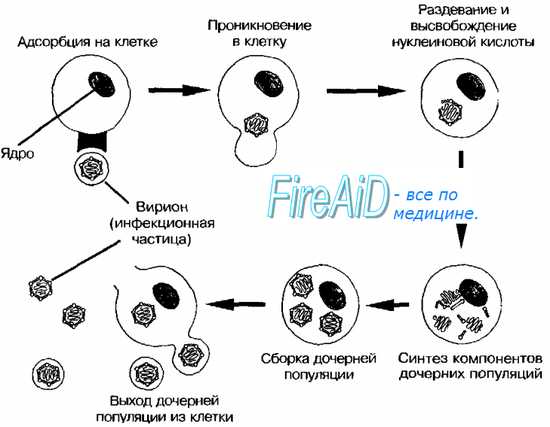
Изображённые на рис. 2-3 этапы репродукции (от адсорбции вирионов до высвобождения дочерней популяции) происходят при продуктивном взаимодействии вируса с клеткой.

Рис. 2-3. Основные этапы репродукции вирусов.
Адсорбция вириона к клетке
• Процесс адсорбции не зависит от температуры (то есть не требует энергетических затрат) и протекает в две фазы; фаза ионного притяжения обусловлена неспецифическим взаимодействием, фаза прикрепления происходит благодаря структурной гомологии либо комплемен-тарности взаимодействующих молекул.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

