Как вирусная инфекция влияет на плаценту
Обновлено: 24.04.2024
Внутриутробная инфекция (ВУИ) представляет собой серьезную проблему современной перинатальной медицины, так как данное осложнение может быть причиной перинатальной патологии и смертности матери и ребенка [1-3, 6, 9].
ВУИ играет важную роль в генезе различных патологических процессов при беременности, оказывает вредное влияние на исход беременности и состояние новорожденного. В подавляющем большинстве случаев ВУИ является причиной антенатальной патологии: 32% самопроизвольного выкидыша, 24% внутриутробной задержки развития плода и преждевременных родов. Наиболее распространенным представителем нативных вирусов является герпесвирусная инфекция, частота обнаружения вируса простого герпеса (ВПГ) составляет 98,9% среди взрослого населения земного шара [1, 2, 4, 7].
В последние годы отмечается тенденция к увеличению инфицирования беременных ВПГ. Генитальной герпетической инфекции уделяется большое внимание, так как ее способность активно размножаться в плаценте и эмбриональных тканях, проникать через плацентарный барьер и вызывать внутриутробное поражение плода приводит к формированию плацентарной недостаточности и развитию пороков развития плода [1-3, 6].
Возрастающая роль внутриутробных инфекций среди причин неблагоприятных перинатальных исходов определяет актуальность всестороннего изучения этой проблемы.
Цель исследования: изучение роли ВПГ в генезе плацентарной недостаточности и определение специфических изменений в плаценте женщин с генитальной герпетической инфекцией.
Материалы и методы исследования. Под нашим наблюдением находилось 204 женщины с диагностированной вирусной инфекцией, Возраст больных составлял от 18 до 37 лет. У всех пациенток в анамнезе (1,2±0,4 года назад) были перинатальные потери, хронические воспалительные заболевания репродуктивной системы, что и послужило основанием для проведения детального клинико-лабораторного, в том числе серологического, обследования на наличие вирусной инфекции. Также проводилось ультразвуковое исследование плода и плаценты в 16-17, 24-28 недель гестации и накануне родов с осуществлением допплерометрии и ультразвуковой фетометрии плода.
Макроскопическое, морфометрическое, гистологическое и иммуногистохимическое исследование плаценты, пуповины и околоплодных оболочек.
Результаты. Методом ПЦР в большинстве случаев обнаружен вирус генитального герпеса в виде моноинфекции у 19,2% (n=40) беременных. У 80,7% (n=164) беременных отмечалось сочетание герпетической инфекции с цитомегаловирусом, а также бактериально-кандидозной инфекций шейки матки. Детальное изучение акушерского анамнеза позволило выделить высокий процент 40,4% (n=82) самопроизвольных выкидышей в ранние сроки гестации, а у 13,5% (27 женщин) в поздние сроки гестации. В 23,0% (n=47) отмечена неразвивающаяся беременность. Преждевременные роды - выявлены в 22,1% (n=45) случаев. 13,5% (n=27) женщин перенесли операцию по поводу внематочной беременности, у 12,5% (n=25) пациенток роды закончились перинатальной смертью новорожденного на различные сутки жизни. У 10,5% (n=21) женщин беременность была прервана по мед. показаниям в различные сроки гестации по поводу аномалии развития и уродства плода, что может быть связано с патогенным действием вируса герпеса на яйцеклетку. В 9,6% (n=19) случаев отмечалось вторичное бесплодие, а в меньшинстве 5,7% (n=11) случаев отмечено антенатальная гибель плода. Наиболее часто встречающимся осложнением родового акта у беременных явилось несвоевременное излитие околоплодных вод 31,7%. При ультразвуковом исследовании выявлен кальциноз плаценты различной степени выраженности 42,4%, задержка внутриутробного развития плода с отставанием от гестационного срока на две недели 10,1%, многоводие 13,4%, маловодие 14,5%, преждевременное созревание плацент в 22,7%. Допплерометрическое исследование позволило в 49,7% случаев выявить нарушения со стороны фето- и маточно-плацентарного кровотока.
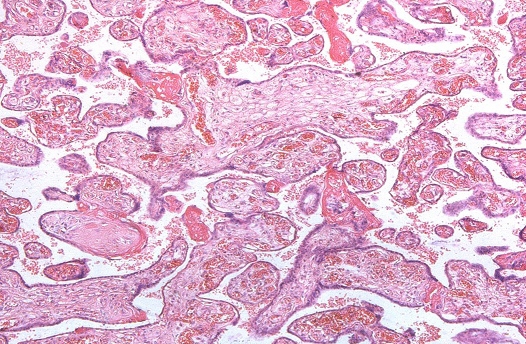
Рис. 1. Патологическая незрелость ворсин хориона при герпесвирусной инфекции у беременных
В ткани плаценты с помощью флюоресцирующих моноклональных антител выявлялись антигены вируса простого герпеса 1-го и 2-го типа. Причем 1-й тип у 15%, 2-й у 40%, сочетание 1-го и 2-го типов у 45%. Светооптически в плаценте пораженных только вирусом простого герпеса 1-го или 2-го типа, изменения идентичны. Характерным является наличие ограниченного продуктивного очагового воспаления с вовлечением в патологический процесс плодовой и материнской частей плаценты. При этом в эпителии амниона, синцитиотрофобласте, эндотелии сосудов, клетках базальной пластинки и септ выявляются гигантские одноядерные клетки с крупными гиперхромными ядрами, содержащими базофильное включение. Последние отделены от кариолеммы полоской просветления и содержат антиген вируса простого герпеса. Часть клеток эпителия амниона и трофобласта претерпевает некротические изменения. Во всех случаях наблюдаются распространенные поражения стенок сосудов ворсин в виде очагового эндоваскулита, иногда с некрозом части внутренней выстилки и формированием тромбов. Интервиллезит встречается нечасто и носит очаговый характер. Более типичными являются кровоизлияния или очаги тромбоза в межворсинчатом пространстве. Базальный децидуит различной степени выраженности имеется во всех наблюдениях. Некротические изменения встречаются как в отдельных клетках, так и в виде очагов. Постоянно выявляются участки склероза, диффузные отложения солей кальция, фибриноида в ворсинах и базальной пластинке.
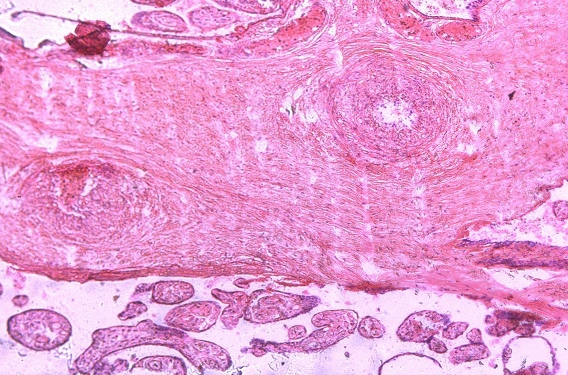
Рис. 2. Отложение фибриноида в прилежащем межворсинчатом пространстве
Изменения в плаценте во многом зависят от времени возникновения рецидивов и их количества. Степень деструкции более выражена у пациенток, имевших 4 рецидива и более.
Обострение заболевания в 1 и II триместрах беременности морфологически манифестируется фибропластическими изменениями. В сосудах стволовых, зрелых промежуточных и терминальных ворсин имеются проявления продуктивного васкулита, с фиброзом стенок, облитерацией и стенозом просвета отдельных из них. Хориальная пластинка выглядит утолщенной, интенсивно окрашивается фуксилином по Ван-Гизону. Плодные оболочки отечны, эпителий их местами утолщен, образует несколько рядов. Воспалительные изменения носят очаговый характер. Морфометрически установлено, что количество бессосудистых терминальных ворсин составляет 15,3±0,62%; 46,0±3,24% содержат 1-2 капилляра, 24,8±0,96% - 3-5 капилляров, 9,4±0,86% - 10 капилляров, 4,5±0,11% - более 10 капилляров. При наличии низкого коэффициента плотности расположения ворсин (2,35±0.4) дети рождаются с нормальной массой тела, что свидетельствует о компенсированной трофической функции плаценты. Уменьшение объема материнской крови в межворсинчатом пространстве (коэффициент 4,7±0,24) сопровождается гипотрофией плода.
Возникновение рецидивов герпетической инфекции в III триместре беременности сочетается с альтеративными процессами в структурах последа. В базальной пластинке, септах, крупных и мелких ворсинах, амнионе, гладком хорионе обнаруживаются резко выраженные дистрофические изменения, некробиоз, очаги фибриноидного некроза. При этом имеется лимфоидно-плазмоцитарная и лимфоидно-макрофагальная воспалительная реакция, нередко с гигантоклеточным метаморфозом и очаговыми кровоизлияниями.
При этом микроскопически в амнионе и пуповине определяются банальная флора (кокки, палочки и др.), париетальный хориоамнионит и париетальный децидуит. Воспалительный инфильтрат содержит преимущественно полиморфноядерные лейкоциты. Фуникулит сопровождается воспалительной инфильтрацией стенок пупочной вены (лишь в одном наблюдении имелась нерезко выраженная воспалительная инфильтрация стенки одной из пупочных артерий). Значительные изменения имеются в сосудах ворсин различного калибра. Продуктивное или смешанное экссудативно-продуктивное воспаление в стенках сочетается со стенозированием их просвета, крайне редко с облитерацией. В межворсинчатом пространстве воспалительные изменения носят ограниченный очаговый характер и представлены скудной лимфоидно-плазмоцитарной инфильтрацией, наличием нитей фибрина. В ворсинах имеются отложения солей кальция, выявляется железо. В 10 наблюдениях констатированы очаговые кровоизлияния в межворсинчатом пространстве. Морфометрически установлено, что количество бессосудистых терминальных ворсин составляет 13,8+0,3%; 37,2±1,22% содержат 1-2 капилляра, 24,0±1,1% - 3-5 капилляров, 7,6±0,31% - 6-10 капилляров.
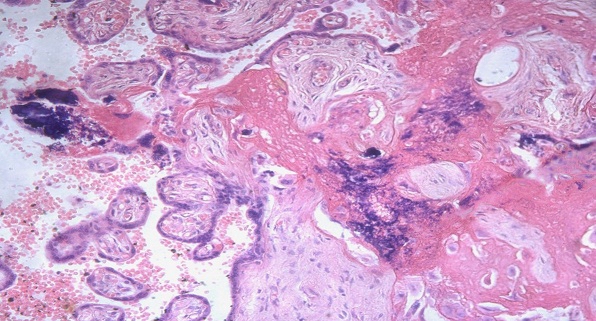
Рис. 3. Некроз и лимфоидная инфильтрация стромы базальной пластины у беременных с герпесвирусной инфекцией
Наряду с описанными изменениями, характеризирующими нарушение созревания плаценты, ее повреждение и воспаление, имеют место различной степени выраженности компенсаторно-приспособительные процессы. Последние определяются степенью васкуляризации ворсин, зависящей от времени возникновения рецидива, наличием функционирующих синцитиальных узелков и количеством циркулирующей материнской крови в межворсинчатом пространстве. Функционирующие синцитиальные узелки, отражающие пролиферативные возможности трофобласта, имеются во всех случаях. Они представляют собой скопление базофильных, тесно прилежащих друг к другу ядер. Нередко эти структуры образуют "мостики", связывающие между собой терминальные ворсины и поддерживающие их внутреннее взаиморасположение. При морфологическом исследовании плацент детей, родившихся в удовлетворительном состоянии и массой тела более 3000 г., выявлены, наряду с нарушением их созревания, повреждением и воспалением, хорошо развитые компенсаторно-приспособительные процессы, основная масса терминальных ворсин была хорошо васкуляризирована. Морфометрически установлено, что 0,95% терминальных ворсин были бессосудистыми, 1,4% ворсин содержали 1-2 капилляра, 2,4% - 3-5 капилляров, 1,1%- 6-10 капилляров и 0,94% - более 10 капилляров. Это свидетельствовало о значительной гиперваскуляризации терминальных ворсин, что обеспечило хорошее внутри-утробное развитие плода. Хорошо была представлена пролиферация синцитиотрофобласта с образованием синцитиальных почек и синцитиальных мостиков. Описанные изменения указывали на наличие компенсированной формы относительной плацентарной недостаточности.
При морфологическом исследовании последов детей, родившихся с явлениями гипотрофии, наряду с характерными изменениями и различной степени выраженности компенсаторно-приспособительными реакциями, имелось явная редукция сосудистого русла ворсинчатого хориона. Это сочеталось с повышением коэффициента плотности ворсин, который составил 4,09±0,06 и, как следствие этого, объем материнской крови в межворсинчатом пространстве был уменьшен. Эти изменения соответствовали относительно субкомпенсированной форме плацентарной недостаточности.
При морфологическом исследовании плаценты после самопроизвольного выкидыша наряду с выраженными альтернативными и воспалительными изменениями отмечалась резкая задержка развития ворсинчатого хориона, выраженный продуктивный васкулит, что сочеталось со слабовыраженными компенсаторно-приспособительными процессами и свидетельствовало о тяжелом герпетическом поражении плаценты с явлениями декомпенсированной формы хронической плацентарной недостаточности.
Заключение. Генитальная герпетическая инфекция приводит к развитию хронической плацентарной недостаточности, степень тяжести которой зависит от времени, частоты и длительности рецидивов заболевания. Изменения в плаценте характеризуются наличием как деструктивных, так и компенсаторных процессов, степень сохранности которых определяет дальнейшее развитие и состояние плода.
Беременных с данной патологией следует отнести к группе высокого риска по возможности развития плацентарной недостаточности. В план обследования пациенток с данной патологией должны быть включены современные методы диагностики состояния фетоплацентарного комплекса и морфологическое исследование последа. Выявленные морфологические изменения последа позволяют своевременно начать патогенетически обоснованную терапию новорожденных, что способствует снижению частоты тяжелых форм неонатального герпеса.
Список использованных источников:
1. Каримова Ф.Д., Раджабова З.А. Современные аспекты патогенеза, диагностики и лечения герпесвирусной инфекции. Метод. пособие. 2008 - С. 1-13.
2. Андриевская И.А. Состояние стероидогенеза в системе мать плацента плод при обострении герпесной инфекции// Бюл. физиол. и патол. дыхания. - 2004. - Вып. 17. - С. 65-68.
3. Довжикова И.В. Гистохимическая характеристика этапов синтеза холестерина в плаценте беременных, перенесших обострение герпесвирусной инфекции// Бюл. физиол. и патол. дыхания. - 2008. - Вып. 28. - С. 17-20.
4. Сухих Г.Л., Ванько Л.В. Иммунология беременности. - М: РАМН, 2003; 400 с.
5. Brown Z. Preventing herpes simplex virus transmission to the neonate// Herpes. - 2004; 11; 3: 175-186.
6. Gerber S., Hohlfeld P. Screening for infectious diseases// Childs Nerv Syst - 2003; 19: 7-8: 429-432.
7. Jonsson M.K., Wahren B. Sexually transmitted herpes simplex viruses// Scand J Infect Dis - 2004; 36: 2: 93-101.
8. Leung D.Т., Sacks S.L. Current treatment options to prevent perinatal transmission of herpes simplex virus// Expert opin Pharmacother 2003; 4: 10: 1809-1819.
9. Schleiss M.R. Vertically transmitted herpes virus infections// Herpes 2003; 10: 1:4-11.
10. Henderson J.L., Weiner C.P. Congenital infection// Curr. Opin. Obstet, Gynecol. 2005, vol. 7, № 2, p. 130–134.
Подписано в печать: 11.01.2012
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.
Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Плацентит – это воспаление плаценты, которое возникает под действием неинфекционных и инфекционных факторов. Патология плаценты может проявиться на любом сроке, симптомы зависят от выраженности воспаления. Плацентит приводит к дисфункции фето-плацентарного комплекса, его исходом становятся плацентарная недостаточность, задержка развития плода, внутриутробное инфицирование. Значительно возрастает риск преждевременных родов и гибели новорожденного. Для диагностики используется УЗИ, которое позволяет заметить нарушение структуры плаценты, плацентарного кровотока. Лечение плацентита проводится антибиотиками, а также препаратами, улучшающими функцию плаценты.
МКБ-10
Общие сведения
Плацентит – инфекционно-воспалительное заболевание, чаще всего является результатом восходящего распространения инфекции. У 98% женщин приводит к неблагоприятному течению беременности и развитию осложнений. Угроза прерывания, ассоциированная с плацентитом, отмечается у 76% беременных. В большинстве случаев плод страдает от внутриутробной гипоксии, 9% детей рождается с признаками гипотрофии. Инфекция вызывает несвоевременное излитие вод у 38% беременных, у трети женщин это приводит к аномалиям родовой деятельности. Риск внутриутробного инфицирования существует у 6% детей, которые развиваются в условиях плацентита.

Причины плацентита
У всех беременных наблюдается физиологическая иммуносупрессия, вызванная повышением выработки прогестерона. При наличии очагов хронической или острой инфекции она может распространиться на плаценту. Чаще всего инфицирование происходит восходящим путем из влагалища через шейку матки. К плацентиту приводят различные виды микроорганизмов и действие неинфекционных факторов:
- Бактерии. У женщин с плацентитом в мочеполовых путях обнаруживаются стрептококки группы В (Streptococcus agalactiae), другие гноеродные бактерии. Возбудителями плацентита могут быть листерии, спирохеты. Микобактерии туберкулеза проникают в плаценту гематогенным путем и вызывают специфическое воспаление.
- Вирусы. В 7-25% случаев вирусного плацентита причиной воспаления является вирус простого герпеса. Морфологические изменения по типу плацентита характерны для парвовирусной (B19V), респираторно-синтициальной инфекции, цитомегаловируса, ВИЧ-инфекции.
- Простейшие. Причиной плацентита может явиться токсоплазмоз. У беременных инфекция может протекать в острой или бессимптомной форме, приводить к тяжелым осложнениям. Редко регистрируется плацентит, вызванный малярийным плазмодием. Эта инфекция характерна для жарких стран, заражение беременной может произойти во время путешествия.
- Неинфекционные причины. Воспалительный ответ тканей плаценты возможен при изменении показателя рН амниотических вод, который в норме составляет 7,0-7,5. При острой или хронической гипоксии плода, преждевременном старении плаценты, переношенной беременности к плацентиту приводит появление мекония в околоплодных водах.
Патогенез
Воспаление может возникать в различных слоях плаценты. Воспалительная реакция сопровождается миграцией лейкоцитов и инфильтрацией тканей, нарушением кровообращения, которое вызвано микротромбозами межворсинчатого пространства, микроинфарктами, ишемией концевых ворсин. Также определяется полнокровие и отек стромы. В зависимости от вовлеченного слоя различают следующие формы плацентита:
- Базальный децидуит – воспаление в базальной пластинке плаценты. Для него характерны некротические изменения, дистрофия клеток, пролиферативные изменения стенок спиральных артерий и вен.
- Интевиллузит - плацентит межворсинчатого пространства, очаговое поражение части ворсин с миграцией воспалительных клеток.
- Виллузит - воспаление ворсин хориона, может быть терминальным или стволовым, в зависимости от типа поврежденных структур.
- Плацентарный хориоамнионит – это более тяжелая форма, которая сопровождается интервиллузитом и ангиитом сосудов пуповины.
Плацентит не всегда приводит к инфицированию плода, но может сказаться на состоянии эндометрия после родов и ухудшить прогнозы для следующих беременностей. Одновременно внутриутробная инфекция у ребенка может протекать без признаков плацентита. Такой вариант течения наблюдается при некоторых вирусных инфекциях. Для каждого типа возбудителя характерна своя гистологическая картина.
Симптомы плацентита
Патология может быть следствием острой либо хронической инфекции. У нее нет специфических проявлений, при латентном течении симптомы могут вовсе отсутствовать. Учитывая восходящий путь инфицирования, беременную могут беспокоить вагинальные выделения. Они могут быть белыми, с желтоватым или сероватым оттенком, с неприятным запахом или без него. При остром течении вагинита из-за близкого расположения мочеиспускательного канала появляются дизурические расстройства. Женщина жалуется на неприятные ощущения во время мочеиспускания, походы в туалет становятся чаще. Выделения сопровождаются зудом и жжением, покраснением половых губ.
Боль внизу живота является следствием воспаления. При плацентите и возникновении угрозы преждевременных родов боли появляются в нижней части матки. Они тянущие, ноющие, могут отдавать в промежность или поясницу. На появление угрозы прерывания беременности указывает тонус матки, схваткообразная боль. Плод реагирует на недостаток кислорода увеличением двигательной активности или снижением количества шевелений. Настороженность должны вызывать подтекание околоплодных вод или их дородовое излитие. Это повод срочно обратиться за медицинской помощью в гинекологическое отделение на сроке до 22 недель, а на более позднем сроке – в роддом.
Осложнения
Плацентит вызывает осложнения беременности, некоторых из них становятся показанием для досрочного родоразрешения. У каждой 5-ой беременной отмечается преждевременное излитие околоплодных вод. Для беременных с плацентитом характерна плацентарная недостаточность. При декомпенсации состояния у плода развивается острая гипоксия, которая может привести к антенатальной гибели или тяжелым повреждениям центральной нервной системы ребенка. Чем раньше возник плацентит, тем выше вероятность тяжелых осложнений. Течение беременности может осложниться гестозом, внутриутробной инфекцией ребенка, преждевременными родами.
Диагностика
При нарушении самочувствия, боли в животе, появлении выделений из половых путей беременной необходимо обратиться к врачу акушеру-гинекологу, у которого она состоит на учете. Объем диагностических процедур подбирается индивидуально, опираясь на клинические проявления, данные анамнеза и предыдущих исследований. Базовая диагностика плацентита проводится неинвазивными инструментальными методами:
- Гинекологический осмотр. Отмечаются патологические выделения из влагалища, признаки воспаления в виде отека и гиперемии слизистой. Но при вирусном плацентите в половых путях изменений может не быть. При угрозе прерывания беременности из шейки выделяется кровь. На подтекание вод указывает наличие прозрачной жидкости во влагалище. Если произошло дородовое излитие вод, предлежащая часть плода опускается в полость малого таза и хорошо пальпируется.
- Акушерский осмотр. Матка в повышенном тонусе, возбудима. При длительно существующем плацентите в тяжелых случаях может наблюдаться отставание размеров матки от срока беременности, что указывает на внутриутробную задержку развития. О гипоксии говорят приглушенные тоны сердца плода. Отсутствие сердцебиения и шевеления – признак антенатальной смерти.
- УЗИ плода. Определяется утолщение плаценты, кистозные полости, кальцификаты. На раннем сроке может наблюдаться расширение межворсинчатого пространства. Неблагоприятный признак – сегментарные сокращения матки, признаки старения плаценты. При развитии фето-плацентраной недостаточности плод отстает в размерах от срока гестации, его двигательная активность снижена.
- Допплерометрия сосудов плаценты. Регистрируются нарушения гемодинамики. При плацентите, который затрагивает плодовую или материнскую часть плаценты, отмечается ее гиповаскуляризация. При диффузном плацентите компенсаторная реакция приводит к гиперваскуляризации плаценты. О выраженности плацентита судят по индексу васкуляризации и кровотока.
- Лабораторная диагностика. В общем анализе крови признаки воспаления – ускорение СОЭ, повышенное количество лейкоцитов. Для вирусного плацентита характерно увеличение лимфоцитов. В лейкоцитарной формуле отмечается сдвиг влево из-за образования молодых форм лейкоцитов. Биохимический анализ крови показывает повышенный С-реактивный белок.
Подтверждается плацентит после родов. Плодное место с оболочками и пуповиной отправляется на гистологическое исследование. По его результатам можно предположить тип инфекции, если обследование не проводилось во время беременности. Для нормального восстановления в послеродовом периоде и профилактики эндометрита назначается лечение.
Лечение плацентита
Женщина с плацентитом госпитализируется для проведения качественного обследования, лечения и выбора акушерской тактики. Консервативная терапия оправдана при недоношенной беременности и признаках незрелого плода, но при сохранении его нормальной гемодинамики. При некупирующейся острой гипоксии плода и в других тяжелых случаях показано досрочное родоразрешение путем кесарева сечения. При плацентите проводится:
- Антибактериальная терапия. Применяются антибиотики широкого спектра действия из группы защищенных пенициллинов, цефалоспоринов, макролидов. В тяжелых состояниях их вводят инъекционно с последующим переходом на формы для приема внутрь. Курс составляет 7-14 суток. Антибиотики обязательно назначаются при безводном промежутке более 12 часов для профилактики хориоамнионита.
- Токолитики. Необходимы для снижения тонуса матки и пролонгирования беременности. Назначают магния сульфат капельно, в качестве экстренного средства допускается применение гексапреналина. Но по клиническим рекомендациям предпочтение отдается фенотеролу. Токолитики не используют после излития вод.
- Глюкокортикоиды. Назначаются в случаях, когда есть высокая вероятность досрочного родоразрешении или после отхождения вод на сроке меньше 36 недель. Необходимы для ускорения созревания легких плода и профилактики болезни гиалиновых мембран новорожденного. Схема и продолжительность терапии подбирается индивидуально.
- Антиагреганты и антикоагулянты. Необходимы для улучшения кровотока в плаценте, профилактики тромботических осложнений. Применяют курантил, пентоксифиллин в таблетках длительным курсом. По показаниям назначаются низкомолекулярные гепарины в виде инъекций. Использование прекращают за 2 недели до предполагаемых родов.
Прогноз и профилактика
При плацентите прогноз зависит от срока развития воспаления и способностей организма компенсировать сосудистые нарушения. Для плода плацентраная недостаточность увеличивает риск задержки развития, внутриутробного инфицирования и гипоксии, которая может завершиться внутриутробной гибелью. Профилактика плацентита заключается в прегравидарной подготовке, своевременном лечении хронических воспалительных процессов половых органов. Мазки на чистоту влагалища, которые берутся при постановке на учет, позволяют вовремя заметить воспалительные изменения, провести дополнительное обследование и лечение.
1. Особенности плацентарного кровотока при плацентитах./Фомина М.П.//Вестник Витебского государственного медицинского университета. - 2012.
2. Перинатальные исходы при инфицированной плаценте./Новикова О.Н., Мустафина Л.Р., Ушакова Г.А., Логвинов С.В.// Мать и дитя в Кузбассе. 2015 - №2(61).
3. Влияние плацентита на течение и исход беременности./Донгузова Е.В.// III Всероссийская неделя медицинской науки с международным участием. – 2014.
Плацентарная недостаточность (ПН), несмотря на успехи современного акушерства, занимает ведущее место в структуре перинатальной заболеваемости и смертности. Плацентарная дисфункция служит основной причиной внутриутробной гипоксии, синдрома задержки роста плода (СЗРП). Частота ПН варьирует по данным различных авторов от 13 до 42% [10, 15].
В то же время отсутствует единство взглядов на ведение беременных с ПН, дискутируется вопрос о длительности лечения, сроках и методах родоразрешения беременных. Актуальным остается изучение адаптационных и компенсаторных изменений в плаценте на ультраструктурном уровне с последующей разработкой подходов к коррекции этих процессов.
Плацентарная недостаточность — это симптомокомплекс, при котором возникают морфофункциональные нарушения плаценты и плода вследствие различных экстрагенитальных, гинекологических заболеваний и акушерских осложнений. При этом нарушается кровообращение плаценты и плода, что сопровождается в ряде случаев задержкой роста плода [9, 10, 14].
Выделяют следующие факторы риска, приводящие к развитию плацентарной недостаточности: возраст младше 17 лет и старше 30 лет; неблагоприятные социально-бытовые условия; вредные пристрастия; экстрагенитальная патология; инфекционные и гинекологические заболевания; отягощенный акушерско-гинекологический анамнез [10, 17].
Несмотря на полиэтиологичную природу ПН, в развитии осложнения на фоне инфекции имеются определенные особенности. К первичным звеньям в патогенезе недостаточности плаценты относят нарушение созревания плаценты, отставание формирования котиледонов, снижение маточно-плацентарного и плодово-плацентарного кровообращения [21].
Под влиянием одного или нескольких патологических факторов возникает активация функции плаценты и компенсаторно-приспособительных процессов, при угнетении которых развивается стадия дезорганизации и угнетения функции плаценты, с возможным развитием в ней необратимых деструктивных процессов [1].
Воздействие инфекционного фактора, при истощении компенсаторно-приспособительных реакций всех звеньев в функциональной системе мать – плацента – плод, способствует инфекционному поражению плаценты с последующим заражением плода [1]. Развивается токсинемия, расстройства метаболизма, циркуляторные нарушения в данной системе.
Плацентарная недостаточность, обусловленная неспецифическим воздействием микробных токсинов и метаболитов, поступающих в материнский кровоток из очага инфекции, создает предпосылки для развития хронической гипоксии и гипотрофии плода. Не оспорим тот факт, что в развитии инфекционного поражения плаценты и плода, степени тяжести их нарушений, локализации патологического процесса, имеют значение сроки беременности, вид возбудителя и его вирулентность, тропизм возбудителя к плаценте, органам и тканям плода, пути проникновения микроорганизмов от матери к плоду, защитные резервы матери и плода [17].
При наличии инфекции в амниотической жидкости повышается уровень липополисахаридов с последующей активацией деятельности клеток фетального трофобласта, что приводит к усиленному синтезу ими цитокинов: IL 1, 6, 8, 10, TNF. Они, в свою очередь, создавая условия для повышения метаболизма цАМФ, выступают посредниками в развитии воспалительных и иммунных реакций в системе мать – плацента – плод [16]. При участии цитокинов, под воздействием эндотоксинов и фосфолипаз микроорганизмов происходит высвобождение арахидоновой кислоты из тканевых фосфолипидов, вызывая синтез простагландинов. Простагландины Е2 и F2α являются медиаторами деградации интерстициального коллагена I типа, дилатации шейки матки и развития родовой деятельности [15]. Однако по данным зарубежной литературы, концентрации регуляторных цитокинов IL 4 и IL 10 оказываются меньше значений, чем у здоровых женщин [20].
Циркуляция вирусов в крови или наличие гнойно-воспалительного очага в организме матери способствует гематогенному или трансплацентарному пути передачи инфекции к плоду [3, 5]. Отмечены случаи трансдецидуального пути проникновения инфекции (из гнойных очагов между стенкой матки и плодными оболочками) и нисходящего пути (через маточные трубы из возможных очагов в брюшной полости). В тоже время, наличие массивной инфекции у женщин вирусной или бактериальной этиологии может не вызывать инфицированности у плода [3, 9, 14, 15].
Таким образом, степень выраженности патологического влияния инфекции на плод и новорожденного зависит от характера изменений иммунного статуса беременной. Повышенный рост титра активных антител, может выступать в качестве прямых патогенных факторов по отношению к плоду. В свою очередь тяжесть общего клинического состояния и частота нарушений физиологического течения раннего неонатального периода зависит от выраженности изменений содержания данных антител.
Во время физиологически протекающей беременности меняются функции Т-системы иммунитета у матери за счет выработки цитотрофобластом иммунодепрессантов, возникает состояние физиологической иммуносупрессии и развитие вторичного иммунодефицита, создавая хорошие условия для реактивации хронической инфекции [19]. У беременных с персистирующей бактериальной инфекцией снижается интерфероносинтезирующая функция лейкоцитов, развивается ферментативный дисбаланс иммунокомпетентных клеток [14]. При вирусных заболеваниях снижается количество лимфоцитов, угнетается их бластная трансформация, с последующим подавлением ими синтеза α и γ-интерферона [8].
При выявлении плацентарной недостаточности инфекционного генеза необходимо определение причины, которая ее вызвала [1]. Методы диагностики плацентарной недостаточности включают в себя: 1) стандартные, свидетельствующие о степени и характере изменений происходящих в плаценте, 2) специфические обследования на вид возбудителя у беременных с высоким риском развития ПН.
К стандартным методам относятся исследования гормональной (плацентарного лактогена, трофобластического бета-1-гликопротеина (ТБГ), хорионического гонадотропина, эстриола и кортизола в сыворотке крови беременных) [10] и метаболической функции плаценты, ультразвуковое исследование, допплерометрия кровотока в сосудах фетоплацентарного комплекса, морфологическая диагностика плаценты [2, 11]. Причем оценка нарушений метаболизма (изменение уровня плацентарной щелочной фосфатазы), образование продуктов свободно-радикальных реакций, сдвиги кислотно-основного состояния позволяют диагностировать хроническую ПН на доклиническом этапе.
При развитии инфекционного процесса определение белков острой фазы (БОФ), например, лактоферрина (ЛФ) [4], позволяет определить напряженность организма, связанную с бактериальной агрессией, при этом концентрация ЛФ в плазме крови не зависит от степени ее насыщения железом [7]. ЛФ синтезируются клетками сыворотки крови нейтрофилами [7], стимулируют фагоцитарные и цитотоксические свойства макрофагов, повышая их бактерицидную активность, а так же угнетают реакцию СЗ и С5 компонентов комплемента с иммунными комплексами по классическому пути, оказывая супрессивное действие на выработку IL 1 [6].
При ПН инфекционного генеза и ВУИ важную роль играет исследование амниотической жидкости на противовоспалительные цитокины (IL 6). Так повышение содержания IL 6 в слизи цервикального канала у беременных с вирусной инфекцией служит маркером ВУИ у плода [10].
При инфекционном процессе в репродуктивном тракте беременных происходит активация клеток иммунной системы, приводящее к индукции клеточного иммунного ответа и продукции провоспалительных цитокинов [13]. Выявление в сыворотке крови повышенной концентрации цитокинов говорит о нарушении принципа локальности функционирования цитокиновой системы, развивающееся при воспалительных процессах, и в дальнейшем сопровождающееся генерализованной активацией клеток иммунной системы [12]. Развитие воспалительного процесса в урогенитальном тракте беременных сопровождается антигенной стимуляцией макрофагов, нейтрофилов, лимфоцитов, усиленной продукцией цитокинов (IL 1, IL 6, IL 8, TNF и т.д.) с развитием синдрома системного воспалительного ответа [12,17]. В результате этого, по мере развития инфекционного процесса, возникает гипоксия плода. В зависимости от компенсаторных возможностей организма имеющиеся метаболические расстройства у плода, могут приводить к нарушению функционального состояния матери и плода [2]. Развитие явлений плацентита при ПН инфекционного генеза приводит к системным нарушениям гормонального баланса, иммунного и цитокинового статусов [11, 18].
Учитывая короткий период полужизни цитокинов, тесный биологический эффект одного цитокина, с действием других нацеливает клиницистов на поиск новых маркеров активации иммунной системы.
Таким образом, диагностика плацентарной недостаточности инфекционного генеза, особенно на ранних этапах ее развития, требует детального исследования беременных на инфекции, передаваемые половым путем и выделение пациенток в группу риска по развитию ВУИ. Необходимо своевременное проведение ультразвуковой диагностики ПН и ВУИ, с назначением адекватной терапии с учетом сложившейся клинической ситуации.
Список использованных источников:
1. Бубнова Н.И., Зайдиева З.С., Тютюнник В.Л. Морфология последа при генитальной герпетической инфекции// Акушерство и гинекология. – 2001. – № 6. – С. 24-29.
2. Введение в клиническую морфологию плаценты человека/ Под ред. А.Ф.Яковцевой.- Саратов: Изд-во Саратовского ун-та, 1991.- 168 с.
3. Веденеева Г.Н., Фоменко Б.А., Евсюкова И.И., Сельков С.А. Состояние и последующее развитие новорожденных детей от матерей с ЦМВИ// Российский вестник перинатологии и педиатрии. – 1997. – № 3. – С. 25-29.
4. Гнипова В.В. Оптимизация патогенетической терапии у женщин с привычным невынашиванием беременности I триместра на основании исследования состояния эндометрия: Автореф. дис. … канд. мед. наук. - М., 2003. - 20 с.
5. Димитрова В.И. Оздоровление женщин после неразвивающейся беременности: Автореф. дис. … канд. мед. наук. - М., 2006.-22 с.
7. Ефремов С.Н., Цхай В.Б., Пуликов А.С., Макаренко Т.А. Морфофункциональные особенности плаценты при хламидиозе// Вестник перинатологии, акушерства и гинекологии. – Красноярск, 2000. – Вып. 7. – С. 46-49.
8. Запертова Е.Ю. Роль ряда цитокинов и интегринов в генезе привычного невынашивания беременности: Автореф. дис. … канд. мед. наук. -М., 2005.- 24 с.
10. Макаров И.О. Функциональное состояние системы мать-плацента-плод при гестозе: Дис. . докт. мед. наук. – М. – 1998.
12. Назаров П.Г. Реактанты острой фазы воспаления. – СПб.: Наука, 2001. – 423с.
13. Останин А.А., Макагон А.В., Леплина О.Ю. Показатели иммунитета плода в ранней диагностике внутриутробной инфекции// Медицинская иммунология. – 2001. – Т. 3, № 4. – С. 515-524.
14. Савичева А.М., Башмакова М.А., Аржанова О.Н. и др. Инфекции у беременных// Журналъ акушерства и женскихъ болезней.-2002.-Вып.2-Т.LI.- С.71-77.
15. Серов В.Н., Тютюнник В.Л., Зубков В.В., Зайдиева З.С. Перинатальные исходы у беременных с инфекционными заболеваниями и плацентарной недостаточностью// Акушерство и гинекология. – 2002. – № 3. – С. 16-21.
16. Тареева Т.Г. Перинатальные аспекты смешанной урогенитальной инфекции (патогенез, прогнозирование, профилактика): Дис. . докт. мед. наук. – М. – 2000.
17. Тютюнник В.Л. Хроническая плацентарная недостаточность при бактериальной и вирусной инфекции (патогенез, диагностика, профилактика, лечение): Дис. . докт. мед. наук. – М. – 2002.
18. Шуршалина А.В. Хронический эндометрит у женщин с патологией репродуктивной функции: Автореф. дис. . докт. мед. наук. -М., 2007.- 38 с.
19. Hallman M. Intrauterine infections and the fetus// Duodecim. – 1999. – Vol. 115, № 14. – P. 1437-1438.
20. Yamada H., Kato E.H., Tsuruga R. et al. Insulin response patterns contribute to different perinatal risks in gestational diabetes// Gynecol.Obstet.Invest.-2001.-Vol.51.-P.103-109.
21. Kingdom R., Gupta N., Nair D. et al. Screening for TORCH-infections in pregnant women: a report from Delhi// Southeast. Asian. J. Trop. Med. Public. Health. – 1999. – Vol. 30, № 2. – P. 284-286.
Подписано в печать: 12.01.2012
Читайте также:

