Как выглядит вирус бактериофаг
Обновлено: 24.04.2024
Валентин Викторович Власов — академик РАН, доктор химических наук, профессор, директор Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Лауреат Государственной премии РФ (1999). Автор и соавтор более 300 научных работ и 20 патентов.
Вера Витальевна Морозова — кандидат биологических наук, старший научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор более 30 научных работ и 6 патентов.
Игорь Викторович Бабкин — кандидат биологических наук, ведущий научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 58 научных работ и 2 патентов.
Нина Викторовна Тикунова — доктор биологических наук, заведующая лабораторией молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 120 научных работ и 21 патента.
Когда в 1930-х гг. группа ученых занялась проблемами функционирования живых систем, то в поиске простейших моделей они обратили внимание на бактериофаги — вирусы бактерий. Ведь среди биологических объектов нет ничего проще, чем бактериофаги, к тому же их можно легко и быстро выращивать и анализировать, а вирусные генетические программы невелики.
Фаг — это минимального размера природная структура, содержащая плотно упакованную генетическую программу (ДНК или РНК), в которой нет ничего лишнего. Эта программа заключена в белковую оболочку, снабженную минимальным набором устройств для ее доставки внутрь бактериальной клетки. Бактериофаги не могут размножаться сами по себе, и в этом смысле их нельзя считать полноценными живыми объектами. Их гены начинают работать только в бактерии, используя имеющиеся в бактериальной клетке биосинтетические системы и запасы молекул, необходимых для синтеза. Однако генетические программы этих вирусов принципиально не отличаются от программ более сложных организмов, поэтому эксперименты с бактериофагами позволили установить основополагающие принципы устройства и работы генома.
В дальнейшем эти знания и разработанные в ходе исследований методы стали фундаментом для развития биологической и медицинской науки, а также широкого спектра биотехнологических приложений.
Бактериофаги — наши друзья, когда речь идет о бактериях, патогенных для человека. Однако есть и другие, дружественные нам бактерии, которые используются в современных биотехнологических производствах, а также в традиционных производствах пищевой промышленности, таких как сыроварение и т. п. В этих случаях фаги могут приносить большой вред, поскольку в больших популяциях микроорганизмов, находящихся в стадии интенсивного роста, создаются благоприятные условия для размножения фагов, что приводит к лизису производственных бактериальных культур. При производстве сыра проблема не столь серьезна, так как при этом обычно применяют закваски, состоящие из многих культур, часть которых выдержит фаговую атаку и продолжит процесс молочнокислого брожения. Серьезные неприятности возникают, если весь процесс основан на применении одного конкретного бактериального штамма, как, например, при производстве антибиотиков или терапевтических белков.
Борцы с патогенами
Первые попытки использовать бактериофаги для лечения инфекционных заболеваний были предприняты практически сразу после их открытия, однако недостаток знаний и несовершенные биотехнологии того времени не позволили достичь полного успеха. Тем не менее дальнейшая клиническая практика показала принципиальную возможность успешного применения бактериофагов при инфекционных заболеваниях желудочно-кишечного тракта, мочеполовой системы, при острых гнойно-септических состояниях больных, для лечения хирургических инфекций и т. д.
По сравнению с антибиотиками бактериофаги имеют ряд преимуществ: они не вызывают побочных эффектов, к тому же строго специфичны для определенных видов бактерий, поэтому при их использовании не нарушается нормальный микробиом человека. Однако такая высокая избирательность создает и проблемы: чтобы успешно лечить пациента, нужно точно знать инфекционный агент и подбирать бактериофаг индивидуально.
Бактериофагами лечат инфекционные болезни не только людей, но и домашних и сельскохозяйственных животных: мастит у коров, колибактериоз и эшерихиоз у телят и свиней, сальмонеллез у кур. Особенно удобно применять фаговые препараты в случае аквакультуры — для лечения промышленно выращиваемых рыб и креветок, так как в воде они долго сохраняются. Бактериофаги помогают защитить и растения, хотя применение фаговых технологий в этом случае затруднено из-за воздействия природных факторов, таких как солнечный свет и дождь, губительных для вирусов.
Фаги могут сыграть большую роль в поддержании микробиологической безопасности продуктов питания, так как применение антибиотиков и химических агентов в пищевой отрасли не решает эту проблему, одновременно снижая уровень экологической чистоты продукции. О серьезности самой проблемы говорят статистические данные: например, в США и России ежегодно регистрируется до 40 тыс. заболевших сальмонеллезом, из которых 1% умирает. Распространение этой инфекции в значительной степени связано с выращиванием, переработкой и потреблением различных видов птицы, и попытки применить для борьбы с ней бактериофаги дали многообещающие результаты.
Так, американская компания Intralytix производит фаговые препараты для борьбы с листериозом, сальмонеллезом и бактериальным загрязнением кишечной палочкой. Они разрешены к применению как добавки, предотвращающие размножение бактерий на продуктах питания — их распыляют на продукты из мяса и домашней птицы, а также на овощи и фрукты. Эксперименты показали, что коктейль из бактериофагов может быть успешно применен и при транспортировке и реализации живой прудовой рыбы для снижения бактериального загрязнения не только воды, но и самой рыбы.
Очевидным применением бактериофагов является дезинфекция, то есть уничтожение бактерий в тех местах, где их не должно быть: в больницах, на пищевых производствах и т. п. Для этой цели британская компания Fixed-Phage разработала метод фиксации фаговых препаратов на поверхностях, обеспечивающий сохранение биологической активности фагов до трех лет.
Эксперимент американских исследователей А. Херши и М. Чейза с использованием бактериофагов, меченных изотопами серы и фосфора, доказали роль ДНК как основного носителя генетической информации
В качестве объектов для своих исследований М. Дельбрюк и его сотрудники использовали мутантные бактериофаги так называемой Т-серии, поражающие кишечную палочку
Семь дней творения
Современные методы синтетической биологии позволяют не только вносить различные модификации в фаговые геномы, но и создавать полностью искусственные активные фаги. Технологически это несложно, нужно только синтезировать фаговый геном и ввести его в бактериальную клетку, а там он уже сам запустит все процессы, необходимые для синтеза белков и сборки новых фаговых частиц. В современных лабораториях на эту работу уйдет всего несколько дней.
Генетические модификации применяют, чтобы изменить специфичность фагов и повысить эффективность их терапевтического действия. Для этого наиболее агрессивные фаги снабжают узнающими структурами, связывающими их с целевыми бактериями. Также в вирусные геномы дополнительно встраивают гены, кодирующие токсические для бактерий белки, нарушающие метаболизм, — такие фаги более смертоносны для бактерий.
Универсальный способ защиты бактерий от всех внешних воздействий — так называемые биофильмы, пленки из ДНК, полисахаридов и белков, которые бактерии создают совместными усилиями и куда не проникают ни антибиотики, ни терапевтические белки. Такие биопленки — головная боль врачей, так как они способствуют разрушению зубной эмали, образуются на поверхности имплантов, катетеров, искусственных суставов, а также в дыхательных путях, на поверхности кожи и т. п. Для борьбы с биофильмами были сконструированы особые бактериофаги, содержащие ген, кодирующий специальный литический фермент, разрушающий бактериальные полимеры.
Большое число ферментов, сегодня широко использующихся в молекулярной биологии и генетической инженерии, были открыты в результате исследований бактериофагов.
Фаговые антибиотики
В терапевтических целях фаги необязательно использовать напрямую. За миллионы лет эволюции бактериофаги разработали арсенал специфических белков — инструментов для распознавания целевых микроорганизмов и манипуляций с биополимерами жертвы, на основе которых можно создавать противобактериальные препараты. Наиболее перспективными белками такого типа являются ферменты эндолизины, которые фаги используют для разрушения клеточной стенки при выходе из бактерии. Сами по себе эти вещества являются мощными антибактериальными средствами, нетоксичными для человека. Эффективность и направленность их действия можно повысить, изменив в них адресующие структуры — белки, специфически связывающиеся с определенными бактериями.
Большинство бактерий делятся по устройству клеточной стенки на грамположительные, мембрана которых покрыта очень толстым слоем пептидогликанов, и грамотрицательные, у которых слой пептидогликана расположен между двумя мембранами. Использование природных эндолизинов особенно эффективно в случае грамположительных бактерий (стафилококков, стрептококков и др.), поскольку пептидогликановый слой у них расположен снаружи. Грамотрицательные бактерии (синегнойная палочка, сальмонеллы, кишечная палочка и др.) являются менее доступной мишенью, поскольку ферменту, чтобы добраться до внутреннего пептидогликанового слоя, необходимо проникнуть сквозь внешнюю бактериальную мембрану.
Для преодоления этой проблемы были созданы так называемые артилизины — модифицированные варианты природных эндолизинов, содержащие поликатионные или амфипатические пептиды, которые дестабилизируют внешнюю мембрану и обеспечивают доставку эндолизина непосредственно к пептидогликановому слою. Артилизины обладают высокой бактерицидной активностью и уже показали свою эффективность при лечении отитов у собак (Briers et al., 2014).
Примером модифицированного эндолизина, избирательно действующего на определенные бактерии, является препарат P128 канадской компании GangaGen Inc. Он представляет собой биологически активный фрагмент эндолизина, соединенный с лизостафином — адресующей белковой молекулой, которая связывается с поверхностью клеток стафилококков. Полученный химерный белок обладает высокой активностью против разных штаммов стафилококка, в том числе обладающих множественной лекарственной устойчивостью.
Анализируя размножение фагов в присутствии целевых бактерий, можно количественно определить численность последних. Так как количество фаговых частиц в растворе возрастет пропорционально числу содержавшихся в нем бактериальных клеток, то для оценки численности бактерий достаточно определить титр бактериофага.
Специфичность и чувствительность такой аналитической реакции достаточно высока, а сами процедуры просты в исполнении и не требуют сложного оборудования. Важно, что диагностические системы, основанные на бактериофагах, сигнализируют о наличии именно живого патогена, тогда как другие методы, такие как ПЦР и иммуноаналитические, свидетельствуют лишь о наличии биополимеров, принадлежащих этой бактерии. Такого типа диагностические методы особенно удобны для использования в экологических исследованиях, а также в пищевой индустрии и сельском хозяйстве.
Вероятно, с помощью модифицированных фагов удастся решить и давнюю задачу глобальной важности — разработать дешевые и быстрые методы детекции возбудителей туберкулеза на ранней стадии заболевания. Задача эта очень сложна, поскольку микобактерии, вызывающие туберкулез, отличаются крайне медленным ростом при культивировании в лабораторных условиях. Поэтому диагностика заболевания традиционными методами может затягиваться на срок до нескольких недель.
Фаговая технология позволяет упростить эту задачу. Суть ее в том, что к образцам анализируемой крови добавляют бактериофаг D29, способный поражать широкий спектр микобактерий. Затем бактериофаги отделяют, и образец перемешивают с быстрорастущей непатогенной культурой микобактерий, также чувствительной к этому бактериофагу. Если в крови первоначально имелись микобактерии, которые были инфицированы фагами, то в новой культуре будет также наблюдаться наработка бактериофага. Таким образом можно выявить единичные клетки микобактерий, а сам процесс диагностики с 2–3 недель сокращается до 2–5 дней (Swift & Rees, 2016).
Фаговый дисплей
Из экспериментов Смита последовало два важных вывода: во-первых, используя технологию рекомбинантных ДНК, можно создавать огромные по разнообразию популяции численностью 10 6 –10 14 фаговых частиц, каждая из которых несет на своей поверхности разные варианты белков. Такие популяции назвали комбинаторные фаговые библиотеки. Во-вторых, выделив из популяции конкретный фаг (например, обладающий способностью связываться с определенным белком или органической молекулой), можно этот фаг размножить в бактериальных клетках и получить неограниченное число потомков с заданными свойствами.
Принципиальная схема процедуры биопеннинга — отбора высокоспецифичных рекомбинантных антител к конкретной мишени-антигену из комбинаторной библиотеки фагового дисплея на основе нитчатых бактериофагов. По: (Тикунова, Морозова, 2009)
На сегодня можно выделить два основных направления применения фагового дисплея. Технология на основе пептидов используется для исследования рецепторов и картирования сайтов связывания антител, создания иммуногенов и нановакцин, а также картирования сайтов связывания субстратов у белков-ферментов. Технология на основе белков и белковых доменов — для отбора антител с заданными свойствами, изучения белок-лигандных взаимодействий, скрининга экспрессируемых фрагментов комплементарной ДНК и направленных модификаций белков.
С помощью фагового дисплея можно вносить узнающие группировки во все виды поверхностных вирусных белков, а также в основной белок, формирующий тело бактериофага. Вводя в поверхностные белки пептиды с заданными свойствами, можно получить целый спектр ценных биотехнологических продуктов. Например, если этот пептид будет имитировать белок опасного вируса или бактерии, узнаваемый иммунной системой, то такой модифицированный бактериофаг представляет собой вакцину, которую можно просто, быстро и безопасно наработать.
Одним из важных применений метода фагового дисплея белков является создание фаговых библиотек рекомбинантных антител, где антигенсвязывающие фрагменты иммуноглобулинов расположены на поверхности фаговых частиц fd или М13. Особый интерес представляют библиотеки антител человека, поскольку такие антитела могут быть использованы в терапии без ограничения. В последние годы только на фармацевтическом рынке США продается около полутора десятка терапевтических антител, сконструированных с использованием этого метода.
Так как вирус представляет собой достаточно жесткую конструкцию с определенным соотношением размерностей, это обстоятельство позволяет использовать его для получения пористых наноструктур с известной площадью поверхности и нужным распределением пор в структуре. Как известно, именно площадь поверхности катализатора является критическим параметром, определяющим его эффективность. А существующие на сегодня технологии формирования на поверхности бактериофагов тончайшего слоя металлов и их оксидов позволяют получать катализаторы с чрезвычайно развитой регулярной поверхностью заданной размерности. (Lee et al., 2012).
Нитчатый бактериофаг М13, размножающийся в обычной кишечной палочке (а), может нести на своей поверхности рекомбинантные чужеродные белки, такие как антитела (б) либо пептиды (в). Он также может служить шаблоном для создания наноустройств и наноматериалов, таких как нанокристаллический катализатор с известной площадью поверхности и нужным распределением пор (г)
Путем покрытия нитчатых фагов золотом и двуокисью индия были получены электрохромные материалы — пористые нанопленки, меняющие цвет при изменении электрического поля, способные реагировать на изменение электрического поля в полтора раза быстрее известных аналогов. Подобного рода материалы перспективны для создания энергосберегающих ультратонких экранных устройств (Nam et al., 2012).
На основе комплексов бактериофага М13, двуокиси титана и одностенных углеродных нанотрубок были также созданы материалы для солнечных батарей (Dang et al., 2011).
Последние годы ознаменовались широкими исследованиями бактериофагов, которые находят себе все новые применения не только в терапии, но и в био- и нанотехнологиях. Их очевидным практическим результатом должно стать возникновение нового мощного направления персонализированной медицины, а также создание целого спектра технологий в пищевой промышленности, ветеринарии, сельском хозяйстве и в производстве современных материалов. Мы ждем, что второе столетие исследований бактериофагов принесет не меньше открытий, чем первое.
Литература
1. Бактериофаги: биология и применение / Ред.: Э. Каттер, А. Сулаквелидзе. М.: Научный мир. 2012.
2. Стент Г., Кэлиндар Р. Молекулярная генетика. М.: Мир. 1974. 614 с.
3. Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Acta Naturae. 2009. № 3. C. 6–15.
4. Mc Grath S., van Sinderen D. Bacteriophage: Genetics and Molecular Biology. Horizon Scientific Press, 2007.

Препараты на основе бактериофагов способны оказывать эффективную помощь при профилактике и борьбе с распространенными инфекциями без вреда организму. Мы попытаемся доходчиво объяснить, что такое бактериофаги, как они устроены и чем полезны для человека.
Мы будем очень рады, если вы процитируете наш материал, но обязательно укажите активную ссылку на него. Спасибо!
Препараты на основе бактериофагов способны оказывать эффективную помощь при профилактике и борьбе с распространенными инфекциями без вреда организму. Мы попытаемся доходчиво объяснить, что такое бактериофаги, как они устроены и чем полезны для человека.
Мы будем очень рады, если вы процитируете наш материал, но обязательно укажите активную ссылку на него. Спасибо!
В 1928 году британский бактериолог Александр Флеминг вернулся из отпуска в Шотландии в свою лабораторию в Лондоне и обнаружил, как в одной из чашек Петри бурно разрослась колония плесневых грибов (Penicillium notatum). С выделением пенициллина началась эра антибиотиков.
С тех пор антибиотики спасли миллионы жизней по всей планете. Флеминг также обнаружил, что бактерии обладали устойчивостью к антибиотикам, если действовали малым количеством пенициллина, либо если антибиотик употреблялся слишком короткое время.
Алмрот Райт предсказал устойчивость к антибиотикам еще до того, когда это было обнаружено экспериментально. Бактериальная резистентность — явление естественное по своей природе, а потому неизбежное.

Вот уже более десятка лет Всемирная организация здравоохранения, Центр по контролю заболеваний в США, многие крупные эксперты в России открыто признают, что мы вступили в так называемую пост антибиотиковую эру.
Например, в 2015 году в Китае была выявлена бактерия с новой мутацией в генах MCR-1, устойчивая к наиболее важному антибиотику в медицине - колистину, применяемому лишь в крайних случаях. Скорее всего, она появилась после того, как препарат начали активно использовать на животноводческих фермах. Ничего не мешает ей распространяться по миру и увеличивать спектр неизлечимых инфекций.
В 2016 году в США зафиксирован случай заражения человека одной из разновидностей энтеробактерий. Штамп оказался устойчивым к воздействию тетрациклина, колистина, ко всем до единого из 26 видов антибиотиков, представленных на рынке. Женщину так и не удалось спасти.
Ученые по всему миру продолжают изучать явление резистентности в надежде минимизировать угрозы. Однако одной из самых подходящих альтернатив можно назвать препараты (комбинированные или моно) на основе бактериофагов.
Бактериофаги являются важнейшим компонентом нашей продукции и помогают при профилактике бактериальных заболеваний и борьбе с ними. Название звучит непривычно и немного непонятно. На самом деле, с бактериофагами люди знакомы уже более ста лет.
Они являются самым распространенным биологическим объектом на Земле.
Второе открытие было сделано во время исследования вспышки дизентерии среди французских солдат во время Первой мировой войны. При изучении лизиса (разрушения клетки под действием собственных или чужеродных ферментов) бактериальных культур.
Ученый обратил внимание, что какое-то существо, невидимое в обычный микроскоп, разрушает выращенные им культуры бактерий. Микробиологу удалось настроить его размножение: бактерии, зараженные им, погибали, а количество агента увеличивалось.
В 1919 году ученый успешно вылечил бактериофагами первых пациентов. Он описал случай успешного лечения дизентерии с использованием фагов, доказав, что они обеспечивают выздоровление больного организма. Были проведены и первые опыты по применению фагов при раневых инфекциях, холере, тифе и даже бубонной чуме. Успех выглядел вполне убедительно.
Хотя в государствах Восточной Европы, таких как СССР, применение бактериофагов в терапии продолжилось, чему способствовало основание в 1934 году Института Бактериофага в Тбилиси Георгием Элиавой совместно с Феликсом Д'Эреллем.
В мире интерес к фаговой терапии возобновился только в 1980-е годы, когда эффективность лечения антибиотиками значительно снизилась, а бактерии стали более устойчивы к лекарствам. Сейчас исследования в этой области активно ведутся по всему миру.
30 до 10 32 фаговых частиц в биосфере, — и играют ключевую роль в поддержании баланса всех исследованных экосистем. Бактериофаги являются естественными регуляторами и борцами с бактериями и обеспечивают динамическое равновесие в природе, сохраняя относительное постоянство микробного пейзажа в природе и ограничивая рост популяции бактерий. Бактериофаги присутствуют даже в нашей пище — ежедневное поедание бактериофагов с пищей, в которой они присутствуют естественным образом, регулирует микробный баланс в организме человека.
Знаменитый ученый Д, Эрелль представил миру бактериофаги как естественные антибактериальные агенты и предложил использовать их для терапии — еще до открытия антибиотиков.
Бактериофаги в препаратах
Возможность исследования фагов в качестве антимикробных агентов в клинике привлекает внимание мирового врачебного и научного сообщества. Быстрое распространение мультирезистентных к антибиотикам штаммов мутантов вредоносных бактерий разожгло интерес научного сообщества к этому методу с почти 100-летней историей.
Современные биотехнологии позволяют использовать бактериофаговую терапию против большинства бактериальных инфекций. На сегодняшний день созданы лекарственные препараты на основе бактериофагов. История массового применения этих препаратов уходит корнями в трагические времена Великой Отечественной Войны (в 1940 году был создан коктейль из нескольких видов бактериофагов, борющихся с бактериями, вызывающими тяжелые раневые инфекции).
Эти препараты спасли жизни тысячам раненных солдат. Подобный опыт позволил сохранить и развить биофармацевтическое производство бактериофагов в России — сегодня наша страна мировой лидер в производстве этих лекарственных антибактериальных препаратов.
Наука и бактериофаги
В 50-90-е годы их использовали просто как очень удобный объект для исследований: многие фундаментальные открытия в молекулярной биологии, такие как генетический код, рекомбинация, репликация нуклеиновой кислоты, были сделаны на примере бактериофагов, потому что их легко культивировать и они продуцируют большое количество нуклеиновой кислоты.
Бактериофаги и фармацевтическая промышленность Запада
В тридцатых годах прошлого века крупный американский концерн основал даже клинику, где начали лечить фагами. Пропагандисты нового метода сулили исцеление от всех болезней. Однако действительность оставляла желать лучшего: научные основы такой терапии были ещё так скудны, что новое средство применяли практически вслепую. Считалось, что все фаги одинаковы и побеждают любую бактерию. Одним и тем же бактериофагом начинали лечить разные заболевания, а болезнь всё не уходила — так метод был серьёзно скомпрометирован. Мнение о малой эффективности фагов задержалось в кругах медиков на многие годы, живёт оно ещё и сегодня.
Недавно появились публикации исследователей из Рокфеллеровского университета в Нью-Йорке об успехах терапии с помощью фагов.
Кому подходят препараты бактериофагов
Препараты бактериофагов подходят для людей различных возрастных категорий, нуждающихся в профилактике и лечении бактериальных инфекций. Бактериофаги показаны даже беременным, кормящим матерям и детям с 0 лет. Ведь применение бактериофагов абсолютно физиологично.
Какие проблемы решают препараты бактериофагов
Эффективная борьба с бактериальными инфекциями
Усиление действия антибиотиков
Уничтожают только вредоносные бактерии
Эффективная замена антибиотикам
Минимум противопоказаний
Бактериофаги могут применяться как внутрь, так и использоваться для наружного применения
Что такое бактериофаги?
Из чего состоит бактериофаг
Преимущества бактериофагов
Бактериофаги – антибактериальные агенты и природные антисептики
Безопасны и не токсичны, побочные эффекты редки, применяются у новорождённых детей, беременных и кормящих женщин
Действие бактериофагов не затрагивает полезную микрофлору организма, в отличие от антибиотиков
Бактериофаги совместимы со всеми лекарственными препаратами. Применение бактериофагов не ограничивает использование других лекарств и не влияет на их эффективность
Воздействует лишь на чувствительные к ним болезнетворные бактерии, вызывающие инфекционное заболевание, разрушая их изнутри
Бактериофаги выводятся из организма естественным путем
Применение бактериофагов
Сразу после открытия бактериофагов, препараты на их основе стали использовать для борьбы с инфекционными болезнями человека. Однако в результате изобретения антибиотиков и недостатка знаний о бактериофагах их лечебный потенциал не был реализован.
Фаги нашли применение в разных сферах человеческой деятельности, включая био- и нанотехнологии. Например, как простые системы для наработки белков с заданными свойствами или как основа для создания материалов с заданной архитектурой в каталитической химии.
Но все-таки медицина, как и столетие назад, остается главной областью применения этих врагов бактерий. С ростом лекарственной устойчивости бактерий к химическим антибиотикам возросло значение фаготерапии для профилактики и лечения инфекционных болезней человека.
Бактериофаги — современные антимикробные препараты природного происхождения. Это микроорганизмы, способные точечно уничтожать только болезнетворные бактерии. Бактериофаги используются в профилактике и антибактериальной терапии заболеваний, возбудителями которых являются патогенные бактерии.

- Присутствуют повсюду в нашем мире — в океане, почве, глубоководных источниках, питьевой воде и пище.
- Самая распространённая форма жизни на Земле; в биосфере содержится от 10 30 до 10 32 фаговых частиц.
- Старейшие из известных микроорганизмов — их возраст оценивают примерно в 3 миллиарда лет.
- Играют ключевую роль в поддержании баланса всех исследованных человеком экосистем.
- Контролируют количество микробной флоры и сдерживают её патологический рост.

- История применения бактериофагов насчитывает более 100 лет. Мировое врачебное и научное сообщество активно исследует фаги в качестве антимикробных агентов.
- Биотехнологи научились создавать медицинские антибактериальные препараты на основе бактериофагов и применять их для лечения пациентов.
- Современная медицина позволяет использовать бактериофаговую терапию против большинства бактериальных инфекций.
12345678
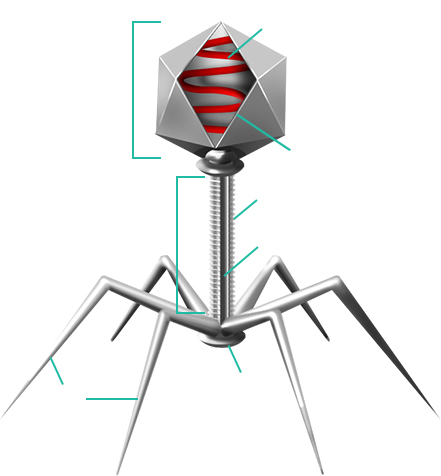
Бактериофаги имеют кубическую, нитевидную или форму головастика. Головка бактериофага содержит нуклеиновую кислоту (ДНК или РНК) , заключённую в белковую оболочку .
Ниже расположен хвостовой отросток , состоящий из внутреннего стержня и сократительного чехла .
Передвигается бактериофаг с помощью ножек-фибрилл , скреплённых в центре базальной пластиной . Размер бактериофага в сотни и тысячи раз меньше микробных клеток.
Факты о бактериофагах
Безопасны и нетоксичны, побочные эффекты редки, применяются у новорождённых детей, беременных и кормящих женщин
Бактериофаги совместимы со всеми лекарственными препаратами. Применение бактериофагов не ограничивает использование других лекарств и не влияет на их эффективность
Воздействует лишь на чувствительные к ним болезнетворные бактерии, вызывающие инфекционное заболевание, разрушая их изнутри
Как работают бактериофаги
Бактериофаги (от лат. phagos - пожирающий бактерии) — особые вирусы, которые способны размножаться только в присутствии определенного вида болезнетворных бактерий. Бактериофаги воспроизводят себе подобных только за счёт бактерий. Но человеку эта особенность только на руку: бактериофаг питается клетками вредных бактерий и полностью разрушает их.










Что лечат бактериофагами
Препараты бактериофагами применяются для лечения и профилактики инфекционных заболеваний в следующих областях: гастроэнтерология, урология, гинекология, хирургия, оториноларингология, пульмонология, инфекционные заболевания желудочно-кишечного тракта (ЖКТ), гнойно-воспалительные заболевания кожи и слизистых.
Абсцесс, панариций, парапроктит, остеомиелит, мастит, перитонит, фурункулы, ожоги, гнойные раны, профилактика внутрибольничных инфекций
ПРОИЗВОДСТВО БАКТЕРИОФАГОВ

На предприятии разрабатываются первый в мире мире универсальный бактериофаг против бактерий рода энтеробактер. Ведутся работы по созданию новых фаговых коктейлей, включая препарат, который действует на синегнойную палочку и бактерии рода ацинетобактер баумани.
Регистрационные удостоверения
Лекарственные препараты бактериофаги сертифицированы в соответствии с государственными стандартами Российской Федерации.

В последнее время бактериофаги привлекают все больше внимания как альтернативный антибиотикам способ лечения. РБК Тренды попросили эксперта рассказать о них все, что известно науке на сегодняшний день
В этой статье о бактериофагах:
Об эксперте: Константин Мирошников, доктор химических наук, главный научный сотрудник лаборатории молекулярной биоинженерии ИБХ РАН.
Что такое бактериофаги
Бактериофаги — это вирусы бактерий. У всех организмов на Земле есть крошечные, невидимые в оптический микроскоп паразиты — вирусы. Есть они и у одноклеточных.
Цикл размножения бактериальных вирусов обычно заканчивается гибелью микроба. Однако существуют разновидности бактериофагов, которые не уничтожают клетку хозяина напрямую, а, как вирусы более совершенных организмов, оставляют ее истощенной, но жизнеспособной.
Бактерии доминируют в биосфере Земли, составляя более 90% ее биомассы. У каждого вида бактерий имеется множество специализированных типов вирусов. Бактериофаги — это самые многочисленные существа в биосфере. Их изучают уже более ста лет.
Кто открыл бактериофаги
В последней четверти XIX века благодаря микробной теории инфекционных заболеваний Пастера и Коха ускорился прогресс в области экспериментальной микробиологии. В частности, ученые научились культивировать микроорганизмы. Исследователи регулярно наблюдали необычный эффект: растущая культура бактерий внезапно самоуничтожалась по не известным тогда причинам. Существование мельчайшего инфекционного агента, способного проходить через самые тонкие фильтры и вызывать гибель бактерий, выявили в конце 1890-х.
Однако природа этого агента оставалась непонятной. В то же время исследователи активно изучали вирусы. Сопоставить эти две линии экспериментальных находок и обосновать это в дискуссии с научными оппонентами удалось в 1917 году франко-канадскому естествоиспытателю Феликсу Д’ Эрелю.
Главной проблемой ранних работ в области биологии бактериофагов была ограниченность доступных в то время экспериментальных методов. Исследователям приходилось работать с невидимым организмом, многие свойства которого было невозможно интерпретировать. Как выглядит бактериофаг, удалось узнать только в 1940-х годах с появлением электронной микроскопии.

Как работают бактериофаги
Инфекционный цикл бактериофагов проходит по тем же основным этапам, что и у других вирусов. Бактериофаг должен присоединиться к бактериальной клетке и доставить свой генетический материал внутрь нее. Дальнейшие этапы развития инфекции переключают механизмы жизнедеятельности бактерии на обслуживание бактериофага, размножение его генома, построение копий вирусных оболочек, упаковку в них нуклеиновой кислоты вируса и, наконец, разрушение зараженной клетки. У каждого из этих этапов существуют множество нюансов, имеющих глубокий эволюционный и экологический смысл.
Роль бактериофагов в биосфере — регуляция численности и разнообразия одноклеточных микроорганизмов. Бактерии и их вирусные паразиты сосуществуют миллиарды лет. И эта борьба за выживание не закончилась ни тотальным уничтожением одноклеточных, ни приобретением тотальной устойчивости к фагам и бесконтрольным размножением бактерий.
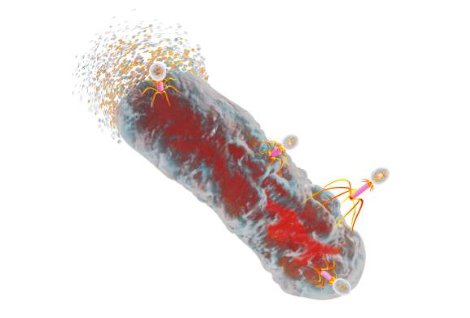
Самые распространенные бактериофаги
На что способны бактериофаги
Во время раннего периода изучения бактериофагов, в 1920–1930-х годах, единственным достоверно понятным их свойством была способность уничтожать бактерии, в том числе и болезнетворные. Этим свойством незамедлительно заинтересовались исследователи в области медицины. Первые попытки лечения фагами дизентерии, раневых инфекций, холеры и тифа были проведены пусть не по современным стандартам, но достаточно аккуратно. Успех выглядел вполне убедительно. Перспективными были попытки бороться с их помощью с бактериальными болезнями животных и растений.
Однако после начала массового выпуска и использования фаговых препаратов эйфория сменилась разочарованием. На тот момент было известно очень мало о том, что такое бактериофаги, как их производить, очищать и применять их лекарственные формы.
В 1940-х годах более перспективным оказался подход применения в медицине низкомолекулярных веществ, убивающих микроорганизмы, — антибиотиков. Эти вещества были проще в производстве, хранении, а главное — быстро и качественно уничтожали всех микробов в человеческом организме.
Расшифровка геномов организмов тоже началась с небольших геномов фагов. С развитием экспериментальной геномики ученые все больше узнавали о колоссальной роли бактериофагов в экологии и эволюции биосферы. Выполненные в начале 2000-х исследования метагеномов — полного генетического материала биологических сообществ — пролили свет на колоссальное разнообразие бактериофагов в природе. Так, например, была открыта система CRISPR-Cas.
Какой потенциал у изучения бактериофагов
Потенциал детальных исследований бактериофагов еще очень велик как в фундаментальном, так и в прикладном контексте.
Возобновляется интерес к бактериофагам как к терапевтическим средствам. В последние десятилетия использование антибиотиков вызывает все больше вопросов. Возникает проблема поиска дополнительных и альтернативных средств борьбы с болезнетворными бактериями. В отличие от ситуации столетней давности, о бактериофагах известно достаточно, чтобы обоснованно выбирать те, которые подходят для терапевтических целей. Изучены многие аспекты поведения фагов в организме человека и их взаимодействия с иммунной системой.
Для разработки и производства эффективного препарата необходимо точно подобрать бактериофаги с полностью расшифрованными геномами, культивировать их по современным биотехнологическим стандартам на определенных штаммах бактерий в химически чистых средах и провести очистку высокой степени. Однако это все равно дешевле, чем создание современных сложных антибиотиков. Кроме того, использование бактериофагов и антибиотиков в медицинских целях не противоречит друг другу. При совместном их применении наблюдается синергизм — взаимное усиление антибактериального эффекта. Это позволяет, например, снизить дозы антибиотиков до значений, не вызывающих выраженных побочных эффектов. Опубликован ряд работ, которые детально описывают успешные случаи излечения с помощью бактериофагов инфекций, устойчивых к антибиотикам.
За что критикуют исследование бактериофагов в научном сообществе
Разумеется, бактериофаги не всесильны. Есть ряд фундаментальных ограничений их использования. Прежде всего — очень высокая специфичность действия. С одной стороны, это достоинство, так как антибактериальный эффект препаратов не затрагивает нормальную микрофлору человеческого организма. Но, с другой, применение бактериофагов требует высокоточной диагностики целевого патогена — возбудителя заболевания. В идеале подбор фагов-компонентов лекарственного препарата можно было бы делать индивидуально для каждого конкретного пациента. Но несмотря на то, что о персонифицированной медицине много говорится, эта концепция слишком сложна и дорога на практике.
Но по существующим правилам при каждом изменении компонентов необходимо заново проводить сертификационные действия. Требуется разработка принципиально новых стандартов тестирования и регистрации лекарственных препаратов на основе бактериофагов. Это признается специалистами здравоохранения, но нигде в мире пока не реализовано.
Читайте также:

