Какая вакцина от гриппа лучше гриппол плюс или гриппол плюс
Обновлено: 19.04.2024
Гриппол® Плюс – тривалентная гриппозная адъювантная вакцина, в которой снижено содержание антигенов: она содержит 5 мкг антигенов вируса каждого штамма и адъювант Полиоксидоний. Благодаря этому иммунная система организма испытывает меньшую антигенную нагрузку, что вызывает меньше общих или местных реакций и осложнений после введения вакцины. Более 12 лет применения вакцины Гриппол® плюс подтвердили ее эффективность при максимальной безопасности.
Вакцинация от гриппа: здоровье привитых под иммунным зонтиком
Эффективность и безопасность применения вакцины Гриппол® плюс исследуется на протяжении всего времени ее применения. Так, за 10 лет (2009 – 2019 гг.) было установлено, что после прививки детей, взрослых, беременных, людей с хроническими заболеваниями (бронхиальная астма, сахарный диабет и другие) не было случаев серьезных осложнений или выраженных поствакцинальных реакций. Вакцина хорошо переносилась даже теми, кто входит в группу риска по развитию неблагоприятных последствий прививки.
Клинические, эпидемиологические и пост-регистрационные исследования Гриппол® плюс на территории Российской Федерации и стран СНГ с участием 12 579 детей и 9 349 взрослых продемонстрировали, что вакцина относится к слабо реактогенным препаратам, а по иммуногенности соответствует всем критериям эффективности гриппозных вакцин. Согласно требованиям, изложенным в руководствах по гармонизации требований к противогриппозным вакцинам Европейского комитета по патентованным лекарственным препаратам (СPMP/BWP/214/96) и EMA/CHMP/VWP/457259/2014, вакцина Гриппол® плюс соответствует международным требованиям к противогриппозным вакцинам.
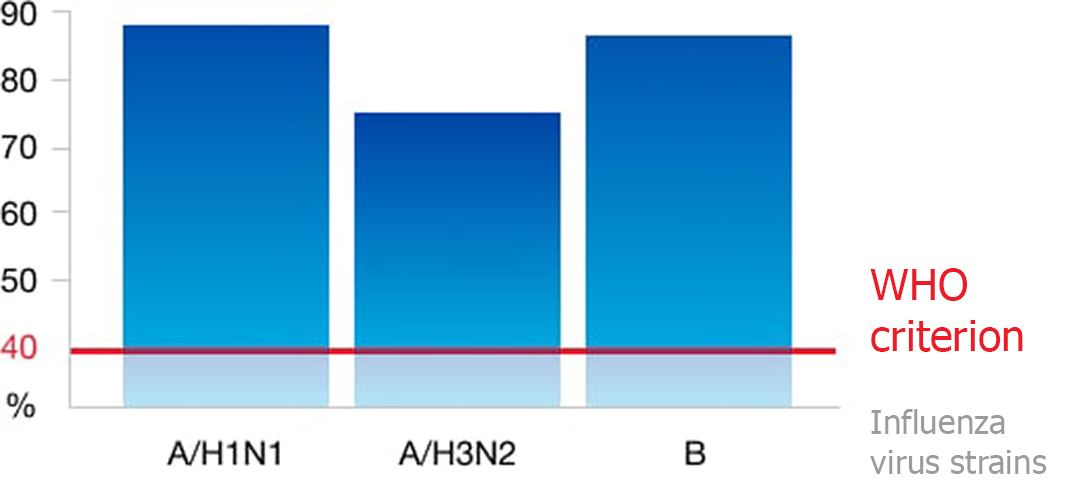
Иммуногенность вакцины Гриппол® плюс соответствует требованиям ВОЗ
Уровень серопротекции, %
Кратность нарастания титров антител

Уровень сероконверсии, %
- Гриппол ® плюс обеспечивает эффективную защиту ко всем трём антигенам актуальных штаммов вируса гриппа у 95-100% вакцинируемых
- Более чем у 70% вакцинированных отмечено четырёхкратное увеличение титра антител
- После вакцинации титр защитных антител увеличивается в 4 и более раз
Таблица 1. Клинические исследования вакцины Гриппол® плюс.
Иммуногенность вакцин, содержащих по 5 и по 10 мкг гемагглютинина каждого штамма
Гриппол плюс (по 5 мкг на штамм)
Гриппол плюс (по 10 мкг на штамм
Слабые нормальные общие вакцинальные реакции отмечены у 6.9% вакцинированных (недомогание, субфебрильная температура). Ни у одного привитого не отмечено сильных общих вакцинальных реакций или поствакцинальных осложнений. Местные реакции (болезненность в месте введения в течение 30-60 минут) отмечены у 14.8% привитых.
Гриппол: 98%, 85%, 70%, соответственно
Гриппол плюс по 5 мкг: 95%, 84%, 76%, соответственно
Гриппол плюс по 10 мкг: 94%, 90%, 88%
Доля лиц с 4-х-кратным приростом:
Гриппол: 97.5%, 78%, 63%
Гриппол плюс по 5 мкг:
Гриппол плюс по 10 мкг: 95.5%, 88; 90.1% для штаммов A/H1N1; A/H3N2 и В, соответственно.
Варьировала в диапазоне от 6.7 до 31.6.
Выбрана доза по 5 мкг на каждый штамм
Рандомизированное двойное слепое контролируемое, сравнительное в параллельных группах 2 .
1 - Гриппол® плюс
2 - Вакцина сравнения
Частота общих и местных реакций – 5,6%
Местных реакций не отмечено.
Число общих реакций: головная боль -1, недомогание – 2, боль в животе – 1
Доля лиц с 4-кратным приростом к штаммам A/H1N1; A/H3N2 и В титров:
96%, 87% и 100%, соответственно у исходно серонегативных и
100%, 71.4% и 40%, соответственно у исходно серопозитивных.
Кратность нарастания титров
19.9, 18.3, 6.0, соответственно у исходно серонегативных и 5.3, 6.5, 2.8 у исходно серопозитивных.
Доля лиц с защитным титром
к штаммам A/H1N1; A/H3N2 и В:
к штаммам A/H1N1; A/H3N2 и В:
Рандомизированное двойное слепое контролируемое, сравнительное в параллельных группах 3
Дети 6 – 35 месяцев, n=140
Сравнение безопасности и иммуногенности при использовании двух режимов вакцинации:
Группа 1 - двукратно дозой 0,5 мл с интервалом 21-28 недель
Группа 2 - двукратно дозой 0,25 мл с интервалом 21-28 недель
Ни один из режимов не влиял на клинические параметры крови
Местные реакции (боль, покраснение, припухлость) после первой и второй вакцинации варьируется в диапазоне: 3.1% – 7.4%
Общие реакции (головная боль, недомогание, нарушение аппетита, нарушение сна, потливость, насморк, кашель) варьируется в диапазоне 1.5% - 14.5%. Все они были кратковременными, не требовали медикаментозной коррекции.
Пожилые люди от 60 лет и старше 4 ,
Иммуногенность спустя 1 месяц и 6 мес
Общие реакции отмечали у 22% вакцинированных. Наиболее частая – головная боль (14%-16%), боль в суставах (2.5%–3.4%), субфебрильная температура (до 37.5) – 2.5%. Все реакции были кратковременными и проходили самостоятельно.
Спустя месяц после вакцинации:
Доля лиц с защитным титром: 67.4% - 80.0%
Доля лиц с 4-кратным приростом: 39.0% - 68.9%
Кратность прироста титров антител: 2.6 (для гриппа В) – 6.5 (для гриппа А)
Спустя 6 месяцев после вакцинации:
Доля лиц с защитным титром: 53.80% - 64.4%
Доля лиц с 4-кратным приростом: 21.7% - 55.1%
Кратность нарастания по сравнению с исходным уровнем: 1.8 (для гриппа В) -4.3 (для гриппаА)
Снижение заболеваемости ОРВИ и частоты эпизодов обострения основного хронического заболевания в группе привитых.
Рандомизированное открытое контролируемое, с ослеплением по конечным точкам в параллельных группах 5
Дети 3-17 лет с аллергическими заболеваниями, n=160:
106 с аллергическими заболеваниями (пищевая аллергия, БА, поллиноз),
54 - здоровых ребенка
Обе вакцины показали благоприятный профиль безопасности в отношении общих и местных реакций. Достоверных различий в безопасности и переносимости двух вакцин не выявлено.
Спустя 1 месяц кратность прироста в штаммам A/H1N1, A/H3N2 и в составили соответственно:
Доля лиц с 4-кратным приростом среди исходно серонегативных составила 45.5%-52.9% в группе вакцинированных Грипполом® плюс и 50.0%-63.6% в группе вакцинированных Инфлюваком.
Доля лиц с защитным титром составила 69.2%-80.8% в группе Гриппол плюс и 64.7%-94.1% в группе Инфлювак.
Достоверных различий в иммуногенности вакцин не выявлено
С момента регистрации вакцины и выхода на рынок также был проведен ряд пострегистрационных исследований. Все исследования можно разделить на 4 группы:
1) когортные эпидемиологические исследования (оценка профилактической эффективности вакцинации как мероприятия при иммунизации организованных коллективов);
2) оценка безопасности, профилактической и клинической эффективности и у разных контингентов, относящихся к группам риска по гриппу (беременные, пациенты с различными хроническими заболеваниями, пожилые люди);
3) сравнительные исследования безопасности и/или иммуногенности вакцины Гриппол® плюс с другими гриппозными вакцинами; оценка безопасности вакцины при сочетанном применении с другими вакцинами;
Таблица 2. Результаты эпидемиологических пост-регистрационных когортных исследований вакцины Гриппол® плюс
2. Ни у одного привитого не отмечено выраженных общих или местных поствакцинальных реакций и осложнений
3. Вакцинация препаратом Гриппол® плюс способствовала уменьшению количества осложнений у заболевших: в группе непривитых гриппи ОРЗ протекали с осложнениями в 2,5 раза чаще, чем у привитых
2. В школах с охватом прививок ≥ 60% учащихся общая заболеваемость ОРВИ (случаи на 1000 человек) была на 40% ниже, чем в школах с охватом прививок £ 60%
4. Эффективность вакцины в отношении гриппа составила 66,2%
5. У вакцинированных детей достоверно меньшее число случаев повторного заболевания и количество осложнений (гайморит, бронхит, пневмония) по сравнению с непривитыми.
Взрослые с 18 лет и старше,
6. Эффективность вакцины в отношении гриппа у взрослых составила 50,3%
7. При общем низком уровне заболеваемости во всех 3 городах, риск заболевания (ОР) вакцинированных был достоверно ниже (p < 0,05), чем непривитых: ОР [95% CI]: Гродно: 0,63 [0,53 – 0,75]; Витебск: 0,26 [0,15 – 0,43]; Минск: 0,72 [0,60 – 0,86];
Более 10 пост-регистрационных исследований, проведенных за период с 2009 по 2019 гг., посвящены оценке безопасности, иммуногенности, профилактической и клинической эффективности вакцины Гриппол® плюс в разных группах риска, таких как:
- беременные 9, 10, 11 и новорожденные от вакцинированных беременных 12, 13 ;
- пожилые люди в возрасте 60 лет и старше с болезнями системы кровообращения 14, 15 ;
- дети и взрослые с бронхиальной астмой и другими хроническими обструктивными заболеваниями дыхательных путей 16, 17, 18 ;
Все перечисленные популяции относятся к группам риска по гриппу и подлежат вакцинации в рамках Российской национальной программы иммунизации. В связи с этим опыт применения и оценка безопасности и профилактической эффективности вакцины представляются для таких контингентов особенно актуальными.
У пациентов с хроническими заболеваниями (ХОБЛ, БСК), вакцинированных против гриппа, отмечено снижение среди привитых заболеваемости ОРВИ и уменьшение числа эпизодов обострения базового заболевания по сравнению с непривитыми, в течение эпидемического сезона. При оценке иммунологической эффективности вакцины у взрослых пациентов с хроническими обструктивными заболеваниями легких доля сероконверсий спустя 6 месяцев составила 44%-75% у исходно серонегативных пациентов и 25%-50% у исходно серопозитивных пациентов; средний геометрический титр антител (СГТА) спустя 6 месяцев после вакцинации составил 70-135, сохраняясь выше защитного к году после вакцинации (55-211) 17 .
Оценка иммуногенности вакцины Гриппол® плюс у беременных, иммунизированных во 2-м и 3-м триместрах беременности, показала, что спустя месяц после вакцинации уровень сероконверсий составил от 65.2% до 74.1%; уровень серопротекций варьировал в диапазоне от 77% до 91.3% спустя месяц после вакцинации и в диапазоне от 62% до 81.5% спустя 3 месяца после вакцинации 11 .
Ни в одном исследовании вакцины Гриппол плюс среди групп риска не отмечено серьезных пост-вакцинальных явлений, неожиданных реакций, осложнений на прививку. Все исследователи отмечают хорошую переносимость вакцины, отсутствие негативного эффекта на общее состояние вакцинированных, на течение базового заболевания.
Исследования, посвященные сравнительной оценке безопасности, иммуногенности и клинической эффективности вакцины Гриппол® плюс с другими вакцинами, а также безопасности и эффективности при сочетанном применении включали здоровых взрослых, детей с аллергическими заболеваниями, сахарным диабетом, различными патологиями 20, 21, 22, 23, 24, 25, 26 .
Таблица 3. Сравнение эффективности вакцин Гриппол Плюс, Инфлювак и Ваксигрип на 28 день после вакцинации.
* - для каждого штамма по крайней мере один показатель должен отвечать указанным требованиям.
Особенность вакцинации против гриппа заключается в том, что это единственная прививка, которая проводится ежегодно. Для гриппозных вакцин, содержащих адъювант, важным фактором является вопрос иммунологической безопасности и понимания механизмов действия. Для вакцины Гриппол® плюс проведены исследования по оценке влияния на клеточный иммунитет. Сравнительная оценка влияния противогриппозных вакцин разного типа (субъединичной, сплит вакцины, адъювантной субъединичной) на субпопуляционный состав лимфоцитов человека в условиях in vitro показала, что вакцина Гриппол Плюс имела высоко выраженное воздействие на эффекторы клеточного и гуморального иммунного ответа. Так, количество NK- и NKT-клеток в культуре под воздействием вакцины Гриппол плюс увеличивалось в сравнении с контролем в 3,3 и 2,1 раза соответственно, под воздействием Инфлювак - в 2,8 и 2 раза, Ваксигрипа - в 3 и 2,26 раза. Гриппол плюс и Инфлювак вызывали достоверное и сопоставимое повышение числа B-лимфоцитов – в 1.5 и 2.5 раза соответственно 28 .
Таким образом, накоплена достаточно обширная доказательная база, позволяющая говорить о том, что адъювантная вакцина Гриппол® плюс со сниженным содержанием антигенов является безопасной и эффективной препаратом и при массовом применении обладает профилактической эффективностью.
Этот сайт предназначен для специалистов здравоохранения. Продолжая пользоваться нашим сайтом, Вы даете согласие на обработку ваших cookie файлов. Мы используем cookie-файлы для получения статистики о посетителях сайта. Вы можете отключить cookie-файлы в настройках браузера.
ВНИМАНИЕ!
Информация, размещенная на этом сайте, предназначена для специалистов в области медицины и/или фармацевтики. Пожалуйста, подтвердите, что вы являетесь специалистом в данных областях.
Гриппол®: начало пути

Гриппол® плюс: защита от трех штаммов гриппа
С 2008 года используется вакцина Гриппол® плюс. Она также относится к субъединичным адъювантным, но при этом имеет существенные отличия от первой вакцины.
- В составе Гриппол® плюс — по 5 мкг трех антигенов вирусов гриппа: два типа А (H1N1 и H3N2) и один типа В линии Ямагата или Виктория, произведенные нидерландской компанией Эбботт Биолоджикалс. В качестве адъюванта — Полиоксидоний, 500 мкг на одну дозу.
- Не содержит никаких консервантов и добавок, поскольку выпускается на современной производственной линии, которая обеспечивает абсолютную стерильность и исключает попадание компонентов любого рода, в том числе микробов. Этот факт особенно важен при вакцинации маленьких детей, беременных и лиц с хроническими заболеваниями.
- Выпускается в двух формах: индивидуальном шприц-дозе и в ампулах по 5 доз.
Эта вакцина предназначена для прививок у взрослых и у детей, начиная с 6-месячного возраста, и может использоваться для ежегодной прививки от гриппа, как рекомендовано Национальным календарем прививок.

Гриппол® Квадривалент: защита от четырех штаммов
Адъювант Полиоксидоний из расчета 500 мкг на дозу вакцины позволил снизить содержание антигенов и уменьшить вероятность развития реакций в ответ на прививку.
В этой вакцине нет консервантов и антибиотиков, она, как и Гриппол® Плюс, выпускается на технологическом оборудовании, отвечающем международными требованиями GMP: попадание любых сторонних частиц и микробов исключено.
Гриппол® Квадривалент используется для вакцинации взрослых в возрасте от 18 до 60 лет, и обладает высокой эффективностью и безопасностью. В 2018 году завершены клинические исследования среди детей в возрасте от 6 до 17 лет и ожидается, что в сезоне 2019-2020 гг. вакцину Гриппол® Квадривалент можно будет применять для вакцинации детей обозначенного возраста.

Индивидуальный шприц с иглой со специальным покрытием уменьшает болезненность при введении, что особенно важно при вакцинации маленьких детей, и исключает неправильную дозировку.
Отличия вакцин Гриппол® приведены в таблице ниже.
| Гриппол® | Гриппол® плюс | Гриппол® Квадривалент | |
|---|---|---|---|
| Год выпуска | 1996, в настоящее время не выпускается | 2008 | 2018 |
| Производитель | НПО Микроген, Россия, по лицензии НПО Петровакс Фарм | НПО Петровакс Фарм | НПО Петровакс Фарм |
| Группировочное наименование | Вакцина для профилактики гриппа (инактивированная) + Азоксимера бромид | ||
| Технология производства | Субъединичная адъювантная | ||
| Возраст применения | С 6 месяцев без ограничения возраста | с 18 - 60 лет | |
| Количество антигенов на каждый штамм вируса гриппа, мкг | 5 мкг А (H1N1)+5 мкг A(H3N2)+11 мкг (В/Виктория или Ямагата) | 5 мкг А (H1N1)+5 мкг A(H3N2)+5 мкг (В/Виктория или Ямагата) | 5 мкг А (H1N1)+5 мкг A(H3N2)+5 мкг (В/Виктория)+5 мкг (В/Ямагата) |
| Общее количество антигенов на дозу вакцины, мкг | 21 | 15 | 20 |
| Число штаммов в вакцине | 3 | 3 | 4 |
| Адъювант | Полиоксидоний® 500 мкг (МНН: Азоксимера бромид) на одну дозу вакцины | ||
| Наличие консерванта (тиомерсал) | да | нет | нет |
| Производство GMP | нет | да | да |
| Форма выпуска | Ампулы №10 | Шприц-доза №1, ампулы №5 | Шприц-доза №1 |
Этот сайт предназначен для специалистов здравоохранения. Продолжая пользоваться нашим сайтом, Вы даете согласие на обработку ваших cookie файлов. Мы используем cookie-файлы для получения статистики о посетителях сайта. Вы можете отключить cookie-файлы в настройках браузера.
ВНИМАНИЕ!
Информация, размещенная на этом сайте, предназначена для специалистов в области медицины и/или фармацевтики. Пожалуйста, подтвердите, что вы являетесь специалистом в данных областях.

В состав вакцины Гриппол плюс входят очищенные антигены актуальных штаммов вируса гриппа, рекомендованные ВОЗ для текущего эпидемического сезона. Одна доза Гриппол® плюс содержит по 5 мкг гемагглютинина каждого из актуальных штаммов вируса гриппа подтипов А (H1N1 и H3N2) и В, а также 500 мкг адъюванта Полиоксидоний.
Адъювант в составе Гриппол® плюс повышает эффективность и безопасность вакцинации

Адъювант - субстанция, используемая в комбинации со специфическим антигеном, обеспечивающая более выраженный иммунный ответ, чем сам антиген.
Полиоксидоний в вакцине работает в нескольких направлениях: 1

Позволяет снизить количество антигенов, обеспечивая выраженный и длительный иммунный ответ на вакцинацию



Вакцина Гриппол® плюс: показания к применению
- Детям с 6 месячного возраста
- Беременным женщинам по решению врача (наиболее безопасная вакцинации во втором и третьем триместрах)
- Вакцина также показана
- Подросткам
- Взрослым без ограничения возраста
- Лицам с высоким риском осложнений в случаи заболевания гриппом
- Лицам, по роду профессии имеющим высокий риск заболевания гриппом или заражения им других лиц
- Беременность и кормление грудью не являются противопоказанием
Преимущества применения вакцины Гриппол плюс:
Вакцина Гриппол® плюс предназначена для профилактики гриппа у детей старше 6 месяцев, беременных, пожилых, взрослых с хроническими болезнями, в том числе с аллергией и иммунодефицитами. Проведенные сравнительные испытания Гриппол® плюс в соответствии с мировыми стандартами Good Clinical Practice доказали, что вакцина обладает высокой эффективностью, не уступающей лучшим зарубежным аналогам и высоким профилем безопасности
Введение в состав вакцины адъюванта Полиоксидоний позволяет снизить количество антигенов с сохранением высокой иммуногенности.
Гриппол плюс выпускается в соответствии с международными стандартами производства GMP, доступна по цене в сравнении с зарубежными вакцинами. Может применяться при сочетанной иммунизации с вакцинами Национального календаря прививок (за исключением БЦЖ, БЦЖ-М)

Обзор
Автор
Редакторы



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Мутации и вариации
Известно три разновидности вируса гриппа, опасных для человека:
- тип А (Alphainfluenzavirus) — наиболее подвержен мутациям и является постоянной головной болью Всемирной организации здравоохранения (ВОЗ);
- тип В (Betainfluenzavirus) — более стабилен, но все же может видоизменяться;
- тип С (Gammainfluenzavirus) — наиболее стабилен, поэтому к нему вырабатывается длительный иммунитет. Эпидемичных вспышек не дает, чаще всего приводит к нетяжелому заболеванию у детей.
Если бы все типы вируса гриппа были похожи на тип С, больших проблем с ними не было. Однако тип А постоянно мутирует, поэтому довольно часто появляются его новые вариации (штаммы), с которыми наша иммунная система еще не знакома [2]. Из-за этой изменчивости классификация вирусов гриппа достаточно сложная: внутри каждого типа существуют подтипы (в случае с типом В — линии), в которые объединяют штаммы вируса. Причем, штаммы подтипов могут быть как родственными (то есть эволюционно недалеко ушедшими друг от друга), так и непохожими.
Кому опасен грипп?
Причем в случае с беременными женщинами риск касается не только будущей мамы, но и ее ребенка: грипп во время беременности более чем в 7 раз повышает риск госпитализации, а также может привести к преждевременным родам (около 30% случаев), мертворождению и малому весу при рождении [2], [6]. Поэтому во многих странах мира (США, Великобритания, Австралия, Италия) беременным рекомендована вакцинация против гриппа. Делают это по двум причинам:

Рисунок 1. Строение вируса гриппа (типы А и В)
Когда лучше сделать прививку?
Вакцинация против гриппа — это ежегодная прививка , которая защищает от трех или четырех наиболее распространенных в данной местности штаммов вируса. Это значит, что каждый год на основании рекомендаций ВОЗ и региональной ситуации национальные комитеты по контролю над гриппом составляют рекомендации антигенного состава будущей вакцины [15], [16]. Однако чаще всего эти рекомендации совпадают с рекомендациями ВОЗ, которые публикуются отдельно для северного и южного полушарий.
Большинству людей прививают одну дозу вакцины, однако детям от шести месяцев до двух лет (и до девяти лет в случае их первой вакцинации [17]) рекомендованы две дозы с минимальным интервалом в один месяц. Исследования показывают, что в этом случае эффективность вакцинации увеличивается [18], [2].
Состав противогриппозных вакцин все время меняется: например, в сезоне 2019–2020 были заменены оба штамма вируса типа А, и в итоге в четырехкомпонентную вакцину вошли:
- A/Brisbane/02/2018 (H1N1);
- A/Kansas/14/2017 (H3N2);
- B/Colorado/06/2017 (линия B/Victoria/2/87);
- B/Phuket/3073/2013 (линия B/Yamagata/16/88).
В трехкомпонентную вакцину, соответственно, рекомендовано включить первые три штамма вируса [16]. Однако бывает и так, что каждый год в составе вакцин повторяется название одного из штаммов. Значит ли это, что постоянно прививают одно и то же? Нет, даже в этом случае штаммы могут существенно различаться, в том числе и по генам, не входящим в классификацию.
Как долго длится иммунитет после вакцинации и имеет ли он пролонгированный эффект на будущий год? К сожалению, эффективность прививок против гриппа недолговечна. Она зависит от времени, прошедшего с момента прививки и штамма вируса: в среднем, считается, что защита снижается примерно на 7% в месяц для H3N2 и штаммов линии В и на 6–11% — для H1N1 [17]. Конечно, скорость и степень снижения могут различаться, но эффективной защиты, скорее всего, хватает на год [11].
Как выбирают штаммы и почему четыре лучше трех?
В течение всего года специалисты NICs анализируют циркулирующие штаммы вирусов на основании лабораторных анализов пациентов с респираторными заболеваниями, выделяют из общей массы пробы с вирусом гриппа и выбирают подходящих кандидатов для дальнейшего изучения в одном из пяти центров ВОЗ (WHO CCs) [19]. Отбор идет по принципу типичности вируса для данного региона и новизне, которую определяют по его реакции с антителами из набора ВОЗ. Дальнейшая работа осуществляется уже в центрах ВОЗ, где штаммы культивируют, анализируют, сравнивают между собой, составляют карты антигенности, строят математические модели и в итоге на основании всех этих данных выбирают претендентов в состав вакцины [19]. Как происходит этот процесс и сколько времени занимает каждая стадия, показано на рисунке 2.

Рисунок 2. Процесс отбора штаммов для противогриппозной вакцины
И наконец, дважды в год проходят Сезонные совещания ВОЗ, посвященные составам противогриппозных вакцин (Seasonal influenza vaccine composition meeting), на которых объявляют рекомендации для будущего сезона: в феврале — для северного полушария, в сентябре — для южного. Как только составы обнародованы, и производители получают вакцинные штаммы, запускается процесс производства, на который уходит около полугода (видео 1). Однако ошибки в планировании могут задержать весь цикл, что скажется на количестве произведенной вакцины или на сроках ее поставки.
Видео 1. Производство противогриппозных вакцин
Почему все-таки четырехкомпонентная вакцина лучше трехкомпонентной, если циркулирующих штаммов гораздо больше? Все дело в линии В, вирусы которой обычно циркулируют вместе, но в разных пропорциях [3], поэтому в случае с вакцинами, состоящими из трех компонентов, штамм линии В всегда является компромиссным вариантом. Экспертам ВОЗ приходится выбирать большее из двух зол, но так как невозможно точно предсказать ситуацию, которая будет наблюдаться через восемь месяцев, периодически случаются ошибки, сказывающиеся на эффективности вакцины. Например, в сезоне 2017–2018 она оказалась ниже ожидаемой, так как ВОЗ прогадала со штаммом вируса типа В, предположив, что доминировать будет линия Victoria, а оказалось — Yamagata [20]. Кроме того, уже не первый год наблюдается низкая эффективность вакцины в отношении штамма H3N2. Точная причина неизвестна, но существует несколько предположений:
- Адаптация штамма во время производства может приводить к некоторым изменениям (антигенному несоответствию), и иммунитет развивается уже к новому штамму, который отличается от циркулирующего.
- Циркулирующие штаммы подтипа H3N2 меняются быстрее, чем другие — им хватает полугода (то есть времени, прошедшего с момента объявления рекомендаций ВОЗ), чтобы измениться и стать менее похожим на вакцинный штамм.
- Стандартной дозы, содержащейся в вакцине, может быть недостаточно для эффективной защиты [18], [21].
Какой должна быть идеальная вакцина?
Вакцины против гриппа бывают живыми (интраназальные вакцины, применяются редко) и инактивированными. Современные инактивированные делятся на нескольких категорий:

Рисунок 3. Виды антигенов инактивированных вакцин. а — Инактивированный вирусный вирион в цельновирионной вакцине. б — Расщепленный инактивированный вирион в сплит-вакцине. в — Частички антигена в субъединичной вакцине.
Все вышеперечисленные вакцины являются вакцинами против сезонного гриппа .
В отдельную группу выделяют препандемические и пандемические вакцины. Их производят в случае возникновения угрозы пандемии. Препандемические (зоонозные) состоят из штамма зарождающегося вируса животного происхождения, который, по мнению экспертов, обладает пандемическим потенциалом, пандемические — из штамма, вызвавшего пандемию (такие вакцины появляются на волне заболеваемости) [15].
Однако выбрать штаммы для состава — лишь полдела. Главное, чтобы вакцина была эффективной. Для этого существуют определенные критерии.
Во-вторых, существуют требования к титрам антител после вакцинации (в том числе и для вакцин с адъювантами), которые указаны в таблице 1.
| Показатель | Люди от 18 до 60 лет | Люди старше 60 лет |
|---|---|---|
| 1. Кратность нарастания среднего геометрического титра антител после вакцинации (GMT increase) | 2,5 раза | 2 раза |
| 2. Уровень сероконверсии * (процент привитых с нарастанием титра антител минимум в четыре раза по сравнению с исходым) | 40% | 30% |
| 3. Уровень серопротекции (число лиц с защитным титром) ** | 70% | 60% |
| * — В тестах, измеряющих ингибирование гемагглютинина (HI), сероконверсия соответствует отрицательной сыворотке до вакцинации (HI < 1:10) и сыворотке крови после вакцинации HI ≥ 1:40. ** — Серопротекция соответствует проценту привитых с сывороткой HI ≥ 1:40. | ||
Для сезонных вакцин необязательно соблюдение всех трех условий; соответствие всем требованиям необходимо только для пандемических [24]. Мало того, сейчас титр HI ≥ 1:40 уже не считается надежным фактором для определения эффективности защиты (50–70% против клинических симптомов гриппа), так как уровни защиты могут варьировать в зависимости от индивидуальных характеристик, групп населения, возрастных групп и даже от типа вакцины [25].
В-третьих, есть отдельные требования к вакцинам, содержащим адъюванты:
- Совместимость адъюванта с антигенными компонентами вакцины.
- Доказательство последовательной связи адъюванта с вакцинными антигенами во время производства и в течение срока годности.
- Данные о влиянии адъюванта на эффективность вакцины.
- Биохимическая чистота адъюванта [23].
Если все это суммировать, то идеальная вакцина должна быть безопасной (низкореактогенной ), содержать 15 мкг гемагглютинина на дозу, вызывать определенные уровни титров антител у привитых в зависимости от их возраста (при этом количество эффективно привитых должно быть не менее 70% среди взрослого населения до 60 лет). Если же вакцина содержит адъювант, он должен быть безопасным, связанным с антигенами и вызывать иммунный ответ в соответствии со строгими стандартами.
Что касается безопасности, то благодаря широкому использованию сплит- и субъединичных вакцин, прививки против гриппа демонстрируют низкую реактогенность. В основном наблюдаются местные реакции (у 10–64 привитых из 100) и повышение температуры (чаще всего у детей: 12 из 100 привитых) [26].
Вакцинация против гриппа и аллергия на куриный белок
В противопоказаниях к вакцинам против гриппа указано, что их нельзя прививать людям, у которых есть аллергические реакции на любой из компонентов, в том числе и на белок куриного яйца [27]. Однако в международной практике людей с аллергией на куриный белок совершенно спокойно прививают как против гриппа, так и против кори, краснухи и паротита, хотя вирусы для этих вакцин выращивают с использованием куриных эмбрионов. Вакцинации аллергиков дали зеленый свет после серии исследований [28–30], в которых изучали реактогенность у людей с аллергическими реакциями на куриный белок: в итоге эти вакцины признали безопасными, и теперь прививают даже людям с анафилактической реакцией на куриный белок (единственное, таких пациентов нельзя прививать в аптеках или школах, как это делают в некоторых странах — только в медицинских центрах, где есть противошоковые медикаменты).
Во время производства вакцины клеточную культуру подвергают сериям центрифугирований и ультрафильтраций, которые позволяют отделить вирусные частицы от остальных белков. Конечно, эта технология не идеальна, но даже если в препарат вдруг что-то и попадает, то лишь следовые количества овальбумина — основного белка куриного яйца: ≤ 1 мкг на 0,5 мл дозы инактивированной и 0,24 мкг на 0,2 мл дозы живой вакцины [31]. Поэтому основным противопоказанием для вакцинации против гриппа являются только тяжелые реакции на введение этих вакцин в прошлом (реакция на предыдущую дозу и аллергия на куриный белок не всегда связаны между собой: человек мог отреагировать на другой компонент, например, на неомицин) [27], [31].
Чем же прививаться?
Это вопрос, который волнует многих. В России прививают следующими вакцинами:
В какие противогриппозные вакцины добавляют адъюванты?
Муки выбора
Но, честно говоря, таких исследований единицы, поэтому выводы приходится делать по косвенным данным — официальной статистике заболеваемости гриппом в зависимости от количества привитых в нашей стране (рис. 4).

Рисунок 4. Заболеваемость гриппом и количество привитых против гриппа в России за 1996–2018 годы
Автор благодарит врача-биофизика Кирилла Скрипкина за помощь в подготовке материала.
Читайте также:

