Какие лекарства назначают при герпесе 6 типа у ребенка
Обновлено: 24.04.2024
Эпштейна-Барр вирусная инфекция (ЭБВИ) относится к наиболее распространенным инфекционным заболеваниям человека. Антитела (Ат) к вирусу Эпштейна-Барр (ВЭБ) обнаруживают у 60% детей первых двух лет жизни и у 80–100% взрослых [3, 13]. Заболеваемость острой формой ЭБВИ (ОЭБВИ) в различных регионах мира колеблется от 40 до 80 случаев на 100 тыс. населения [2]. Хроническая форма ЭБВИ (ХЭБВИ) развивается у 15–25% лиц после ОЭБВИ [1, 5, 15]. Установлена роль ВЭБ в развитии злокачественных новообразований, аутоиммунных заболеваний и синдрома хронической усталости [3, 5, 14, 15]. Все это свидетельствует об актуальности проблемы ЭБВИ.
ВЭБ, открытый в 1964 г. M. Epstein и Y. Barr, относится к γ-герпес-вирусам [3]. ВЭБ имеет в своем составе 3 антигена: капсидный (VCA), ранний (EA) и ядерный (EBNA). Своеобразие патологического процесса при ЭБВИ определяется способностью ВЭБ к трансформации В-лимфоцитов, пожизненной персистенции в организме человека, индукции вторичного иммунодефицитного состояния (ИДС), аутоиммунных реакций, злокачественных опухолей [1, 3, 5, 12].
Источник заражения ВЭБ — больные манифестными и бессимптомными формами. 70–90% лиц, перенесших ОЭБВИ, выделяют вирус в последующие 1–18 мес. Пути передачи ВЭБ: воздушно-капельный, контактно-бытовой, парентеральный, половой, вертикальный. ОЭБВИ характеризуется эпидемическими подъемами 1 раз в 6–7 лет, чаще регистрируется в возрасте от 1 до 5 лет, в организованных коллективах [4, 7, 9].
Иммунный статус 109 больных ОЭБВИ в возрасте от 5 до 14 лет в нашей работе выявил признаки активации Т-клеточного звена иммунной системы — повышение количества Т-лимфоцитов (CD3), цитотоксических Т-лимфоцитов (CD8), клеток с маркерами поздней активации (HLA-DR); поликлональную активацию В-лимфоцитов — увеличение количества CD20-клеток, иммуноглобулинов (Ig) IgA, IgM, IgG, циркулирующих иммунных комплексов (ЦИК). Обнаружены признаки угнетения иммунной системы: нормальное содержание Т-хелперов (CD4), снижение иммунорегуляторного индекса CD4/CD8, количества естественных киллерных клеток NK (CD16), повышение готовности иммунокомпетентных клеток к апоптозу (CD95). Наблюдалась активация кислородзависимого метаболизма нейтрофилов и редукция его адаптационных возможностей.
У трети обследованных детей (33,9%) ОЭБВИ протекала в форме микст-инфекции с цитомегаловирусами (ЦМВ), вирусами простого герпеса 1 и 2 типов (ВПГ-1, ВПГ-2). При бактериологическом исследовании мазков из ротоглотки у 41,3% пациентов выделены Streptococcus (S.) viridans, у 11,9% — Candida albicans, у 8,2% — Staphilococcus (Staph.) epidermidis, у 6,4% — S. pyogenes, у 2,7% — Klebsiella (Kl.) pneumoniae, у 41,3% — ассоциация бактерий. У 43,1% пациентов — серологические маркеры активной формы хламидийной инфекции, у 30,3% — микоплазмоза.
Возможны следующие исходы ОЭБВИ: латентная инфекция, ХЭБВИ, ИДС, онкологические, аутоиммунные заболевания, синдром хронической усталости [5, 8, 10, 11]. Переход в ХЭБВИ связан с комплексом неблагоприятных факторов в анте-, интра- и постнатальном периодах, нарушением нейроиммунноэндокринной регуляции, генетической предрасположенностью.
Проведенное нами обследование 60 детей в возрасте от 5 до 14 лет с ХЭБВИ показало, что в этой группе у 86,7% матерей имел место отягощенный акушерский анамнез; у 83,3% детей обнаружены перинатальная и постнатальная патология ЦНС, ЛОР-органов и др.
Нарушения иммунного статуса приводили к активации условно-патогенной микрофлоры, вирусных и грибковых инфекций. В микробном спектре слизистой ротоглотки пациентов с ХЭБВИ выделены S. Viridans (30%), Candida albicans (28,3%), Staph. Epidermidis (25%), S. Pyogenes (20%), Kl. Pneumoniae (8,4%), ассоциация бактерий (41,7%); у 28,3% — серологические маркеры активной формы хламидиоза, у 26,7% — микоплазмоза. У 90% пациентов заболевание протекало в форме микст-инфекции с участием герпес-вирусов: ВЭБ + ЦМВ, ВЭБ + ВПГ-1, ВПГ-2.
Классификация. Общепринятая классификация заболевания отсутствует; рекомендуем использовать разработанную нами рабочую классификацию ЭБВИ.
- По периоду возникновения: врожденная, приобретенная.
- По форме: типичная (инфекционный мононуклеоз), атипичная: стертая, бессимптомная, висцеральная.
- По тяжести: легкая, среднетяжелая, тяжелая.
- По течению: острая, затяжная, хроническая.
- По фазе: активная, неактивная.
- Осложнения: гепатит, разрыв селезенки, менингоэнцефалит, полирадикулонейропатия, миокардит, синусит, отит, гемолитическая анемия, тромбоцитопения, нейтропения, панкреатит и др.
- Микст-инфекция.
Примеры оформления диагноза:
- Осн.: Приобретенная ЭБВИ, типичная тяжелая форма (инфекционный мононуклеоз), острое течение, активная фаза. Осл.: Острый гепатит.
- Осн.: Приобретенная ЭБВИ, висцеральная форма (менингоэнцефалит, гепатит, нефрит), тяжелое хроническое течение, активная фаза. Осл.: острая печеночно-почечная недостаточность. Сопp.: Респираторный хламидиоз (ринофарингит, бронхит, пневмония).
Клиническая картина острой ЭБВИ впервые была описана Н. Ф. Филатовым (1885) и Е. Пфейфером (1889). Инкубационный период длится от 4-х дней до 7 нед. Полный симптомокомплекс формируется к 4–10-му дням болезни [4, 7].
Нами обследованы 109 детей с ОЭБВИ. У большинства пациентов заболевание начинается остро, с повышения температуры тела и появления симптомов интоксикации; реже отмечается постепенное начало: несколько дней наблюдается недомогание, слабость, вялость, снижение аппетита. Температура тела субфебрильная или нормальная. Ко 2–4-му дням болезни температура достигает 39–40 °С; лихорадка и симптомы интоксикации могут сохраняться в течение 2–3 и более недель.
Тонзиллит — наиболее частый и ранний симптом ОЭБВИ, сопровождается увеличением миндалин до II-III степени. Лакунарный рисунок подчеркнут за счет инфильтрации ткани миндалин или сглажен из-за лимфостаза. На миндалинах — налеты желтовато-белого или грязно-серого цвета в виде островков, полосок. Они исходят из лакун, имеют шероховатую поверхность (напоминают кружево), легко снимаются без кровоточивости, растираются, не тонут в воде. Характерно несоответствие размера налета и степени увеличения регионарных ЛУ. При фибринозно-некротическом характере налетов в случае их распространения за пределы миндалин необходим дифференциальный диагноз с дифтерией. Налеты на миндалинах исчезают, как правило, через 5–10 дней.
Гепатомегалия может быть обнаружена с первых дней болезни, однако чаще выявляется на второй неделе. Нормализация размеров печени происходит в течение полугода. У 15–20% больных в качестве осложнения развивается гепатит.
Спленомегалия относится к поздним симптомам, встречается у большинства больных. Нормализация размеров селезенки происходит в течение 1–3 нед.
Экзантема при ОЭБВИ появляется на 3–14-й дни болезни, имеет полиморфный характер — пятнистая, папулезная, пятнисто-папулезная, розеолезная, мелкоточечная, геморрагическая. Определенной локализации нет. Сыпь наблюдается в течение 4–10 дней, иногда оставляет пигментацию. У детей, получавших ампициллин или амоксициллин, сыпь появляется чаще (90–100%).
Гематологические изменения включают лейкоцитоз (10–30 х 10 9 /л), нейтропению с палочкоядерным сдвигом влево, увеличение количества лимфоцитов, моноцитов, атипичных мононуклеаров до 50–80%, повышение СОЭ до 20–30 мм/час. Характерный гематологический признак — атипичные мононуклеары в количестве 10–50%: они появляются к концу первой недели заболевания, сохраняются в течение 1–3 нед.
Хроническая ЭБВИ является исходом ОЭБВИ или развивается как первично-хроническая форма [2, 5, 8, 10, 11, 15]. Нами обследовано 60 детей с ХЭБВИ, клиника которой включала хронический мононуклеозоподобный синдром и полиорганную патологию. У всех пациентов обнаружены лимфопролиферативный синдром (генерализованная лимфаденопатия, гипертрофия небных и глоточной миндалин, увеличение печени и селезенки) и признаки хронической интоксикации (длительный субфебрилитет, слабость, снижение аппетита и др.). Вследствие развития ИДС наблюдались острые инфекции респираторного тракта и ЛОР-органов с обострениями до 6–11 раз в год: ринофарингиты (28,3%), фаринготонзиллиты (91,7%), аденоидиты (56,7%), отиты (11,7%), синуситы (20%), ларинготрахеиты (18,3%), бронхиты (38,3%), пневмонии (25%). Обращала внимание высокая частота полиорганной патологии, обусловленная длительной репликацией ВЭБ, вторичным ИДС, аутоиммунными реакциями (патология ЦНС; хронический гастрит, дискинезия желчевыводящих путей; кардиальный синдром, артралгии).
В последние годы описана врожденная ЭБВИ. Установлено, что риск ее при первичной ЭБВИ во время беременности составляет 67%, при реактивации — 22%. Клиника врожденной ЭБВИ сходна с ЦМВИ.
Установлена роль ВЭБ в развитии онкологических заболеваний и паранеопластических процессов — лимфомы Беркетта, назофарингеальной карциномы, лимфогранулематоза, опухолей желудка, кишечника, слюнных желез, матки, лейкоплакии языка и слизистой ротовой полости, а также ряда аутоиммунных заболеваний — системной красной волчанки, ревматоидного артрита, синдрома Шегрена, лимфоидного интерстициального пневмонита, хронического гепатита, увеита и др. [3, 5, 14, 15]. ВЭБ, наряду с вирусами герпеса человека 6 и 7 типов, является этиологическим фактором синдрома хронической усталости и наиболее частой причиной (15%) развития длительной лихорадки неясного генеза.
Диагностика ЭБВИ основана на учете групп риска, ведущих клинических синдромов и данных лабораторного исследования [8–11]. К группам риска у матери относят отягощенный анамнез, маркеры герпес-вирусных инфекций и др., у ребенка — перинатальное поражение ЦНС, аллергический фенотип, ИДС, маркеры герпес-вирусных инфекций и др. Ведущими клиническими синдромами ЭБВИ являются мононуклеозоподобный, общеинфекционный синдромы, экзантема, синдром полиорганной патологии.
В обязательный стандарт диагностики ЭБВИ входят клинический анализ крови, общий анализ мочи, биохимическое исследование крови, бактериологическое исследование слизи ротоглотки и носа, серологические маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм, УЗИ органов брюшной полости, консультация ЛОР-врача, по показаниям — рентгенография придаточных пазух носа, органов грудной клетки, ЭКГ. Дополнительный стандарт диагностики (в специализированном лечебно-профилактическом учреждении): маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм методом полимеразной цепной реакции (ПЦР), иммунограмма второго уровня, консультация иммунолога, по показаниям — коагулограмма, морфологическая картина стернальной пункции, консультация гематолога, онколога.
Методом иммуноферментного анализа (ИФА) определяют Ат к антигенам ВЭБ, что позволяет осуществить лабораторную диагностику ЭБВИ и определить период инфекционного процесса.
Ат класса IgM к VCA появляются одновременно с клиникой ОЭБВИ, сохраняются в течение 2–3 мес, повторно синтезируются при реактивации ВЭБ. Длительная персистенция высоких титров этих Ат характерна для ХЭБВИ, ВЭБ-индуцированных опухолей, аутоиммунных заболеваний, ИДС.
Ат класса IgG к EA достигают высокого титра на 3–4-й нед ОЭБВИ, исчезают через 2–6 мес. Они появляются при реактивации, отсутствуют при атипичной форме ЭБВИ. Высокие титры Ат данного класса выявляют при ХЭБВИ, ВЭБ-индуцированных онкологических и аутоиммунных заболеваниях, ИДС.
Ат класса IgG к EBNA появляются через 1–6 мес после первичной инфекции. Затем их титр уменьшается и сохраняется в течение всей жизни. При реактивации ЭБВИ происходит повторное увеличение их титра.
Большое значение имеет исследование авидности Ат класса IgG (прочности связывания антигена с Ат). При первичной инфекции сначала синтезируются Ат с низкой авидностью (индекс авидности (ИА) менее 30%). Для поздней стадии первичной инфекции характерны Ат со средней авидностью (ИА — 30–49%). Высокоавидные Ат (ИА — более 50%) образуются через 1–7 мес после инфицирования ВЭБ.
Серологическими маркерами активной фазы ЭБВИ являются Ат IgM к VCA и Ат IgG к EA, низкая и средняя авидность Ат IgG к маркерам неактивной фазы, Ат IgG к EBNA.
Материалом для ПЦР служат кровь, ликвор, слюна, мазки со слизистой ротоглотки, биоптаты органов и др. Чувствительность ПЦР при ЭБВИ (70–75%) ниже, чем при других герпесвирусных инфекциях (95–100%). Это связано с появлением ВЭБ в биологических жидкостях лишь при иммуноопосредованном лизисе инфицированных В-лимфоцитов.
На основании опыта лечения 169 детей с ЭБВИ нами разработан стандарт лечения этого заболевания.
Базисная терапия: охранительный режим; лечебное питание; противовирусные препараты: вироцидные препараты — инозин пранобекс (Изопринозин), аномальные нуклеозиды (Валтрекс, Ацикловир), Арбидол; препараты ИФН — рекомбинантный ИФН α-2β (Виферон), Кипферон, Реаферон-ЕС-Липинт, интерфероны для в/м введения (Реаферон-EC, Реальдирон, Интрон А, Роферон А и др.); индукторы ИФН — Амиксин, сверхмалые дозы антител к γ-ИФН (Анаферон), Циклоферон, Неовир. По показаниям: локальные антибактериальные препараты (Биопарокс, Лизобакт, Стопангин и др.); системные антибактериальные препараты (цефалоспорины, макролиды, карбапенемы); иммуноглобулины для внутривенного введения (Иммуновенин, Габриглобин, Интраглобин, Пентаглобин и др.); витаминно-минеральные комплексы — Мульти-табс, Вибовит, Санасол, Киндер Биовиталь гель и др.
Интенсификация базисной терапии по показаниям:
Симптоматическая терапия.
При лихорадке — жаропонижающие препараты (парацетамол, ибупрофен и др.); при затруднении носового дыхания — назальные препараты (Изофра, Полидекса, Називин, Виброцил, Адрианол и др.); при сухом кашле — противокашлевые препараты (Глаувент, Либексин), при влажном кашле — отхаркивающие и муколитические препараты (АмброГЕКСАЛ, бромгексин, ацетилцистеин и др.).
Эффективность этиотропной терапии ОЭБВИ оценена в двух группах больных. Пациенты 1-й группы (52 человека) получали инозин пранобекс (Изопринозин) в сочетании с рекомбинантным ИФН α-2β (Вифероном), больные 2-й группы (57 детей) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Клинико-серологические показатели до начала лечения и через 3 мес терапии представлены в табл. 1. У пациентов обеих групп в динамике отмечалось достоверное уменьшение таких симптомов, как генерализованная лимфаденопатия, тонзиллит, аденоидит, гепатомегалия и спленомегалия. Вместе с тем на фоне комбинированной терапии, положительная динамика клинических показателей была более значительной; острые респираторные инфекции (ОРИ) лишь у 19,2% больных 1-й группы и у 40,3% больных 2-й группы (p < 0,05). На фоне комбинированной терапии наблюдалось более быстрое исчезновение серологических маркеров репликации.
Эффективность этиотропной терапии исследована у 60 больных ХЭБВИ. Пациенты 1-й группы (30 детей) получали инозина пранобекс (Изопринозин) и рекомбинантный ИФН α-2β (Виферон), 2-я группа (30 человек) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Независимо от схемы лечения через 3 мес после начала терапии отмечалось достоверное уменьшение частоты генерализованной лимфаденопатии, гипертрофии небных и глоточной миндалин, спленомегалии, интоксикационного, инфекционного и вегето-висцерального синдромов (табл. 2). Комбинация инозина пранобекса (Изопринозина) с рекомбинантным ИФН α-2β (Вифероном) способствовало более существенной динамике клинических показателей. Количество эпизодов ОРИ снизилось с 6–11 (7,9 ± 1,1) до 4–6 (5,2 ± 1,2) в год на фоне монотерапии рекомбинантным ИФН α-2β (Вифероном), и до 2–4 (2,5 ± 1,4) в год на фоне комбинированной терапии (p < 0,05). В обеих группах уменьшалась частота репликации ВЭБ, однако при сочетанном применении противовирусных препаратов этот эффект был более выраженным.
Побочных эффектов при использовании инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона) не было.
Результаты проведенного исследования свидетельствуют о потенцировании эффектов при комбинации инозина пранобекса (Изопринозина) с рекомбинантным ИФН a-2b (Вифероном) у больных ЭБВИ.
Потенцирование противовирусных, иммуномодулирующих и цитопротекторных эффектов этих препаратов приводит к более существенной, чем при монотерапии, положительной динамике проявлений клинических симптомов ЭБВИ, к исчезновению серологических маркеров активности инфекционного процесса. Следует отметить высокую эффективность и безопасность комбинированной терапии с использованием инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона).
Реабилитация. Ребенок наблюдается участковым врачом и инфекционистом, снимается с учета через 6–12 мес после исчезновения клинико-лабораторных показателей активности инфекционного процесса. Кратность осмотров — 1 раз в месяц. По показаниям рекомендуют консультацию ЛОР-врача, иммунолога, гематолога, онколога и др. Лабораторные и инструментальные исследования пациентов включают: клинический анализ крови 1 раз в месяц в течение 3 мес, затем 1 раз в 3 месяца, по показаниям — чаще; серологические маркеры ВЭБ методом ИФА один раз в три месяца, по показаниям — чаще; ПЦР крови, мазков из ротоглотки 1 раз в 3 месяца, по показаниям — чаще; иммунограмма — 1 раз в 3–6 мес; биохимическое и инструментальное исследования — по показаниям.
Реабилитационная терапия включает: охранительный режим, лечебное питание, противовирусные препараты по пролонгированным схемам. Под контролем иммунограммы осуществляют иммунокоррекцию. По показаниям назначают локальные антибактериальные препараты, курсы витаминно-минеральных комплексов, про- и пребиотиков, препаратов метаболической реабилитации, энтеросорбентов, антигистаминные препараты, гепато-, нейро- и ангиопротекторы, кардиотропные препараты, ферменты, гомеопатические средства, немедикаментозные методы лечения.
Таким образом, ЭБВИ характеризуется широким распространением, длительным течением с периодической реактивацией инфекционного процесса у части пациентов, возможностью развития осложнений и неблагоприятных исходов (онкозаболеваний, аутоиммунной патологии). Важную роль при ЭБВИ играет формирование вторичного ИДС. Ведущими клиническими синдромами ЭБВИ являются острый и хронический мононуклеозоподобный синдромы, интоксикационный, инфекционный, церебральный, гастроинтестинальный, кардиальный и артралгический синдромы. Диагностика ЭБВИ основана на анализе групп риска, выделении ведущих клинических синдромов и лабораторном исследовании. Лечение ЭБВИ является комплексным и включает этиотропные средства (виростатические препараты, интерферон и его индукторы), препараты патогенетической, иммуномодулирующей, симптоматической терапии. Сочетанное пролонгированное использование инозина пранобекс (Изопринозина) и рекомбинантного ИФН α-2β (Виферона), потенцирующих свои иммунокорригирующие и цитопротекторные эффекты, существенно повышает эффективность лечения. Больные ЭБВИ нуждаются в длительной реабилитации с обязательным контролем клинико-лабораторных показателей активности инфекционного процесса.
По вопросам литературы обращайтесь в редакцию.
Э. Н. Симованьян, доктор медицинских наук, профессор
В. Б. Денисенко, кандидат медицинских наук
Л. Ф. Бовтало, кандидат медицинских наук
А. В. Григорян
Ростовский ГМУ, Ростов-на-Дону
Герпес 6 типа относится к той группе вирусов, с которыми человечество сосуществует тысячи лет, но мало что о них знает. До недавнего герпес почти не изучался, так как эти микроорганизмы не считались опасными для здоровья человека, в отличие от того же гриппа или бушующего нынче в мире коронавируса. Однако и герпес может доставить немало неприятностей человеку. Открытие герпеса 6 типа, который мы рассмотрим в этой статье, произошло относительно недавно и, в некотором роде, случайно. В 1986 году американские биохимики в штате Невада изучали кровь больных СПИДом. Врачей интересовали инфекции, которые находились в крови пациентов, и могли быть опасными для больных. В части биоматериала и были обнаружен неизвестный вирус. Спустя два года исследований они были классифицированы как герпесвирусы. Иногда их называли вирус простого герпеса 6 типа, но это неточная формулировка. Вирус активно изучался, но очень часто показывал разную клиническую картину заболевания. Ученые недоумевали: вирус один, а его проявления разнятся. И только в 21 веке, а точнее в 2016 году, с развитием технических методов диагностики, герпес 6 типа было решено разделить на два вида i . Было замечено, что при схожей структуре подвиды герпеса 6 типа отличаются по ряду признаков. Так первый вид герпеса 6 типа, или ВГЧ-6A, является причиной различных нарушений в работе нервной системы взрослых пациентов, а вот второй подвид (ВГЧ-6B) – это фактор появления детской розеолы.
Симптомы герпеса 6 типа у ребенка
Вирус герпеса 6 типа у детей в основном проявляется как детская розеола, которую часто раньше принимали за другое инфекционное заболевание, краснуху. Они, действительно, очень схожи по симптоматике ii .
Каковы главные симптомы детского герпеса 6 типа?
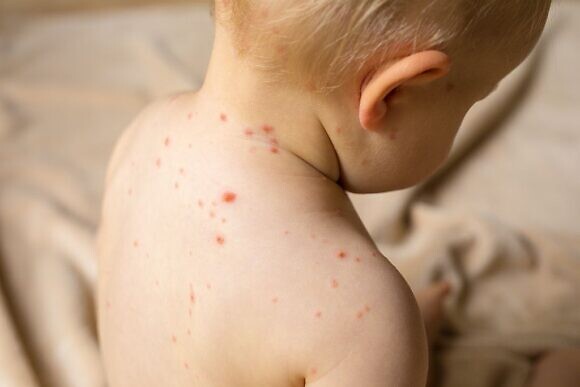
Надо отметить, что в группе риска находятся, прежде всего, малыши от 4 месяцев. В этом возрасте у активного ребенка может внезапно, казалось бы, беспричинно, подняться температура и держаться до пяти дней. Затем по всему телу малыша появляются обильные высыпания. Эта сыпь, хотя и занимает значительную часть кожных покровов ребенка, обычно не сопровождается зудом и не доставляет особого беспокойства маленькому пациенту. Родителей пугает этот вирус больше, чем ребенка. Диагностировать iii причину высыпаний и лихорадки удается не всегда. Порой, герпетическую инфекцию можно принять за корь, энтеровирусную инфекцию или аллергию. Тем более, что при появлении сыпи ребенок становится вялым, капризным, может потерять аппетит. Можно наблюдать у малыша и увеличение лимфоузлов. Сыпь держится от нескольких часов до нескольких дней. Педиатры всегда рекомендуют при температуре у таких маленьких детей незамедлительно обращаться к специалистам. Кстати, часто герпес может протекать вообще без высыпаний. Точный диагноз можно поставить только после проведения ряда анализов.
Осложнения, которые могут быть связаны с герпесом 6 типа
К сожалению, ВГЧ-6В не всегда ограничивается только лихорадкой и сыпью при первичном инфицировании. Возможны и более серьезные последствия:
- менингоэнцефалит;
- миокардит;
- фульминантный гепатит;
- тромбоцитопеническая пурпура;
- мононуклеозоподобный синдром;
- различные пневмонии.
Кроме того, при высокой температуре, а она может внезапно превысить показания в 40 градусов, есть риск возникновения судорог и лихорадочных конвульсий. Перенесенные в таком возрасте конвульсии могут спровоцировать впоследствии эпилепсию iv .
Особенности терапии вируса герпеса 6 типа у детей
Как и в случае с ВПГ 1 и ВПГ 2, сегодня не существует препаратов, способных полностью избавить человека от вируса герпеса 6 типа. Как правило, переболев герпесом 6 типа, ребенок приобретает иммунитет, способность подавлять активность вируса. Тем не менее, вирус продолжает существовать в организме человека.
В период болезни врач назначает симптоматическое лечение, которые снижает дискомфорт для ребенка, и облегчает течение болезни.
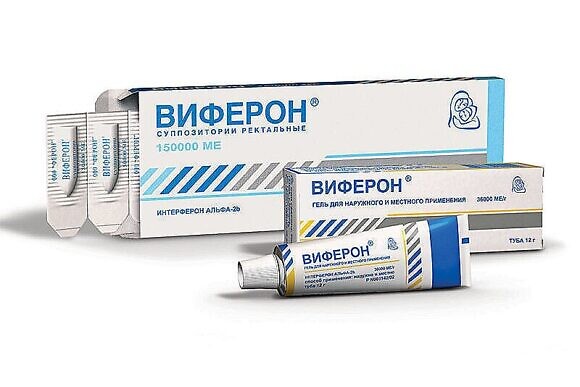
А вот высыпания на коже малыша можно обрабатывать препаратом ВИФЕРОН Гель. Средство наносится три-пять раз в день. Этот препарат также можно применять в самом раннем возрасте.
Профилактика простудных заболеваний
Несмотря на то, что герпес 6 типа у детей очень заразен и легко передается воздушно-капельным путем, а также через слюну, поцелуи и так далее, ребенка все равно можно попытаться защитить, если не от этой инфекции, то от сочетания герпеса и ОРЗ. Ослабленный вирусом герпеса организм очень чувствителен к другим инфекциям, в том числе респираторным, поэтому терапия таких микст-инфекций может усложниться.
Особенно это касается малышей, которые по тем или иным причинам не получают материнское молоко. Такие дети, как считается, более подвержены вирусным заболеваниям. Перенесение же одновременно герпесвирусной и иной инфекции может быть очень большой нагрузкой для организма ребенка.

Поэтому в возрасте от 4 месяцев до трех лет желательно соблюдать некоторые профилактические меры:
- Соблюдение личной гигиены мамы и всех, кто имеет касательство к ребенку;
- Закаливание (разумеется, посоветовавшись со специалистом);
- Регулярная влажная уборка помещения;
- Сбалансированный рацион ребенка с достаточным количеством витаминов;
- Профилактические лекарственные средства в период сезонных вирусных эпидемий.
К последнему пункту можно отнести и уж упомянутый ВИФЕРОН Гель. Для профилактики его следует наносить на слизистую внутри носика ребенка, два раза в день.
Врач дерматовенеролог, д.м.н., профессор
iv Никольский М.А., Радыш М.В. Роль вирусов герпеса человека 6 и 7-го типов в возникновении фебрильных судорог у детей // Вопросы диагностики в педиатрии. 2012. Т. 4. № 4. С. 46–48.
Все дело в том, что вирус герпеса человека (Human Herpes Virus) может вызвать гораздо более грозную болезнь, чем кажется большинству. Он способен стать причиной развития многих заболеваний, в том числе в виде тяжелых поражений центральной нервной системы, печени, желудочно-кишечного тракта, легких и костного мозга. Также герпес приводит к преждевременным родам у беременных женщин, препятствует правильному развитию новорожденных и даже может привести к инвалидности ребенка. Вирусы семейства Herpes viridae способны избегать влияния иммунной защиты, что позволяет им длительное время существовать в организме.
Пять фактов о герпесе 6 типа
- По структуре вириона и биологическим свойствам в семействе выделяют 3 подсемейства вируса герпеса: альфа-, бета- и гаммагерпесвирусы (α, β и γ). Вирус 6-го типа относится к подсемейству β-герпесвирусов, род Roseolovirus. Он пока мало изучен. По своему строению и аминокислотам ВГЧ-6 больше всего похож на ВГЧ-7 и цитомегаловирусную инфекцию.
- Впервые о герпесе 6 типа заговорили относительно недавно, в 1985 году. Это заболевание было обнаружено у людей, страдающих лимфоретикулярными болезнями и зараженных вирусом иммунодефицита человека. Начав изучать ВГЧ-6, ученые пришли к выводу, что вирус можно разделить на два подтипа: ВГЧ-6А и ВГЧ-6В. Оба этих подтипа хоть и похожи между собой, но имеют различное строение и приводят к разным заболеваниям. Также было установлено, что ВГЧ может поражать как лиц с ослабленным иммунитетом, так и с нормальной иммунной защитой.
- Герпес 6 типа усиливает проявления других заболеваний. Инфицирование ВГЧ-6А, по версии ученых, играет важную роль в развитии эпилепсии и эпилептического статуса, рассеянного склероза и может препятствовать пересадке органов, становясь причиной развития инфекции после операции. ВПГ-6В может приводить к острым лихорадочным состояниям и к развитию внезапной экзантемы – острого инфекционного заболевания детей раннего возраста, протекающего с повышением температуры тела и кожными высыпаниями.
- Кроме того, ВГЧ-6 повышает чувствительность человека ко многим лекарственным средствам. Это при приеме лекарств приводит к тяжелым системным реакциям, которые проявляются сыпью, лихорадкой и нарушением работы внутренних органов и систем.
- По одной из версий, этот тип герпеса также является причиной одного из самых загадочных и неоднозначных заболеваний современности – синдрома хронической усталости. В 1992 году ученые провели исследование и обнаружили, что у 70% пациентов с жалобами на постоянную физическую и психическую слабость, возникшую по неизвестной причине и продолжающуюся более полугода, был выявлен ВГЧ-6.
Как передается вирус герпеса 6 типа
Источником инфекции являются больные с явными клиническими признаками заболевания и носители ВГЧ-6. Ведущий путь передачи – воздушно-капельный, но не исключаются и другие пути, в частности, контактно-бытовой, хотя это случается реже. Также возможна передача вируса половым путем, при переливании инфицированной крови и пересадке органов и тканей от инфицированных доноров. Возможна вертикальная передача вируса от инфицированной матери плоду как во время беременности, так и после родов. Вирус может передаваться даже через слюну.
По версии американских и японских ученых, у детей чаще всего инфицирование вирусом происходит в возрасте от 6 месяцев до года.
Симптомы герпеса 6 типа у детей и его проявления у взрослых
Симптомы и состояния, которые должны насторожить и заставить обратиться к врачу:
- повышение температуры тела и появление розовой пятнисто-папулезной сыпи на коже;
- пузырьковые высыпания на коже;
- увеличение лимфатических узлов;
- иммунодефицитные состояния.
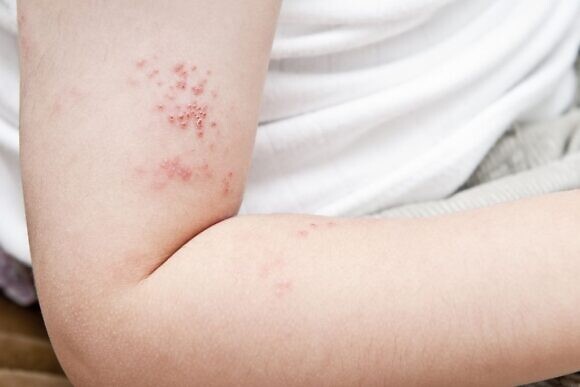
Анализ на выявление герпесвируса 6-го типа также необходимо сдать при таких заболеваниях, как краснуха, корь, инфекционная эритема, энтеровирусная инфекция, отиты, менингиты, бактериальная пневмония, аллергия на лекарства, заражение крови. Во время проведения профилактических скрининговых исследований тоже может потребоваться проведение подобной диагностики.
Какой анализ сдают на выявления герпеса 6?
Дифференциацию между типами А и В невозможно осуществить на основе проведения серологических тестов и обнаружения IgM (антител, формирующихся при первом контакте с инфекцией) и/или IgG (антител, показывающих более ранний контакт с инфекцией, т.е. они появляются после уже перенесенного инфекционного заболевания) в крови. С этой целью проводят ПЦР – экспериментальный метод молекулярной биологии, способ значительного увеличения малых концентраций определенных фрагментов нуклеиновой кислоты (ДНК) в биологическом материале. Для проведения ПЦР можно использовать кровь, слюну или спинномозговую жидкость.
Симптомы ГВЧ-6 у детей
У маленьких детей (0,5-3 года) о заражении вирусом герпеса шестого типа может свидетельствовать развитие внезапной эритемы (детской розеолы), которая дает о себе знать внезапным повышением температуры тела до 40 °С. При этом какие-либо другие симптомы чаще всего отсутствуют. После понижения показателей температуры на теле ребенка появляется розовая сыпь, которая сначала охватывает лицо, грудь и живот, а далее распространяется по всему телу. Как правило, после появления сыпи температура тела больше не повышается. Может наблюдаться увеличение лимфатических желез. Детскую розеолу не следует путать с ветрянкой или ОРВИ. Заболевшего ребенка необходимо изолировать до исчезновения клинических признаков и сразу же обратиться к врачу.

Какие еще встречаются проявления ГВЧ-6 у взрослых
Если вас продолжительное беспокоит субфебрильная температура тела, повышенная ночная потливость, проблемы со сном, слабость, вялость, чувство подавленности, вам стало трудно заниматься своими привычными делами и все это не проходит даже после отдыха – возможно, у вас синдром хронической усталости, и одновременно с этим вы заражены герпесом 6-го типа. Вам также необходима помощь специалиста.
Лечение герпеса 6 типа у детей
Наверное, ни для кого не секрет, что для ребенка подобрать лекарственные препараты, которые помогут избавиться от заболевания и при этом не нанесут вреда, гораздо сложнее, чем для взрослых. Многие лекарства нельзя применять новорожденным детям и детям до года, что создает огромную проблему как для родителей, так и для врачей. Но все же существуют препараты, которые можно применять для борьбы с герпесом 6-го типа даже у новорожденных малышей. Один из таких препаратов – это препарат ВИФЕРОН Свечи (суппозитории), который содержит интерферон альфа-2b человеческий рекомбинантный. Курс лечения составляет пять дней, ВИФЕРОН Свечи 150 000 ME применяются 1 раз в 12 часов. При необходимости врач может подобрать для ребенка другую дозировку.
Препарат прошел полный цикл клинических испытаний при широком спектре патологии в ведущих клиниках России. Результатом проведенных исследований явилось доказательство лечебно-профилактической и иммунокорригирующей эффективности препарата ВИФЕРОН при различных инфекционно-воспалительных заболеваниях у взрослых и детей. Научно доказано, что форма выпуска обеспечивает препарату уникальные фармакодинамические характеристики, а наличие высокоактивных антиоксидантов, витаминов Е и С, позволяет усилить противовирусную активность интерферона. Также нельзя не отметить отсутствие побочных эффектов, присущих парентеральным препаратам рекомбинантных интерферонов (вводимым в виде инъекций).Благодаря несовершенству функционирования интерфероновой системы в раннем возрасте, новорожденные и дети первых лет жизни проявляют повышенную чувствительность к инфекционным болезням, со склонностью к их более тяжелому и генерализованному течению с высоким риском осложнений и развития хронических очагов инфекции. Своевременное применение противовирусного препарата может помочь избежать осложнений и тяжелого течения болезни.
Схема применения препарата ВИФЕРОН Гель и Мазь для детей
Для лечения детей всех возрастов, в том числе новорожденных, также можно применять противовирусный препарат ВИФЕРОН Гель. Для борьбы с проявлениями герпеса 6-го типа необходимо 3-5 раз в день в течение 5-6 дней полоску геля длиной не более 0,5 см наносить на предварительно подсушенную пораженную поверхность при помощи шпателя или ватного тампона.

ВИФЕРОН Мазь применяют у детей старше года. Для лечения герпеса шестого типа необходимо 3-4 раза в день в течение тонким слоем на предварительно подсушенную пораженную поверхность. Совместное применение суппозиториев ВИФЕРОН и ВИФЕРОН Мазь/Гель позволяет усилить клинические эффекты проводимой терапии.
Лечение герпеса 6 типа у взрослых
Для лечения взрослых применяется ВИФЕРОН 1 000 000 МЕ два раза в день в течение 10 дней. Терапия заболеваний, ассоциированных с герпесом 6 типа, – это трудоемкая и длительная задача, поэтому, возможно, потребуется повторение курса лечения несколько раз с небольшими интервалами.
Что принимать при беременности
Беременным женщинам с 14-й недели гестации рекомендуется препарат ВИФЕРОН Свечи в дозировке 500 000 ME с дальнейшим назначением поддерживающих курсов согласно инструкции по медицинскому применению. Гестация – это, по сути, та же самая беременность, только ее срок определяется количеством полных недель вынашивания, которые прошли с даты первого дня последней менструации до рождения ребенка.
Схема применения препарата ВИФЕРОН Гель и Мазь при ГВЧ-6 во время беременности
При лечении препаратом ВИФЕРОН Гель полоску геля длиной не более 0,5 см наносят при помощи шпателя или ватного тампона / ватной палочки на предварительно подсушенную пораженную поверхность 3-5 раз в день, курс лечения – 5-6 суток. При необходимости продолжительность курса увеличивают до исчезновения клинических проявлений.
ВИФЕРОН Мазь 3-4 раза в день наносят тонким слоем на предварительно подсушенную пораженную поверхность. Такая схема лечения препаратом ВИФЕРОН Гель и Мазь подходит и для беременных женщин с первой недели гестации.
В статье рассматриваются некоторые аспекты этиопатогенеза герпесвирусных заболеваний у детей, современные подходы к лекарственной терапии и профилактике рецидивов.
This article discusses some aspects of the pathogenesis of herpes-associated diseases in children, modern approaches to drug therapy and relapse prevention.
В последние годы среди основных возбудителей вирусных инфекций у детей особое место занимают герпес-вирусы, что связано с их повсеместным распространением, широким разнообразием, полиорганностью поражения, многообразием клинических проявлений, а также высокой частотой хронического течения. Герпес-ассоциированные заболевания входят в число наиболее распространенных и плохо контролируемых инфекций человека. Это связано с тем, что герпес-вирусы могут длительно бессимптомно циркулировать в организме человека с нормальной иммунной системой, а при иммуносупрессии способствовать развитию тяжелых заболеваний, вплоть до угрожающих жизни генерализованных инфекций. Так, по данным Всемирной организации здравоохранения (World Health Organization, WHO), смертность от герпетической инфекции составляет около 16% и находится на втором месте после гепатита среди вирусных заболеваний [1].
.jpg)
Вирионы герпес-вирусов термолабильны — они инактивируются в течение 30 мин при температуре 50–52 °C, в течение 20 ч — при температуре 37,5 °C, но хорошо переносят лиофилизацию. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, на влажных медицинских материалах (вата и марля) — до их высыхания при комнатной температуре (до 6 ч). Уникальность герпес-вирусов заключается в том, что они способны непрерывно или циклично размножаться в инфицированных клетках тропных тканей (персистенция), а также пожизненно сохраняться в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных нервных ганглиев (латенция) и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов. Однако способность к персистенции и латенции у различных штаммов неодинаковая: наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна–Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами вирусов. Основной путь инфицирования — воздушно-капельный, при прямом контакте или через предметы обихода (общие посуда, полотенца, носовые платки и пр.). Отмечается также оральный, генитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции. ВПГ 1-го и 2-го типов, цитомегаловирус входят в число возбудителей TORCH-инфекций, способствуют развитию серьезных заболеваний новорожденных и детей младшего возраста. Вирусы простого герпеса, цитомегаловирус, вирус Эпштейна–Барр рассматриваются как индикаторы СПИДа в связи с их частым обнаружением при данном заболевании [3, 4]. С герпес-вирусами связывают развитие синдрома хронической усталости (Chronic fatigue syndrome — CFS) [5].
Клинически герпес-инфекция у детей может протекать в виде ветряной оспы (вирус варицелла зостер), инфекционного мононуклеоза (вирус Эпштейна–Барр), внезапной экзантемы (вирус герпеса человека 6-го и 7-го типов), афтозного стоматита (ВПГ 1-го или 2-го типа), мононуклеозоподобного синдрома (цитомегаловирус). У подростков и взрослых людей часто инфекция протекает бессимптомно, что объясняется как биологическими свойствами штаммов, так и индивидуальными особенностями иммунного ответа. Часто при снижении иммунореактивности организма герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому течению основного заболевания, развитию осложнений. Велика роль герпесвирусных инфекций, особенно цитомегаловирусной, в формировании младенческой смертности. Наибольшую угрозу для жизни и здоровья детей представляют герпетические нейроинфекции — летальность при них достигает 20%, а инвалидизация — 50%. Тяжело протекают офтальмогерпес (развитие катаракты или глаукомы — до 50%), генитальный герпес, генерализованная форма Эпштейна–Барр-вирусной инфекции (инфекционного мононуклеоза) [1, 6].
Герпесвирусная инфекция относится к трудноконтролируемым заболеваниям. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения данной патологии, средств, обеспечивающих полное излечение, не существует. Это обусловлено генотипическими особенностями возбудителя, формированием резистентности герпес-вирусов и молекулярной мимикрией.
Открытые с помощью методов молекулярной биологии механизмов репликации герпес-вирусов, а также изучение взаимодействия вируса с клеткой позволили создать целый ряд эффективных химиотерапевтических средств, обладающих противогерпетической активностью. Однако, эффективно купируя острые проявления инфекции, они не предотвращают рецидивирования, не всегда снижают частоту рецидивов.
Учитывая, что при герпес-ассоциированных инфекциях, как и при других хронических заболеваниях с длительной персистенцией вируса, развиваются иммунодефицитные состояния, для повышения эффективности лечения в схемы терапии наряду с противовирусными препаратами приходится включать препараты, способствующие коррекции иммунного статуса больного. Все это диктует необходимость правильно подбирать лекарственное средство, его дозу и длительность приема, при необходимости использовать комбинацию различных препаратов, избегая при этом полипрагмазии. Определенную сложность терапии в детском возрасте вызывают возрастные ограничения для ряда лекарственных средств, наличие нежелательных лекарстввенных реакций (НЛР) и противопоказаний.
В настоящее время для лечения герпесвирусных заболеваний и профилактики рецидивов используют следующие группы препаратов (табл.).
При лечении герпес-инфекций следует придерживаться комплексного подхода. Длительность и интенсивность терапии определяются возрастом больного, клинической формой заболевания, тяжестью его течения, а также наличием осложнений и сопутствующей патологии. Лечебно-профилактические мероприятия следует разделять на несколько этапов.
- Острый период болезни (рецидив) — охранительный режим, лечебное питание, противовирусные препараты, интерфероны и их индукторы. По показаниям назначаются иммуноглобулины, антибактериальные препараты местного и системного действия, глюкокортикоиды, нейро- и ангиопротекторы, гепатопротекторы, кардиотропные препараты, ингибиторы протеаз. Симптоматическая терапия может включать жаропонижающие, отхаркивающие и муколитические препараты.
- Ремиссия, стихание основных клинических проявлений (иммуномодуляторы, адаптогены растительного происхождения, пре- и пробиотики, витамино-минеральные комплексы).
- Профилактика рецидивов (специфическая профилактика — вакцинация, санация хронических очагов инфекции, восстановление иммунного статуса и пр.).
Следует отметить, что сочетанное применение противовирусных препаратов и иммунобиологических средств имеет ряд преимуществ. Во-первых, комплексная терапия обеспечивает синергидный эффект. Во-вторых, позволяет снизить дозу противовирусного химиопрепарата, уменьшая вероятность развития НЛР, сокращая его токсическое воздействие на организм и снижая вероятность возникновения устойчивых штаммов герпес-вирусов. Кроме того, это значительно сокращает продолжительность острого периода болезни и сроки лечения.
Одним из препаратов, показавшим свою эффективность при лечении герпес-ассоциированных заболеваний у детей, является инозин пранобекс. Инозин пранобекс — это синтетическое комплексное производное пурина, обладающее иммуностимулирующей активностью и неспецифическим противовирусным действием. Препарат восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитарных клеток, стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов, оказывает стимулирующее влияние на активность цитотоксических Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию иммуноглобулина G, интерферонов, интерлейкинов (ИЛ-1 и ИЛ-2), снижает образование провоспалительных цитокинов (ИЛ-4 и ИЛ-10), потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов. Механизм противовирусного действия препарата связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации, усилении подавленного вирусами синтеза мРНК лимфоцитов, что сопровождается угнетением биосинтеза вирусной РНК и трансляции вирусных белков.
Инозин пранобекс малотоксичен, хорошо переносится, в России рекомендован в виде таблеток детям с 3-летнего возраста (масса тела более 15 кг). За рубежом он доступен и в форме сиропа и не имеет возрастных ограничений. Препарат назначается по 50–100 мг/кг/сут внутрь в 3–4 приема в течение всего острого периода болезни (5–10 дней в зависимости от длительности вирусемии и выраженности синдрома интоксикации). В качестве поддерживающей терапии для восстановления иммунологических показателей возможно назначение препарата по иммуномодулирующей схеме (50 мг 2 раза в день в течение 14–28 дней). Доказана высокая эффективность курсовой терапии инозином пранобексом (50 мг/кг массы тела в сутки в 3–4 приема внутрь, три курса лечения по 10 дней с интервалом 10 дней) [7], комбинированной курсовой терапии с использованием инозина пранобекса и рекомбинантного интерферона α-2β (3 курса по 10 дней с интервалом 14 дней) у детей с микст-вирусными инфекциями [8].
Применение инозина пранобекса как препарата с иммунотропным и противовирусным действием на различных этапах лечебно-профилактических мероприятий позволяет избежать полипрагмазии, тем самым снизить медикаментозную нагрузку на организм и уменьшить риск нежелательных эффектов.
Литература
- Кускова Т. К., Белова Е. Г. Семейство герпес-вирусов на современном этапе // Лечащий Врач. 2004, № 5, с. 64–69.
- Hjalgrim H., Askling J., Rostgaard K. et al. Characteristics of Hodgkin’s lymphoma after infectious mononucleosis // N. Engl. J. Med. 2003; 349: 1324–1332.
- Никольский И. С., Юрченко В. Д., Никольская К. И. Характеристика активной хронической Эпштейна–Барр вирусной инфекции: клинико-иммунологический синдром // Современные инфекции. 2003, № 3, с. 60–62.
- Katz B. Z., Shiraishi Y., Mears C. J., Binns H. J., Taylor R. Chronic fatigue syndrome after infectious mononucleosis in adolescents // Pediatrics. 2009, Jul; 124 (1): 189–193.
- Lerner A. M., Begar S. N., Deeter R. G. IgM serum antibodies to Epstein-Barr virus are uniquely present in a subset of patients with the chronic fatigue syndrome // In Vivo. 2004, Mar-Apr; 18 (2): 101–106.
- Maakaroun N. R., Moanna A., Jacob J. T., Albrecht H. Viral infections associated with haemophagocytic syndrome // Rev. Med. Virol. 2010, Mar; 20 (2): 93–105.
- Симованьян Э. Н., Денисенко В. Б., Григорян А. В. Эффективность применения инозина пранобекс у часто болеющих детей с хронической Эпштейна-Барр вирусной инфекцией: результаты рандомизированного исследования // Вопросы современной педиатрии. 2011, Т. 10, № 2, С. 16–21.
- Нестерова И. В., Ковалева С. В., Чудилова Г. А., Ломтатидзе Л. В., Клещенко Е. И., Шинкарева О. Н. Динамика изменений фенотипа и функциональной активности нейтрофильных гранулоцитов у иммунокомпрометированных детей с повторными ОРВИ, ассоциированными с герпесвирусными инфекциями, на фоне комбинированной интерфероно- и иммунотерапии // Цитокины и воспаление. 2014, Т. 13, № 1, с. 113.
Т. А. Бокова, доктор медицинских наук, профессор
Простой герпес у детей – болезнь, которая поражает множество тканей и органов ребенка, что сопровождается высыпаниями на коже и слизистых оболочках в виде пузырьков. В большинстве случаев лечение длительное латентное, случаются периодические рецидивы.
Простой герпес у детей, согласно международной классификации, делится на:
- герпетическую болезнь глаз (подразделяется на передний увеит, кератоконъюнктивит, кератит, ирит, иридоциклит, дерматит век, конъюнктивит);
- герпетический энцефалит;
- герпетический гингивостоматит и фаринготонзиллит;
- герпетический менингит;
- герпетический везикулярный дерматит;
- герпетическую экзему;
- диссеминированную герпетическую болезнь;
- герпетические инфекции неуточненные;
- другие формы герпетических инфекций.
Эпидемиология
Инфекции подвержены дети, которые заражаются инфекцией в первые 3 года жизни. Новорожденные не могут заразиться данной болезнью до полугода, т. к. имеют в крови специфические антитела класса lgG. Но бывают очень редкие случаи, когда у матери в крови антитела отсутствуют, а значит – и у ребенка. Тогда при заражении у ребенка возникает генерализированная форма болезни, течение тяжелое. У большинства детей 3-летнего возраста в крови достаточно антител, защищающих организм. Число детей с высоким уровнем антител к ВПГ2 возрастает к 5-7-летнему возрасту.
Инфекцию переносят и распространяют как больные, так и вирусоносители. Пути передачи инфекции: контактный, половой и, предположительно, воздушно-капельный. Заразиться можно, что касается подростков, при поцелуе – через слюну. Также заражение происходит через предметы быта, игрушки и прочие предметы, на которых может оказаться слюна зараженного человека. Ребенок может заразиться в утробе матери или при рождении в родовых путях.
Заболевания встречаются периодически, отдельными случаями по всей стране. Но в зимний период (меньше – в другие сезоны) случаются небольшие эпидемии в детсадах, школах и прочих детских коллективах.
На скорость и масштабы распространения герпеса влияют переохлаждение, плохие санитарно-гигиенические условия, повышенная инсоляция, скученность и др.
Что провоцирует / Причины Герпеса у детей:
Вирус простого герпеса (обозначают аббревиатурой ВПГ) содержит РНК. Диаметр вириона 120-150 нм. Размножение вируса происходит лучше всего в тканях куриного эмбриона. В инфицированных клетках из-за влияния вируса образуются внутриядерные включения и гигантские клетки.
Лучше всего вирус герпеса сохраняется при низкой температуре (- 70 °С). Инактивировать его можно, повышая температуру среды до 50-52 °С на протяжении получаса. Также вирус уничтожается ультрафиолетовыми и рентгеновскими лучами. В высушенном состоянии может сохранять жизнедеятельность около 10 лет.
Вирус простого герпеса делят на ВПГ1 и ВПГ2. Первая группа приводит к поражению кожи лица и слизистой во рту. ВПГ2 поражают гениталии, вызывают менингоэнцефалит. Если ребенок заразился одним типом вируса, может возникнуть также инфекция, вызванная и вторым типом.
Патогенез (что происходит?) во время Герпеса у детей:
Инфекция попадает в организм ребенка через поврежденные слизистые оболочки и травмированную кожу. ВПГ вызывает высыпания в местах поражения. В редких случаях вирус из мест первичной локализации попадает в регионарные лимфатические узлы, еще более редко он проникает в кровоток.
Развитие инфекции далее зависит от состояния систем, отвечающих за иммунитет. Если формы герпеса локализированы, то процесс завершается лишь местными проявлениями. Вирус с кровью заносится в легкие, печень, селезенку или другие органы и поражает их – такое происходит при генерализованных формах герпеса. При этом процессе в крови скоро накапливаются вирус-нейтрализующие антитела. Вирусная ДНК внутри клетки не инактивируется. Вирус нельзя убить до конца, он пребывает в организме всю жизнь, из-за чего время от времени возникают повторения заболевания. Рецидивы происходят, не смотря на то, что в крови присутствуют вируснейтрализующие антитела.
Рецидивы наступают по причине ослабления местного иммунитета или из-за генетически детерминированного дефицита клеточного иммунитета. Если иммунный контроль ослаблен, вирус свободно переходит по клеткам и между ними.
Патоморфология. Патологические изменения зависят от локализации инфекции. Происходит баллотирующая дегенерация эпителия, что проявляется как воспаление в эпидермисе в виде пузырьков. Пузырек лежит на на инфильтрированном и отечном сосочковом слое дермы.
При генерализованных формах заболевания во многих органах и системах организма появляются мелкие очаги коагуляционного некроза. Встречаются изменения в ЦНС. Есть вероятность кровоизлияний в субарахноидальное пространство (полость между паутинной и мягкой мозговыми оболочками).
Обнаруживают картину лептоменингита с и нфильтрацией оболочек и стенок сосудов клеточными лимфогистиоцитарными элементами. Изменения такого же характера могут произойти в легких, печени, костном мозге, селезенке и коре надпочечников.
Симптомы Герпеса у детей:
Клинические проявления
Инкубационный период болезни составляет 6 дней (в среднем), но в разных случаях может длиться 2-14 дней. Локализация патологического процесса позволяет различать такие виды поражений:
- поражение глаз (проявляющееся как блефароконъюнктивит, конъюнктивит, кератит, хориоретинит и пр.);
- поражение слизистых оболочек (проявляющееся как стоматит, тонзиллит, гингивит и т. д.);
- поражение кожи (проявляющееся как герпес носа, герпес губ, век рук, лица и пр.);
- генитальный герпес (поражение вульвы, полового члена, уретры и т. д.);
- герпетическая экзема;
- висцеральные формы (пневмония, гепатит);
- поражение ЦНС (неврит, менингоэнцефалит и пр.).
В диагнозе обычно указывают, насколько распространены поражения (герпес: локализованный, распространенный или генерализованный простой). Течение заболевания: острое, абортивное, рецидивирующее. Абортивная форма указывает на быстрое, преждевременное прекращение болезненного процесса. Рецидивирующее течение указывает на повторение болезни в виде выздоровления и нового возвращения симптомов. После исчезновения клинических проявлений в крови есть антитела, но вирус присутствует в организме, ничем не проявляясь. В случае появления фактора активизации он проявляется и поражает те же или иные органы человека.
Один из самых распространенных симптомов герпеса у детей – поражение слизистых оболочек. Оно проявляется как острый стоматит или гингивостоматит. Такой симптом может быть у детей любого возраста, но в большинстве случаев – у детей от 2 до 3 лет. Инкубационный период длится от одного дня до восьми. Заболевание имеет острое начало с подъемом температуры до 39—40 °С. Ребенка знобит, он начинает проявлять беспокойство (новорожденные и груднички). Появляется общее недомогание. Малыш отказывается от еды, потому что она вызывает болезненные ощущения во рту. Родители могут отметить активное слюнотечение и характерный запах изо рта. У маленьких детей снижается масса тела, появляются в редких случаях расстройства желудка, возможна дегидратация.
При поражении слизистых оболочек рот внутри отечный и красноватый. Слизистая покрыта высыпаниями размером от 2 до 10 мм, которые выглядят, как пузырьки. Сначала они прозрачные, а затем появляется желтоватое содержимое. Они скоро лопаются, после пузырьков остаются эрозии. Регионарные лимфатические узлы увеличены и болезненны (боль при пальпации). Заболевание продолжается от 1 до 2 недель. На 3-5 сутки температура тела приходит в норму. В некоторых случаях возможны рецидивы болезни.
Поражение кожи в большинстве случаев возникает вокруг рта, носа и ушей. За несколько дней до появления высыпаний может появиться жжение, а также зуд, покалывание или небольшие болевые ощущения. Стоит отметить, что жидкость в появившихся позже пузырьках может быть с примесью крови. Когда затягиваются появившиеся на месте пузырьков эрозии, появляется корочка буровато-желтоватого оттенка. Корочки отпадают в скором времени, на их месте кожа может быть красной или слегка пигментированной.
Следующая форма герпеса – герпетическая экзема. Возникает у детей, заболевших экземой, нейродермитом и другими дерматозами, при которых имеются эрозивные поражения (через которые инфекция попадает в организм). Болезнь также называется иначе: осповидные высыпания Капоши, вакциниформный пустулез, герпетиформная экзема и т. д.
Есть вероятность судорог, потеря сознания кратковременная. С первого дня заболевания появляется обильная сыпь, иногда она может проявиться только на 2-3 сутки. Высыпания держатся до 2-3 недель. Случается болезненный регионарный лимфоаденит. Сначала пузырьки прозрачные, затем становятся более мутными и уплотненными. Элементы сыпи на второй день напоминают вакцинальные пустулы. Пузырьки сливаются между собой, лопаются, покрываясь корочкой. В тяжелых случаях сыпь оставляет на коже рубцы. Болезнь может длиться долго, есть вероятность повторных высыпаний на протяжении 2 или 3 недель. На 7-10 день температура тела приходит в норму, общее состояние больного улучшается. После этого начинает очищаться кожа. Если организм ребенка ослаблен, герпетическая экзема имеет тяжелое течение. Патологический процесс затрагивает не только слизистые оболочки и кожу, но и нервную систему, висцеральные органы, глаза, что приводит при несвоевременном лечении и ослабленности организма к летальному исходу.
.Из-за обширности поражения кожных покровов угрозу представляет вторичная бактериальная инфекция.
Поражение глаз (офтальмогерпес) часто развивается из-за заражения вирусом герпеса. Может проявляться как изолированное поражение глаза, но также нередки случаи комбинирования поражения глаза, слизистых оболочек полости рта и кожи. Увеличиваются регионарные лимфатические узлы, развивается фолликулярный, катаральный или везикулезно-язвенный конъюнктивит.
Офтальмогерпес начинается остро, появляется конъюнктивит, язвочки или герметические пузырьки на коже века возле ресниц. Течение поверхностных герпетических кератитов в большинстве случаев доброкачественное. Глубокие дисковидные герпетические кератиты имеют тяжелое течение, что нередко приводит к воспалению переднего отдела сосудистого тракта.
Клинические проявления генитального герпеса различны. Течение в большинстве случаев упорное и рецидивирующее. Генитальный герпес у подростков и детей другого возраста вызывает везикулезные и эрозивно-язвенные высыпания на коже и слизистой оболочке половых органов.
У заболевших женского пола высыпания могут быть локализированы на половых губах (малых и больших), в промежности, реже – на внутренней поверхности бедер. В еще более редких случаях высыпания могут появиться на слизистой оболочке влагалища, клиторе или анусе. У заболевших мужского пола высыпания локализируются на внутреннем листке крайней плоти и коже мошонки. Также возможны случаи появления сыпи на слизистой оболочке уретры, которые переходят в высыпания на мочевом пузыре. Болезнь проявляется лихорадкой, болью, зудом, жжением и пр. на участках, пораженных болезнью. Тяжелее, чем у детей, генитальный герпес протекает у взрослых. После исчезновения симптомов возможно длительное латентное вирусоносительство, что повышает риск заражения окружающих детей и взрослых.
Поражение нервной системы при герпесе. Распространение вируса по кровотоку может привести к инфицированию мозга. Поражение ЦНС может иметь течение, сходное с менингоонцефапитом, энцефалитом, менингитом, менингоэнцефалорадикулита. Самыми распространенными формами герпеса являются энцефалит и менингит, которыми болеют обычно новорожденные и младенцы.
По клиническим проявлениям герпетический энцефалит не отличается от других вирусных энцефалитов. У детей раннего возраста часто возникает первичная генерализованная инфекция, хотя поражение ЦНС возможно одновременно с проявлением высыпаний на губах, глазах и пр. Герпетический энцефалит начинается остро, с очень повышенной температуры. Головная боль сильная, чувствуется озноб, возможны повторяющиеся приступы рвоты. За ребенком нужно наблюдать, тогда можно заметить заторможенность и сонливость, но в некоторых случаях – наоборот – возбужденность. В разгар болезни могут случиться судороги, обмороки, параличи и даже нарушение рефлексов. Течение болезни тяжелое, последствия серьезные. Особо тяжелые случаи кончаются фатальным исходом. В таких случаях вскрытие показывает острый геморрагический некроз в коре головного мозга.
Анализ спинномозговой жидкости показывает лимфоцитарньтй цитоз и повышенный белок.
Висцеральные формы проявляются в виде острого паренхиматозного гепатита, пневмонии, поражения почек и других органов.
Герпетический гепатит распространен в основном среди новорожденных детей, но также встречается и у более старших. Обычно гепатит появляется как следствие генерализации простого герпеса, в результате которого возникает поражение многих органов ребенка. Но возможно также, хоть и редко, изолированное поражение печени больного.
Герпетический гепатит проявляется высокой лихорадкой, выраженными симптомами интоксикации, сонливостью, расстройством дыхания, одышкой, цианозом, увеличением печени, рвотой, увеличением селезенки и т. д. Не исключена и желтуха, как при других формах гепатита.
Герпетическая пневмония и герпетический очаговый нефрит клинически не отличаются от поражений легких и почек другой этиологии. Заболевание имеет течение как у вирусно-бактериальной инфекции. Течение острое или рецидивирующее. В основном – именно рецидивирующее. Болезнь повторяется по причине переохлаждения или перегревания, присоединения/активизации вирусных и бактериальных инфекций. У девочек периодом нового обострения болезни может быть время менструаций. Рецидивы обычно имеют легкое течение.
Осложнения при герпесе возникают в случае присоединения бактериальной инфекции.
Диагностика Герпеса у детей:
Простой герпес определяется врачами по характерным пузырьковым высыпаниям, группирующимся на коже и слизистых оболочках. Лабораторное подтверждение проходит с помощью анализа наличия вируса в пузырьках-высыпаниях, в кожных изъязвлениях, в крови, в спинномозговой жидкости (метод ПЦР). Для диагностики рецидивирующего герпеса определенное значение имеет обнаружение высоких пиров антител IgG или нарастание титра в динамике заболевания.
Прогноз благоприятный при локализированных формах болезни. При генерализированных формах лечение более тяжелое и длительное, не исключены летальные исходы. Особенно тяжелый прогноз при герпетических энцефалитах, менингоэнцефалитах, я также при врожденном герпесе и при заболеваниях новорожденных.
Лечение Герпеса у детей:
Локализированные поражения слизистых и кожи лечат местным способом – мазью ацикловира, 5% линимента циклофероном и другими противовирусными препаратами. Интерферон назначают в форме примочек, мази, полосканий слизистых или ингаляций. Пораженные участки кожи и слизистых оболочек обрабатывают 1—2% спиртовым раствором бриллиантового зеленого, 1—3% спиртовым раствором меч кленового синего. Полость рта обрабатывают 3% раствором перекиси водорода, что дает санирующий эффект при герпетическом стоматите. Чтобы груднички могли питаться без болевых ощущений, применяют обезболивающие средства местно – например, анестезин или лидокаин.
Если температура сильно повышена, больному дают ибупрофен. Тяжелые формы герпеса лечат ацикловиром. Комбинированная терапия предусматривает ацикловир + циклоферон.
При рецидивирующем течении болезни назначают курс виферона, витаминов В, В2, В12, пирогенала. Также назначают экстракт элеутерококка жидкий, настойку женьшеня и др. Также эффективны для лечения специфический противогерпетический иммуноглобулин и противогерпетическая вакцина, особенно в комбинированном применении с циклофероном.
В некоторых случаях назначают индукторы интерферона, например, циклоферон или анаферон детский. Присоединение бактериальной инфекции означает, что к лечению нужно добавить антибактериальную терапию. Противопоказаны для лечения герпеса кортикостероидные гормоны, но их подключают при тяжелых формах герпетического энцефалита и менингоэнцефалита.
При рецидивирующем течении герпеса ацикловир малодейственен, нунжо применять его комплексно, вместе с циклофероном.
Профилактика Герпеса у детей:
Среди профилактических мер выделяют закаливание детей и воспитание навыков гигиены. Инфицированным детям не рекомендованы ультрафиолетовое облучение, физические нагрузки, сильный стресс.
Особенно важно оберегать детей, страдающих экземой и мокнущими формами атонического дерматита. Новорожденные, имевшие контакт с заболевшим герпесом человеком, подлежат изоляции. Если мать заражена герпесом, и высыпания есть у нее на коже и слизистых, при контакте с ребенком она обязана носить хирургическую маску. Пока эрозии после отпадения корочек не заживут, зараженная мать не может прижиматься к коже ребенка и целовать его. Если на груди поражений герпеса нет, кормление разрешено.
Чтобы предупредить внутриутробное заражение малыша, беременных рекомендуется обследовать на ВПГ. Если есть клинические признаки инфицирования, вводят иммуноглобулин (0,2 мл/кг). Если признаки генитального герпеса найдены перед родами, роды должны проходить с помощью кесаревого сечения. Но эта мера не на 100% исключает возможность заражения новорожденного.
Читайте также:

