Какие лекарства принимать при гепатите с и циррозе печени
Обновлено: 18.04.2024
Цирроз печени – последняя стадия развития фиброза. Заболевание вызывает необратимые дегенеративные изменения в структуре органа. В результате хронического воспалительного процесса возникают очаги некроза, функциональные клетки печени замещаются соединительной тканью, нарушается дольковое строение органа. Как следствие, печень перестает работать нормально, что представляет непосредственную угрозу для жизни. Цирроз может развиться на фоне гепатитов, токсического поражения и неалкогольной жировой болезни печени, наследственных нарушений обмена веществ и т. д. Заболевание является неизлечимым. Ни одно лекарство от цирроза не позволяет полностью восстановить поврежденные клетки и функции печени. Комплексная терапия позволяет отсрочить разрастание соединительной ткани и таким образом предупредить развитие крайней стадии фиброза.
Какие средства могут применяться для профилактики и лечения цирроза печени
Гепатопротекторы. К этой группе применяемых при циррозе лекарств относятся средства, которые предупреждают повреждение клеточных мембран и способствуют восстановлению гепатоцитов (функциональных клеток печени) на доциротической стадии.
Противовирусные препараты. Специалисты назначают такие лекарства при циррозе печени вирусной этиологии. Данные препараты подавляют размножение возбудителя, за счет чего способствуют предотвращению развития цирроза и его прогрессирования.
Кортикостероиды. При алкогольном циррозе важной является противовоспалительная терапия. В рамках лечения назначаются гормональные препараты – кортикостероиды. Такие средства от цирроза печени способствуют улучшению прогноза заболевания 1 .
Фосфоглив® в профилактике и комплексном лечении цирроза
Фосфоглив® применяется в комплексной терапии цирроза печени. Этот препарат из группы гепатопротекторов содержит в составе фосфолипиды и глицирризиновую кислоту. Активные компоненты средства действуют комплексно, благодаря чему Фосфоглив®:
- обладает антифибротическим действием, таким образом снижая риск развития фиброза и цирроза;
- способствует восстановлению целостности клеточных мембран гепатоцитов, устраняя обратимые повреждения печени;
- оказывает противовоспалительное действие, влияя на основную внутреннюю причину поражения органа и замещение нормальной ткани печени соединительной.
Для профилактики цирроза печени препарат принимают курсом, длительность которого определяет врач. Средняя продолжительность приема составляет 3 месяца 2 .
1 Ramond M.J., Poynard T., Rueff T. // New Engl. J. Med. — 1992. — n.326. — p. 507—512.
2 В соответствии с инструкцией по медицинскому применению препарата Фосфоглив®.
Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов.

Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов. Медленное нарастание фиброза при ХГ С наблюдается у женщин молодого возраста в отсутствие таких факторов, как стеатоз печени, синдром перегрузки железом, злоупотребление алкоголем. Ряд причин обусловливает быстрое формирование ЦП: пожилой возраст при инфицировании, мужской пол, систематическое употребление алкоголя более 50 г/сут, наличие коинфекции вирусов гепатита В и/или ВИЧ, избыточная масса тела (> 28 кг/мІ), гетерогенность по гену гемохроматоза, полиморфизм генов ряда цитокинов, играющих ключевую роль в фиброгенезе. Среднее время развития ЦП у лиц, инфицированных в возрасте после 40 лет и злоупотребляющих алкоголем, составляет 13 лет, а у молодых женщин в отсутствие приема алкоголя ЦП формируется через 42 года. У 32% больных ХГ С протекает стабильно и не сопровождается прогрессированием болезни.
Важным фактором фиброгенеза является сохраняющаяся активность ХГ С по лабораторным данным и морфологическим признакам. У больных со стойко нормальным уровнем трансаминаз сыворотки риск развития ЦП С составляет 5%, в то время как наличие 3–5-кратного повышения АЛТ сыворотки ассоциируется с быстрым формированием ЦП С у 50% больных. Показано также, что факторами риска прогрессирования фиброза являются: наличие фиброза в ткани печени при первой биопсии, стеатоз печени и возраст больных. Быстрота прогрессирования фиброза определяется предшествующим фиброзом, стеатозом и лобулярным гепатитом [1]. При ХГ С низкой степени активности (ИГА по Knodell 4–8 баллов) риску развития ЦП С подвержены 7–10% больных, при ХГ С высокой степени активности (ИГА — более 13 баллов) у 71% больных цирроз может развиться уже через 7 лет. Проспективное изучение 404 больных компенсированным ЦП С показало, что за 85,7±36 мес наблюдения у 28% больных развивается хотя бы одно осложнение ЦП С, в том числе гепатоцеллюлярная карцинома (ГЦК) — у 19%, асцит — у 17%, кровотечение из варикозно расширенных вен пищевода (ВРВП) — у 5%, декомпенсация ЦП С (Чайлд В/С) — у 17%, энцефалопатия — у 2% [2].
Высокая частота развития ЦП С при хронической HCV-инфекции и риск серьезных осложнений в этой группе больных определяют задачи противовирусной терапии (ПВТ). Основная задача лечения — эрадикация вируса гепатита С и достижение стойкой ремиссии ХГ С, однако возможности достижения устойчивого вирусологического ответа (УВО) у больных ЦП С значительно ниже, чем при ХГ С. Исследования последних лет показали, что ПВТ способствует уменьшению выраженности фиброза, поэтому у больных ЦП С без вирусологического ответа целью противовирусного лечения является замедление прогрессирования болезни, снижение риска декомпенсации ЦП и развития его осложнений, в том числе ГЦК, В-клеточной лимфомы, криоглобулинемии, внепеченочных проявлений, портальной гипертензии и печеночно-клеточной недостаточности.
Представляют интерес исследования M. Curry и соавторов (2005), изучивших влияние длительной терапии пегинтерфероном α-2b в малых дозах на динамику портальной гипертензии у больных ХГ С со стадией фиброза F3 и ЦП С (F4). В исследование COPILOT были включены 267 больных, получавших колхицин 0,6 мг 2 раза в день, и 270 больных, которым проводится лечение пегинтроном 0,5 мкг/кг 1 раз в неделю в течение 4 лет. Обе группы были представлены больными, не ответившими на комбинированную терапию интерфероном и рибавирином. 83% больных в каждой группе имели ЦП С, у 40% из них имелись признаки портальной гипертензии, выявленные при эндоскопии (ВРВП или портальная гастропатия). ЭГДС проводилась с интервалом в 2 года. Опубликованы предварительные результаты исследования.
У 5 больных ЦП С, не получавших β-блокаторы с целью коррекции портальной гипертензии, до лечения пегинтроном провели измерение портального давления. Спустя 2 года лечения при повторной ЭГДС новые ВРВП появились у 11 из 66 больных, получавших колхицин, и сохранялись у 5 из 66 больных, получавших монотерапию пегинтроном. У всех 5 больных первоначальное портальное давление составляло 15 мм рт. ст., через 24 нед лечения составило в среднем 6 мм рт. ст. Кровотечение из ВРВП через 2 года отмечено у 11 (9%) больных, получавших колхицин, и у одного (1%) больного, получавшего пегинтрон. Асцит и печеночно-клеточная недостаточность также чаще выявлялись при лечении колхицином (20 больных), чем пегинтроном (13 больных). Таким образом, длительное лечение малыми дозами пегинтрона больных ЦП С может замедлить формирование ВРВП, снизить портальное давление, предотвратить кровотечение из ВРВП и другие осложнения портальной гипертензии у больных ЦП С, не достигших УВО на предшествующую комбинированную терапию интерфероном и рибавирином [3].
В последние годы ПВТ претерпела существенные изменения: с 2000 г. комбинированная терапия пегилированными интерферонами α-2a и 2b и рибавирином заняла ведущие позиции в лечении ХГ С и компенсированного ЦП С. Изучены прогностические факторы ответа на лечение, появились возможности коррекции ряда побочных эффектов ПВТ, что позволило достичь УВО у 56–63% больных ХГ С, включенных в лечение. Приверженность больных к лечению, адекватные дозы препаратов и длительность ПВТ позволяют повысить УВО до 72–75% [4, 5]. Наибольший эффект комбинированной терапии ХГ С отмечается у больных с генотипами 2 или 3 HCV: непродолжительный курс лечения (24 нед) при высокой приверженности к лечению пегилированными ИФН α и рибавирином позволяет достичь успеха в 84–94% случаев.
Несмотря на достижения последних лет, остаются категории трудных для лечения больных ХГ С, к которым относятся пациенты с генотипом 1 HCV и высокой вирусной нагрузкой и больные ЦП С.
Генотип 1 HCV и высокая вирусная нагрузка оказались независимыми прогностическими факторами слабого ответа на лечение. Причины этого до конца не ясны. Изучается значение мутаций в E2 и NS5A генах HCV (неструктурный регион NS5A определяет чувствительность к интерферону). Элиминация гепатоцитов, инфицированных генотипом 1 HCV, в процессе ПВТ происходит медленнее, чем при других генотипах. В первые 1–2 нед терапии вирусная нагрузка снижается на 1,6 log копий/мл при генотипе 1 HCV и на 2,9 log копий/мл при генотипе 2. Скорость гибели инфицированных гепатоцитов составляет 0,1 в день у больных с генотипом 1 и 0,26 в день при генотипе 2, что объясняется различиями в иммунном ответе у больных и дает основание для обсуждения необходимости более агрессивной и, возможно, более длительной ПВТ при генотипе 1 HCV [5].
Стратегия лечения больных ЦП и ХГ С, инфицированных генотипом 1 HCV и имеющих высокую вирусную нагрузку, тесно связана. УВО при лечении ИФН α в стандартном режиме больных ХГ С с генотипом 1 HCV не превышает 10% независимо от сроков лечения — 24 или 48 нед. При использовании комбинированной терапии (ИФН α/рибавирин) в течение 48 нед УВО у таких больных возрастает до 28–36%, оставаясь значительно ниже УВО при генотипах 2 и 3 HCV (64–79%). Лечение ХГ С с генотипом 1 HCV в течение 48 нед дает более высокие результаты (46–52%), чем 24 нед (29–42%). Таким образом, генотип вируса HCV определяет стратегию ПВТ ХГ С и ЦП С.
Уровень вирусной нагрузки, как и генотип вируса, не влияет на вариант и тяжесть течения ХГ C. Высокая вирусная нагрузка (более 2х10 6 копий/мл или более 800 000 МЕ/мл) может быть выявлена при хроническом гепатите низкой, умеренной, высокой степени активности, при минимальных изменениях в печени или при ЦП С. Однако уровень виремии отчетливо влияет на частоту достижения УВО: пегилированный ИФН α-2b 1,5 мкг/кг 1 раз в неделю в комбинации с рибавирином в дозе 800 мг/сут при высокой вирусной нагрузке обеспечивает УВО в 42% случаев, а при низкой — в 78%.
В последние годы разработан метод оценки успеха терапии на основании изучения вирусной кинетики на ранней стадии ПВТ. Ранний вирусологический ответ позволяет прогнозировать УВО. Высокая приверженность больных ХГ C к лечению и оценка прогноза ПВТ на основании данных раннего вирусологического ответа на 4-й или 12-й неделе позволили повысить результативность терапии в группе всех леченных больных ХГ С до 90%. Отказ от стандартных схем лечения ИФН α (3 млн МЕ 3 раза в нед) с переходом на комбинированную ПВТ также способствует повышению количества больных с ранним вирусологическим ответом.
Изучение раннего вирусологического ответа на основании количественного анализа HCV-РНК с помощью высокочувствительной ПЦР позволяет идентифицировать больных, которые не ответят на ПВТ. Если после 12-недельной ПВТ пегилированными ИФН α и рибавирином уровень HCV-РНК снизился на два и более десятичных логарифмов, но РНК вируса по-прежнему выявляется в крови, то целесообразно продолжить ПВТ еще в течение 12 нед, а затем провести повторное исследование HCV-РНК. При его отрицательном результате УВО колеблется от 42 до 78% в зависимости от вирусной нагрузки. Представляется целесообразным 72-недельный курс ПВТ, т. е. продление лечения до 1,5 лет, что позволяет значительно улучшить результаты лечения. При сохраняющейся виремии с падением ее уровня на 12-й неделе менее чем на два десятичных логарифма УВО составляет от 0 до 5%, что позволяет уже на ранних этапах либо отказаться от бесперспективной терапии при генотипе 1 HCV, либо модифицировать ее, либо перейти на поддерживающую терапию пегилированным ИФН α-2а (90 мкг) или ИФН α-2b (0,5 мкг/кг) с целью замедления прогрессирования ЦП С и профилактики развития ГЦК и лимфомы.
Тройная схема комбинированной ПВТ с включением помимо пегилированного ИФН α и рибавирина 200 мг амантадина не имеет преимуществ перед обычной схемой в лечении ХГ C генотипа 1b с высокой вирусной нагрузкой.
Обоснованием для лечения ХГ C с продвинутой стадией фиброза или сформировавшимся ЦП С стали данные о снижении риска декомпенсации ЦП и развития ГЦК, а также регрессе фиброза у 60% больных, получающих ПВТ. Наличие портального фиброза или ЦП С считается независимым фактором низкой частоты УВО у HCV-инфицированных больных. Пациенты с ЦП C обычно плохо отвечают на стандартную монотерапию ИФН α: УВО составляет от 5 до 20%. Эффективность комбинированной терапии ИФН α и рибавирином составила в этой группе 5–29%. Применение пегилированных ИФН α в составе комбинированной терапии компенсированного ЦП C или ХГ С с мостовидным фиброзом позволило повысить УВО до 44–50%.
Следует отметить, что даже при монотерапии пегилированным ИФН α можно достигнуть гистологического улучшения у 54% больных компенсированным ЦП С. В сравнительном исследовании эффективности пегилированных ИФН α-2a и 2b у больных ЦП C наличие мостовидного фиброза являлось отрицательным прогностическим фактором достижения раннего вирусологического ответа. В конце 24-недельной ПВТ вирусологический ответ в 1-й группе больных ЦП C составил 83%, во 2-й — 60%. Таким образом, пегилированный ИФН α-2a может быть препаратом выбора в комбинированной терапии ЦП C [8]. Даже при отсутствии вирусологического ответа на комбинированную ПВТ при ЦП C отмечается улучшение гистологической картины в печени (снижение ИГА и ГИС).
Наиболее значимое улучшение морфологических данных имеет место при достижении УВО, что сопровождается улучшением качества жизни больных ЦП С, несмотря на наличие продвинутой стадии болезни. Интерес представляют данные Poynard и соавторов (2000), наблюдавших 3010 больных ХГ С с повторной биопсией печени (до начала ПВТ и спустя 6–12 мес после ее окончания) при использовании различных режимов лечения: монотерапии ИФН α-2b, комбинированной ПВТ ИФН α или пегилированным ИФН α-2b и рибавирином в течение 48 нед. Более чем у трети больных, у которых был достигнут УВО, улучшилась гистологическая картина (ГИС и ИГА) в печени, морфологическая динамика отмечена также у трети больных без вирусологического ответа [9]. Анализ биопсий печени у больных ХГ С, участвовавших в четырех многоцентровых исследованиях, показал, что у 75 (49%) из 153 пациентов ЦП С после окончания терапии ГИС (уровень фиброза) снизился на 1–3 балла, что позволяет говорить о возможности регресса фиброза при ЦП С под влиянием настойчивой целенаправленной ПВТ [10].
В последние годы предпринимаются попытки противовирусного лечения декомпенсированного ЦП С (Чайлд В и С). Известно, что 40% всех ортотопических трансплантаций печени проводится в связи с ЦП С. Больные с сохраняющейся виремией имеют высокий риск реакций отторжения трансплантата и инфицирования донорской печени вирусом гепатита С с быстрым развитием (в течение 5–7 лет) ЦП С и/или ГЦК в пересаженной печени. В 2003–2004 гг. появились первые публикации использования ПВТ малыми дозами интерферона и рибавирина при декомпенсированном ЦП С у кандидатов на трансплантацию печени. Предлагается начинать лечение ИФН α 3 млн МЕ ежедневно и рибавирином 800 мг/сут за 4 мес до предполагаемой операции. Режим ежедневного введения интерферона позволяет уменьшить частоту гриппоподобного синдрома, лечение в течение 4 мес позволяет добиться максимального снижения виремии (до операции). У 9 (30%) из 30 больных декомпенсированным ЦП С (Чайлд В или С) удалось достичь вирусологического ответа на 12-й неделе, у 6 из них (20%) авиремия сохранялась после трансплантации печени [11]. Аналогичные данные о возможности развития УВО в 18–20% случаев декомпенсированного ЦП С опубликованы рядом авторов, длительность наблюдения за такими больными продолжается более 3,9 лет.
Известно, что употребление алкоголя значительно повышает смертность при вирусных ЦП: пятилетняя выживаемость больных достигает лишь 43%, значительно отличаясь в группах ЦП Чайлд А (66%), Чайлд В (50%) и Чайлд С (25%). При продолжающемся приеме алкоголя риск смерти у больных ЦП С повышается в случае наличия таких факторов, как пожилой возраст, печеночно-клеточная дисфункция (Чайлд В или С), желудочно-кишечное кровотечение, коинфекция (HBV, HCV), курение и отсутствие признаков острого алкогольного гепатита при биопсии печени. Среди механизмов влияния алкоголя на прогрессирование HCV-инфекции отмечают активацию репликации, повышение разнообразия квазивидов и мутаций вируса, усиление апоптоза гепатоцитов, подавление иммунного ответа хозяина, нарастание стеатоза и уровня железа в печени. Все это ведет к быстрому развитию болезни, высокой частоте формирования ЦП С и ГЦК и низкой эффективности интерферонотерапии. Эффективность ПВТ при ХГ С у лиц, употребляющих алкоголь, в 3 раза ниже стандартных показателей УВО: при монотерапии ИФН УВО снижается до 7–8% по сравнению с 25% у больных, не употребляющих алкоголь; при комбинированной терапии — до 12–4% по сравнению с 41%. Не существует безопасных доз алкоголя для больных ХГ С. Рекомендуется полный отказ от его приема за 6 мес до предполагаемой ПВТ, что улучшает результаты противовирусного лечения, однако УВО не достигает показателей, свойственных больным, не употреблявшим алкоголь в прошлом. Возврат к приему алкоголя после окончания ПВТ повышает риск обострения ХГ С и возврата виремии.
У больных ХГ С на стадии цирроза или при наличии мостовидного фиброза (F3) риск развития побочных эффектов интерферонотерапии выше, чем при менее продвинутых стадиях фиброза. Показано, однако, что частота их выявления и необходимость прекращения ПВТ существенно не отличаются в группах больных, леченных пегилированным ИФН α или ИФН α в стандартном режиме. Пегилированный ИФН α-2а обладает более выраженным миелосупрессивным действием, чем ИФН α-2b. Гематологическая токсичность при применении пегилированных ИФН α проявляется в первые 4 нед лечения, затем достигается устойчивый уровень лейкоцитов и тромбоцитов. Особенно быстро их число снижается после первой дозы препаратов. ПВТ назначают больным компенсированным ЦП С с уровнем лейкоцитов 3000/ммЁ и тромбоцитов 50 000/ммЁ. При снижении уровня нейтрофилов до 600/ммЁ, а уровня тромбоцитов до 20 000/ммЁ ИФН α отменяют.
Модификация дозы пегилированного ИФН α или рибавирина (снижение дозы или отмена препарата) в связи с побочными эффектами отмечена у 50% больных ЦП С. В зависимости от достижения раннего вирусологического ответа на 12-й неделе лечения предложены различные варианты лечения ЦП С: продолжение комбинированной терапии в максимально эффективных дозах в течение 36 нед при достижении раннего вирусологического ответа; лечение небольшими дозами пегилированного ИФН α-2b (0,5 мкг/кг) в течение 5 лет при отсутствии такого ответа на 4-й нед (EPIC3) или малыми дозами пегилированного ИФН α-2а (90 мкг) в течение 4 лет (HALT-С).
Определены показания к повторным курсам ПВТ: наличие генотипов 2 или 3 НСV; частичный ответ при предшествующем курсе ПВТ, F3- и F4-стадии фиброза. Противопоказаниями к повторным курсам лечения являются: пожилой возраст, генотип 1, ЦП С с гипербилирубинемией, высокая вирусная нагрузка, высокий индекс массы тела, минимальные изменения в печени при биопсии (ИГА менее 4 баллов) и продолжающееся употребление алкоголя или наркотиков.
Таким образом, ПВТ компенсированного и декомпенсированного ЦП при ХГ С решает ряд следующих задач: замедление декомпенсации цирроза, снижение смертности от его осложнений (кровотечение из варикозно расширенных вен, печеночно-клеточная недостаточность и т. д.), предотвращение развития ГЦК и профилактику реактивации инфекции после трансплантации печени, а также улучшение качества жизни больных и обеспечение их социальной реабилитации. Несомненно, что на ранних стадиях HCV-инфекции ПВТ дает лучшие результаты: частота УВО при лечении острого гепатита С достигает 90%, ХГ С — 60–70%, что превышает эффективность лечения ЦП С пегилированными ИФН α и рибавирином (30–50%). Наш опыт ПВТ ХГ С низкой степени активности позволяет говорить о высокой эффективности лечения данной категории больных. Используя пегилированный ИФН α-2b (1,5 мкг/кг) и рибаверин (более 10,6 мг/кг) при лечении первичных больных с небольшим сроком заболевания (5,9±5,7 лет), преимущественно низкой степени активности и слабым фиброзом (F1), а также низкой вирусной нагрузкой, мы получили устойчивый вирусологический ответ в 86 % случаев, в том числе у 77% пациентов с генотипом 1 HCV, включая 5 больных на стадии ЦП С [12].
Литература
Т. Н. Лопаткина, кандидат медицинских наук, доцент
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
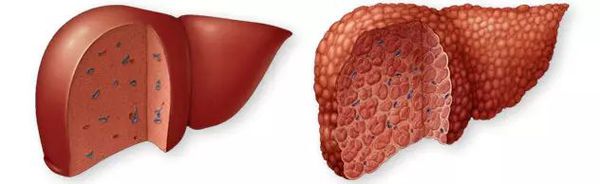
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
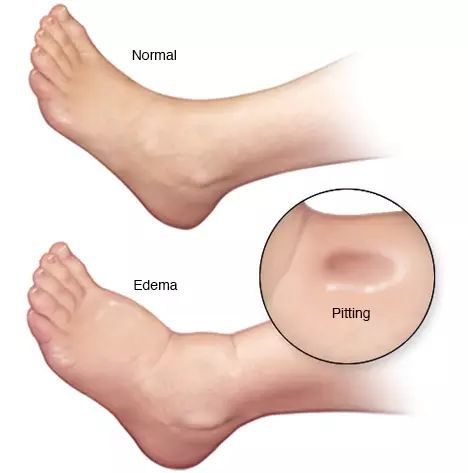
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
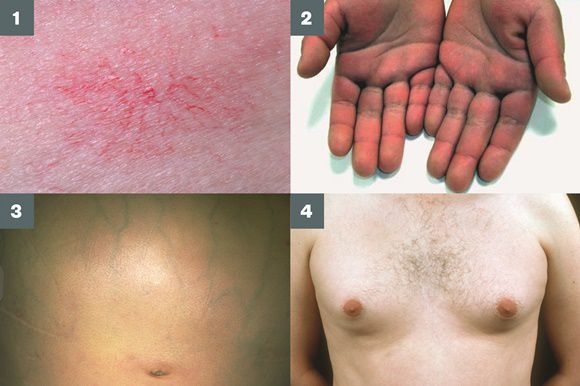
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
Хронический вирусный гепатит С – это хроническое заболевание печени, обусловленное инфицированием вирусом гепатита С. Процесс продолжается более 6 месяцев. При этом в ткани этого органа развивается воспаление и фиброз (разрастание соединительной ткани).
По данным официальной статистики, в Российской Федерации насчитывается около 5 миллионов больных хроническим вирусным гепатитом С. По неофициальным данным эта цифра может быть в 3–6 раз выше. Ежегодно регистрируется более 40 тысяч новых больных хроническим вирусным гепатитом С. При отсутствии эффективного лечения в 10–20 % случаев инфицирования в течение 20–30 лет развивается цирроз печени.
Вирус гепатита С (HCV) является РНК-вирусом из семейства Flaviviridae, представленным семью генотипами. Наиболее распространенным в мире является 1-ый генотип, в Европе и в России –1b. Кроме того, достаточно высокую распространенность в нашей стране имеют 2-й и 3-й генотипы вируса гепатита С.
Основные факторы риска заражения вирусом
- Внутривенное введение наркотических средств;
- сексуальные контакты с лицами, применяющими внутривенные наркотики;
- гемодиализ;
- мужской гомосексуализм;
- переливание крови;
- беспорядочные половые связи;
- медицинские манипуляции.
Заражение происходит парентерально, то есть через кровь. Попадая в кровоток, вирус гепатита С достигает печени, проникает в ее клетки – гепатоциты – и размножается. После выхода из гепатоцитов новые вирусные частицы заражают здоровые клетки печени.
Поражение вирусом гепатита С осуществляется неколькими механизмами. Во-первых, активированные присутствием в организме вируса гепатита С клетки иммунной системы (Т-лимфоциты), направленные на его уничтожение, повреждают и инфицрованные гепатоциты. Во-вторых, клетки печени, в которые проник вирус гепатита С, воспринимаются иммунной системой, как чужеродные и она стремится от них избавиться. В-тертьих, белки вируса гепатита С обладают прямым повреждающим действием на гепатоциты, стимулируя воспаление и фиброз.
Симптомы вирусного гепатита
Симптомы вирусного гепатита С неспецифичны, что серьезно затрудняет раннюю диагностику и своевременное начало лечения. Возможно появление слабости, тошноты, болей в мышцах и суставах, повышенной утомляемости, снижения массы тела. При наличии подобных проявлений, которые могут быть симптомами вирусного гепатита С, следует как можно раньше обратиться к врачу.
Диагностика хронического вирусного гепатита С
Что касается уровня аланинаминотрансферазы – фермента, считающегося универсальным маркером неблагополучия печени – при хроническом вирусном гепатите С его диагностическая ценность невелика. Уровень аланинаминотрансферазы имеет волнообразную динамику, то есть, на том или ином этапе течения болезни показатель в пределах нормальных значений может быть обманчивым.
Лечение заболевания
Лечение вирусного гепатита С – нелегкая задача. Необходимо отметить, что терапией данного заболевания должен заниматься только опытный специалист – врач-инфекционист или гепатолог.
В качестве основных средств, используемых при лечении вирусного гепатита С выступают противовирусные препараты. До недавнего времени были доступны только препараты интерферона – стандартного и пегилированного (длительного действия). За последние годы в лечении гепатита был достигнут значительный прогресс – появились более эффективные лекарства, влияющие непосредственно на размножение вируса.
Вместе с тем нельзя забывать о том, что лечение гепатита С не всегда бывает эффективным, даже при использовании современных лекарственных средств. Могут быть противопоказания для назначения лечения или его непереносимость. В некоторых случаях терапия гепатита С не назначается сразу, так как требуется ожидание, которое может составлять месяцы или даже годы. Иногда боязнь возможных побочных эффектов и длительность лечения заставляют необоснованно отказаться от противовирусных препаратов.
Но, к сожалению, пациентов с гепатитом С, которым не требуется лечение, нет. Это связано с тем, что заболевание прогрессирует, независимо от наличия симптомов и их выраженности. Во избежание развития цирроза, при невозможности по тем или иным причинам принимать препараты, действие которых направлено на уничтожение вируса гепатита С, следует принимать лекарства, способные защитить печень от неблагоприятных последствий инфекции.
Фосфоглив* – это не только средство для восстановления клеток печени, но и борьба с причиной их разрушения!
Одним из препаратов, показанных для патогенетического лечения вирусного гепатита С, является Фосфоглив*. Его активный компонент, обуславливающий целесообразность назначения при гепатите С, – это глицирризиновая кислота, обладающая противовоспалительным и антифиброзным действием. Клинический эффект, а также благоприятный профиль безопасности препарата доказаны исследованиями. *Помните, что диагностировать вирусный гепатит и назначить соответствующее лечение может только врач!
ХГС: Буеверов А.О. Глицирризиновая кислота: патогенетическая терапия хронического гепатита С у особых групп пациентов // Клинические перспективы гастроэнтерологии, гепатологии – 2014. - № 4. – С. 3-9. 1

Цирроз печени – финальный этап развития многих хронических патологий гепатобилиарной системы. Это заболевание возникает вследствие перерождения паренхиматозной ткани в соединительную, приводит к необратимым изменениям в структуре органа, представляющим непосредственную угрозу для жизни человека.
Механизм развития заболевания
В основе цирроза печени лежит развитие хронического воспалительного процесса. Подобное состояние приводит к образованию локальных очагов некроза, вокруг которых начинают формироваться соединительнотканные волокна. Они поражают сосуды и вызывают кислородное голодание. Недостаточность окислительных процессов способствует дальнейшему развитию фиброза и диффузному разрастанию рыхлой волокнистой ткани – циррозу. В зависимости от причины болезни и места локализации некротических очагов соединительная ткань может формироваться вокруг разветвлений воротной вены, в дольках печени и во внутрипеченочных желчных путях. Разрастание соединительной ткани влечет за собой нарушение многочисленных функций органа, изменение белкового состава крови и развитие печеночной недостаточности.
Причины
Существует множество экзогенных (внешних) и эндогенных (внутренних) причин, обуславливающих развитие болезни:
- наследственные метаболические нарушения (болезнь Коновалова − Вильсона, гепатолентикулярная дегенерация, гемохроматоз и пр.);
- гепатиты (вирусные, токсические, аутоиммунные);
- хронические воспалительные заболевания желчных путей;
- алиментарная недостаточность (дефицит витаминов, белковое голодание);
- длительный нерациональный прием лекарственных препаратов;
- НАЖБП (неалкогольная жировая болезнь печени);
- АБП (алкогольная болезнь печени);
- иммунные патологии (системная красная волчанка, склеродермия, ревматоидный артрит).
У значительной части пациентов причины остаются невыясненными.
Признаки заболевания
Ранние проявления
Первые признаки цирроза печени весьма вариативны и не всегда достаточно очевидны. Часто единственным характерным проявлением, позволяющим заподозрить развитие заболевания, является портальная гипертензия – повышение давления в системе воротной вены. Данное нарушение сопровождается периодическими болями в области правого подреберья, усиливающимися после интенсивных физических нагрузок, употребления жирной, жареной пищи и алкогольных напитков. Также пациенты могут жаловаться на следующие неприятные проявления:
- снижение аппетита,
- метеоризм,
- эпизодические расстройства стула,
- сухость во рту,
- тошноту и рвоту,
- повышенную утомляемость,
- чрезмерную психическую возбудимость.
Некоторые формы хронического воспалительного процесса уже на ранних стадиях проявляются желтухой. В других случаях заболевание развивается остро, первых признаков цирроза печени, перечисленных выше, может не наблюдаться.
Дальнейшее развитие болезни
По мере развития патологического процесса симптоматика нарастает. Из-за увеличения размеров и растяжения капсулы органа появляется постоянная тяжесть и боль в боку. К внепеченочным (внешним) проявлениям болезни относят:
Достаточно характерным признаком цирроза печени является потеря массы тела с одновременным накоплением избыточной жидкости в брюшной полости. При выраженном патологическом процессе фигура больного приобретает характерную форму паука – большой живот и очень тонкие конечности. На поздних стадиях, при выраженной портальной гипертензии (повышенное давление в системе воротной вены), развиваются отеки в области голеней, в целом кожа становится менее эластичной и слегка отечной, на ощупь она кажется похожей на тесто (пастозность). У некоторых пациентов может наблюдаться повышение температуры тела до 37–38 °C.
Виды заболевания
В клинической практике цирроз печени классифицируется по причинам, спровоцировавшим его развитие и по морфологическим признакам.
Классификация по этиологическому (причине появления) принципу:
- вирусный (вызванный вирусом гепатита В, С, D);
- алкогольный;
- лекарственный;
- токсический;
- врожденный.
Классификация по степени функциональных нарушений:
- компенсированный – первая стадия, на которой симптомы заболевания не проявляются, синтетическая функция на удовлетворительном уровне (альбумин, билирубин, время свертывания крови в пределах нормы), нет асцита и печеночной энцефалопатии. Лечение заключается в терапии основного заболевания;
- субкомпенсированный – заболевание начинает проявляться, ухудшается самочувствие, темнеет моча, на теле и лице появляются сосудистые звездочки. Необходимо соответствующее лечение;
- декомпенсированный – поздняя стадия, которая характеризуется развитием печеночной недостаточности. В брюшной полости скапливается жидкость, увеличивается вероятность кровотечения из желудка, пищевода. Необходимо лечение.
Классификация по размеру узлов фиброзной соединительной ткани в печени:
- мелкоузловой – до 3 мм в диаметре;
- крупноузловой – свыше 3 мм;
- смешанный.
Осложнения цирроза
Несоблюдение врачебных рекомендаций и отсутствие адекватного лечения нередко становятся причиной целого ряда серьезных осложнений. Нарушение венозного оттока крови может привести к развитию асцита, спонтанному бактериальному перитониту (следствие инфицирования асцитической жидкости) и коме. В 5–20 % случаев цирроз трансформируется в первичный рак. Еще одно достаточно опасное осложнение, возникающее на стадии декомпенсации цирроза, – внутреннее кровотечение из расширенных вен пищевода. Самым характерным признаком подобного состояния является рвота алой кровью. Одно из самых распространенных осложнений – это печеночная энцефалопатия. Наиболее типичные признаки развиваются на фоне увеличения концентрации аммиака в плазме крови:
- повышенная тревожность,
- расстройство координации движений,
- ухудшение сна,
- нарушение речевой функции,
- дезориентация в пространстве и времени,
- хлопающий тремор конечностей.
Диагностика
Диагностика цирроза печени включает:
- первичный врачебный осмотр;
- уточнение жалоб пациента;
- выяснение причин появления заболевания;
- сбор анамнеза;
- выявление внешних признаков заболевания;
- инструментальное и лабораторное исследования.
В список инструментальных диагностических методик входит:
- УЗИ печени;
- эластометрия;
- сцинтиграфия;
- фиброгастродуоденоскопия;
- компьютерная томография (КТ);
- магниторезонансная томография (МРТ).
Лабораторная диагностика включает:
- фибротесты;
- общий и биохимический анализ крови (определение уровня билирубина, АЛТ и АСТ, щелочной фосфотазы, холестерина, креатинина, глюкозы, протромбина);
- определение маркеров гепатотропных инфекций;
- гистологическое исследование биоптата (ткани печени).
Степень тяжести заболевания определяется по шкале Чайлда − Пью, в которой указываются ключевые лабораторные параметры и баллы в порядке повышения степени тяжести:
- класс А (5–6 баллов) – компенсированный;
- класс В (7–9 баллов) – субкомпенсированный;
- класс С (10–15 баллов) – декомпенсированный.
Лечение
Основополагающим моментом, определяющим успешное лечение цирроза печени, является раннее выявление заболевания и определение причин, обусловивших его развитие. Ввиду того, что данная болезнь относится к категории неизлечимых, восстановить паренхиматозную ткань органа до нормального состояния практически невозможно. Однако отсрочить и даже предотвратить чрезмерное разрастание соединительной ткани вполне возможно. Для этого используются различные медикаментозные и немедикаментозные методики.
Немедикаментозное лечение. В первую очередь предусматривает полный отказ от алкогольных напитков, ограничение физической активности, рациональный режим труда и отдыха и соблюдение щадящей диеты (диет. стол № 5).
Медикаментозная терапия. Включает в себя достаточно широкий спектр лекарственных средств. Могут использоваться гепатопротекторы, прокинетики, ферменты поджелудочной железы, препараты, способствующие выведению аммиака, витамины и микроэлементы. Если причиной болезни стал один из вирусных гепатитов, лечение цирроза печени предусматривает прием противовирусных препаратов. При наличии аутоиммунных состояний обычно назначаются глюкокортикостероиды, в случае развития отеков – мочегонные средства, для нормализации кишечной микрофлоры – пробиотики.
Лечение печеночной энцефалопатии предусматривает поддержание водно-электролитного баланса, очищение кишечника, инфузию больших объемов концентрированного раствора глюкозы, внутривенное введение витамина К и препаратов, предотвращающих развитие отека мозга. При инфекционных осложнениях проводится антибактериальная терапия, при кровотечении из расширенных вен пищевода назначаются бета-адреноблокаторы и по врачебным показаниям выполняется перевязка венозных сосудов.
Другие методы терапии. При скоплении большого количества асцитической жидкости и развитии выраженного асцита может рекомендоваться проведение парацентеза (пункция брюшной полости). Для формирования альтернативного кровотока может быть выполнено шунтирование коллатеральных сосудов. Пациентам с прогрессирующим течением заболевания и высокой степенью перерождения паренхиматозной ткани, приводящей к тяжелой печеночной недостаточности (цирроз класса С), показана трансплантация печени.
Лечение должно проводиться в специализированных лечебных учреждениях под контролем гастроэнтеролога или гепатолога.
Профилактика
- Ограничение потребления или полный отказ от алкоголя.
- Защита от заражения вирусами гепатита В, С и D.
- Предохранение от воздействия токсических веществ.
- Здоровое питание.
- Предотвращение развития сердечно-сосудистых заболеваний.
Комплексное лечение гепатитов вирусной и невирусной этиологии, способных привести к циррозу печени, обязательно должно в себя включать препараты, снижающие воспаление и предотвращающие развитие фиброплазии.
Фосфоглив* при лечении цирроза
Фосфоглив* – это современный гепатопротектор, обладающий выраженными антиоксидантными, противовоспалительными и антифибротическими свойствами. Препарат содержит в составе глицирризиновую кислоту и фосфолипиды, которые:
- способствуют восстановлению целостности мембран клеток печени;
- увеличивают способность обезвреживать токсические вещества;
- оказывают противовоспалительное, антифибротические и антиоксидантные действия.
Фосфоглив* подавляет образование соединительной ткани, что снижает риск развития цирроза и улучшает общее состояние пациента.
Препарат показан к применению в составе комплексного лечения острых и хронических вирусных гепатитов, при жировой дистрофии, фиброзе, токсических, алкогольных и медикаментозных поражениях печени, в том числе для комплексной терапии и предотвращения развития цирроза.
Читайте также:

